Method Article
Модифицированная техника манжеты для модели трансплантации шейки шейки сердца мыши
В этой статье
Резюме
В настоящем протоколе модель трансплантации сердца мыши используется для исследования механизма отторжения сердечного аллотрансплантата. В этой модели гетеротопической трансплантации сердца повышается эффективность операции, а приживаемость сердечных трансплантатов обеспечивается за счет шейного сквозного анастомоза имплантации сердца с использованием модифицированной техники Cuff.
Аннотация
Отторжение сердечного аллотрансплантата ограничивает долгосрочную выживаемость пациентов после трансплантации сердца. Модель трансплантации сердца мыши идеально подходит для изучения механизма отторжения сердечного аллотрансплантата в доклинических исследованиях из-за их высокой гомологии с генами человека. Это понимание поможет разработать уникальные подходы к улучшению долгосрочной выживаемости пациентов, получающих сердечные аллотрансплантаты. В мышиной модели имплантация донорского сердца в брюшной полости обычно выполняется со сквозным анастомозом аорты реципиента и нижней полой вены с помощью швов. В этой модели сердце донора имплантируется путем сквозного анастомоза в сонную артерию и яремную вену реципиента с помощью техники модифицированной манжеты. Операция по трансплантации проводится без наложения швов и, таким образом, может увеличить выживаемость реципиента, поскольку нет вмешательства в кровоснабжение и венозный рефлюкс нижней части тела. Эта модель мыши поможет исследовать механизмы, лежащие в основе иммунологического и патологического (острого / хронического) отторжения сердечных аллотрансплантатов.
Введение
Трансплантация сердца стала стандартным методом лечения терминальной сердечной недостаточности. Более 5 500 трансплантаций сердца в год выполняются в организациях, зарегистрированных при Международном обществе трансплантации сердца и легких. Среди реципиентов аллогенной трансплантации сердца частота отторжения в течение 1 года по-прежнему составляет >10%, в то время как частота отторжения в течение 3 лет увеличилась до 36%1,2. Тем не менее, эффективные профилактические методы лечения пациентов с отторжением сердечного аллотрансплантата отсутствуют. Поэтому необходимы исследования на животных моделях, которые выясняют физиологические механизмы, лежащие в основе иммунологического и патологического отторжения сердечных аллотрансплантатов. Такие исследования будут способствовать изучению новых мишеней, необходимых для разработки эффективных лекарств, которые помогут предотвратить отторжение сердечного аллотрансплантата и улучшить показатели выживаемости в этих популяциях пациентов.
Некоторые потенциальные иммунологические и патофизиологические механизмы отторжения сердечного аллотрансплантата были предложены недавно в мышиных модельных исследованиях гетеротопической трансплантации сердца 3,4,5. Следовательно, гетеротопическая трансплантация сердца у мышей стала идеальной доклинической моделью для исследования механизмов иммунного отторжения и патологического повреждения, происходящего в сердечных аллотрансплантатах после трансплантации сердца из-за их высокой гомологии с генами человека. Преобладающая концепция заключается в выполнении гетеротопической трансплантации на мышиной модели путем абдоминального сквозного анастомоза в аорте реципиента и нижней полой вене с использованием швов, аналогично нормальной анатомии человека. Однако эта процедура может нарушить кровоснабжение реципиента и венозный рефлюкс нижней части тела6. Поэтому здесь предложена модифицированная гетеротопическая процедура трансплантации сердца на мышиной модели.
Донорское сердце имплантируется сонной артерией и яремной веной реципиента сквозным цервикальным анастомозом с использованием модифицированной техники Cuff. Эта модифицированная процедура облегчила оперативную осуществимость и обеспечила приживаемость сердечного трансплантата без вмешательства в кровоснабжение и венозный рефлюкс нижней части тела.
протокол
Все эксперименты на животных проводились в соответствии с Руководством по уходу и использованию лабораторных животных, восьмое издание, Национальный исследовательский совет (США) 2011 г. Процедуры, связанные с животными, были одобрены Комитетом по уходу за животными и их использованию онкологической больницы Чунцинского университета, Чунцин, Китай. Для аллогенной трансплантации сердца использовали самцов мышей BALB/c и C57BL/6 массой 20-30 г, полученных из коммерческих источников (см. Таблицу материалов). Мыши C57BL/6 использовались в качестве доноров и сингенных реципиентов, в то время как мыши BALB/c служили аллогенными реципиентами. Схема протокола показана на рисунке 1.
ПРИМЕЧАНИЕ: Все расходные материалы, используемые во время операции, включая хирургические инструменты и растворы, стерильны. Хирургическое вмешательство проводится по принципу асептической техники операции.
1. Процедура получения реципиента
- Вызвать общую анестезию путем вдыхания 5% изофлурана через индукционную камеру размером 15 x 10 x 10 см, соединенную с колпаком (см. Таблицу материалов).
- Зафиксируйте мышь-реципиент на операционном столе с помощью грелки. Поддерживайте анестезию при непрерывном вдыхании 2% изофлурана через маску для лица над носом и ртом.
ПРИМЕЧАНИЕ: Медленная частота и ритм дыхания, исчезновение роговичного рефлекса и отсутствие педального рефлекса в пальцах ног указывают на эффективность анестезии. - После бритья волос продезинфицируйте операционную область тремя чередующимися раундами повидон-йодного скраба с последующим добавлением спирта. Затем надрежьте кожу на 1,5-2 см параллельно средней линии шейки матки от правильного нижнечелюстного угла до хвоста.
- Рассекают ~1 см правой наружной яремной вены с помощью электрокоагулятора и микрощипцов. Перережьте вену на проксимальном конце атравматичным микрососудистым зажимом и перевязать ее на дистальном конце.
- Пропустите дистальный конец вены через полиуретановую колючую манжету 22 G (см. Таблицу материалов) со скошенным концом и поверхностными канавками. Зафиксируйте вену ручкой манжеты с помощью микрососудистого зажима.
- Убрать 8-0 Перевязывают шов на дистальном конце, переворачивают просвет над манжетой, зацепленной поверхностной зазубриной, наизнанку и фиксируют хирургическим швом 10-0 в бороздках поверхности.
- Резецируют правую подъязычную железу, чтобы сформировать ямку для имплантации сердечного трансплантата, и оставляют правую долю подчелюстной железы и правую грудино-ключичную мышцу.
- Рассекают правую общую сонную артерию на ~1 см с помощью микрощипцов и зажимают артерию атравматичным микрососудистым зажимом на проксимальном конце. На дистальном конце перевязывают и перерезают артерию.
- Пропустите дистальный конец артерии через полиуретановую колючую манжету 26 G (см. Таблицу материалов) со скошенным концом и канавками на поверхности. Зафиксируйте артерию ручкой манжеты с помощью микрососудистого зажима.
- Снимите шов лигирования на дистальном конце, выверните просвет наизнанку над манжетой и зафиксируйте поверхностным шипом и бороздками хирургическим швом 10-0.
- После подготовки сосудов реципиента капните 100 МЕ/мл физиологического раствора гепарина на сосуды, чтобы предотвратить тромбоз. Накройте шейный разрез стерильной влажной солевой марлей для последующей имплантации.
2. Донорская процедура
- Используйте ту же анестезирующую процедуру (шаг 1.1) для мыши-донора.
- Сбрейте волосы на животе с помощью электрической бритвы и продезинфицируйте операционную область тремя чередующимися раундами повидон-йодного скраба с последующим добавлением спирта.
- Надрежьте живот (2-3 см) ножницами по средней линии от лобкового симфиза до подкшифовидного сустава, а разрезаемый участок расширите ретрактором.
- Рассекают 1 см брюшной аорты и нижней полой вены с помощью электрокоагулятора и микрощипцов и проводят гепаринизацию путем введения 1 мл физиологического раствора с добавлением 250 МЕ/мл гепарина через нижнюю полую вену. После этого иссекают брюшную аорту и нижнюю полую вену.
- Иссеките грудную клетку по передней подмышечной линии с обеих сторон хирургическими ножницами, чтобы отделить грудную стенку. Обыграйте верхнюю полую вену со счетом 8-0 хирургический шов.
- Вставьте иглу для кожи головы в надпеченочную нижнюю полую вену. Затем введите ледяной физиологический раствор с добавлением 100 МЕ / мл гепарина через иглу для кожи головы из надпечной нижней полой вены для перфузии донорского сердца до тех пор, пока цвет крови не исчезнет.
- Повторно перфузируют донорское сердце 2-3 мл ледяного раствора гистидина-триптофана-кетоглутарата (HTK) (см. Таблицу материалов) с помощью иглы для кожи головы из дуги аорты для защиты донорского миокарда. Среднее время теплой ишемии составляет 5 минут.
- Перевязывают верхнюю и нижнюю полые вены и легочную вену хирургическим швом 5-0. Рассекают и отрезают донорскую аорту и легочную артерию до их разветвления. После этого разделите верхнюю и нижнюю полые вены и легочную вену, чтобы удалить донорское сердце.
3. Имплантация
- Имплантируйте донорское сердце в шейный карман мыши-реципиента в перевернутом положении.
- Втяните манжету с вывернутой яремной веной реципиента в просвет донорской легочной артерии для выполнения сквозного анастомоза донорской легочной артерии к наружной яремной вене реципиента. Перевязать манжету, используя бороздки на поверхности через хирургический шов 10-0, чтобы зафиксировать анастомоз.
- Используйте аналогичную процедуру для сквозного анастомоза донорской аорты к сонной артерии реципиента.
- Отпустите атравматичный микрососудистый зажим яремной вены с последующей сонной артерией для повторной перфузии донорского сердца. Среднее время холодовой ишемии составляет 15 минут.
- Зафиксируйте сердечный трансплантат и зашите его должным образом, чтобы предотвратить перекручивание трансплантата.
- Закрыть шейный разрез непрерывными швами с помощью полиамидного монофиламентного шва 5-0 (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Снимите шов после полного заживления раны. - Держите мышь-реципиента в теплой, сухой и чистой клетке, пока она не оправится от анестезии.
ПРИМЕЧАНИЕ: Восстановление занимает 5-10 минут. - Вводите бупренорфин (0,05 мг/кг) подкожно мыше-реципиенту каждые 6 ч в течение 48 ч для послеоперационной анальгезии.
ПРИМЕЧАНИЕ: Дозировка анальгезии была оптимизирована для этого исследования. Тем не менее, режим обезболивания может быть расширен / изменен при наличии каких-либо признаков боли в соответствии с рекомендациями по использованию животных в учреждении.
Результаты
В этой мышиной гетеротопической модели трансплантации сердца выживаемость мышей-реципиентов составила примерно 95,2% (20 из 21 мыши выжили). Основной причиной смерти стало послеоперационное кровотечение. Учащенное сердцебиение с регулярным ритмом служит показателем приживаемости имплантированного донорского сердца.
Мыши C57BL/6 и BALB/c были типами MHC (H-2b) и MHC (H-2d) в этой модели, соответственно 7,8. Эти два штамма различаются по H-2, который вызывает острое Т-клеточное отторжение9. Из всех сердечных аллотрансплантатов 62,5% были потеряны в течение 7 дней после трансплантации, что оценивалось при пальпации сердцебиения. Все сердечные аллотрансплантаты были потеряны в течение 8 дней после трансплантации. Напротив, все изогенные трансплантации сердца просуществовали более 4 недель (рис. 2). Мышей, которые выжили более 4 недель, усыпляли ингаляцией CO2.

Рисунок 1: Схема модели гетеротопической трансплантации сердца шейки матки мыши. (А) Протокол подготовки реципиента: после клипирования общей сонной артерии и наружной яремной вены на проксимальном конце сосудистый просвет сосудов выворачивается и фиксируется после прохождения через колючую манжету со скошенным концом и бороздками на поверхности. Пунктирный квадрат показывает структуру и использование манжеты. (B) Резекция донорского сердца: после перфузии донорского сердца гепарином и раствором HTK из нижней полой вены и аорты верхняя и нижняя полая вена и легочная вена перевязываются швами. Затем донорское сердце резецируют путем разрезания сосудистых сосудов. (C) Имплантация донорского сердца. Донорская легочная артерия и аорта анастомозируются наружной яремной веной реципиента, а сонная артерия - через манжету, при этом сосудистая сеть реципиента выворачивается наизнанку по сквозному рисунку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
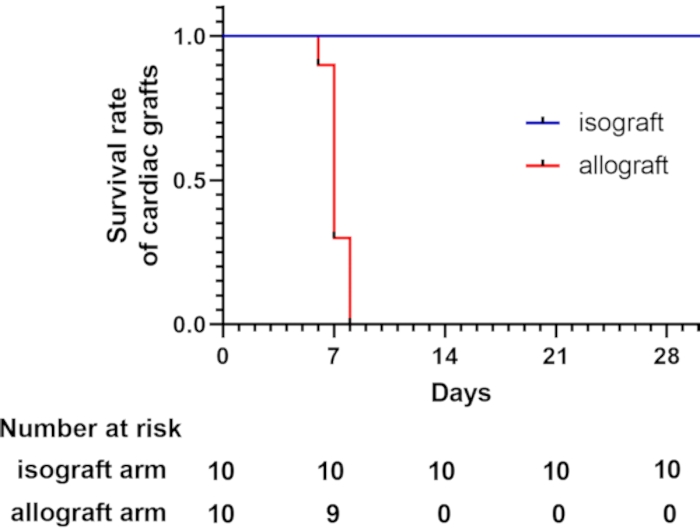
Рисунок 2: Кривая выживаемости сердечных трансплантатов. Кривая выживаемости сердечных трансплантатов показывает, что аллогенные трансплантаты сердца теряются в течение 8 дней после трансплантации, что оценивалось при пальпации сердцебиения. В общей сложности 10 мышей-реципиентов подверглись модифицированной шейной гетеротопической трансплантации сердца в каждой группе. Все изогенные пересадки сердца просуществовали более 4 недель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Руперт Оберхубер и др.10 | Синь Мао и др. (настоящая работа) | |||
| Анестезия | ксилазин и кетамин | изофлуран (безопасный, непрерывный и стабильный) | ||
| Правая доля подчелюстной железы | удаление | сохранение (Уменьшить вращение трансплантатов) | ||
| Правая грудино-ключично-сосцевидная мышца | удаление | сохранение (Уменьшить вращение трансплантатов) | ||
| Сердечная перфузия | Ретроградная перфузия раствором HTK 4 °C из дуги аорты | 1. Антероградная перфузия ледяным физиологическим раствором с добавлением 100 МЕ/мл раствора гепарина из надпечной полой вены. 2. Ретроградная реперфузия ледяным раствором HTK из дуги аорты. (Уменьшить коагуляцию и повысить защиту миокарда) | ||
| Манжета | тупой конец, с ручкой | конический конец, с ручкой, зазубринами и канавками на поверхности (облегчает выворот и фиксацию) | ||
Таблица 1: Сравнение методик трансплантации сердца. Современная техника трансплантации шейного стержня сердца у мышей модифицирована из Oberhuber, R. et al.10 и обладает дополнительными преимуществами для выживания сердечного трансплантата.
Обсуждение
Модель трансплантации сердца мыши способствует исследованию механизмов отторжения после трансплантации сердца, способствуя разработке уникальных подходов к улучшению долгосрочной выживаемости реципиентов сердечного аллотрансплантата. Однако трансплантация сердца у мышей является сложной и ответственной задачей, требующей высокого уровня микрохирургических методов, особенно при сосудистом анастомозе11,12,13. Модель трансплантации абдоминальной гетеротопической трансплантации сердца мыши выполняется с помощью швов путем анастомоза донорской аорты и легочной артерии аорте реципиента и нижней полой вены. Во время этой операции необходимо заблокировать аорту и нижнюю полую вену реципиента. Таким образом, ишемия нижней части тела и тромбоз нижней полой вены могут увеличить инвалидность и смерть мышей-реципиентов. Чтобы уменьшить трудности сосудистого анастомоза во время трансплантации, Matsuura et al. впервые представили модель трансплантации шейного отдела сердца у мышей с использованием техники манжеты в 1991 году14. В данной модели надрукавный эвертированный анастомоз сосудов путем перевязки манжетой повышал эффективность анастомоза. В отличие от анастомоза сосудов с наложением швов на мышиной модели трансплантации брюшной полости, он снижал вероятность кровотечения после процедуры. Таким образом, повышение эффективности анастомоза сокращало время ишемии сердечной мышцы и увеличивало выживаемость сердечных трансплантатов. Кроме того, шейная имплантация донорского сердца не прерывает кровообращение аорты реципиента и нижней полой вены по сравнению с абдоминальной имплантацией15; Таким образом, выживаемость мышей-реципиентов увеличивается.
Здесь описана уникальная экспериментальная модель гетеротопической трансплантации сердца у мышей, созданная Рупертом Оберхубером и др.10. Процедура включает в себя сквозной шейный анастомоз донорской аорты и легочной артерии на сонную артерию реципиента и яремную вену с использованием модифицированной техники Манжеты. В этой модели системное кровообращение мышей-реципиентов не препятствует10, а сердце донора перфузировали из нижней полой вены и аорты растворами гепарина и HTK для лучшей защиты миокарда. Однако критический компонент этой модели отличался от компонента Oberhuber et al.10, в котором использовалась модифицированная колючая манжета со скошенным концом и канавками, аналогичными компоненту Finsterer et al.16. Скошенный конец облегчает выворачивание сосудистого просвета в виде рукава. Бороздки на поверхности облегчают фиксацию вывернутых стенок сосудов манжетой с помощью швов, а зазубрины снаружи манжеты уменьшают соскальзывание стенок анастомозированного сосуда с манжеты (рисунок 1). Эти модификации сокращают время операции на 20% и повышают эффективность имплантации и выживаемость сердечных трансплантатов. Кроме того, модифицированная колючая манжета изготавливается из наиболее распространенного полиуретанового катетера, используемого для иглоукалывания кожи головы, что значительно снижает стоимость процедуры. Сравнение существующей методики с методикой Oberhuber et al.10 показано в таблице 1.
Необходимо отметить уникальные особенности этой модели. Во-первых, длина и калибр манжеты имеют важное значение для успешного анастомоза. Подходящая длина манжеты составляла ~3 мм с ручкой (1 мм) (рис. 1). Подходящий калибр манжеты составляет 26 G и 22 G для артерий и вен соответственно. Неподходящая длина и калибр манжеты могут привести к перекручиванию или чрезмерному натяжению анастомозированных сосудов. Во-вторых, подходящая длина сосудов реципиента составляет от 1,5 до 2 складок манжеты. В-третьих, сердце донора не перфузируется чрезмерным давлением, потенциально повреждая трансплантат. В-четвертых, сердечный трансплантат фиксируется, а манжета анастомозируется в подходящем положении путем наложения швов после имплантации, чтобы избежать движения или скручивания анастомозированных сосудов или трансплантатов. В-пятых, сохранение подчелюстной железы и грудино-ключично-сосцевидной кости способствует уменьшению завихрения или скручивания анастомозированных сосудов или трансплантата при резекции правой подъязычной железы для получения ямки для сердечного трансплантата. В-шестых, для облегчения переворачивания сосудистого просвета и уменьшения тромбоза после операции раствор гепарина (100 МЕ/мл) может быть введен в анастомозированные сосуды при выполнении анастомоза.
Эта техника манжеты облегчает анастомоз сосудов донора и реципиента во время имплантации; Однако твердость манжеты может, в свою очередь, увеличить риск перекручивания анастомозированных сосудов, что приводит к увеличению тромбоза после трансплантации. Оптимизация материала манжеты оправдана для уменьшения осложнений, увеличения приживаемости трансплантата и увеличения коэффициента использования моделей в последующих экспериментах. Кроме того, фиброзный рубец разреза может ограничивать пространство для сердечного трансплантата и влиять на его долгосрочную выживаемость. Кроме того, выброс сердечного трансплантата может мешать нормальному гемодинамическому кровотоку мышей-реципиентов. Наконец, эта модель не функционирует и не может быть использована для оценки сердечной функции трансплантатов. Тем не менее, это исследование дает знания об иммунологических и патологических функциях трансплантации сердца.
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (81870304) Цзюнь Ли.
Материалы
| Name | Company | Catalog Number | Comments |
| 5-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C3090954 | |
| 8-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C2090880 | |
| 10-0 Polyamide Monofilament suture | B.Braun Medical Inc. | G0090781 | |
| 22 G polyurethane cuff | B.Braun Medical Inc. | 4251628-02 | |
| 26 G polyurethane cuff | Suzhou Linhua Medical Instrument Co., LTD | REF383713 | |
| Anesthesia induction chamber | RWD Life Science Co., LTD | V100 | |
| Atraumatic microvascular clamp | Beyotime | FS500 | |
| BALB/c and C57BL/6 mice (20–30 g) | Centre of Experimental Animals (Army Medical University, Chongqing, China) | ||
| Buprenorphine | US Biological life Sciences | 352004 | |
| Electrocoagulator | Guangzhou Runman Medical Instrument Co., LTD | ZJ1099 | |
| Gauze | Henan piaoan group Co., LTD | 10210402 | |
| Heating pad | Guangzhou Dewei Biological Technology Co., LTD | DK0032 | |
| Heparin | North China Pharmaceutical Co., LTD | 2101131-2 | |
| HTK solution | Shenzhen Changyi Pharmaceutical Co., LTD | YZB/Min8263-2013 | |
| Injection syringe (10 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | |
| Isoflurane | RWD Life Science Co., LTD | 21070201 | |
| Physiological saline | Southwest pharmaceutical Co., LTD | H50021610 | |
| Scalp needle | Hongyu Medical Group | 20183150210 | |
| Shaver | Beyotime | FS600 | |
| Small animal anesthesia machine | RWD Life Science Co., LTD | R500 | |
| Surgical operation microscope | Tiannuoxiang Scientific Instrument Co. , Ltd, Beijing, China | SZX-6745 | |
| Swab | Yubei Medical Materials Co., LTD | 21080274 |
Ссылки
- Khush, K. K., et al. The International thoracic organ transplant registry of the international society for heart and lung transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. The Journal of Heart and Lung Transplantation. 38 (10), 1056-1066 (2019).
- Stehlik, J., et al. The registry of the international society for heart and lung transplantation: 29th official adult heart transplant report--2012. The Journal of Heart and Lung Transplantation. 31 (10), 1052-1064 (2012).
- Huang, H., et al. Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression. Journal of Surgical Research. 185 (2), 896-903 (2013).
- Eggenhofer, E., et al. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transplant Immunology. 25 (2-3), 141-147 (2011).
- Sula Karreci, E., et al. Brief treatment with a highly selective immunoproteasome inhibitor promotes long-term cardiac allograft acceptance in mice. Proceedings of the National Academy of Sciences of the United States of America. 113 (52), 8425-8432 (2016).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. 6, 238(2007).
- Lin, C. M., Gill, R. G., Mehrad, B. The natural killer cell activating receptor, NKG2D, is critical to antibody-dependent chronic rejection in heart transplantation. American Journal of Transplantation. 21 (11), 3550-3560 (2021).
- Ito, H., Hamano, K., Fukumoto, T., Wood, K. J., Esato, K. Bidirectional blockade of CD4 and major histocompatibility complex class II molecules: An effective immunosuppressive treatment in the mouse heart transplantation model. The Journal of Heart and Lung Transplantation. 17 (5), 460-469 (1998).
- Zhou, Y. X., et al. Acute rejection correlates with expression of major histocompatibility complex class I antigens on peripheral blood CD3(+)CD8(+) T-lymphocytes following skin transplantation in mice. Journal of International Medical Research. 39 (2), 480-487 (2011).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. Journal of Visualized Experiments. (92), e50753(2014).
- Cui, D., Tan, C., Liu, Z. An alternative technique of arterial anastomosis in mouse heart transplantation. Clinical Transplantation. 32 (6), 13264(2018).
- Plenter, R. J., Zamora, M. R., Grazia, T. J. Four decades of vascularized heterotopic cardiac transplantation in the mouse. Journal of Investigative Surgery. 26 (4), 223-228 (2013).
- Fang, J., et al. A simplified two-stitch sleeve technique for arterial anastomosis of cervical heterotopic cardiac transplantation in mice. American Journal of Translational Research. 5 (5), 521-529 (2013).
- Matsuura, A., Abe, T., Yasuura, K. Simplified mouse cervical heart transplantation using a cuff technique. Transplantation. 51 (4), 896-898 (1991).
- Corry, R. J., Winn, H. J., Russell, P. S. Primarily vascularized allografts of hearts in mice. The role of H-2D, H-2K, and non-H-2 antigens in rejection. Transplantation. 16 (4), 343-350 (1973).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), 293-299 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены