Method Article
טכניקת שרוול שונה למודל השתלת לב הטרוטופי של עכבר צוואר הרחם
In This Article
Summary
בפרוטוקול הנוכחי, מודל השתלת לב עכבר משמש לחקירת מנגנון דחיית אלוגרפט לבבי. במודל השתלת לב הטרוטופי זה, יעילות הניתוח משופרת, והישרדותם של שתלי לב מובטחת על ידי אנסטומוזה מקצה לקצה של צוואר הרחם של השתלת לב באמצעות טכניקת שרוול שונה.
Abstract
דחיית השתלת לב מגבילה את הישרדותם לטווח ארוך של חולים לאחר השתלת לב. מודל השתלת לב עכבר אידיאלי לחקר המנגנון של דחיית אלוגרפט לבבי במחקרים פרה-קליניים בגלל ההומולוגיה הגבוהה שלהם עם גנים אנושיים. הבנה זו תסייע לפתח גישות ייחודיות לשיפור הישרדותם ארוכת הטווח של החולים המטופלים באלושתלי לב. במודל עכברי, השתלת לב תורם בטן מבוצעת בדרך כלל עם אנסטומוזה מקצה לקצה לאבי העורקים של המקבל ונבוב ורידי נחות באמצעות תפרים. במודל זה, ליבו של התורם מושתל באנסטומוזה מקצה לקצה לעורק התרדמה ולווריד הצוואר של המקבל בטכניקת השרוול השונה. ניתוח ההשתלה מבוצע ללא תפירה ובכך עשוי להגדיל את הישרדותו של המושתל שכן אין הפרעה באספקת הדם וריפלוקס ורידי פלג הגוף התחתון. מודל עכברי זה יסייע לחקור את המנגנונים העומדים בבסיס הדחייה האימונולוגית והפתולוגית (חריפה/כרונית) של אלוגרפטים לבביים.
Introduction
השתלת לב הפכה לטיפול הסטנדרטי באי ספיקת לב סופנית. יותר מ-5,500 השתלות לב בשנה מבוצעות בארגונים הרשומים תחת האגודה הבינלאומית להשתלות לב וריאות. בקרב מושתלי הלב האלוגניים, שיעור הדחייה לשנה הוא עדיין >10%, בעוד ששיעור הדחייה ל-3 שנים עלה ל-36%1,2. עם זאת, טיפולים מניעתיים יעילים לחולים עם דחיית אלוגרפט לבבית חסרים. לכן, מחקרי מודלים בבעלי חיים מוצדקים המבהירים את המנגנונים הפיזיולוגיים העומדים בבסיס הדחייה החיסונית והפתולוגית של אלוגרפטים לבביים. מחקרים כאלה יתרמו לחקר מטרות חדשות הנדרשות לפיתוח תרופות יעילות, אשר יסייעו במניעת דחיית אלוגרפט לבבי וישפרו את שיעורי ההישרדות באוכלוסיות חולים אלה.
כמה מנגנונים אימונולוגיים ופתופיזיולוגיים פוטנציאליים של דחיית אלוגרפט לבבי הוצעו לאחרונה במחקרי מודל עכברים של השתלת לב הטרוטופית 3,4,5. כתוצאה מכך, השתלת לב הטרוטופית בעכבר הפכה למודל פרה-קליני אידיאלי לחקר מנגנוני הדחייה החיסונית והפגיעה הפתולוגית המתרחשים בהשתלות לב לאחר השתלת לב בגלל ההומולוגיה הגבוהה שלהם עם גנים אנושיים. הרעיון הרווח הוא לבצע השתלה הטרוטופית במודל עכברי על ידי אנסטומוזה בטנית מקצה לקצה באבי העורקים המושתל ונבוב ורידי נחות באמצעות תפרים, בדומה לאנטומיה האנושית הרגילה. עם זאת, הליך זה עלול להפריע לאספקת הדם של המקבל וריפלוקס ורידי של פלג הגוף התחתון6. לכן, הליך השתלת לב הטרוטופי שונה במודל עכבר מוצע כאן.
ליבו של התורם מושתל בעורק התרדמה ובווריד הצוואר של המקבל על ידי אנסטומוזה צווארית מקצה לקצה בטכניקת שרוול שונה. הליך שונה זה הקל על ההיתכנות הניתוחית והבטיח את הישרדות השתל הלבבי מבלי להפריע לאספקת הדם ולריפלוקס ורידי של פלג הגוף התחתון.
Protocol
כל הניסויים בבעלי חיים בוצעו בהתאם למדריך לטיפול ושימוש בחיות מעבדה, מהדורה שמינית, המועצה הלאומית למחקר (ארה"ב) 2011. נהלים המערבים נבדקים בבעלי חיים אושרו על ידי הוועדה לטיפול ושימוש בבעלי חיים של בית החולים לסרטן של אוניברסיטת צ'ונגצ'ינג, צ'ונגצ'ינג, סין. עכברי BALB/c ו-C57BL/6 זכרים במשקל 20-30 גרם, שהתקבלו ממקורות מסחריים (ראו טבלת חומרים), שימשו למחקר השתלת לב אלוגנית. עכברי C57BL/6 שימשו כתורמים ומושתלים סינגניים, ואילו עכברי BALB/c שימשו כמושתלים אלוגניים. סכמה של הפרוטוקול מוצגת באיור 1.
הערה: כל החומרים המשמשים במהלך הניתוח, כולל מכשירים ופתרונות ניתוחיים, הם סטריליים. ההליך הכירורגי שומר על עקרון טכניקת הפעולה האספטית.
1. הליך הנמען
- יש להשרות הרדמה כללית באמצעות שאיפה של איזופלורן 5% דרך תא אינדוקציה בגודל 15 x 10 x 10 ס"מ המחובר למכסה מנוע (ראה טבלת חומרים).
- תקן את העכבר הנמען על שולחן הניתוחים באמצעות כרית חימום. יש לשמור על הרדמה עם שאיפה מתמשכת של 2% איזופלורן דרך מסכת פנים מעל האף והפה.
הערה: קצב וקצב נשימה איטיים, היעלמות רפלקס הקרנית והיעדר רפלקס הדוושה באצבעות הרגליים מצביעים על יעילות ההרדמה. - לאחר גילוח השיער, יש לחטא את אזור הניתוח בשלושה סבבים לסירוגין של קרצוף פובידון-יוד ואחריו אלכוהול. לאחר מכן, חותכים את העור 1.5-2 ס"מ במקביל לקו האמצע הצווארי מהזווית המנדיבולרית הימנית ועד קצה הזנב.
- לנתח ~ 1 ס"מ של וריד הצוואר החיצוני הימני באמצעות אלקטרו-קרישה ומיקרו-מלקחיים. חותכים את הווריד בקצה הפרוקסימלי עם מהדק כלי דם א-טראומטי ומחברים אותו בקצה הדיסטלי.
- מעבירים את הקצה הדיסטלי של הווריד דרך שרוול דוקרני פוליאוריתן 22 גרם (ראו טבלת חומרים) עם קצה משופע וחריצים שטחיים. תקן את הווריד עם ידית השרוול באמצעות מהדק כלי דם.
- הסר את ה-8-0 תפר קשירה בקצה הדיסטלי, להפוך את לומן מעל השרוול מחובר על ידי barb שטחי מבפנים החוצה ולתקן עם תפר כירורגי 10-0 חריצים של פני השטח.
- יש לכרות את הבלוטה התת-לשונית הימנית כדי ליצור פוסה להשתלת השתלת הלב, ולשמור את האונה הימנית של הבלוטה התת-מקסילרית ואת הסטרנוקלידומסטואיד הימני.
- נתחו את עורק התרדמה המשותף הימני במשך ~1 ס"מ באמצעות מיקרו-מלקחיים, וחתכו את העורק עם מהדק מיקרו-וסקולרי א-טראומטי בקצה הפרוקסימלי. בקצה הדיסטלי, לקשור ולחתוך את העורק.
- מעבירים את הקצה הדיסטלי של העורק דרך שרוול דוקרני פוליאוריתן 26 גרם (ראו טבלת חומרים) עם קצה משופע וחריצים על פני השטח. תקן את העורק עם ידית השרוול באמצעות מהדק כלי דם.
- מוציאים את תפר הקשירה בקצה הדיסטלי, הופכים את הלומן מבפנים החוצה מעל השרוול, ומקבעים עם מוט שטחי וחריצים בתפר כירורגי 10-0.
- לאחר הכנת כלי הדם של הנמען, יש לטפטף 100 IU/mL של מי מלח הפרין על כלי הדם כדי למנוע פקקת. מכסים את חתך צוואר הרחם בגזה מלח רטובה סטרילית להשתלה לאחר מכן.
2. הליך התורם
- השתמש באותו הליך הרדמה (שלב 1.1) עבור העכבר התורם.
- יש לגלח את שיער הבטן באמצעות סכין גילוח חשמלי, ולחטא את אזור הניתוח בשלושה סבבים לסירוגין של קרצוף פובידון-יוד ואחריו אלכוהול.
- חותכים את הבטן (2-3 ס"מ) עם מספריים לאורך קו האמצע מהסימפיזיס פאביס לסובקסיפואיד, ומרחיבים את האזור החתוך עם מחזיר.
- יש לנתח 1 ס"מ של אבי העורקים הבטני והווריד הנבוב התחתון באמצעות אלקטרו-קרישה ומיקרו-מלקחיים, ולבצע הפריניזציה על ידי הזרקת 1 מ"ל של מי מלח פיזיולוגיים בתוספת 250 IU/מ"ל של הפרין דרך הווריד הנבוב התחתון. לאחר מכן, הבלו את אבי העורקים הבטן ואת נבוב הווריד הנחות.
- מוציאים את בית החזה לאורך קו בית השחי הקדמי משני הצדדים באמצעות מספריים כירורגיים להפרדת דופן בית החזה. ניצחון 0:8 על הווריד קאווה המעולה תפר כירורגי.
- הכנס מחט קרקפת אל הווריד הנבוב התחתון suprahepatic. לאחר מכן, הזריקו מלח פיזיולוגי קר כקרח בתוספת 100 IU/mL של הפרין דרך מחט הקרקפת מווריד נבוב נחות בכבד כדי לחורר את הלב התורם עד שצבע הדם דוהה.
- לנקב מחדש את לב התורם עם 2-3 מ"ל של תמיסת היסטידין-טריפטופן-קטוגלוטרט (HTK) קרה כקרח (ראו טבלת חומרים) באמצעות מחט קרקפת מקשת אבי העורקים כדי להגן על שריר הלב של התורם. זמן האיסכמיה החם הממוצע הוא 5 דקות.
- קשרו את הווריד הנבוב העליון והנחות ואת וריד הריאתי בתפר ניתוחי 5-0. לנתח ולחתוך את אבי העורקים התורם ואת עורק הריאה לפני הסתעפותם. לאחר מכן, לחלק את הווריד הנבוב העליון והנחות ואת הווריד הריאתי כדי להסיר את הלב של התורם.
3. השתלה
- השתיל את הלב התורם בכיס הצוואר של העכבר המקבל במצב הפוך.
- משוך את השרוול עם וריד ג'וגולרי מושתל קטוע לתוך לומן של עורק הריאה התורם כדי לבצע אנסטומוזה מקצה לקצה של עורק הריאה התורם לווריד הצוואר החיצוני של הנמען. קשרו את השרוול באמצעות החריצים על פני השטח דרך תפר כירורגי 10-0 כדי לתקן את האנסטומוזה.
- להפעיל הליך דומה עבור אנסטומוזה מקצה לקצה של אבי העורקים התורם לעורק התרדמה המקבל.
- שחררו את המהדק המיקרו-וסקולרי הא-טראומטי של הווריד הצווארי ואחריו את עורק התרדמה כדי לחורר מחדש את לב התורם. זמן האיסכמיה הקר הממוצע הוא 15 דקות.
- תקן את השתל הלבבי ותפר אותו כראוי כדי למנוע פיתול של השתל.
- סגור את החתך הצווארי עם תפרים רציפים באמצעות תפר מונופילמנט פוליאמיד 5-0 (ראה טבלת חומרים).
הערה: הסר את התפר לאחר שהפצע נרפא לחלוטין. - שמור את העכבר המושתל בתוך כלוב חם, יבש ונקי עד שהוא מתאושש מההרדמה.
הערה: לוקח 5-10 דקות להתאושש. - הזריקו buprenorphine (0.05 מ"ג / ק"ג) תת עורית לתוך העכבר המקבל כל 6 שעות במשך 48 שעות עבור שיכוך כאבים לאחר הניתוח.
הערה: מינון שיכוך הכאבים הותאם למחקר זה. עם זאת, ניתן להאריך / לשנות את משטר שיכוך הכאבים אם יש סימן כלשהו לכאב בהתאם להנחיות המוסדיות לשימוש בבעלי חיים.
תוצאות
במודל השתלת לב הטרוטופי זה של עכבר צוואר הרחם, שיעור ההישרדות של עכברים מושתלים היה כ -95.2% (20 מתוך 21 עכברים שרדו). סיבת המוות העיקרית הייתה דימום לאחר הניתוח. פעימות הלב המהירות עם קצב קבוע משמשות אינדיקטור להישרדות הלב התורם המושתל.
עכברי C57BL/6 ו-BALB/c היו מסוג MHC (H-2b) ו-MHC (H-2d) בדגם זה, בהתאמה 7,8. שני זנים אלה נבדלים זה מזה ב-H-2, הגורם לדחייה חריפה בתיווך תאי T9. מתוך כל השתלות הלב, 62.5% אבדו תוך 7 ימים לאחר ההשתלה, כפי שהוערך על ידי מישוש פעימות הלב. כל השתלות הלב אבדו תוך 8 ימים לאחר ההשתלה. לעומת זאת, כל השתלות הלב האיזוגניות שרדו מעבר ל-4 שבועות (איור 2). עכברים ששרדו מעבר ל-4 שבועות הומתו על ידי שאיפתCO2.

איור 1: סכמטי של מודל השתלת הלב ההטרוטופי של צוואר הרחם בעכבר. (A) פרוטוקול להכנת הנמען: לאחר חיתוך עורק התרדמה המשותף ווריד הצוואר החיצוני בקצה הפרוקסימלי, לומן כלי הדם נחתך ומקובע לאחר שעבר דרך השרוול הדוקרני עם קצה משופע וחריצים על פני השטח. הריבוע המקווקו מציג את מבנה השרוול ואת השימוש בו. (B) כריתת לב מתורם: לאחר זילוח הלב התורם עם הפרין ותמיסת HTK מהווריד הנבוב התחתון ואבי העורקים, קושרים את הווריד הנבוב העליון והתחתון ואת וריד הריאה בתפרים. לאחר מכן הלב של התורם נכרת על ידי חיתוך כלי הדם. (ג) השתלת לב התורם. עורק הריאה ואבי העורקים של התורם מוצמד לווריד הצוואר החיצוני של הנתרם, ועורק התרדמה דרך השרוול כאשר כלי הדם של המקבל מופנים החוצה בתבנית מקצה לקצה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
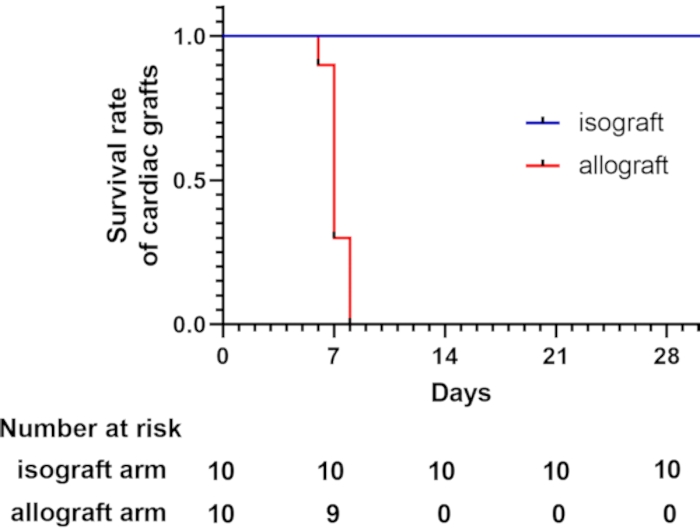
איור 2: עקומת הישרדות עבור שתלי לב. עקומת ההישרדות של שתלי לב מראה כי השתלות לב אלוגניות אובדות תוך 8 ימים לאחר ההשתלה, אשר הוערכה על ידי מישוש פעימות הלב. סה"כ 10 עכברים מושתלים עברו השתלת לב הטרוטופית צווארית שונה בכל קבוצה. כל השתלות הלב האיזוגניות שרדו יותר מ-4 שבועות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| רופרט אוברהובר ואח' 10 | Xin Mao et al (עבודה נוכחית) | |||
| הרדמה | קסילזין וקטמין | איזופלורן (בטוח, רציף ויציב) | ||
| האונה הימנית של הבלוטה התת-לסתית | להסרת | שימור (הפחתת סיבובים של שתלים) | ||
| סטרנוקלידומסטואיד ימני | להסרת | שימור (הפחתת סיבובים של שתלים) | ||
| זילוח לב | זילוח מדרדר עם תמיסת HTK בטמפרטורה של 4°C מקשת אבי העורקים | 1. זילוח אנטרוגרדי עם מי מלח פיזיולוגיים קרים כקרח בתוספת תמיסת הפרין 100 IU/mL מהווריד הנבוב העל-כבדי. 2. זילוח מדרדר עם תמיסת HTK קרה כקרח מקשת אבי העורקים. (הפחתת קרישה והגברת ההגנה על שריר הלב) | ||
| שרוול | קצה קהה, עם ידית | קצה משופע, עם ידית, מוטות וחריצים על פני השטח (להקל על היפוך וקיבוע) | ||
טבלה 1: השוואה בין טכניקות השתלת לב. טכניקת השתלת הלב ההטרוטופית הנוכחית של עכבר צוואר הרחם שונה מ- Oberhuber, R. et al.10 ויש לה יתרונות נוספים להישרדות השתלת לב.
Discussion
מודל השתלת הלב בעכבר תורם לחקר מנגנוני הדחייה לאחר השתלת לב, ותורם לפיתוח גישות ייחודיות לשיפור הישרדותם ארוכת הטווח של מושתלי השתלת לב. עם זאת, השתלת לב בעכברים היא משימה מורכבת ומאתגרת, הדורשת רמה גבוהה של טכניקות מיקרוכירורגיה, במיוחד באנסטומוזה וסקולרית11,12,13. מודל השתלת לב הטרוטופי בטני בעכבר מבוצע באמצעות תפרים על ידי אנסטומוזה של אבי העורקים התורם ועורק הריאה לאבי העורקים המקבל ולווריד הנבוב התחתון. אבי העורקים של הנמען והווריד הנבוב התחתון צריכים להיחסם בפעולה זו. לכן, איסכמיה של פלג הגוף התחתון ופקקת של הווריד הנבוב התחתון יכולים להגדיל את הנכות ואת המוות של עכברים מקבלים. כדי להפחית את הקשיים של אנסטומוזה וסקולרית במהלך ההשתלה, Matsuura et al. הציגו לראשונה מודל השתלת לב צוואר הרחם בעכברים באמצעות טכניקת השרוול בשנת 199114. במודל זה, האנסטומוזה דמוית שרוול יתר של כלי דם על ידי קשירה עם שרוול הגבירה את יעילות האנסטומוזה. בניגוד לאנסטומוזה של כלי דם עם תפרים במודל עכבר השתלת לב בטן, היא הפחיתה את ההסתברות לדימום לאחר ההליך. לכן, שיפור יעילות האנסטומוזה הפחית את זמן האיסכמיה של שריר הלב והגדיל את שיעור ההישרדות של שתלי לב. בנוסף, השתלת צוואר הרחם של לב התורם אינה קוטעת את זרימת אבי העורקים המקבל ואת הווריד הנבוב התחתון בהשוואה להשתלת בטן15; לכן, הישרדותם של עכברים מושתלים גדלה.
כאן מתואר מודל השתלת לב ניסיוני הטרוטופי ייחודי של עכברים, שהוקם על ידי רופרט אוברהובר ואחרים. ההליך כולל אנסטומוזה צווארית מקצה לקצה של אבי העורקים ועורק הריאה התורם לעורק התרדמה המקבל ולווריד הצווארי, בעקבות טכניקת שרוול שונה. במודל זה, זרימת הדם המערכתית של העכברים המקבלים אינה מפריעהל-10, וליבו של התורם נוקב מהווריד הנבוב ואבי העורקים הנחותים עם תמיסות הפרין ו-HTK להגנה טובה יותר על שריר הלב. עם זאת, המרכיב הקריטי של מודל זה היה שונה מזה של Oberhuber et al.10, אשר השתמשו בשרוול דוקרני שונה עם קצה משופע וחריצים דומים לזה של Finsterer et al.16. קצה השיפוע מאפשר אוורט דמוי שרוול של לומן כלי הדם. החריצים על פני השטח מאפשרים קיבוע של דפנות כלי דם חתוכים באמצעות שרוול באמצעות תפרים, והמוט שמחוץ לשרוול מפחית את ההחלקה של דפנות כלי הדם האנסטומוזיים מהשרוול (איור 1). שינויים אלו מקצרים את זמן הניתוח ב-20% ומשפרים את יעילות ההשתלה והשרידות של השתלות הלב. יתר על כן, השרוול הדוקרני המותאם מופק מצנתר הפוליאוריתן הנפוץ ביותר המשמש לדיקור בקרקפת, ובכך מוזיל משמעותית את עלות ההליך. השוואה של הטכניקה הנוכחית עם זו של Oberhuber et al.10 מוצגת בטבלה 1.
יש לציין את התכונות הייחודיות של מודל זה. ראשית, אורכו ואיכותו של השרוול חיוניים לאנסטומוזה מוצלחת. האורך המתאים של השרוול היה ~3 מ"מ עם ידית (1 מ"מ) (איור 1). הקליבר המתאים של השרוול הוא 26 G ו 22 G עבור עורק וורידים, בהתאמה. האורך והקליבר הלא מתאימים של השרוול יגרמו לפיתול או מתח מוגזם של כלי הדם האנסטומוזיים. שנית, אורכי הכלים המתאימים של המקבל הם 1.5 עד 2 קפלים של השרוול. שלישית, ליבו של התורם אינו מחורר בלחץ מוגזם, מה שעלול לפגוע בשתל. רביעית, השתל הלבבי קבוע, והשרוול עובר אנסטומוזות בתנוחה מתאימה על ידי תפירה לאחר ההשתלה כדי למנוע תזוזה או פיתול של כלי דם או שתלים אנסטומוזיים. חמישית, שימור הבלוטה התת-מקסילרית והסטרנוקלידומסטואיד תורם להפחתת סיבוב או פיתול של כלי הדם האנסטומוזיים או השתל בעת כריתת הבלוטה התת-לשונית הימנית כדי לייצר פוסה להשתלת לב. שישית, כדי להקל על אוורט דמוי שרוול יתר של לומנאנד כלי הדם להפחית פקקת לאחר הניתוח, תמיסת הפרין (100 IU / מ"ל) ניתן לספק כלי הדם anastomosed בעת ביצוע anastomosis.
טכניקת שרוול זו מקלה על האנסטומוזה של כלי הדם של התורם והמקבל במהלך ההשתלה; עם זאת, קשיות השרוול עשויה, בתורו, להגדיל את הסיכון לסובב את כלי הדם anastomosed, וכתוצאה מכך עלייה פקקת לאחר ההשתלה. אופטימיזציה של חומר השרוול נדרשת כדי להפחית סיבוכים, להגדיל את הישרדות השתל ולהגדיל את שיעור ניצול המודלים בניסויים הבאים. יתר על כן, הצלקת הסיבית של החתך עלולה להגביל את שטח השתל הלבבי ולהשפיע על הישרדותו לטווח ארוך. בנוסף, פליטה של שתל הלב עלולה להפריע לזרימת הדם ההמודינמית הרגילה של העכברים המושתלים. לבסוף, מודל זה אינו פונקציונלי ולא ניתן להשתמש בו כדי להעריך את תפקוד הלב של שתלים. עם זאת, מחקר זה מספק ידע לגבי התפקודים האימונולוגיים והפתולוגיים של השתלת לב.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי הקרן הלאומית למדעי הטבע של סין (81870304) לג'ון לי.
Materials
| Name | Company | Catalog Number | Comments |
| 5-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C3090954 | |
| 8-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C2090880 | |
| 10-0 Polyamide Monofilament suture | B.Braun Medical Inc. | G0090781 | |
| 22 G polyurethane cuff | B.Braun Medical Inc. | 4251628-02 | |
| 26 G polyurethane cuff | Suzhou Linhua Medical Instrument Co., LTD | REF383713 | |
| Anesthesia induction chamber | RWD Life Science Co., LTD | V100 | |
| Atraumatic microvascular clamp | Beyotime | FS500 | |
| BALB/c and C57BL/6 mice (20–30 g) | Centre of Experimental Animals (Army Medical University, Chongqing, China) | ||
| Buprenorphine | US Biological life Sciences | 352004 | |
| Electrocoagulator | Guangzhou Runman Medical Instrument Co., LTD | ZJ1099 | |
| Gauze | Henan piaoan group Co., LTD | 10210402 | |
| Heating pad | Guangzhou Dewei Biological Technology Co., LTD | DK0032 | |
| Heparin | North China Pharmaceutical Co., LTD | 2101131-2 | |
| HTK solution | Shenzhen Changyi Pharmaceutical Co., LTD | YZB/Min8263-2013 | |
| Injection syringe (10 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | |
| Isoflurane | RWD Life Science Co., LTD | 21070201 | |
| Physiological saline | Southwest pharmaceutical Co., LTD | H50021610 | |
| Scalp needle | Hongyu Medical Group | 20183150210 | |
| Shaver | Beyotime | FS600 | |
| Small animal anesthesia machine | RWD Life Science Co., LTD | R500 | |
| Surgical operation microscope | Tiannuoxiang Scientific Instrument Co. , Ltd, Beijing, China | SZX-6745 | |
| Swab | Yubei Medical Materials Co., LTD | 21080274 |
References
- Khush, K. K., et al. The International thoracic organ transplant registry of the international society for heart and lung transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. The Journal of Heart and Lung Transplantation. 38 (10), 1056-1066 (2019).
- Stehlik, J., et al. The registry of the international society for heart and lung transplantation: 29th official adult heart transplant report--2012. The Journal of Heart and Lung Transplantation. 31 (10), 1052-1064 (2012).
- Huang, H., et al. Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression. Journal of Surgical Research. 185 (2), 896-903 (2013).
- Eggenhofer, E., et al. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transplant Immunology. 25 (2-3), 141-147 (2011).
- Sula Karreci, E., et al. Brief treatment with a highly selective immunoproteasome inhibitor promotes long-term cardiac allograft acceptance in mice. Proceedings of the National Academy of Sciences of the United States of America. 113 (52), 8425-8432 (2016).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. 6, 238 (2007).
- Lin, C. M., Gill, R. G., Mehrad, B. The natural killer cell activating receptor, NKG2D, is critical to antibody-dependent chronic rejection in heart transplantation. American Journal of Transplantation. 21 (11), 3550-3560 (2021).
- Ito, H., Hamano, K., Fukumoto, T., Wood, K. J., Esato, K. Bidirectional blockade of CD4 and major histocompatibility complex class II molecules: An effective immunosuppressive treatment in the mouse heart transplantation model. The Journal of Heart and Lung Transplantation. 17 (5), 460-469 (1998).
- Zhou, Y. X., et al. Acute rejection correlates with expression of major histocompatibility complex class I antigens on peripheral blood CD3(+)CD8(+) T-lymphocytes following skin transplantation in mice. Journal of International Medical Research. 39 (2), 480-487 (2011).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. Journal of Visualized Experiments. (92), e50753 (2014).
- Cui, D., Tan, C., Liu, Z. An alternative technique of arterial anastomosis in mouse heart transplantation. Clinical Transplantation. 32 (6), 13264 (2018).
- Plenter, R. J., Zamora, M. R., Grazia, T. J. Four decades of vascularized heterotopic cardiac transplantation in the mouse. Journal of Investigative Surgery. 26 (4), 223-228 (2013).
- Fang, J., et al. A simplified two-stitch sleeve technique for arterial anastomosis of cervical heterotopic cardiac transplantation in mice. American Journal of Translational Research. 5 (5), 521-529 (2013).
- Matsuura, A., Abe, T., Yasuura, K. Simplified mouse cervical heart transplantation using a cuff technique. Transplantation. 51 (4), 896-898 (1991).
- Corry, R. J., Winn, H. J., Russell, P. S. Primarily vascularized allografts of hearts in mice. The role of H-2D, H-2K, and non-H-2 antigens in rejection. Transplantation. 16 (4), 343-350 (1973).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), 293-299 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved