Method Article
Una técnica de manguito modificado para el modelo de trasplante cardíaco heterotópico cervical de ratón
En este artículo
Resumen
En el presente protocolo, se utiliza un modelo de trasplante cardíaco de ratón para investigar el mecanismo del rechazo del aloinjerto cardíaco. En este modelo heterotópico de trasplante cardíaco, se mejora la eficiencia de la operación y la supervivencia de los injertos cardíacos se garantiza mediante una anastomosis cervical de extremo a extremo de la implantación cardíaca utilizando una técnica de manguito modificado.
Resumen
El rechazo del aloinjerto cardíaco limita la supervivencia a largo plazo de los pacientes después del trasplante de corazón. Un modelo de trasplante de corazón de ratón es ideal para investigar el mecanismo de rechazo del aloinjerto cardíaco en estudios preclínicos debido a su alta homología con genes humanos. Esta comprensión ayudaría a desarrollar enfoques únicos para mejorar la supervivencia a largo plazo de los pacientes tratados con aloinjertos cardíacos. En un modelo de ratón, la implantación cardíaca de un donante abdominal se realiza comúnmente con una anastomosis de extremo a extremo en la aorta del receptor y la vena cava inferior mediante puntos de sutura. En este modelo, el corazón del donante se implanta mediante anastomosis de extremo a extremo en la arteria carótida y la vena yugular del receptor mediante la técnica del manguito modificado. La cirugía de trasplante se realiza sin suturas y, por lo tanto, puede aumentar la supervivencia del receptor, ya que no hay interferencia con el suministro de sangre y el reflujo venoso de la parte inferior del cuerpo. Este modelo de ratón ayudaría a investigar los mecanismos subyacentes al rechazo inmunológico y patológico (agudo/crónico) de los aloinjertos cardíacos.
Introducción
El trasplante de corazón se ha convertido en el tratamiento estándar para la insuficiencia cardíaca terminal. Más de 5.500 trasplantes de corazón por año se realizan en las organizaciones registradas bajo la Sociedad Internacional de Trasplante de Corazón y Pulmón. Entre los receptores de trasplante alogénico de corazón, la tasa de rechazo a 1 año sigue siendo del >10%, mientras que la tasa de rechazo a 3 años aumentó al 36%1,2. Sin embargo, faltan tratamientos profilácticos efectivos para los pacientes con rechazo del aloinjerto cardíaco. Por lo tanto, se justifican estudios con modelos animales que aclaren los mecanismos fisiológicos subyacentes al rechazo inmunológico y patológico de los aloinjertos cardíacos. Tales estudios contribuirían a la investigación de nuevos objetivos necesarios para desarrollar fármacos eficaces, lo que ayudaría a prevenir el rechazo del aloinjerto cardíaco y mejorar las tasas de supervivencia en esas poblaciones de pacientes.
Algunos posibles mecanismos inmunológicos y fisiopatológicos del rechazo del aloinjerto cardíaco han sido propuestos recientemente en estudios con modelos de ratón de trasplante cardíaco heterotópico 3,4,5. En consecuencia, el trasplante cardíaco heterotópico de ratón se convirtió en un modelo preclínico ideal para investigar los mecanismos de rechazo inmune y lesión patológica que ocurren en los aloinjertos cardíacos después del trasplante cardíaco debido a su alta homología con genes humanos. El concepto predominante es realizar un trasplante heterotópico en un modelo de ratón mediante una anastomosis abdominal de extremo a extremo en la aorta receptora y la vena cava inferior mediante puntos de sutura, similares a la anatomía humana normal. Sin embargo, este procedimiento puede interferir con el riego sanguíneo del receptor y el reflujo venoso de la parte inferior del cuerpo6. Por lo tanto, aquí se propone un procedimiento de trasplante cardíaco heterotópico modificado en un modelo de ratón.
El corazón del donante se implanta con la arteria carótida y la vena yugular del receptor mediante una anastomosis cervical de extremo a extremo utilizando una técnica de manguito modificada. Este procedimiento modificado facilitó la viabilidad operatoria y aseguró la supervivencia del injerto cardíaco sin interferir con el suministro de sangre y el reflujo venoso de la parte inferior del cuerpo.
Protocolo
Todos los experimentos con animales se realizaron de conformidad con la Guía para el cuidado y uso de animales de laboratorio, octava edición, Consejo Nacional de Investigación (EE.UU.) 2011. Los procedimientos que involucran sujetos animales han sido aprobados por el Comité de Cuidado y Uso de Animales del Hospital de Cáncer de la Universidad de Chongqing, Chongqing, China. Para el estudio de trasplante alogénico se utilizaron ratones machos BALB/c y C57BL/6 con un peso de 20-30 g, obtenidos de fuentes comerciales (ver Tabla de materiales). Los ratones C57BL/6 se utilizaron como donantes y receptores singénicos, mientras que los ratones BALB/c sirvieron como receptores alogénicos. En la figura 1 se muestra un esquema del protocolo.
NOTA: Todos los suministros utilizados durante la cirugía, incluidos los instrumentos y soluciones quirúrgicas, son estériles. El procedimiento quirúrgico se adhiere al principio de la técnica de operación aséptica.
1. Procedimiento del destinatario
- Inducir anestesia general por inhalación de isoflurano al 5% a través de una cámara de inducción de 15 x 10 x 10 cm conectada con una campana (ver Tabla de materiales).
- Fije el ratón destinatario en la mesa de operaciones con una almohadilla térmica. Mantener la anestesia con inhalación continua de isoflurano al 2% a través de una mascarilla facial sobre la nariz y la boca.
NOTA: La frecuencia y el ritmo respiratorios lentos, la desaparición del reflejo corneal y la ausencia del reflejo pedal en los dedos de los pies indican la efectividad de la anestesia. - Después de afeitarse el cabello, desinfecte el área quirúrgica con tres rondas alternas de exfoliante de povidona yodada seguido de alcohol. Luego, incide la piel 1.5-2 cm paralela a la línea media cervical desde el ángulo mandibular derecho hasta el extremo de la cola.
- Diseccionar ~1 cm de la vena yugular externa derecha usando un electrocoagulador y microfórceps. Recorte la vena en el extremo proximal con una pinza microvascular atraumática y anítela en el extremo distal.
- Pase el extremo distal de la vena a través de un manguito de púas de poliuretano de 22 G (consulte la Tabla de materiales) con un extremo cónico y ranuras superficiales. Fije la vena con el mango del manguito con una pinza microvascular.
- Eliminar el 8-0 Sutura de ligadura en el extremo distal, gire la luz sobre el manguito enganchado por la púa superficial al revés y fije con una sutura quirúrgica 10-0 en las ranuras de la superficie.
- Resecar la glándula sublingual derecha para formar una fosa para implantar el injerto cardíaco, y reservar el lóbulo derecho de la glándula submaxilar y el esternocleidomastoideo derecho.
- Diseccionar la arteria carótida común derecha durante ~1 cm usando microfórceps, y cortar la arteria con una pinza microvascular atraumática en el extremo proximal. En el extremo distal, ligar y cortar la arteria.
- Pase el extremo distal de la arteria a través de un manguito de púas de poliuretano de 26 G (consulte la Tabla de materiales) con un extremo cónico y ranuras en la superficie. Fije la arteria con el mango del manguito con una pinza microvascular.
- Retire la sutura de ligadura en el extremo distal, gire la luz al revés sobre el manguito y fíjela con una púa superficial y surcos con una sutura quirúrgica 10-0.
- Después de preparar los vasos del receptor, deje caer 100 UI / ml de solución salina de heparina en los vasos para prevenir la trombosis. Cubra la incisión cervical con una gasa salina húmeda estéril para su posterior implantación.
2. Procedimiento del donante
- Emplear el mismo procedimiento anestésico (paso 1.1) para el ratón donante.
- Afeite el vello abdominal con una maquinilla de afeitar eléctrica y desinfecte el área quirúrgica con tres rondas alternas de exfoliante de povidona yodada seguido de alcohol.
- Incise el abdomen (2-3 cm) con una tijera a lo largo de la línea media desde la sínfisis del pubis hasta la subxifoidea, y expanda el área incisa con un retractor.
- Diseccionar 1 cm de la aorta abdominal y la vena cava inferior utilizando un electrocoagulador y un microfórceps, y realizar la heparinización inyectando 1 mL de solución salina fisiológica suplementada con 250 UI/mL de heparina a través de la vena cava inferior. Después de esto, extirpar la aorta abdominal y la vena cava inferior.
- Extirpe el tórax a lo largo de la línea axilar anterior en ambos lados usando una tijera quirúrgica para separar la pared torácica. Ligate la vena cava superior con un 8-0 sutura quirúrgica.
- Inserte una aguja del cuero cabelludo en la vena cava inferior suprahepática. Luego, inyecte solución salina fisiológica helada suplementada con 100 UI / ml de heparina a través de la aguja del cuero cabelludo de la vena cava inferior suprahepática para perfundir el corazón del donante hasta que el color de la sangre se desvanezca.
- Vuelva a perfundir el corazón del donante con 2-3 ml de solución helada de histidina-triptófano-cetoglutarato (HTK) (consulte la Tabla de materiales) utilizando una aguja del cuero cabelludo del arco aórtico para proteger el miocardio del donante. El tiempo medio de isquemia cálida es de 5 min.
- Ligate la vena cava superior e inferior y la vena pulmonar con una sutura quirúrgica 5-0. Diseccionar y cortar la aorta y la arteria pulmonar del donante antes de su ramificación. Después de eso, divida la vena cava superior e inferior y la vena pulmonar para extraer el corazón del donante.
3. Implantación
- Implante el corazón del donante en el bolsillo cervical del ratón receptor en posición invertida.
- Tire del manguito con una vena yugular receptora evertida hacia la luz de la arteria pulmonar del donante para realizar la anastomosis de extremo a extremo de la arteria pulmonar del donante a la vena yugular externa receptora. Ligate el manguito usando los surcos en la superficie a través de una sutura quirúrgica 10-0 para corregir la anastomosis.
- Emplear un procedimiento similar para la anastomosis de extremo a extremo de la aorta del donante a la arteria carótida receptora.
- Libere la pinza microvascular atraumática de la vena yugular seguida de la arteria carótida para volver a perfundir el corazón del donante. El tiempo medio de isquemia fría es de 15 min.
- Fije el injerto cardíaco y suture adecuadamente para evitar la torsión del injerto.
- Cierre la incisión cervical con suturas continuas usando una sutura de monofilamento de poliamida 5-0 (ver Tabla de materiales).
NOTA: Retire la sutura después de que la herida esté completamente curada. - Mantenga al ratón receptor dentro de una jaula tibia, seca y limpia hasta que se recupere de la anestesia.
NOTA: Se tarda 5-10 minutos en recuperarse. - Inyectar buprenorfina (0,05 mg/kg) por vía subcutánea en el ratón receptor cada 6 h durante 48 h para analgesia postoperatoria.
NOTA: La dosis de analgesia fue optimizada para este estudio. Sin embargo, el régimen de analgesia puede extenderse / modificarse si hay algún signo de dolor de acuerdo con las pautas institucionales de uso de animales.
Resultados
En este modelo de trasplante cardíaco heterotópico cervical de ratón, la tasa de supervivencia de los ratones receptores fue de aproximadamente el 95,2% (20 de 21 ratones sobrevivieron). La causa principal de muerte fue el sangrado postoperatorio. El latido cardíaco rápido con un ritmo regular sirve como un indicador de la supervivencia del corazón del donante implantado.
Los ratones C57BL/6 y BALB/c eran tipos MHC (H-2b) y MHC (H-2d) en este modelo, respectivamente 7,8. Estas dos cepas difieren por el H-2, que causa rechazo agudo mediado por células T9. De todos los aloinjertos cardíacos, el 62,5% se perdieron dentro de los 7 días posteriores al trasplante, según lo evaluado mediante la palpación de los latidos del corazón. Todos los aloinjertos cardíacos se perdieron dentro de los 8 días posteriores al trasplante. En contraste, todos los trasplantes cardíacos isogénicos sobrevivieron más allá de 4 semanas (Figura 2). Los ratones que sobrevivieron más de 4 semanas fueron sacrificados por inhalación deCO2.

Figura 1: Esquema del modelo de trasplante cardíaco heterotópico cervical de ratón. (A) Protocolo para preparar al receptor: después de recortar la arteria carótida común y la vena yugular externa en el extremo proximal, la luz vascular de los vasos se everta y se fija después de pasar a través del manguito de púas con un extremo cónico y surcos en la superficie. El cuadrado discontinuo muestra la estructura y el uso del puño. (B) Resección cardíaca del donante: después de la perfusión del corazón del donante con heparina y solución HTK de la vena cava inferior y la aorta, la vena cava superior e inferior y la vena pulmonar se ligan con suturas. Luego, el corazón del donante se reseca mediante la incisión de los vasos vasculares. (C) Implantación del corazón del donante. La arteria pulmonar y la aorta del donante se anastomosan a la vena yugular externa del receptor, y la arteria carótida a través del manguito con la vasculatura del receptor al revés en un patrón de extremo a extremo. Haga clic aquí para ver una versión más grande de esta figura.
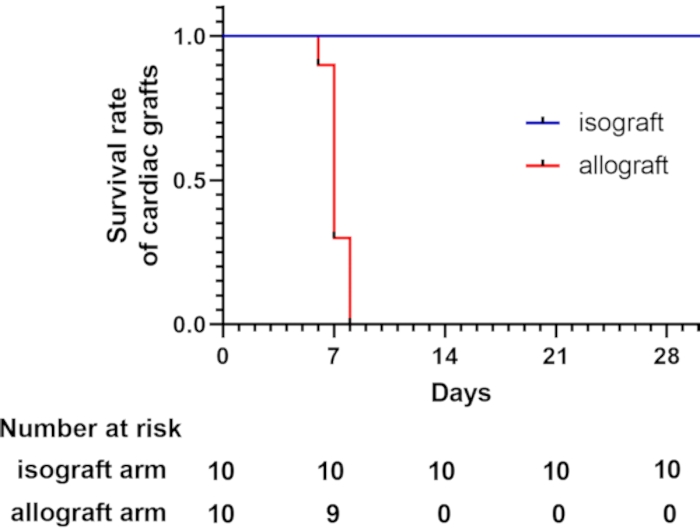
Figura 2: Curva de supervivencia para injertos cardíacos. La curva de supervivencia de los injertos cardíacos muestra que los trasplantes alogénicos de corazón se pierden dentro de los 8 días posteriores al trasplante, lo que se evaluó mediante la palpación de los latidos cardíacos. Un total de 10 ratones receptores se sometieron al trasplante cardíaco heterotópico cervical modificado en cada grupo. Todos los trasplantes de corazón isogénicos sobrevivieron más de 4 semanas. Haga clic aquí para ver una versión más grande de esta figura.
| Rupert Oberhuber et al.10 | Xin Mao et al (trabajo actual) | |||
| Anestesia | xilazina y ketamina | isoflurano (seguro, continuo y estable) | ||
| Lóbulo derecho de la glándula submandibular | eliminación | preservación (reducir el giro de los injertos) | ||
| Esternocleidomastoideo derecho | eliminación | preservación (reducir el giro de los injertos) | ||
| Perfusión cardíaca | Perfusión retrógrada con solución HTK a 4 °C del arco aórtico | 1. Perfusión anterógrada con solución salina fisiológica helada suplementada con 100 UI/ml de solución de heparina de la vena cava suprahepática. 2. Reperfusión retrógrada con solución HTK helada del arco aórtico. (Reducir la coagulación y aumentar la protección miocárdica) | ||
| Puño | extremo romo, con asa | extremo cónico, con asa, púa y ranuras en la superficie (Facilitar la eversión y fijación) | ||
Tabla 1: Comparación de técnicas de trasplante cardíaco. La técnica actual de trasplante cardíaco heterotópico cervical de ratón está modificada de Oberhuber, R. et al.10 y posee ventajas adicionales para la supervivencia del injerto cardíaco.
Discusión
El modelo de trasplante de corazón de ratón contribuye a la investigación de los mecanismos de rechazo después del trasplante de corazón, contribuyendo al desarrollo de enfoques únicos para mejorar la supervivencia a largo plazo de los receptores de aloinjertos cardíacos. Sin embargo, el trasplante cardíaco en ratones es una tarea compleja y desafiante, que requiere un alto nivel de técnicas de microcirugía, especialmente en anastomosis vascular11,12,13. El modelo de trasplante cardíaco heterotópico abdominal de ratón se realiza mediante puntos de sutura por anastomosis de la aorta del donante y la arteria pulmonar a la aorta receptora y la vena cava inferior. La aorta y la vena cava inferior del receptor deben bloquearse en esta operación. Por lo tanto, la isquemia de la parte inferior del cuerpo y la trombosis de la vena cava inferior pueden aumentar la discapacidad y la muerte de los ratones receptores. Para reducir las dificultades de la anastomosis vascular durante el trasplante, Matsuura et al. introdujeron por primera vez un modelo de trasplante cardíaco cervical en ratones utilizando la técnica del manguito en 199114. En este modelo, la anastomosis evertida en forma de manga superior de los vasos por ligadura con manguito aumentó la eficiencia de la anastomosis. En contraste con la anastomosis de vasos con suturas en un modelo de ratón de trasplante de corazón abdominal, redujo la probabilidad de sangrado después del procedimiento. Por lo tanto, la mejora de la eficiencia de la anastomosis redujo el tiempo de isquemia del músculo cardíaco y aumentó la tasa de supervivencia de los injertos cardíacos. Además, la implantación cervical del corazón del donante no interrumpe la circulación de la aorta receptora y de la vena cava inferior en comparación con la implantación abdominal15; Por lo tanto, la supervivencia de los ratones receptores aumenta.
Aquí se describe un modelo experimental único de trasplante cardíaco heterotópico de ratón, establecido por Rupert Oberhuber et al.10. El procedimiento implica una anastomosis cervical de extremo a extremo de la aorta del donante y la arteria pulmonar a la arteria carótida receptora y la vena yugular, siguiendo una técnica de manguito modificada. En este modelo, la circulación sistémica de los ratones receptores no interfiere con10, y el corazón del donante se perfundió desde la vena cava inferior y la aorta con soluciones de heparina y HTK para una mejor protección miocárdica. Sin embargo, el componente crítico de este modelo difería del de Oberhuber et al.10, que empleaban el manguito de púas modificado con un extremo cónico y ranuras similares a las de Finsterer et al.16. El extremo cónico facilita una vertiente similar a una manga de la luz vascular. Las ranuras en la superficie facilitan la fijación de las paredes de los vasos evertidos con un manguito usando suturas, y la púa fuera del manguito reduce el deslizamiento de las paredes de los vasos anastomosados del manguito (Figura 1). Estas modificaciones acortan el tiempo quirúrgico en un 20% y mejoran la eficiencia y supervivencia de implantación de los injertos cardíacos. Además, el manguito de púas modificado se produce a partir del catéter de poliuretano más común utilizado para la acupuntura del cuero cabelludo, lo que reduce significativamente el costo del procedimiento. En la Tabla 1 se muestra una comparación de la técnica actual con la de Oberhuber et al.10.
Es necesario tener en cuenta las características únicas de este modelo. En primer lugar, la longitud y el calibre del manguito son esenciales para una anastomosis exitosa. La longitud adecuada del manguito fue de ~3 mm con un mango (1 mm) (Figura 1). El calibre adecuado del manguito es de 26 G y 22 G para arterias y venas, respectivamente. La longitud y el calibre inadecuados del manguito darían lugar a una torsión o tensión excesiva de los vasos anastomosados. En segundo lugar, las longitudes adecuadas de los vasos del receptor son de 1,5 a 2 pliegues del manguito. En tercer lugar, el corazón del donante no se perfunde con una presión excesiva, lo que puede dañar el injerto. En cuarto lugar, el injerto cardíaco es fijo, y el manguito se anastomosa en una posición adecuada mediante sutura después de la implantación para evitar el movimiento o la torsión de los vasos anastomosados o injertos. En quinto lugar, la preservación de la glándula submaxilar y la esternocleidomastoidea contribuye a reducir el giro o la torsión de los vasos anastomosados o el injerto al resecar la glándula sublingual derecha para producir una fosa para el injerto cardíaco. En sexto lugar, para facilitar el evert en forma de manga de la luz vascular y reducir la trombosis después de la cirugía, se puede proporcionar una solución de heparina (100 UI / ml) a los vasos anastomosados mientras se realiza la anastomosis.
Esta técnica del manguito facilita la anastomosis de los vasos donantes y receptores durante la implantación; Sin embargo, la dureza del manguito puede, a su vez, aumentar el riesgo de torcer los vasos anastomosados, lo que resulta en un aumento de la trombosis después del trasplante. La optimización del material del manguito está garantizada para reducir las complicaciones, aumentar la supervivencia del injerto y aumentar la tasa de utilización de los modelos en experimentos posteriores. Además, la cicatriz fibrosa del corte puede limitar el espacio para el injerto cardíaco y afectar su supervivencia a largo plazo. Además, la eyección del injerto cardíaco puede interferir con el flujo sanguíneo hemodinámico normal de los ratones receptores. Finalmente, este modelo no es funcional y no se puede utilizar para evaluar la función cardíaca de los injertos. Sin embargo, este estudio proporciona conocimiento sobre las funciones inmunológicas y patológicas del trasplante cardíaco.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Fundación Nacional de Ciencias Naturales de China (81870304) a Jun Li.
Materiales
| Name | Company | Catalog Number | Comments |
| 5-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C3090954 | |
| 8-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C2090880 | |
| 10-0 Polyamide Monofilament suture | B.Braun Medical Inc. | G0090781 | |
| 22 G polyurethane cuff | B.Braun Medical Inc. | 4251628-02 | |
| 26 G polyurethane cuff | Suzhou Linhua Medical Instrument Co., LTD | REF383713 | |
| Anesthesia induction chamber | RWD Life Science Co., LTD | V100 | |
| Atraumatic microvascular clamp | Beyotime | FS500 | |
| BALB/c and C57BL/6 mice (20–30 g) | Centre of Experimental Animals (Army Medical University, Chongqing, China) | ||
| Buprenorphine | US Biological life Sciences | 352004 | |
| Electrocoagulator | Guangzhou Runman Medical Instrument Co., LTD | ZJ1099 | |
| Gauze | Henan piaoan group Co., LTD | 10210402 | |
| Heating pad | Guangzhou Dewei Biological Technology Co., LTD | DK0032 | |
| Heparin | North China Pharmaceutical Co., LTD | 2101131-2 | |
| HTK solution | Shenzhen Changyi Pharmaceutical Co., LTD | YZB/Min8263-2013 | |
| Injection syringe (10 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | |
| Isoflurane | RWD Life Science Co., LTD | 21070201 | |
| Physiological saline | Southwest pharmaceutical Co., LTD | H50021610 | |
| Scalp needle | Hongyu Medical Group | 20183150210 | |
| Shaver | Beyotime | FS600 | |
| Small animal anesthesia machine | RWD Life Science Co., LTD | R500 | |
| Surgical operation microscope | Tiannuoxiang Scientific Instrument Co. , Ltd, Beijing, China | SZX-6745 | |
| Swab | Yubei Medical Materials Co., LTD | 21080274 |
Referencias
- Khush, K. K., et al. The International thoracic organ transplant registry of the international society for heart and lung transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. The Journal of Heart and Lung Transplantation. 38 (10), 1056-1066 (2019).
- Stehlik, J., et al. The registry of the international society for heart and lung transplantation: 29th official adult heart transplant report--2012. The Journal of Heart and Lung Transplantation. 31 (10), 1052-1064 (2012).
- Huang, H., et al. Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression. Journal of Surgical Research. 185 (2), 896-903 (2013).
- Eggenhofer, E., et al. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transplant Immunology. 25 (2-3), 141-147 (2011).
- Sula Karreci, E., et al. Brief treatment with a highly selective immunoproteasome inhibitor promotes long-term cardiac allograft acceptance in mice. Proceedings of the National Academy of Sciences of the United States of America. 113 (52), 8425-8432 (2016).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. 6, 238(2007).
- Lin, C. M., Gill, R. G., Mehrad, B. The natural killer cell activating receptor, NKG2D, is critical to antibody-dependent chronic rejection in heart transplantation. American Journal of Transplantation. 21 (11), 3550-3560 (2021).
- Ito, H., Hamano, K., Fukumoto, T., Wood, K. J., Esato, K. Bidirectional blockade of CD4 and major histocompatibility complex class II molecules: An effective immunosuppressive treatment in the mouse heart transplantation model. The Journal of Heart and Lung Transplantation. 17 (5), 460-469 (1998).
- Zhou, Y. X., et al. Acute rejection correlates with expression of major histocompatibility complex class I antigens on peripheral blood CD3(+)CD8(+) T-lymphocytes following skin transplantation in mice. Journal of International Medical Research. 39 (2), 480-487 (2011).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. Journal of Visualized Experiments. (92), e50753(2014).
- Cui, D., Tan, C., Liu, Z. An alternative technique of arterial anastomosis in mouse heart transplantation. Clinical Transplantation. 32 (6), 13264(2018).
- Plenter, R. J., Zamora, M. R., Grazia, T. J. Four decades of vascularized heterotopic cardiac transplantation in the mouse. Journal of Investigative Surgery. 26 (4), 223-228 (2013).
- Fang, J., et al. A simplified two-stitch sleeve technique for arterial anastomosis of cervical heterotopic cardiac transplantation in mice. American Journal of Translational Research. 5 (5), 521-529 (2013).
- Matsuura, A., Abe, T., Yasuura, K. Simplified mouse cervical heart transplantation using a cuff technique. Transplantation. 51 (4), 896-898 (1991).
- Corry, R. J., Winn, H. J., Russell, P. S. Primarily vascularized allografts of hearts in mice. The role of H-2D, H-2K, and non-H-2 antigens in rejection. Transplantation. 16 (4), 343-350 (1973).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), 293-299 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados