Method Article
Una tecnica di bracciale modificata per il modello di trapianto di cuore eterotopico cervicale del topo
In questo articolo
Riepilogo
Nel presente protocollo, un modello di trapianto di cuore di topo viene utilizzato per studiare il meccanismo di rigetto dell'allotrapianto cardiaco. In questo modello di trapianto di cuore eterotopico, l'efficienza operativa è migliorata e la sopravvivenza degli innesti cardiaci è assicurata da un'anastomosi cervicale end-to-end dell'impianto cardiaco utilizzando una tecnica di bracciale modificata.
Abstract
Il rigetto dell'allotrapianto cardiaco limita la sopravvivenza a lungo termine dei pazienti dopo il trapianto di cuore. Un modello di trapianto di cuore di topo è ideale per studiare il meccanismo di rigetto cardiaco dell'allotrapianto negli studi preclinici a causa della loro elevata omologia con i geni umani. Questa comprensione aiuterebbe a sviluppare approcci unici per migliorare la sopravvivenza a lungo termine dei pazienti trattati con allotrapianti cardiaci. In un modello murino, l'impianto di cuore da donatore addominale viene comunemente eseguito con un'anastomosi end-to-end all'aorta del ricevente e alla vena cava inferiore utilizzando punti. In questo modello, il cuore del donatore viene impiantato mediante anastomosi end-to-end all'arteria carotide e alla vena giugulare del ricevente mediante la tecnica del bracciale modificato. L'intervento chirurgico di trapianto viene eseguito senza cuciture e quindi può aumentare la sopravvivenza del ricevente poiché non vi è alcuna interferenza con l'afflusso di sangue e il reflusso venoso della parte inferiore del corpo. Questo modello murino aiuterebbe a studiare i meccanismi alla base del rigetto immunologico e patologico (acuto/cronico) degli allotrapianti cardiaci.
Introduzione
Il trapianto di cuore è diventato il trattamento standard per l'insufficienza cardiaca terminale. Più di 5.500 trapianti di cuore all'anno vengono eseguiti nelle organizzazioni registrate sotto la Società internazionale per il trapianto di cuore e polmone. Tra i pazienti sottoposti a trapianto di cuore allogenico, il tasso di rigetto a 1 anno è ancora del >10%, mentre il tasso di rigetto a 3 anni è aumentato al 36%1,2. Tuttavia, mancano trattamenti profilattici efficaci per i pazienti con rigetto cardiaco dell'allotrapianto. Pertanto, sono necessari studi su modelli animali che chiariscano i meccanismi fisiologici alla base del rigetto immunologico e patologico degli allotrapianti cardiaci. Tali studi contribuirebbero allo studio di nuovi bersagli necessari per sviluppare farmaci efficaci, che contribuirebbero a prevenire il rigetto cardiaco dell'allotrapianto e a migliorare i tassi di sopravvivenza in quelle popolazioni di pazienti.
Alcuni potenziali meccanismi immunologici e fisiopatologici di rigetto cardiaco allogenico sono stati recentemente proposti in studi su modelli murini di trapianto di cuore eterotopico 3,4,5. Di conseguenza, il trapianto di cuore eterotopico di topo è diventato un modello preclinico ideale per studiare i meccanismi di rigetto immunitario e danno patologico che si verificano negli allotrapianti cardiaci dopo trapianto di cuore a causa della loro elevata omologia con i geni umani. Il concetto prevalente è quello di eseguire il trapianto eterotopico in un modello murino mediante anastomosi addominale end-to-end nell'aorta ricevente e nella vena cava inferiore utilizzando punti, simili alla normale anatomia umana. Tuttavia, questa procedura può interferire con l'afflusso di sangue del ricevente e il reflusso venoso della parte inferiore del corpo6. Pertanto, qui viene proposta una procedura di trapianto di cuore eterotopico modificata in un modello murino.
Il cuore del donatore viene impiantato con l'arteria carotide e la vena giugulare del ricevente mediante un'anastomosi cervicale end-to-end utilizzando una tecnica di bracciale modificata. Questa procedura modificata ha facilitato la fattibilità operativa e ha assicurato la sopravvivenza dell'innesto cardiaco senza interferire con l'afflusso di sangue e il reflusso venoso della parte inferiore del corpo.
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con la Guida per la cura e l'uso degli animali da laboratorio, ottava edizione, National Research Council (US) 2011. Le procedure che coinvolgono soggetti animali sono state approvate dal Comitato per la cura e l'uso degli animali del Chongqing University Cancer Hospital, Chongqing, Cina. Topi maschi BALB/c e C57BL/6 del peso di 20-30 g, ottenuti da fonti commerciali (vedi Tabella dei materiali), sono stati utilizzati per lo studio del trapianto di cuore allogenico. I topi C57BL/6 sono stati utilizzati come donatori e riceventi singeneici, mentre i topi BALB/c sono serviti come riceventi allogenici. Uno schema del protocollo è mostrato nella Figura 1.
NOTA: Tutte le forniture utilizzate durante l'intervento chirurgico, compresi gli strumenti e le soluzioni chirurgiche, sono sterili. La procedura chirurgica aderisce al principio della tecnica di operazione asettica.
1. Procedura del destinatario
- Indurre l'anestesia generale mediante inalazione di isoflurano al 5% attraverso una camera di induzione di 15 x 10 x 10 cm collegata con una cappa (vedere Tabella dei materiali).
- Fissare il mouse ricevente sul tavolo operatorio con una piastra riscaldante. Mantenere l'anestesia con inalazione continua di isoflurano al 2% attraverso una maschera facciale sul naso e sulla bocca.
NOTA: La frequenza respiratoria e il ritmo rallentati, la scomparsa del riflesso corneale e l'assenza del riflesso del pedale nelle dita dei piedi indicano l'efficacia dell'anestesia. - Dopo aver rasato i capelli, disinfettare la zona chirurgica con tre cicli alternati di scrub povidone-iodio seguiti da alcool. Quindi, incidere la pelle 1,5-2 cm parallelamente alla linea mediana cervicale dall'angolo mandibolare destro all'estremità della coda.
- Sezionare ~ 1 cm della vena giugulare esterna destra usando un elettrocoagulatore e microforze. Tagliare la vena all'estremità prossimale con un morsetto microvascolare atraumatico e ligarla all'estremità distale.
- Far passare l'estremità distale della vena attraverso un bracciale in poliuretano spinato da 22 G (vedi Tabella dei materiali) con un'estremità smussata e scanalature superficiali. Fissare la vena con il manico del bracciale usando un morsetto microvascolare.
- Rimuovere l'8-0 sutura di legatura all'estremità distale, girare il lume sopra il bracciale agganciato dalla sbavatura superficiale al rovescio e fissare con una sutura chirurgica 10-0 nelle scanalature della superficie.
- Resecare la ghiandola sublinguale destra per formare una fossa per l'impianto dell'innesto cardiaco e riservare il lobo destro della ghiandola sottomascellare e lo sternocleidomastoide destro.
- Sezionare l'arteria carotide comune destra per ~ 1 cm usando una pinza micro-pinza e tagliare l'arteria con un morsetto microvascolare atraumatico all'estremità prossimale. All'estremità distale, ligate e tagliano l'arteria.
- Far passare l'estremità distale dell'arteria attraverso un bracciale spinato in poliuretano da 26 G (vedi Tabella dei materiali) con un'estremità smussata e scanalature sulla superficie. Fissare l'arteria con il manico del bracciale utilizzando un morsetto microvascolare.
- Rimuovere la sutura di legatura all'estremità distale, capovolgere il lume sopra il bracciale e fissare con una sbavatura superficiale e solchi con una sutura chirurgica 10-0.
- Dopo aver preparato i vasi del ricevente, far cadere 100 UI / ml di soluzione salina di eparina sui vasi per prevenire la trombosi. Coprire l'incisione cervicale con una garza salina bagnata sterile per il successivo impianto.
2. Procedura del donatore
- Utilizzare la stessa procedura anestetica (fase 1.1) per il topo donatore.
- Rasare i peli addominali con un rasoio elettrico e disinfettare l'area chirurgica con tre cicli alternati di scrub povidone-iodio seguiti da alcool.
- Incidi l'addome (2-3 cm) con una forbice lungo la linea mediana dalla sinfisi pubica al subxifoide ed espandi l'area incisa con un divaricatore.
- Sezionare 1 cm dell'aorta addominale e della vena cava inferiore utilizzando un elettrocoagulatore e una pinza micro-forze, ed eseguire l'eparinizzazione iniettando 1 mL di soluzione fisiologica integrata con 250 UI/mL di eparina attraverso la vena cava inferiore. Dopo questo, asportare l'aorta addominale e la vena cava inferiore.
- Eliminare il torace lungo la linea ascellare anteriore su entrambi i lati usando una forbice chirurgica per separare la parete toracica. Ligate la vena cava superiore con un 8-0 sutura chirurgica.
- Inserire un ago del cuoio capelluto nella vena cava inferiore sopraepatica. Quindi, iniettare soluzione fisiologica ghiacciata integrata con 100 UI / ml di eparina attraverso l'ago del cuoio capelluto dalla vena cava inferiore sopraepatica per perfondere il cuore del donatore fino a quando il colore del sangue svanisce.
- Ri-perfondere il cuore del donatore con 2-3 ml di soluzione ghiacciata di istidina-triptofano-chetoglutarato (HTK) (vedere Tabella dei materiali) utilizzando un ago del cuoio capelluto dall'arco aortico per proteggere il miocardio del donatore. Il tempo medio di ischemia calda è di 5 min.
- Ligare la vena cava superiore e inferiore e la vena polmonare con una sutura chirurgica 5-0. Sezionare e tagliare l'aorta del donatore e l'arteria polmonare prima della loro ramificazione. Successivamente, dividere la vena cava superiore e inferiore e la vena polmonare per rimuovere il cuore del donatore.
3. Impianto
- Impiantare il cuore del donatore nella tasca cervicale del topo ricevente in posizione invertita.
- Tirare il bracciale con una vena giugulare ricevente estroflessa nel lume dell'arteria polmonare del donatore per eseguire l'anastomosi end-to-end dell'arteria polmonare del donatore alla vena giugulare esterna ricevente. Azionare il bracciale utilizzando le scanalature sulla superficie attraverso una sutura chirurgica 10-0 per fissare l'anastomosi.
- Utilizzare una procedura simile per l'anastomosi end-to-end dell'aorta del donatore all'arteria carotide ricevente.
- Rilasciare il morsetto microvascolare atraumatico della vena giugulare seguito dall'arteria carotide per ri-perfondere il cuore del donatore. Il tempo medio di ischemia fredda è di 15 minuti.
- Fissare l'innesto cardiaco e suturarlo correttamente per evitare la torsione dell'innesto.
- Chiudere l'incisione cervicale con suture continue utilizzando una sutura monofilamento in poliammide 5-0 (vedi Tabella dei materiali).
NOTA: Rimuovere la sutura dopo che la ferita è completamente guarita. - Conservare il topo ricevente all'interno di una gabbia calda, asciutta e pulita fino a quando non si riprende dall'anestesia.
NOTA: Ci vogliono 5-10 minuti per recuperare. - Iniettare buprenorfina (0,05 mg/kg) per via sottocutanea nel topo ricevente ogni 6 ore per 48 ore per l'analgesia postoperatoria.
NOTA: Il dosaggio di analgesia è stato ottimizzato per questo studio. Tuttavia, il regime di analgesia può essere esteso / modificato se c'è qualche segno di dolore in conformità con le linee guida istituzionali sull'uso degli animali.
Risultati
In questo modello di trapianto di cuore eterotopico cervicale di topo, il tasso di sopravvivenza dei topi riceventi era di circa il 95,2% (20 topi su 21 sono sopravvissuti). La causa primaria di morte era il sanguinamento postoperatorio. Il battito cardiaco accelerato con un ritmo regolare serve come indicatore della sopravvivenza del cuore del donatore impiantato.
I topi C57BL/6 e BALB/c erano di tipo MHC (H-2b) e MHC (H-2d) in questo modello, rispettivamente 7,8. Questi due ceppi differiscono per l'H-2, che causa il rigetto acuto mediato dalle cellule T9. Di tutti gli allotrapianti cardiaci, il 62,5% è stato perso entro 7 giorni dal trapianto, come valutato palpando il battito cardiaco. Tutti gli allotrapianti cardiaci sono stati persi entro 8 giorni dal trapianto. Al contrario, tutti i trapianti di cuore isogeneici sono sopravvissuti oltre le 4 settimane (Figura 2). I topi sopravvissuti oltre le 4 settimane sono stati eutanizzati per inalazione di CO2.

Figura 1: Schema del modello di trapianto di cuore eterotopico cervicale murino. (A) Protocollo per la preparazione del ricevente: dopo aver tagliato l'arteria carotide comune e la vena giugulare esterna all'estremità prossimale, il lume vascolare dei vasi viene estroflesso e fissato dopo aver attraversato il bracciale spinato con un'estremità smussata e solchi sulla superficie. Il quadrato tratteggiato mostra la struttura e l'uso del bracciale. (B) Resezione cardiaca del donatore: dopo la perfusione del cuore del donatore con eparina e soluzione HTK dalla vena cava inferiore e dall'aorta, la vena cava superiore e inferiore e la vena polmonare vengono legate con punti di sutura. Il cuore del donatore viene quindi resecato incidendo i vasi vascolari. (C) Impianto del cuore del donatore. L'arteria polmonare e l'aorta del donatore vengono anastomosi alla vena giugulare esterna del ricevente e all'arteria carotide attraverso il bracciale con la vascolarizzazione del ricevente capovolta in uno schema end-to-end. Fare clic qui per visualizzare una versione ingrandita di questa figura.
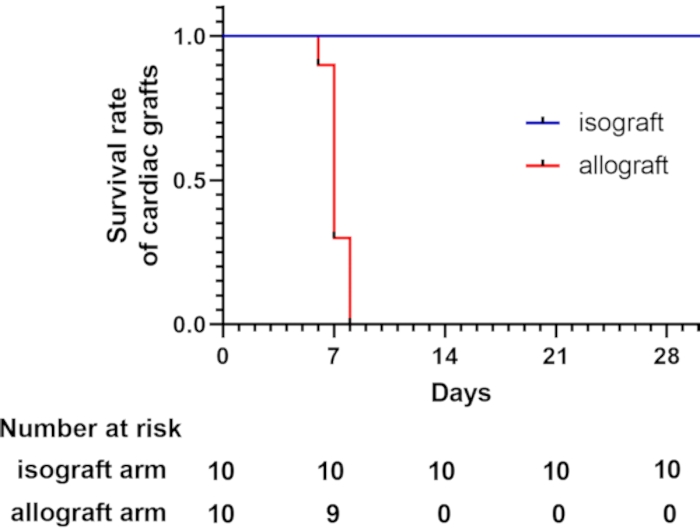
Figura 2: Curva di sopravvivenza per gli innesti cardiaci. La curva di sopravvivenza degli innesti cardiaci mostra che i trapianti di cuore allogenici vengono persi entro 8 giorni dal trapianto, che è stato valutato mediante palpazione del battito cardiaco. Un totale di 10 topi riceventi sono stati sottoposti al trapianto di cuore eterotopico cervicale modificato in ciascun gruppo. Tutti i trapianti di cuore isogeneico sono sopravvissuti più di 4 settimane. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Rupert Oberhuber et al.10 | Xin Mao et al (lavoro attuale) | |||
| Anestesia | xilazina e ketamina | isoflurano (sicuro, continuo e stabile) | ||
| Lobo destro della ghiandola sottomandibolare | allontanamento | conservazione (Ridurre il roteare degli innesti) | ||
| Sternocleidomastoide destro | allontanamento | conservazione (Ridurre il roteare degli innesti) | ||
| Perfusione cardiaca | Perfusione retrograda con soluzione HTK a 4 °C dall'arco aortico | 1. Perfusione anterograda con soluzione fisiologica ghiacciata integrata con soluzione di eparina 100 UI/mL dalla vena cava sopraepatica. 2. Riperfusione retrograda con soluzione HTK ghiacciata dall'arco aortico. (Ridurre la coagulazione e aumentare la protezione miocardica) | ||
| Polsino | estremità smussata, con maniglia | estremità smussata, con maniglia, sbavatura e scanalature sulla superficie (facilitare l'eversione e il fissaggio) | ||
Tabella 1: Confronto delle tecniche di trapianto di cuore. L'attuale tecnica di trapianto di cuore eterotopico cervicale del topo è modificata da Oberhuber, R. et al.10 e possiede ulteriori vantaggi per la sopravvivenza del trapianto cardiaco.
Discussione
Il modello di trapianto di cuore di topo contribuisce allo studio dei meccanismi di rigetto dopo il trapianto di cuore, contribuendo allo sviluppo di approcci unici per migliorare la sopravvivenza a lungo termine dei riceventi di allotrapianti cardiaci. Tuttavia, il trapianto di cuore nei topi è un compito complesso e impegnativo, che richiede un alto livello di tecniche di microchirurgia, specialmente nell'anastomosi vascolare11,12,13. Il modello di trapianto di cuore eterotopico addominale del topo viene eseguito utilizzando punti di sutura mediante anastomosi dell'aorta donatrice e dell'arteria polmonare all'aorta ricevente e alla vena cava inferiore. L'aorta del ricevente e la vena cava inferiore devono essere bloccate in questa operazione. Pertanto, l'ischemia della parte inferiore del corpo e la trombosi della vena cava inferiore possono aumentare la disabilità e la morte dei topi riceventi. Per ridurre le difficoltà dell'anastomosi vascolare durante il trapianto, Matsuura et al. hanno introdotto per la prima volta un modello di trapianto di cuore cervicale nei topi utilizzando la tecnica del bracciale nel 199114. In questo modello, l'anastomosi estroflessa dei vasi mediante legatura con bracciale ha aumentato l'efficienza dell'anastomosi. In contrasto con l'anastomosi dei vasi con punti di sutura in un modello murino di trapianto di cuore addominale, ha ridotto la probabilità di sanguinamento post-procedura. Pertanto, il miglioramento dell'efficienza dell'anastomosi ha ridotto il tempo di ischemia del muscolo cardiaco e aumentato il tasso di sopravvivenza degli innesti cardiaci. Inoltre, l'impianto cervicale del cuore del donatore non interrompe la circolazione dell'aorta ricevente e della vena cava inferiore rispetto all'impianto addominale15; Pertanto, la sopravvivenza dei topi riceventi è aumentata.
Un modello sperimentale unico di trapianto di cuore eterotopico di topo è descritto qui, stabilito da Rupert Oberhuber et al.10. La procedura prevede un'anastomosi cervicale end-to-end dell'aorta donatrice e dell'arteria polmonare all'arteria carotide ricevente e alla vena giugulare, seguendo una tecnica di bracciale modificata. In questo modello, la circolazione sistemica dei topi riceventi non interferisce con10 e il cuore del donatore è stato perfuso dalla vena cava inferiore e dall'aorta con soluzioni di eparina e HTK per una migliore protezione miocardica. Tuttavia, la componente critica di questo modello differiva da quella di Oberhuber et al.10, che impiegava il bracciale spinato modificato con un'estremità smussata e scanalature simili a quelle di Finsterer et al.16. L'estremità smussata facilita un oversleeve-like evert del lume vascolare. Le scanalature sulla superficie facilitano il fissaggio delle pareti del vaso estroflesso con un bracciale usando punti di sutura, e la punta esterna al bracciale riduce lo slittamento delle pareti anastomiche del vaso dal bracciale (Figura 1). Queste modifiche riducono i tempi chirurgici del 20% e migliorano l'efficienza e la sopravvivenza dell'impianto degli innesti cardiaci. Inoltre, il bracciale modificato viene prodotto dal più comune catetere in poliuretano utilizzato per l'agopuntura del cuoio capelluto, riducendo così significativamente il costo della procedura. Un confronto della tecnica attuale con quella di Oberhuber et al.10 è mostrato nella Tabella 1.
Le caratteristiche uniche di questo modello devono essere notate. Innanzitutto, la lunghezza e il calibro del bracciale sono essenziali per un'anastomosi di successo. La lunghezza adatta del bracciale era ~ 3 mm con un manico (1 mm) (Figura 1). Il calibro adatto del bracciale è di 26 G e 22 G rispettivamente per arteria e vene. La lunghezza e il calibro inadeguati del bracciale comporterebbero torsioni o eccessiva tensione dei vasi anastomizzati. In secondo luogo, le lunghezze adatte delle navi del destinatario sono da 1,5 a 2 pieghe del bracciale. In terzo luogo, il cuore del donatore non è perfuso con una pressione eccessiva, potenzialmente danneggiando l'innesto. In quarto luogo, l'innesto cardiaco è fisso e il bracciale viene anastomoso in una posizione adatta suturando dopo l'impianto per evitare il movimento o la torsione di vasi o innesti anastomizzati. In quinto luogo, la conservazione della ghiandola sottomascellare e dello sternocleidomastoide contribuisce a ridurre il vortice o la torsione dei vasi anastomosi o dell'innesto quando si reseca la ghiandola sublinguale destra per produrre una fossa per l'innesto cardiaco. Sesto, per facilitare l'estro del lume vascolare e ridurre la trombosi dopo l'intervento chirurgico, la soluzione di eparina (100 UI / ml) può essere fornita ai vasi anastomosi durante l'esecuzione dell'anastomosi.
Questa tecnica del bracciale facilita l'anastomosi dei vasi donatori e riceventi durante l'impianto; Tuttavia, la durezza del bracciale può, a sua volta, aumentare il rischio di torcere i vasi anastomizzati, con conseguente aumento della trombosi dopo il trapianto. L'ottimizzazione del materiale del bracciale è garantita per ridurre le complicanze, aumentare la sopravvivenza dell'innesto e aumentare il tasso di utilizzo dei modelli negli esperimenti successivi. Inoltre, la cicatrice fibrosa del taglio può limitare lo spazio per l'innesto cardiaco e influenzare la sua sopravvivenza a lungo termine. Inoltre, l'espulsione dell'innesto cardiaco può interferire con il normale flusso sanguigno emodinamico dei topi riceventi. Infine, questo modello non è funzionale e non può essere utilizzato per valutare la funzione cardiaca degli innesti. Tuttavia, questo studio fornisce conoscenze sulle funzioni immunologiche e patologiche del trapianto di cuore.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto dalla National Natural Science Foundation of China (81870304) a Jun Li.
Materiali
| Name | Company | Catalog Number | Comments |
| 5-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C3090954 | |
| 8-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C2090880 | |
| 10-0 Polyamide Monofilament suture | B.Braun Medical Inc. | G0090781 | |
| 22 G polyurethane cuff | B.Braun Medical Inc. | 4251628-02 | |
| 26 G polyurethane cuff | Suzhou Linhua Medical Instrument Co., LTD | REF383713 | |
| Anesthesia induction chamber | RWD Life Science Co., LTD | V100 | |
| Atraumatic microvascular clamp | Beyotime | FS500 | |
| BALB/c and C57BL/6 mice (20–30 g) | Centre of Experimental Animals (Army Medical University, Chongqing, China) | ||
| Buprenorphine | US Biological life Sciences | 352004 | |
| Electrocoagulator | Guangzhou Runman Medical Instrument Co., LTD | ZJ1099 | |
| Gauze | Henan piaoan group Co., LTD | 10210402 | |
| Heating pad | Guangzhou Dewei Biological Technology Co., LTD | DK0032 | |
| Heparin | North China Pharmaceutical Co., LTD | 2101131-2 | |
| HTK solution | Shenzhen Changyi Pharmaceutical Co., LTD | YZB/Min8263-2013 | |
| Injection syringe (10 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | |
| Isoflurane | RWD Life Science Co., LTD | 21070201 | |
| Physiological saline | Southwest pharmaceutical Co., LTD | H50021610 | |
| Scalp needle | Hongyu Medical Group | 20183150210 | |
| Shaver | Beyotime | FS600 | |
| Small animal anesthesia machine | RWD Life Science Co., LTD | R500 | |
| Surgical operation microscope | Tiannuoxiang Scientific Instrument Co. , Ltd, Beijing, China | SZX-6745 | |
| Swab | Yubei Medical Materials Co., LTD | 21080274 |
Riferimenti
- Khush, K. K., et al. The International thoracic organ transplant registry of the international society for heart and lung transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. The Journal of Heart and Lung Transplantation. 38 (10), 1056-1066 (2019).
- Stehlik, J., et al. The registry of the international society for heart and lung transplantation: 29th official adult heart transplant report--2012. The Journal of Heart and Lung Transplantation. 31 (10), 1052-1064 (2012).
- Huang, H., et al. Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression. Journal of Surgical Research. 185 (2), 896-903 (2013).
- Eggenhofer, E., et al. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transplant Immunology. 25 (2-3), 141-147 (2011).
- Sula Karreci, E., et al. Brief treatment with a highly selective immunoproteasome inhibitor promotes long-term cardiac allograft acceptance in mice. Proceedings of the National Academy of Sciences of the United States of America. 113 (52), 8425-8432 (2016).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. 6, 238 (2007).
- Lin, C. M., Gill, R. G., Mehrad, B. The natural killer cell activating receptor, NKG2D, is critical to antibody-dependent chronic rejection in heart transplantation. American Journal of Transplantation. 21 (11), 3550-3560 (2021).
- Ito, H., Hamano, K., Fukumoto, T., Wood, K. J., Esato, K. Bidirectional blockade of CD4 and major histocompatibility complex class II molecules: An effective immunosuppressive treatment in the mouse heart transplantation model. The Journal of Heart and Lung Transplantation. 17 (5), 460-469 (1998).
- Zhou, Y. X., et al. Acute rejection correlates with expression of major histocompatibility complex class I antigens on peripheral blood CD3(+)CD8(+) T-lymphocytes following skin transplantation in mice. Journal of International Medical Research. 39 (2), 480-487 (2011).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. Journal of Visualized Experiments. (92), e50753 (2014).
- Cui, D., Tan, C., Liu, Z. An alternative technique of arterial anastomosis in mouse heart transplantation. Clinical Transplantation. 32 (6), 13264 (2018).
- Plenter, R. J., Zamora, M. R., Grazia, T. J. Four decades of vascularized heterotopic cardiac transplantation in the mouse. Journal of Investigative Surgery. 26 (4), 223-228 (2013).
- Fang, J., et al. A simplified two-stitch sleeve technique for arterial anastomosis of cervical heterotopic cardiac transplantation in mice. American Journal of Translational Research. 5 (5), 521-529 (2013).
- Matsuura, A., Abe, T., Yasuura, K. Simplified mouse cervical heart transplantation using a cuff technique. Transplantation. 51 (4), 896-898 (1991).
- Corry, R. J., Winn, H. J., Russell, P. S. Primarily vascularized allografts of hearts in mice. The role of H-2D, H-2K, and non-H-2 antigens in rejection. Transplantation. 16 (4), 343-350 (1973).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), 293-299 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon