Method Article
一种改进的袖带技术用于小鼠颈椎异位心脏移植模型
摘要
在本协议中,使用小鼠心脏移植模型来研究心脏同种异体移植排斥的机制。在这种异位心脏移植模型中,提高了手术效率,并使用改进的袖带技术对心脏植入的颈椎端到端吻合确保了心脏移植物的存活。
摘要
心脏同种异体移植排斥反应限制了心脏移植后患者的长期生存。小鼠心脏移植模型是临床前研究中研究心脏同种异体移植排斥反应机制的理想选择,因为它们与人类基因具有高度同源性。这种理解将有助于开发独特的方法来改善用心脏同种异体移植物治疗的患者的长期生存率。在小鼠模型中,腹部供体心脏植入通常使用缝线对受体的主动脉和下腔静脉进行端到端吻合。在该模型中,通过改良袖带技术通过端到端吻合将供体的心脏植入受体的颈动脉和颈静脉。移植手术无需缝合即可进行,因此可以增加接受者的生存,因为不会干扰下半身的血液供应和静脉反流。该小鼠模型将有助于研究心脏同种异体移植物的免疫和病理(急性/慢性)排斥反应的机制。
引言
心脏移植已成为终末期心力衰竭的标准治疗方法。每年有超过5,500例心脏移植在国际心肺移植学会注册的组织中进行。在同种异体心脏移植受者中,1 年排斥率仍为 >10%,而 3 年排斥率上升至 36%1,2。然而,对于心脏同种异体移植排斥反应患者缺乏有效的预防性治疗。因此,有必要进行动物模型研究,阐明心脏同种异体移植物免疫和病理排斥反应的生理机制。这些研究将有助于研究开发有效药物所需的新靶点,这将有助于防止心脏同种异体移植排斥反应并提高这些患者群体的存活率。
最近在异位心脏移植的小鼠模型研究中提出了心脏同种异体移植排斥反应的一些潜在的免疫和病理生理机制3,4,5。因此,小鼠异位心脏移植因其与人类基因的高度同源性而成为研究心脏移植后心脏同种异体移植物发生免疫排斥和病理损伤机制的理想临床前模型。普遍的概念是在小鼠模型中使用缝线在受体主动脉和下腔静脉中进行腹部端到端吻合,类似于正常的人体解剖结构。但是,此过程可能会干扰接受者的血液供应和下半身的静脉反流6。因此,本文提出了一种改良的小鼠模型中异位心脏移植程序。
捐赠者的心脏通过使用改进的袖带技术通过端到端颈吻合术植入接受者的颈动脉和颈静脉。这种改良的程序促进了手术的可行性,并确保了心脏移植物的存活,而不会干扰下半身的血液供应和静脉反流。
研究方案
所有动物实验均按照国家研究委员会(美国)2011年《实验动物护理和使用指南》第八版进行。涉及动物受试者的程序已获得中国重庆大学肿瘤医院动物护理和使用委员会的批准。从商业来源获得的重20-30g的雄性BALB / c和C57BL / 6小鼠用于同种异体心脏移植研究。C57BL/6小鼠作为供体和同系受体,BALB/c小鼠作为同种异体受体。该协议的原理图如图1所示。
注意:手术期间使用的所有用品,包括手术器械和溶液,都是无菌的。外科手术遵循无菌操作技术的原则。
1. 收件人程序
- 通过与罩连接的15 x 10 x 10 cm诱导室吸入5%异氟醚 诱导 全身麻醉(参见 材料表)。
- 用加热垫将收件人鼠标固定在手术台上。通过口罩在鼻子和嘴巴上连续吸入2%异氟醚来维持麻醉。
注意:呼吸频率和节律缓慢,角膜反射消失以及脚趾踏板反射消失表明麻醉的有效性。 - 剃光头发后,用三轮交替的聚维酮碘磨砂膏对手术区域进行消毒,然后用酒精进行消毒。然后,从右下颌角到尾端切开平行于颈椎中线的皮肤 1.5-2 厘米。
- 使用电凝器和微型镊子解剖~1厘米的右颈外静脉。用无创伤微血管钳夹在近端夹住静脉,并在远端结扎。
- 将静脉的远端穿过带有斜端和浅凹槽的 22 G 聚氨酯倒刺袖带(见 材料表)。使用微血管夹用袖带的手柄固定静脉。
- 删除 8-0远端结扎缝合,将内翻由浅表倒钩住的袖带上的腔,并用10-0手术缝合线固定在表面的凹槽中。
- 切除右舌下腺形成用于植入心脏移植物的窝,并保留上颌下腺的右叶和右胸锁乳突。
- 使用微钳解剖右颈总动脉~1 cm,并在近端用无创伤微血管钳夹住动脉。在远端,结扎并切断动脉。
- 将动脉的远端穿过带有斜端和表面凹槽的 26 G 聚氨酯倒刺袖带(见 材料表)。使用微血管夹用袖带的手柄固定动脉。
- 取下远端的结扎缝合线,将腔内翻在袖带上,并用浅表倒钩和凹槽用 10-0 手术缝合线固定。
- 准备好受体的血管后,在血管上滴100 IU / mL肝素盐水以防止血栓形成。用无菌湿盐水纱布覆盖宫颈切口,以便随后植入。
2. 捐赠程序
- 对供体小鼠采用相同的麻醉程序(步骤1.1)。
- 使用电动剃须刀剃除腹毛,并用三轮交替的聚维酮碘磨砂膏对手术区域进行消毒,然后用酒精进行消毒。
- 用剪刀沿耻骨联合到剑下线的中线切开腹部(2-3 cm),并用牵开器扩大切口区域。
- 使用电凝器和微钳解剖腹主动脉和下腔静脉 1 cm,并通过下腔静脉注射 1 mL 生理盐水补充 250 IU/mL 肝素来进行肝素化。之后,切除腹主动脉和下腔静脉。
- 使用手术剪刀沿两侧腋窝前线切除胸部,以分离胸壁。以8-0的比分结扎上腔静脉手术缝合。
- 在上胸下腔静脉插入头皮针。然后,从上麻盆下腔静脉的头皮针注射补充有 100 IU/mL 肝素的冰冷生理盐水,灌注供体心脏,直到血色褪色。
- 使用主动脉弓的头皮针重新灌注供体心脏,用2-3mL冰冷的组氨酸-色氨酸-酮戊二酸(HTK)溶液(见 材料表)保护供体心肌。平均暖缺血时间为5分钟。
- 用5-0手术缝合结扎上腔静脉和下腔静脉和肺静脉。在供体分支之前解剖并切断供体主动脉和肺动脉。之后,将上腔静脉和下腔静脉分开,以切除供体的心脏。
3. 植入
- 将供体心脏以倒置位置植入受体小鼠的颈椎袋中。
- 将带有外出的颈静脉袖带拉入供体肺动脉腔,以对供体肺动脉与受体颈外静脉进行端到端吻合。使用表面上的凹槽通过 10-0 手术缝合线结扎袖带以固定吻合口。
- 采用类似的程序进行供体主动脉与受体颈动脉的端到端吻合术。
- 释放颈静脉的无创伤微血管钳夹,然后释放颈动脉,重新灌注供体的心脏。平均冷缺血时间为15分钟。
- 固定心脏移植物并正确缝合以防止移植物扭曲。
- 使用5-0聚酰胺单丝缝合线用连续缝合线关闭宫颈切口(见 材料表)。
注意:伤口完全愈合后拆下缝合线。 - 将受体小鼠保留在温暖,干燥和干净的笼子中,直到它从麻醉中恢复。
注意:恢复需要5-10分钟。 - 每6小时将丁丙诺啡(0.05mg / kg)皮下注射到受体小鼠中,持续48小时用于术后镇痛。
注意:镇痛剂量针对本研究进行了优化。但是,如果有任何疼痛迹象,可以根据机构动物使用指南延长/修改镇痛方案。
结果
在该小鼠宫颈异位心脏移植模型中,受体小鼠的存活率约为95.2%(21只小鼠中有20只存活)。死亡的主要原因是术后出血。具有规律节律的快速心跳可作为植入供体心脏存活的指标。
C57BL/6和BALB/c小鼠在该模型中分别为MHC(H-2b)和MHC(H-2d)类型,分别为7,8。这两种菌株因H-2而异,H-2导致急性T细胞介导的排斥反应9。在所有心脏同种异体移植物中,62.5%在移植后7天内丢失,通过触诊心跳进行评估。所有心脏同种异体移植物在移植后8天内丢失。相比之下,所有同基因心脏移植存活超过4周(图2)。存活超过4周的小鼠通过吸入CO2实施安乐死。

图1:小鼠颈椎异位心脏移植模型示意图 。 (一)准备受体的方案:在近端夹住颈总动脉和颈外静脉后,血管腔通过带刺的袖带后外翻并固定,斜端和表面有凹槽。虚线方块显示袖口的结构和用法。(B)供体心脏切除术:供体心脏从下腔静脉和主动脉用肝素和HTK溶液灌注后,用缝合线结扎上下腔静脉和肺静脉。然后通过切开血管来切除供体的心脏。(C)植入捐赠者的心脏。供体肺动脉和主动脉与受者的颈外静脉吻合,颈动脉通过袖带 吻 合,受者的脉管系统以端到端模式由内而外转动。 请点击此处查看此图的大图。
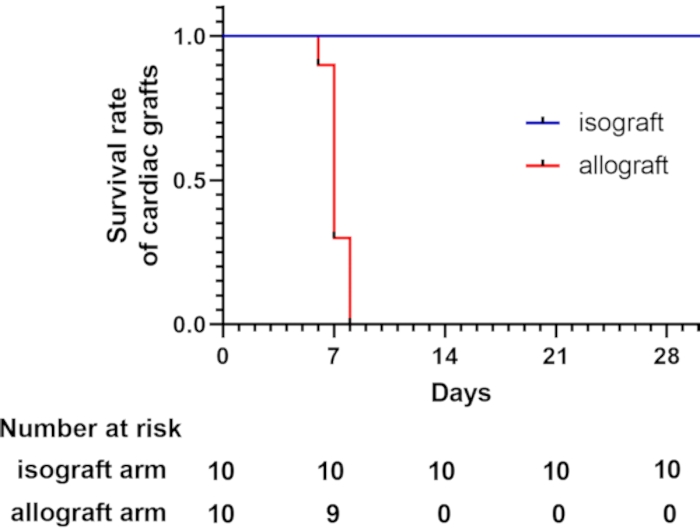
图2:心脏移植物的存活曲线。 心脏移植物的存活曲线显示,同种异体心脏移植在移植后8天内丢失,通过触诊心跳进行评估。每组共10只受体小鼠接受改良的宫颈异位心脏移植。所有同基因心脏移植存活超过4周。 请点击此处查看此图的大图。
| 鲁珀特·奥伯胡贝尔等人10 | 辛茂等(现作品) | |||
| 麻醉 | 甲苯噻嗪和氯胺酮 | 异氟醚(安全、连续、稳定) | ||
| 下颌下腺右叶 | 免职 | 保存(减少移植物的旋转) | ||
| 右胸锁乳突 | 免职 | 保存(减少移植物的旋转) | ||
| 心脏灌注 | 用主动脉弓的4°C HTK溶液逆行灌注 | 1.顺行灌注冰冷生理盐水,补充100 IU/mL肝素溶液,来自肝上腔静脉。2.从主动脉弓用冰冷的HTK溶液逆行再灌注。 (减少凝血,增加心肌保护) | ||
| 袖口 | 钝端,带手柄 | 斜面端,表面有手柄、倒钩和凹槽(便于外翻和固定) | ||
表1:心脏移植技术的比较。 目前的小鼠宫颈异位心脏移植技术是从Oberhuber,R.等人10 修改而来的,并且对心脏移植存活具有额外的优势。
讨论
小鼠心脏移植模型有助于研究心脏移植后的排斥机制,有助于开发独特的方法来改善心脏同种异体移植受者的长期生存率。然而,小鼠心脏移植是一项复杂且具有挑战性的任务,需要高水平的显微外科技术,特别是在血管吻合术中11,12,13。小鼠腹部异位心脏移植模型是通过供体主动脉和肺动脉与受体主动脉和下腔静脉吻合缝合进行的。在此操作中,需要阻断受者的主动脉和下腔静脉。因此,下半身缺血和下腔静脉血栓形成可增加受体小鼠的残疾和死亡。为了减少移植过程中血管吻合的困难,Matsuura等于1991年首次使用袖带技术在小鼠中引入了宫颈心脏移植模型14。在该模型中,通过袖带结扎对血管进行套筒状外翻吻合提高了吻合效率。与腹心移植小鼠模型中缝合血管的吻合相比,它降低了手术后的出血概率。因此,吻合效率的提高减少了心肌缺血时间,提高了心脏移植物的存活率。此外,与腹部植入相比,宫颈植入供体心脏不会中断受体主动脉和下腔静脉的循环15;因此,受体小鼠的存活率增加。
这里描述了一种独特的实验性小鼠异位心脏移植模型,由Rupert Oberhuber等人建立10。该手术涉及在改良的袖带技术下,将供体主动脉和肺动脉与受体颈动脉和颈静脉进行端到端颈动脉吻合。在该模型中,受体小鼠的体循环不会干扰10,并且供体的心脏从下腔静脉和主动脉注入肝素和HTK溶液,以获得更好的心肌保护。然而,该模型的关键组件与Oberhuber等人10不同,后者采用了改良的带刺袖口,其斜面端和凹槽类似于Finsterer等人16。斜端便于血管腔的套筒状埃弗特。表面上的凹槽便于使用缝合线用袖带固定外翻的血管壁,袖带外的倒钩减少了吻合血管壁从袖带的滑动(图1)。这些修改将手术时间缩短了20%,提高了心脏移植物的植入效率和存活率。此外,改进的带刺袖带由用于头皮针灸的最常见聚氨酯导管制成,从而大大降低了手术成本。表1显示了当前技术与Oberhuber等人10的技术的比较。
需要注意该模型的独特功能。首先,袖带的长度和口径对于成功的吻合至关重要。袖带的合适长度为~3毫米,带手柄(1毫米)(图1)。袖带的合适口径分别为动脉和静脉26克和22克。袖带的长度和口径不合适会导致吻合血管扭曲或过度紧张。其次,接受者血管的合适长度是袖带的 1.5 至 2 倍。第三,供体的心脏没有注入过大的压力,可能会损害移植物。第四,固定心脏移植物,植入后通过缝合将袖带吻合在合适的位置,以避免吻合血管或移植物的移动或扭曲。第五,保留上颌下腺和胸锁乳突肌有助于在切除右舌下腺以产生用于心脏移植的窝时减少吻合血管或移植物的旋转或扭曲。第六,为便于血管腔的套筒状内脏,减少术后血栓形成,可在进行吻合时向吻合血管提供肝素溶液(100 IU/mL)。
这种袖带技术有助于在植入过程中对供体和受体血管进行吻合;然而,袖带的硬度可能反过来增加扭曲吻合血管的风险,导致移植后血栓形成增加。需要优化袖带材料,以减少并发症,提高移植物存活率,并提高模型在后续实验中的利用率。此外,切口的纤维性疤痕可能会限制心脏移植的空间并影响其长期生存。此外,心脏移植物的喷射可能会干扰受体小鼠的正常血流动力学血流。最后,该模型是非功能性的,不能用于评估移植物的心脏功能。然而,这项研究提供了有关心脏移植免疫和病理功能的知识。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了中国国家自然科学基金(81870304)对李军的支持。
材料
| Name | Company | Catalog Number | Comments |
| 5-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C3090954 | |
| 8-0 Polyamide Monofilament suture | B.Braun Medical Inc. | C2090880 | |
| 10-0 Polyamide Monofilament suture | B.Braun Medical Inc. | G0090781 | |
| 22 G polyurethane cuff | B.Braun Medical Inc. | 4251628-02 | |
| 26 G polyurethane cuff | Suzhou Linhua Medical Instrument Co., LTD | REF383713 | |
| Anesthesia induction chamber | RWD Life Science Co., LTD | V100 | |
| Atraumatic microvascular clamp | Beyotime | FS500 | |
| BALB/c and C57BL/6 mice (20–30 g) | Centre of Experimental Animals (Army Medical University, Chongqing, China) | ||
| Buprenorphine | US Biological life Sciences | 352004 | |
| Electrocoagulator | Guangzhou Runman Medical Instrument Co., LTD | ZJ1099 | |
| Gauze | Henan piaoan group Co., LTD | 10210402 | |
| Heating pad | Guangzhou Dewei Biological Technology Co., LTD | DK0032 | |
| Heparin | North China Pharmaceutical Co., LTD | 2101131-2 | |
| HTK solution | Shenzhen Changyi Pharmaceutical Co., LTD | YZB/Min8263-2013 | |
| Injection syringe (10 mL) | Shandong weigao group medical polymer Co., LTD | 20211001 | |
| Isoflurane | RWD Life Science Co., LTD | 21070201 | |
| Physiological saline | Southwest pharmaceutical Co., LTD | H50021610 | |
| Scalp needle | Hongyu Medical Group | 20183150210 | |
| Shaver | Beyotime | FS600 | |
| Small animal anesthesia machine | RWD Life Science Co., LTD | R500 | |
| Surgical operation microscope | Tiannuoxiang Scientific Instrument Co. , Ltd, Beijing, China | SZX-6745 | |
| Swab | Yubei Medical Materials Co., LTD | 21080274 |
参考文献
- Khush, K. K., et al. The International thoracic organ transplant registry of the international society for heart and lung transplantation: Thirty-sixth adult heart transplantation report - 2019; focus theme: Donor and recipient size match. The Journal of Heart and Lung Transplantation. 38 (10), 1056-1066 (2019).
- Stehlik, J., et al. The registry of the international society for heart and lung transplantation: 29th official adult heart transplant report--2012. The Journal of Heart and Lung Transplantation. 31 (10), 1052-1064 (2012).
- Huang, H., et al. Combined intrathymic and intravenous injection of mesenchymal stem cells can prolong the survival of rat cardiac allograft associated with decrease in miR-155 expression. Journal of Surgical Research. 185 (2), 896-903 (2013).
- Eggenhofer, E., et al. Features of synergism between mesenchymal stem cells and immunosuppressive drugs in a murine heart transplantation model. Transplant Immunology. 25 (2-3), 141-147 (2011).
- Sula Karreci, E., et al. Brief treatment with a highly selective immunoproteasome inhibitor promotes long-term cardiac allograft acceptance in mice. Proceedings of the National Academy of Sciences of the United States of America. 113 (52), 8425-8432 (2016).
- Liu, F., Kang, S. M. Heterotopic heart transplantation in mice. Journal of Visualized Experiments. 6, 238 (2007).
- Lin, C. M., Gill, R. G., Mehrad, B. The natural killer cell activating receptor, NKG2D, is critical to antibody-dependent chronic rejection in heart transplantation. American Journal of Transplantation. 21 (11), 3550-3560 (2021).
- Ito, H., Hamano, K., Fukumoto, T., Wood, K. J., Esato, K. Bidirectional blockade of CD4 and major histocompatibility complex class II molecules: An effective immunosuppressive treatment in the mouse heart transplantation model. The Journal of Heart and Lung Transplantation. 17 (5), 460-469 (1998).
- Zhou, Y. X., et al. Acute rejection correlates with expression of major histocompatibility complex class I antigens on peripheral blood CD3(+)CD8(+) T-lymphocytes following skin transplantation in mice. Journal of International Medical Research. 39 (2), 480-487 (2011).
- Oberhuber, R., et al. Murine cervical heart transplantation model using a modified cuff technique. Journal of Visualized Experiments. (92), e50753 (2014).
- Cui, D., Tan, C., Liu, Z. An alternative technique of arterial anastomosis in mouse heart transplantation. Clinical Transplantation. 32 (6), 13264 (2018).
- Plenter, R. J., Zamora, M. R., Grazia, T. J. Four decades of vascularized heterotopic cardiac transplantation in the mouse. Journal of Investigative Surgery. 26 (4), 223-228 (2013).
- Fang, J., et al. A simplified two-stitch sleeve technique for arterial anastomosis of cervical heterotopic cardiac transplantation in mice. American Journal of Translational Research. 5 (5), 521-529 (2013).
- Matsuura, A., Abe, T., Yasuura, K. Simplified mouse cervical heart transplantation using a cuff technique. Transplantation. 51 (4), 896-898 (1991).
- Corry, R. J., Winn, H. J., Russell, P. S. Primarily vascularized allografts of hearts in mice. The role of H-2D, H-2K, and non-H-2 antigens in rejection. Transplantation. 16 (4), 343-350 (1973).
- Fensterer, T. F., Miller, C. J., Perez-Abadia, G., Maldonado, C. Novel cuff design to facilitate anastomosis of small vessels during cervical heterotopic heart transplantation in rats. Comparative Medicine. 64 (4), 293-299 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。