Method Article
Выделение микровезикул селезенки на мышиной модели внутрибрюшинной бактериальной инфекции
В этой статье
Резюме
Микровезикулы, выделяющиеся из плазматической мембраны, действуют как клеточные эффекторы. Микровезикулы селезенки (СМВ) являются суррогатными маркерами патофизиологических состояний. У крыс и мышей содержание и свойства SMV характеризуют старение или воспаление и изменяются под действием цитопротекторных препаратов, что делает их ценным и в то же время обильным инструментом мониторинга для доклинических исследований.
Аннотация
Микровезикулы (МВ) представляют собой субмикронные фрагменты, высвобождаемые из плазматической мембраны активированных клеток, которые действуют как провоспалительные и прокоагулянтные клеточные эффекторы. У крыс МВ селезенки (МВ) являются суррогатными маркерами патофизиологических состояний. Предыдущие исследования in vitro показали, что Porphyromonas gingivalis (P. gingivalis), основной патоген пародонта, способствует выделению эндотелия и апоптозу, в то время как липополисахарид (ЛПС) способствует выделению микровезикул, полученных из спленоцитов (SMV). Исследования in vivo показали целесообразность фармакологического контроля выделения СМВ. Настоящий протокол устанавливает стандартизированную процедуру выделения СМВ селезенки из модели острой мышиной инфекции P. gingivalis. Инфекция P. gingivalis индуцировалась у молодых мышей C57BL/6 путем внутрибрюшинного введения (три инъекции 5 x 10-7 бактерий в неделю). Через две недели были собраны селезенки, взвешены и подсчитаны спленоциты. SMV были выделены и количественно определены с помощью анализов белка, РНК и протромбиназы. Жизнеспособность клеток оценивали либо с помощью йодида пропидия, либо с помощью исключающих красителей трипанового синего. После экстракции спленоцитов количество нейтрофилов получали методом проточной цитометрии через 24 ч культивирования спленоцитов. У мышей, которым вводили P. gingivalis, наблюдалось увеличение массы селезенки в 2,5 раза и увеличение количества спленоцитов в 2,3 раза, в то время как количество нейтрофилов увеличилось в 40 раз. Клеточная жизнеспособность спленоцитов мышей, которым вводили P. gingivalis, варьировала от 75% до 96% и снижалась на 50% после 24 ч культивирования без какой-либо существенной разницы по сравнению с контрольной группой, не подвергавшейся воздействию. Тем не менее, спленоциты от инъекционных мышей выделяли большее количество MV с помощью анализа протромбиназы или измерения белка. Данные показывают, что прокоагулянтные SMV являются надежными инструментами для оценки раннего ответа селезенки на внутрибрюшинную инфекцию P. gingivalis.
Введение
Микровезикулы (МВ), также называемые микрочастицами или эктосомами, представляют собой фрагменты плазматической мембраны диаметром 0,1-1,0 мкм, выделяемые в жидкостях организма и внеклеточном пространстве в ответ на различные клеточные стимулы. Впервые идентифицированные как тромбоцитарная пыль, обнажающая прокоагулянтные фосфолипиды, в основном фосфатидилсерин (PSer), MV представляют собой дополнительную поверхность для сборки комплексов свертывания крови 1,2. Ключевая роль циркулирующих MV в качестве прокоагулянтных эффекторов была продемонстрирована у пациентов с синдромом Скотта2, редким генетическим заболеванием, которое приводит к дисфункциональному воздействию PSer и кровотечению (дополнительный рисунок 1). МВ широко изучались в качестве циркулирующих биомаркеров тромботического риска при хронических заболеваниях, связанных с сердечно-сосудистыми расстройствами, таких как диабет, хроническая болезнь почек, преэклампсия и гипертензия 3,4. В настоящее время они признаны истинными клеточными эффекторами в жидкостях или тканях органов, таких как миокард1. Поскольку они передают активные белки, липиды и микроРНК, они дистанционно модулируют сосудистые реакции, такие как гемостаз, воспаление, сосудистый ангиогенез и рост сосудов илиремоделирование тканей.
В то время как в клинических исследованиях изучается прогностическая ценность МВ в отношении факторов риска, МВ, выделенные из жидкостей или тканей пациента, позволяют ex vivo оценить их эффекторные свойства6. Расшифровка механизмов, управляющих биогенезом МВ и способностью к перекрестным помехам, обычно достигается в моделях клеточных культур для идентификации активных молекул, подвергающихся воздействию или инкапсулированных внутри МВ, и их нисходящей сигнализации. Взаимодействие MV с клетками-мишенями будет зависеть от связывания мембранного белка/белка, при наличии соответствующих контрлигандов и/или слияния липидов7.
В физиологических условиях МВ, циркулирующие в плазме, в основном происходят из сосудистых клеток, что идентифицируется маркерами дифференцировки кластеров линии (CD)8,9. Однако при патологии, особенно при раке10 и отторжении трансплантата 11,12, МВ выделяются из поврежденной ткани и обладают вредными прокоагулянтными и провоспалительными свойствами. Они обнаруживаются в системном кровотоке, что делает их полезными зондами для мониторинга защитной или омолаживающей терапии, а также возможных фармакологических мишеней13. Поскольку МВ циркулируют в виде динамического накопительного пула, отражающего гомеостаз сосудистых и тканевых клеток в норме и при заболеваниях, необходимо также исследовать более глубокое понимание их отдаленного действия in vivo, после внутривенного введения или назального инстилляции у мелких животных14,15. Действительно, МВ считаются основными участниками сложных путей, связывающих чрезмерное воспаление и тромбоз16.
Пародонтит – это воспалительное заболевание инфекционного происхождения, поражающее ткани, поддерживающие зуб17,18 и связанное с риском тромбоза. Он характеризуется кровоточивостью десен, разрушением альвеолярной кости, подвижностью зубов и в конечном итоге может привести к потере зубов. Пародонтит широко распространен во всем мире и поражает более 50% населения, причем 11% имеют тяжелую форму19. Пародонтит индуцируется бактериальным дисбиозом поддесневых биопленок, которые поддерживают обостренную воспалительную реакцию, вызывающую разрушение тканей20. В течение последнего десятилетия пародонтит был связан с системными заболеваниями, такими как сердечно-сосудистые заболевания, диабет и ревматоидный артрит. Возможными объяснениями являются действие пародонтальных патогенов на расстоянии и/или усиление системного воспаления, опосредованного провоспалительными цитокинами, такими как интерлейкин (IL-1, IL-6) и TNF-α21,22.
Среди патогенов, ассоциированных с возникновением и развитием пародонтита, Porphyromonas gingivalis (P. gingivalis)23 обнаруживается при наиболее тяжелых поражениях, которые собирают несколько факторов вирулентности, включая липополисахарид (ЛПС)24, индуцирующий воспалительные реакции, опосредованные Toll-подобными рецепторами (TLR)25 и рекрутирование нейтрофилов и полиморфноядерных лейкоцитов (ПМН) в месте первоначальной инфекции26. ЛПС P. gingivalis активирует TLR-4 или TLR-2, способствуя иммунному обнаружению и уклонению от выживания бактерий27. На сосудистом уровне активация TLR2 с помощью ЛПС связана с иммунотромбозом. Уникальная способность P. gingivalis вызывать передачу сигналов TLR-2 в то время как TLR-4-зависимое распознавание значительно нарушено, способствует стойкой инфекции низкой степенизлокачественности 28,29.
Процедуры in vivo для изучения реакции MV на хроническую и устойчивую инфекцию возбудителя низкой степени злокачественности редки. Методологические подходы к экстракции тканевых МВ слабо описаны в литературе и в основном касаются забора МВ из патологических тканей, таких как солидные опухоли, стеатоз печени, атеротромботические бляшки или трансплантаты 11,29,30, в то время как селезенка воспринимает бактерии и вирусы в кровотоке. Он также хранит эритроциты, тромбоциты, лимфоциты, моноциты, базофилы и эозинофилы, участвующие в иммунном ответе. Гранулоциты, такие как нейтрофилы из красной пульпы, также генерируют активные формы кислорода (АФК) и протеазы, которые уничтожают патогены и предотвращают распространение инфекции31,32. Удивительно, но, насколько нам известно, МВ селезенки не исследуются в контексте вызванных патогенами повреждений тканей. Существует глобальная неудовлетворенная потребность в изучении вариаций ципсулярных МВ в физиопатологии.
Данные in vitro из нашей лаборатории показали, что ЛПС индуцирует выделение прокоагулянтных МВ из спленоцитов крыс, что, в свою очередь, вызывает старение культивируемых коронарных эндотелиальных клеток и последовательный провоспалительный и прокоагулянтный эндотелиальный фенотип11. Возможность фармакологического контроля МВ селезенки была дополнительно продемонстрирована после лечения животного оптимизированной формулой омега-3. Было обнаружено, что пероральный зонд крыс среднего и пожилого возраста защищает как от выделения прокоагулянтных MV из спленоцитов, так и от их старческих вредных свойств по отношению к коронарному эндотелию33.
По сравнению с кровью, селезенка имеет то преимущество, что является важным источником лейкоцитов у одного человека. Кроме того, недавно была предложена ось селезенка-сердце 3,34, что делает селезенку возможным фактором риска сердечно-сосудистых заболеваний, связанного с инфекцией, представляющим полезный интерес для фармакологического контроля. Оценка свойств или высвобождения SMV является ключом к пониманию патогенных или воспалительных реакций. Интересно, что это может быть достигнуто у обработанных животных и при различных физиопатологических моделях (возраст, гипертония, диабет). Действительно, сравнивая крыс среднего и старого возраста33, различия в свойствах и высвобождении МВ селезенки могут быть доказаны после простого 24-часового посева спленоцитов.
Учитывая вышеуказанные свидетельства изменения эффекторных свойств МВ селезенки в зависимости от физиопатологического состояния и целесообразность их фармакологического контроля у крыс, в настоящем документе описан стандартизированный протокол выделения МВ селезенки мышей. Эта процедура лучше подходит для углубленных исследований in vivo механизмов, поддерживающих SMV-опосредованные эффекты, в конечном итоге у сконструированных мышей. Процедура была установлена на мышах C57BL/6 с использованием местной внутрибрюшинной инфекции P. gingivalis, чтобы установить доказательства отдаленного действия патогена на эффекторные свойства MV селезенки (SMV).
протокол
Все протоколы экспериментов были одобрены и составлены в соответствии с соответствующими руководящими принципами местного Комитета по этике (APAFIS#28745-2020121815051557) и службы по уходу за животными Университета по дому и INSERM. Для экспериментов использовали самцов молодых мышей C57BL/6 в возрасте 6-8 недель. Мышей регулярно обследовали для оценки боли и стресса, а их вес контролировался ежедневно. Если не указано иное, все экстрагирующие буферы и растворы должны быть стерильными и иметь комнатную температуру.
1. Подготовка животных
- Вводите мышам шесть внутрибрюшинных инъекций P. gingivalis (PG) каждые 2 дня в течение 2 недель (три инъекции 5 x 107 бактерий в неделю, Дополнительный файл 1).
- Обезболите мышей комбинацией 100 мг/кг кетамина и 10 мг/кг ксилазина.
- Принесите в жертву мышей, находящихся под наркозом, и соберите селезенку после лапаротомии.
Примечание: Конкретные условия заражения P. gingivalis и жертвоприношения животных для сбора селезенки подробно описаны в разделе «Эксперимент на животных» Дополнительного файла 1. Схематическое изображение этапов протокола показано на рисунке 1.
2. Экстракция спленоцитов
- Используя скальпель, измельчите ткань селезенки на ломтики ~1 мм в чашке Петри, уже заполненной 3 мл RPMI, содержащей антибиотики (стрептомицин (100 ЕД/мл)/пенициллин (100 ЕД/мл), фунгизон (250 мг/мл), L-глютамин (2 мМ)), и с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS) (см. Таблицу материалов).
- Переложите ломтики на сито (см. Таблицу материалов), которое заранее прикреплено к полистирольной трубке объемом 50 мл.
- С помощью поршня шприца в качестве пестика раздавите салфетки на сите.
- Промойте сито средой RPMI (3 мл).
- Центрифугируйте клеточную суспензию, элюируйте при 450 х г в течение 5 мин при комнатной температуре и осторожно выбросьте надосадочную жидкость с помощью обратного потока.
3. Удаление эритроцитов с помощью осмотического шока
- Добавьте 1 мл буфера ACK (см. Таблицу материалов), хорошо перемешайте, инкубируйте в течение 3 минут при комнатной температуре и осторожно встряхивайте, вращая рукой.
- Разбавьте, добавив 9 мл RPMI, и хорошо перемешайте с помощью аспирации и обратного потока.
- Центрифуга при давлении 450 х г в течение 5 минут при комнатной температуре.
- Выбросьте надосадочную жидкость путем аспирации и обратного потока и повторно суспендируйте гранулу в 5 мл среды RPMI.
- Осторожно перемешайте (аспирация/обратный поток) и в конечном итоге удалите липидный мусор с помощью пипетирования или с помощью сита.
4. Корректировка концентрации выделенных спленоцитов
- Заполните микропробирку объемом 1,5 мл, содержащую 900 мкл RPMI.
- С помощью микропипетки возьмите 100 мкл клеточной суспензии, добавьте в микропробирку объемом 1,5 мл, содержащую 900 мкл среды RPMI, и хорошо перемешайте.
- Перенесите 10 мкл разведенных клеток в микропробирку, добавьте 10 мкл трипанового синего эксклюзионного красителя и хорошо перемешайте.
- Поместите 10 μL раствора (шаг 3.3) в предметное стекло автоматического счетчика клеток (см. Таблицу материалов) и определите количество клеток.
ПРИМЕЧАНИЕ: Программное обеспечение устройства выдает два значения: общее количество клеток и количество живых клеток и процент. - Отрегулируйте концентрацию живых клеток до 3 или 5 x 106 клеток/мл (Vmax = 20 мл; максимальная общая емкость составляет 100 x 106 клеток/мл).
- Поместите клетки в колбу объемом 75 мл, содержащую RPMI.
- Инкубируйте колбу вертикально во влажном инкубаторе при температуре 37 °C в течение 24 часов.
ВНИМАНИЕ: Трипановый синий является мутагенным и канцерогенным агентом35,36. Обязательно надевайте перчатки во время подсчета, даже снаружи капюшона. Немедленно выбросьте наконечники и жидкости в контейнеры и вымойте поверхность скамейки.
ПРИМЕЧАНИЕ: Если собранные клетки меньше 50 x 106, используйте колбу для культур объемом 25 мл. Номер ячейки не должен сильно отличаться от одного человека к другому. Процент живых клеток обычно превышает 80% на этом этапе.
5. Выделение микровезикул спленоцитов
- Через 24 ч высыпать содержимое колбы в полипропиленовую или полистирольную пробирку объемом 50 мл.
- Центрифуга при 450 x g в течение 15 минут при комнатной температуре для удаления клеток и мусора.
- После центрифугирования оставьте 100 мкл 1-го надосадочной жидкости (SN1) для возможного измерения начальной концентрации MV для расчета выхода изоляции. Обратите внимание на том SN1.
- Центрифугируйте SN1 при давлении 450 x g в течение 15 минут при комнатной температуре.
- Выбросьте гранулы и снова центрифугируйте при 450 x g в течение 15 минут при комнатной температуре. Быстро извлеките и соберите SN2 (обратите внимание на громкость).
- Перенесите SN2 в микропробирки объемом 1,8 мл с коническим дном. Храните 100 мкл SN2 для возможного измерения исходной концентрации MV для расчета выхода изоляции в случае, если слишком большое количество мусора в конечном итоге ухудшит измерение MV в SN1.
- Добавьте 5 мл среды RPMI в гранулу (клетки) и подсчитайте количество спленоцитов.
ПРИМЕЧАНИЕ: Клеточная суспензия также может быть зафиксирована для определения характеристик проточной цитометрии в 0,1% параформальдегида (конечная концентрация)37. - Центрифугируйте SN2 при 14 000 x g в течение 1 ч при 4 °C и в конечном итоге предварительно охладите ротор, запустив пустой ротор при 4 °C. На этом шаге генерируется SN3.
- Немедленно извлеките SN3 из каждой микропробирки, перевернув одну стерильную пробирку объемом 50 мл (под колпаком). Обратите внимание на том SN3.
- Аккуратно перемешайте SN3 с помощью пипетки под колпаком. Храните аликвоты для возможных измерений в суспензии.
Примечание: Раствор в настоящее время истощен MV, но содержит растворимые медиаторы и экзосомы. - Соскребите каждую микротрубку (закрытую) на решетке с шипами, чтобы механически способствовать повторной суспензии MV в грануле.
- Добавьте 200 мкл сбалансированного физиологического раствора Хэнка без Ca2+ и Mg2+ (HBSS) в первую микропробирку (см. Таблицу материалов).
- Ресуспендируйте гранулу MV из первой пробирки с помощью щадящих циклов аспирации/обратного потока (~10 раз) с помощью микропипетки объемом 1 мл. Будьте очень осторожны, чтобы избежать пенообразования, так как это будет способствовать окислению везикул и других фрагментов в суспензии.
- Соберите первые 200 μл ресуспендированных MV и вылейте их во вторую пробирку над гранулой. Аккуратно перемешайте, как указано выше, а затем снова вылейте в третью трубку и аккуратно перемешайте. Суспензия становится все более мутной от трубки к трубке. Закройте третью трубку.
- Начните забор следующих трех микропробирок, как указано выше (шаг 4.14).
- Соберите все ресуспендированные МВ в одну (или две) коллекторные микропробирки (2 мл с коническим дном). Оставьте 50 мкл для окончательного расчета выхода на этом этапе. Обратите внимание на объем суспензии.
- Центрифугируйте коллекторную трубку при давлении 14 000 x g в течение 1 ч при 4 °C. На этом шаге генерируется SN4.
- Немедленно выбросьте SN4 (залейте пробирку для сбора надосадочной жидкости). Сохраните аликвоту SN4 для расчета выхода на этапе очистки и аккуратно ресуспендируйте гранулу в 500 мкл HBBS (без Ca2+ и Mg2+). Сохраните аликвоту в 50 мкл ресуспендированной гранулы, чтобы рассчитать выход очистки и отметить ее объем.
- Ресуспендированную гранулу хранят при температуре 4 °C до одного месяца для функциональных анализов в стерильных условиях или при -20 °C для структурных анализов.
- Рассчитайте выход очистки (см. ПРИМЕЧАНИЕ ниже) каждого этапа или всей процедуры, измерив концентрацию МТ в надосадочной жидкости и/или суспензиях гранул.
ПРИМЕЧАНИЕ: Выход очистки (%): ([MV1] x объем SN1) / ([MV4] x конечный объем суспензии) x 100.
Этот выход должен быть рационализирован до количества спленоцитов, выделенных из колбы с культурой и подсчитанных на шаге 4.4. Выход очистки в данном эксперименте составляет ~70%, начиная со 111 х 106 клеток и 60 мл надосадочной жидкости.- Оцените потерю SMV, вызванную процедурой, путем измерения SMV, оставшихся в надосадочной жидкости, обедненных SMV и в основном содержащих экзосомы (SN2 и SN4).
- Измерьте концентрацию MV с помощью TRPS или анализа протромбиназы38 для получения высокой чувствительности и специфичности.
ВНИМАНИЕ: Соберите MV после центрифугирования путем быстрой заливки надосадочной жидкости вверх ногами. Ожидание или использование U-образных микротрубок приведет к потере MV на стенке микротрубки. Никогда не используйте микропипетку для удаления надосадочной жидкости; Вместо этого гранулу можно аспирировать. Никогда не откладывайте процесс после остановки центрифуги. Превышение частоты вращения центрифугирования приведет к загрязнению гранулы MV экзосомами.
ПРИМЕЧАНИЕ: Скорость и продолжительность центрифугирования оптимизированы для обогащения MV с минимальным загрязнением экзосомами. Этот протокол ненадежен для изучения МВ моноцитов/макрофагов селезенки, поскольку эти клетки могут фагоцитировать и быстро захватывать свои собственные МВ39. Протокол не может быть приостановлен и возобновлен позже из-за потери клеток из-за жизнеспособности клеток.
Результаты
Предоставленные данные дают полное представление о всей процедуре с использованием двух основных условий на животных: контрольные молодые мыши C57BL/6 без лечения и их однопометники, подвергавшиеся шести внутрибрюшинным (IP) инъекциям PG каждые 2 дня в течение 2 недель. Они также показывают отдаленное действие внутрибрюшинной инъекции ПГ на реакцию селезенки через 2 недели. Микровезикулы спленоцитов количественно определяли либо с помощью ферментативного анализа протромбиназы, либо путем измерения концентрации их белков и РНК с помощью спектрофотометрии, а долю нейтрофилов определяли с помощью проточной цитометрии33,38 в суспензии спленоцитов (разделы 2-4 Дополнительного файла 1 и Дополнительный рисунок 2).
Масса селезенки и количество клеток увеличиваются после 2 недель инъекции IP в P. gingivalis
У молодых взрослых мышей инъекция ПГ приводит к значительному увеличению массы селезенки в 2,6 раза через 2 недели, вероятно, из-за иммунного ответа. Действительно, общее количество спленоцитов также было увеличено в 2,3 раза (рис. 2, n = 5 мышей при каждом условии, p < 0,0001 по Т-критерию Стьюдента).
Жизнеспособность спленоцитов не нарушается при 2-недельном введении P. gingivalis
Одинаковые показатели жизнеспособности были измерены между обработанными и необработанными мышами после выделения спленоцитов или через 24 ч после культивирования клеток. Тем не менее, когда исходный процент живых клеток при t0 был ниже 76%, жизнеспособность снижалась в обеих группах на ~50% через 24 ч. (см. Ctl 1-3, Таблица 1, в качестве примера). И наоборот, независимо от состояния животного, 24-часовое восстановление усиливалось, когда доля живых клеток достигала 90% или более при t0, что указывает на решающую роль первых этапов изоляции (Рисунок 3).
Количество нейтрофилов спленоцитов увеличивается у мышей, которым вводили P. gingivalis
После двойного окрашивания нейтрофилы были идентифицированы с помощью проточной цитометрии как Mac1+ и LYG-6-(Gr1)+ (см. Таблицу материалов и раздел 4 в Дополнительном файле 1). В ответ на ПГ количество нейтрофилов в селезенке значительно увеличивалось в 40 раз сразу после выделения клеток (t0, 4,8% ± 0,6 против 0,86% ± 0,06). Тем не менее, стоит учесть, что после 24 ч культивирования доля нейтрофилов в суспензии спленоцитов увеличивается с 4,8% ± 0,6 до 14,67% ± 2,02 (рис. 4).
У мышей, инфицированных P. gingivalis, увеличивается выделение МВ из спленоцитов
Следуя протоколу, мы доказали, что выделенные спленоциты выделяют больше MV при воздействии ПГ-инфекции на мышей. Для сравнения, в контрольной группе и в контрольном анализе, МВ, выделяемые в надосадочной жидкости, были примерно в три раза увеличены у мышей, получавших ПГ-инъекции, с использованием либо анализа с помощью протромбиназы, который относится к общей поверхности прокоагулянтных анионных фосфолипидов, переносимых SMV (рисунок 5A), либо содержания белка в SMV, измеренного с помощью спектрофотометрии (рисунок 5B), либо содержания РНК SMV, оцененного с помощью спектрофотометрии (рисунок 5C, n = 5, протромбиназа: p = 0,002; содержание белка: p = 0,003; содержание РНК, p = 0,008, по T-критерию Стьюдента). Более высокая степень складного диапазона была получена с помощью анализа протромбиназы, который показал очень низкий фон.
Интересно, что корреляция может быть установлена между содержанием белка SMV и SMV, измеренным с помощью анализа протромбиназы (дополнительный рисунок 3). Кроме того, распределение SMV по размерам не варьировалось, как было определено в предварительных экспериментах (дополнительный рисунок 4), сравнивающих SMV мышей, стимулированных и нестимулированных PG (средний диаметр 193 нм против 189 нм). Эти значения диаметра близки к значениям SMV, выделенных из спленоцитов крыс в ответ на 24-часовую инкубацию с ЛПС (5 мкг/мл) или ацетатом миристата форбола (25 нг/мл) и ионофором (1 мкМ) (средний диаметр 222 нм против 212 нм в контроле)11 (дополнительный рисунок 5). Кроме того, содержание белка в SMV может быть оценено с помощью вестерн-блоттинга, который позволяет охарактеризовать специфические цитоплазматические или мембранные белки, преимущественно экспортируемые в SMV (дополнительный рисунок 5).
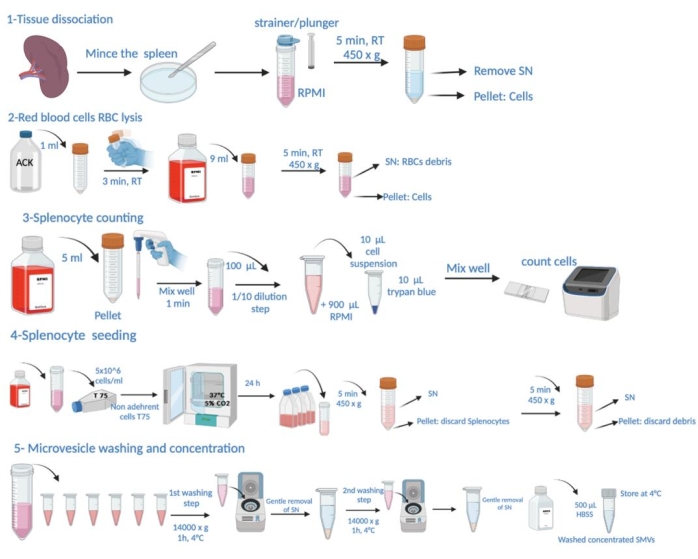
Рисунок 1: Схематическое изображение этапов протокола. Он состоит из вскрытия тканей, лизиса эритроцитов (эритроцитов), подсчета спленоцитов, посева, забора микровезикул из надосадочной жидкости, промывания и определения концентрации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Инъекция P. gingivalis значительно увеличивает массу селезенки (А) и количество спленоцитов (В). CTL: необработанные мыши, IP: мыши, получавшие инъекцию PG в течение 2 недель. Данные выражаются в виде среднего значения ± SEM. n = 5: ***: p < 0,0001 и 0,0005 соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Жизнеспособность спленоцитов снижается через 24 ч после посева спленоцитов, в то время как инъекция P. gingivalis не изменяет жизнеспособность клеток. CTL: необработанные мыши, IP: мыши, которым вводили PG в течение 2 недель, t0: жизнеспособность измерялась сразу после выделения, t24: через 24 ч посева. Данные выражаются как среднее значение ± SEM. n = 5, ***: p < 0,0001 по T-критерию Стьюдента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
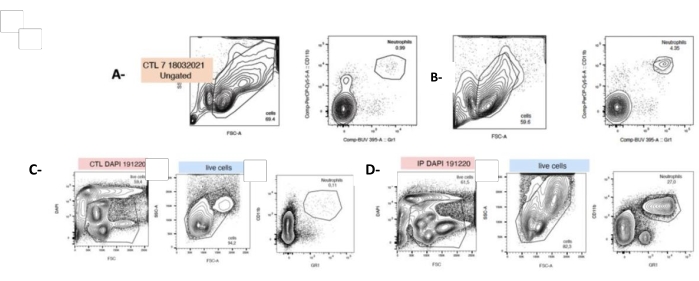
Рисунок 4: Инъекция P. gingivalis увеличивает количество нейтрофилов при t0 и через 24 ч после культивирования клеток. Клетки были только что выделены из собранной селезенки и помечены флуоресцентными антителами, направленными против гранулоцитов (LyG-6 Gr1) или нейтрофилов (LY6-C) и идентифицированы в воротах CD11b+ , которые разграничивают моноциты, гранулоциты и нейтрофилы. Нейтрофилы были идентифицированы как LY6-C+, CD11b+ и LYG-6 Gr1 с низким уровнем. Репрезентативные графики, показывающие SSC/FSC и CD11b+, а также двойное окрашивание LYG-6 Gr1 для каждого условия при t0 (A,B) или через 24 часа после посева (C,D). А,С: спленоциты мышей без лечения; B,D: спленоциты мышей, подвергшихся инъекции P. gingivalis. FSC: Прямой разброс; SSC: боковой разброс; CTL: мыши, не подвергшиеся воздействию. n = 5, ***: p < 0,0001, 10000 событий, полученных на выборку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: P. gingivalis способствует усиленному выделению спленоцитов MV после посева через 24 часа. Спленоциты были выделены у инфицированных P. gingivalis и контрольных мышей и культивировались в течение 24 ч, а SMV измеряли с помощью различных анализов. Черные полосы: необработанные мыши (CTL), серые полосы (IP): мыши, подвергшиеся инъекции P. gingivalis в течение 2 недель. A: Количественное определение с помощью анализа протромбиназы, B: концентрация белка в интактных SMV, определенная с помощью спектрофотометрии, C: содержание РНК в SMV, определенное с помощью спектрофотометрии. Данные выражаются как среднее значение ± SEM. n = 5, **: p < 0,0001, по T-критерию Стьюдента. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Состояние животного | Масса селезенки | Количество спленоцитов | Жизнеспособность (%) | Жизнеспособность (%) |
| после выделения клеток | ||||
| (мг) | (106 ячеек) | Через 24 ч культивирование клеток | ||
| (т0) | ||||
| Ctl 1 | 108 | 25 | 75 | 24 |
| Ctl 2 | 112 | 55 | 70 | 26 |
| Ctl 3 | 118 | 52 | 73 | 26 |
| Ctl 4 | 83 | 38 | 91 | 46 |
| КТЛ 5 | 78 | 55 | 96 | 46 |
| ИП 1 | 243 | 150 | 91 | 43 |
| ИП 2 | 250 | 138 | 93 | 46 |
| ИП 3 | 283 | 85 | 90 | 46 |
| ИП 4 | 270 | 100 | 91 | 43 |
| ИП 5 | 300 | 125 | 91 | 43 |
Таблица 1: Сравнение показателей жизнеспособности спленоцитов у обработанных и необработанных мышей после выделения спленоцитов.
Дополнительный рисунок 1: Как прокоагулянтные МВ являются прокоагулянтами? Для получения подробной информации см. Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 2: Анализ протромбиназы на основе захвата микрочастиц (МП). Для получения подробной информации см. Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 3: График корреляции между измерениями SMV с помощью анализа протромбиназы и спектрофотометрического анализа белков у мышей, не получавших лечения, или мышей, получавших P. gingivalis . Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 4: Анализ распределения по размерам SMV, выделенных из мышей (A) и спленоцитов крыс (B). Суспензию SMV получали из селезенки необработанных мышей (контрольных MVs) или лиц, подвергшихся повреждению десен без LIG MV или с местным добавлением P. gingivalis (LIG-PG MVs). СМВ у крыс собирали в надосадочной жидкости изолированных спленоцитов, подвергавшихся 24-часовой стимуляции ЛПС (ЛПС МВ) или ПМА (ПМА МВ), как описано в другом месте37. Mean dia: Средний диаметр; Диаметр моды: медианное значение диаметра. Измерения проводились с использованием 400 нанопор для оценки наибольшего диапазона распределения по размерам. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный рисунок 5: Идентификация содержания белка МВ из спленоцитов крыс, выделенных от молодых крыс, методом вестерн-блоттинга. Подробнее см. Дополнительный файл 1. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 1: Подробная информация об экспериментальных процедурах и пояснения к дополнительным рисункам 1,2,5. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Настоящее исследование подтверждает, что селезенка является основным и надежным источником МВ с физиологической значимостью по сравнению с другими источниками, такими как кровь, ограниченного объема у мышей. При условии соблюдения мер предосторожности метод прост в настройке и не требует дорогостоящего оборудования. Поскольку альтернативного способа, кроме оценки in vivo , не существует, нынешняя модель представляется ценным методом изучения влияния про-лекарств на выделение MV. Важно отметить, что представленный здесь стандартизированный протокол забора микровезикул селезенки (SMV) мышей должен соответствовать неудовлетворенным потребностям исследования in vivo по контролю SMV-опосредованных эффектов, в конечном итоге у сконструированных мышей после инъекции или назального инстилляции.
Настоящий метод также показывает, что SMV являются подходящими доклиническими инструментами для исследования отдаленных эффектов местных инфекций, таких как инфекция P. gingivalis . IP. Действительно, при использовании нескольких подходов были выявлены значительные различия между SMV, высвобожденными из P. gingivalis, и Были измерены животные, не получавшие лечения, что свидетельствует об отдаленном эффекте местной инъекции IP, обнаруживаемом уже через 2 недели. Предварительные данные, полученные в нашей лаборатории с использованием других удаленных участков инфекции P. gingivalis , подтвердили, что P. gingivalis может инициировать 1,7-кратное повышение SMV уже на 7-й день после заражения.
Также было отмечено, что отдаленные эффекты, вызванные P. gingivalis, были подтверждены анализом селезенки со значительными вариациями веса, жизнеспособности клеток и общего количества. Кроме того, P. gingivalis вызвал 6,5-кратное увеличение количества нейтрофилов селезенки при измерении методом иммуноокрашивания сразу после выделения спленоцитов (t0). Соответственно, вариации профиля происхождения SMV-клеток указывают на выпадение родительских клеток, вызванное исходным состоянием животного.
Поскольку SMV, высвобождаемые в надосадочной жидкости культур спленоцитов в течение 24 ч, были увеличены в три раза при выделении от мышей, которым вводили IP, они являются надежными биомаркерами дистанционной активации селезенки P. gingivalis, что делает их возможными инструментами для мониторинга фармакологического контроля.
Культура спленоцитов in vitro может быть выполнена с использованием 10% FBS, истощенных или не истощенных экзосом. В текущих экспериментах не наблюдалось никаких различий, и вариации между необработанными спленоцитами оставались обнаруживаемыми в одинаковой степени при обоих типах FBS.
В данной процедуре продолжительность в 2 недели не привела к значительным изменениям массы селезенки у мышей, не получавших лечения. Тем не менее, важно иметь в виду, что масса селезенки может меняться с возрастом, как сообщалось ранее у ряда контрольных крыс молодого, старого и среднего возраста. 1 В таком случае количественное определение SMV должно быть выражено в виде отношения количества клеток.
Данная методика была оптимизирована для мышиной модели и пригодна для дальнейших исследований трансгенных мышей. Несмотря на то, что основным недостатком мышиной модели является малая масса селезенки по сравнению с крысами33, описанные здесь процедуры выделения спленоцитов и SMV предотвращают повреждение и потерю клеток, в то время как все загрязняющие эритроциты полностью отбрасываются от них. Промывание имеет решающее значение для хорошей очистки спленоцитов и должно выполняться осторожно, не более 1 мл буфера для лизиса ACK на селезенку в 9 мл RPMI, чтобы обеспечить обширную элиминацию эритроцитов. Этот шаг можно повторять до тех пор, пока гранулы не станут белыми. Эта процедура не позволяет исследовать моноциты и в таком случае должна быть адаптирована для адгезивных клеток.
После 24 ч культивирования концентрация SMV, измеренная в надосадочной жидкости клеточных культур, отражает баланс между генерацией MV и повторным захватом MV культивируемыми спленоцитами. Поэтому в адаптированных вариантах вышеуказанной методики особое внимание необходимо уделять наличию клеток с профессиональной или вспомогательной фагоцитарной активностью (моноцитов, эндотелиальных клеток и т.д.), и соответственно следует тщательно устанавливать кинетику высвобождения SMV в надосадочной жидкости.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы выражают признательность Клодин Эбель (Claudine Ebel) из Service commun de cytométrie en flux (Institut de Génétique et de Biologie Moléculaire et Cellulaire, Strasbourg) за экспертную помощь и проведение комплексного анализа проточной цитометрии селезенки и Али Эль Хабхабу (Ali El Habhab) за начальное обучение по мечению клеток селезенки крыс. Дениз Карагёз помогал в раскопках, сборе литературы. Эта работа была частично поддержана двумя грантами ANR COCERP (N°A17R417B), ENDOPAROMP (N°ANR-17-CE17-0024-01).
Материалы
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
Ссылки
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669(2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21(2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778(2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356(2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197(2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215(2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898(2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45(2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734(2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.
