Method Article
בידוד של מיקרו-שלפוחיות טחול במודל עכברי של זיהום חיידקי תוך-צפקי
In This Article
Summary
מיקרו-שלפוחיות הנשפכות מקרום הפלזמה פועלות כאפקטורים תאיים. מיקרו-שלפוחית הטחול (SMVs) הם סמנים חלופיים למצבים פתופיזיולוגיים. בחולדות ועכברים, תכולת ה-SMV ותכונותיה מאפיינים הזדקנות או דלקת ומשתנים על ידי טיפולים ציטו-פרוטקטיביים, מה שהופך אותם לכלי ניטור רב ערך אך שופע למחקר פרה-קליני.
Abstract
מיקרו-שלפוחיות (MVs) הן שברים תת-מיקרוניים המשתחררים מקרום הפלזמה של תאים מופעלים הפועלים כאפקטורים תאיים פרו-דלקתיים ופרו-קרישיים. בחולדות, MV של הטחול (SMVs) הם סמנים חלופיים למצבים פתופיזיולוגיים. מחקרי מבחנה קודמים הראו כי Porphyromonas gingivalis (P. gingivalis), פתוגן חניכיים עיקרי, מאפשר את נשירת האנדותל ואפופטוזיס בעוד שליפופוליסכריד (LPS) מעדיף נשירה של מיקרו-שלפוחיות שמקורן בטחול (SMVs). מחקרי in vivo הראו היתכנות של בקרה פרמקולוגית על שפיכת SMV. הפרוטוקול הנוכחי קובע נוהל סטנדרטי לבידוד SMVs טחול ממודל הזיהום החריף בעכברים P . gingivalis . זיהום P. gingivalis הושרה בעכברים צעירים C57BL/6 על ידי הזרקה תוך צפקית (שלוש זריקות של 5 x 107 חיידקים בשבוע). לאחר שבועיים נאספו הטחולים, נשקלו ונספרו הטחולים. SMVs בודדו וכומתו על ידי מבחני חלבון, RNA ופרותרומבינאז. כדאיות התאים הוערכה על ידי צבעי אי-הכללה של פרופידיום יודיד או טריפאן כחול. לאחר מיצוי הטחול, ספירת נויטרופילים הושגה על ידי זרימה ציטומטרית לאחר 24 שעות של תרבית טחול. בעכברים שהוזרקו על ידי P. gingivalis, נצפתה עלייה של פי 2.5 במשקל הטחול ועלייה של פי 2.3 בספירת הטחול, בעוד שספירת הנויטרופילים גדלה פי 40. כדאיות התאים של טחול מעכברים שהוזרקו על ידי P. gingivalis נעה בין 75%-96% וירדה ב-50% לאחר 24 שעות של תרבית ללא כל הבדל משמעותי בהשוואה לביקורת שלא נחשפה. עם זאת, טחול מעכברים שהוזרקו משיל כמויות גבוהות יותר של MV על ידי בדיקת פרותרומבינאז או מדידות חלבון. הנתונים מראים כי SMVs פרו-קרישים הם כלים אמינים להערכת תגובה מוקדמת של הטחול לזיהום תוך-צפקי P. gingivalis .
Introduction
מיקרו-שלפוחיות (MVs), המכונים גם מיקרו-חלקיקים או אקטוזומים, הם שברי קרום פלזמה בקוטר של 0.1-1.0 מיקרומטר המשתחררים בנוזלי הגוף ובחלל החוץ-תאי בתגובה לגירויים תאיים שונים. MVs שזוהו לראשונה כאבק טסיות דם החושף פוספוליפידים פרוקו-קרישיים, בעיקר פוספטידילסרין (PSER), מהווים משטח נוסף להרכבת קומפלקסי קרישת הדם 1,2. תפקיד המפתח של MV במחזור כאפקטורים פרו-קרישים הוכח בחולים עם תסמונת סקוט2, מחלה גנטית נדירה המובילה לחשיפה לקויה של PSER ודימום (איור משלים 1). MV נחקרו בהרחבה כסמנים ביולוגיים במחזור הדם של סיכון פקקתי במחלות כרוניות הקשורות להפרעות לב וכלי דם כגון סוכרת, מחלת כליות כרונית, רעלת הריון ויתר לחץ דם 3,4. הם מוכרים כיום כאפקטורים תאיים אמיתיים בנוזלים או ברקמות איברים כמו שריר הלב1. מכיוון שהם מעבירים חלבונים פעילים, שומנים ו-miRNA, הם מווסתים מרחוק תגובות כלי דם כגון המוסטזיס, דלקת, אנגיוגנזה של כלי הדם וצמיחת כלי דם או עיצוב מחדש של רקמות5.
בעוד שמחקרים קליניים בוחנים את ערך הפרוגנוזה של MVs לגבי גורמי סיכון, MVs המבודדים מהנוזלים או הרקמות של המטופל מאפשרים הערכה ex vivo של תכונות האפקטור שלהם6. פענוח המנגנונים השולטים בביוגנזה של MV ויכולות הצלבה מושג בדרך כלל במודלים של תרביות תאים לזיהוי מולקולות פעילות שנחשפו או עטופות בתוך ה-MV והאיתות שלהן במורד הזרם. אינטראקציות ה-MV עם תאי המטרה יהיו תלויות בקשירת חלבון/חלבון ממברנה, כאשר קיימים ליגנדים נגדיים מתאימים, ו/או היתוך שומנים7.
בתנאים פיזיולוגיים, MV המסתובבים בפלזמה מקורם בעיקר בתאי כלי דם, כפי שזוהו על ידי סמני התמיינות אשכול השושלת (CD)8,9. עם זאת, בפתולוגיה, במיוחד בסרטן10 ודחיית שתל11,12, MV נשפכים מהרקמה הפגועה ונושאים מאפיינים מזיקים של קרישה ופרו-דלקת. אלה מתגלים במחזור המערכתי, מה שהופך אותם לבדיקות שימושיות לניטור טיפולי הגנה או התחדשות, ומטרות פרמקולוגיות אפשריות13. מכיוון ש-MV מסתובבים כמאגר אחסון דינמי המשקף הומאוסטזיס של כלי הדם ותאי הרקמה בבריאות ובחולי, יש לחקור הבנה טובה יותר של פעולתם מרחוק גם in vivo, לאחר הזרקת IV או החדרת אף בבעלי חיים קטנים14,15. ואכן, MV נחשבו לתורמים עיקריים למסלולים המורכבים המצמדים דלקת מוגזמת ופקקת16.
דלקת חניכיים היא מחלה דלקתית ממקור זיהומי הפוגעת ברקמות תומכות שיניים17,18 וקשורה לסיכון פקקתי. הוא מאופיין בדימום חניכיים, הרס עצם המכתשית, ניידות שיניים ובסופו של דבר יכול להוביל לאובדן שיניים. דלקת חניכיים נפוצה מאוד ברחבי העולם ומשפיעה על יותר מ-50% מהאוכלוסייה, כאשר 11% מציגים צורה חמורהשל 19. דלקת חניכיים נגרמת על ידי דיסביוזה חיידקית של הביופילמים התת-חניכיים, המקיימים תגובה דלקתית מחמירה הגורמת להרס רקמות20. במהלך העשור האחרון, דלקת חניכיים נקשרה למחלות מערכתיות כגון הפרעות לב וכלי דם, סוכרת ודלקת מפרקים שגרונית. ההסברים האפשריים הם פעולת הפתוגנים החניכיים מרחוק ו/או הדלקת המערכתית המוגברת המתווכת על ידי ציטוקינים פרו-דלקתיים כגון אינטרלוקין (IL-1, IL-6) ו-TNF-α21,22.
בין פתוגנים הקשורים להופעת דלקת חניכיים והתפתחותה, Porphyromonas gingivalis (P. gingivalis)23 נמצא ברוב הנגעים החמורים הקוצרים מספר גורמי אלימות, כולל ליפופוליסכריד (LPS)24 הגורמים לתגובות דלקתיות בתיווך קולטן דמוי טול (TLR)25 וגיוס נויטרופילים ולויקוציטים פולימורפו-גרעיניים (PMNs) באתר ההדבקה הראשונית26. ה-LPS מ-P. gingivalis מפעיל TLR-4 או TLR-2, מה שמקל על זיהוי חיסוני והתחמקות מהישרדות חיידקים27. ברמת כלי הדם, הפעלת TLR2 על ידי LPS קשורה לאימונוטרומבוזה. היכולת הייחודית של P. gingivalis לעורר איתות TLR-2 בעוד שזיהוי תלוי TLR-4 נפגע משמעותית מעדיפה זיהום מתמשך בדרגה נמוכה28,29.
נהלים in vivo לחקר תגובות MV לפתוגן בדרגה נמוכה זיהום כרוני ומתמשך הם נדירים. גישות מתודולוגיות למיצוי MV טיסולרי מתוארות בצורה גרועה בספרות ובדרך כלל נוגעות לקצירת MVs מרקמות פתולוגיות כמו גידולים מוצקים, סטיאטוזיס בכבד, פלאק עורק או שתלים 11,29,30, בעוד שהטחול חש חיידקים ווירוסים בזרם הדם. הוא גם מאחסן אריתרוציטים, טסיות דם, לימפוציטים, מונוציטים, בזופילים ואאוזינופילים המעורבים בתגובה החיסונית. גרנולוציטים כמו נויטרופילים מהעיסה האדומה מייצרים גם מיני חמצן תגובתיים (ROS) ופרוטאזות המשמידים פתוגנים ומונעים התפשטות זיהום31,32. באופן מדהים, ולמיטב ידיעתנו, MV בטחול אינו נחקר בהקשר של עלבונות רקמות הנגרמים על ידי פתוגנים. קיים צורך עולמי שלא נענה לחקור את הווריאציות של MV טיסולרי בפיזיופתולוגיה.
נתוני מבחנה מהמעבדה שלנו הראו כי LPS גורם לנשירה של MVs פרו-קרישיים מטחולת חולדות, אשר בתורם מעודדים הזדקנות של תאי אנדותל כליליים מתורבתים ופנוטיפ אנדותל פרו-דלקתי ופרו-דלקתיעוקב 11. היתכנות הבקרה הפרמקולוגית של MVs הטחול הוכחה עוד יותר לאחר טיפול בבעל החיים בפורמולה אופטימלית של אומגה 3. הפגיעה האוראלית של חולדות בגיל העמידה ובגיל העמידה נמצאה כמגנה הן מפני שפיכת MV פרוקו-קרישה מהטחול והן מפני תכונותיהם המזיקות לכיוון האנדותל הכלילי33.
בהשוואה לדם, הטחול מציע את היתרון בהיותו מקור חשוב ללויקוציטים אצל אדם אחד. בנוסף, לאחרונה הוצע ציר טחול-לב 3,34, מה שהופך את הטחול לתורם אפשרי לסיכון הקרדיווסקולרי הקשור לזיהום בעל עניין מועיל לבקרה פרמקולוגית. הערכת תכונות ה-SMV או שחרורם היא המפתח להבנת תגובות הנגרמות על ידי פתוגנים או דלקתיות. מעניין שניתן להשיג זאת בבעלי חיים מטופלים ובמודלים פיזיופתולוגיים שונים (גיל, יתר לחץ דם, סוכרת). ואכן, על ידי השוואה בין חולדות בגיל העמידה לחולדותבגיל 33, ניתן להוכיח את ההבדלים בתכונות הטחול MV ובשחרורו בעקבות תרבית טחול פשוטה של 24 שעות.
בהתחשב בעדויות לעיל לשינוי תכונות האפקטור של MV טחול עם המצב הפיזיופתולוגי והיתכנות הבקרה התרופתית שלהם בחולדות, מתואר כאן פרוטוקול סטנדרטי לבידוד MV של טחול עכבר. ההליך יתאים יותר לחקירות מעמיקות של מנגנוני in vivo התומכים בהשפעות בתיווך SMV, בסופו של דבר בעכברים מהונדסים. ההליך נקבע בעכברי C57BL/6 באמצעות זיהום תוך-צפקי מקומי על ידי P. gingivalis, כדי לבסס הוכחה לפעולה מרחוק של הפתוגן על תכונות אפקטור MV של הטחול (SMV).
Protocol
כל פרוטוקולי הניסוי אושרו על ידי ועדת האתיקה המקומית (APAFIS#28745-2020121815051557) וטיפול בבעלי חיים של אוניברסיטת הבית ושל INSERM. עכברים צעירים זכרים C57BL/6, בני 6-8 שבועות, שימשו לניסויים. עכברים נבדקו באופן קבוע כדי להעריך כאב ומתח, ומשקלם נוטר מדי יום. אלא אם צוין אחרת, כל חוצצי המיצוי והתמיסות חייבים להיות סטריליים ובטמפרטורת החדר.
1. הכנת בעלי חיים
- יש לתת לעכברים שש זריקות תוך-צפקיות של P. gingivalis (PG) כל יומיים למשך שבועיים (שלוש זריקות של 5 x 107 חיידקים בשבוע, קובץ משלים 1).
- הרדמו את העכברים באמצעות שילוב של 100 מ"ג/ק"ג קטמין ו-10 מ"ג/ק"ג קסילזין.
- הקריבו את העכברים המורדמים וקצרו את הטחול לאחר הלפרוטומיה.
הערה: התנאים הספציפיים לזיהום P. gingivalis והקרבת בעלי החיים לקציר הטחול מפורטים בסעיף "ניסוי בבעלי חיים" בקובץ משלים 1. הייצוג הסכמטי של שלבי הפרוטוקול מוצג באיור 1.
2. מיצוי טחול
- בעזרת אזמל, טחנו את רקמת הטחול לפרוסות של ~1 מ"מ בצלחת פטרי שכבר מלאה ב-3 מ"ל RPMI המכילה אנטיביוטיקה (סטרפטומיצין (100 U/mL)/פניצילין (100 U/mL), Fungizone (250 מ"ג/מ"ל), L-גלוטמין (2 מ"מ)), ובתוספת 10% סרום בקר עוברי (FBS) (ראה טבלת חומרים).
- מעבירים את הפרוסות למסננת (ראה טבלת חומרים), המחוברת מראש לצינור פוליסטירן בנפח 50 מ"ל.
- השתמש בבוכנה של מזרק כעלי כדי לרסק את הרקמות על המסננת.
- שוטפים את המסננת עם מדיום RPMI (3 מ"ל).
- צנטריפוגה מתלה התא נשטף ב-450 x גרם למשך 5 דקות בטמפרטורת החדר והשליך את הסופרנטנט בזהירות על ידי זרימה חוזרת.
3. הסרת אריתרוציטים באמצעות הלם אוסמוטי
- הוסף 1 מ"ל של מאגר ACK (ראה טבלת חומרים), ערבב היטב, דגר במשך 3 דקות בטמפרטורת החדר ונער בעדינות על ידי סיבוב ידני.
- מדללים על ידי הוספת 9 מ"ל RPMI ומערבבים היטב באמצעות שאיפה וזרימה חוזרת.
- צנטריפוגה בחום של 450 x גרם למשך 5 דקות בטמפרטורת החדר.
- השליכו את ה-supernatant על ידי שאיפה וזרימה חוזרת, והשעו מחדש את הגלולה ב-5 מ"ל של מדיום RPMI.
- מערבבים בעדינות (שאיפה/זרימה חוזרת) ובסופו של דבר מסירים כל פסולת ליפידית על ידי פיפטינג או שימוש במסננת.
4. התאמת ריכוז הטחול המבודד
- מלאו מיקרו-צינור של 1.5 מ"ל המכיל 900 מיקרוליטר של RPMI.
- בעזרת מיקרופיפטה, קחו 100 מיקרוליטר מהמתלה הסלולרי, הוסיפו למיקרו-צינור של 1.5 מ"ל המכיל 900 מיקרוליטר של מדיום RPMI, וערבבו היטב.
- מעבירים 10 מיקרוליטר מהתאים המדוללים למיקרו-צינור, מוסיפים 10 מיקרוליטר מצבע ההדרה הכחול של טריפן ומערבבים היטב.
- הנח 10 מיקרוליטר של התמיסה (שלב 3.3) בשקופית הספירה של מונה התאים האוטומטי (ראה טבלת חומרים) וקבע את ספירת התאים.
הערה: תוכנת ההתקן נותנת שני ערכים: מספר התא הכולל ומספר התא החי ואחוז. - התאם את ריכוז התאים החיים ל-3 או 5 x 106 תאים/מ"ל (Vמקסימום = 20 מ"ל; הקיבולת הכוללת המקסימלית היא 100 x 106 תאים/מ"ל).
- זרעו את התאים בבקבוק של 75 מ"ל המכיל RPMI.
- דגרו את הבקבוק אנכית בחממה לחה בטמפרטורה של 37 מעלות צלזיוס למשך 24 שעות.
זהירות: טריפן כחול הוא חומר מוטגני ומסרטן35,36. הקפד ללבוש כפפות בזמן הספירה, אפילו מחוץ למכסה המנוע. השליכו מיד טיפים ונוזלים למיכלים ושטפו את משטח הספסל.
הערה: אם התאים שנאספו הם פחות מ-50 x 106, השתמש בבקבוק תרבית של 25 מ"ל. מספר התא לא אמור להשתנות בהרבה מאדם אחד למשנהו. אחוז התאים החיים בדרך כלל עולה על 80% בשלב זה.
5. בידוד של מיקרו-שלפוחיות טחול
- לאחר 24 שעות, שפכו את תכולת הבקבוק לצינור פוליפרופילן או פוליסטירן בנפח 50 מ"ל.
- צנטריפוגה ב-450 x גרם למשך 15 דקות בטמפרטורת החדר להסרת תאים ופסולת.
- לאחר צנטריפוגה, שמור 100 מיקרוליטר של הסופרנטנט הראשון (SN1) למדידה סופית של ריכוז ה-MV הראשוני כדי לחשב את תפוקת הבידוד. שים לב לאמצעי האחסון SN1.
- צנטריפוגה את ה- SN1 ב 450 x גרם למשך 15 דקות בטמפרטורת החדר.
- השלך שוב את הגלולה והצנטריפוגה ב -450 x גרם למשך 15 דקות בטמפרטורת החדר. משוך במהירות ואסוף SN2 (שימו לב לעוצמת הקול).
- העבירו את SN2 למיקרו-צינורות של 1.8 מ"ל עם תחתית בצורת חרוט. שמור 100 מיקרוליטר של SN2 למדידה בסופו של דבר של ריכוז ה-MV הראשוני כדי לחשב את תפוקת הבידוד למקרה שיותר מדי פסולת תפגע בסופו של דבר במדידת MV ב-SN1.
- הוסף 5 מ"ל של מדיום RPMI לגלולה (תאים) וספור את הטחול.
הערה: ניתן לתקן את תרחיף התא גם לאפיון זרימה ציטומטרית ב-0.1% פרפורמלדהיד (ריכוז סופי)37. - צנטריפוגה SN2 ב-14,000 x גרם למשך שעה ב-4 מעלות צלזיוס ובסופו של דבר מקררים את הרוטור מראש על ידי הפעלת הרוטור הריק ב-4 מעלות צלזיוס. שלב זה מייצר SN3.
- משוך מיד את SN3 מכל מיקרו-צינור על ידי היפוך על צינור סטרילי יחיד של 50 מ"ל (מתחת למכסה המנוע). שים לב לאמצעי האחסון SN3.
- מערבבים בעדינות SN3 באמצעות פיפטה מתחת למכסה המנוע. שמור ציטוטים למדידות סופיות במתלה.
הערה: התמיסה התרוקנה כעת מ-MV אך מכילה את המתווכים והאקסוזומים המסיסים. - מגרדים כל מיקרו-צינור (סגור) על מתלה דוקרני כדי להעדיף מכנית את ההשעיה מחדש של ה-MV בגלולה.
- הוסף 200 מיקרוליטר של תמיסת המלח המאוזנת של האנק ללא Ca2+ ו-Mg2+ (HBSS) במיקרו-שפופרת הראשונה (ראה טבלת חומרים).
- השעו מחדש את גלולת ה-MV של הצינור הראשון על ידי מחזורי שאיפה/זרימה חוזרת עדינים (~10 פעמים) באמצעות מיקרופיפטה של 1 מ"ל. היזהר מאוד להימנע מקצף מכיוון שהדבר יקדם את חמצון השלפוחיות וחלקים אחרים בתרחיף.
- קצרו את 200 המיקרוליטר הראשונים של MV תלויים ושפכו אותם לצינור השני מעל הגלולה. מערבבים בעדינות כאמור לעיל, ואז יוצקים שוב לצינור השלישי ומערבבים בעדינות. המתלים הופכים עכורים יותר ויותר מצינור לצינור. סגור את הצינור השלישי.
- התחל את האיסוף של שלושת המיקרו-צינורות הבאים כאמור לעיל (שלב 4.14).
- אסוף את כל ה-MV התלויים במיקרו-צינור אספן יחיד (או שניים) (2 מ"ל עם תחתית בצורת חרוט). שמור 50 מיקרוליטר לחישוב הסופי של התשואה של שלב זה. שימו לב לנפח המתלים.
- צנטריפוגה את צינור הקולט ב-14,000 x גרם למשך שעה אחת ב-4 מעלות צלזיוס. שלב זה מייצר SN4.
- השליכו מיד את ה- SN4 (שפכו על צינור איסוף סופרנטנט). שמור על ציטוט של SN4 כדי לחשב את התשואה של שלב הטיהור ולהשעות בעדינות את הגלולה ב-500 מיקרוליטר של HBBS (ללא Ca2+ ו-Mg2+). שמור על מינון של 50 מיקרוליטר של הגלולה המושעה כדי לחשב את תפוקת הטיהור ולציין את נפחו.
- אחסן את הגלולה המושעה ב-4 מעלות צלזיוס למשך עד חודש לבדיקות פונקציונליות בתנאים סטריליים או ב-20 מעלות צלזיוס לבדיקות מבניות.
- חשב את תפוקת הטיהור (ראה הערה למטה) של כל שלב או את ההליך כולו על ידי מדידת ריכוז ה-MV בסופרנטנטים ו/או תרחיפי גלולה.
הערה: תפוקת טיהור (%): ([MV1] x נפח SN1) / ([MV4] x נפח מתלה סופי) x 100.
יש להסביר את התשואה הזו למספר הטחול המבודד מבקבוק התרבות ולספור אותו בשלב 4.4. תפוקת הטיהור של הניסוי הנוכחי היא ~70% החל מ-111 x 106 תאים ו-60 מ"ל של סופרנטנט.- העריכו את אובדן ה-SMV שנגרם על ידי ההליך על ידי מדידת ה-SMVs שנותרו בסופרנטנטים שהתרוקנו מ-SMV ומכילים בעיקר אקסוזומים (SN2 ו-SN4).
- מדוד את ריכוז ה-MV על ידי TRPS או בדיקת פרותרומבינאז38 לרגישות וסגוליות גבוהות.
זהירות: קצרו את ה-MV לאחר צנטריפוגה על ידי שפיכה מהירה הפוכה של הסופרנטנט. המתנה או שימוש במיקרו-צינורות בצורת U יגרמו לאובדן MV על דופן המיקרו-צינור. לעולם אל תשתמש במיקרופיפטה כדי להשליך את הסופרנטנט; ניתן לשאוב את הגלולה במקום. לעולם אל תעכב את התהליך לאחר עצירת הצנטריפוגה. צנטריפוגה במהירות יתר תגרום לזיהום של כדור ה-MV על ידי אקסוזומים.
הערה: מהירויות הצנטריפוגה ומשך הזמן מותאמים להעשרת MV עם זיהום מינימלי על ידי אקסוזומים. פרוטוקול זה אינו אמין לחקר MV מונוציטים/מקרופאגים של טחול מכיוון שתאים אלה יכולים לפגוציטים וללכוד במהירות את MVs39 שלהם. לא ניתן להשהות את הפרוטוקול ולהפעיל אותו מחדש מאוחר יותר בגלל אובדן תאים עקב כדאיות התא.
תוצאות
הנתונים שסופקו נותנים ייצוג מלא של ההליך כולו, תוך שימוש בשני מצבים עיקריים של בעלי חיים: ביקורת על עכברי C57BL/6 צעירים שלא טופלו וחבריהם לשגר שעברו שש זריקות PG תוך-צפקיות (IP) כל יומיים, למשך שבועיים. הם גם מראים את הפעולה מרחוק של הזרקת PG תוך-צפקית על תגובת הטחול לאחר שבועיים. מיקרו-שלפוחיות טחול כומתו על ידי בדיקה אנזימטית של פרותרומבינאז או על ידי מדידת החלבונים וריכוז ה-RNA שלהם על ידי ספקטרופוטומטרי, ושיעור הנויטרופילים נקבע על ידי זרימה ציטומטרית33,38 בתרחיף הטחול (סעיפים 2-4 בתיק משלים 1 ואיור משלים 2).
משקל הטחול ומספר התאים עולים לאחר שבועיים של הזרקת IP ב - P. gingivalis
בעכברים בוגרים צעירים, הזרקת ה-PG מובילה לעלייה משמעותית של פי 2.6 במשקל הטחול לאחר שבועיים, ככל הנראה עקב התגובה החיסונית. ואכן, ספירת הטחול הכוללת עלתה גם היא פי 2.3 (איור 2, n = 5 עכברים לכל מצב, p < 0.0001 על ידי מבחן Student's T).
חיוניות הטחול אינה נפגעת על ידי שבועיים של הזרקה ב-P. gingivalis
שיעורי כדאיות דומים נמדדו בין עכברים שטופלו ולא טופלו לאחר בידוד הטחול או 24 שעות לאחר תרבית תאים. עם זאת, כאשר האחוז ההתחלתי של תאים חיים ב-t0 היה מתחת ל-76%, הכדאיות הופחתה בשתי הקבוצות ב-~50% לאחר 24 שעות (ראה Ctl 1-3, טבלה 1, כדוגמה). לעומת זאת, וללא קשר למצב החיה, ההתאוששות של 24 שעות השתפרה כאשר שיעור התאים החיים הגיע ל-90% או יותר ב-t0, מה שמצביע על התפקיד המכריע של שלבי הבידוד הראשונים (איור 3).
ספירת הנויטרופילים של הטחול מוגברת בעכברים שהוזרקו על ידי P. gingivalis
לאחר צביעה כפולה, נויטרופילים זוהו על ידי ציטומטריית זרימה כ-Mac1+ ו-LYG-6-(Gr1)+ (ראה טבלת חומרים וסעיף 4 בקובץ משלים 1). בתגובה ל-PG, ספירת הטחול של הנויטרופילים גדלה באופן משמעותי פי 40 מיד לאחר בידוד התאים (t0, 4.8% ±-0.6 לעומת 0.86% ±-0.06). עם זאת, כדאי לקחת בחשבון שלאחר תרבית של 24 שעות, שיעור הנויטרופילים בתרחיף הטחול עולה מ-4.8% ±-0.6 ל-14.67% ±-2.02 (איור 4).
נשירת MV מטחול עולה בעכברים שנדבקו ב-P. gingivalis
בעקבות הפרוטוקול, הוכחנו שהטחול המבודד שחרר יותר MV כאשר עכברים היו חשופים לזיהום PG. לשם השוואה, לביקורת ולבדיקת המדידה, MVs שנשפכו בסופרנטנט שולשו בערך בעכברים שהוזרקו PG, תוך שימוש בזיהוי על ידי בדיקת פרותרומבינאז המתייחסת למשטח הכולל של פוספוליפידים אניונים פרו-קרישים הנישאים על ידי SMV (איור 5A), תכולת החלבון של SMVs שנמדדה על ידי ספקטרופוטומטריה (איור 5B), או תכולת ה-RNA של SMVs המוערכת על ידי ספקטרופוטומטריה (איור 5C, n = 5, פרותרומבינאז: p = 0.002; תכולת חלבון: p = 0.003; תכולת RNA, p = 0.008, לפי מבחן T של סטודנט). טווח הקיפול הגבוה יותר הושג באמצעות בדיקת פרותרומבינאז שהראתה רקע נמוך מאוד.
מעניין שניתן לקבוע מתאם בין תכולת החלבון של SMVs לבין SMVs שנמדדו על ידי בדיקת פרותרומבינאז (איור משלים 3). בנוסף, התפלגות גודל ה-SMV לא השתנתה כפי שנקבע בניסויים ראשוניים (איור משלים 4) המשווה SMV מעכברים מגורים PG וללא גירוי (קוטר חציוני 193 ננומטר לעומת 189 ננומטר). ערכי קוטר אלה קרובים לאלה של SMVs שבודדו מטחולות חולדות בתגובה לדגירה של 24 שעות עם LPS (5 מיקרוגרם/מ"ל) או Phorbol myristate אצטט (25 ננוגרם/מ"ל) ויונופור (1 מיקרומטר), (קוטר חציוני, 222 ננומטר לעומת ביקורת 212 ננומטר)11 (איור משלים 5). בנוסף, ניתן להעריך את תכולת החלבון של ה-SMVs על ידי כתם מערבי, המאפשר אפיון של חלבונים ציטופלזמיים או ממברניים ספציפיים המיוצאים באופן מועדף ל-SMVs (איור משלים 5).
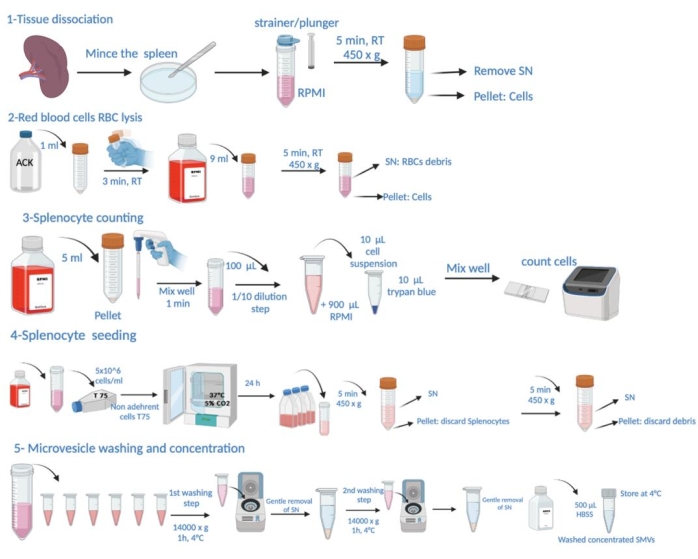
איור 1: ייצוג סכמטי של שלבי הפרוטוקול. זה מורכב מדיסקציה של רקמות, ליזה של כדוריות דם אדומות (RBC), ספירת טחול, זריעה, קציר מיקרו-שלפוחית מסופרנטנט, שטיפה וקביעת ריכוז. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: הזרקת IP של P. gingivalis משפרת משמעותית את משקל הטחול (A) ואת ספירת הטחול (B). CTL: עכברים לא מטופלים, IP: עכברים שעברו הזרקת PG למשך שבועיים. הנתונים מבוטאים כממוצע ± SEM. n = 5: ***: p < 0.0001 ו-0.0005, בהתאמה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: כדאיות הטחול מופחתת 24 שעות לאחר תרבית הטחול, בעוד שהזרקת IP של P. gingivalis אינה משנה את כדאיות התאים. CTL: עכברים לא מטופלים, IP: עכברים שעברו הזרקת PG למשך שבועיים, t0: כדאיות נמדדה מיד לאחר הבידוד, t24: לאחר תרבית של 24 שעות. הנתונים מבוטאים כממוצע ± SEM. n = 5, ***: p < 0.0001 על ידי מבחן Student's T. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
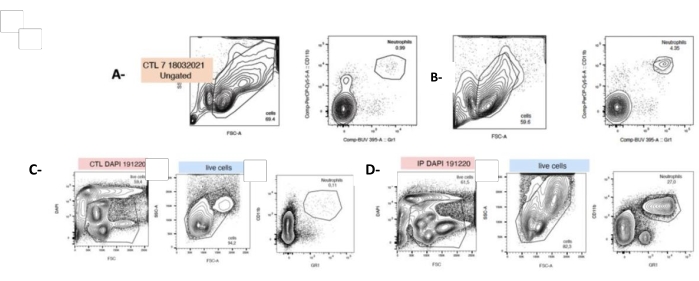
איור 4: הזרקת P. gingivalis מגדילה את ספירת הנויטרופילים ב-t0 ולאחר 24 שעות של תרבית תאים. התאים בודדו טריים מהטחול שנקטף וסומנו בנוגדנים פלואורסצנטיים המכוונים כנגד גרנולוציטים (LyG-6 Gr1) או נויטרופילים (LY6-C) וזוהו בשער CD11b+ התוחם מונוציטים, גרנולוציטים ונויטרופילים. נויטרופילים זוהו כ-LY6-C+, CD11b+ ו-LYG-6 Gr1 נמוך. עלילות מייצגות המציגות SSC/FSC ו-CD11b+, ו-LYG-6 Gr1 צביעה כפולה עבור כל מצב ב-t0 (A,B) או 24 שעות לאחר הזריעה (C,D). A,C: טחול עכברים לא מטופל; B,D: טחול מעכברים שעברו הזרקת IP של P. gingivalis. FSC: פיזור קדימה; SSC: פיזור צדדי; CTL: עכברים לא חשופים. n = 5, ***: p < 0.0001, 10000 אירועים שנרכשו לכל דגימה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 5: P. gingivalis מעדיף נשירת טחול MV מוגברת לאחר תרבית של 24 שעות. הטחול בודד מעכברים נגועים ב-P. gingivalis וביקורת ותורבו במשך 24 שעות ו-SMVs נמדדו על ידי בדיקות שונות. פסים שחורים: עכברים לא מטופלים (CTL), פסים אפורים (IP): עכברים שעברו הזרקת P. gingivalis במשך שבועיים. A: כימות על ידי בדיקת פרותרומבינאז, B: ריכוז החלבון של ה-SMVs השלמים שנקבע על ידי ספקטרופוטומטריה, C: תכולת RNA של SMVs שנקבעה על ידי ספקטרופוטומטריה. הנתונים מבוטאים כממוצע ± SEM. n = 5, **: p < 0.0001, על ידי מבחן T של התלמיד. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| מצב בעלי חיים | משקל הטחול | מספר הטחול | כדאיות (%) | כדאיות (%) |
| לאחר בידוד התאים | ||||
| (מ"ג) | (106 תאים) | לאחר 24 שעות תרבית תאים | ||
| (ט0) | ||||
| Ctl 1 | 108 | 25 | 75 | 24 |
| CTL 2 | 112 | 55 | 70 | 26 |
| Ctl 3 | 118 | 52 | 73 | 26 |
| CTL 4 | 83 | 38 | 91 | 46 |
| CTL 5 | 78 | 55 | 96 | 46 |
| IP 1 | 243 | 150 | 91 | 43 |
| כתובת IP 2 | 250 | 138 | 93 | 46 |
| איי פי 3 | 283 | 85 | 90 | 46 |
| כתובת IP 4 | 270 | 100 | 91 | 43 |
| איי פי 5 | 300 | 125 | 91 | 43 |
טבלה 1: השוואה בין שיעורי הכדאיות של הטחול בין העכברים שטופלו ולא טופלו לאחר בידוד הטחול.
איור משלים 1: כיצד MV פרו-קרישה הם פרו-קרישה? לפרטים, ראה קובץ משלים 1. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: בדיקת פרותרומבינאז מבוססת פרותרומבינאז מבוססת מיקרו-חלקיקים (MP). לפרטים, ראה קובץ משלים 1. אנא לחץ כאן להורדת קובץ זה.
תרשים משלים 3: עלילת מתאם בין מדידות של SMVs על ידי בדיקת פרותרומבינאז ועל ידי בדיקת חלבון ספקטרופוטומטרי בעכברים לא מטופלים או שטופלו ב-P. gingivalis . אנא לחץ כאן להורדת קובץ זה.
איור משלים 4: ניתוח התפלגות הגודל של SMV שבודדו מעכברים (A) וטחולות חולדות (B). ההשעיה של SMVs התקבלה מהטחול של עכברים לא מטופלים (Control MVs) או אנשים שנחשפו לנזק לחניכיים ללא LIG MVs או עם תוספת מקומית של P. gingivalis (LIG-PG MVs). SMVs מחולדות נאספו בסופרנטנט של טחולים מבודדים שהיו נתונים לגירוי של 24 שעות על ידי LPS (LPS MVs) או PMA (PMA MVs) כמתואר במקום אחר37. קוטר ממוצע: קוטר ממוצע; קוטר מצב: הערך החציוני של הקוטר. המדידות בוצעו באמצעות 400 ננו-נקבוביות כדי להעריך את טווח התפלגות הגודל הגדול ביותר. אנא לחץ כאן להורדת קובץ זה.
תרשים משלים 5: זיהוי תכולת החלבון של MV מטחולות חולדות שבודדו מחולדות צעירות על ידי כתם מערבי. לפרטים, ראה קובץ משלים 1. אנא לחץ כאן להורדת קובץ זה.
קובץ משלים 1: פרטים על הליכי הניסוי והסברים לאיורים משלימים 1,2,5. אנא לחץ כאן להורדת קובץ זה.
Discussion
המחקר הנוכחי מאשר כי הטחול הוא מקור עיקרי ואמין ל-MV עם רלוונטיות פיזיופתולוגית בהשוואה למקורות אחרים כמו דם, בנפח מוגבל בעכברים. בתנאי שננקטים אמצעי זהירות, השיטה קלה להתקנה ואינה דורשת ציוד יקר. מכיוון שאין דרך חלופית אחרת מלבד הערכה in vivo , נראה שהמודל הנוכחי הוא שיטה רבת ערך לחקר ההשפעה של פרו-תרופות על שפיכת MV. חשוב לציין, הפרוטוקול הסטנדרטי לקצירת מיקרו-שלפוחיות טחול עכבריות (SMVs) המוצג כאן אמור להתאים לצרכים הבלתי מסופקים למחקר in vivo של בקרת השפעות בתיווך SMV, בסופו של דבר בעכברים מהונדסים לאחר הזרקה או החדרה לאף.
השיטה הנוכחית מראה גם ש-SMV הם כלים פרה-קליניים רלוונטיים לחקירת השפעות מרחוק של זיהומים מקומיים, כמו זיהום IP של P. gingivalis . ואכן, באמצעות מספר גישות, הבדלים משמעותיים בין SMVs ששוחררו מ-P. gingivalis שטופלו לעומת P. בעלי חיים שלא טופלו נמדדו, מה שמרמז על השפעה מרחוק של הזרקת ה-IP המקומית, שכבר ניתנת לזיהוי לאחר שבועיים. נתונים ראשוניים מהמעבדה שלנו באמצעות אתרי הדבקה מרוחקים אחרים של P. gingivalis אישרו כי P. gingivalis עשוי ליזום עלייה של פי 1.7 ב-SMV כבר ביום השביעי לאחר ההדבקה.
כמו כן, נצפה כי ההשפעות המרוחקות הנגרמות על ידי P. gingivalis אושרו על ידי ניתוח טחול עם שינויים משמעותיים במשקל, כדאיות התאים והספירה הכוללת. יתר על כן, P. gingivalis גרם לעלייה של פי 6.5 בספירת הנויטרופילים בטחול כאשר נמדד על ידי צביעה חיסונית מיד לאחר בידוד הטחול (t0). בהתאם לכך, וריאציות של פרופיל המקור של תאי SMV יצביעו על נשירה של תאי הורים הנגרמת על ידי המצב הראשוני של החיה.
מכיוון ש-SMVs ששוחררו בסופרנטנט של תרביות טחול של 24 שעות שולשו כאשר בודדו מעכברים שהוזרקו IP, הם נראים כסמנים ביולוגיים אמינים של הפעלת טחול מרחוק על ידי P. gingivalis, מה שהופך אותם בסופו של דבר לכלים לניטור בקרה פרמקולוגית.
במבחנה, ניתן לבצע את תרבית הטחול באמצעות 10% FBS, מדולדל או לא מאקסוזומים. בניסויים הנוכחיים לא נצפו הבדלים, והבדלים בין הטחול הלא מטופל נותרו ניתנים לזיהוי באותה מידה עם שני סוגי ה-FBS.
בהליך הנוכחי, משך של שבועיים לא הוביל לשינויים משמעותיים במשקל הטחול בעכברים שלא טופלו. עם זאת, חשוב לזכור שמשקל הטחול עשוי להשתנות עם הגיל, כפי שדווח בעבר בסדרה של חולדות ביקורת צעירות, מבוגרות ובגיל העמידה. 1 במקרה כזה, כימות ה-SMV צריך להתבטא כיחס ספירת תאים.
ההליך הנוכחי מותאם למודל עכברים ומתאים לחקירות נוספות של עכברים טרנסגניים. למרות שהחיסרון העיקרי של מודל העכברים הוא משקל טחול קטן בהשוואה לחולדות33, נהלי בידוד הטחול וה-SMV המותאמים המתוארים כאן מונעים נזק ואובדן תאים, בעוד שכל האריתרוציטים המזהמים מושלכים במלואם. שטיפה חיונית לתפוקת טיהור טחול טובה ויש לבצע אותה בעדינות עם לא יותר מ-1 מ"ל של מאגר ליזה ACK לטחול ב-9 מ"ל של RPMI כדי לאפשר חיסול נרחב של כדוריות דם אדומות. ניתן לחזור על שלב זה עד שהכדור לבן. הליך זה אינו מאפשר חקירה של מונוציטים ויש להתאים אותו לתאים נצמדים במקרה כזה.
לאחר תרבית של 24 שעות, ריכוז ה-SMV שנמדד בסופרנטנטים של תרבית תאים משקף את האיזון בין יצירת MV ללכידה מחדש של MV על ידי הטחול המתורבת. לכן, בגרסאות מותאמות של ההליך הנ"ל, יש להקדיש תשומת לב מיוחדת לנוכחותם של תאים בעלי פעילות פגוציטים מקצועית או אביזרית (מונוציטים, תאי אנדותל וכו'), ויש לבסס בקפידה את הקינטיקה של שחרור ה-SMV בסופרנטנט בהתאם.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים אסירי תודה לקלודין אבל מהשירות המשותף לציטומטריה בשטף (Institut de Génétique et de Biologie Moléculaire et Cellulaire, שטרסבורג) על סיוע מומחה וגיבוש לניתוח ציטומטריית זרימה מורכבת של הטחול ולעלי אל חבהב להכשרה ראשונית על תיוג תאי טחול של חולדות. דניז קרגיוז עזר בחפירה באיסוף ספרות. עבודה זו נתמכה בחלקה על ידי שני מענקי ANR COCERP (N°A17R417B), ENDOPAROMP (N°ANR-17-CE17-0024-01).
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
References
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669(2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21(2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778(2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356(2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197(2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215(2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898(2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45(2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734(2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved