Method Article
Isolement de microvésicules spléniques dans un modèle murin d’infection bactérienne intrapéritonéale
Dans cet article
Résumé
Les microvésicules excrétées par la membrane plasmique agissent comme des effecteurs cellulaires. Les microvésicules de la rate (SMV) sont des marqueurs de substitution des conditions physiopathologiques. Chez les rats et les souris, le contenu et les propriétés du SMV caractérisent le vieillissement ou l’inflammation et sont modifiés par les traitements cytoprotecteurs, ce qui en fait un outil de surveillance précieux mais abondant pour la recherche préclinique.
Résumé
Les microvésicules (MV) sont des fragments submicroniques libérés par la membrane plasmique des cellules activées qui agissent comme des effecteurs cellulaires pro-inflammatoires et procoagulants. Chez le rat, les MV de la rate (SMV) sont des marqueurs de substitution des conditions physiopathologiques. Des études in vitro antérieures ont démontré que Porphyromonas gingivalis (P. gingivalis), un pathogène parodontal majeur, permet l’excrétion endothéliale et l’apoptose, tandis que le lipopolysaccharide (LPS) favorise l’excrétion des microvésicules dérivées des splénocytes (SMV). Des études in vivo ont montré la faisabilité d’un contrôle pharmacologique de l’excrétion du SMV. Le présent protocole établit une procédure normalisée pour isoler les SMV spléniques à partir du modèle d’infection aiguë murine à P. gingivalis . L’infection à P. gingivalis a été induite chez de jeunes souris C57BL/6 par injection intrapéritonéale (trois injections de 5 x 107 bactéries/semaine). Après deux semaines, les rates ont été recueillies, pesées et les splénocytes ont été comptés. Les SMV ont été isolés et quantifiés par des tests de protéines, d’ARN et de prothrombinase. La viabilité cellulaire a été évaluée à l’aide de colorants d’exclusion à l’iodure de propidium ou au bleu de trypan. Après l’extraction des splénocytes, le nombre de neutrophiles a été obtenu par cytométrie en flux après 24 h de culture de splénocytes. Chez les souris injectées de P. gingivalis, une augmentation de 2,5 fois du poids de la rate et une augmentation de 2,3 fois du nombre de splénocytes ont été observées, tandis que le nombre de neutrophiles a été multiplié par 40. La viabilité cellulaire des splénocytes de souris injectées de P. gingivalis variait de 75 % à 96 % et diminuait de 50 % après 24 h de culture, sans aucune différence significative par rapport aux témoins non exposés. Cependant, les splénocytes de souris injectées libèrent des quantités plus élevées de MV par dosage de la prothrombinase ou par mesure des protéines. Les données démontrent que les SMV procoagulants sont des outils fiables pour évaluer une réponse précoce de la rate à l’infection intrapéritonéale à P. gingivalis .
Introduction
Les microvésicules (MV), également appelées microparticules ou ectosomes, sont des fragments de membrane plasmique d’un diamètre de 0,1 à 1,0 μm libérés dans les fluides corporels et l’espace extracellulaire en réponse à divers stimuli cellulaires. D’abord identifiés comme des poussières plaquettaires exposant des phospholipides procoagulants, principalement de la phosphatidylsérine (PSer), les MV constituent une surface supplémentaire pour l’assemblage des complexes de coagulation sanguine 1,2. Le rôle clé des MV circulants en tant qu’effecteurs procoagulants a été démontré chez des patients atteints du syndromede Scott 2, une maladie génétique rare qui entraîne une exposition dysfonctionnelle au PSer et des saignements (Figure supplémentaire 1). Les MV ont été largement étudiés en tant que biomarqueurs circulants du risque thrombotique dans les maladies chroniques associées à des troubles cardiovasculaires tels que le diabète, les maladies rénales chroniques, la prééclampsie et l’hypertension 3,4. Ils sont actuellement reconnus comme de véritables effecteurs cellulaires dans les fluides ou les tissus d’organes comme le myocarde1. Parce qu’ils transportent des protéines actives, des lipides et des miARN, ils modulent à distance les réponses vasculaires telles que l’hémostase, l’inflammation, l’angiogenèse vasculaire et la croissance vasculaire ou le remodelage tissulaire5.
Alors que les études cliniques examinent la valeur pronostique des MV concernant les facteurs de risque, les MV isolés dans les fluides ou les tissus du patient permettent d’évaluer ex vivo leurs propriétés effectrices6. Le déchiffrage des mécanismes régissant la biogenèse des MV et les capacités de diaphonie est généralement réalisé dans des modèles de culture cellulaire pour identifier les molécules actives exposées ou encapsulées dans les MV et leur signalisation en aval. Les interactions MV avec les cellules cibles dépendront de la liaison protéine/protéine membranaire, lorsque des contre-ligands appropriés sont disponibles et/ou de la fusion lipidique7.
Dans des conditions physiologiques, les MV circulant dans le plasma proviennent principalement des cellules vasculaires, comme l’identifient les marqueurs de différenciation des clusters de lignées (CD)8,9. Cependant, en pathologie, notamment dans le cancer10 et le rejet de greffe11,12, les MV sont éliminés des tissus endommagés et présentent des caractéristiques procoagulantes et pro-inflammatoires nocives. Ceux-ci sont détectés dans la circulation systémique, ce qui en fait des sondes utiles pour surveiller les thérapies de protection ou de rajeunissement, et les cibles pharmacologiques possibles13. Étant donné que les MV circulent comme un pool de stockage dynamique reflétant l’homéostasie des cellules vasculaires et tissulaires dans la santé et la maladie, une meilleure compréhension de leur action à distance doit également être étudiée in vivo, après une injection IV ou une instillation nasale chez de petits animaux14,15. En effet, les MV ont été considérés comme des contributeurs majeurs aux voies complexes couplant l’inflammation exagérée et la thrombose16.
La parodontite est une maladie inflammatoire d’origine infectieuse affectant les tissus de soutien des dents17,18 et est associée à un risque thrombotique. Elle se caractérise par des saignements gingivaux, une destruction de l’os alvéolaire, une mobilité dentaire et peut finalement entraîner la perte de dents. La parodontite est très répandue dans le monde entier et touche plus de 50 % de la population, dont 11 % présentent une forme sévère19. La parodontite est induite par une dysbiose bactérienne des biofilms sous-gingivaux, qui soutiennent une réponse inflammatoire exacerbée qui déclenche la destruction des tissus20. Au cours de la dernière décennie, la parodontite a été liée à des maladies systémiques telles que les troubles cardiovasculaires, le diabète et la polyarthrite rhumatoïde. Les explications possibles sont l’action des agents pathogènes parodontaux à distance et/ou l’augmentation de l’inflammation systémique médiée par les cytokines pro-inflammatoires telles que l’interleukine (IL-1, IL-6) et le TNF-α21,22.
Parmi les agents pathogènes associés à l’apparition et au développement de la parodontite, Porphyromonas gingivalis (P. gingivalis)23 est présent dans la plupart des lésions graves qui récoltent plusieurs facteurs de virulence, y compris les lipopolysaccharides (LPS)24 induisant des réponses inflammatoires médiées par les récepteurs de type Toll (TLR)25 et le recrutement de neutrophiles et de leucocytes polymorphonucléaires (PMN) sur le site de l’infection initiale26. Le LPS de P. gingivalis active TLR-4 ou TLR-2, facilitant la détection immunitaire et l’évasion de la survie bactérienne27. Au niveau vasculaire, l’activation de TLR2 par le LPS est associée à l’immunothrombose. La capacité unique de P. gingivalis à déclencher la signalisation TLR-2 tandis que la reconnaissance dépendante de TLR-4 est significativement altérée favorise une infection persistante de bas grade28,29.
Les procédures in vivo pour étudier les réponses MV à l’infection chronique et durable d’un agent pathogène de bas grade sont rares. Les approches méthodologiques pour l’extraction des MVs tissulaires sont peu décrites dans la littérature et concernent généralement la récolte de MVs à partir de tissus pathologiques comme les tumeurs solides, la stéatose hépatique, les plaques d’athérothrombotique, ou les greffes 11,29,30, tandis que la rate détecte les bactéries et les virus dans la circulation sanguine. Il stocke également les érythrocytes, les plaquettes, les lymphocytes, les monocytes, les basophiles et les éosinophiles impliqués dans la réponse immunitaire. Les granulocytes comme les neutrophiles de la pulpe rouge génèrent également des espèces réactives de l’oxygène (ROS) et des protéases qui détruisent les agents pathogènes et empêchent l’infection de se propager31,32. Étonnamment, et au meilleur de notre connaissance, les MV de la rate ne sont pas étudiées dans le contexte des agressions tissulaires induites par des agents pathogènes. Il existe un besoin mondial non satisfait d’étudier les variations des MV tissulaires en physiopathologie.
Les données in vitro de notre laboratoire ont montré que le LPS induit l’excrétion de MV procoagulants à partir des splénocytes de rat, ce qui provoque à son tour la sénescence de cellules endothéliales coronaires en culture et un phénotype endothélial procoagulant pro-inflammatoire et pro-inflammatoire consécutif11. La faisabilité du contrôle pharmacologique des MV de la rate a été démontrée après le traitement de l’animal avec une formule optimisée d’oméga-3. Le gavage oral de rats d’âge moyen et âgés s’est avéré protecteur à la fois contre l’excrétion de MV procoagulants par les splénocytes et contre leurs propriétés nocives prosénescentes envers l’endothéliumcoronaire 33.
Par rapport au sang, la rate offre l’avantage d’être une source importante de leucocytes chez un individu. De plus, un axe splénique-cardiaque a récemment été proposé 3,34, faisant de la rate un contributeur possible au risque cardiovasculaire lié à l’infection d’intérêt bénéfique pour le contrôle pharmacologique. L’évaluation des propriétés ou de la libération des SMV est essentielle pour comprendre les réponses induites par les agents pathogènes ou inflammatoires. Il est intéressant de noter qu’elle peut être réalisée chez les animaux traités et dans différents modèles physiopathologiques (âge, hypertension, diabète). En effet, en comparant des rats d’âge moyen et des ratsâgés 33, les différences dans les propriétés et la libération des MV de la rate peuvent être mises en évidence après une simple culture de splénocytes de 24 heures.
Compte tenu des preuves ci-dessus de l’altération des propriétés effectrices des MV de la rate avec l’état physiopathologique et de la faisabilité de leur contrôle pharmacologique chez le rat, un protocole normalisé est décrit ici pour l’isolement des MV de la rate murine. La procédure s’adapterait mieux aux études approfondies des mécanismes in vivo soutenant les effets médiés par les SMV, éventuellement chez les souris modifiées. La procédure a été établie chez des souris C57BL/6 à l’aide d’une infection intrapéritonéale locale par P. gingivalis, afin d’établir la preuve d’une action à distance de l’agent pathogène sur les propriétés effectrices du MV de la rate (SMV).
Protocole
Tous les protocoles expérimentaux ont été approuvés et ont suivi les directives pertinentes du Comité d’éthique local (APAFIS#28745-2020121815051557) et des soins aux animaux de l’Université d’origine et de l’INSERM. De jeunes souris mâles C57BL/6, âgées de 6 à 8 semaines, ont été utilisées pour les expériences. Les souris ont été régulièrement examinées pour évaluer la douleur et le stress, et leur poids a été surveillé quotidiennement. Sauf indication contraire, tous les tampons et solutions d’extraction doivent être stériles et à température ambiante.
1. Préparation des animaux
- Administrer aux souris six injections intrapéritonéales de P. gingivalis (PG) tous les 2 jours pendant 2 semaines (trois injections de 5 x 107 bactéries/semaine, Dossier supplémentaire 1).
- Anesthésiez les souris à l’aide d’une combinaison de 100 mg/kg de kétamine et de 10 mg/kg de xylazine.
- Sacrifiez les souris anesthésiées et récoltez la rate après laparotomie.
REMARQUE : Les conditions spécifiques à l’infection à P. gingivalis et au sacrifice des animaux pour le prélèvement de la rate sont détaillées dans la section « expérimentation animale » du Dossier supplémentaire 1. La représentation schématique des étapes du protocole est illustrée à la figure 1.
2. Extraction des splénocytes
- À l’aide d’un scalpel, hachez le tissu de la rate en tranches de ~1 mm dans une boîte de Pétri déjà remplie de 3 mL de RPMI contenant des antibiotiques (streptomycine (100 U/mL)/pénicilline (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM)), et complétée par 10 % de sérum de veau fœtal (FBS) (voir le tableau des matières).
- Transférez les tranches dans un tamis (voir tableau des matériaux), qui est préalablement fixé à un tube de polystyrène de 50 ml.
- Utilisez le piston d’une seringue comme pilon pour écraser les tissus sur le tamis.
- Rincer le tamis avec le milieu RPMI (3 ml).
- Centrifuger l’éluat en suspension cellulaire à 450 x g pendant 5 min à température ambiante et jeter le surnageant avec prudence par refoulement.
3. Élimination des érythrocytes par choc osmotique
- Ajouter 1 mL de tampon ACK (voir le tableau des matériaux), bien mélanger, incuber pendant 3 min à température ambiante et agiter doucement par rotation de la main.
- Diluer en ajoutant 9 mL de RPMI et bien mélanger en utilisant l’aspiration et le reflux.
- Centrifuger à 450 x g pendant 5 min à température ambiante.
- Jeter le surnageant par aspiration et refoulement, et remettre la pastille en suspension dans 5 mL de milieu RPMI.
- Mélanger délicatement (aspiration/reflux) et éventuellement éliminer les éventuels débris lipidiques par pipetage ou à l’aide d’un tamis.
4. Ajustement de la concentration en splénocytes isolés
- Remplissez un microtube de 1,5 mL contenant 900 μL de RPMI.
- À l’aide d’une micropipette, prélever 100 μL de suspension cellulaire, l’ajouter au microtube de 1,5 ml contenant 900 μL de milieu RPMI et bien mélanger.
- Transférez 10 μL des cellules diluées dans un microtube, ajoutez 10 μL de colorant d’exclusion au bleu de trypan et mélangez bien.
- Placez 10 μL de la solution (étape 3.3) dans la lame de comptage du compteur automatique de cellules (voir le tableau des matériaux) et déterminez le nombre de cellules.
REMARQUE : Le logiciel de l’appareil donne deux valeurs : le nombre total de cellules et le nombre et le pourcentage de cellules vivantes. - Ajustez la concentration des cellules vivantes à 3 ou 5 x 106 cellules/mL (Vmax = 20 mL ; la capacité totale maximale est de 100 x 106 cellules/mL).
- Ensemencer les cellules dans une fiole de 75 mL contenant du RPMI.
- Incuber le ballon à la verticale dans un incubateur humidifié à 37 °C pendant 24 h.
ATTENTION : Le bleu de trypan est un agent mutagène et cancérigène 35,36. Assurez-vous de porter des gants pendant le comptage, même à l’extérieur de la cagoule. Jetez immédiatement les pointes et les liquides dans des récipients et lavez la surface de la paillasse.
REMARQUE : Si les cellules prélevées mesurent moins de 50 x 106, utilisez une fiole de culture de 25 ml. Le numéro de portable ne doit pas beaucoup varier d’un individu à l’autre. Le pourcentage de cellules vivantes est généralement supérieur à 80 % à cette étape.
5. Isolement des microvésicules splénocytaires
- Après 24 h, verser le contenu de la fiole dans un tube de 50 mL en polypropylène ou en polystyrène.
- Centrifuger à 450 x g pendant 15 min à température ambiante pour éliminer les cellules et les débris.
- Après la centrifugation, conserver 100 μL du 1er surnageant (SN1) pour une éventuelle mesure de la concentration initiale en MV afin de calculer le rendement d’isolement. Notez le volume SN1.
- Centrifugez le SN1 à 450 x g pendant 15 min à température ambiante.
- Jeter la pastille et centrifuger à nouveau à 450 x g pendant 15 min à température ambiante. Retirez et collectez rapidement SN2 (notez le volume).
- Transférer SN2 dans des microtubes de 1,8 mL à fond conique. Conservez 100 μL de SN2 pour une mesure éventuelle de la concentration MT initiale afin de calculer le rendement d’isolement au cas où trop de débris finirait par altérer la mesure MT dans SN1.
- Ajouter 5 mL de milieu RPMI à la pastille (cellules) et compter les splénocytes.
REMARQUE : La suspension cellulaire peut également être fixée pour la caractérisation par cytométrie en flux dans du paraformaldéhyde à 0,1 % (concentration finale)37. - Centrifugez SN2 à 14 000 x g pendant 1 h à 4 °C et réfrigérez éventuellement le rotor à l’avance en faisant fonctionner le rotor vide à 4 °C. Cette étape génère SN3.
- Retirer immédiatement le SN3 de chaque microtube en le retournant sur un seul tube stérile de 50 mL (sous le capot). Notez le volume SN3.
- Mélangez délicatement SN3 à l’aide d’une pipette sous le capot. Conservez des aliquotes pour les mesures éventuelles dans la suspension.
REMARQUE : La solution est maintenant appauvrie en MV mais contient les médiateurs solubles et les exosomes. - Racler chaque microtube (fermé) sur une grille à pointes pour favoriser mécaniquement la remise en suspension des MVs dans le granulé.
- Ajouter 200 μL de solution saline équilibrée de Hank sans Ca2+ et Mg2+ (HBSS) dans le premier microtube (voir tableau des matériaux).
- Remettre en suspension la pastille MV du premier tube par des cycles doux d’aspiration/refoulement (~10 fois) à l’aide d’une micropipette de 1 mL. Prenez grand soin d’éviter la formation de mousse car cela favorisera l’oxydation des vésicules et autres fractions de la suspension.
- Récoltez les premiers 200 μL de MV remis en suspension et versez-les dans le deuxième tube sur le granulé. Mélangez doucement comme ci-dessus, puis versez à nouveau dans le troisième tube et mélangez doucement. La suspension devient de plus en plus trouble d’un tube à l’autre. Fermez le troisième tube.
- Amorcez la collecte des trois microtubes suivants comme ci-dessus (étape 4.14).
- Rassemblez tous les MV remis en suspension dans un seul (ou deux) microtube collecteur (2 mL avec fond de forme conique). Conservez 50 μL pour le calcul éventuel du rendement de cette étape. Notez le volume de suspension.
- Centrifuger le tube collecteur à 14 000 x g pendant 1 h à 4 °C. Cette étape génère SN4.
- Jetez immédiatement le SN4 (versez sur un tube collecteur de surnageant). Conservez une aliquote de SN4 pour calculer le rendement de l’étape de purification et remettez doucement en suspension la pastille dans 500 μL de HBBS (sans Ca2+ et Mg2+). Conservez une aliquote de 50 μL de la pastille remise en suspension pour calculer le rendement de purification et noter son volume.
- Conserver la pastille remise en suspension à 4 °C pendant un mois maximum pour les tests fonctionnels dans des conditions stériles ou à -20 °C pour les tests structurels.
- Calculez le rendement de purification (voir NOTE ci-dessous) de chaque étape ou de l’ensemble de la procédure en mesurant la concentration des MV dans les surnageants et/ou les suspensions de granulés.
REMARQUE : Rendement de purification ( %) : ([MV1] x volume SN1) / ([MV4] x volume de suspension final) x 100.
Ce rendement doit être rationalisé en fonction du nombre de splénocytes isolés du ballon de culture et comptés à l’étape 4.4. Le rendement de purification de la présente expérience est de ~70 % à partir de 111 x 106 cellules et 60 mL de surnageant.- Évaluer la perte de SMV causée par la procédure en mesurant les SMV restants dans les surnageants appauvris en SMV et contenant principalement des exosomes (SN2 et SN4).
- Mesurer la concentration de MV à l’aide du TRPS ou de l’essai de prothrombinase38 pour une sensibilité et une spécificité élevées.
ATTENTION : Récoltez les MV après centrifugation par le versement rapide du surnageant à l’envers. L’attente ou l’utilisation de microtubes en forme de U entraînera une perte de MV sur la paroi du microtube. N’utilisez jamais de micropipette pour jeter le surnageant ; Le granulé peut être aspiré à la place. Ne retardez jamais le processus après l’arrêt de la centrifugeuse. La centrifugation à vitesse excessive entraînera la contamination de la pastille MV par des exosomes.
REMARQUE : Les vitesses et la durée de centrifugation sont optimisées pour un enrichissement MT avec une contamination minimale par les exosomes. Ce protocole n’est pas fiable pour étudier les MV des monocytes/macrophages de la rate, car ces cellules peuvent phagocyter et recapturer rapidement leurs propres MV39. Le protocole ne peut pas être interrompu et redémarré plus tard en raison de la perte de cellules due à la viabilité cellulaire.
Résultats
Les données fournies donnent une représentation complète de l’ensemble de la procédure, en utilisant deux conditions animales principales : contrôler les jeunes souris C57BL/6 non traitées et leurs compagnons de portée soumis à six injections intrapéritonéales (IP) de PG tous les 2 jours, pendant 2 semaines. Ils montrent également l’action à distance d’une injection intrapéritonéale de PG sur la réponse de la rate après 2 semaines. Les microvésicules splénocytaires ont été quantifiées soit par dosage enzymatique de la prothrombinase, soit par spectrophotométrie de leur concentration en protéines et en ARN, et la proportion de neutrophiles a été déterminée par cytométrie en flux33,38 dans la suspension splénocytaire (sections 2-4 du fichier supplémentaire 1 et de la figure supplémentaire 2).
Le poids de la rate et le nombre de cellules augmentent après 2 semaines d’injection IP chez P. gingivalis
Chez les jeunes souris adultes, l’injection de PG entraîne une augmentation significative de 2,6 fois du poids de la rate après 2 semaines, probablement en raison de la réponse immunitaire. En effet, le nombre total de splénocytes a également été multiplié par 2,3 (Figure 2, n = 5 souris par condition, p < 0,0001 par le test T de Student).
La viabilité des splénocytes n’est pas altérée par 2 semaines d’injection chez P. gingivalis
Des taux de viabilité similaires ont été mesurés entre les souris traitées et non traitées après l’isolement des splénocytes ou 24 h après la culture cellulaire. Néanmoins, lorsque le pourcentage initial de cellules vivantes à t0 était inférieur à 76 %, la viabilité était réduite dans les deux groupes de ~50 % après 24 h. (voir Ctl 1-3, tableau 1, à titre d’exemple). À l’inverse, et quelle que soit l’état de l’animal, la récupération sur 24 h est renforcée lorsque la proportion de cellules vivantes atteint 90 % ou plus à t0, mettant en évidence le rôle crucial des premières étapes d’isolement (Figure 3).
Le nombre de neutrophiles dans les splénocytes est augmenté chez les souris injectées de P. gingivalis
Après double coloration, les neutrophiles ont été identifiés par cytométrie en flux comme Mac1+ et LYG-6-(Gr1)+ (voir le tableau des matériaux et la section 4 du fichier supplémentaire 1). En réponse à la PG , le nombre de neutrophiles dans la rate a été significativement multiplié par 40 juste après l’isolement cellulaire (t0, 4,8 % ± 0,6 vs 0,86 % ± 0,06). Néanmoins, il convient de noter qu’après 24 h de culture, la proportion de neutrophiles dans la suspension splénocytaire passe de 4,8 % ± 0,6 à 14,67 % ± 2,02 (Figure 4).
L’excrétion de MV par les splénocytes augmente chez les souris infectées par P. gingivalis
En suivant le protocole, nous avons prouvé que les splénocytes isolés libéraient plus de MV lorsque les souris étaient soumises à une infection PG. En comparaison, pour les individus témoins et le test de mesure, les MV excrétés dans le surnageant ont été grossièrement triplées chez les souris injectées de PG, en utilisant soit la détection par dosage de la prothrombinase qui fait référence à la surface totale des phospholipides anioniques procoagulants portés par les SMV (Figure 5A), la teneur en protéines des SMV mesurée par spectrophotométrie (Figure 5B), soit la teneur en ARN des SMV évaluée par spectrophotométrie (Figure 5C, n = 5, Prothrombinase : p = 0,002 ; teneur en protéines : P = 0,003 ; teneur en ARN, p = 0,008, par le test T de Student). L’étendue la plus élevée a été obtenue à l’aide du test de prothrombinase qui a montré un bruit de fond très faible.
Il est intéressant de noter qu’une corrélation peut être établie entre la teneur en protéines des SMV et les SMV mesurés par dosage de la prothrombinase (figure supplémentaire 3). De plus, la distribution de la taille des SMV n’a pas varié, comme l’ont déterminé les expériences préliminaires (figure supplémentaire 4) comparant les SMV de souris stimulées et non stimulées par PG (diamètre médian de 193 nm contre 189 nm). Ces valeurs de diamètre sont proches de celles des SMV isolés à partir de splénocytes de rat en réponse à une incubation de 24 heures avec du LPS (5 μg/mL) ou de l’acétate de myristate de Phorbol (25 ng/mL) et de l’ionophore (1 μM) (diamètre médian, 222 nm par rapport au témoin 212 nm)11 (figure supplémentaire 5). De plus, la teneur en protéines des SMV peut être évaluée par western blot, ce qui permet de caractériser des protéines cytoplasmiques ou membranaires spécifiques exportées préférentiellement dans les SMV (figure supplémentaire 5).
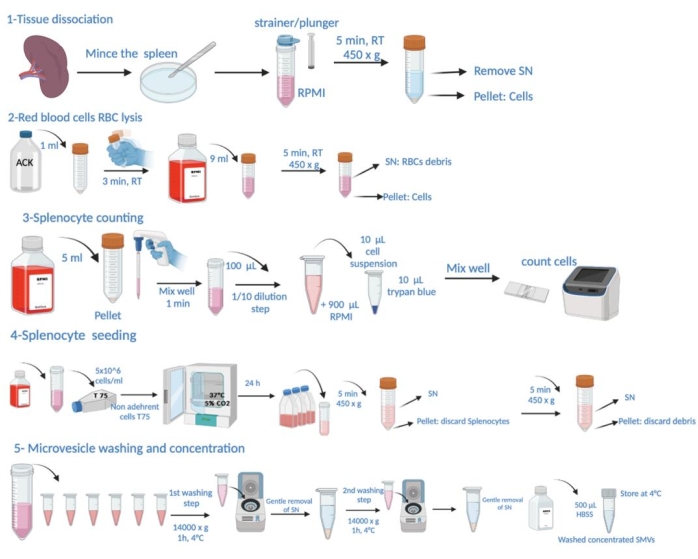
Figure 1 : Représentation schématique des étapes du protocole. Il s’agit de la dissection tissulaire, de la lyse des globules rouges (GRC), du comptage des splénocytes, de l’ensemencement, de la récolte de microvésicules à partir du surnageant, du lavage et de la détermination de la concentration. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : L’injection IP de P. gingivalis augmente significativement le poids de la rate (A) et le nombre de splénocytes (B). CTL : souris non traitées, IP : souris soumises à une injection de PG pendant 2 semaines. Les données sont exprimées en moyenne ± SEM. n = 5 : *** : p < 0,0001 et 0,0005, respectivement. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : La viabilité des splénocytes est réduite 24 h après la culture des splénocytes, alors que l’injection IP de P. gingivalis n’altère pas la viabilité cellulaire. CTL : souris non traitées, IP : souris soumises à une injection de PG pendant 2 semaines, t0 : viabilité mesurée immédiatement après isolement, t24 : après culture de 24 h. Les données sont exprimées en moyenne ± SEM. n = 5, *** : p < 0,0001 par le test T de Student. Veuillez cliquer ici pour voir une version agrandie de cette figure.
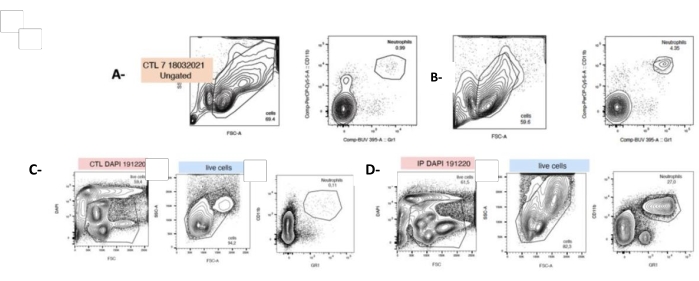
Figure 4 : L’injection de P. gingivalis augmente le nombre de neutrophiles à t0 et après 24 h de culture cellulaire. Les cellules ont été fraîchement isolées de la rate prélevée et marquées avec des anticorps fluorescents dirigés contre les granulocytes (LyG-6 Gr1) ou les neutrophiles (LY6-C) et identifiées dans la porte CD11b+ qui délimite les monocytes, les granulocytes et les neutrophiles. Les neutrophiles ont été identifiés comme étant LY6-C+, CD11b+ et LYG-6 Gr1 faibles. Parcelles représentatives montrant une double coloration SSC/FSC et CD11b+, et LYG-6 Gr1 pour chaque condition à t0 (A,B) ou 24h après le semis (C,D). A,C : splénocytes de souris non traités ; B,D : splénocytes de souris soumises à une injection IP de P. gingivalis. FSC : Diffusion vers l’avant ; SSC : Diffusion latérale ; CTL : souris non exposées. n = 5, *** : p < 0,0001, 10000 événements acquis par échantillon. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : P. gingivalis favorise une augmentation de l’excrétion des splénocytes MV après une culture de 24 heures. Des splénocytes ont été isolés de souris infectées par P. gingivalis et de souris témoins, puis mis en culture pendant 24 heures et les VMS ont été mesurés par différents dosages. Barres noires : souris non traitées (CTL), barres grises (IP) : souris soumises à l’injection de P. gingivalis pendant 2 semaines. A : Quantification par dosage de la prothrombinase, B : concentration en protéines des SMV intacts déterminée par spectrophotométrie, C : teneur en ARN des SMV déterminée par spectrophotométrie. Les données sont exprimées en moyenne ± SEM. n = 5, ** : p < 0,0001, par le test T de Student. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Condition animale | Poids de la rate | Nombre de splénocytes | Viabilité ( %) | Viabilité ( %) |
| Après l’isolement cellulaire | ||||
| (en milliers) | (106 cellules) | Après 24 h de culture cellulaire | ||
| (t0) | ||||
| Ctl 1 | 108 | 25 | 75 | 24 |
| Ctl 2 | 112 | 55 | 70 | 26 |
| Ctl 3 | 118 | 52 | 73 | 26 |
| Ctl 4 | 83 | 38 | 91 | 46 |
| Ctl 5 | 78 | 55 | 96 | 46 |
| IP 1 | 243 | 150 | 91 | 43 |
| IP 2 | 250 | 138 | 93 | 46 |
| IP 3 | 283 | 85 | 90 | 46 |
| IP 4 | 270 | 100 | 91 | 43 |
| IP 5 | 300 | 125 | 91 | 43 |
Tableau 1 : Comparaison des taux de viabilité des splénocytes entre les souris traitées et non traitées après isolement des splénocytes.
Figure supplémentaire 1 : Comment les MV procoagulants sont-ils procoagulants ? Pour plus de détails, voir le fichier supplémentaire 1. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2 : Le dosage de la prothrombinase basé sur la capture de microparticules (MP). Pour plus de détails, voir le fichier supplémentaire 1. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3 : Tracé de corrélation entre les mesures des SMV par dosage de la prothrombinase et par dosage spectrophotométrique des protéines chez des souris non traitées ou traitées à P. gingivalis . Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 4 : Analyse de la distribution granulométrique des SMV isolés chez la souris (A) et les splénocytes de rat (B). La suspension des SMV a été obtenue à partir de la rate de souris non traitées (MV de contrôle) ou d’individus soumis à des lésions de la gencive sans MV LIG ou avec ajout local de P. gingivalis (MV LIG-PG). Les SMV de rats ont été récoltés dans le surnageant de splénocytes isolés soumis à une stimulation de 24 heures par LPS (LPS MV) ou PMA (PMA MV) comme décrit ailleurs37. Diamètre moyen : Diamètre moyen ; Mode dia : valeur médiane du diamètre. Les mesures ont été effectuées à l’aide d’un nanopore de 400 pour évaluer la plus grande plage de distribution de taille. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 5 : Identification de la teneur en protéines des MV à partir de splénocytes de rats isolés de jeunes rats par western blot. Pour plus de détails, voir le Fichier supplémentaire 1. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 1 : Détails sur les procédures expérimentales et explications pour les figures supplémentaires 1, 2 et 5. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
La présente étude confirme que la rate est une source majeure et fiable de MV ayant une pertinence physiopathologique par rapport à d’autres sources comme le sang, de volume limité chez la souris. À condition que des précautions soient prises, la méthode est facile à mettre en place et ne nécessite pas d’équipement coûteux. Étant donné qu’il n’existe pas d’autre méthode que l’évaluation in vivo , le modèle actuel semble être une méthode précieuse pour étudier l’impact des pro-médicaments sur l’excrétion de MV. Il est important de noter que le protocole standardisé pour la récolte des microvésicules spléniques (SMV) murins présenté ici devrait répondre aux besoins non satisfaits de l’étude in vivo du contrôle des effets médiés par le SMV, éventuellement chez les souris modifiées après injection ou instillation nasale.
La présente méthode montre également que les SMV sont des outils précliniques pertinents pour étudier les effets à distance d’infections locales, comme l’infection IP à P. gingivalis . En effet, en utilisant plusieurs approches, des variations significatives entre les SMV libérés par P. gingivalis traités vs. des animaux non traités ont été mesurés, suggérant un effet à distance de l’injection IP locale, déjà détectable après 2 semaines. Les données préliminaires de notre laboratoire utilisant d’autres sites d’infection à P. gingivalis éloignés ont confirmé que P. gingivalis peut initier une élévation du SMV de 1,7 fois dès le 7e jour après l’infection.
Il est également observé que les effets à distance induits par P. gingivalis ont été confirmés par l’analyse de la rate avec des variations significatives de poids, de viabilité cellulaire et de numération totale. De plus, P. gingivalis a provoqué une augmentation de 6,5 fois du nombre de neutrophiles de la rate lorsqu’il a été mesuré par immunomarquage juste après l’isolement des splénocytes (t0). En conséquence, les variations du profil d’origine des cellules SMV indiqueraient l’excrétion des cellules parentales causée par l’état initial de l’animal.
Parce que les SMV libérés dans le surnageant de cultures de splénocytes de 24 h ont été triplés lorsqu’ils ont été isolés à partir de souris injectées IP, ils apparaissent comme des biomarqueurs fiables de l’activation à distance de la rate par P. gingivalis, ce qui en fait des outils éventuels pour surveiller le contrôle pharmacologique.
In vitro, la culture des splénocytes peut être réalisée en utilisant 10 % de FBS, appauvri ou non en exosomes. Dans les expériences actuelles, aucune différence n’a été observée, et les variations entre les splénocytes non traités sont restées détectables dans la même mesure avec les deux types de FBS.
Dans la procédure actuelle, une durée de 2 semaines n’a pas entraîné de variations significatives du poids de la rate chez les souris non traitées. Il est toutefois important de garder à l’esprit que le poids de la rate peut varier avec l’âge, comme indiqué précédemment chez une série de rats témoins jeunes, âgés et d’âge moyen. 1 Dans un tel cas, la quantification de la SMV doit être exprimée sous la forme d’un rapport de numération cellulaire.
La procédure actuelle a été optimisée pour un modèle murin et adaptée à d’autres investigations sur des souris transgéniques. Bien que le principal inconvénient du modèle murin soit un faible poids de rate par rapport à celui des rats33, les procédures d’isolement adaptées des splénocytes et du SMV décrites ici empêchent les dommages et la perte cellulaires, tandis que tous les érythrocytes contaminants sont entièrement éliminés. Le lavage est crucial pour un bon rendement de purification des splénocytes et doit être effectué en douceur avec pas plus de 1 ml de tampon de lyse ACK par rate dans 9 ml de RPMI pour permettre une élimination complète des globules rouges. Cette étape peut être répétée jusqu’à ce que la pastille soit blanche. Cette procédure ne permet pas l’investigation des monocytes et doit être adaptée aux cellules adhérentes dans une telle éventualité.
Après 24 h de culture, la concentration de SMV mesurée dans les surnageants de culture cellulaire reflète l’équilibre entre la génération de MV et la recapture de MV par les splénocytes en culture. Par conséquent, dans les versions adaptées de la procédure ci-dessus, une attention particulière doit être accordée à la présence de cellules ayant une activité phagocytaire professionnelle ou accessoire (monocytes, cellules endothéliales, etc.), et la cinétique de libération du SMV dans le surnageant doit être soigneusement établie en conséquence.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs sont redevables à Claudine Ebel du Service commun de cytométrie en flux (Institut de Génétique et de Biologie Moléculaire et Cellulaire, Strasbourg) pour l’assistance experte et la formation à l’analyse complexe de cytométrie en flux de la rate et à Ali El Habhab pour la formation initiale sur le marquage des cellules de rate du rat. Deniz Karagyoz a aidé à creuser pour rassembler la littérature. Ce travail a été en partie soutenu par deux bourses ANR COCERP (N°A17R417B), ENDOPAROMP (N°ANR-17-CE17-0024-01).
matériels
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
Références
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669 (2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21 (2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778 (2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356 (2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197 (2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215 (2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898 (2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45 (2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734 (2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon
Nous utilisons des cookies afin d'améliorer votre expérience sur notre site web.
En continuant à utiliser notre site ou en cliquant sur le bouton ''continuer'', vous acceptez l'utilisation de cookies.
