Method Article
Isolierung von Milz-Mikrovesikeln in einem Mausmodell für intraperitoneale bakterielle Infektionen
In diesem Artikel
Zusammenfassung
Mikrovesikel, die von der Plasmamembran abgestoßen werden, wirken als zelluläre Effektoren. Milz-Mikrovesikel (SMVs) sind Surrogatmarker für pathophysiologische Zustände. Bei Ratten und Mäusen charakterisieren der Gehalt und die Eigenschaften von SMV das Altern oder die Entzündung und werden durch zytoprotektive Behandlungen verändert, was sie zu einem wertvollen, aber reichhaltigen Überwachungsinstrument für die präklinische Forschung macht.
Zusammenfassung
Mikrovesikel (MVs) sind Submikron-Fragmente, die von der Plasmamembran aktivierter Zellen freigesetzt werden und als proinflammatorische und prokoagulansive zelluläre Effektoren wirken. Bei Ratten sind Milz-MVs (SMVs) Surrogatmarker für pathophysiologische Zustände. Frühere In-vitro-Studien zeigten, dass Porphyromonas gingivalis (P. gingivalis), ein wichtiger parodontaler Erreger, die endotheliale Ausscheidung und Apoptose ermöglicht, während Lipopolysaccharid (LPS) die Ausscheidung von Splenozyten-abgeleiteten Mikrovesikeln (SMVs) begünstigt. In-vivo-Studien zeigten die Durchführbarkeit einer pharmakologischen Kontrolle der SMV-Ausscheidung. Das vorliegende Protokoll etabliert ein standardisiertes Verfahren zur Isolierung von Milz-SMVs aus dem P . gingivalis-Modell für akute murine Infektionen. Eine P. gingivalis-Infektion wurde bei jungen C57BL/6-Mäusen durch intraperitoneale Injektion induziert (drei Injektionen von 5 x 107 Bakterien/Woche). Nach zwei Wochen wurden die Milz entnommen, gewogen und die Milzzellen gezählt. SMVs wurden isoliert und durch Protein-, RNA- und Prothrombinase-Assays quantifiziert. Die Lebensfähigkeit der Zellen wurde entweder mit Propidiumiodid oder Trypanblau-Ausschlussfarbstoffen bewertet. Nach der Splenozytenextraktion wurden die Neutrophilenzahlen durch Durchflusszytometrie nach 24 Stunden Splenozytenkultur ermittelt. Bei Mäusen, die mit P. gingivalis injiziert wurden, wurde eine 2,5-fache Zunahme des Milzgewichts und eine 2,3-fache Erhöhung der Splenozytenzahl beobachtet, während die Anzahl der Neutrophilen um das 40-fache erhöht war. Die Zellviabilität von Splenozyten aus P . gingivalis-injizierten Mäusen lag zwischen 75 % und 96 % und war nach 24 Stunden Kultur um 50 % verringert, ohne dass ein signifikanter Unterschied im Vergleich zu nicht exponierten Kontrollen bestand. Splenozyten von injizierten Mäusen scheiden jedoch durch Prothrombinase-Assays oder Proteinmessungen höhere Mengen an MVs aus. Die Daten zeigen, dass die prokoagulanzien SMVs zuverlässige Werkzeuge sind, um eine frühe Milzreaktion auf eine intraperitoneale P. gingivalis-Infektion zu beurteilen.
Einleitung
Mikrovesikel (MVs), auch Mikropartikel oder Ektosomen genannt, sind Plasmamembranfragmente mit einem Durchmesser von 0,1-1,0 μm, die in Körperflüssigkeiten und im extrazellulären Raum als Reaktion auf verschiedene Zellreize freigesetzt werden. MVs, die zuerst als Blutplättchenstaub identifiziert wurden, der das Gerinnungs-Phospholipid, meist Phosphatidylserin (PSer), freilegt, stellen eine zusätzliche Oberfläche für den Aufbau der Blutgerinnungskomplexedar 1,2. Die Schlüsselrolle zirkulierender MVs als prokoagulanziöse Effektoren wurde bei Patienten mit Scott-Syndrom2 gezeigt, einer seltenen genetischen Erkrankung, die zu dysfunktionaler PSer-Exposition und Blutungen führt (Ergänzende Abbildung 1). MVs wurden als zirkulierende Biomarker für das thrombotische Risiko bei chronischen Erkrankungen im Zusammenhang mit Herz-Kreislauf-Erkrankungen wie Diabetes, chronischen Nierenerkrankungen, Präeklampsie und Bluthochdruck ausführlich untersucht 3,4. Sie sind derzeit als echte zelluläre Effektoren in Flüssigkeiten oder Organgeweben wie dem Myokard1 anerkannt. Da sie aktive Proteine, Lipide und miRNA transportieren, modulieren sie aus der Ferne vaskuläre Reaktionen wie Blutstillung, Entzündung, vaskuläre Angiogenese und vaskuläres Wachstum oder Gewebeumbau5.
Während klinische Studien den Prognosewert von MVs hinsichtlich Risikofaktoren untersuchen, ermöglichen MVs, die aus der Flüssigkeit oder dem Gewebe des Patienten isoliert wurden, die ex vivo Beurteilung ihrer Effektoreigenschaften6. Die Entschlüsselung der Mechanismen, die die MV-Biogenese und die Cross-Talk-Fähigkeiten steuern, wird im Allgemeinen in Zellkulturmodellen erreicht, um aktive Moleküle zu identifizieren, die von den MVs freigelegt oder in ihnen eingekapselt sind, und ihre nachgeschaltete Signalübertragung. Die MV-Wechselwirkungen mit den Zielzellen hängen von der Membranprotein-Protein-Bindung ab, sofern geeignete Gegenliganden verfügbar sind, und/oder von der Lipidfusion7.
Unter physiologischen Bedingungen stammen die im Plasma zirkulierenden MVs hauptsächlich aus vaskulären Zellen, wie durch die Lineage Cluster Differentiation Marker (CD)8,9 identifiziert wird. In der Pathologie jedoch, insbesondere bei Krebs10 und Transplantatabstoßung11,12, werden MVs aus dem geschädigten Gewebe abgestoßen und weisen schädliche prokoagulanziöse und proinflammatorische Merkmale auf. Diese werden im systemischen Kreislauf nachgewiesen, was sie zu nützlichen Sonden für die Überwachung von Schutz- oder Verjüngungstherapien und möglichen pharmakologischen Zielen macht13. Da MVs als dynamischer Speicherpool zirkulieren, der die Homöostase von Gefäß- und Gewebezellen in Gesundheit und Krankheit widerspiegelt, muss ein besseres Verständnis ihrer Fernwirkung auch in vivo nach intravenöser Injektion oder nasaler Instillation bei Kleintieren untersucht werden14,15. In der Tat gelten MVs als Hauptverursacher der komplizierten Signalwege, die übertriebene Entzündungen und Thrombosen koppeln16.
Parodontitis ist eine entzündliche Erkrankung infektiösen Ursprungs, die das zahnstützende Gewebe betrifft17,18 und mit einem thrombotischen Risiko verbunden ist. Sie ist gekennzeichnet durch Zahnfleischbluten, Zerstörung des Alveolarknochens, Zahnbeweglichkeit und kann letztendlich zu Zahnverlust führen. Parodontitis ist weltweit weit verbreitet und betrifft mehr als 50 % der Bevölkerung, wobei 11 % eine schwere Form19 aufweisen. Die Parodontitis wird durch eine bakterielle Dysbiose der subgingivalen Biofilme induziert, die eine verschlimmerte Entzündungsreaktion aufrechterhalten, die die Gewebezerstörung auslöst20. In den letzten zehn Jahren wurde Parodontitis mit systemischen Erkrankungen wie Herz-Kreislauf-Erkrankungen, Diabetes und rheumatoider Arthritis in Verbindung gebracht. Mögliche Erklärungen sind die Fernwirkung der parodontalen Erreger und/oder die erhöhte systemische Entzündung, die durch proinflammatorische Zytokine wie Interleukin (IL-1, IL-6) und TNF-αvermittelt wird 21,22.
Unter den Krankheitserregern, die mit dem Auftreten und der Entwicklung von Parodontitis in Verbindung gebracht werden, findet sich Porphyromonas gingivalis (P. gingivalis)23 in den schwersten Läsionen, die mehrere Virulenzfaktoren ernten, einschließlich Lipopolysaccharid (LPS)24, das Toll-like-Rezeptor (TLR)-vermittelte Entzündungsreaktionen induziert25 und die Rekrutierung von Neutrophilen und polymorphkernigen Leukozyten (PMNs) am Ort der Erstinfektion26. Das LPS von P. gingivalis aktiviert TLR-4 oder TLR-2 und erleichtert so den Immunnachweis und die Umgehung des bakteriellen Überlebens27. Auf vaskulärer Ebene ist die Aktivierung von TLR2 durch LPS mit Immunthrombose assoziiert. Die einzigartige Fähigkeit von P. gingivalis, die TLR-2-Signalgebung auszulösen, während die TLR-4-abhängige Erkennung signifikant beeinträchtigt ist, begünstigt eine persistierende niedriggradige Infektion28,29.
In-vivo-Verfahren zur Untersuchung der MV-Reaktionen auf niedriggradige Erreger, chronische und anhaltende Infektionen sind rar. Methodische Ansätze zur Extraktion von tissularen MVs sind in der Literatur nur unzureichend beschrieben und betreffen im Allgemeinen die Entnahme von MVs aus pathologischen Geweben wie soliden Tumoren, Lebersteatose, atherothrombotischen Plaques oder Transplantaten 11,29,30, während die Milz Bakterien und Viren im Blutkreislauf wahrnimmt. Es speichert auch Erythrozyten, Blutplättchen, Lymphozyten, Monozyten, Basophile und Eosinophile, die an der Immunantwort beteiligt sind. Granulozyten wie Neutrophile aus der roten Pulpa erzeugen auch reaktive Sauerstoffspezies (ROS) und Proteasen, die Krankheitserreger zerstören und die Ausbreitung der Infektion verhindern31,32. Erstaunlicherweise und nach unserem besten Wissen werden Milz-MVs nicht im Zusammenhang mit erregerinduzierten Gewebeschädigungen untersucht. Es besteht ein weltweit ungedeckter Bedarf, die Variationen von tissularen MVs in der Physiopathologie zu untersuchen.
In-vitro-Daten aus unserem Labor zeigten, dass LPS die Ausscheidung von prokoagulanziellen MVs aus Ratten-Splenozyten induziert, was wiederum die Seneszenz von kultivierten koronaren Endothelzellen und einen konsekutiven proinflammatorischen und proinflammatorischen prokoagulanziellen endothelialen Phänotyp induziert11. Die Machbarkeit der pharmakologischen Kontrolle der Milz-MVs wurde nach der Behandlung des Tieres mit einer optimierten Omega-3-Formel weiter demonstriert. Es wurde festgestellt, dass die orale Sonde von Ratten mittleren und älteren Alters sowohl vor der Ausscheidung von prokoagulanzien MVs aus den Splenozyten als auch vor ihren proseneszenten schädlichen Eigenschaften gegenüber dem Koronarendothel schützt33.
Im Vergleich zu Blut bietet die Milz den Vorteil, dass sie bei einem Individuum eine wichtige Quelle für Leukozyten ist. Darüber hinaus wurde kürzlich eine Milz-Herz-Achse vorgeschlagen 3,34, was die Milz zu einem möglichen Faktor für das infektionsbedingte kardiovaskuläre Risiko macht, was für die pharmakologische Kontrolle von Vorteil ist. Die Bewertung der Eigenschaften oder der Freisetzung von SMVs ist der Schlüssel zum Verständnis von erregerinduzierten oder entzündlichen Reaktionen. Interessanterweise kann es bei behandelten Tieren und in verschiedenen physiopathologischen Modellen (Alter, Bluthochdruck, Diabetes) erreicht werden. Durch den Vergleich von Ratten mittleren und älteren Alters33 können die Unterschiede in den Eigenschaften und der Freisetzung von Milz-MVs nach einer einfachen 24-Stunden-Splenozytenkultur nachgewiesen werden.
Angesichts der oben genannten Hinweise auf die Veränderung der Effektoreigenschaften von Milz-MVs mit dem physiopathologischen Zustand und der Durchführbarkeit ihrer pharmakologischen Kontrolle bei Ratten wird hier ein standardisiertes Protokoll für die Isolierung von murinen Milz-MVs beschrieben. Das Verfahren würde besser zu eingehenden Untersuchungen der In-vivo-Mechanismen passen, die SMV-vermittelte Effekte unterstützen, möglicherweise in manipulierten Mäusen. Das Verfahren wurde an C57BL/6-Mäusen unter Verwendung einer lokalen intraperitonealen Infektion durch P. gingivalis etabliert, um den Nachweis einer Fernwirkung des Erregers auf die Effektoreigenschaften von Milz-MV (SMV) zu erbringen.
Protokoll
Alle Versuchsprotokolle wurden von der lokalen Ethikkommission (APAFIS#28745-2020121815051557) und der Tierbetreuung der Heimatuniversität und des INSERM genehmigt und befolgten deren Richtlinien. Für die Experimente wurden männliche junge C57BL/6-Mäuse im Alter von 6-8 Wochen verwendet. Die Mäuse wurden regelmäßig untersucht, um Schmerzen und Stress zu bewerten, und ihr Gewicht wurde täglich überwacht. Sofern nicht anders angegeben, müssen alle Extraktionspuffer und -lösungen steril und bei Raumtemperatur sein.
1. Vorbereitung der Tiere
- Den Mäusen werden 2 Wochen lang alle 2 Tage sechs intraperitoneale Injektionen von P. gingivalis (PG) verabreicht (drei Injektionen von 5 x 107 Bakterien/Woche, Ergänzende Datei 1).
- Betäuben Sie die Mäuse mit einer Kombination aus 100 mg/kg Ketamin und 10 mg/kg Xylazin.
- Opfern Sie die betäubten Mäuse und ernten Sie die Milz nach der Laparotomie.
ANMERKUNG: Die spezifischen Bedingungen für eine Infektion mit P. gingivalis und die Tötung der Tiere für die Milzgewinnung sind im Abschnitt "Tierversuche" in der Zusatzdatei 1 aufgeführt. Die schematische Darstellung der Protokollschritte ist in Abbildung 1 dargestellt.
2. Extraktion von Splenozyten
- Zerkleinern Sie das Milzgewebe mit einem Skalpell in ~1 mm große Scheiben in einer Petrischale, die bereits mit 3 ml RPMI-haltigen Antibiotika (Streptomycin (100 U/ml)/Penicillin (100 U/ml), Fungizone (250 mg/ml), L-Glutamin (2 mM)) gefüllt ist und mit 10 % fötalem Rinderserum (FBS) ergänzt ist (siehe Materialtabelle).
- Geben Sie die Scheiben in ein Sieb (siehe Materialtabelle), das zuvor auf ein 50 mL Styroporröhrchen aufgesteckt wurde.
- Verwenden Sie den Kolben einer Spritze als Stößel, um das Gewebe auf dem Sieb zu zerkleinern.
- Spülen Sie das Sieb mit dem RPMI-Medium (3 mL) aus.
- Das Zellsuspensionseluat bei 450 x g für 5 min bei Raumtemperatur zentrifugieren und den Überstand vorsichtig durch Rückfluss verwerfen.
3. Entfernung von Erythrozyten durch einen osmotischen Schock
- 1 ml ACK-Puffer zugeben (siehe Materialtabelle), gut mischen, 3 Minuten bei Raumtemperatur inkubieren und vorsichtig durch Handdrehung schütteln.
- Durch Zugabe von 9 mL RPMI verdünnen und durch Aspiration und Rückfluss gut mischen.
- Zentrifugieren Sie bei 450 x g für 5 min bei Raumtemperatur.
- Der Überstand wird durch Aspiration und Rückfluss verworfen und das Pellet in 5 ml RPMI-Medium resuspendiert.
- Vorsichtig mischen (Aspiration/Rückfluss) und eventuell alle Lipidrückstände durch Pipettieren oder mit einem Sieb entfernen.
4. Einstellung der isolierten Splenozytenkonzentration
- Füllen Sie ein 1,5-ml-Mikroröhrchen mit 900 μl RPMI.
- Nehmen Sie mit einer Mikropipette 100 μl der zellulären Suspension, geben Sie es in das 1,5-ml-Mikroröhrchen mit 900 μl RPMI-Medium und mischen Sie es gut.
- 10 μl der verdünnten Zellen in ein Mikroröhrchen geben, 10 μl des Trypanblau-Ausschlussfarbstoffs hinzufügen und gut mischen.
- 10 μl der Lösung (Schritt 3.3) in den Zählschieber des automatischen Zellzählers geben (siehe Materialtabelle) und die Zellzahl bestimmen.
HINWEIS: Die Gerätesoftware gibt zwei Werte an: die Gesamtzahl der Zellen und die Anzahl und den Prozentsatz der lebenden Zelle. - Stellen Sie die Konzentration der lebenden Zellen auf 3 oder 5 x 106 Zellen/ml ein (Vmax = 20 mL; maximale Gesamtkapazität beträgt 100 x 106 Zellen/ml).
- Die Zellen werden in einen 75-ml-Kolben mit RPMI gegeben.
- Der Kolben wird in einem befeuchteten Brutschrank bei 37 °C 24 Stunden lang vertikal inkubiert.
ACHTUNG: Trypanblau ist ein erbgutverändernder und krebserregender Stoff35,36. Achten Sie darauf, beim Zählen Handschuhe zu tragen, auch außerhalb der Kapuze. Entsorgen Sie Spitzen und Flüssigkeiten sofort in Behälter und waschen Sie die Oberfläche der Bank.
HINWEIS: Wenn die entnommenen Zellen kleiner als 50 x 106 sind, verwenden Sie einen 25-ml-Kulturkolben. Die Zellzahl sollte von Person zu Person nicht stark variieren. Der Anteil lebender Zellen liegt in diesem Schritt in der Regel über 80 %.
5. Isolierung von Splenozyten-Mikrovesikeln
- Nach 24 Stunden wird der Kolbeninhalt in ein 50-ml-Röhrchen aus Polypropylen oder Polystyrol gegossen.
- Zentrifugieren Sie bei 450 x g für 15 min bei Raumtemperatur, um Zellen und Ablagerungen zu entfernen.
- Nach der Zentrifugation werden 100 μl des 1. Überstands (SN1) für eine eventuelle Messung der anfänglichen MV-Konzentration zur Berechnung der Isolationsausbeute aufbewahrt. Notieren Sie sich die SN1-Lautstärke.
- Zentrifugieren Sie den SN1 bei 450 x g für 15 min bei Raumtemperatur.
- Pellet verwerfen und erneut bei 450 x g für 15 min bei Raumtemperatur zentrifugieren. Schnelles Abheben und Sammeln von SN2 (Notieren Sie sich die Lautstärke).
- Übertragen Sie SN2 in 1,8 mL Mikroröhrchen mit konisch geformten Böden. Bewahren Sie 100 μl SN2 für eine eventuelle Messung der anfänglichen MV-Konzentration auf, um die Isolationsausbeute zu berechnen, falls zu viel Schmutz die MS-Messung in SN1 beeinträchtigt.
- Geben Sie 5 ml RPMI-Medium in das Pellet (die Zellen) und zählen Sie die Splenozyten.
HINWEIS: Die Zellsuspension kann auch für die durchflusszytometrische Charakterisierung in 0,1 % Paraformaldehyd (Endkonzentration) fixiert werden37. - SN2 bei 14.000 x g für 1 h bei 4 °C zentrifugieren und den Rotor eventuell vorher kühlen, indem der leere Rotor bei 4 °C laufen gelassen wird. In diesem Schritt wird SN3 generiert.
- Entnehmen Sie sofort SN3 aus jedem Mikroröhrchen, indem Sie es über ein einzelnes steriles 50-ml-Röhrchen (unter der Haube) umdrehen. Beachten Sie die SN3-Lautstärke.
- SN3 vorsichtig mit einer Pipette unter der Haube mischen. Bewahren Sie die Aliquote für eventuelle Messungen in der Suspension auf.
HINWEIS: Die Lösung ist nun von MVs erschöpft, enthält aber die löslichen Mediatoren und Exosomen. - Kratzen Sie jedes Mikroröhrchen (geschlossen) auf einem Stachelgestell ab, um die Resuspension der MVs im Pellet mechanisch zu begünstigen.
- Geben Sie 200 μl Hanks ausgewogene Kochsalzlösung ohne Ca2+ und Mg2+ (HBSS) in das erste Mikroröhrchen (siehe Materialtabelle).
- Resuspendieren Sie das MV-Pellet des ersten Röhrchens durch sanfte Aspirations-/Rückflusszyklen (~10 Mal) mit einer 1-ml-Mikropipette. Achten Sie sehr darauf, Schaumbildung zu vermeiden, da dies die Oxidation der Vesikel und anderer Teile in der Suspension fördert.
- Ernten Sie die ersten 200 μl der resuspendierten MVs und gießen Sie sie in das zweite Röhrchen über dem Pellet. Vorsichtig wie oben mischen, dann erneut in die dritte Tube gießen und vorsichtig mischen. Die Aufhängung wird von Rohr zu Rohr immer trüber. Schließen Sie das dritte Rohr.
- Starten Sie die Entnahme der nächsten drei Mikroröhrchen wie oben (Schritt 4.14).
- Sammeln Sie alle resuspendierten MVs in einem einzigen (oder zwei) Kollektor-Mikroröhrchen (2 mL mit konischem Boden). Bewahren Sie 50 μl für die spätere Berechnung der Ausbeute dieses Schritts auf. Notieren Sie sich die Federungslautstärke.
- Das Kollektorrohr wird bei 14.000 x g für 1 h bei 4 °C zentrifugiert. In diesem Schritt wird SN4 generiert.
- Entsorgen Sie das SN4 sofort (gießen Sie es über ein überstehendes Auffangröhrchen). Bewahren Sie ein Aliquot von SN4 auf, um die Ausbeute des Reinigungsschritts zu berechnen, und resuspendieren Sie das Pellet vorsichtig in 500 μl HBBS (ohne Ca2+ und Mg2+). Bewahren Sie ein Aliquot von 50 μl des resuspendierten Pellets auf, um die Reinigungsausbeute zu berechnen und sein Volumen zu notieren.
- Lagern Sie das resuspendierte Pellet bis zu einem Monat bei 4 °C für funktionelle Assays unter sterilen Bedingungen oder bei -20 °C für strukturelle Assays.
- Berechnen Sie die Reinigungsausbeute (siehe ANMERKUNG unten) für jeden Schritt oder das gesamte Verfahren, indem Sie die Konzentration von MV in Überständen und/oder Pelletsuspensionen messen.
HINWEIS: Reinigungsausbeute (%): ([MV1] x SN1-Volumen) / ([MV4] x Endsuspensionsvolumen) x 100.
Diese Ausbeute muss auf die Anzahl der aus dem Kulturkolben isolierten Splenozyten rationalisiert und in Schritt 4.4 gezählt werden. Die Reinigungsausbeute des vorliegenden Experiments beträgt ~70%, ausgehend von 111 x 106 Zellen und 60 mL Überstand.- Der durch das Verfahren verursachte Verlust von SMVs ist zu bewerten, indem die SMVs gemessen werden, die in den SMV-armen Überständen verbleiben, die hauptsächlich Exosomen (SN2 und SN4) enthalten.
- Messen Sie die MV-Konzentration mit TRPS oder Prothrombinase-Assay38 für eine hohe Sensitivität und Spezifität.
ACHTUNG: Die MVs nach der Zentrifugation durch schnelles Gießen des Überstands auf dem Kopf stehend ernten. Das Warten oder die Verwendung von U-förmigen Mikroröhrchen führt zu einem MV-Verlust an der Mikroröhrchenwand. Verwenden Sie niemals eine Mikropipette, um den Überstand zu entsorgen; Das Pellet kann stattdessen abgesaugt werden. Verzögern Sie den Prozess niemals, nachdem die Zentrifuge gestoppt wurde. Eine Zentrifugation mit Überdrehzahl führt zu einer Kontamination des MV-Pellets durch Exosomen.
HINWEIS: Die Zentrifugationsgeschwindigkeiten und -dauer sind für eine MV-Anreicherung mit minimaler Kontamination durch Exosomen optimiert. Dieses Protokoll ist nicht zuverlässig, um Milzmonozyten/Makrophagen-MVs zu untersuchen, da diese Zellen phagozytieren und ihre eigenen MVs schnell zurückerobern können39. Das Protokoll kann nicht pausiert und später neu gestartet werden, da Zellen aufgrund der Zellviabilität verloren gehen.
Ergebnisse
Die bereitgestellten Daten geben eine vollständige Darstellung des gesamten Verfahrens unter Verwendung von zwei Haupttierbedingungen: unbehandelte junge C57BL/6-Mäuse und ihre Wurfgeschwister erhielten 2 Wochen lang alle 2 Tage sechs intraperitoneale (IP) PG-Injektionen. Sie zeigen auch die Fernwirkung einer intraperitonealen PG-Injektion auf die Milzreaktion nach 2 Wochen. Splenozyten-Mikrovesikel wurden entweder durch einen enzymatischen Prothrombinase-Assay oder durch spektrophotometrische Messung ihrer Proteine und RNA-Konzentration quantifiziert, und der Anteil der Neutrophilen wurde durch Durchflusszytometrie33,38 in der Splenozytensuspension bestimmt (Abschnitte 2-4 der ergänzenden Datei 1 und ergänzende Abbildung 2).
Zunahme des Milzgewichts und der Zellzahl nach 2-wöchiger IP-Injektion bei P. gingivalis
Bei jungen erwachsenen Mäusen führt die PG-Injektion nach 2 Wochen zu einer signifikanten 2,6-fachen Zunahme des Milzgewichts, wahrscheinlich aufgrund der Immunantwort. Tatsächlich war auch die Gesamtsplenozytenzahl um das 2,3-fache erhöht (Abbildung 2, n = 5 Mäuse pro Bedingung, p < 0,0001 durch den Student's T-Test).
Die Lebensfähigkeit der Splenozyten wird durch eine 2-wöchige Injektion bei P. gingivalis nicht beeinträchtigt
Ähnliche Viabilitätsraten wurden zwischen behandelten und unbehandelten Mäusen nach Splenozytenisolierung oder 24 Stunden nach Zellkultur gemessen. Nichtsdestotrotz, wenn der anfängliche Prozentsatz lebender Zellen bei t0 unter 76% lag, war die Lebensfähigkeit in beiden Gruppen nach 24 Stunden um ~50% reduziert (siehe Ctl 1-3, Tabelle 1, als Beispiel). Umgekehrt und unabhängig vom Zustand des Tieres wurde die 24-Stunden-Erholung verbessert, wenn der Anteil lebender Zellen bei t0 90 % oder mehr erreichte, was auf die entscheidende Rolle der ersten Isolationsschritte hinweist (Abbildung 3).
Die Anzahl der Splenozyten-Neutrophilen ist bei Mäusen, die mit P. gingivalis injiziert wurden, erhöht
Nach der Doppelfärbung wurden Neutrophile mittels Durchflusszytometrie als Mac1+ und LYG-6-(Gr1)+ identifiziert (siehe Materialtabelle und Abschnitt 4 in der Zusatzdatei 1). Als Reaktion auf PG war die Anzahl der neutrophilen Milz unmittelbar nach der Zellisolierung signifikant um das 40-fache erhöht (t0, 4,8% ± 0,6 vs. 0,86% ± 0,06). Dennoch ist zu bedenken, dass nach 24-stündiger Kultur der Neutrophilenanteil in der Splenozytensuspension von 4,8 % ± 0,6 auf 14,67 % ± 2,02 % ansteigt (Abbildung 4).
Die Ausscheidung von MVs aus Splenozyten nimmt bei Mäusen zu, die mit P. gingivalis infiziert sind
Gemäß dem Protokoll konnten wir nachweisen, dass die isolierten Splenozyten mehr MVs freisetzten, wenn Mäuse einer PG-Infektion unterzogen wurden. Im Vergleich dazu wurden die im Überstand ausgeschiedenen MVs bei PG-injizierten Mäusen zur Kontrolle von Individuen und dem Messassay etwa verdreifacht, wobei entweder der Nachweis durch Prothrombinase-Assay verwendet wurde, der sich auf die Gesamtoberfläche der von SMVs getragenen anionischen Phospholipide des Prokoagulans bezieht (Abbildung 5A), der Proteingehalt von SMVs, gemessen durch Spektrophotometrie (Abbildung 5B), oder der RNA-Gehalt von SMVs, der durch Spektrophotometrie bestimmt wurde (Abbildung 5C, n = 5, Prothrombinase: p = 0,002; Proteingehalt: p = 0,003; RNA-Gehalt, p = 0,008, nach Student's T-Test). Die Ausdehnung des höheren Faltungsbereichs wurde mit dem Prothrombinase-Assay ermittelt, der einen sehr niedrigen Hintergrund zeigte.
Interessanterweise kann eine Korrelation zwischen dem Proteingehalt der SMVs und den mit dem Prothrombinase-Assay gemessenen SMVs hergestellt werden (Ergänzende Abbildung 3). Darüber hinaus variierte die Größenverteilung der SMVs nicht, wie in vorläufigen Experimenten festgestellt wurde (Ergänzende Abbildung 4) beim Vergleich von SMVs von PG-stimulierten und unstimulierten Mäusen (medianer Durchmesser 193 nm vs. 189 nm). Diese Durchmesserwerte liegen nahe an denen von SMVs, die aus Ratten-Splenozyten als Reaktion auf eine 24-stündige Inkubation mit LPS (5 μg/ml) oder Phorbol-Myristatacetat (25 ng/ml) und Ionophor (1 μM) isoliert wurden (medianer Durchmesser, 222 nm vs. Kontrolle 212 nm)11 (Ergänzende Abbildung 5). Darüber hinaus kann der Proteingehalt der SMVs mittels Western Blot bestimmt werden, was die Charakterisierung spezifischer zytoplasmatischer oder Membranproteine ermöglicht, die bevorzugt in die SMVs exportiert werden (Ergänzende Abbildung 5).
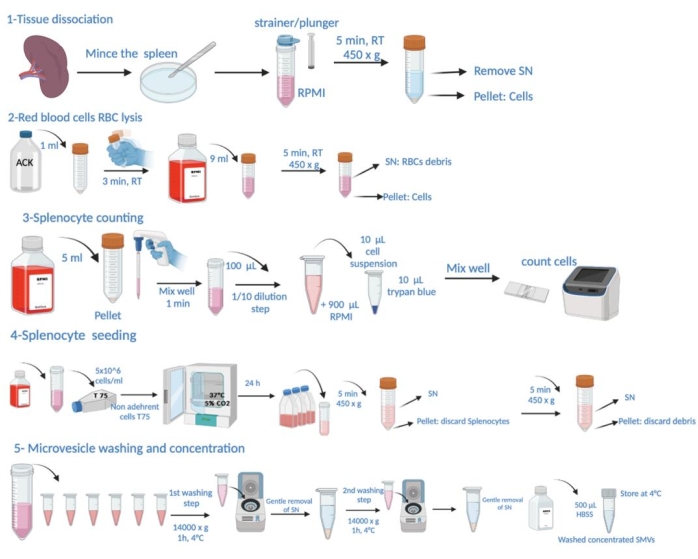
Abbildung 1: Schematische Darstellung der Protokollschritte. Dies besteht aus der Gewebedissektion, der Lyse der roten Blutkörperchen (RBC), der Splenozytenzählung, der Aussaat, der Mikrovesikelentnahme aus dem Überstand, dem Waschen und der Konzentrationsbestimmung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Die IP-Injektion von P. gingivalis erhöht signifikant das Milzgewicht (A) und die Splenozytenzahl (B). CTL: unbehandelte Mäuse, IP: Mäuse, die 2 Wochen lang einer PG-Injektion unterzogen wurden. Die Daten werden als Mittelwert ± SEM ausgedrückt. n = 5: ***: p < 0,0001 bzw. 0,0005. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die Lebensfähigkeit der Splenozyten ist 24 Stunden nach der Splenozytenkultur reduziert, während die IP-Injektion von P. gingivalis die Lebensfähigkeit der Zellen nicht verändert. CTL: unbehandelte Mäuse, IP: Mäuse, die 2 Wochen lang einer PG-Injektion unterzogen wurden, t0: Lebensfähigkeit unmittelbar nach der Isolierung gemessen, t24: nach 24-Stunden-Kultur. Die Daten werden als Mittelwert ± SEM ausgedrückt. n = 5, ***: p < 0,0001 durch den Student's t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
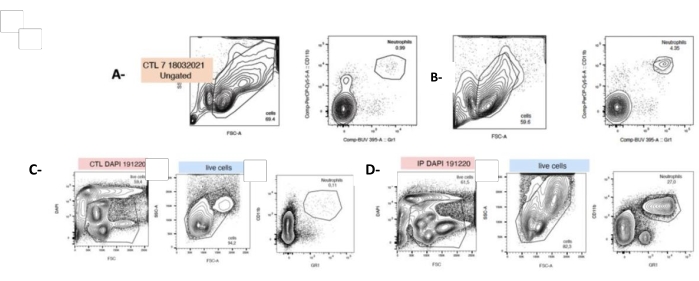
Abbildung 4: Die Injektion von P. gingivalis erhöht die Neutrophilenzahl bei t0 und nach 24 h Zellkultur. Die Zellen wurden frisch aus der geernteten Milz isoliert und mit fluoreszierenden Antikörpern markiert, die gegen Granulozyten (LyG-6 Gr1) oder Neutrophile (LY6-C) gerichtet waren, und im CD11b+ -Gate identifiziert, das Monozyten, Granulozyten und Neutrophile abgrenzt. Neutrophile wurden als LY6-C+, CD11b+ und LYG-6 Gr1 niedrig identifiziert. Repräsentative Diagramme mit SSC/FSC und CD11b+ und LYG-6 Gr1 Doppelfärbung für jede Bedingung bei t0 (A,B) oder 24 Stunden nach der Aussaat (C,D). A,C: unbehandelte Splenozyten von Mäusen; B,D: Splenozyten von Mäusen, die einer IP-Injektion von P. gingivalis unterzogen wurden. FSC: Vorwärts-Streuung; SSC: Seitliche Streuung; CTL: nicht exponierte Mäuse. n = 5, ***: p < 0,0001, 10000 erfasste Ereignisse pro Stichprobe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: P. gingivalis begünstigt eine verstärkte MV-Splenozytenabscheidung nach 24-stündiger Kultur. Splenozyten wurden aus mit P. gingivalis infizierten und Kontrollmäusen isoliert und über 24 h kultiviert, und SMVs, die mit verschiedenen Assays gemessen wurden. Schwarze Balken: unbehandelte Mäuse (CTL), graue Balken (IP): Mäuse, die 2 Wochen lang einer P. gingivalis-Injektion unterzogen wurden. A: Quantifizierung durch Prothrombinase-Assay, B: Proteinkonzentration der intakten SMVs bestimmt durch Spektrophotometrie, C: RNA-Gehalt von SMVs bestimmt durch Spektrophotometrie. Die Daten werden als Mittelwert ± SEM ausgedrückt. n = 5, **: p < 0,0001, durch den Student's t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Zustand der Tiere | Gewicht der Milz | Anzahl der Splenozyten | Rentabilität (%) | Rentabilität (%) |
| nach der Zellisolierung | ||||
| (mg) | (106 Zellen) | Nach 24 h Zellkultur | ||
| (t0) | ||||
| CTL 1 | 108 | 25 | 75 | 24 |
| CTL 2 | 112 | 55 | 70 | 26 |
| CTL 3 | 118 | 52 | 73 | 26 |
| CTL 4 | 83 | 38 | 91 | 46 |
| CTL 5 | 78 | 55 | 96 | 46 |
| Schutzart 1 | 243 | 150 | 91 | 43 |
| Schutzart 2 | 250 | 138 | 93 | 46 |
| Schutzart 3 | 283 | 85 | 90 | 46 |
| Schutzart IP 4 | 270 | 100 | 91 | 43 |
| Schutzart 5 | 300 | 125 | 91 | 43 |
Tabelle 1: Vergleich der Splenozyten-Lebensfähigkeitsraten zwischen den behandelten und unbehandelten Mäusen nach Splenozytenisolierung.
Ergänzende Abbildung 1: Wie sind prokoagulanziöse MVs prokoagulans? Weitere Informationen finden Sie in der Ergänzungsdatei 1. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: Der auf Mikropartikeln (MP) gefangene Prothrombinase-Assay. Weitere Informationen finden Sie in der Ergänzungsdatei 1. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: Korrelationsdiagramm zwischen Messungen von SMVs mittels Prothrombinase-Assay und mittels spektrophotometrischem Proteinassay bei unbehandelten oder mit P. gingivalis behandelten Mäusen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: Analyse der Größenverteilung von SMVs, die aus Mäusen (A) und Ratten-Splenozyten (B) isoliert wurden. Die Suspension der SMVs wurde aus der Milz von unbehandelten Mäusen (Kontroll-MVs) oder Personen gewonnen, die Zahnfleischschäden ohne LIG-MVs oder unter lokaler Zugabe von P. gingivalis (LIG-PG MVs) erlitten hatten. SMVs von Ratten wurden im Überstand isolierter Splenozyten entnommen, die einer 24-stündigen Stimulation durch LPS (LPS MVs) oder PMA (PMA MVs) unterzogen wurden, wie an anderer Stelle beschrieben37. Mittlerer Durchmesser: Mittlerer Durchmesser; Mode dia: Medianwert des Durchmessers. Die Messungen wurden mit einer 400-Nanopore durchgeführt, um den größten Größenverteilungsbereich zu bestimmen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5: Identifizierung des Proteingehalts von MVs aus Ratten-Splenozyten, die aus jungen Ratten mittels Western Blot isoliert wurden. Ausführliche Informationen finden Sie in der Zusatzdatei 1. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 1: Einzelheiten zu den experimentellen Verfahren und Erläuterungen zu den ergänzenden Abbildungen 1,2,5. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die vorliegende Studie bestätigt, dass die Milz eine wichtige und zuverlässige Quelle für MVs mit physiopathologischer Relevanz im Vergleich zu anderen Quellen wie Blut mit begrenztem Volumen bei Mäusen ist. Vorsichtsmaßnahmen vorausgesetzt, ist die Methode einfach einzurichten und erfordert keine teure Ausrüstung. Da es keinen anderen Weg als die In-vivo-Bewertung gibt, scheint das aktuelle Modell eine wertvolle Methode zu sein, um die Auswirkungen von Pro-Medikamenten auf die MV-Ausscheidung zu untersuchen. Wichtig ist, dass das hier vorgestellte standardisierte Protokoll für die Ernte von murinen Milz-Mikrovesikeln (SMVs) den ungedeckten Bedarf für die In-vivo-Studie zur Kontrolle von SMV-vermittelten Effekten decken sollte, eventuell in manipulierten Mäusen nach Injektion oder nasaler Instillation.
Die vorliegende Methode zeigt auch, dass SMVs relevante präklinische Werkzeuge sind, um Fernwirkungen von lokalen Infektionen, wie z.B. P. gingivalis IP-Infektionen, zu untersuchen. Unter Verwendung mehrerer Ansätze zeigten sich signifikante Unterschiede zwischen SMVs, die von mit P. gingivalis behandelten vs. Es wurden unbehandelte Tiere gemessen, was auf einen Ferneffekt der lokalen IP-Injektion hindeutet, der bereits nach 2 Wochen nachweisbar ist. Vorläufige Daten aus unserem Labor unter Verwendung anderer entfernter P. gingivalis-Infektionsstellen bestätigten, dass P. gingivalis bereits am 7. Tag nach der Infektion eine 1,7-fache SMV-Erhöhung auslösen kann.
Es wird auch beobachtet, dass die durch P. gingivalis induzierten Ferneffekte durch Milzanalysen mit signifikanten Schwankungen in Gewicht, Zellviabilität und Gesamtzahl bestätigt wurden. Darüber hinaus führte P. gingivalis zu einem 6,5-fachen Anstieg der Neutrophilenzahl der Milz, wenn es durch Immunfärbung direkt nach der Splenozytenisolierung (t0) gemessen wurde. Dementsprechend würden Variationen des Herkunftsprofils der SMV-Zellen auf die Abstoßung von Elternzellen hinweisen, die durch den Ausgangszustand des Tieres verursacht wird.
Da SMVs, die im Überstand von 24-Stunden-Splenozytenkulturen freigesetzt wurden, verdreifacht wurden, wenn sie aus IP-injizierten Mäusen isoliert wurden, scheinen sie zuverlässige Biomarker für die Milzaktivierung über die Ferne durch P. gingivalis zu sein, was sie zu einem möglichen Werkzeug zur Überwachung der pharmakologischen Kontrolle macht.
In vitro kann die Splenozytenkultur mit 10 % FBS durchgeführt werden, abgereichert oder nicht aus Exosomen. In den aktuellen Experimenten wurden keine Unterschiede beobachtet, und Variationen zwischen unbehandelten Splenozyten blieben bei beiden FBS-Typen in gleichem Maße nachweisbar.
Im vorliegenden Verfahren führte eine Dauer von 2 Wochen bei unbehandelten Mäusen nicht zu signifikanten Schwankungen des Milzgewichts. Es ist jedoch wichtig zu bedenken, dass das Milzgewicht mit dem Alter variieren kann, wie zuvor bei einer Reihe von jungen, alten und mittleren Kontrollratten berichtet wurde. 1 In einem solchen Fall muss die SMV-Quantifizierung als Zellzahlverhältnis ausgedrückt werden.
Das vorliegende Verfahren wurde für ein Mausmodell optimiert und eignet sich für weitere Untersuchungen an transgenen Mäusen. Obwohl der Hauptnachteil des Mausmodells ein geringes Milzgewicht im Vergleich zu Ratten33 ist, verhindern die hier beschriebenen adaptierten Splenozyten- und SMV-Isolierungsverfahren Zellschäden und -verluste, während alle kontaminierenden Erythrozyten vollständig verworfen werden. Das Waschen ist entscheidend für eine gute Splenozytenreinigungsausbeute und muss schonend mit nicht mehr als 1 ml ACK-Lysepuffer pro Milz in 9 ml RPMI durchgeführt werden, um eine weitgehende Eliminierung der roten Blutkörperchen zu ermöglichen. Dieser Schritt kann wiederholt werden, bis das Pellet weiß ist. Dieses Verfahren erlaubt keine Untersuchung von Monozyten und sollte in einem solchen Fall für adhärente Zellen angepasst werden.
Nach 24-stündiger Kultur spiegelt die in den Zellkulturüberständen gemessene SMV-Konzentration das Gleichgewicht zwischen MV-Erzeugung und MV-Rückgewinnung durch die kultivierten Splenozyten wider. Daher muss in angepassten Versionen des oben genannten Verfahrens besonderes Augenmerk auf das Vorhandensein von Zellen mit professioneller oder akzessorischer Phagozytenaktivität (Monozyten, Endothelzellen usw.) gelegt werden, und die Kinetik der SMV-Freisetzung im Überstand sollte entsprechend sorgfältig festgelegt werden.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren danken Claudine Ebel vom Service commun de cytométrie en flux (Institut de Génétique et de Biologie Moléculaire et Cellulaire, Straßburg) für die fachkundige Unterstützung und Ausbildung zur komplexen durchflusszytometrischen Analyse der Milz und Ali El Habhab für die Erstausbildung zur Markierung von Milzzellen der Ratte. Deniz Karagyoz half beim Ausgraben, Sammeln von Literatur. Diese Arbeit wurde teilweise durch zwei ANR-Zuschüsse unterstützt: COCERP (N°A17R417B), ENDOPAROMP (N°ANR-17-CE17-0024-01).
Materialien
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
Referenzen
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669 (2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21 (2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778 (2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356 (2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197 (2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215 (2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898 (2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45 (2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734 (2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.