Method Article
在腹膜内细菌感染的小鼠模型中分离脾微泡
摘要
从质膜脱落的微泡充当细胞效应器。脾微泡 (SMV) 是病理生理状况的替代标志物。在大鼠和小鼠中,SMV 含量和特性表征衰老或炎症,并通过细胞保护性治疗而改变,使其成为临床前研究有价值但丰富的监测工具。
摘要
微泡 (MV) 是从活化细胞质膜释放的亚微米片段,充当促炎和促凝血细胞效应器。在大鼠中,脾脏 MVs (SMV) 是病理生理状况的替代标志物。先前的体外研究表明,牙龈卟啉单胞菌 (P. gingivalis) 是一种主要的牙周病原体,能够促进内皮脱落和细胞凋亡,而脂多糖 (LPS) 有利于脾细胞衍生的微泡 (SMV) 的脱落。体内研究表明了 SMV 脱落的药理学控制的可行性。本方案建立了从牙龈卟啉单胞菌急性小鼠感染模型中分离脾 SMV 的标准化程序。通过腹腔注射 (每周 3 次注射 5 x 107 个细菌) 诱导年轻 C57BL/6 小鼠牙龈卟啉单胞菌感染。两周后,收集脾脏,称重,计数脾细胞。通过蛋白质、 RNA 和凝血酶原酶测定分离和定量 SMV。通过碘化丙啶或台盼蓝排除染料评估细胞活力。脾细胞提取后,脾细胞培养 24 小时后通过流式细胞术获得中性粒细胞计数。在注射牙龈卟啉单胞菌的小鼠中,观察到脾脏重量增加 2.5 倍,脾细胞计数增加 2.3 倍,而中性粒细胞计数增加 40 倍。来自牙龈卟啉单胞菌注射小鼠的脾细胞活力范围为 75%-96%,培养 24 小时后降低 50%,与未暴露的对照相比,无任何显着差异。然而,通过凝血酶原酶测定或蛋白质测量,注射小鼠的脾细胞脱落了更多的 MV。数据表明,促凝血 SMV 是评估早期脾脏对腹膜内牙龈卟啉单胞菌感染反应的可靠工具。
引言
微泡 (MVs),也称为微粒或胞外体,是响应各种细胞刺激而释放在体液和细胞外间隙中的直径为 0.1-1.0 μm 的质膜片段。MV 最初被发现是暴露出促凝血磷脂(主要是磷脂酰丝氨酸 (PSer))的血小板尘埃,构成了凝血复合物组装的额外表面 1,2。循环 MV 作为促凝血效应子的关键作用已在 Scott 综合征 2 患者中得到证实,Scott 综合征2 是一种罕见的遗传病,会导致功能失调的 PSer 暴露和出血(补充图 1)。MV 已被广泛研究为与心血管疾病相关的慢性疾病(如糖尿病、慢性肾病、子痫前期和高血压)血栓形成风险的循环生物标志物 3,4。它们目前被认为是液体或器官组织(如心肌1)中的真正细胞效应子。因为它们传递活性蛋白、脂质和 miRNA,所以它们会远程调节血管反应,如止血、炎症、血管生成和血管生长或组织重塑5。
虽然临床研究检查了 MV 在风险因素方面的预后价值,但从患者体液或组织中分离的 MV 能够对其效应特性 进行体外 评估6。控制 MV 生物发生和串扰能力的机制的破译通常在细胞培养模型中实现,以识别 MV 暴露或封装在 MV 中的活性分子及其下游信号传导。MV 与靶细胞的相互作用将取决于膜蛋白/蛋白质结合(当合适的反配体可用时)和/或脂质融合7。
在生理条件下,血浆中循环的 MV 主要来源于维管细胞,由谱系簇分化标志物 (CD) 鉴定8,9。然而,在病理学中,特别是在癌症10 和移植物排斥反应11,12 中,MV 从受损组织中脱落并具有有害的促凝血和促炎特征。这些在体循环中检测到,使其成为监测保护性或年轻化疗法以及可能的药理学靶点的有用探针13。由于 MV 作为反映健康和疾病中血管和组织细胞稳态的动态储存池循环,因此在小动物静脉注射或鼻滴注后,还需要在体内更好地了解它们的远程作用14,15。事实上,MV 被认为是耦合夸张炎症和血栓形成的复杂途径的主要贡献者16。
牙周炎是一种感染性炎症性疾病,影响牙齿支撑组织17,18,并与血栓形成风险有关。它的特点是牙龈出血、牙槽骨破坏、牙齿松动,并最终导致牙齿脱落。牙周炎在世界范围内非常普遍,影响超过 50% 的人口,其中 11% 表现为严重的19 型。牙周炎是由龈下生物膜的细菌菌群失调引起的,它维持着加剧的炎症反应,从而引发组织破坏20。在过去的十年中,牙周炎与心血管疾病、糖尿病和类风湿性关节炎等全身性疾病有关。可能的解释是牙周病原体在远处的作用和/或促炎细胞因子(如白细胞介素 (IL-1、IL-6) 和 TNF-α介导的全身炎症增加21,22。
在与牙周炎发作和发展相关的病原体中,牙龈卟啉单胞菌 (P. gingivalis)23 存在于最严重的病变中,这些病变收获了多种毒力因子,包括脂多糖 (LPS)24 诱导 Toll 样受体 (TLR) 介导的炎症反应25 以及在初始感染部位募集中性粒细胞和多形核白细胞 (PMN)26。来自牙龈卟啉单胞菌的 LPS 激活 TLR-4 或 TLR-2,促进免疫检测和细菌存活逃避27。在血管水平,LPS 激活 TLR2 与免疫血栓形成有关。P. gingivalis 提示 TLR-2 信号传导的独特能力,而 TLR-4 依赖性识别显著受损,有利于持续性低度感染28,29。
研究 MV 对低级别病原体慢性和持续感染的反应的体内程序很少。文献中对 tissular MVs 提取的方法描述不佳,通常涉及从实体瘤、肝脂肪变性、动脉粥样硬化血栓形成斑块或移植物等病理组织中收获 MV 11,29,30,而脾脏感知血液中的细菌和病毒。它还储存参与免疫反应的红细胞、血小板、淋巴细胞、单核细胞、嗜碱性粒细胞和嗜酸性粒细胞。粒细胞(如来自红浆的中性粒细胞)也会产生活性氧 (ROS) 和蛋白酶,从而破坏病原体并防止感染传播31,32。令人惊讶的是,据我们所知,脾脏 MV 并未在病原体诱导的组织损伤的情况下进行研究。全球存在未满足的需求,需要研究生理病理学中 tissular MVs 的变化。
我们实验室的体外数据表明,LPS 诱导大鼠脾细胞中促凝血 MV 脱落,进而促使培养的冠状动脉内皮细胞衰老和连续的促炎和促炎促凝血内皮表11。在用优化的 omega-3 配方治疗动物后,进一步证明了脾脏 MV 药理学控制的可行性。发现中老年大鼠的口服灌胃对促凝血 MV 从脾细胞脱落及其对冠状动脉内皮的有害特性具有保护作用33。
与血液相比,脾脏的优势在于它是一个个体白细胞的重要来源。此外,最近提出了脾-心轴 3,34,使脾脏成为感染相关心血管风险的可能贡献者,对药物控制有益。SMV 特性或释放的评估是了解病原体诱导或炎症反应的关键。有趣的是,它可以在治疗过的动物和不同的生理病理模型(年龄、高血压、糖尿病)中实现。事实上,通过比较中年和老年大鼠33,在简单的 24 小时脾细胞培养后可以证明脾 MVs 特性和释放的差异。
鉴于上述证据证明脾脏 MVs 的效应特性随生理病理条件的变化及其在大鼠中进行药理学控制的可行性,本文描述了用于分离小鼠脾脏 MVs 的标准化方案。该程序将更适合对支持 SMV 介导作用的 体内 机制的深入研究,最终在工程小鼠中进行。该程序是使用 牙龈卟啉单 胞菌的局部腹膜内感染在 C57BL/6 小鼠中建立的,以证明病原体对脾脏 MV (SMV) 效应子特性的远程作用。
研究方案
所有实验方案均经当地伦理委员会 (APAFIS#28745-2020121815051557) 以及母校和 INSERM 的动物护理部门批准并遵循相关指导方针。使用雄性年轻 C57BL/6 小鼠,6-8 周龄进行实验。定期检查小鼠以评估疼痛和压力,并每天监测它们的体重。除非另有说明,否则所有提取缓冲液和溶液都必须在室温下无菌。
1. 动物准备
- 每 2 天给小鼠腹膜内注射 6 次牙龈卟啉单 胞菌 (PG),持续 2 周(每周 3 次注射 5 x 107 个细菌/周, 补充文件 1)。
- 使用 100 mg/kg 氯胺酮和 10 mg/kg 甲苯噻嗪的组合麻醉小鼠。
- 处死麻醉小鼠,剖腹手术后收获脾脏。
注意:P . gingivalis 感染的具体条件和动物为收获脾脏而牺牲的具体条件在 补充文件 1 的“动物实验”部分有详细说明。协议步骤的示意图如图 1 所示。
2. 提取脾细胞
- 使用手术刀,在培养皿中将脾脏组织切碎成 ~1 mm 的切片,培养皿中已经装满了 3 mL 含有抗生素(链霉素 (100 U/mL)/青霉素 (100 U/mL)、真菌酮 (250 mg/mL)、L-谷氨酰胺 (2 mM)),并补充有 10% 胎牛血清 (FBS)(见 材料表)。
- 将切片转移到筛子中(参见 材料表),筛子事先连接到 50 mL 聚苯乙烯管上。
- 使用注射器的柱塞作为杵,将组织压碎筛子上。
- 用 RPMI 培养基 (3 mL) 冲洗筛子。
- 在室温下以 450 x g 离心细胞悬浮液洗脱液 5 分钟,然后通过回流小心弃去上清液。
3. 通过 渗透压休克去除红细胞
- 加入 1 mL ACK 缓冲液(参见 材料表),充分混合,在室温下孵育 3 分钟,然后用手旋转轻轻摇晃。
- 加入 9 mL RPMI 稀释,并使用吸液和回流充分混合。
- 在室温下以 450 x g 离心 5 分钟。
- 通过抽吸和回流弃去上清液,并将沉淀重悬于 5 mL RPMI 培养基中。
- 轻轻混合(吸液/回流),最终通过移液或使用筛子去除任何脂质碎片。
4. 调整分离的脾细胞浓度
- 填充含有 900 μL RPMI 的 1.5 mL 微管。
- 使用微量移液器,取 100 μL 细胞悬液,加入含有 900 μL RPMI 培养基的 1.5 mL 微管中,并充分混合。
- 将 10 μL 稀释的细胞转移到微管中,加入 10 μL 台盼蓝排阻染料,并充分混合。
- 将 10 μL 溶液(步骤 3.3)放入自动细胞计数仪的计数玻片中(参见 材料表)并确定细胞计数。
注意:设备软件给出两个值:总细胞数和活细胞数和百分比。 - 将活细胞浓度调节至 3 或 5 x 106 个细胞/mL(Vmax = 20 mL;最大总容量为 100 x 106 个细胞/mL)。
- 将细胞接种在含有 RPMI 的 75 mL 培养瓶中。
- 将烧瓶在 37 °C 的加湿培养箱中垂直孵育 24 小时。
注意: 台盼蓝是一种致突变剂和致癌剂35,36。确保在计数时戴手套,即使在引擎盖外也是如此。立即将吸头和液体倒入容器中,并清洗工作台表面。
注:如果收集的细胞小于 50 x 106,请使用 25 mL 培养瓶。细胞数量不应因人而异。在此步骤中,活细胞的百分比通常优于 80%。
5. 分离脾细胞微泡
- 24 小时后,将培养瓶内容物倒入 50 mL 聚丙烯或聚苯乙烯管中。
- 在室温下以 450 x g 离心 15 分钟以去除细胞和碎片。
- 离心后,保留 100 μL 第 1 上清液 (SN1),用于最终测量初始 MV 浓度以计算分离产量。请注意 SN1 卷。
- 在室温下以 450 x g 离心 SN1 15 分钟。
- 弃去沉淀,在室温下再次以 450 x g 离心 15 分钟。快速提取并收集 SN2 (注意体积)。
- 将 SN2 转移至底部呈锥形的 1.8 mL 微离心管中。保留 100 μL SN2 用于初始 MV 浓度的最终测量,以计算分离产量,以防过多的碎片最终损害 SN1 中的 MV 测量。
- 向沉淀物(细胞)中加入 5 mL RPMI 培养基并计数脾细胞。
注:细胞悬液也可以固定在 0.1% 多聚甲醛(终浓度)中用于流式细胞术表征37。 - 将SN2 在4°C下以14,000 x g 离心1小时,并最终通过在4°C下运行空转子来提前冷藏转子。 此步骤生成 SN3。
- 立即从每个微管中取出 SN3,方法是倒置在一根无菌 50 mL 试管上(在引擎盖下)。请注意 SN3 卷。
- 在引擎盖下使用移液器轻轻混合 SN3。在悬浮液中保留等分试样以进行最终测量。
注意:该溶液现在已耗尽 MV,但包含可溶性介质和外泌体。 - 在带尖刺的架子上刮擦每个微管(封闭),以机械地有利于 MV 在颗粒中的重悬。
- 在第一个微管中加入 200 μL 不含 Ca2+ 和 Mg2+ (HBSS) 的 Hank 平衡盐水溶液(参见 材料表)。
- 使用 1 mL 微量移液器通过轻柔的吸液/回流循环(~10 次)重悬第一管的 MV 沉淀。要非常小心地避免起泡,因为这会促进悬浮液中囊泡和其他部分的氧化。
- 收获前 200 μL 重悬的 MV,并将它们倒入沉淀上方的第二根试管中。如上所述轻轻混合,然后再次倒入第三管中并轻轻混合。悬浮液从管到管变得越来越浑浊。关闭第三根管子。
- 如上所述开始收集接下来的三个微管(步骤 4.14)。
- 将所有重悬的 MV 收集在单个(或两个)收集微管(2 mL,底部呈锥形)中。保留 50 μL 用于最终计算此步骤的产量。注意悬浮液体积。
- 将收集管在 4 °C 下以 14,000 x g 离心 1 小时。 此步骤生成 SN4。
- 立即丢弃 SN4(倒在上清液收集管上)。保留 SN4 等分试样以计算纯化步骤的产量,并将沉淀轻轻重悬于 500 μL HBBS(不含 Ca2+ 和 Mg2+)中。保留 50 μL 等分试样的重悬沉淀,以计算纯化产量并记录其体积。
- 将重悬的沉淀在 4 °C 下储存长达一个月,以便在无菌条件下进行功能测定,或在 -20 °C 下储存用于结构测定。
- 通过测量上清液和/或沉淀悬浮液中 MV 的浓度,计算每个步骤或整个过程的纯化产量(参见下面的注释)。
注:纯化产量 (%):([MV1] x SN1 体积)/([MV4] x 最终悬浮液体积)x 100。
该产量需要根据从培养瓶中分离的脾细胞数量合理化,并在步骤 4.4 中计数。本实验的纯化产量为 ~70%,从 111 x 106 个细胞和 60 mL 上清液开始。- 通过测量残留在 SMV 耗尽且主要含有外泌体(SN2 和 SN4)的上清液中残留的 SMV,评估该程序引起的 SMV 损失。
- 通过 TRPS 或凝血酶原酶测定法38 测量 MV 浓度,以获得高灵敏度和特异性。
注意:离心后通过快速倒入上清液收获 MV。等待或使用 U 形微管会提示微管壁上的 MV 丢失。切勿使用微量移液器丢弃上清液;颗粒可以被吸出。离心机停止后切勿延迟该过程。超速离心将导致 MV 沉淀被外泌体污染。
注:离心速度和持续时间针对 MV 富集进行了优化,外泌体的污染最小。该方案对于研究脾单核细胞/巨噬细胞 MV 不可靠,因为这些细胞可以吞噬细胞并快速重新捕获自己的 MV39。由于细胞活力导致细胞损失,该方案不能暂停和稍后重新启动。
结果
提供的数据使用两种主要动物条件完整地代表了整个过程:对照未经治疗的年轻 C57BL/6 小鼠及其同窝小鼠每 2 天进行 6 次腹膜内 (IP) PG 注射,持续 2 周。它们还显示了 2 周后腹膜内 PG 注射对脾脏反应的远程作用。通过凝血酶原酶测定或通过分光光度法测量其蛋白质和 RNA 浓度来定量脾细胞微泡,并通过流式细胞术33,38 测定脾细胞悬液中中性粒细胞的比例(补充文件 2 和补充图 2 的第 4-1 节)。
牙龈卟啉单胞菌 IP 注射 2 周后脾脏重量和细胞数量增加
在年轻成年小鼠中,PG 注射导致 2 周后脾脏重量显着增加 2.6 倍,这可能是由于免疫反应。事实上,总脾细胞计数也增加了 2.3 倍(图 2,每种情况 n = 5 只小鼠, p < 0.0001 通过学生 T 检验)。
脾细胞活力不受牙龈卟啉单胞菌注射 2 周的影响
在脾细胞分离后或细胞培养后 24 小时,在处理和未处理的小鼠之间测量了相似的活力率。然而,当 t0 处活细胞的初始百分比低于 76% 时,24 小时后两组的活力都降低了 ~50%(参见 Ctl 1-3, 表 1,作为示例)。相反,无论动物状况如何,当活细胞的比例在 t0 达到 90% 或更高时,24 小时的回收率都会增强,这表明第一个分离步骤的关键作用(图 3)。
在牙 龈卟啉单胞菌注射的小鼠中脾细胞中粒细胞计数增加
双染色后,通过流式细胞术鉴定中性粒细胞为 Mac1 + 和 LYG-6 - (Gr1)+ (参见 材料表 和 补充文件 4 中的第 1 节)。作为对 PG 的响应, 中性粒细胞脾脏计数在细胞分离后显着增加了 40 倍 (t0,4.8% ± 0.6 vs. 0.86% ± 0.06)。然而,值得考虑的是,培养 24 小时后,脾细胞悬浮液中的中性粒细胞比例从 4.8% ± 0.6% 增加到 14.67%,± 2.02%(图 4)。
在牙龈卟啉单胞菌感染的小鼠中,脾细胞中 MVs 的脱落增加
按照该方案,我们证明当小鼠受到 PG 感染时,分离的脾细胞释放了更多的 MVs。相比之下,为了对照个体和测量测定,在 PG 注射的小鼠中,上清液中脱落的 MV 大约增加了两倍,使用凝血酶原测定法的检测,该测定是指 SMV 携带的促凝阴离子磷脂的总表面(图 5A),通过分光光度法测量的 SMV 的蛋白质含量(图 5B),或通过分光光度法评估的 SMV 的 RNA 含量(图 5C, n = 5,凝血酶原酶: p = 0.002;蛋白质含量: P = 0.003;RNA 含量, p = 0.008,通过学生 T 检验)。 使用凝血酶原酶测定获得更高的倍数范围范围,该测定显示背景非常低。
有趣的是,SMV 蛋白含量与凝血酶原酶测定法测量的 SMV 之间存在相关性(补充图 3)。此外,SMV 大小分布没有变化,如初步实验中确定的那样(补充图 4),比较来自 PG 刺激和未刺激小鼠的 SMV(中位直径 193 nm 对 189 nm)。这些直径值接近于响应与 LPS (5 μg/mL) 或佛波醇肉豆蔻酸酯 (25 ng/mL) 和离子载体 (1 μM) 孵育 24 小时后从大鼠脾细胞中分离的 SMV 的直径值,(中位直径,222 nm vs. 对照 212 nm)11 (补充图 5)。此外,SMV 的蛋白质含量可以通过 western blot 进行评估,从而能够表征优先输出到 SMV 中的特异性细胞质或膜蛋白(补充图 5)。
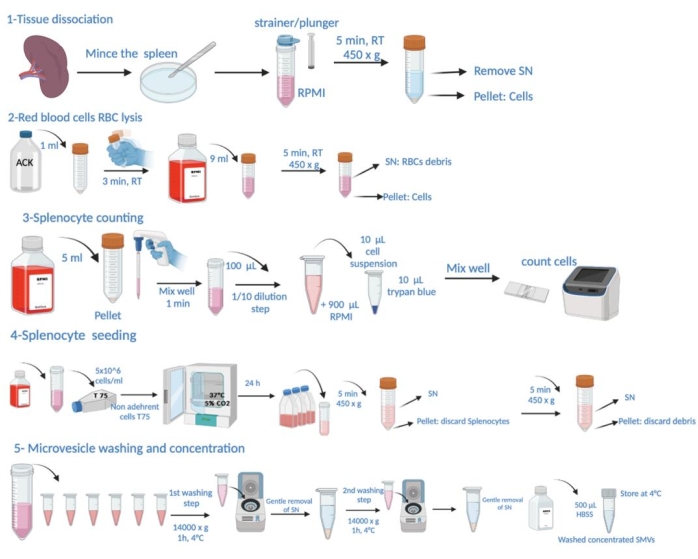
图 1:协议步骤的示意图。 这包括组织解剖、红细胞 (RBC) 裂解、脾细胞计数、接种、从上清液中收获微泡、洗涤和浓度测定。 请单击此处查看此图的较大版本。

图 2:牙 龈卟啉单 胞菌 IP 注射显着提高脾重量 (A) 和脾细胞计数 (B)。 CTL:未治疗的小鼠,IP:PG 注射 2 周的小鼠。数据表示为 SEM ±平均值。n = 5: ***: p 分别< 0.0001 和 0.0005。 请单击此处查看此图的较大版本。

图 3:脾细胞培养后 24 小时脾细胞活力降低,而 IP 注射 牙龈卟啉单 胞菌不会改变细胞活力。 CTL:未处理的小鼠,IP:PG 注射 2 周的小鼠,t0:分离后立即测量活力,t24:培养 24 小时后。数据表示为均值 ± SEM。n = 5,***: p < 0.0001 通过学生 T 检验。 请单击此处查看此图的较大版本。
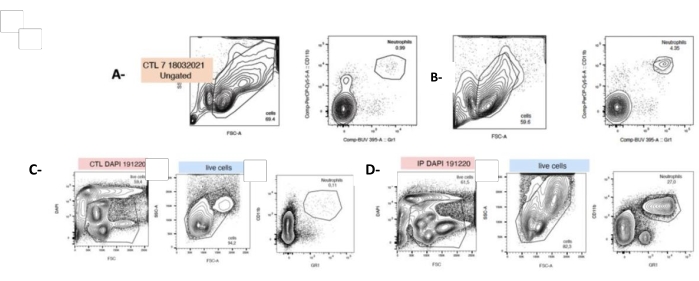
图 4: 牙龈卟啉单 胞菌注射液在 t0 和细胞培养 24 小时后增加中性粒细胞计数。 从收获的脾脏中新鲜分离细胞,并用针对粒细胞 (LyG-6 Gr1) 或中性粒细胞 (LY6-C) 的荧光抗体标记,并在描绘单核细胞、粒细胞和中性粒细胞的 CD11b + 门中鉴定。中性粒细胞鉴定为 LY6-C+、CD11b+ 和 LYG-6 Gr1 低。代表性图显示 SSC/FSC 和 CD11b + ,以及 t0 (A,B) 或接种后 24 小时 (C,D) 每种条件的 LYG-6 Gr1 双染色。A,C: 未处理的小鼠脾细胞;B,D: 来自 IP 注射牙 龈卟啉单胞菌的小鼠的脾细胞。FSC: 前向散射;SSC: Side Scatter 侧向散射;CTL: 未暴露的小鼠。n = 5,***: p < 0.0001,每个样本采集 10000 个事件。 请单击此处查看此图的较大版本。

图 5: P. gingivalis 有利于培养 24 小时后增强的 MV 脾细胞脱落。 从牙 龈卟啉单 胞菌感染的小鼠和对照小鼠中分离脾细胞并培养 24 小时,并通过不同的测定法测量 SMV。黑条:未处理的小鼠 (CTL),灰条(IP):注射 牙龈卟啉 单胞菌 2 周的小鼠。A:通过凝血酶原测定法定量,B:通过分光光度法测定完整 SMV 的蛋白质浓度,C:通过分光光度法测定 SMV 的 RNA 含量。数据表示为均值 ± SEM。n = 5,**: p < 0.0001,通过学生 T 检验。 请单击此处查看此图的较大版本。
| 动物状况 | 脾重量 | 脾细胞数量 | 活力 (%) | 活力 (%) |
| 细胞分离后 | ||||
| (毫克) | (106 个细胞) | 细胞培养 24 小时后 | ||
| (t0) | ||||
| 第 1 克拉 | 108 | 25 | 75 | 24 |
| 第 2 节 | 112 | 55 | 70 | 26 |
| 第 3 节 | 118 | 52 | 73 | 26 |
| 第 4 节 | 83 | 38 | 91 | 46 |
| 第 5 节 | 78 | 55 | 96 | 46 |
| IP地址 1 | 243 | 150 | 91 | 43 |
| 防护等级 2 | 250 | 138 | 93 | 46 |
| 防护等级 3 | 283 | 85 | 90 | 46 |
| 防护等级 4 | 270 | 100 | 91 | 43 |
| 防护等级 5 | 300 | 125 | 91 | 43 |
表 1:脾细胞分离后治疗和未治疗小鼠的脾细胞活力率比较。
补充图 1:促凝血 MV 如何促凝? 有关详细信息,请参阅 补充文件 1. 请单击此处下载此文件。
补充图 2:基于微粒 (MP) 捕获的凝血酶原测定。 有关详细信息,请参阅 补充文件 1. 请单击此处下载此文件。
补充图 3: 在未经处理或 牙龈卟啉单 胞菌处理的小鼠中通过凝血酶原测定和分光光度蛋白测定测量 SMV 之间的相关性图。 请点击此处下载此文件。
补充图 4: 分析从小鼠 (A) 和大鼠脾细胞 (B) 分离的 SMV 的大小分布。SMV 的悬浮液来自未经处理的小鼠 (对照 MVs) 或在没有 LIG MVs 或局部添加牙 龈卟啉单 胞菌 (LIG-PG MVs) 的牙龈损伤个体的脾脏中。如其他地方所述,在经 LPS (LPS MVs) 或 PMA (PMA MVs) 刺激 24 小时的离体脾细胞的上清液中收获来自大鼠的SMVs37。平均直径:平均直径;模态直径:直径的中值。使用 400 纳米孔进行测量,以评估最大的尺寸分布范围。 请点击此处下载此文件。
补充图 5: 通过 western blot 鉴定从年轻大鼠中分离的大鼠脾细胞中 MVs 的蛋白质含量。有关详细信息,请参阅 补充文件 1。 请点击此处下载此文件。
补充文件 1:有关实验程序的详细信息和补充图 1、2、5 的解释。请点击此处下载此文件。
讨论
本研究证实,与小鼠体积有限的血液等其他来源相比,脾脏是具有生理病理学相关性的 MV 的主要可靠来源。如果采取预防措施,该方法易于设置,不需要昂贵的设备。由于除了 体内 评估之外没有其他方法可用,因此目前的模型似乎是研究前药对 MV 脱落影响的有价值的方法。重要的是,此处介绍的收获小鼠脾微泡 (SMV) 的标准化方案应该适合控制 SMV 介导效应的 体内 研究的未满足需求,最终在注射或鼻腔滴注后在工程小鼠中。
该方法还表明,SMV 是研究局部感染(如 牙龈卟啉单 胞菌 IP 感染)的远程影响的相关临床前工具。事实上,使用多种方法,从 牙龈卟啉单胞菌处理释放的 SMV 与。测量未治疗的动物,表明局部 IP 注射的远程效应,2 周后已经可以检测到。我们实验室使用其他远程 牙龈卟啉 单胞菌感染部位的初步数据证实, 牙龈卟啉单 胞菌可能早在感染后第 7 天就开始 SMV 升高 1.7 倍。
还观察到,牙 龈卟啉单胞菌诱导的远程效应通过脾脏分析得到证实,重量、细胞活力和总数存在显着变化。此外,在脾细胞分离后 (t0) 通过免疫染色测量时,牙 龈卟啉 单胞菌促使脾中性粒细胞计数增加 6.5 倍。因此,SMV 细胞起源谱的变化表明亲本细胞的脱落是由动物的初始条件引起的。
由于从 IP 注射小鼠中分离时,在 24 小时脾细胞培养物上清液中释放的 SMV 增加了两倍,因此它们似乎是 牙龈卟啉单 胞菌远程脾激活的可靠生物标志物,使它们最终成为监测药理学控制的工具。
在体外,可以使用 10% FBS 进行脾细胞培养,无论是否从外泌体中去除。在目前的实验中,没有观察到差异,并且两种类型的 FBS 在相同程度上仍然可以检测到未经处理的脾细胞之间的差异。
在本程序中,2 周的持续时间不会导致未经治疗的小鼠脾脏重量的显着变化。然而,重要的是要记住,脾脏重量可能随年龄而变化,正如之前在一系列年轻、老年和中年对照大鼠中报道的那样。1 在这种情况下,SMV 定量需要表示为细胞计数比。
本程序针对小鼠模型进行了优化,适用于进一步的转基因小鼠研究。尽管小鼠模型的主要缺点是与大鼠33 相比脾脏重量小,但本文描述的适应性脾细胞和 SMV 分离程序可防止细胞损伤和丢失,同时所有污染的红细胞都被完全丢弃。洗涤对于良好的脾细胞纯化产量至关重要,需要在 9 mL RPMI 中每个脾脏的 ACK 裂解缓冲液不超过 1 mL 进行洗涤,以实现红细胞的广泛消除。可以重复此步骤,直到颗粒呈白色。该程序不允许研究单核细胞,在这种情况下应适用于贴壁细胞。
培养 24 小时后,在细胞培养上清液中测得的 SMV 浓度反映了 MV 产生和培养的脾细胞重新捕获 MV 之间的平衡。因此,在上述程序的改编版本中,需要特别注意具有专业或辅助吞噬细胞活性的细胞(单核细胞、内皮细胞等)的存在,并且应相应地仔细建立上清液中 SMV 释放的动力学。
披露声明
作者没有什么可披露的。
致谢
作者感谢斯特拉斯堡 Service commun de cytométrie en flux (Institut de Génétique et de Biologie Moléculaire et Cellulaire) 的 Claudine Ebel 为脾脏的复杂流式细胞术分析提供专家帮助和组建,并感谢 Ali El Habhab 对大鼠脾细胞标记进行初步培训。Deniz Karagyoz 帮助挖掘收集文献。这项工作得到了两个 ANR 赠款 COCERP (N°A17R417B)、ENDOPAROMP (N°ANR-17-CE17-0024-01) 的部分支持。
材料
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
参考文献
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669(2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21(2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778(2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356(2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197(2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215(2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898(2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45(2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734(2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。