Method Article
عزل الحويصلات الدقيقة الطحالية في نموذج الفئران للعدوى البكتيرية داخل الصفاق
In This Article
Summary
تعمل الحويصلات الدقيقة المتساقطة من غشاء البلازما كمؤثرات خلوية. الحويصلات الدقيقة للطحال (SMVs) هي علامات بديلة للحالات الفيزيولوجية المرضية. في الفئران والفئران ، يميز محتوى وخصائص SMV الشيخوخة أو الالتهاب ويتم تغييرها عن طريق العلاجات الواقية للخلايا ، مما يجعلها أداة مراقبة قيمة ولكنها وفيرة للأبحاث قبل السريرية.
Abstract
الحويصلات الدقيقة (MVs) عبارة عن شظايا فرعية من الميكرون يتم إطلاقها من غشاء البلازما للخلايا المنشطة والتي تعمل كمؤثرات خلوية مسببة للالتهابات وتخثر. في الفئران ، الطحال MVs (SMVs) هي علامات بديلة للظروف الفيزيولوجية المرضية. أظهرت الدراسات السابقة في المختبر أن Porphyromonas gingivalis (P. gingivalis) ، وهو أحد مسببات الأمراض الرئيسية في اللثة ، يمكن من تساقط البطانة وموت الخلايا المبرمج بينما يفضل عديدات السكاريد الدهنية (LPS) تساقط الحويصلات الدقيقة المشتقة من خلايا الطحال (SMVs). أظهرت الدراسات في الجسم الحي جدوى التحكم الدوائي في تساقط SMV. يضع البروتوكول الحالي إجراء موحديا لعزل المتلازمات المتلازمة الطحالية من نموذج عدوى الفئران الحادة P. gingivalis . P. اللثة تم إحداث عدوى في الفئران الصغيرة C57BL / 6 عن طريق الحقن داخل الصفاق (ثلاث حقن من 5 × 107 بكتيريا / أسبوع). بعد أسبوعين ، تم جمع الطحال ووزنها وعد خلايا الطحال. تم عزل SMVs وقياسها كميا بواسطة فحوصات البروتين والحمض النووي الريبي والبروثرومبيناز. تم تقييم صلاحية الخلية إما عن طريق أصباغ استبعاد يوديد البروبيديوم أو التريبان الأزرق. بعد استخراج خلايا الطحال ، تم الحصول على عدد العدلات عن طريق قياس التدفق الخلوي بعد 24 ساعة من زراعة خلايا الطحال. في الفئران المحقونة باللثة ، لوحظت زيادة بمقدار 2.5 ضعف في وزن الطحال وزيادة بمقدار 2.3 مرة في عدد خلايا الطحال ، بينما تم تعزيز عدد العدلات بمقدار 40 ضعفا. تراوحت صلاحية خلايا خلايا الطحال من الفئران المحقونة بالمتصورة اللثوية من 75٪ -96٪ وانخفضت بنسبة 50٪ بعد 24 ساعة من الثقافة دون أي فرق كبير مقارنة بالضوابط غير المكشوفة. ومع ذلك ، فإن خلايا الطحال من الفئران المحقونة تلقي كميات أكبر من MVs عن طريق فحص البروثرومبيناز أو قياسات البروتين. توضح البيانات أن SMVs التخثرية هي أدوات موثوقة لتقييم استجابة الطحال المبكرة لعدوى المتصورة اللثوية داخل الصفاق.
Introduction
الحويصلات الدقيقة (MVs) ، والتي تسمى أيضا الجسيمات الدقيقة أو الجسيمات الخارجية ، هي شظايا غشاء البلازما التي يبلغ قطرها 0.1-1.0 ميكرومتر يتم إطلاقها في سوائل الجسم والفضاء خارج الخلية استجابة لمحفزات الخلايا المختلفة. تم تحديده لأول مرة على أنه غبار الصفائح الدموية الذي يعرض الدهون الفوسفورية المخثرة ، ومعظمها من الفوسفاتيديل سيرين (PSer) ، وتشكل MVs سطحا إضافيا لتجميع مجمعات تخثر الدم1،2. تم إثبات الدور الرئيسي للمركبات المتوسطة المنتشرة كمؤثرات تخثر في المرضى الذين يعانون من متلازمة سكوت2 ، وهو مرض وراثي نادر يؤدي إلى التعرض الوظيفي ل PSer والنزيف (الشكل التكميلي 1). تمت دراسة MVs على نطاق واسع كمؤشرات حيوية منتشرة لمخاطر التخثر في الأمراض المزمنة المرتبطة باضطرابات القلب والأوعية الدموية مثل مرض السكري وأمراض الكلى المزمنة وتسمم الحمل وارتفاع ضغطالدم 3،4. يتم التعرف عليها حاليا على أنها مؤثرات خلوية حقيقية في السوائل أو أنسجة الأعضاء مثل عضلةالقلب 1. نظرا لأنها تنقل البروتينات النشطة والدهون والميرنا المرسال ، فإنها تعدل عن بعد استجابات الأوعية الدموية مثل الإرقاء والالتهاب وتكوين الأوعية الدموية ونمو الأوعية الدموية أو إعادة تشكيلالأنسجة 5.
بينما تفحص الدراسات السريرية قيمة تشخيص MVs فيما يتعلق بعوامل الخطر ، فإن MVs المعزولة من سوائل المريض أو أنسجته تمكن من تقييم خصائص المستجيب خارج الجسم الحي 6. يتم تحقيق فك رموز الآليات التي تحكم التكوين الحيوي للجهد المتوسط وقدرات الحديث المتبادل بشكل عام في نماذج زراعة الخلايا لتحديد الجزيئات النشطة المكشوفة أو المغلفة داخل MVs وإشاراتها النهائية. تعتمد تفاعلات MV مع الخلايا المستهدفة على ارتباط البروتين / البروتين الغشائي ، عند توفر الروابط المضادة المناسبة ، و / أو اندماج الدهون7.
في ظل الظروف الفسيولوجية ، تنشأ MVs المنتشرة في البلازما في الغالب من خلايا الأوعية الدموية ، كما هو محدد بواسطة علامات تمايز عنقود النسب (CD) 8،9. ومع ذلك ، في علم الأمراض ، لا سيما في السرطان10 ورفض الكسب غير المشروع11،12 ، يتم التخلص من MVs من الأنسجة التالفة وتحمل سمات تخثر ضارة ومسببة للالتهابات. يتم اكتشافها في الدورة الدموية الجهازية ، مما يجعلها مجسات مفيدة لمراقبة العلاجات الوقائية أو التجديد ، والأهداف الدوائيةالمحتملة 13. نظرا لأن MVs تنتشر كحوض تخزين ديناميكي يعكس توازن الخلايا الوعائية والأنسجة في الصحة والمرض ، يجب أيضا التحقيق في فهم أفضل لعملها عن بعد في الجسم الحي ، بعد الحقن الوريدي أو تقطير الأنف في الصغيرة14،15. في الواقع ، تم اعتبار MVs مساهما رئيسيا في المسارات المعقدة التي تربط الالتهاب المبالغ فيه والتخثر16.
التهاب دواعم السن هو مرض التهابي من أصل معدي يصيب الأنسجة الداعمة للأسنان17،18 ويرتبط بخطر تجلط الدم. يتميز بنزيف اللثة وتدمير العظام السنخية وحركة الأسنان ويمكن أن يؤدي في النهاية إلى فقدان الأسنان. ينتشر التهاب دواعم السن بشكل كبير في جميع أنحاء العالم ويصيب أكثر من 50٪ من السكان ، مع 11٪ يظهرون شكلا حادا19. يحدث التهاب دواعم السن بسبب خلل التنكسج البكتيري للأغشية الحيوية تحت اللثة ، والتي تحافظ على استجابة التهابية متفاقمة تؤدي إلى تدمير الأنسجة20. على مدى العقد الماضي ، تم ربط التهاب دواعم السن بالأمراض الجهازية مثل اضطرابات القلب والأوعية الدموية والسكري والتهاب المفاصل الروماتويدي. التفسيرات المحتملة هي عمل مسببات أمراض اللثة عن بعد و / أو زيادة الالتهاب الجهازي بوساطة السيتوكينات المسببة للالتهابات مثل الإنترلوكين (IL-1 ، IL-6) و TNF-α21،22.
من بين مسببات الأمراض المرتبطة بظهور التهاب دواعم السن وتطوره ، تم العثور على Porphyromonas gingivalis (P. gingivalis)23 في معظم الآفات الشديدة التي تحصد العديد من عوامل الفوعة ، بما في ذلك عديدات السكاريد الدهنية (LPS) 24 التي تحفز الاستجابات الالتهابية بوساطة المستقبلات الشبيهة بالحصيلة (TLR)25 وتجنيد العدلات وكريات البيض متعددة الأشكال (PMNs) في موقع العدوى الأولية26. LPS من P. gingivalis ينشط TLR-4 أو TLR-2 ، مما يسهل اكتشاف المناعة والتهرب من البقاء على قيد الحياةالبكتيرية 27. على مستوى الأوعية الدموية ، يرتبط تنشيط TLR2 بواسطة LPS بالتخثر المناعي. القدرة الفريدة ل P. gingivalis على دفع إشارات TLR-2 بينما يضعف التعرف المعتمد على TLR-4 بشكل كبير تفضل العدوى المستمرة منخفضة الدرجة28،29.
إجراءات في الجسم الحي لدراسة استجابات MV للعدوى المزمنة والمستمرة لمسببات الأمراض منخفضة الدرجة نادرة. تم وصف الأساليب المنهجية لاستخراج MVs Tissular بشكل سيئ في الأدبيات وتتعلق عموما بحصاد MVs من الأنسجة المرضية مثل الأورام الصلبة أو التنكس الدهني في الكبد أو لويحات تخثر الشرايين أو الطعوم11،29،30 ، بينما يستشعر الطحال البكتيريا والفيروسات في مجرى الدم. كما أنه يخزن كريات الدم الحمراء والصفائح الدموية والخلايا الليمفاوية والخلايا الوحيدة والخلايا القاعدية والحمضات المشاركة في الاستجابة المناعية. تولد الخلايا المحببة مثل العدلات من اللب الأحمر أيضا أنواعا من الأكسجين التفاعلية (ROS) والبروتياز الذي يدمر مسببات الأمراض ويمنع العدوى من الانتشار31،32. بشكل مثير للدهشة ، وعلى حد علمنا ، لا يتم التحقيق في MVs الطحال في سياق إهانات الأنسجة التي يسببها مسببات الأمراض. هناك حاجة عالمية غير ملباة لدراسة الاختلافات في MVs Tissular في علم الأمراض الفيزيائية.
أظهرت البيانات المختبرية من مختبرنا أن LPS يحفز تساقط MVs مخلوطة التخثر من خلايا الطحال في الفئران ، والتي بدورها تؤدي إلى شيخوخة الخلايا البطانية التاجية المستنبتة والنمط الظاهري البطاني المسبب للالتهابات والتخثرالمتتالي 11. تم إثبات جدوى التحكم الدوائي في الطحال MVs بعد علاج بتركيبة أوميغا 3 المحسنة. تم العثور على التزقيم الفموي للفئران في منتصف العمر والعمر ليكون وقائيا من تساقط MVs التخثر من خلايا الطحال وخصائصها الضارة المسببة تجاه البطانة التاجية33.
بالمقارنة مع الدم ، يوفر الطحال ميزة كونه مصدرا مهما للكريات البيض في فرد واحد. بالإضافة إلى ذلك ، تم مؤخرا اقتراح محور الطحال والقلب3،34 ، مما يجعل الطحال مساهما محتملا في مخاطر القلب والأوعية الدموية المرتبطة بالعدوى ذات الأهمية المفيدة للتحكم الدوائي. يعد تقييم خصائص SMVs أو إطلاقها أمرا أساسيا في فهم الاستجابات التي يسببها مسببات الأمراض أو الالتهابات. ومن المثير للاهتمام أنه يمكن تحقيقه في المعالجة وفي النماذج الفيزيائية المرضية المختلفة (العمر وارتفاع ضغط الدم والسكري). في الواقع ، من خلال مقارنة الفئران في منتصف العمر والعمر33 ، يمكن إثبات الاختلافات في خصائص الطحال MVs وإطلاقها بعد ثقافة بسيطة لخلايا الطحال لمدة 24 ساعة.
بالنظر إلى الأدلة المذكورة أعلاه على تغيير الخصائص المستجيبة للطحال MVs مع الحالة الفيزيولوجية المرضية وجدوى السيطرة الدوائية في الفئران ، يتم وصف بروتوكول موحد هنا لعزل طحال الفئران MVs. من شأن الإجراء أن يتناسب بشكل أفضل مع التحقيقات المتعمقة لآليات in vivo التي تدعم التأثيرات بوساطة SMVs ، في نهاية المطاف في الفئران الهندسية. تم إنشاء الإجراء في الفئران C57BL / 6 باستخدام عدوى موضعية داخل الصفاق بواسطة P. gingivalis ، لإثبات التأثير البعيد لمسببات الأمراض على خصائص المستجيب MV (SMV).
Protocol
تمت الموافقة على جميع البروتوكولات التجريبية واتبعتها المبادئ التوجيهية ذات الصلة للجنة الأخلاقيات المحلية (APAFIS # 2020121815051557) ورعاية في الجامعة الأم و INSERM. تم استخدام ذكور الفئران الصغيرة C57BL / 6 ، بعمر 6-8 أسابيع ، في التجارب. تم فحص الفئران بانتظام لتقييم الألم والتوتر ، وتمت مراقبة أوزانها يوميا. ما لم ينص على خلاف ذلك ، يجب أن تكون جميع المخازن المؤقتة والمحاليل للاستخراج معقمة وفي درجة حرارة الغرفة.
1. تحضير
- إدارة الفئران بستة حقن داخل الصفاق من P. gingivalis (PG) كل يومين لمدة أسبوعين (ثلاث حقن من 5 × 107 بكتيريا / أسبوع ، ملف تكميلي 1).
- قم بتخدير الفئران باستخدام مزيج من 100 مجم / كجم من الكيتامين و 10 مجم / كجم من الزيلازين.
- التضحية بالفئران المخدرة وحصاد الطحال بعد بضع البطن.
ملاحظة: الشروط المحددة لعدوى المتصورة اللثوية والتضحية بالحيوانات من أجل حصاد الطحال مفصلة في قسم "التجربة على" في الملف التكميلي 1. يظهر التمثيل التخطيطي لخطوات البروتوكول في الشكل 1.
2. استخراج خلايا الطحال
- باستخدام مشرط ، قم بفرم أنسجة الطحال إلى شرائح ~ 1 مم في طبق بتري مملوء بالفعل ب 3 مل من RPMI الذي يحتوي على مضادات حيوية (Streptomycin (100 U / mL) / Penicillin (100 U / mL) ، Fungizone (250 مجم / مل) ، L-glutamine (2 مل)) ، واستكمل بنسبة 10٪ مصل بقري جنيني (FBS) (انظر جدول المواد).
- انقل الشرائح إلى غربال (انظر جدول المواد) ، وهو متصل مسبقا بأنبوب بوليسترين سعة 50 مل.
- استخدم مكبس المحقنة كمدقة لسحق الأنسجة الموجودة على المنخل.
- اشطف المنخل بوسط RPMI (3 مل).
- جهاز الطرد المركزي ، يشطف تعليق الخلية عند 450 × جم لمدة 5 دقائق في درجة حرارة الغرفة ويتخلص من المادة الطافية بحذر عن طريق التدفق العكسي.
3. إزالة كريات الدم الحمراء عن طريق صدمة تناضحية
- أضف 1 مل من المخزن المؤقت ACK (انظر جدول المواد) ، واخلطه جيدا ، واحتضنه لمدة 3 دقائق في درجة حرارة الغرفة ورجه برفق عن طريق الدوران اليدوي.
- خفف بإضافة 9 مل من RPMI واخلطه جيدا باستخدام الشفط والتدفق العكسي.
- جهاز طرد مركزي عند 450 × جم لمدة 5 دقائق في درجة حرارة الغرفة.
- تخلص من المادة الطافية عن طريق الشفط والتدفق العكسي ، وأعد تعليق الحبيبات في 5 مل من وسط RPMI.
- امزج برفق (الشفط / التدفق العكسي) وقم في النهاية بإزالة أي بقايا دهنية عن طريق سحب العينات أو استخدام غربال.
4. تعديل تركيز خلايا الطحال المعزولة
- املأ أنبوبا صغيرا سعة 1.5 مل يحتوي على 900 ميكرولتر من RPMI.
- باستخدام ماصة دقيقة، خذ 100 ميكرولتر من المعلق الخلوي، وأضفه إلى الأنبوب الدقيق سعة 1.5 مل الذي يحتوي على 900 ميكرولتر من وسط RPMI، واخلطه جيدا.
- انقل 10 ميكرولتر من الخلايا المخففة إلى أنبوب دقيق ، وأضف 10 ميكرولتر من صبغة استبعاد التريبان الزرقاء ، واخلطها جيدا.
- ضع 10 ميكرولتر من المحلول (الخطوة 3.3) في شريحة العد لعداد الخلايا الأوتوماتيكي (انظر جدول المواد) وحدد عدد الخلايا.
ملاحظة: يعطي برنامج الجهاز قيمتين: إجمالي عدد الخلية وعدد الخلية الحية والنسبة المئوية. - اضبط تركيز الخلايا الحية على 3 أو 5 × 106 خلايا / مل (V كحد أقصى = 20 مل ؛ السعة الإجمالية القصوى 100 × 106 خلايا / مل).
- زرع الخلايا في قارورة سعة 75 مل تحتوي على RPMI.
- احتضان القارورة عموديا في حاضنة مرطبة عند 37 درجة مئوية لمدة 24 ساعة.
تنبيه: التريبان الأزرق هو عامل مطفرات ومسرطن35،36. تأكد من ارتداء القفازات أثناء العد ، حتى خارج غطاء المحرك. تخلص على الفور من الأطراف والسوائل في حاويات واغسل سطح المقعد.
ملاحظة: إذا كانت الخلايا المجمعة أقل من 50 × 106 ، فاستخدم قارورة ثقافة سعة 25 مل. يجب ألا يختلف رقم الخلية كثيرا من فرد لآخر. النسبة المئوية للخلايا الحية أعلى بشكل عام من 80٪ في هذه الخطوة.
5. عزل الحويصلات الدقيقة لخلايا الطحال
- بعد 24 ساعة ، اسكب محتوى القارورة في أنبوب بولي بروبيلين أو بوليسترين سعة 50 مل.
- جهاز طرد مركزي عند 450 × جم لمدة 15 دقيقة في درجة حرارة الغرفة لإزالة الخلايا والحطام.
- بعد الطرد المركزي ، احتفظ ب 100 ميكرولتر من المادة الطافية الأولى (SN1) لقياس نهائي لتركيز MV الأولي لحساب عائد العزل. لاحظ وحدة تخزين SN1.
- جهاز الطرد المركزي SN1 عند 450 × جم لمدة 15 دقيقة في درجة حرارة الغرفة.
- تخلص من الحبيبات وأجهزة الطرد المركزي مرة أخرى عند 450 × جم لمدة 15 دقيقة في درجة حرارة الغرفة. اسحب وجمع SN2 بسرعة (لاحظ الحجم).
- انقل SN2 إلى أنابيب دقيقة سعة 1.8 مل بقيعان مخروطية الشكل. احتفظ ب 100 ميكرولتر من SN2 لقياس نهائي لتركيز MV الأولي لحساب عائد العزل في حالة إعاقة الكثير من الحطام في النهاية لقياس MV في SN1.
- أضف 5 مل من وسط RPMI إلى الحبيبات (الخلايا) واحسب خلايا الطحال.
ملاحظة: يمكن أيضا تثبيت تعليق الخلية لتوصيف قياس التدفق الخلوي في 0.1٪ بارافورمالدهيد (التركيز النهائي) 37. - جهاز الطرد المركزي SN2 عند 14,000 × جم لمدة ساعة واحدة عند 4 درجات مئوية وفي النهاية قم بتبريد الدوار مسبقا عن طريق تشغيل الدوار الفارغ عند 4 درجات مئوية. تقوم هذه الخطوة بإنشاء SN3.
- اسحب SN3 على الفور من كل أنبوب دقيق عن طريق قلب أنبوب واحد معقم سعة 50 مل (تحت الغطاء). لاحظ وحدة تخزين SN3.
- امزج SN3 برفق باستخدام ماصة أسفل الغطاء. احتفظ بحصص للقياسات النهائية في التعليق.
ملاحظة: تم استنفاد المحلول الآن من MVs ولكنه يحتوي على الوسطاء القابل للذوبان والإكسوسومات. - اكشط كل أنبوب دقيق (مغلق) على رف مسنن لصالح ميكانيكيا إعادة تعليق MVs في الحبيبات.
- أضف 200 ميكرولتر من محلول هانك الملحي المتوازن بدون Ca2+ و Mg2+ (HBSS) في الأنبوب الدقيق الأول (انظر جدول المواد).
- أعد تعليق الحبيبات MV للأنبوب الأول عن طريق دورات الشفط / التدفق العكسي اللطيفة (~ 10 مرات) باستخدام ماصة دقيقة سعة 1 مل. احرص على تجنب الرغوة لأن ذلك سيعزز أكسدة الحويصلات والشقوق الأخرى في التعليق.
- احصد أول 200 ميكرولتر من MVs المعلقة واسكبها في الأنبوب الثاني فوق الحبيبات. تخلط برفق على النحو الوارد أعلاه ، ثم تصب مرة أخرى في الأنبوب الثالث وتخلط برفق. يصبح التعليق أكثر وعكرة من أنبوب إلى أنبوب. أغلق الأنبوب الثالث.
- ابدأ في جمع الأنابيب الدقيقة الثلاثة التالية على النحو الوارد أعلاه (الخطوة 4.14).
- اجمع كل MVs المعلقة في أنبوب صغير واحد (أو اثنين) مجمع (2 مل مع قاع مخروطي الشكل). احتفظ ب 50 ميكرولتر لحساب عائد هذه الخطوة في نهاية المطاف. لاحظ حجم التعليق.
- جهاز طرد مركزي أنبوب التجميع عند 14,000 × جم لمدة 1 ساعة عند 4 درجات مئوية. تقوم هذه الخطوة بإنشاء SN4.
- تخلص من SN4 على الفور (صب فوق أنبوب تجميع طاف). احتفظ بكمية من SN4 لحساب عائد خطوة التنقية وأعد تعليق الحبيبات برفق في 500 ميكرولتر من سداسي البروم ثنائي الفينيل (بدون Ca2+ و Mg2+). احتفظ بمقدار 50 ميكرولتر من الحبيبات المعلقة لحساب عائد التنقية وملاحظة حجمها.
- قم بتخزين الحبيبات المعلقة عند 4 درجات مئوية لمدة تصل إلى شهر واحد للمقايسات الوظيفية في ظل ظروف معقمة أو عند -20 درجة مئوية للمقايسات الهيكلية.
- احسب إنتاجية التنقية (انظر الملاحظة أدناه) لكل خطوة أو الإجراء بأكمله عن طريق قياس تركيز MVs في المواد الطافية و / أو معلقات الحبيبات.
ملاحظة: إنتاجية التنقية (٪): ([MV1] × وحدة تخزين SN1) / ([MV4] × حجم التعليق النهائي) × 100.
يجب ترشيد هذا العائد لعدد خلايا الطحال المعزولة من قارورة الاستزراع وحسابها في الخطوة 4.4. عائد التنقية للتجربة الحالية هو ~ 70٪ بدءا من 111 × 106 خلايا و 60 مل من المادة الطافية.- تقييم فقدان SMVs الناجم عن الإجراء عن طريق قياس SMVs المتبقية في المواد الطافية المستنفدة من SMVs والتي تحتوي بشكل أساسي على الإكسوسومات (SN2 و SN4).
- قم بقياس تركيز MV بواسطة TRPS أو مقايسة البروثرومبيناز38 للحصول على حساسية وخصوصية عالية.
تنبيه: احصد MVs بعد الطرد المركزي عن طريق الصب السريع المقلوب للمادة الطافية. سيؤدي انتظار أو استخدام الأنابيب الدقيقة على شكل حرف U إلى فقدان MV على جدار الأنبوب الصغير. لا تستخدم أبدا ماصة دقيقة للتخلص من المادة الطافية. يمكن شفط الحبيبات بدلا من ذلك. لا تؤخر العملية أبدا بعد إيقاف جهاز الطرد المركزي. سيؤدي الطرد المركزي بسرعة زائدة إلى تلوث حبيبات الجهد المتوسط بواسطة الإكسوسومات.
ملاحظة: تم تحسين سرعات الطرد المركزي ومدته من أجل تخصيب الجهد المتوسط مع الحد الأدنى من التلوث بالإكسوسومات. هذا البروتوكول غير موثوق به لدراسة الخلايا الوحيدة / البلاعم الطحال MVs لأن هذه الخلايا يمكن أن تتغذى على الخلايا البلعمية وتستعيد بسرعة MVs39 الخاصة بها. لا يمكن إيقاف البروتوكول مؤقتا وإعادة تشغيله لاحقا بسبب فقدان الخلايا بسبب صلاحية الخلية.
النتائج
تعطي البيانات المقدمة تمثيلا كاملا للإجراء بأكمله ، باستخدام حالتين رئيسيتين للحيوانات: السيطرة على الفئران الصغيرة C57BL / 6 غير المعالجة وزملائها في القمامة التي تخضع لستة حقن PG داخل الصفاق (IP) كل يومين ، لمدة أسبوعين. كما أنها تظهر العمل عن بعد لحقن PG داخل الصفاق على استجابة الطحال بعد 2 أسابيع. تم قياس الحويصلات الدقيقة لخلايا الطحال إما عن طريق الفحص الأنزيمي للبروثرومبيناز أو عن طريق قياس البروتينات وتركيز الحمض النووي الريبي عن طريق القياس الطيفي الضوئي ، وتم تحديد نسبة العدلات عن طريق قياس التدفق الخلوي33،38 في تعليق خلايا الطحال (الأقسام 2-4 من الملف التكميلي 1 والشكل التكميلي 2).
زيادة وزن الطحال وعدد الخلايا بعد أسبوعين من حقن IP في P. gingivalis
في الفئران البالغة الصغيرة ، يؤدي حقن PG إلى زيادة كبيرة بمقدار 2.6 مرة في وزن الطحال بعد أسبوعين ، ويرجع ذلك على الأرجح إلى الاستجابة المناعية. في الواقع ، تم رفع إجمالي عدد خلايا الطحال أيضا بمقدار 2.3 أضعاف (الشكل 2 ، ن = 5 فئران لكل حالة ، ص < 0.0001 بواسطة اختبار Student's T).
لا تتأثر صلاحية خلايا الطحال بأسبوعين من الحقن في المتصورة اللثوية
تم قياس معدلات بقاء مماثلة بين الفئران المعالجة وغير المعالجة بعد عزل خلايا الطحال أو بعد 24 ساعة من زراعة الخلايا. ومع ذلك ، عندما كانت النسبة المئوية الأولية للخلايا الحية في t0 أقل من 76٪ ، انخفضت الجدوى في كلتا المجموعتين بنسبة ~ 50٪ بعد 24 ساعة. (انظر Ctl 1-3 ، الجدول 1 ، كمثال). على العكس من ذلك ، ومهما كانت حالة ، تم تعزيز التعافي لمدة 24 ساعة عندما وصلت نسبة الخلايا الحية إلى 90٪ أو أكثر عند t0 ، مما يشير إلى الدور الحاسم لخطوات العزل الأولى (الشكل 3).
يتم تعزيز عدد عدلات خلايا الطحال في الفئران المحقونة بالمتصورة اللثوية
بعد التلوين المزدوج ، تم تحديد العدلات عن طريق قياس التدفق الخلوي على أنها Mac1 + و LYG-6- (Gr1) + (انظر جدول المواد والقسم 4 في الملف التكميلي 1). استجابة ل PG ، تم تعزيز عدد طحال العدلات بشكل ملحوظ بمقدار 40 ضعفا بعد عزل الخلية مباشرة (t0 ، 4.8٪ ± 0.6 مقابل 0.86٪ ± 0.06). ومع ذلك ، تجدر الإشارة إلى أنه بعد 24 ساعة من الثقافة ، تزداد نسبة العدلات في تعليق خلايا الطحال من 4.8٪ ± 0.6 إلى 14.67٪ ± 2.02 (الشكل 4).
يزداد تساقط الخلايا المتحركة من خلايا الطحال في الفئران المصابة بالمتصورة اللثوية
باتباع البروتوكول ، أثبتنا أن خلايا الطحال المعزولة أطلقت المزيد من MVs عندما تعرضت الفئران لعدوى PG. بالمقارنة ، للتحكم في الأفراد ومقايسة القياس ، تم تضاعف MVs المتساقطة في المادة الطافية ثلاث مرات تقريبا في الفئران المحقونة ب PG ، باستخدام إما الكشف عن طريق مقايسة البروثرومبيناز الذي يشير إلى السطح الكلي للفوسفوليبيدات الأنيونية المبدئية للتخثر التي تحملها SMVs (الشكل 5 أ) ، أو محتوى البروتين في SMVs المقاسة بواسطة قياس الطيف الضوئي (الشكل 5 ب) ، أو محتوى الحمض النووي الريبي ل SMVs التي تم تقييمها بواسطة قياس الطيف الضوئي (الشكل 5 ج ، ن = 5 ، البروثرومبيناز: ص = 0.002 ؛ محتوى البروتين: ف = 0.003 ؛ محتوى الحمض النووي الريبي ، ص = 0.008 ، بواسطة اختبار T للطالب). تم الحصول على مدى نطاق الطي الأعلى باستخدام مقايسة البروثرومبيناز التي أظهرت خلفية منخفضة جدا.
ومن المثير للاهتمام ، أنه يمكن إنشاء علاقة بين محتوى بروتين SMVs و SMVs المقاسة بواسطة مقايسة البروثرومبيناز (الشكل التكميلي 3). بالإضافة إلى ذلك ، لم يختلف توزيع حجم SMVs كما هو محدد في التجارب الأولية (الشكل التكميلي 4) التي تقارن SMVs من الفئران المحفزة ب PG وغير المحفزة (متوسط القطر 193 نانومتر مقابل 189 نانومتر). قيم القطر هذه قريبة من قيم SMVs المعزولة من خلايا طحال الفئران استجابة لحضانة لمدة 24 ساعة مع LPS (5 ميكروغرام / مل) أو أسيتات فوربول ميريستات (25 نانوغرام / مل) والأيونوفور (1 ميكرومتر) ، (متوسط القطر ، 222 نانومتر مقابل التحكم 212 نانومتر) 11 (الشكل التكميلي 5). بالإضافة إلى ذلك ، يمكن تقييم محتوى البروتين في SMVs بواسطة اللطخة الغربية ، مما يتيح توصيف بروتينات سيتوبلازمية أو غشائية معينة يتم تصديرها بشكل تفضيلي إلى SMVs (الشكل التكميلي 5).
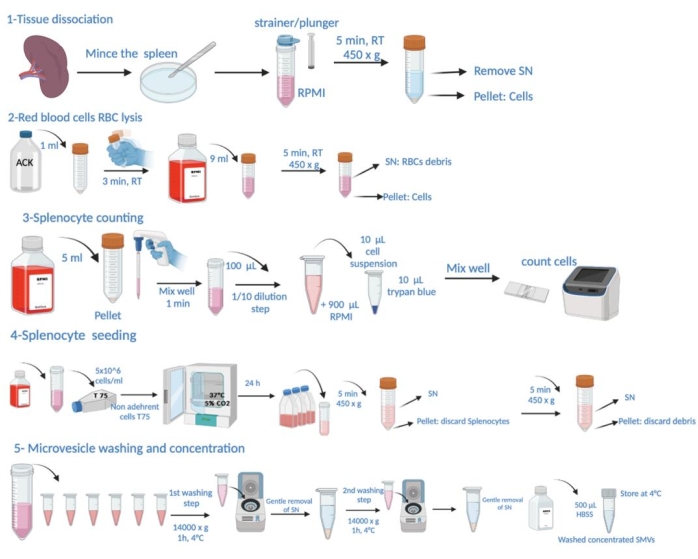
الشكل 1: التمثيل التخطيطي لخطوات البروتوكول. يتكون هذا من تشريح الأنسجة ، وتحلل خلايا الدم الحمراء (RBC) ، وعد خلايا الطحال ، والبذر ، وحصاد الحويصلات الدقيقة من المادة الطافية ، والغسيل وتحديد التركيز. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: حقن IP من P. gingivalis يعزز بشكل كبير وزن الطحال (A) وعدد خلايا الطحال (B). CTL: الفئران غير المعالجة ، IP: الفئران التي تعرضت لحقن PG لمدة أسبوعين. يتم التعبير عن البيانات كمتوسط ± SEM. n = 5: ***: p < 0.0001 و 0.0005 ، على التوالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: تقل صلاحية خلايا الطحال بعد 24 ساعة من زراعة خلايا الطحال ، في حين أن حقن IP ل P. gingivalis لا يغير قابلية بقاء الخلية. CTL: الفئران غير المعالجة ، IP: الفئران التي تعرضت لحقن PG لمدة أسبوعين ، t0: الجدوى المقاسة مباشرة بعد العزل ، t24: بعد 24 ساعة مزرعة. يتم التعبير عن البيانات كمتوسط ± SEM. n = 5 ، ***: p < 0.0001 بواسطة اختبار Student's T. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
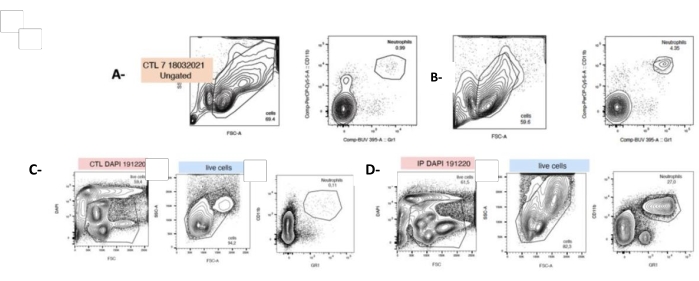
الشكل 4: ف. حقن اللثة يزيد من عدد العدلات عند t0 وبعد 24 ساعة من زراعة الخلايا. تم عزل الخلايا حديثا من الطحال المحصود وتصنيفها بأجسام مضادة فلورية موجهة ضد الخلايا المحببة (LyG-6 Gr1) أو العدلات (LY6-C) وتم تحديدها في بوابة CD11b + التي تحدد الخلايا الوحيدة والخلايا الحبيبية والعدلات. تم تحديد العدلات على أنها LY6-C + و CD11b + و LYG-6 Gr1 منخفضة. قطع أراضي تمثيلية تظهر SSC / FSC و CD11b + ، و LYG-6 Gr1 تلطيخ مزدوج لكل حالة عند t0 (A ، B) أو 24 ساعة بعد البذر (C ، D). أ ، ج: خلايا الطحال الفئران غير المعالجة. ب ، د: خلايا الطحال من الفئران المعرضة لحقن IP من P. gingivalis. FSC: مبعثر إلى الأمام. SSC: مبعثر جانبي. CTL: الفئران غير المعرضة. ن = 5 ، ***: ص < 0.0001 ، 10000 حدث تم الحصول عليه لكل عينة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: P. gingivalis يفضل تساقط خلايا الطحال MV المعززة بعد 24 ساعة استزراع. تم عزل خلايا الطحال من الفئران المصابة بالمتصورة اللثوية والسيطرة عليها واستزراعها لمدة 24 ساعة وتم قياس SMVs بواسطة فحوصات مختلفة. القضبان السوداء: الفئران غير المعالجة (CTL) ، القضبان الرمادية (IP): الفئران التي تعرضت لحقن P. gingivalis لمدة أسبوعين. ج: القياس الكمي عن طريق مقايسة البروثرومبيناز ، ب: تركيز البروتين ل SMVs السليمة التي يحددها القياس الطيفي الضوئي ، C: محتوى الحمض النووي الريبي ل SMVs التي يحددها القياس الطيفي. يتم التعبير عن البيانات بمتوسط ± SEM. n = 5 ، **: p < 0.0001 ، بواسطة اختبار Student's T. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| حالة | وزن الطحال | عدد خلايا الطحال | الجدوى (٪) | الجدوى (٪) |
| بعد عزل الخلية | ||||
| (ملغ) | (106 خلايا) | بعد 24 ساعة زراعة الخلايا | ||
| (ر0) | ||||
| ال 1 | 108 | 25 | 75 | 24 |
| Ctl 2 | 112 | 55 | 70 | 26 |
| Ctl 3 | 118 | 52 | 73 | 26 |
| Ctl 4 | 83 | 38 | 91 | 46 |
| سي تي إل 5 | 78 | 55 | 96 | 46 |
| IP 1 | 243 | 150 | 91 | 43 |
| IP 2 | 250 | 138 | 93 | 46 |
| IP 3 | 283 | 85 | 90 | 46 |
| IP 4 | 270 | 100 | 91 | 43 |
| IP 5 | 300 | 125 | 91 | 43 |
الجدول 1: مقارنة معدلات بقاء خلايا الطحال بين الفئران المعالجة وغير المعالجة بعد عزل خلايا الطحال.
الشكل التكميلي 1: كيف تكون MVs مخلوطة للتخثر؟ لمزيد من التفاصيل، انظر الملف التكميلي 1. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 2: مقايسة البروثرومبيناز المستندة إلى الجسيمات الدقيقة (MP). لمزيد من التفاصيل، انظر الملف التكميلي 1. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 3: مخطط الارتباط بين قياسات SMVs عن طريق مقايسة البروثرومبيناز ومقايسة البروتين الطيفي الضوئي في الفئران غير المعالجة أو P. gingivalis المعالجة. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 4: تحليل توزيع حجم SMVs المعزولة من الفئران (A) وخلايا طحال الفئران (B). تم الحصول على تعليق SMVs من طحال الفئران غير المعالجة (Control MVs) أو الأفراد المعرضين لتلف اللثة بدون LIG MVs أو مع إضافة موضعية ل P. gingivalis (LIG-PG MVs). تم حصاد SMVs من الفئران في طاف خلايا الطحال المعزولة التي تعرضت لتحفيز لمدة 24 ساعة بواسطة LPS (LPS MVs) أو PMA (PMA MVs) كما هو موضح في مكان آخر37. متوسط ضياء: متوسط القطر. ضياء الوضع: القيمة المتوسطة للقطر. تم إجراء القياسات باستخدام 400 نانو مسام لتقييم أكبر نطاق توزيع للحجم. الرجاء النقر هنا لتنزيل هذا الملف.
الشكل التكميلي 5: تحديد محتوى البروتين في MVs من خلايا طحال الفئران المعزولة من الفئران الصغيرة بواسطة اللطخة الغربية. للحصول على التفاصيل، راجع الملف التكميلي 1. الرجاء النقر هنا لتنزيل هذا الملف.
الملف التكميلي 1: تفاصيل عن الإجراءات التجريبية والتفسيرات للأشكال التكميلية 1،2،5. الرجاء النقر هنا لتنزيل هذا الملف.
Discussion
تؤكد الدراسة الحالية أن الطحال هو مصدر رئيسي وموثوق به للمركبات المتوسطة ذات الصلة الفيزيائية المرضية مقارنة بالمصادر الأخرى مثل الدم ، ذات الحجم المحدود في الفئران. شريطة اتخاذ الاحتياطات ، فإن الطريقة سهلة الإعداد ولا تتطلب معدات باهظة الثمن. نظرا لعدم توفر طريقة بديلة بخلاف التقييم في الجسم الحي ، يبدو أن النموذج الحالي طريقة قيمة لدراسة تأثير الأدوية المؤيدة للأدوية على التخلص من MV. الأهم من ذلك ، أن البروتوكول الموحد لحصاد الحويصلات الدقيقة الطحالية للفئران (SMVs) المقدم هنا يجب أن يتناسب مع الاحتياجات غير الملباة للدراسة في الجسم الحي للتحكم في التأثيرات بوساطة SMV ، في النهاية في الفئران المهندسة بعد الحقن أو تقطير الأنف.
توضح الطريقة الحالية أيضا أن SMVs هي أدوات قبل سريرية ذات صلة للتحقيق في الآثار البعيدة للعدوى الموضعية ، مثل P. gingivalis عدوى IP. في الواقع ، باستخدام مناهج متعددة ، هناك اختلافات كبيرة بين SMVs المنبعثة من P. gumivalis المعالجة مقابل . تم قياس غير المعالجة ، مما يشير إلى تأثير بعيد لحقن IP المحلي ، والذي يمكن اكتشافه بالفعل بعد أسبوعين. أكدت البيانات الأولية من مختبرنا باستخدام مواقع عدوى المتصورة اللثية الأخرى البعيدة أن المتصورة اللثية قد تبدأ ارتفاعا بمقدار 1.7 ضعفا في اليوم السابع بعد الإصابة.
ويلاحظ أيضا أن المتصورة اللثة تم تأكيد التأثيرات البعيدة التي يسببها المتصورة اللثوية من خلال تحليل الطحال مع اختلافات كبيرة في الوزن وصلاحية الخلايا والعدد الإجمالي. علاوة على ذلك ، P. gingivalis دفع إلى زيادة 6.5 أضعاف في عدد عدلات الطحال عند قياسه عن طريق التلوين المناعي بعد عزل خلايا الطحال مباشرة (t0). وفقا لذلك ، فإن الاختلافات في ملف تعريف أصل خلية SMV تشير إلى تساقط الخلايا الأبوية الناجمة عن الحالة الأولية للحيوان.
نظرا لأن SMVs التي تم إطلاقها في الطاف لمزارع خلايا الطحال لمدة 24 ساعة قد تضاعفت ثلاث مرات عند عزلها عن الفئران المحقونة ب IP، فإنها تظهر مؤشرات حيوية موثوقة لتنشيط الطحال عن بعد بواسطة المتصورة اللثوية، مما يجعلها أدوات نهائية لمراقبة المكافحة الدوائية.
في المختبر ، يمكن إجراء زراعة خلايا الطحال باستخدام FBS بنسبة 10٪ ، مستنفدة أو غير مستنفدة من الإكسوسوم. في التجارب الحالية ، لم يتم ملاحظة أي اختلافات ، وظلت الاختلافات بين خلايا الطحال غير المعالجة قابلة للاكتشاف بنفس القدر مع كلا النوعين من FBS.
في الإجراء الحالي ، لم تؤد مدة أسبوعين إلى اختلافات كبيرة في وزن الطحال في الفئران غير المعالجة. ومع ذلك ، من المهم أن تضع في اعتبارك أن وزن الطحال قد يختلف مع تقدم العمر ، كما ورد سابقا في سلسلة من الفئران الضابطة الصغيرة والكبيرة والمتوسطة العمر. 1 في مثل هذه الحالة ، يجب التعبير عن القياس الكمي SMV كنسبة عدد الخلايا.
تم تحسين الإجراء الحالي لنموذج الفئران ومناسب لمزيد من فحوصات الفئران المعدلة وراثيا. على الرغم من أن العيب الرئيسي لنموذج الفئران هو وزن الطحال الصغير مقارنة بالجرذان33 ، إلا أن إجراءات عزل خلايا الطحال والمتلازمة التنفسية المتكيفة الموضحة هنا تمنع تلف الخلايا وفقدانها ، بينما يتم التخلص من جميع كريات الدم الحمراء الملوثة بالكامل. يعد الغسيل أمرا بالغ الأهمية للحصول على إنتاجية جيدة لتنقية خلايا الطحال ويجب إجراؤه برفق مع ما لا يزيد عن 1 مل من محلول تحلل ACK لكل طحال في 9 مل من RPMI لتمكين التخلص على خلايا الدم الحمراء على نطاق واسع. يمكن تكرار هذه الخطوة حتى تصبح الحبيبات بيضاء. لا يسمح هذا الإجراء بالتحقيق في الخلايا الوحيدة ويجب تكييفه مع الخلايا الملتصقة في مثل هذا الاحتمال.
بعد 24 ساعة من الاستزراع ، يعكس تركيز SMV المقاس في المواد الطافية لزراعة الخلايا التوازن بين توليد MV واستعادة MV بواسطة خلايا الطحال المستزرعة. لذلك ، في الإصدارات المعدلة من الإجراء أعلاه ، يجب إيلاء اهتمام خاص لوجود خلايا ذات نشاط بلعمة احترافي أو ملحق (الخلايا الوحيدة ، الخلايا البطانية ، إلخ) ، ويجب تحديد حركية إطلاق SMV في المادة الطافية بعناية وفقا لذلك.
Disclosures
المؤلفون ليس لديهم ما يكشفون عنه.
Acknowledgements
المؤلفون مدينون لكلودين إيبل من Service commun de cytométrie en flux (Institut de Génétique et de Biologie Moléculaire et Cellulaire, Strasbourg) لمساعدة الخبراء وتشكيل تحليل قياس التدفق الخلوي المعقد للطحال وعلي الحباب للتدريب الأولي على وضع العلامات على خلايا طحال الفئران. ساعد دينيز كاراجيوز في حفر جمع الأدب. تم دعم هذا العمل جزئيا من خلال منحتين من ANR COCERP (N° A17R417B) و ENDOPAROMP (N°ANR-17-CE17-0024-01).
Materials
| Name | Company | Catalog Number | Comments |
| 2 mL tubes type Eppendorf | Dutscher | 54816 | Conical bottom stériel microtubes |
| Allegra 64 R Centrifuge | Beckman Coulter | ||
| Automatic cell counter | Biorad | ||
| Bovine serum albumin | Euromedex | 04-100-812-E | Prepared, filtered with 0.22 µm sieve and stored at 4 °C under sterile conditions by using the following formulas: 2 mM EDTA, 0,5% BSA and sterile PBS |
| CD11 (Mac-1) | e-Biosciences | 45-00112-80 | Conjugated to eFluor 450; λmax excitation 405 nm λmax emission 445 nm |
| CD16/32 | BD Biosciences | 553142 | unconjugated |
| EDTA | Calbiochem | Calbiochem | S 6381-92-6 |
| Falcon tube | Cell star | 227261 | 50 mL |
| Fetal Bovine serum | Dutscher | S1810-500 | Batch number = S14028S1810 |
| Fortessa Aria | BD Biosciences | for cell sorting | |
| Fortessa flow cytometer | Becton-Dickinson. | ||
| Fungizone | PAN biotech | P06-01050 | |
| HBSS | Gibco | 14175-053 | Without phenol red, without Ca+2 and Mg+2 |
| ICAM-1 | abcam | ab171123 | |
| LYG-6 (Gr-1) | BD Biosciences | 566218 | Conjugated to BUV395; λmax excitation 348 nm, λmax emission 395 nm |
| Lysis buffer erythrocytes (ACK) | Sigma | Prepared, filtered with 0.22 µm sieve and stored at 4°C under sterile conditions by using the following formulas: NH4Cl, 0.15 M (molarity), 53.491 (mw) 4 g KHCO3 1 mM (molarity) 100.115 (mw), 50 mg EDTA 0.1 mM (molarity), 292.24 (mw), 14.6 g pH: 7.2–7.4 | |
| NanoDrop 1000 spectrophotometer | Thermoscientific | ||
| PBS | Lonza | 17-516F | Without Ca+2 and Mg+2 |
| Plastic petri dish | 100 mm | ||
| Polystyren tube | Falcon | 352070 | |
| q-Nano Gold | iZON science | ||
| RPMI 1640 culture medium: 2 g/L glucose | PAN biotech | p04-18047 | Supplemented withsupplemented with Streptomycin (100 U/mL) /Penicillin (100 U/mL), Fungizone (250 mg/mL), L-glutamine (2 mM) and FBS 10%. |
| Scalpels | |||
| Sieve Nylon | Falcon USA | 352360 | 100 µm |
| Streptomycin/Penicillin | PAN biotech | P06-07100 | |
| Syringe | 2 mL | ||
| Trypan Blue | Biorad | 1450013 | |
| VCAM1 | abcam | ab215380 |
References
- Loyer, X., et al. Intra-cardiac release of extracellular vesicles shapes inflammation following myocardial infarction. Circulation Research. 123 (1), 100-106 (2018).
- Aupeix, K., Toti, F., Satta, N., Bischoff, P., Freyssinet, J. M. Oyxsterols induce membrane procoagulant activity in monocytic THP-1 cells. Biochemical Journal. 314 (3), 1027-1033 (1996).
- Emami, S., et al. Antibiotic resistance pattern and distribution of pslA gene among biofilm producing Pseudomonas aeruginosa isolated from waste water of a burn center. Jundishapur Journal of Microbiology. 8 (11), 23669 (2015).
- Burger, D., et al. Microparticles: biomarkers and beyond. Clinical Science. 124 (7), 423-441 (2013).
- Braeckmans, K., et al. Sizing nanomatter in biological fluids by fluorescence single particle tracking. Nano Letters. 10 (11), 4435-4442 (2010).
- Chironi, G. N., et al. Endothelial microparticles in diseases. Cell and Tissue Research. 335 (1), 143-151 (2009).
- Meldolesi, J. Exosomes and ectosomes in intercellular communication. Current Biology. 28 (8), 435-444 (2018).
- Chen, T. S., et al. Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs. Nucleic Acids Research. 38 (1), 215-224 (2010).
- Pirro, M., et al. Microparticles derived from endothelial progenitor cells in patients at different cardiovascular risk. Atherosclerosis. 197 (2), 757-767 (2008).
- Zahra, S., Anderson, J. A., Stirling, D., Ludlam, C. A. Microparticles, malignancy and thrombosis. British Journal of Haematology. 152 (6), 688-700 (2011).
- Amoura, L., et al. Assessment of plasma microvesicles to monitor pancreatic islet graft dysfunction: Beta cell- and leukocyte-derived microvesicles as specific features in a pilot longitudinal study. American Journal of Transplantation. 20 (1), 40-51 (2020).
- De Rop, C., et al. Evaluation of tissue factor bearing microparticles as biomarkers in allogeneic stem-cell transplantation. Transplantation. 92 (3), 351-358 (2011).
- de Abreu, R. C., et al. Native and bioengineered extracellular vesicles for cardiovascular therapeutics. Nature Reviews Cardiology. 17 (11), 685-697 (2020).
- Beitler, J. R., et al. Advancing precision medicine for acute respiratory distress syndrome. The Lancet Respiratory Medicine. 10 (1), 107-120 (2022).
- Porro, C., et al. Proinflammatory effect of cystic fibrosis sputum microparticles in the murine lung. Journal of Cystic Fibrosis. 12 (6), 721-728 (2013).
- Boisrame-Helms, J., et al. Lipid emulsions differentially affect LPS-induced acute monocytes inflammation: in vitro effects on membrane remodeling and cell viability. Lipids. 49 (11), 1091-1099 (2014).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Authors' reply: Predictive diagnostic tests in periodontal diseases. Nature Reviews Disease Primers. 3 (1), (2017).
- Kinane, D. F., Stathopoulou, P. G., Papapanou, P. N. Periodontal diseases. Nature Reviews Disease Primers. 3 (1), 1-14 (2017).
- Kassebaum, D. K., Tedesco, L. A. The 21(st)-century dental curriculum: a framework for understanding current models. Journal of Dental Education. 81 (8), 13-21 (2017).
- Hajishengallis, G., Chavakis, T., Hajishengallis, E., Lambris, J. D. Neutrophil homeostasis and inflammation: novel paradigms from studying periodontitis. Journal of Leukocyte Biology. 98 (4), 539-548 (2015).
- Suh, J. S., et al. Periodontitis-induced systemic inflammation exacerbates atherosclerosis partly via endothelial-mesenchymal transition in mice. International Journal of Oral Science. 11 (3), 21 (2019).
- Bugueno, I. M., et al. Porphyromonas gingivalis triggers the shedding of inflammatory endothelial microvesicles that act as autocrine effectors of endothelial dysfunction. Scientific Reports. 10 (1), 1778 (2020).
- Hajishengallis, G., Lamont, R. J. Breaking bad: manipulation of the host response by Porphyromonas gingivalis. European Journal of Immunology. 44 (2), 328-338 (2014).
- Lamont, T., Worthington, H. V., Clarkson, J. E., Beirne, P. V. Routine scale and polish for periodontal health in adults. The Cochrane Database of Systematic Reviews. 12, (2018).
- Huck, O., et al. Reduction of articular and systemic inflammation by Kava-241 in a Porphyromonas gingivalis-induced arthritis murine model. Infection and Immunity. 86 (9), 00356 (2018).
- Sochalska, M., Potempa, J. Manipulation of neutrophils by Porphyromonas gingivalis in the development of periodontitis. Frontiers in Cellular and Infection Microbiology. 7, 197 (2017).
- Kocgozlu, L., Elkaim, R., Tenenbaum, H., Werner, S. Variable cell responses to P. gingivalis lipopolysaccharide. Journal of Dental Research. 88 (8), 741-745 (2009).
- Slocum, C., et al. Distinct lipid a moieties contribute to pathogen-induced site-specific vascular inflammation. PLOS Pathogens. 10 (7), 1004215 (2014).
- Thietart, S., Rautou, P. E. Extracellular vesicles as biomarkers in liver diseases: A clinician's point of view. Journal of Hepatology. 73 (6), 1507-1525 (2020).
- Witek, R. P., et al. Liver cell-derived microparticles activate hedgehog signaling and alter gene expression in hepatic endothelial cells. Gastroenterology. 136 (1), 320-330 (2009).
- Tahir, F., Ahmed, J., Malik, F. Post-splenectomy sepsis: a review of the literature. Cureus. 12 (2), 6898 (2020).
- Hussain, M., Stover, C. M., Dupont, A. P. gingivalis in periodontal disease and atherosclerosis - scenes of action for antimicrobial peptides and complement. Frontiers in Immunology. 6, 45 (2015).
- Qureshi, A. W., et al. Ageing enhances the shedding of splenocyte microvesicles with endothelial pro-senescent effect that is prevented by a short-term intake of omega-3 PUFA EPA:DHA 6:1. Biochemical Pharmacology. 173, 113734 (2020).
- Dunford, A., Keramida, G., Anagnostopoulos, C. D., Michael Peters, A. The cardiosplenic axis: another obscure pathophysiological function of the spleen and its investigation using molecular imaging. Nuclear Medicine Communications. 38 (3), 205-208 (2017).
- Ford, R. J., Becker, F. F. The characterization of trypan blue-induced tumors in Wistar rats. The American Journal of Pathology. 106 (3), 326-331 (1982).
- Field, F. E., et al. Trypan blue: identification and teratogenic and oncogenic activities of its coloured constituents. Chemico-Biological Interactions. 16 (1), 69-88 (1977).
- Covarrubias, R., et al. Optimized protocols for isolation, fixation, and flow cytometric characterization of leukocytes in ischemic hearts. American Journal of Physiology - Heart and Circulatory Physiology. 317 (3), 658-666 (2019).
- El Habhab, A., et al. Significance of neutrophil microparticles in ischaemia-reperfusion: Proinflammatory effectors of endothelial senescence and vascular dysfunction. Journal of Cellular and Molecular Medicine. 24 (13), 7266-7281 (2020).
- Freyssinet, J. M. Cellular microparticles: what are they bad or good for. The Journal of Thrombosis and Haemostasist. 1 (7), 1655-1662 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.