Method Article
Изоляция островков взрослых свиней
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот подробный протокол охватывает методологические этапы выделения островков взрослой свиньи от фазы сбраживания через очистку до окончательной функциональной оценки островков. Этот план может быть использован в качестве руководства по изоляции островков взрослых свиней в научно-исследовательских учреждениях.
Аннотация
Сахарный диабет 1 типа (СД1) вызывается аутоиммунным разрушением β клеток поджелудочной железы, что приводит к незначительной выработке инсулина или ее отсутствию. Трансплантация островковых клеток играет важную роль в лечении СД1, при этом улучшается гликометаболический контроль, уменьшается прогрессирование осложнений, уменьшаются эпизоды гипогликемии по сравнению с традиционной инсулинотерапией. Результаты III фазы клинических исследований также продемонстрировали безопасность и эффективность аллотрансплантации островковых клеток при СД1. Однако нехватка доноров поджелудочной железы ограничивает ее широкое использование. Животные в качестве источника островков, такие как свиньи, предлагают альтернативный выбор. Поскольку архитектура поджелудочной железы свиньи отличается от островков мышей или человека, процедура изоляции островков свиньи по-прежнему является сложной задачей. Поскольку перевод альтернативных источников островков свиней (ксеногенных источников) в клинические условия для лечения СД1 путем клеточной трансплантации имеет большое значение, срочно необходим экономически эффективный, стандартизированный и воспроизводимый протокол для выделения островков свиней. В данной рукописи описывается упрощенный и экономически эффективный метод выделения и очистки взрослых островков свиней, основанный на предыдущих протоколах, которые успешно пересаживали островки свиней приматам. Это будет руководство для начинающих без использования специализированного оборудования, такого как процессор COBE 2991.
Введение
Сахарный диабет 1 типа (СД1) — серьезное заболевание, при котором аутоиммунное разрушение бета-клеток приводит к незначительной выработке инсулина или ее отсутствию 1,2,3. Значительная группа пациентов с СД1 не может стабилизировать гликемическую лабильность с помощью инсулинотерапии и испытывает угрожающие жизни эпизоды гипогликемии. Трансплантация островковых клеток, при условии успеха, может этого достичь. Более 1500 пациентов с диабетом во всем мире прошли успешную трансплантацию островковых клеток, демонстрируя меньший риск, но долгосрочный успех по сравнению с трансплантацией поджелудочной железы4.
По сравнению с инсулинотерапией, трансплантация островковых клеток дает лучшие результаты в снижении прогрессирования осложнений5. Результаты III фазы клинического исследования также продемонстрировали безопасность и эффективность аллотрансплантации островковых клеток при СД1 6,7. Трансплантация островков может быть лучшим терапевтическим вариантом, доступным в настоящее время для пациентов с СД1, которые испытывают угрожающие жизни эпизоды гипогликемии.
Однако нехватка аллогенных донорских островков человека ограничивает широкое использование трансплантации островков 8,9. Поэтому использование островков животного происхождения в качестве замены желательно10. Свинья была выбрана в качестве донора островковых клеток при доклинической ксенотрансплантации, и она имеет потенциальную применимость в клинике благодаря 1) доступности, 2) метаболическому сходству с человеком, 3) довольно большой массе бета-клеток и 4) возможности генной инженерии для улучшения иммунологической совместимости с человеком.
Высокая чистота и жизнеспособность островков являются ключевыми этапами для успеха ксенотрансплантации. Тем не менее, процедура выделения островков от взрослых доноров свиней представляет собой сложную задачу из-за архитектуры самой поджелудочной железы, которая отличается от островков мышей или человека12. Вообще говоря, форма островков поджелудочной железы свиней не являетсякомпактной12. По сравнению с островками поджелудочной железы человека и грызунов, островки свиньи легче диссоциируют12. Однако спонтанная диссоциация наружного слоя островковых клеток, сопровождающаяся длительным временем культивирования, приводит к существенному уменьшению размера островков поджелудочной железы10.
В процессе выделения островков на качество островков влияют многие факторы, такие как возраст донора, время теплой ишемии, ферментативная активность, растяжение при ферментативном введении13,14. Несмотря на то, что во многих предыдущих исследованиях были представлены методы изоляции островков свиней, не существует подробного пошагового видеопротокола для исследователей в качестве эффективной инструкции 10,15,16,17,18,19,20,21,22,23.
С этой целью этот подробный протокол охватывает все этапы изоляции, от извлечения органов до функциональной оценки островков после изоляции, надеясь предложить простой и понятный обзор процесса для легкого применения. Данный протокол основан на ранее опубликованных методах с модификациями 10,11.
протокол
Все процедуры, связанные с животными, одобрены Комитетом по уходу за животными и их использованию Второй народной больницы Шэньчжэня и соответствуют всем национальным нормам. В этом протоколе в качестве доноров поджелудочной железы использовались свиньи породы Дюрок-Ландрас-Йоркшир (в возрасте ~6 месяцев), приобретенные на рынке. Вес собранной поджелудочной железы составил 123,63 г ± 22,50 г. Во время экспериментов надеваются средства индивидуальной защиты, в том числе защитная одежда, маски, перчатки и шапочки.
1. Подготовка СМИ
- Чистящая среда: Чтобы приготовить 100 мл чистящего средства, смешайте сбалансированный солевой раствор Хэнка (HBSS), 2% свиную сыворотку, 20 мМ 4-(2-гидроксиэтил)-1-пиперазиэтанасульфоновой кислоты (HEPES) и 1% пенициллин-стрептомицин (P/S).
- Собирающая среда: Смешайте RPMI 1640 с 5% сывороткой свинины и 1% пенициллин-стрептомицином (P/S).
- Питательная среда: Смешайте CMRL 1066 с 10% свиной сывороткой, 10 ммоль/л никотинамида, 1% P/S и 2 ммоль/л L-глютамина.
- Ферментный раствор: Приготовьте раствор коллагеназы типа V 1 мг/мл (активность: 918 ЕД/мг твердого вещества) в HBSS.
- Раствор с низкой концентрацией глюкозы: Чтобы приготовить раствор с низкой концентрацией глюкозы, добавьте 0,5% бычьего сывороточного альбумина (BSA) и 2,8 мМ D-глюкозы в 1 мл буфера Kreb's Ringer (KRBB).
- Раствор с высокой концентрацией глюкозы: Чтобы приготовить раствор с высокой концентрацией глюкозы, добавьте 0,5% бычьего сывороточного альбумина (BSA) и 28 мМ D-глюкозы в 1 мл буфера Kreb's Ringer (KRBB).
2. Забор поджелудочной железы
- Анестезия свиньи и подготовка кожи
- Обезболить свинью-донора с помощью внутримышечного введения анестетиков Люмианнинг (2,5-5 мг/кг) и Пропофол (2-3 мг/кг) (подробнее см. Таблицу материалов ).
- Поддерживайте анестезию 1%-3% изофлураном в вентиляционном объеме 1-1,5 л/мин с помощью газоанестезионных масок.
- Следите за частотой сердечных сокращений, чтобы подтвердить правильную анестезию. Используйте ветеринарную мазь для глаз, чтобы предотвратить сухость во время анестезии.
- Выбрейте брюшную полость, очистите ее йодофором и накройте свинью стерильной хирургической простыней.
- Вскрытие живота
- После обеспечения стерильных условий сделайте лапаротомический разрез по средней линии от мечевидной кости до пупка немного возле хвоста.
- Надрезаем диафрагму.
- Изолируют надпеченочную аорту и надпеченочную нижнюю полую вену (НПВ) с помощью сосудистых щипцов, а затем изолируют инфраренальную аорту и инфрапеченочный НПВ тем же методом.
- Ввести свинье внутривенно гепарин (100 ЕД/кг) для предотвращения свертывания крови.
- Выведите тонкую и толстую кишку наружу и протолкните печень и желудок к головке, чтобы полностью обнажить поджелудочную железу.
- Перфузия поджелудочной железы
- Зажмите аорту над диафрагмой сосудистыми щипцами, интубируйте аорту над ветвью почечной аорты через аортальную канюлю (16 G) и перевяжите шовной нитью 2-0.
- Влейте в животное 2-3 литра холодного раствора HBSS (предварительно упакованного и поддерживаемого при температуре 4 °C) через аортальную канюлю (16 G). Введите раствор HBSS через аортальную канюлю под действием силы тяжести, в то время как надпеченочный НПВ и НПВ пересекаются для высвобождения перфузионной жидкости.
ПРИМЕЧАНИЕ: Продолжайте инфузию до тех пор, пока отток из НПВ не станет прозрачным.
- Иссечение поджелудочной железы
- Снимите сальник, найдите доли поджелудочной железы и селезенки вместе с селезенкой и отделите их.
- Отделите соединенную долю поджелудочной железы с прилегающими тканями.
- Найдите главный проток поджелудочной железы в нисходящей части двенадцатиперстной кишки. Перевязать желчный проток швом (2-0) и пересечь его ножницами возле протока поджелудочной железы.
- Зажмите участок двенадцатиперстной кишки, содержащий ампулу Фатера, с обеих сторон головки поджелудочной железы сосудистыми щипцами, а затем резецируйте двенадцатиперстную кишку ножницами.
- Извлеките всю поджелудочную железу, погрузите ее в холодный HBSS и немедленно транспортируйте в изолятор островков.
ПРИМЕЧАНИЕ: Свиней усыпляли с использованием пентобарбитала натрия (100-200 мг/кг). Внутрипротоковая инфузия HBSS или консервирующего раствора может быть использована для расширения поджелудочной железы в месте забора органа, если поджелудочная железа закупается на местной скотобойне.
3. Подготовьте три шкафа биобезопасности для проведения следующих экспериментов
- Установите шкаф биобезопасности #1 с тазиком для почек, хирургическими инструментами и стаканами для чистки поджелудочной железы (раздел 4, рисунок 1А).
- Установите шкаф биобезопасности #2 с водяной баней, перистальтическим насосом, подставкой для трубок с рециркуляционной трубкой и камерой для разложения островков (раздел 5, рисунок 1B).
- Установите шкаф биобезопасности #3 с одноразовыми фильтрами и центрифужными пробирками для получения ферментов, очистки островков, а также выполните следующие шаги (разделы 6-8, рисунок 1C).
4. Чистка поджелудочной железы
- Очистите и взвесьте поджелудочную железу.
- Промойте поджелудочную железу в 200 мл йодофора в течение 3 минут в шкафу биобезопасности #1. Промойте поджелудочную железу в 200 мл холодного HBSS дважды, по 2 мин каждый.
- Положите очищенную поджелудочную железу в таз для почек, содержащий 100 мл чистящего средства со льдом.
- Ампулу держите зажатой, резекцию двенадцатиперстной кишки. Очистите поджелудочную железу от внешнего жира и соединительной ткани.
- Взвесьте поджелудочную железу.
5. Пищеварение поджелудочной железы
- Инфузия коллагеназы
- Разрежьте поперечное сечение одной из кольцевидных ветвей поджелудочной железы и вставьте ангиокат 18 G (если диаметр протока меньше, рассмотрите ангиокат 20 G) в главный проток поджелудочной железы и зашите его на место шелковым швом 2-0.
- Отрежьте тканевый мостик, который проходит через соединительную долю возле головки поджелудочной железы, и зажмите катетер сбоку от разреза возле головки поджелудочной железы, чтобы уменьшить утечку фермента.
- Установите несколько ангиокатов для лучшей внутрипротоковой инфузии ферментов. Для этого вводят дополнительные ангиокаты (размер 20-22 G) после рассечения органа поджелудочной железы, чтобы обнажить проток.
- Установите заправочный трубопровод, включая силиконовую трубку длиной 1 м (16#) с разъемом Luer-lock. Средняя часть трубки встроена в перистальтическую головку насоса.
- Включите перистальтический насос, чтобы наполнить систему трубок (размер трубки 16#) 300 мл 1 мг/мл, коллагеназу типа V (активность: 918 единиц/мг), предварительно нагретую до 24 °C и удалить пузырьки воздуха в трубопроводе.
- Подсоедините перфузионную трубку к ангиокату и включите перистальтический насос со скоростью 20 мл/мин.
- Остановите перфузию, когда большая часть фермента будет введена и поджелудочная железа хорошо растянута (Рисунок 2B).
- Разрежьте прозрачную студенистую ткань, которая образуется вокруг поджелудочной железы во время перфузии.
ПРИМЕЧАНИЕ: Этот шаг очень важен, потому что гель может засорить фильтр в камере и затруднить сбор переваренной ткани (Рисунок 2B). - Удалите ангиокаты после настаивания.
- Переваривание тканей
- Разогрейте 1 л раствора HBSS до 36 °C. Заранее подготовьте систему сбраживания, состоящую из камеры сбраживания и трубки, соединенных в закрытую систему, и перенесите нагревательный змеевик контура в водяную баню с температурой 36 °C.
- Разрежьте поджелудочную железу на 3-4 части и залейте их коллагеназой типа V в стакан объемом 500 мл.
- Накройте стакан стерильной крышкой чашки Петри, перенесите его в шкаф биобезопасности #2 и поместите содержимое стакана в камеру для разложения, содержащую четыре силиконизированных стеклянных шарика и ячейку размером 500 мкм.
- Закройте камеру и закрутите винты. Поместите оставшийся фермент в рециркуляционный стакан и включите перистальтический насос со скоростью 80 мл/мин.
- Добавьте теплый раствор HBSS (обычно около 150 мл), предварительно нагретый на шаге 5.2.1, чтобы заполнить контур до конца. Аккуратно встряхните камеру и переверните ее так, чтобы шарики из силиконизированного стекла попали на ткань.
ПРИМЕЧАНИЕ: Поскольку островки свиньи более нежные, чем человеческие ткани, встряхивание должно быть равномерным и медленным, чтобы избежать повреждений. По мере того, как ткань переваривается, она начнет разваливаться и вытекать из камеры. - Каждые 2 минуты отбирайте пробу (примерно 1 мл) из контура, чтобы проверить наличие свободных островков после встряхивания в течение 1 минуты.
- Поместите образец в 6-луночный планшет с 80 мкл дитизона (DTZ). Добавьте 2 мл фосфатно-солевого буфера (PBS) и исследуйте образец под микроскопом с 40-кратным увеличением. DTZ окрасит островки в красный цвет.
- Сборник дайджеста
- Продолжайте переваривание до тех пор, пока не будут наблюдаться свободные островки (даже если многие из них все еще частично захвачены экзокрином).
ПРИМЕЧАНИЕ: Выделение островков занимает около 10-15 минут, но время переваривания часто зависит от возраста донора, количества ферментов, концентрации фермента и т.д. - Откройте контур и соберите высвободившуюся салфетку во флаконы объемом 1 л. Держите флаконы на льду во время сбора, чтобы помочь инактивировать коллагеназу типа V.
- Добавьте оставшийся теплый раствор HBSS (~850 мл, шаг 5.2.1) в стакан рециркуляции и соберите остатки переваренной ткани из камеры для сбраживания.
- Добавьте в камеру холодную собирающую среду (через рециркуляционный стакан).
ПРИМЕЧАНИЕ: Прекратите сбор, когда гранулы ткани станут меньше. Фаза сбора (шаги 5.3.2-5.3.3) может занимать до 40-75 минут и 5-8 л собирающей среды. - Переложите салфетку из флакона для сбора в конические центрифужные пробирки объемом 250 мл и центрифугируйте при 200 x g в течение 3 минут при 4 °C.
- Выбросьте надосадочную жидкость и повторно суспендируйте ткань в 500 мл свежей собирающей среды.
- Продолжайте смешивать гранулы клеток в холодную собирающую среду (500 мл) до тех пор, пока не будет собран весь расщепленный материал.
- Промойте клеточную гранулу взвешенной в холодной среде центрифугированием (3 мин при 200 х г, 4 °C).
- Выбросьте надосадочную жидкость. Оцените и количественно оцените гранулу клетки, следуя шагам, указанным в разделах 6-8.
ПРИМЕЧАНИЕ: Конечный объем зависит от размера поджелудочной железы, но ожидается, что он будет в пределах 40-80 мл.
- Продолжайте переваривание до тех пор, пока не будут наблюдаться свободные островки (даже если многие из них все еще частично захвачены экзокрином).
6. Очищение островков
- Очистите островки свиней путем разделения по градиенту плотности.
ПРИМЕЧАНИЕ: Обратитесь к Таблице материалов для получения подробной информации об используемых решениях градиента плотности.- Добавьте 2 мл ткани поджелудочной железы в конические трубки объемом 50 мл.
- Добавьте 12 мл градиента полисахарозы 1119 (1,119 г/см3) для ресуспендирования каждых 2 мл ткани поджелудочной железы.
- Добавьте 10 мл раствора полисахарозы 1083 (1,083 г/см3), 10 мл раствора полисахарозы 1077 (1,077 г/см3), 10 мл раствора полисахарозы 1037 (1,037 г/см3) и 5 мл HBSS, последовательно.
Примечание: Раствор полисахарозы 1037 (1,037 г/см3) получают путем смешивания раствора полисахарозы 1077 (1,077 г/см3) и гипертонического раствора цитратпурина (38,5 мл:11,5 мл). - Центрифуга при давлении 900 x g без тормоза в течение 10 мин при 4 °C.
- Отсасывайте островки между слоями раствора полисахарозы 1077 и раствора полисахарозы 1037.
- Переложите островки в центрифужную пробирку объемом 50 мл, равномерно распределите жидкость в каждой пробирке и сбалансируйте перед центрифугированием.
- Промыть свиные островки
- Центрифугируйте при 200 х г в течение 3 минут при 4 °C, выбросьте надосадочную жидкость. Добавьте собирающую среду, чтобы довести объем до 45 мл.
- Центрифугировать при 200 х г в течение 3 мин при 4 °С, оставляя около 2 мл надосадочной жидкости; Аккуратно встряхните, чтобы перемешать.
- Соедините все гранулы в одной центрифужной пробирке объемом 50 мл. Добавьте собирающую среду, чтобы довести объем до 45 мл.
7. Подсчет островковых эквивалентов (IEQ) и культуры островков
- DTZ окрашивание островков
- Соедините островки вместе, добавьте больше собирающей среды, чтобы довести объем до 250 мл, и снова суспендируйте островки.
- Возьмите 500 μL репрезентативной пробы и поместите ее в чашку диаметром 35 мм с 80 μL DTZ. Дайте ему поинкубироваться при комнатной температуре в течение 1-2 минут, а затем добавьте 2 мл PBS.
- Рассматривайте при 40-кратном увеличении под инвертированным микроскопом. Островковые агрегаты окрашиваются ДТЗ в красный цвет.
- Подсчет окрашенных островков
- Подсчитайте окрашенные островки, разделив их на размерные категории, перечисленные в таблице 1. Используйте коэффициент пересчета для определения островкового эквивалента (IEQ) в соответствии с размером.
ПРИМЕЧАНИЕ: Конверсию ИЭК проводят, когда диаметр большинства ДТЗ-положительных агрегатов превышает 50 мкм (у взрослых (>2 года) и некоторых молодых (6-12 месяцев) препаратах переходят к шагу 7.2.4). Во всех остальных случаях (у молодых свиней в возрасте до 6 месяцев и у остальных молодых взрослых свиней) количество островков оценивали исходя из объема частиц или содержания ДНК (согласно шагам 7.2.2-7.2.3). - (НЕОБЯЗАТЕЛЬНО) Центрифуга при 200 x g при 4 °C в течение 2 мин для измерения поддонов.
- (НЕОБЯЗАТЕЛЬНО) Оцените содержание ДНК в одиночных островках, а также в гранулах островковых клеток с помощью набора для анализа пролиферации клеток. Экстраполируйте количество бета-клеток свиньи по содержанию ДНК и иммуноцитохимическому анализу.
- Сложите все категории и определите общий IEQ для выборки. Умножьте это число на объем дроби. (например, 200 IEQ в 500 μL из фракции 250 мл = 200 x 2 x 250 = 100 000 IEQ).
- Подсчитайте окрашенные островки, разделив их на размерные категории, перечисленные в таблице 1. Используйте коэффициент пересчета для определения островкового эквивалента (IEQ) в соответствии с размером.
- Островковая культура
- Центрифугировать островки при 200 х г при 4 °C в течение 1 мин; Выбросьте надосадочную жидкость.
- Добавьте 5 мл предварительно подогретой питательной среды для ресуспендирования островков и переложите в чашку Петри диаметром 150 мм.
ПРИМЕЧАНИЕ: Ресуспендирование 10 000 островков на тарелку. - Добавьте еще питательную среду, чтобы довести объем до 30 мл в чашке Петри 150 мм.
8. Оценка качества островков
- Кальцеин AM (CA) -Йодид пропидия (PI) окрашивание островков
- Вручную соберите 50 островков в 48-луночную пластину. Умойте один раз 1 мл HBSS.
- Добавьте 200 мкл смеси, содержащей 1x CA и 1x PI в соответствии с инструкциями набора для окрашивания жизнеспособности клеток.
- Накройте чашку Петри крышкой и поместите ее в инкубатор при температуре 37 °C на 30 минут.
- Визуализируйте островки с помощью флуоресцентного микроскопа и сделайте снимки.
- Количественно оцените жизнеспособность, подсчитав живые клетки (зеленые) и мертвые клетки (красные) после окрашивания CA-PI.
- Глюкозостимулированная секреция инсулина (GSIS)
- Добавьте 1 мл раствора с низкой концентрацией глюкозы в три лунки 24-луночной установки.
- После культивирования, по крайней мере, в течение ночи, вручную отоберите 100 островков аналогичного размера в диапазоне 100-200 мкм в диаметре и перенесите их в три лунки 24-луночного планшета, предварительно заполненные раствором с низкой концентрацией глюкозы (как на шаге 8.2.1).
ПРИМЕЧАНИЕ: Промойте островки в промежуточной лунке с помощью HBSS перед тем, как перенести их в лунку для вымывания питательной среды. - Инкубируйте островки в инкубаторе с 5% содержаниемCO2 при температуре 37 °C в течение 30 минут.
- Осторожно удалите надосадочную жидкость с помощью пипетки, не касаясь островков.
- Добавьте 1 мл нового раствора с низкой концентрацией глюкозы.
- Инкубируйте островки в инкубаторе с 5% содержаниемCO2 при температуре 37 °C в течение 60 минут.
- Соберите надосадочную жидкость (без островков) и перенесите не менее 500 мкл ее в центрифужную пробирку объемом 1,5 мл. Он будет содержать инсулин, выделяемый при стимуляции низким уровнем глюкозы.
- Осторожно добавьте 1 мл раствора с высокой концентрацией глюкозы в те же лунки.
- Инкубируйте островки в инкубаторе с 5% содержаниемCO2 при температуре 37 °C в течение 60 минут.
- Перелейте еще 500 μл питательной среды в новую центрифужную пробирку объемом 1,5 мл. Он будет содержать инсулин, секретируемый при стимуляции высоким уровнем глюкозы.
- Используйте наборы иммуноферментного анализа (ИФА) для свиного инсулина для измерения концентрации инсулина, высвобождаемого после стимуляции низким и высоким уровнем глюкозы (шаги 8.2.7 и 8.2.10).
ПРИМЕЧАНИЕ: Индекс стимуляции (SI) рассчитывается как отношение концентрации инсулина, измеренной после стимуляции высоким уровнем глюкозы, к концентрации инсулина после стимуляции низким уровнем глюкозы.
Результаты
Подготовка шкафа биобезопасности показана на рисунке 1. Созданы три независимых операционных пространства. Шкаф биобезопасности #1 оснащен тазиками для почек, хирургическими инструментами и стаканами для обрезки поджелудочной железы (рис. 1А). Шкаф биобезопасности #2 оснащен водяной баней, перистальтическим насосом, подставкой для трубок с рециркуляционной трубкой и камерой для разложения островков (Рисунок 1В). Шкаф биобезопасности #3 оснащен одноразовыми фильтрами и центрифужными пробирками для получения ферментов, очистки островков и выполнения следующих этапов (рис. 1C).
Поджелудочная железа (до и после перфузии фермента) показана на рисунке 2. Раствор коллагеназы V типа перфузируется во всю поджелудочную железу через проток поджелудочной железы, начиная от головки поджелудочной железы. Если соединительная доля не была успешно перфузирована, ее нужно разрезать на отдельные части, и каждую из них нужно перфузировать.
Сбраживание поджелудочной железы осуществляется в камере сбраживания, как показано на рисунке 3. Ткань поджелудочной железы после механического разрушения и непереваренная ткань поджелудочной железы, оставшаяся после переваривания, показаны на рисунке. Небольшое количество непереваренной ткани свидетельствует о полноценном пищеварении; однако это также может указывать на чрезмерное пищеварение; Поэтому, если в камере остается 15%-25% органа поджелудочной железы, это допустимо. Затем переваренную ткань поджелудочной железы промывают и центрифугируют на прерывистых градиентах плотности для отделения островков от ацинарных клеток (очистка), как показано на рисунке 4. Островки поджелудочной железы находятся в среднем слое.
Окрашивание островков DTZ показано на рисунке 5. Точка, в которой прекращается переваривание и начинается сбор (т.е. когда появляются свободные островки), показана на рисунке 5А. Очищенные островки свиней после разделения по градиенту плотности показаны на рисунке 5B. Островки в светлом поле показаны на рисунке 6А. Качество островков проверяют с помощью окрашивания кальцеином AM (CA) -йодидом пропидия (PI), как показано на рисунке 6B. Живые клетки имеют зеленый цвет, а мертвые клетки – красный. Средний выход изоляции островков по этому протоколу составляет 360 935 ± 114 279 IEQ/поджелудочная железа и 2 439-3 252 IEQ/г поджелудочной железы, что аналогично предыдущему исследованию (333 000 ± 129 000 IEQ/поджелудочная железа). Средняя жизнеспособность островков по этому протоколу составляет более 81%, что несколько ниже, чем в предыдущем исследовании (86,7%). Один из репрезентативных результатов индекса стимуляции (SI = соотношение между количествами инсулина (мЕд/л), высвобождаемыми при высоком уровне глюкозы по сравнению с низким содержанием глюкозы), полученным с помощью теста секреции глюкозы (GSIS), измеренного методом ИФА по этому протоколу, составляет 1,4 ± 0,3, что аналогично предыдущему исследованию (1,75 ± 0,60)24. Вышеуказанные результаты обобщены в таблице 2.

Рисунок 1: Подготовка шкафа биобезопасности. (A) Шкаф биобезопасности #1 показывает бассейн с почками, хирургические инструменты и стаканы в стерильном поле. (B) Шкаф биобезопасности #2 с водяной баней (слева направо), перистальтическим насосом, подставкой для трубок с рециркуляционной трубкой и трубками, а также камерой для разложения. (В) Шкаф биобезопасности #3 с одноразовыми фильтрами и центрифужными пробирками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
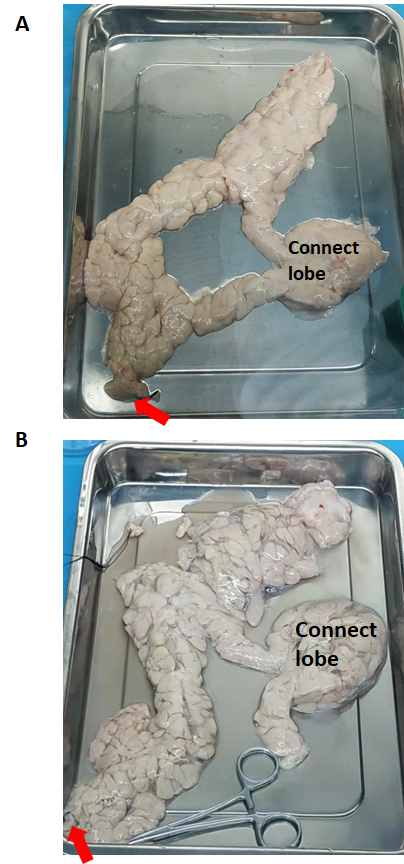
Рисунок 2: Поджелудочная железа до и после перфузии фермента. (A) До перфузии фермента. (B) Расширенная поджелудочная железа после ферментной перфузии. Красная стрелка указывает на течение раствора коллагеназы типа V. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Поджелудочная железа в камере сбраживания. (A) Ткань поджелудочной железы после пищеварения и разрушения шариками. (В) Ткань поджелудочной железы, оставшаяся после пищеварения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
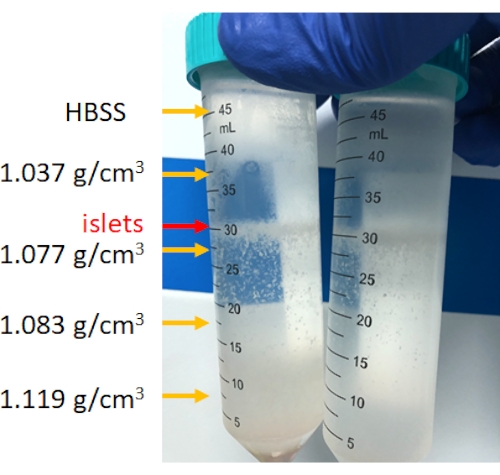
Рисунок 4: Стратификация клеток поджелудочной железы после прерывистого центрифугирования с градиентом плотности. После центрифугирования островки будут концентрироваться между 1,077 г/см3 и слоем HBSS, а донный осадок представляет собой неостровковую ткань. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
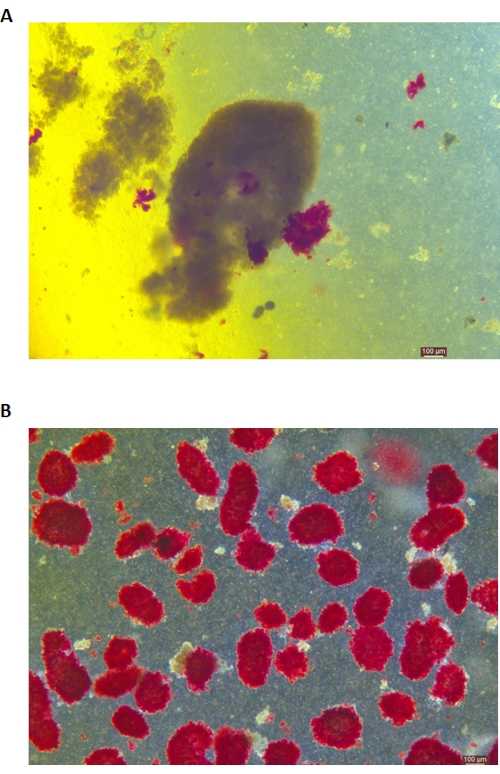
Рисунок 5: Окрашивание островков дитизоном (DTZ) во время пищеварения. (A) Образцы собираются из пищеварительной комнаты. Островки в образце окрашены в красный цвет. Сигналом к началу сбора является полное освобождение 1-2 островков из экзокринной ткани. (B) Очищенные островки, разделенные прерывистым градиентом плотности. Масштабная линейка составляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
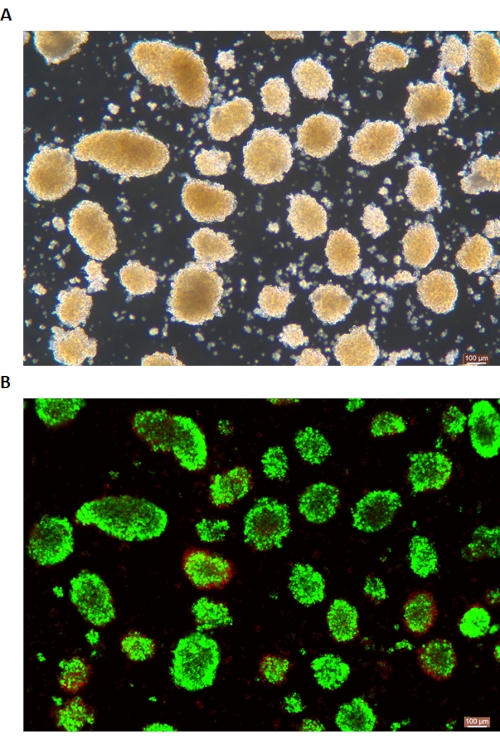
Рисунок 6: Окрашивание жизнеспособности живых/мертвых островковых клеток. (А) Островки в светлом поле. (B) Кальцеин AM (CA) -Окрашивание иодида пропидиума (PI) островков. Живые клетки имеют зеленый цвет, а мертвые клетки – красный. Масштабная линейка составляет 100 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Категория | Диапазон диаметров островков (мкм) | Коэффициент пересчета IEQ |
| 1 | 50–100 | х 0,167 |
| 2 | 101–150 | х 0,648 |
| 3 | 151–200 | х 1.685 |
| 4 | 201–250 | х 3.500 |
| 5 | 251–300 | х 6.315 |
| 6 | 301–350 | х 10.352 |
| 7 | >350 | х 15.833 |
Таблица 1: Коэффициенты пересчета для расчета островковых эквивалентов (IEQ).
| Этот протокол | Предыдущие исследования24 | |
| Выход островков (IEQ/поджелудочная железа) | 360 935 ± 114 279 | 333 000 ± 129 000 |
| Жизнеспособность островков | 81% | 86.70% |
| Индекс инсулиновой стимуляции островков | 1,4 ± 0,3 | 1.75 ± 0.60 |
Таблица 2: Сравнение результатов, полученных с помощью этого протокола, с предыдущими исследованиями.
Обсуждение
Ксенотрансплантация островков с использованием свиней в качестве источника островков является перспективным подходом к преодолению нехватки островков человека. Несмотря на то, что выделение островков взрослой свиньи является сложной задачей, несколько групп разработали протоколы для успешной последовательной изоляции островков10,11. Независимо от метода, для подтверждения высокого качества продукции необходимо продемонстрировать жизнеспособность островков и функциональные свойства. Этот протокол основан на опубликованных10,11 в видеоформате, чтобы его было легко понять и воспроизвести.
Согласно предыдущим отчетам и нашему опыту, несколько параметров имеют решающее значение для успешного выделения островков взрослой свиньи13,14. К критическим параметрам относятся: (1) Возраст и пол свиньи-донора: самки свиней с более чем двумя пометами (так называемые выведенные на пенсию заводчики) предпочтительнее более молодых свиней, потому что они могут легко обеспечить большое количество высококачественных островков 25,26,27,28,29,30, (2) Время теплой ишемии: ограничение до 10 минут с целью снижения самопереваривания 14, (3) Фермент пищеварения: коллагеназа V типа является допустимым вариантом, (4) Время переваривания: важно остановить переваривание достаточно рано, чтобы избежать переваривания. Как только будут обнаружены свободные островки, начнется процесс сбора, даже если они частично захвачены. Это очень ранняя стадия процесса.
Этот протокол имеет ряд преимуществ. По сравнению с непрерывными или прерывистыми градиентами плотности с использованием процессора ячеек COBE 2991 для очистки островков, этот протокол слоя изоляет решения с градиентом плотности с использованием конических пробирок и стандартной центрифуги. Он экономичен и прост в освоении для новичков. Поскольку этот метод очистки требует больше ручного труда, для бестарного производства и больших гранул все еще может потребоваться процессор ячеек COBE для повышения эффективности.
Здесь также обсуждаются некоторые шаги по устранению неполадок. (1) Предположим, что более 25% ткани поджелудочной железы не переварено, или большинство островков поджелудочной железы покрыты ацинарной тканью. В этом случае возможными причинами могут быть плохая перфузия, остаточная кровь, которая влияет на активность фермента, низкая концентрация или активность фермента или низкая температура во время пищеварения. (2) Чрезмерное переваривание ткани поджелудочной железы может привести к фрагментации островков поджелудочной железы. Возможная причина заключается в том, что время теплой ишемии плохо контролируется, высокая концентрация пищеварительных ферментов, более длительное воздействие раствора пищеварительного фермента на переваренные островки или высокая температура пищеварения. Этого можно избежать только путем стандартизации параметров ферментов/сбраживания и оптимизации процесса. (3) Потеря целостности островков поджелудочной железы также может произойти в процессе культивирования. Некоторые причины этого включают ацинарное загрязнение, приводящее к низкой чистоте островков поджелудочной железы, слишком высокую плотность культуры островковых клеток, недостаточное питание или механические повреждения. Чтобы преодолеть потерю целостности островков поджелудочной железы, увеличьте объем островковой среды, увеличьте плотность среды, а также центрифугируйте островки медленнее и в течение более короткого времени.
Таким образом, этот протокол был успешно использован для подготовки островков взрослых свиней к трансплантации реципиентам приматов. В дальнейшем он будет использоваться для получения островков для будущих исследований.
Раскрытие информации
Авторы не сообщают о конфликте интересов.
Благодарности
Мы благодарим профессора Дэвида К. С. Купера (Центр трансплантологии, Массачусетская больница общего профиля) за помощь в создании всей системы ксенотрансплантации. Мы благодарим мисс Синлин Ху (Вторая народная больница Шэньчжэня), мисс Сяохэ Тянь (Калифорнийский университет, Беркли), г-на Бо Чжоу (Бостонский университет) за полезную дискуссию и предложения. Эта работа была поддержана грантами Национальной ключевой программы исследований и разработок Китая (2017YFC1103701, 2017YFC1103704), Специальных фондов для строительства больниц высокого уровня в провинции Гуандун (2019) и Проекта медицины Саньмин в Шэньчжэне (SZSM201812079).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Ссылки
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены