Method Article
成体ブタ島の分離
* これらの著者は同等に貢献しました
要約
この詳細なプロトコルは、 消化段階から 精製を経て膵島の最終的な機能評価まで、成体ブタの膵島の分離の方法論的ステップをカバーしています。この概要は、研究機関における成体ブタ島隔離のガイドラインとして活用できます。
要約
1型糖尿病(T1DM)は、膵臓β細胞の自己免疫破壊によって引き起こされ、その結果、インスリンの産生がほとんどまたはまったくなくなります。膵島移植は、従来のインスリン療法と比較した場合、糖代謝制御の改善、合併症の進行の減少、低血糖エピソードの減少により、T1DMの治療に重要な役割を果たします。第III相臨床試験の結果は、T1DMにおける膵島同種移植の安全性と有効性も実証されました。しかし、膵臓ドナーの不足により、その広範な使用は限られています。ブタのような小島の供給源としての動物は、別の選択肢を提供します。ブタの膵臓の構造はマウスや人間の膵島とは異なるため、ブタの膵島隔離手順は依然として困難です。細胞移植によるT1DMの治療のための臨床現場への代替ブタ膵島供給源(異種)の翻訳は非常に重要であるため、ブタ膵島を単離するための費用対効果が高く、標準化され、再現性のあるプロトコルが緊急に必要とされています。この原稿では、ブタ島を非ヒト霊長類に移植することに成功した以前のプロトコルに基づいて、成体のブタ島を分離および精製するための簡略化された費用対効果の高い方法について説明します。これは、COBE 2991 Cell Processorなどの専用機器を使用しない初心者向けガイドになります。
概要
1型糖尿病(T1DM)は、ベータ細胞の自己免疫破壊によりインスリン産生がほとんどまたはまったくなくなる深刻な疾患です1,2,3。T1DM患者のかなりのグループは、インスリン療法で血糖不安定性を安定させることができず、生命を脅かす低血糖エピソードを経験します。膵島移植は、成功すれば、それを達成することができます。世界中で1,500人以上の糖尿病患者が膵島移植に成功しており、膵臓移植よりもリスクが低く、長期的な結果の成功が示されています4。
インスリン療法と比較して、膵島移植は合併症の進行を抑える効果が良好です5。第III相臨床試験の結果は、T1DMにおける膵島同種移植の安全性と有効性も実証されました6,7。膵島移植は、生命を脅かす低血糖エピソードを経験するT1DM患者に現在利用可能な最良の治療選択肢である可能性があります。
しかし、ヒトの同種ドナー膵島が不足しているため、膵島移植の広範な使用が制限されています8,9。したがって、代替として動物島を使用することが望ましい10。ブタは、前臨床異種移植における膵島細胞のドナーとして選択されており、1)利用可能性、2)ヒトとの代謝類似性、3)かなり大きなベータ細胞塊、および4)ヒトとの免疫学的適合性を改善するための遺伝子工学の可能性により、臨床への潜在的な翻訳が可能です11。
膵島の高純度と生存率は、異種移植の成功のための重要なステップです。しかし、成体ブタのドナーから膵島を分離する手順は、マウスやヒトの膵島とは異なる膵臓自体の構造のために困難である12。一般的に言えば、ブタ膵島の形状はコンパクトではありません12。ヒトやげっ歯類の膵島と比較して、ブタの膵島はより簡単に解離します12。しかし、膵島細胞の外層の自発的な解離は、長い培養時間を伴うため、膵島サイズ10の大幅な減少につながります。
膵島の隔離プロセス中に、ドナーの年齢、温かい虚血時間、酵素活性、酵素注射13,14による膨張など、多くの要因が膵島の品質に影響を与えます。多くの先行研究がブタ膵島隔離の方法を提供していたが、研究者にとって効果的な指導としての詳細なステップバイステップのビデオプロトコルは存在しない10,15,16,17,18,19,20,21,22,23。
この目的のために、この詳細なプロトコルは、臓器の回収から膵島の分離後の機能評価まで、すべての分離ステップをカバーし、適用を容易にするためのプロセスのシンプルで理解しやすい概要を提供することを望んでいます。このプロトコルは、以前に公開された方法に10,11の変更を加えた方法に基づいています。
プロトコル
動物に関するすべての手続きは、深セン第二人民病院の動物施設管理および使用委員会によって承認され、すべての国内規制に従っています。このプロトコルでは、市場から購入したデュロック-ランドレース-ヨークシャーの豚(生後~6ヶ月)を膵臓ドナーとして使用しました。採取した膵臓の重量は22.50g±123.63gであった。実験中は、防護服、マスク、手袋、帽子などの個人用保護具を着用します。
1. 培地の準備
- 洗浄剤:100 mLの洗浄剤を調製するには、ハンクス平衡塩溶液(HBSS)、2%ブタ血清、20 mM 4-(2-ヒドロキシエチル)-1-ピペラジンエタンスルホン酸(HEPES)、および1%ペニシリン-ストレプトマイシン(P / S)を混合します。
- 収集培地:RPMI 1640を5%ブタ血清および1%ペニシリン-ストレプトマイシン(P / S)と混合します。
- 培地:CMRL 1066を10%ブタ血清、10 mmol/Lニコチンアミド、1%P/S、および2 mmol/L L-グルタミンと混合します。
- 酵素溶液:HBSS中に1 mg/mLコラゲナーゼV型(活性:918単位/mg固体)溶液を調製します。
- 低グルコース濃度溶液:低グルコース濃度溶液を調製するには、0.5%ウシ血清アルブミン(BSA)と2.8 mM D-グルコースを1 mLのクレブスリンガー重炭酸塩緩衝液(KRBB)に加えます。
- 高グルコース濃度溶液:高グルコース濃度溶液を調製するには、0.5%ウシ血清アルブミン(BSA)と28 mM D-グルコースを1 mLのクレブスリンガー重炭酸塩緩衝液(KRBB)に加えます。
2.膵臓の回収
- 豚の麻酔と皮膚の準備
- 麻酔薬Lumianning(2.5-5 mg / kg)とプロポフォール(2-3 mg / kg)の筋肉内注射でドナー豚に麻酔をかけます(詳細については 、材料の表 を参照してください)。
- ガス麻酔マスクにより、1〜1.5 L / minの換気量で1%〜3%のイソフルランで麻酔を維持します。
- 心拍数を監視して、適切な麻酔を確認します。麻酔下での乾燥を防ぐために、目に獣医軟膏を使用してください。
- 腹部を剃り、ヨードフォアできれいにし、豚を滅菌外科用ドレープで適切に覆います。
- 腹部を開く
- 無菌状態を確保した後、剣状突起から尾の少し近くの臍まで正中線開腹切開を行います。
- 横隔膜を切開します。
- 血管鉗子を用いて肝上大動脈と下大静脈上(IVC)を単離し、その後、同じ方法で腎下大動脈と肝下IVCを単離します。
- ヘパリン(100 U / kg)をブタに静脈内投与して、血液凝固を防ぎます。.
- 小腸と大腸を外部に出し、肝臓と胃を頭に向かって押して膵臓を完全に露出させます。
- 膵臓灌流
- 血管鉗子で横隔膜の上の大動脈をクランプし、大動脈カニューレ(16G) を介して 腎大動脈の枝の上の大動脈を挿管し、2-0縫合糸で結びます。
- 大動脈カニューレ(16G)を通して2〜3リットルの冷たいHBSS溶液(以前に袋詰めされ、4°Cに維持されている)を動物に注入します。重力によって大動脈カニューレを通してHBSS溶液を注入し、肝上IVCとIVCを切除して灌流液を放出します。.
注:IVCの流出が明確になるまで注入を続けます。.
- 膵臓切除術
- 大網をはがし、脾臓と一緒に膵臓と脾臓の葉を見つけて分離します。
- 膵臓の接続された葉を隣接する組織と分離します。
- 十二指腸の下行部分にある主膵管を見つけます。胆管を縫合糸(2-0)で結紮し、膵管の近くでハサミで切除します。
- 膵臓の頭部の両側にあるVaterの膨大部を含む十二指腸の一部を血管鉗子で固定し、次にハサミで十二指腸を切除します。
- 膵臓全体を取り出し、冷たいHBSSに浸し、すぐに膵島隔離施設に運びます。
注:豚はペントバルビタールナトリウム(100-200 mg / kg)を使用して安楽死させました。HBSSまたは保存液の管内注入は、膵臓が地元の食肉処理場で調達される場合、臓器調達部位で膵臓を膨張させるために使用できます。
3. 以下の実験のためにバイオセーフティキャビネットを3つ用意します。
- 腎臓洗面器、手術器具、および膵臓を洗浄するためのビーカーを備えたバイオセーフティキャビネット#1を設置します(セクション4、 図1A)。
- ウォーターバス、蠕動ポンプ、再循環チューブを備えたチューブスタンド、および膵島消化用の消化チャンバーを備えたバイオセーフティキャビネット#2を設置します(セクション5、 図1B)。
- 酵素調製、膵島精製、および次の手順(セクション6-8、 図1C)用の使い捨てフィルターと遠心分離管を備えたバイオセーフティキャビネット#3をセットアップします。
4.膵臓のクリーニング
- 膵臓をきれいにして重さを量ります。
- バイオセーフティキャビネット#1で200mLのヨードフォアで膵臓を3分間すすぎます。200mLの冷たいHBSSで膵臓を2回、各2分間すすぎます。
- 洗浄した膵臓を、氷上に100mLの洗浄剤を入れた腎臓洗面器に入れます。
- 膨大部を固定したままにし、十二指腸を切除します。膵臓の外部脂肪と結合組織をきれいにします。
- 膵臓の重さを量ります。
5.膵臓の消化
- コラゲナーゼの注入
- 膵臓の環状枝の1つの断面を切り取り、18Gの血管カテーテル(管の直径が小さい場合は、20Gの血管カテーテルを検討してください)を主膵管に挿入し、2-0編組シルク縫合糸で所定の位置に縫合します。
- 膵臓の頭部付近の連結葉を通る組織架橋を切断し、膵臓頭部付近の切開部側にカテーテルを固定して酵素の漏出を減らします。
- より良い管内酵素注入のために複数の血管カスを配置します。このためには、膵臓を切片にして管を露出させた後、追加の血管腫(サイズ20-22 G)を挿入します。
- ルアーロックコネクタ付きの1 mシリコンチューブ(16#)を含む充填パイプラインを取り付けます。チューブの中央部分は、ペリスタルティックポンプヘッドに埋め込まれています。
- チューブシステム(チューブサイズ16#)に300 mLの1 mg / mL、コラゲナーゼV型(活性:918ユニット/ mg)を24°Cに予熱したチューブシステム(チューブサイズ16#)に充填し、配管内の気泡を取り除きます。
- 灌流チューブを血管動物に接続し、蠕動ポンプを20 mL/分の速度でオンにします。
- ほとんどの酵素が注入され、膵臓が十分に膨張したら、灌流を停止します(図2B)。
- 灌流中に膵臓の周りに形成される透明なゼラチン状組織を切断します。
注:ゲルがチャンバー内のフィルターを詰まらせ、消化された組織の収集を困難にする可能性があるため、このステップは非常に重要です(図2B)。 - 注入後に血管糖を取り除きます。.
- 組織消化
- HBSS溶液1Lを36°Cに予熱します。 分解チャンバーとクローズドシステムに接続されたチューブで構成される分解システムを事前に準備し、回路の加熱コイルを36°Cのウォーターバスに移します。
- 膵臓を3〜4個に切り、コラゲナーゼV型を500mLのビーカーに注ぎます。
- ビーカーを滅菌ペトリ皿の蓋で覆い、バイオセーフティキャビネット#2に移し、ビーカーの内容物を4つのシリコン処理ガラスビー玉と500μmメッシュを含む消化チャンバーに入れます。
- チャンバーを閉じ、ネジを締めます。残りの酵素を再循環ビーカーに入れ、蠕動ポンプを80 mL/minの速度でオンにします。
- ステップ5.2.1で予熱した温かいHBSS溶液(通常は約150mL)を加えて、回路を完成させます。チャンバーを静かに振って裏返し、シリコン処理されたガラスビー玉がティッシュに当たるようにします。
注:ブタの膵島は人間の組織よりもデリケートであるため、損傷を避けるために揺れは均一でゆっくりと行う必要があります。組織が消化されると、組織はバラバラになり始め、チャンバーから流れ出します。 - 2分ごとに回路からサンプル(約1mL)を採取し、1分間振とうした後、遊離島を確認します。
- サンプルを80 μLのジチゾン(DTZ)を入れた6ウェルプレートに入れます。2 mLのリン酸緩衝生理食塩水(PBS)を加え、顕微鏡で40倍の倍率でサンプルを検査します。DTZは小島を赤く染めます。
- ダイジェスト集
- 遊離島が観察されるまで消化を続けます(多くがまだ外分泌に部分的に閉じ込められている場合でも)。
注:膵島の放出には約10〜15分かかりますが、消化時間はドナーの年齢、酵素ロット、酵素の濃度などに影響されることがよくあります。 - 回路を開き、放出された組織を1Lボトルに集めます。コラゲナーゼV型を不活性化するために、ボトルを採取しながら氷の上に置いてください。
- 残りの温かいHBSS溶液(~850 mL、ステップ5.2.1)を再循環ビーカーに加え、残りの消化組織を消化チャンバーから回収します。
- 冷間収集媒体をチャンバーに加えます(再循環ビーカーを介して )。
注:ティッシュペレットが小さくなると収集を停止します。収集フェーズ(ステップ5.3.2-5.3.3)には、最大40〜75分、メディアの収集には5〜8Lかかる場合があります。 - 収集ボトルから組織を250 mLの円錐形遠心チューブに移し、200 x g で4°Cで3分間遠心分離します。
- 上清を捨て、組織を500 mLの新鮮な収集培地に再懸濁します。
- すべての消化物が収集されるまで、細胞ペレットを冷間収集培地(500 mL)に混ぜ続けます。
- 冷媒体に懸濁した細胞ペレットを遠心分離(200 x g、4°Cで3分間)で洗浄します。
- 上清を捨てます。セクション6〜8に記載されている手順に従って、細胞ペレットを評価および定量します。
注:最終的な容量は膵臓のサイズによって異なりますが、40〜80mL以内であると予想されます。
- 遊離島が観察されるまで消化を続けます(多くがまだ外分泌に部分的に閉じ込められている場合でも)。
6.膵島の浄化
- ブタの膵島を密度勾配分離法で精製します。
注:使用する密度勾配溶液の詳細については、 材料表 を参照してください。- 2 mLの膵臓組織を50 mLのコニカルチューブに加えます。.
- 12 mLの1119ポリスクロースグラジエント(1.119 g / cm3)を加えて、各2 mLの膵臓組織を再懸濁します。.
- 1083ポリショ糖溶液(1.083 g/cm3)10 mL、1077 ポリスクロース溶液(1.077 g/cm3)10 mL、1037 ポリスクロース溶液(1.037 g/cm3)10 mL、HBSS5 mLを順次加えます。
注:1037ポリスクロース溶液(1.037g / cm3)は、1077ポリスクロース溶液(1.077 g / cm3)と高張クエン酸プリン溶液(38.5 mL:11.5 mL)を混合して調製します。 - ブレーキなしで900 x g で4°Cで10分間遠心分離します。
- 1077ポリスクロース溶液と1037ポリスクロース溶液の層の間に膵島を吸引します。
- 膵島を50 mLの遠心分離チューブに移し、各チューブ内の液体を均等に分配し、遠心分離前にバランスを取ります。
- 豚の島を洗う
- 200 x g で4°Cで3分間遠心分離し、上清を捨てます。収集培地を追加して、容量を45 mLにします。
- 200 x g で 4 °C で 3 分間遠心分離し、約 2 mL の上清を残します。軽く振って混ぜます。
- すべてのペレットを同じ50 mL遠心分離チューブに結合します。収集培地を追加して、容量を45 mLにします。
7. 膵島等価物(IEQ)と膵島文化のカウント
- 膵島のDTZ染色
- 膵島を一緒にプールし、収集培地を追加して容量を最大250 mLにし、膵島を再懸濁します。
- 代表サンプル500μLを取り出し、80μLのDTZを入れた35mmディッシュに入れます。室温で1〜2分間インキュベートした後、PBSを2mL加えます。
- 倒立顕微鏡で40倍の倍率で観察します。膵島の骨材はDTZによって赤く染められます。
- 汚れた島を数える
- 汚れた島を 表1にリストされているサイズカテゴリに分割してカウントします。変換係数を使用して、サイズに応じて小島相当量 (IEQ) を決定します。
注:IEQ変換は、DTZ陽性凝集体の直径の大部分が50μmを超える場合に実行されます(成人(>2年)および一部の若年成人(6〜12か月)の準備はステップ7.2.4に進みます)。他のすべての場合(生後6か月未満の若いブタおよび残りの若い成体のブタ)では、膵島の数は粒子量またはDNA含有量に基づいて推定されました(ステップ7.2.2〜7.2.3に従って)。 - (オプション)200 x g 、4°Cで2分間遠心分離し、パレットを測定します。
- (オプション)細胞増殖アッセイキットにより、単一の膵島および膵島細胞ペレットのDNA含有量を評価します。DNA含量および免疫細胞化学分析からブタβ細胞数を推定します。
- すべてのカテゴリを追加し、サンプルの合計 IEQ を決定します。その数値に分数の体積を掛けます。(例:250 mL画分500 μL中に200 IEQ = 200 x 2 x 250 = 100,000 IEQ)。
- 汚れた島を 表1にリストされているサイズカテゴリに分割してカウントします。変換係数を使用して、サイズに応じて小島相当量 (IEQ) を決定します。
- 島の文化
- 膵島を200 x g 、4°Cで1分間遠心分離します。上清を捨てます。
- 予め温めた培地5mLを加えて膵島を再懸濁し、150mmのシャーレに移します。
注:10,000島/皿を再懸濁します。 - 培地をさらに追加して、150 mmのペトリ皿の容量を最大30 mLにします。
8. 膵島の品質評価
- 膵島のカルセインAM(CA)-ヨウ化プロピジウム(PI)染色
- 50個の小島を48ウェルプレートにハンドピックします。HBSS1mLで1回洗浄します。
- 細胞生存率染色キットの指示に従って、1x CAおよび1x PIを含む混合物200 μLを添加します。
- ペトリ皿に蓋をして、37°Cのインキュベーターに30分間置きます。
- 蛍光顕微鏡を使用して島を視覚化し、画像をキャプチャします。
- CA-PI染色後の生細胞(緑)と死細胞(赤)をカウントして生存率を定量します。
- グルコース刺激インスリン分泌(GSIS)
- 1 mLの低グルコース濃度溶液を24ウェル植物の3つのウェルに加えます。
- 少なくとも一晩培養した後、直径100〜200μmの範囲の同様のサイズの100個の小島を手摘みし、低グルコース濃度溶液を事前に充填した24ウェルプレートの3つのウェルに移します(ステップ8.2.1を参照)。
注:膵島をHBSSで中間ウェルで洗浄してから、ウェルに移して培地を洗い流します。 - 5% CO2 インキュベーターで膵島を37°Cで30分間インキュベートします。
- 上清は、膵島に触れないようにピペットで慎重に取り除きます。
- 新しい低グルコース濃度溶液1mLを加えます。
- 5% CO2 インキュベーターで膵島を37°Cで60分間インキュベートします。
- 上清(膵島なし)を採取し、少なくとも500 μLを1.5 mLの遠心チューブに移します。これには、低グルコース刺激下で分泌されるインスリンが含まれます。
- 1 mLの高グルコース濃度溶液を同じウェルに慎重に加えます。
- 5% CO2 インキュベーターで膵島を37°Cで60分間インキュベートします。
- さらに500 μLの培地を新しい1.5 mL遠心チューブに移します。これには、高グルコース刺激下で分泌されるインスリンが含まれます。
- ブタインスリン用の酵素結合免疫吸着アッセイ(ELISA)キットを使用して、低グルコースおよび高グルコース刺激後に放出されるインスリンの濃度を測定します(ステップ8.2.7および8.2.10)。
注:刺激指数(SI)は、高グルコース刺激後に測定されたインスリン濃度を低グルコース刺激後のインスリン濃度で割ったものとして計算されます。
結果
バイオセーフティキャビネットの準備を 図1に示します。3つの独立した操作スペースが設定されています。バイオセーフティキャビネット#1には、腎臓洗面器、手術器具、膵臓トリミング用のビーカーがセットされています(図1A)。バイオセーフティキャビネット#2には、ウォーターバス、ペリスタルティックポンプ、再循環チューブ付きチューブスタンド、および膵島消化用の消化チャンバーが設置されています(図1B)。バイオセーフティキャビネット#3には、酵素調製、膵島精製、および次の手順のための使い捨てフィルターと遠心分離チューブがセットされています(図1C)。
膵臓(酵素灌流前と酵素灌流後)を 図2に示します。コラゲナーゼV型溶液は、膵臓の頭部から膵管 を介して 膵臓全体に灌流されます。コネクティングローブが正常に灌流されない場合は、コネクティングローブを別々の部分に切断する必要があり、それぞれを灌流する必要があります。
膵臓の消化は、 図3に示すように、消化チャンバー内で行われます。機械的破壊後の膵臓組織と、消化後に残存する未消化の膵臓組織を図に示します。少量の未消化組織は、完全な消化を示します。ただし、消化が過剰であることを示している可能性もあります。したがって、膵臓臓器の15%〜25%がチャンバー内に残っている場合、それは許容されます。次に、消化された膵臓組織を洗浄し、不連続な密度勾配で遠心分離して、 図4に示すように、膵島を腺房細胞から分離します(精製)。膵島は中間層にあります。
小島のDTZ染色を 図5に示します。消化が停止して収集が開始されるポイント(すなわち、遊離島が出現するとき)を 図5Aに示します。密度勾配分離後の精製ブタ島を 図5Bに示します。明視野の島を 図 6A に示します。膵島の品質は、 図6Bに示すように、Calcein AM(CA)-Propidium Yoodide(PI)染色によって検査されます。生細胞は緑色で、死細胞は赤色です。このプロトコルの平均膵島分離収率は、114,279 IEQ/膵臓± 360,935 IEQ/g、膵臓の 2,439-3,252 IEQ/g であり、これは以前の研究 (333,000 ± 129,000 IEQ/膵臓) と同様です。このプロトコルによる膵島の平均生存率は81%を超えており、これは以前の研究(86.7%)よりもわずかに低くなっています。このプロトコルによってELISAによって測定されたグルコース刺激インスリン分泌試験(GSIS)によって得られた刺激指数(SI = 高グルコースと低グルコース条件の間に放出されるインスリン量(mU / L)の比率)の代表的な結果の1つは、1.4±0.3であり、これは以前の研究(1.75 ± 0.60)と同様です24。上記の結果を 表2にまとめました。

図1:バイオセーフティキャビネットの準備(A)バイオセーフティキャビネット#1は、無菌フィールドの腎臓洗面器、手術器具、ビーカーを示しています。(B)バイオセーフティキャビネット#2、(左から右)ウォーターバス、ペリスタルティックポンプ、再循環チューブとチューブを備えたチューブスタンド、および消化チャンバー。(C)使い捨てフィルターと遠心分離管を備えたバイオセーフティキャビネット#3。この図の拡大版を表示するには、ここをクリックしてください。
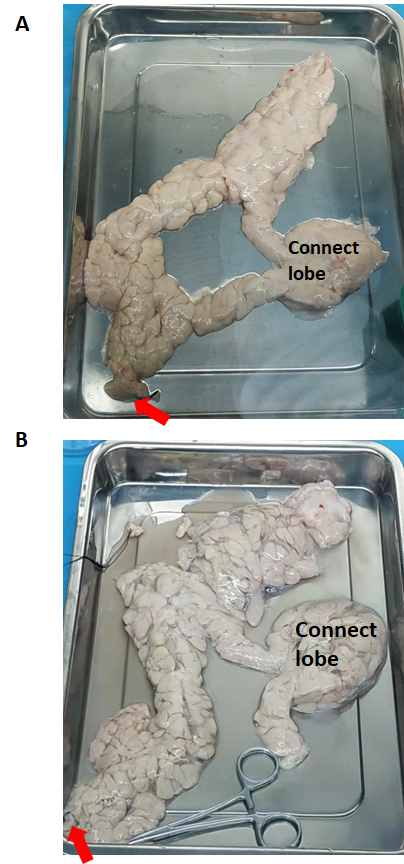
図2:酵素灌流前後の膵臓(A)酵素灌流前。(B)酵素灌流後の膵臓の膨張。赤い矢印は、コラゲナーゼV型の溶液の流れを示しています。この図の拡大版を表示するには、ここをクリックしてください。

図3:消化室内の膵臓 (A)消化後の膵臓組織とビー玉による破壊。(B)消化後に残存する膵臓組織。 この図の拡大版を表示するには、ここをクリックしてください。
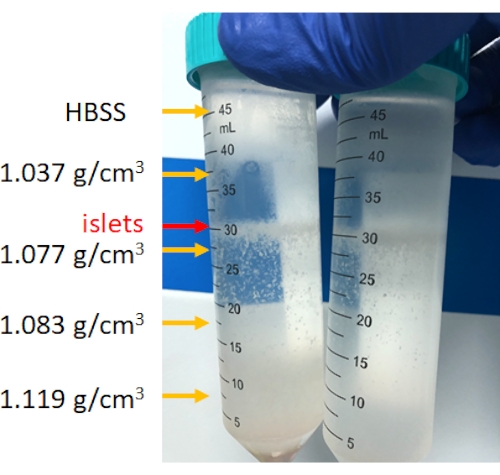
図4:不連続密度勾配遠心分離後の膵臓細胞の層別化。 遠心分離後、膵島は1.077g / cm3 とHBSS層の間に濃縮され、底質は非膵島組織です。 この図の拡大版を表示するには、ここをクリックしてください。
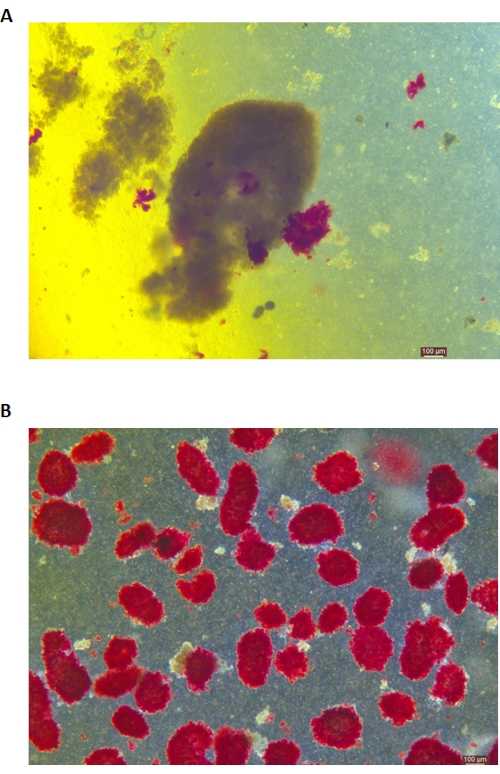
図5:消化中の膵島のジチゾン(DTZ)染色 (A)サンプルは消化室から採取されます。サンプルの膵島は赤く染められています。収集を開始する信号は、1〜2個の膵島が外分泌組織から完全に放出されたときです。(B)不連続な密度勾配によって分離された精製された膵島。スケールバーは100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
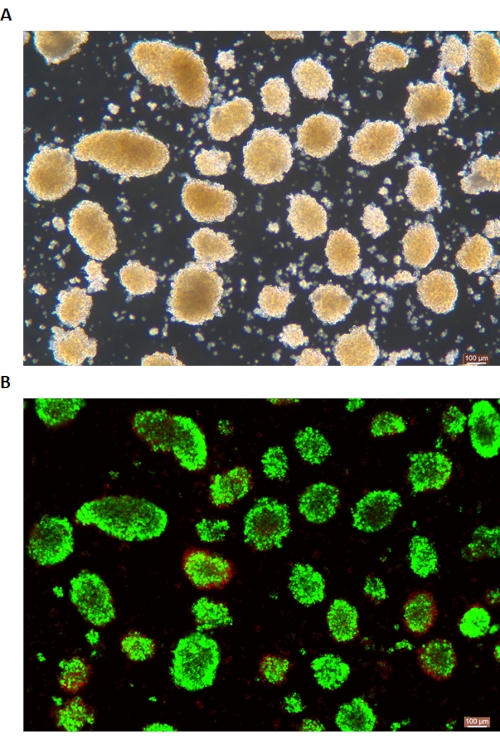
図6:生/死膵島細胞の生存率染色。 (A)明視野の膵島。(B)膵島のカルセインAM(CA)-ヨウ化プロピジウム(PI)染色。生細胞は緑色で、死細胞は赤色です。スケールバーは100μmです。 この図の拡大版を表示するには、ここをクリックしてください。
| カテゴリ | 膵島径範囲 (μm) | IEQ変換係数 |
| 1 | 50–100 | × 0.167 |
| 2 | 101–150 | × 0.648 |
| 3 | 151–200 | × 1.685 |
| 4 | 201–250 | ×3.500 |
| 5 | 251–300 | × 6.315 |
| 6 | 301–350 | × 10.352 |
| 7 | >350 | × 15.833 |
表1:島当量(IEQ)を計算するための変換係数。
| このプロトコル | 過去の研究24 | |
| 膵島収量(IEQ/膵臓) | 360,935±114,279 | 333,000±129,000 |
| 膵島生存率 | 81% | 86.70% |
| 膵島インスリン刺激指数 | 1.4 ± 0.3 | 1.75 ± 0.60 |
表2:このプロトコルによって得られた結果と以前の研究との比較。
ディスカッション
ブタを膵島の供給源とする膵島異種移植は、ヒトの膵島の不足を克服するための有望なアプローチです。成体ブタ島の分離は困難ですが、いくつかのグループは、一貫して膵島を成功裏に分離するためのプロトコルを確立しました10,11。いずれの方法であっても、膵島の生存率と機能特性を実証し、製品の高い品質を確認する必要があります。このプロトコルは、理解しやすく、再現しやすいように、ビデオ形式で公開された10,11に基づいています。
以前の報告と我々の経験によれば、成体ブタ島13,14の分離を成功させるためには、いくつかのパラメータが重要である。重要なパラメータには、(1)ドナー豚の年齢と性別:2つ以上の同腹児を持つ雌豚(いわゆる引退したブリーダー)は、高品質の島25,26,27,28,29,30を多数簡単に提供できるため、若い豚よりも好まれます25,26,27,28,29,30、(2)温かい虚血時間:自己消化を減らすために10分に制限します14、(3)消化酵素:コラゲナーゼV型が有効な選択肢です、(4)消化時間:過剰消化を避けるために、消化を早めに止めることが不可欠です。遊離島が観察されるとすぐに、部分的に閉じ込められていても収集プロセスが開始されます。これは、プロセスの非常に初期の段階です。
このプロトコルにはいくつかの利点があります。膵島の精製にCOBE 2991セルプロセッサーを使用した連続または不連続の密度勾配と比較して、このプロトコルは、コニカルチューブと標準的な遠心分離機を使用して、密度勾配溶液の上に膵島を層化します。費用対効果が高く、初心者でも簡単にマスターできます。この精製方法ではより多くの手作業が必要なため、大量生産や大型ペレットでは、効率を高めるためにCOBE細胞プロセッサーが必要になる場合があります。
ここでは、いくつかのトラブルシューティング手順についても説明します。(1)膵臓組織の25%以上が消化されていない、またはほとんどの膵島が腺房組織で覆われていると仮定します。その場合、考えられる理由には、灌流不良、酵素活性に影響を与える残留血液、酵素濃度または活性の低下、消化中の低温などがあります。(2)膵臓組織の過剰な消化は、膵島の断片化につながる可能性があります。考えられる理由は、温かい虚血時間が十分に制御されていないこと、消化酵素濃度が高いこと、消化された膵島が消化酵素溶液にさらされる時間が長いこと、または消化温度が高いことです。これは、酵素/消化パラメータの標準化とプロセスの最適化によってのみ防ぐことができます。(3)膵島の完全性の喪失は、培養プロセス中にも発生する可能性があります。これには、膵島の純度の低下、膵島の培養密度が高すぎる、栄養不足、または機械的損傷につながる腺房汚染が含まれます。膵島の完全性の損失を克服するには、膵島の培地の体積を増やし、培地の密度を上げ、膵島をよりゆっくりと、より短時間遠心分離します。
要約すると、このプロトコルは、非ヒト霊長類レシピエントに移植される成体ブタ膵島を準備するために成功裏に採用されています。さらに、将来の調査のために膵島を取得するために使用されます。
開示事項
著者らは、利益相反を報告していません。
謝辞
私たちは、異種移植システム全体の設定を支援してくれたDavid K. C. Cooper教授(Center for Transplantation Sciences, Massachusetts General Hospital)に感謝します。Xingling Hu氏(Shenzhen Second People's Hospital)、Xiaohe Tian氏(カリフォルニア大学バークレー校)、Bo Zhou氏(ボストン大学)の有益な議論と提案に感謝します。この研究は、中国の国家重点研究開発プログラム(2017YFC1103701、2017YFC1103704)、広東省の高レベル病院建設のための特別基金(2019)、および深センの三明医学プロジェクト(SZSM201812079)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
参考文献
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved