Method Article
Isolement des îlots de Porcs adultes
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole détaillé couvre les étapes méthodologiques de l’isolement des îlots de porcs adultes, de la phase de digestion à l’évaluation fonctionnelle finale des îlots, en passant par la purification. Ce schéma peut servir de ligne directrice pour l’isolement des îlots de Langerhans de porcs adultes dans les établissements de recherche.
Résumé
Le diabète sucré de type 1 (DT1) est causé par la destruction auto-immune des cellules β pancréatiques, ce qui entraîne une production d’insuline faible ou nulle. La transplantation d’îlots joue un rôle important dans le traitement du DT1, avec l’amélioration du contrôle glycométabolique, la réduction de la progression des complications, la réduction des épisodes d’hypoglycémie par rapport à l’insulinothérapie traditionnelle. Les résultats de l’essai clinique de phase III ont également démontré l’innocuité et l’efficacité de l’allotransplantation d’îlots dans le DT1. Cependant, la pénurie de donneurs de pancréas limite son utilisation généralisée. Les animaux, en tant que source d’îlots, comme le cochon, offrent un choix alternatif. Parce que l’architecture du pancréas du porc est différente de celle des îlots de souris ou des humains, la procédure d’isolement des îlots de porc reste difficile. Étant donné que l’application de sources alternatives d’îlots porcins (xénogéniques) dans le cadre clinique pour le traitement du DT1 par transplantation cellulaire est d’une grande importance, il est urgent de mettre en place un protocole rentable, standardisé et reproductible pour isoler les îlots porcins. Ce manuscrit décrit une méthode simplifiée et rentable pour isoler et purifier les îlots porcins adultes sur la base des protocoles précédents qui ont réussi à transplanter des îlots porcins chez des primates non humains. Il s’agira d’un guide pour les débutants sans l’utilisation d’un équipement spécialisé tel qu’un processeur de cellules COBE 2991.
Introduction
Le diabète sucré de type 1 (DT1) est une maladie grave dans laquelle la destruction auto-immune des cellules bêta entraîneune production d’insuline faible ou nulle 1,2,3. Un groupe important de patients atteints de DT1 ne peut pas stabiliser la labilité glycémique avec l’insulinothérapie et présente des épisodes d’hypoglycémie potentiellement mortels. La transplantation d’îlots, lorsqu’elle réussit, peut y parvenir. Plus de 1 500 patients diabétiques ont subi avec succès une transplantation d’îlots pancréatiques dans le monde entier, ce qui présente un risque plus faible mais un succès à long terme que la transplantation de pancréas4.
Par rapport à l’insulinothérapie, la transplantation d’îlots a de meilleurs résultats dans la réduction de la progression des complications5. Les résultats de l’essai clinique de phase III ont également démontré l’innocuité et l’efficacité de l’allotransplantation d’îlots de Langerhans dans le DT1 6,7. La transplantation d’îlots pancréatiques pourrait être la meilleure option thérapeutique actuellement disponible pour les patients atteints de DT1 qui présentent des épisodes d’hypoglycémie potentiellement mortels.
Cependant, la pénurie d’îlots de Langerhans allogéniques humains limite l’utilisation généralisée de la transplantation d’îlotspancréatiques 8,9. Par conséquent, l’utilisation d’îlots animaux en remplacement est souhaitable10. Le porc a été choisi comme donneur pour les cellules d’îlots pancréatiques dans la xénotransplantation préclinique, et il est potentiellement transposable à la clinique en raison de 1) la disponibilité, 2) les similitudes métaboliques avec les humains, 3) la masse de cellules bêta assez importante, et 4) la possibilité de modifier génétiquement pour améliorer la compatibilité immunologique avec les humains11.
La grande pureté et la viabilité des îlots sont des étapes clés pour le succès de la xénotransplantation. Cependant, la procédure d’isolement des îlots de donneurs de porcs adultes est difficile en raison de l’architecture du pancréas lui-même, qui diffère de celle des îlots de souris ou d’humains12. D’une manière générale, la forme des îlots pancréatiques porcins n’est pas compacte12. Par rapport aux îlots pancréatiques humains et rongeurs, les îlots de porcs se dissocient plus facilement12. Cependant, la dissociation spontanée de la couche externe des cellules des îlots pancréatiques, accompagnée d’un long temps de culture, entraîne une réduction substantielle de la taille10 des îlots pancréatiques.
Au cours du processus d’isolement des îlots, de nombreux facteurs influencent la qualité des îlots, tels que l’âge du donneur, le temps d’ischémie chaude, l’activité enzymatique, la distension par injection enzymatique13,14. Bien que de nombreuses études antérieures aient fourni des méthodes pour l’isolement des îlots de Langerhans, il n’existe pas de protocole vidéo détaillé étape par étape pour les chercheurs en tant qu’instruction efficace 10,15,16,17,18,19,20,21,22,23.
À cette fin, ce protocole détaillé couvre toutes les étapes de l’isolement, du prélèvement d’organes à l’évaluation fonctionnelle post-isolement des îlots, dans l’espoir d’offrir une vue d’ensemble simple et compréhensible du processus pour une applicabilité facile. Ce protocole est basé sur les méthodes précédemment publiées avec les modifications10,11.
Protocole
Toutes les procédures impliquant des animaux sont approuvées par le comité institutionnel de soin et d’utilisation des animaux du Second Hôpital populaire de Shenzhen et conformément à toutes les réglementations nationales. Dans ce protocole, des porcs Duroc-Landrace-Yorkshire (âgés de ~6 mois) achetés sur le marché ont été utilisés comme donneurs de pancréas. Le poids du pancréas prélevé était de 123,63 g ± 22,50 g. Des équipements de protection individuelle, y compris des vêtements de protection, des masques, des gants et des casquettes, sont portés pendant les expériences.
1. Préparation des supports
- Agent de nettoyage : Pour préparer 100 ml de produit de nettoyage, mélangez la solution saline équilibrée de Hank’s (HBSS), du sérum porcin à 2 %, de l’acide 4-(2-hydroxyéthyl)-1-pipérazinesulfonique (HEPES) et de la pénicilline-streptomycine à 1 % (P/S).
- Milieu collecteur : Mélanger RPMI 1640 avec 5 % de sérum porcin et 1 % de pénicilline-streptomycine (P/S).
- Milieu de culture : Mélanger CMRL 1066 avec 10 % de sérum porcin, 10 mmol/L de nicotinamide, 1 % de P/S et 2 mmol/L de L-glutamine.
- Solution enzymatique : Préparer une solution de collagénase de type V (activité : 918 unités/mg solide) dans une solution HBSS.
- Solution à faible concentration de glucose : Pour préparer une solution à faible concentration de glucose, ajoutez 0,5 % d’albumine sérique bovine (BSA) et 2,8 mM de D-glucose à 1 mL de tampon de bicarbonate Ringer de Kreb (KRBB).
- Solution à haute concentration de glucose : Pour préparer une solution à haute concentration de glucose, ajoutez 0,5 % d’albumine sérique bovine (BSA) et 28 mM de D-glucose à 1 mL de tampon de bicarbonate Ringer de Kreb (KRBB).
2. Prélèvement du pancréas
- Anesthésie porcine et préparation de la peau
- Anesthésier le porc donneur par injection intramusculaire d’anesthésiques Lumianning (2,5-5 mg/kg) et Propofol (2-3 mg/kg) (voir le tableau des matériaux pour plus de détails).
- Maintenir l’anesthésie avec 1 à 3 % d’isoflurane dans un volume de ventilation de 1 à 1,5 L/min à l’aide de masques d’anesthésie gazeuse.
- Surveillez la fréquence cardiaque pour confirmer la bonne anesthésie. Utilisez une pommade vétérinaire sur les yeux pour prévenir la sécheresse sous anesthésie.
- Rasez l’abdomen, nettoyez-le avec de l’iodophore et couvrez le porc avec un champ chirurgical stérile de manière appropriée.
- Ouverture de l’abdomen
- Après s’être assuré que les conditions étaient stériles, faites une incision de laparotomie médiane du xiphoïde à l’ombilic légèrement près de la queue.
- Incisez le diaphragme.
- Isolez l’aorte suprahépatique et la veine cave inférieure (CVI) suprahépatique à l’aide d’une pince vasculaire, puis isolez l’aorte infrarénale et la VCI infrahépatique avec la même méthode.
- Administrer de l’héparine par voie intraveineuse (100 U/kg) au porc pour prévenir la coagulation du sang.
- Extériorisez l’intestin grêle et le gros intestin, et poussez le foie et l’estomac vers la tête pour exposer complètement le pancréas.
- Perfusion pancréatique
- Clampez l’aorte au-dessus du diaphragme à l’aide d’une pince vasculaire, intubez l’aorte au-dessus de la branche de l’aorte rénale via la canule aortique (16 G) et attachez avec un fil de suture 2-0.
- Perfuser l’animal avec 2-3 litres de solution HBSS froide (préalablement emballée et maintenue à 4 °C) à travers la canule aortique (16 G). Perfuser la solution HBSS à travers la canule aortique par gravité, tandis que la VCI suprahépatique et la VCI sont traversées pour libérer le liquide de perfusion.
REMARQUE : Continuez la perfusion jusqu’à ce que l’écoulement IVC soit clair.
- Excision du pancréas
- Retirez l’épiploon, trouvez les lobes du pancréas et de la rate avec la rate et séparez-les.
- Séparez le lobe connecté du pancréas avec les tissus adjacents.
- Trouvez le canal pancréatique principal dans la partie descendante du duodénum. Lister le canal biliaire avec une suture (2-0) et le transecter avec des ciseaux près du canal pancréatique.
- Clampez une section du duodénum contenant l’ampoule de Vater de chaque côté de la tête du pancréas avec une pince vasculaire, puis réséquez le duodénum avec des ciseaux.
- Retirez tout le pancréas, plongez-le dans du HBSS froid et transportez-le immédiatement vers l’installation d’isolement des îlots.
REMARQUE : Les porcs ont été euthanasiés à l’aide de pentobarbital sodique (100-200 mg/kg). La perfusion intracanalaire de HBSS ou d’une solution de préservation peut être utilisée pour distendre le pancréas au site d’approvisionnement de l’organe si les pancréas sont obtenus à l’abattoir local.
3. Préparez trois enceintes de biosécurité pour les expériences suivantes
- Installez l’enceinte de biosécurité #1 avec un bassin rénal, des instruments chirurgicaux et des béchers pour nettoyer le pancréas (section 4, figure 1A).
- Installez l’enceinte de sécurité biologique #2 avec un bain-marie, une pompe péristaltique, un support de tube avec le tube de recirculation et une chambre de digestion pour la digestion des îlots de Langerhans (section 5, figure 1B).
- Installez l’enceinte de sécurité biologique #3 avec des filtres jetables et des tubes à centrifuger pour la préparation des enzymes, la purification des îlots de Langerhans et les étapes suivantes (sections 6 à 8, figure 1C).
4. Nettoyage du pancréas
- Nettoyez et pesez le pancréas.
- Rincer le pancréas dans 200 mL d’iodophore pendant 3 min dans l’enceinte de biosécurité #1. Rincer le pancréas dans 200 mL de HBSS froid deux fois, 2 min chacune.
- Mettez le pancréas nettoyé dans un bassin rénal contenant 100 ml de produit de nettoyage sur de la glace.
- Gardez l’ampoule serrée, réséquez le duodénum. Nettoyez le pancréas de la graisse externe et du tissu conjonctif.
- Pesez le pancréas.
5. Digestion du pancréas
- Infusion de collagénase
- Coupez une coupe transversale de l’une des branches annulaires du pancréas et insérez un angiocath de 18 G (si le diamètre du canal est plus petit, envisagez un angiocath de 20 G) dans le canal pancréatique principal et suturez-le en place avec une suture en soie tressée 2-0.
- Coupez le pont tissulaire qui passe à travers le lobe de connexion près de la tête du pancréas et clampez le cathéter sur le côté de l’incision près de la tête du pancréas pour réduire les fuites d’enzymes.
- Placez plusieurs angiocathes pour une meilleure perfusion enzymatique intracanalaire. Pour cela, insérez des angiocathes supplémentaires (taille 20-22 G) après avoir sectionné l’organe pancréatique pour exposer le canal.
- Installez la canalisation de remplissage, y compris un tube en silicone de 1 m (16#) avec un connecteur Luer-lock. La section centrale du tube est encastrée dans la tête de pompe péristaltique.
- Allumez la pompe péristaltique pour remplir le système de tuyauterie (tube 16#) 300 mL de 1 mg/mL, collagénase de type V (activité : 918 unités/mg) préchauffée à 24 °C et éliminez les bulles d’air dans la tuyauterie.
- Raccorder la tubulure de perfusion à l’angiocath et mettre en marche la pompe péristaltique à raison de 20 mL/min.
- Arrêtez la perfusion lorsque la majeure partie de l’enzyme a été perfusée et que le pancréas est bien distendu (Figure 2B).
- Coupez le tissu gélatineux clair qui se forme autour du pancréas pendant la perfusion.
REMARQUE : Cette étape est très importante car le gel peut obstruer le filtre dans la chambre et rendre difficile la collecte des tissus digérés (Figure 2B). - Retirez les angiocathes après la perfusion.
- Digestion tissulaire
- Préchauffer 1 L de solution HBSS à 36 °C. Préparez à l’avance le système de digestion composé de la chambre de digestion et de la tubulure reliée à un système fermé, et transférez le serpentin chauffant du circuit dans un bain-marie à 36 °C.
- Coupez le pancréas en 3-4 morceaux et versez-les avec la collagénase de type V dans un bécher de 500 ml.
- Couvrez le bécher avec un couvercle de boîte de Pétri stérile, transférez-le dans l’armoire de biosécurité #2 et mettez le contenu du bécher dans la chambre de digestion contenant quatre billes de verre siliconé et un maillage de 500 μm.
- Fermez la chambre et serrez les vis. Mettez l’enzyme restante dans le bécher à recirculation et allumez la pompe péristaltique à une vitesse de 80 mL/min.
- Ajouter une solution HBSS chaude (généralement d’environ 150 ml) préchauffée à l’étape 5.2.1 pour remplir le circuit jusqu’à la fin. Secouez doucement la chambre et retournez-la de manière à ce que les billes de verre siliconées frappent le tissu.
REMARQUE : Étant donné que les îlots de porcs sont plus délicats que les tissus humains, les secousses doivent être régulières et lentes pour éviter tout dommage. Au fur et à mesure que le tissu digère le tissu, il commence à se désagréger et à s’écouler hors de la chambre. - Prélever un échantillon (environ 1 ml) du circuit toutes les 2 minutes pour vérifier s’il n’y a pas d’îlots libres après avoir secoué pendant 1 min.
- Placez l’échantillon dans une plaque à 6 puits avec 80 μL de dithizone (DTZ). Ajoutez 2 ml de solution saline tamponnée au phosphate (PBS) et examinez l’échantillon au microscope avec un grossissement de 40x. DTZ tachera les îlots en rouge.
- Collecte du digest
- Continuez la digestion jusqu’à ce que des îlots libres soient observés (même si beaucoup sont encore partiellement piégés dans l’exocrine).
REMARQUE : La libération des îlots prend environ 10 à 15 minutes, mais le temps de digestion est souvent influencé par l’âge du donneur, les lots d’enzymes, la concentration d’enzymes, etc. - Ouvrez le circuit et récupérez le tissu libéré dans des bouteilles de 1 L. Gardez les bouteilles sur de la glace pendant la collecte pour aider à inactiver la collagénase de type V.
- Ajouter la solution chaude HBSS restante (~850 mL, étape 5.2.1) dans le bécher de recirculation et recueillir le reste des tissus digérés de la chambre de digestion.
- Ajouter le fluide collecteur de froid dans la chambre (via le bécher à recirculation).
REMARQUE : Arrêtez la collecte lorsque les granules de tissu deviennent plus petites. La phase de collecte (étapes 5.3.2 à 5.3.3) peut prendre jusqu’à 40 à 75 minutes et 5 à 8 L de milieu de collecte. - Transférez le tissu du flacon de prélèvement dans des tubes à centrifuger coniques de 250 mL et centrifugez à 200 x g pendant 3 min à 4 °C.
- Jeter le surnageant et remettre le tissu en suspension dans 500 mL de milieu de collecte frais.
- Continuez à combiner les pastilles de cellules dans un milieu de collecte froid (500 ml) jusqu’à ce que toute la digestion soit recueillie.
- Laver la pastille cellulaire en suspension dans le milieu froid par centrifugation (3 min à 200 x g, 4 °C).
- Jetez le surnageant. Évaluez et quantifiez la pastille cellulaire en suivant les étapes mentionnées aux sections 6 et 8.
REMARQUE : Le volume final dépend de la taille du pancréas, mais on s’attend à ce qu’il se situe entre 40 et 80 ml.
- Continuez la digestion jusqu’à ce que des îlots libres soient observés (même si beaucoup sont encore partiellement piégés dans l’exocrine).
6. Purification des îlots
- Purifier les îlots de porcs par séparation par gradient de densité.
REMARQUE : Reportez-vous au tableau des matériaux pour les détails des solutions de gradient de densité utilisées.- Ajouter 2 ml de tissu pancréatique dans des tubes coniques de 50 ml.
- Ajouter 12 mL de gradient de polysaccharose 1119 (1,119 g/cm3) pour remettre en suspension chaque 2 mL de tissu pancréatique.
- Ajouter successivement 10 mL de solution de polysaccharose 1083 (1,083 g/cm3), 10 mL de solution de polysaccharose 1077 (1,077 g/cm3), 10 mL de solution de polysaccharose 1037 (1,037 g/cm3) et 5 mL de HBSS.
REMARQUE : La solution de polysaccharose 1037 (1,037 g/cm3) est préparée en mélangeant la solution de polysaccharose 1077 (1,077 g/cm3) et la solution de citrate de purine hypertonique (38,5 mL : 11,5 mL). - Centrifugeuse à 900 x g sans frein pendant 10 min à 4 °C.
- Aspirez les îlots entre les couches de solution de polysaccharose 1077 et de solution de polysaccharose 1037.
- Transférez les îlots dans un tube à centrifuger de 50 ml, répartissez uniformément le liquide dans chaque tube et équilibrez-le avant la centrifugation.
- Laver les îlots de cochons
- Centrifuger à 200 x g pendant 3 min à 4 °C, jeter le surnageant. Ajouter le milieu collecteur pour porter le volume à 45 mL.
- Centrifuger à 200 x g pendant 3 min à 4 °C, en laissant environ 2 mL de surnageant ; Agiter doucement pour mélanger.
- Combinez toutes les pastilles dans le même tube à centrifuger de 50 ml. Ajouter le milieu collecteur pour porter le volume à 45 mL.
7. Comptage des équivalents d’îlots (IEQ) et culture des îlots
- Coloration DTZ des îlots
- Regroupez les îlots, ajoutez plus de milieu de collecte pour porter le volume à 250 ml, et remettez les îlots en suspension.
- Prélever 500 μL de l’échantillon représentatif et le placer dans une boîte de 35 mm avec 80 μL de DTZ. Laisser incuber à température ambiante pendant 1 à 2 minutes, puis ajouter 2 ml de PBS.
- Examinez à un grossissement de 40x sous un microscope inversé. Les agrégats d’îlots sont colorés en rouge par la DTZ.
- Comptage des îlots tachés
- Comptez les îlots tachés en les divisant dans les catégories de taille énumérées dans le tableau 1. Utilisez le facteur de conversion pour déterminer l’équivalent des îlots (IEQ) en fonction de la taille.
REMARQUE : La conversion de la QEI est effectuée lorsque le diamètre de la majorité des agrégats DTZ positifs est supérieur à 50 μm (chez l’adulte (>2 ans) et que certaines préparations de jeunes adultes (6-12 mois) passent à l’étape 7.2.4). Dans tous les autres cas (chez les jeunes porcs de moins de 6 mois et chez les autres jeunes porcs adultes), le nombre d’îlots a été estimé en fonction du volume de particules ou de la teneur en ADN (conformément aux étapes 7.2.2 et 7.2.3). - (FACULTATIF) Centrifugeuse à 200 x g à 4 °C pendant 2 min pour mesurer les palettes.
- (FACULTATIF) Évaluer la teneur en ADN des îlots uniques, ainsi que des culots de cellules d’îlots à l’aide du kit de test de prolifération cellulaire. Extrapolez le nombre de cellules bêta de porc à partir du contenu de l’ADN et de l’analyse immunocytochimique.
- Additionnez toutes les catégories et déterminez la QEI totale de l’échantillon. Multipliez ce nombre par le volume de la fraction. (p. ex., 200 QEI dans 500 μL d’une fraction de 250 ml = 200 x 2 x 250 = 100 000 QEI).
- Comptez les îlots tachés en les divisant dans les catégories de taille énumérées dans le tableau 1. Utilisez le facteur de conversion pour déterminer l’équivalent des îlots (IEQ) en fonction de la taille.
- Culture des îlots
- Centrifuger les îlots à 200 x g à 4 °C pendant 1 min ; Jetez le surnageant.
- Ajouter 5 ml de milieu de culture préchauffé pour remettre les îlots en suspension et transférer dans une boîte de Pétri de 150 mm.
REMARQUE : Remettre en suspension 10 000 îlots/plat. - Ajoutez plus de milieu de culture pour porter le volume à 30 ml dans la boîte de Pétri de 150 mm.
8. Évaluation de la qualité des îlots de Langerhans
- Calcein AM (CA) - Coloration à l’iodure de propidium (PI) des îlots de Langerhans
- Cueillir à la main 50 îlots dans une plaque de 48 puits. Laver une fois avec 1 mL de HBSS.
- Ajouter 200 μL du mélange contenant 1x CA et 1x PI selon les instructions du kit de coloration de viabilité cellulaire.
- Couvrez la boîte de Pétri et placez-la dans un incubateur à 37 °C pendant 30 min.
- Visualisez les îlots à l’aide d’un microscope à fluorescence et capturez les images.
- Quantifiez la viabilité en comptant les cellules vivantes (vertes) et les cellules mortes (rouges) après coloration CA-PI.
- Sécrétion d’insuline stimulée par le glucose (GSIS)
- Ajouter 1 mL de solution à faible concentration de glucose dans trois puits d’une plante de 24 puits.
- Après une culture d’au moins une nuit, prélever à la main 100 îlots de taille similaire dans la gamme de 100 à 200 μm de diamètre et les transférer dans les trois puits de la plaque de 24 puits pré-remplie d’une solution à faible concentration de glucose (comme à l’étape 8.2.1).
REMARQUE : Lavez les îlots dans un puits intermédiaire avec HBSS avant de les transférer dans le puits pour laver le milieu de culture. - Incuber les îlots dans un incubateur à 5 % de CO2 à 37 °C pendant 30 min.
- Retirez soigneusement le surnageant à l’aide d’une pipette sans toucher les îlots.
- Ajouter 1 mL de nouvelle solution à faible concentration de glucose.
- Incuber les îlots dans un incubateur à 5 % de CO2 à 37 °C pendant 60 min.
- Prélever le surnageant (pas d’îlots) et en transférer au moins 500 μL dans un tube à centrifuger de 1,5 mL. Celui-ci contiendra de l’insuline sécrétée lors d’une stimulation à faible taux de glucose.
- Ajoutez soigneusement 1 ml de solution à haute concentration de glucose dans les mêmes puits.
- Incuber les îlots dans un incubateur à 5 % de CO2 à 37 °C pendant 60 min.
- Transférez 500 μL supplémentaires du milieu de culture dans un nouveau tube à centrifuger de 1,5 mL. Celui-ci contiendra de l’insuline sécrétée lors d’une stimulation élevée du glucose.
- Utiliser des trousses d’immuno-absorption enzymatique (ELISA) pour l’insuline porcine afin de mesurer la concentration d’insuline libérée à la suite d’une stimulation à faible et à forte teneur en glucose (étapes 8.2.7 et 8.2.10).
REMARQUE : L’indice de stimulation (IS) est calculé comme le rapport entre la concentration d’insuline mesurée après une stimulation à forte teneur en glucose divisée par la concentration d’insuline après une stimulation à faible teneur en glucose.
Résultats
La préparation de l’enceinte de biosécurité est illustrée à la figure 1. Trois espaces de travail indépendants sont mis en place. L’enceinte de biosécurité #1 est équipée de bassins rénaux, d’instruments chirurgicaux et de béchers pour la coupe du pancréas (figure 1A). L’enceinte de sécurité biologique #2 est équipée d’un bain-marie, d’une pompe péristaltique, d’un support tubulaire avec le tube de recirculation et d’une chambre de digestion pour la digestion des îlots de Langerhans (figure 1B). L’enceinte de sécurité biologique #3 est équipée de filtres jetables et de tubes à centrifuger pour la préparation des enzymes, la purification des îlots de Langerhans et les étapes suivantes (figure 1C).
Le pancréas (avant et après la perfusion enzymatique) est illustré à la figure 2. La solution de collagénase de type V est perfusée dans l’ensemble du pancréas via le canal pancréatique à partir de la tête du pancréas. Si le lobe de connexion n’est pas perfusé avec succès, il doit être coupé en morceaux séparés, et chacun doit être perfusé.
La digestion du pancréas est effectuée dans la chambre de digestion, comme le montre la figure 3. Le tissu pancréatique après la rupture mécanique et le tissu pancréatique non digéré restant après la digestion sont représentés sur la figure. Une petite quantité de tissu non digéré indique une digestion complète ; Cependant, cela peut également indiquer une digestion excessive ; Par conséquent, si 15 à 25 % de l’organe pancréatique reste dans la chambre, c’est acceptable. Le tissu pancréatique digéré est ensuite lavé et centrifugé sur des gradients de densité discontinus pour séparer les îlots des cellules acineuses (purification), comme le montre la figure 4. Les îlots pancréatiques se trouvent dans la couche intermédiaire.
La coloration DTZ des îlots est illustrée à la figure 5. La figure 5A montre le moment où la digestion est interrompue et où la collecte commence (c.-à-d. lorsque les îlots libres apparaissent). Les îlots de porcs purifiés après séparation par gradient de densité sont illustrés à la figure 5B. Les îlots en fond clair sont illustrés à la figure 6A. La qualité des îlots est examinée par coloration Calcein AM (CA) -Iodure de propidium (PI), comme le montre la figure 6B. Les cellules vivantes sont vertes et les cellules mortes sont rouges. Le rendement moyen d’isolement des îlots de Langerhans de ce protocole est de 360 935 ± 114 279 IEQ/pancréas et de 2 439 à 3 252 IEQ/g du pancréas, ce qui est similaire à l’étude précédente (333 000 ± 129 000 IEQ/pancréas). La viabilité moyenne des îlots selon ce protocole est supérieure à 81 %, ce qui est légèrement inférieur à l’étude précédente (86,7 %). L’un des résultats représentatifs de l’indice de stimulation (SI = le rapport entre les quantités d’insuline libérées (mU/L) dans des conditions d’hyperglycémie et de faible glucose) obtenu par le test de sécrétion d’insuline stimulée par le glucose (GSIS) mesuré par ELISA selon ce protocole est de 1,4 ± 0,3, ce qui est similaire à l’étude précédente (1,75 ± 0,60)24. Les résultats ci-dessus sont résumés dans le tableau 2.

Figure 1 : La préparation de l’enceinte de biosécurité. (A) L’enceinte de biosécurité #1 montre le bassin rénal, les instruments chirurgicaux et les béchers dans le champ stérile. (B) Enceinte de biosécurité #2 avec bain-marie (de gauche à droite), pompe péristaltique, support de tube avec tube de recirculation et tubulure et chambre de digestion. (C) Enceinte de biosécurité #3 avec filtres jetables et tubes à centrifuger. Veuillez cliquer ici pour voir une version agrandie de cette figure.
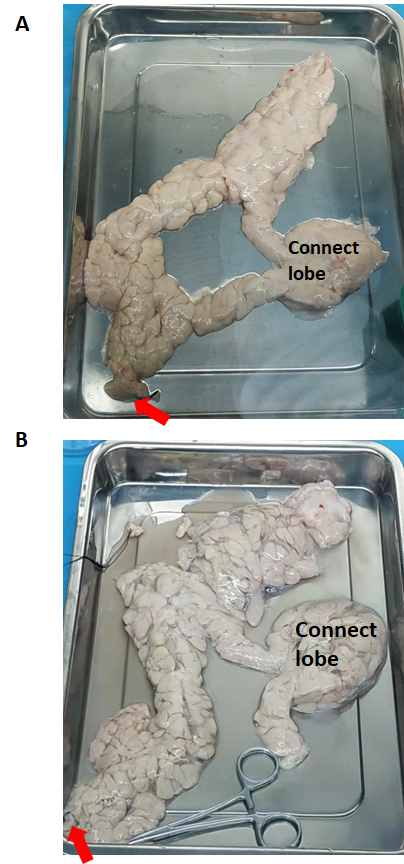
Figure 2 : Le pancréas avant et après la perfusion enzymatique. (A) Avant la perfusion enzymatique. (B) Pancréas distendu après perfusion enzymatique. La flèche rouge indique l’écoulement de la solution de collagénase de type V. Veuillez cliquer ici pour voir une version plus grande de cette figure.

Figure 3 : Le pancréas dans la chambre de digestion. (A) Tissu pancréatique après digestion et perturbation avec des billes. (B) Tissu pancréatique restant après la digestion. Veuillez cliquer ici pour voir une version agrandie de cette figure.
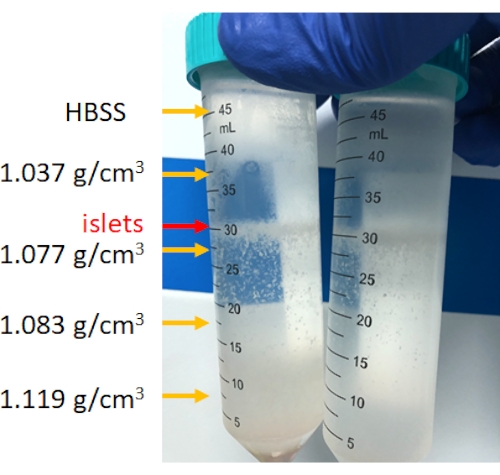
Figure 4 : Stratification des cellules pancréatiques après centrifugation à gradient de densité discontinu. Après centrifugation, les îlots seront concentrés entre 1,077 g/cm3 et la couche HBSS, et les sédiments de fond sont des tissus non îlots. Veuillez cliquer ici pour voir une version agrandie de cette figure.
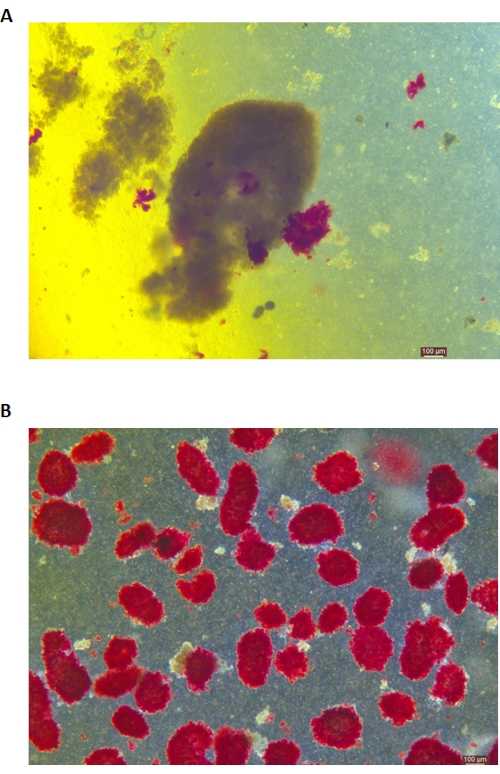
Figure 5 : Coloration à la dithizone (DTZ) des îlots pendant la digestion. (A) Les échantillons sont prélevés dans la salle de digestion. Les îlots de l’échantillon sont teints en rouge. Le signal pour commencer la collecte se produit lorsque 1 à 2 îlots sont complètement libérés du tissu exocrine. (B) Îlots purifiés séparés par un gradient de densité discontinu. La barre d’échelle est de 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
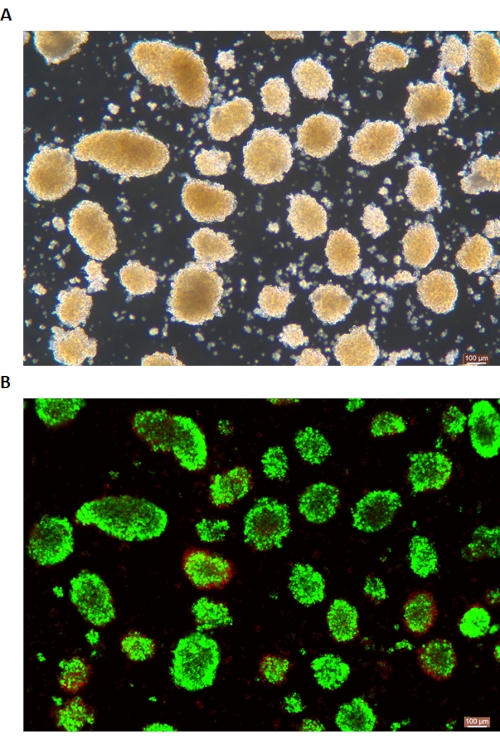
Figure 6 : Coloration de la viabilité des cellules des îlots de Langerhans vivantes/mortes. (A) Îlots en fond clair. (B) Coloration Calcein AM (CA) -Iodure de propidium (PI) des îlots. Les cellules vivantes sont vertes et les cellules mortes sont rouges. La barre d’échelle est de 100 μm. Veuillez cliquer ici pour voir une version plus grande de cette figure.
| Catégorie | Plage de diamètres des îlots (μm) | Facteur de conversion IEQ |
| 1 | 50–100 | x 0,167 |
| 2 | 101–150 | x 0,648 |
| 3 | 151–200 | x 1,685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6,315 |
| 6 | 301–350 | x 10,352 |
| 7 | >350 | x 15.833 |
Tableau 1 : Facteurs de conversion pour calculer les équivalents d’îlots de Langerhans (IEQ).
| Ce protocole | Etudes précédentes24 | |
| Rendement des îlots (IEQ/pancréas) | 360 935 ± 114 279 | 333 000 ± 129 000 |
| Viabilité des îlots | 81% | 86.70% |
| Indice d’insuline des îlots | 1,4 ± 0,3 | 1,75 ± 0,60 |
Tableau 2 : Comparaison des résultats obtenus par ce protocole avec les études précédentes.
Discussion
La xénotransplantation d’îlots, utilisant les porcs comme source d’îlots, est une approche prometteuse pour pallier la pénurie d’îlots humains. Bien que l’isolement des îlots de porcs adultes soit difficile, plusieurs groupes ont établi des protocoles pour isoler avec succès les îlots de manière cohérente10,11. Quelle que soit la méthode, la viabilité des îlots et les propriétés fonctionnelles doivent être démontrées pour confirmer la haute qualité des produits. Ce protocole est basé sur ceux publiés 10,11 dans un format vidéo afin d’être facile à comprendre et à reproduire.
D’après les rapports précédents et notre expérience, plusieurs paramètres sont essentiels pour l’isolement réussi des îlots de porcs adultes13,14. Les paramètres critiques comprennent (1) l’âge et le sexe des porcs donneurs : les porcs femelles avec plus de deux portées (appelés reproducteurs à la retraite) sont préférés aux porcs plus jeunes car ils peuvent facilement fournir un grand nombre d’îlots de grande qualité 25,26,27,28,29,30, (2) Temps d’ischémie chaude : limite à 10 min afin de réduire l’autodigestion14, (3) Enzyme de digestion : la collagénase de type V est une option valable, (4) Temps de digestion : il est essentiel d’arrêter la digestion suffisamment tôt pour éviter une digestion excessive. Dès que les îlots libres sont observés, le processus de collecte est lancé même s’ils sont partiellement piégés. Il est très tôt dans le processus.
Ce protocole présente plusieurs avantages. Par rapport aux gradients de densité continus ou discontinus utilisant un processeur de cellules COBE 2991 pour la purification des îlots, ce protocole superpose des îlots sur des solutions de gradient de densité à l’aide de tubes coniques et d’une centrifugeuse standard. Il est rentable et facile à maîtriser pour les débutants. Étant donné que cette méthode de purification nécessite plus de travail manuel, la production en vrac et les gros granulés peuvent toujours nécessiter un processeur de cellules COBE pour augmenter l’efficacité.
Certaines étapes de dépannage sont également abordées ici. (1) Supposons que plus de 25 % du tissu pancréatique ne soit pas digéré ou que la plupart des îlots pancréatiques soient recouverts de tissu acineux. Dans ce cas, les raisons possibles incluent une mauvaise perfusion, du sang résiduel qui affecte l’activité enzymatique, une faible concentration ou activité enzymatique ou une basse température pendant la digestion. (2) Une digestion excessive du tissu pancréatique peut entraîner une fragmentation des îlots pancréatiques. La raison possible est que le temps d’ischémie chaude n’est pas bien contrôlé, une concentration élevée d’enzymes digestives, des expositions plus longues des îlots digérés à la solution d’enzymes digestives ou une température de digestion élevée. Cela ne peut être évité que par la standardisation des paramètres enzymatiques/de digestion et l’optimisation du processus. (3) Une perte d’intégrité des îlots pancréatiques peut également se produire pendant le processus de culture. Parmi les raisons à cela, citons la contamination acineuse entraînant une faible pureté des îlots pancréatiques, une densité de culture d’îlots pancréatique trop élevée, une nutrition insuffisante ou des dommages mécaniques. Pour surmonter la perte d’intégrité des îlots pancréatiques, augmentez le volume du milieu des îlots, augmentez la densité du milieu et centrifugez les îlots plus lentement et pendant une période plus courte.
En résumé, ce protocole a été utilisé avec succès pour préparer des îlots de porcs adultes à être transplantés chez des receveurs de primates non humains. Il sera ensuite utilisé pour obtenir des îlots de Langerhans pour de futures enquêtes.
Déclarations de divulgation
Les auteurs ne signalent aucun conflit d’intérêts.
Remerciements
Nous remercions le professeur David K. C. Cooper (Center for Transplantation Sciences, Massachusetts General Hospital) de nous avoir aidés à mettre en place l’ensemble du système de xénotransplantation. Nous remercions Mlle Xingling Hu (Shenzhen Second People’s Hospital), Mlle Xiaohe Tian (Université de Californie, Berkeley), M. Bo Zhou (Université de Boston) pour leurs discussions et suggestions utiles. Ce travail a été soutenu par des subventions du National Key R&D Program of China (2017YFC1103701, 2017YFC1103704), des fonds spéciaux pour la construction d’hôpitaux de haut niveau dans la province du Guangdong (2019) et du Sanming Project of Medicine à Shenzhen (SZSM201812079).
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Références
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), London, England. 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, Clifton, N.J. 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , Artechhouse. Norwood, MA. 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, Clifton, N.J. 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, Suppl 2 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon