Method Article
Isolamento de ilhotas de porcos adultos
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo detalhado abrange as etapas metodológicas do isolamento de ilhotas de porcos adultos desde a fase de digestão via purificação até a avaliação funcional final das ilhotas. Este esboço pode ser usado como uma diretriz para o isolamento de ilhotas de porcos adultos em instituições de pesquisa.
Resumo
O diabetes mellitus tipo 1 (DM1) é causado pela destruição autoimune das células β pancreáticas, o que resulta em pouca ou nenhuma produção de insulina. O transplante de ilhotas desempenha um papel importante no tratamento do DM1, com a melhora do controle glicometabólico, a redução da progressão das complicações, a redução dos episódios hipoglicêmicos quando comparado com a insulinoterapia tradicional. Os resultados do ensaio clínico de fase III também demonstraram a segurança e eficácia do alotransplante de ilhotas no DM1. No entanto, a escassez de doadores de pâncreas limita seu uso generalizado. Os animais como fonte de ilhotas, como o porco, oferecem uma escolha alternativa. Como a arquitetura do pâncreas do porco é diferente das ilhotas de camundongos ou humanos, o procedimento de isolamento das ilhotas do porco ainda é um desafio. Uma vez que a tradução de fontes alternativas de ilhotas suínas (xenogênicas) para o ambiente clínico para o tratamento do DM1 por meio de transplante celular é de grande importância, um protocolo econômico, padronizado e reprodutível para isolar ilhotas suínas é urgentemente necessário. Este manuscrito descreve um método simplificado e econômico para isolar e purificar ilhotas suínas adultas com base nos protocolos anteriores que transplantaram com sucesso ilhotas suínas para primatas não humanos. Este será um guia para iniciantes sem o uso de equipamentos especializados, como um processador de célula COBE 2991.
Introdução
O diabetes mellitus tipo 1 (DM1) é uma doença grave na qual a destruição autoimune das células beta resulta em pouca ou nenhuma produção de insulina 1,2,3. Um grupo substancial de pacientes com DM1 não consegue estabilizar a labilidade glicêmica com insulinoterapia e apresenta episódios hipoglicêmicos com risco de vida. O transplante de ilhotas, quando bem-sucedido, pode alcançá-lo. Mais de 1.500 pacientes diabéticos foram submetidos a transplante de ilhotas bem-sucedido em todo o mundo, mostrando menor risco, mas sucesso de resultados a longo prazo do que o transplante de pâncreas4.
Comparado com a insulinoterapia, o transplante de ilhotas tem melhores resultados na redução da progressão das complicações5. Os resultados do ensaio clínico de fase III também demonstraram a segurança e eficácia do alotransplante de ilhotas no DM1 6,7. O transplante de ilhotas pode ser a melhor opção terapêutica atualmente disponível para pacientes com DM1 que apresentam episódios hipoglicêmicos com risco de vida.
No entanto, a escassez de ilhotas de doadores alogênicos humanos limita o uso generalizado do transplante de ilhotas 8,9. Portanto, o uso de ilhotas de animais como substituto é desejável10. O porco foi escolhido como doador de células de ilhotas em xenotransplante pré-clínico, e é de potencial traduzibilidade para a clínica devido a 1) disponibilidade, 2) semelhanças metabólicas com humanos, 3) massa de células beta bastante grande e 4) possibilidade de engenharia genética para melhorar a compatibilidade imunológica com humanos11.
A alta pureza e viabilidade das ilhotas são etapas fundamentais para o sucesso do xenotransplante. No entanto, o procedimento para isolar ilhotas de doadoras de suínos adultos é desafiador devido à arquitetura do próprio pâncreas, que difere das ilhotas de camundongos ou humanos12. De um modo geral, a forma das ilhotas pancreáticas suínas não é compacta12. Em comparação com as ilhotas pancreáticas humanas e de roedores, as ilhotas de porco se dissociam mais facilmente12. No entanto, a dissociação espontânea da camada externa das células das ilhotas, acompanhada por um longo tempo de cultura, leva a uma redução substancial no tamanho das ilhotas pancreáticas10.
Durante o processo de isolamento das ilhotas, muitos fatores influenciam a qualidade das ilhotas, como a idade do doador, o tempo de isquemia quente, a atividade enzimática, a distensão por injeção enzimática13,14. Embora muitos estudos anteriores tenham fornecido métodos para o isolamento de ilhotas de porcos, não existe um protocolo de vídeo passo a passo detalhado para pesquisadores como uma instrução eficaz 10,15,16,17,18,19,20,21,22,23.
Para isso, este protocolo detalhado abrange todas as etapas de isolamento, desde a recuperação de órgãos até a avaliação funcional pós-isolamento das ilhotas, esperando oferecer uma visão geral simples e compreensível do processo para fácil aplicabilidade. Esse protocolo é baseado nos métodos publicados anteriormente com modificações10,11.
Protocolo
Todos os procedimentos envolvendo animais são aprovados pelo comitê institucional de cuidados e uso de animais do Shenzhen Second People's Hospital e seguindo todos os regulamentos nacionais. Neste protocolo, suínos Duroc-Landrace-Yorkshire (~6 meses de idade) adquiridos no mercado foram utilizados como doadores pancreáticos. O peso do pâncreas coletado foi de 123,63 g ± 22,50 g. Equipamentos de proteção individual, incluindo roupas de proteção, máscaras, luvas e bonés, são usados durante os experimentos.
1. Preparação de mídia
- Meio de limpeza: Para preparar 100 mL de meio de limpeza, misture a solução salina balanceada de Hank (HBSS), soro suíno a 2%, ácido 4-(2-hidroxietil)-1-piperazineetanossulfônico (HEPES) a 1% e penicilina-estreptomicina a 1% (P/S).
- Meio coletor: Misture RPMI 1640 com 5% de soro suíno e 1% de penicilina-estreptomicina (P/S).
- Meio de cultura: Misture CMRL 1066 com 10% de soro suíno, 10 mmol/L de nicotinamida, 1% P/S e 2 mmol/L de L-glutamina.
- Solução enzimática: Prepare 1 mg / mL de solução de colagenase tipo V (atividade: 918 unidades / mg sólido) em HBSS.
- Solução de baixa concentração de glicose: Para preparar uma solução de baixa concentração de glicose, adicione 0,5% de albumina de soro bovino (BSA) e 2,8 mM de D-glicose a 1 mL de tampão de bicarbonato de Kreb's Ringer (KRBB).
- Solução de alta concentração de glicose: Para preparar uma solução de alta concentração de glicose, adicione 0,5% de albumina de soro bovino (BSA) e 28 mM de D-glicose a 1 mL de tampão de bicarbonato de Ringer de Kreb (KRBB).
2. Recuperação do pâncreas
- Anestesia de suínos e preparação da pele
- Anestesie o porco doador com injeção intramuscular dos anestésicos Lumianning (2,5-5 mg / kg) e Propofol (2-3 mg / kg) (consulte a Tabela de Materiais para obter detalhes).
- Manter a anestesia com isoflurano a 1% a 3% em um volume de ventilação de 1 a 1,5 L / min com máscaras de gás-anestesia.
- Monitore a frequência cardíaca para confirmar a anestesia adequada. Use pomada veterinária nos olhos para evitar o ressecamento durante a anestesia.
- Raspe o abdômen, limpe-o com iodóforo e cubra o porco com uma cortina cirúrgica estéril adequadamente.
- Abrindo o abdômen
- Depois de garantir condições estéreis, faça uma incisão de laparotomia na linha média do xifóide ao umbigo ligeiramente perto da cauda.
- Incisar o diafragma.
- Isolar a aorta supra-hepática e a veia cava inferior supra-hepática (VCI) com pinça vascular e, em seguida, isolar a aorta infra-renal e a VCI infra-hepática com o mesmo método.
- Administre heparina intravenosa (100 U/kg) ao porco para evitar a coagulação do sangue.
- Exteriorize o intestino delgado e grosso e empurre o fígado e o estômago em direção à cabeça para expor totalmente o pâncreas.
- Perfusão do pâncreas
- Prenda a aorta acima do diafragma com uma pinça vascular, intube a aorta acima do ramo da aorta renal através da cânula aórtica (16 G) e amarre com fio de sutura 2-0.
- Infundir o animal com 2-3 litros de solução fria de HBSS (previamente ensacada e mantida a 4 °C) através da cânula aórtica (16 G). Infundir a solução de HBSS através da cânula aórtica por gravidade, enquanto a VCI supra-hepática e a VCI são seccionadas para liberar o fluido de perfusão.
NOTA: Continue a infusão até que o fluxo de saída da VCI esteja limpo.
- Excisão do pâncreas
- Retire o omento, encontre os lóbulos do pâncreas e do baço junto com o baço e separe-os.
- Separe o lobo conectado do pâncreas com o tecido adjacente.
- Encontre o ducto pancreático principal na parte descendente do duodeno. Ligue o ducto biliar com uma sutura (2-0) e tranecte-o com uma tesoura perto do ducto pancreático.
- Prenda uma seção do duodeno contendo a ampola de Vater em ambos os lados da cabeça do pâncreas com uma pinça vascular e, em seguida, ressecção o duodeno com uma tesoura.
- Retire todo o pâncreas, mergulhe-o em HBSS frio e transporte-o imediatamente para a instalação de isolamento de ilhotas.
NOTA: Os suínos foram eutanasiados com pentobarbital sódico (100-200 mg/kg). A infusão intraductal de HBSS ou solução de preservação pode ser usada para distender o pâncreas no local da captação de órgãos se o pâncreas for obtido no matadouro local.
3. Prepare três gabinetes de biossegurança para os seguintes experimentos
- Configure o gabinete de biossegurança #1 com bacia renal, instrumentos cirúrgicos e béqueres para limpeza do pâncreas (seção 4, Figura 1A).
- Configure o gabinete de biossegurança # 2 com banho-maria, bomba peristáltica, suporte de tubo com o tubo de recirculação e uma câmara de digestão para digestão das ilhotas (seção 5, Figura 1B).
- Configure o gabinete de biossegurança #3 com filtros descartáveis e tubos de centrífuga para preparação enzimática, purificação de ilhotas e as seguintes etapas (seções 6-8, Figura 1C).
4. Limpeza do pâncreas
- Limpe e pese o pâncreas.
- Enxágue o pâncreas em 200 mL de iodóforo por 3 min no gabinete de biossegurança #1. Enxágue o pâncreas em 200 mL de HBSS frio duas vezes, 2 min cada.
- Coloque o pâncreas limpo em uma bacia renal contendo 100 mL de meio de limpeza no gelo.
- Mantenha a ampola presa, ressece o duodeno. Limpe o pâncreas da gordura externa e do tecido conjuntivo.
- Pese o pâncreas.
5. Digestão do pâncreas
- Infusão de colagenase
- Corte uma seção transversal de um dos ramos anulares do pâncreas e insira um angiocath 18 G (se os diâmetros do ducto forem menores, considere um angiocath 20 G) no ducto pancreático principal e suture-o no lugar com uma sutura de seda trançada 2-0.
- Corte a ponte de tecido que passa pelo lobo de conexão perto da cabeça do pâncreas e prenda o cateter na lateral da incisão perto da cabeça do pâncreas para reduzir o vazamento de enzimas.
- Coloque vários angiocateteres para melhor infusão de enzimas intraductais. Para isso, insira angiocateteres adicionais (tamanho 20-22 G) após seccionar o órgão pancreático para expor o ducto.
- Instale a tubulação de enchimento, incluindo um tubo de silicone de 1 m (16#) com um conector Luer-lock. A seção intermediária do tubo é embutida no cabeçote da bomba peristáltica.
- Ligue a bomba peristáltica para encher o sistema de tubulação (tamanho do tubo 16#) 300 mL de 1 mg/mL, colagenase tipo V (atividade: 918 unidades/mg) pré-aquecido a 24 °C e remova as bolhas de ar na tubulação.
- Conecte o tubo de perfusão ao angiocateter e ligue a bomba peristáltica a uma taxa de 20 mL / min.
- Interrompa a perfusão quando a maior parte da enzima tiver sido infundida e o pâncreas estiver bem distendido (Figura 2B).
- Corte o tecido gelatinoso transparente que se forma ao redor do pâncreas durante a perfusão.
NOTA: Esta etapa é muito importante porque o gel pode entupir o filtro na câmara e dificultar a coleta do tecido digerido (Figura 2B). - Remova os angiocateteres após a infusão.
- Digestão tecidual
- Pré-aqueça 1 L de solução HBSS a 36 °C. Preparar previamente o sistema de digestão constituído pela câmara de digestão e pela tubagem ligadas a um sistema fechado e transferir previamente a serpentina de aquecimento do circuito para um banho-maria a 36 °C.
- Corte o pâncreas em 3-4 pedaços e despeje-os com colagenase tipo V em um copo de 500 mL.
- Cubra o béquer com uma tampa de placa de Petri estéril, transfira-o para o gabinete de biossegurança #2 e coloque o conteúdo do béquer na câmara de digestão contendo quatro mármores de vidro siliconizados e uma malha de 500 μm.
- Feche a câmara e aperte os parafusos. Colocar a enzima restante no copo de recirculação e ligar a bomba peristáltica a uma velocidade de 80 ml/min.
- Adicione uma solução HBSS quente (normalmente em torno de 150 mL) pré-aquecida na etapa 5.2.1 para preencher o circuito até a conclusão. Agite a câmara suavemente e vire-a para que as bolinhas de gude de vidro siliconizadas atinjam o tecido.
NOTA: Como as ilhotas de porco são mais delicadas do que o tecido humano, os tremores devem ser uniformes e lentos para evitar danos. À medida que o tecido é digerido, ele começa a se desfazer e fluir para fora da câmara. - Pegue uma amostra (aproximadamente 1 mL) do circuito a cada 2 minutos para verificar se há ilhotas livres após agitar por 1 minuto.
- Colocar a amostra numa placa de 6 poços com 80 μL de ditizona (DTZ). Adicione 2 mL de solução salina tamponada com fosfato (PBS) e examine a amostra ao microscópio com aumento de 40x. DTZ manchará as ilhotas de vermelho.
- Coleta do resumo
- Continue a digestão até que as ilhotas livres sejam observadas (mesmo que muitas ainda estejam parcialmente presas no exócrino).
NOTA: A liberação das ilhotas leva cerca de 10-15 min, mas o tempo de digestão é frequentemente influenciado pela idade do doador, lotes de enzimas, concentração de enzima, etc. - Abra o circuito e recolha o tecido libertado em frascos de 1 L. Mantenha as garrafas no gelo durante a coleta para ajudar a inativar a colagenase tipo V.
- Adicione a solução quente restante de HBSS (~ 850 mL, etapa 5.2.1) ao béquer de recirculação e colete o tecido digerido restante da câmara de digestão.
- Adicionar o colector de frio à câmara (através do copo de recirculação).
NOTA: Pare a coleta quando os pellets de tecido ficarem menores. A fase de coleta (etapas 5.3.2-5.3.3) pode levar até 40-75 min e 5-8 L de mídia de coleta. - Transfira o tecido do frasco de coleta para tubos de centrífuga cônicos de 250 mL e centrifugue a 200 x g por 3 min a 4 ° C.
- Rejeitar o sobrenadante e ressuspender o tecido em 500 ml de meio de recolha fresco.
- Continue a combinar os pellets celulares em meio coletor a frio (500 mL) até que todo o digerir seja coletado.
- Lavar o sedimento de célula suspenso no meio frio por centrifugação (3 min a 200 x g, 4 °C).
- Descarte o sobrenadante. Avalie e quantifique o pellet celular seguindo as etapas mencionadas nas seções 6-8.
NOTA: O volume final depende do tamanho do pâncreas, mas espera-se que esteja entre 40-80 mL.
- Continue a digestão até que as ilhotas livres sejam observadas (mesmo que muitas ainda estejam parcialmente presas no exócrino).
6. Purificação de ilhotas
- Purificar os ilhéus dos porcos por separação por gradiente de densidade.
NOTA: Consulte a Tabela de Materiais para obter os detalhes das soluções de gradiente de densidade usadas.- Adicione 2 mL de tecido pancreático a tubos cônicos de 50 mL.
- Adicione 12 mL de gradiente de polissacarose 1119 (1,119 g / cm3) para ressuspender cada 2 mL de tecido pancreático.
- Adicione 10 mL de solução de polissacarose 1083 (1,083 g / cm3), 10 mL de solução de polissacarose 1077 (1,077 g / cm3), 10 mL de solução de polissacarose 1037 (1,037 g / cm3) e 5 mL de HBSS, sucessivamente.
NOTA: A solução de polissacarose 1037 (1,037 g/cm3) é preparada misturando solução de polissacarose 1077 (1,077 g/cm3) e solução de purina de citrato hipertónico (38,5 ml:11,5 ml). - Centrifugue a 900 x g sem freio por 10 min a 4 °C.
- Aspirar os ilhéus entre as camadas da solução de polissacarose 1077 e da solução de polissacarose 1037.
- Transfira as ilhotas para um tubo de centrífuga de 50 mL, distribua uniformemente o líquido em cada tubo e equilibre antes da centrifugação.
- Lavar ilhotas de porco
- Centrifugar a 200 x g durante 3 min a 4 °C, rejeitar o sobrenadante. Adicione o meio coletor para aumentar o volume para 45 mL.
- Centrifugue a 200 x g por 3 min a 4 °C, deixando cerca de 2 mL de sobrenadante; agite suavemente para misturar.
- Combine todos os pellets no mesmo tubo de centrifugação de 50 mL. Adicione o meio coletor para aumentar o volume para 45 mL.
7. Contagem de equivalentes de ilhéus (IEQ) e cultura de ilhéus
- Coloração DTZ de ilhotas
- Agrupe as ilhotas, adicione mais meio coletor para aumentar o volume para 250 mL e ressuspenda as ilhotas.
- Pegue 500 μl da amostra representativa e coloque-a em um prato de 35 mm com 80 μl de DTZ. Deixe incubar em temperatura ambiente por 1-2 min e, em seguida, adicione 2 mL de PBS.
- Examine com ampliação de 40x sob um microscópio invertido. Os agregados das ilhotas são corados de vermelho pela DTZ.
- Contando ilhotas manchadas
- Conte as ilhotas manchadas dividindo-as nas categorias de tamanho listadas na Tabela 1. Use o fator de conversão para determinar o equivalente da ilhota (IEQ) de acordo com o tamanho.
NOTA: A conversão do IEQ é realizada quando a maioria do diâmetro dos agregados positivos para DTZ é maior que 50 μm (em adultos (>2 anos) e algumas preparações para adultos jovens (6-12 meses) prosseguem para a etapa 7.2.4). Em todos os outros casos (em suínos jovens com menos de 6 meses de idade e nos restantes suínos adultos jovens), o número de ilhotas foi estimado com base no volume de partículas ou no conteúdo de ADN (de acordo com os passos 7.2.2-7.2.3). - (OPCIONAL) Centrifugue a 200 x g a 4 °C durante 2 min para medir as paletes.
- (OPCIONAL) Avaliar o conteúdo de DNA de ilhotas individuais, bem como dos pellets de células de ilhotas pelo kit de ensaio de proliferação celular. Extrapole o número de células beta de porco a partir do conteúdo de DNA e da análise imunocitoquímica.
- Adicione todas as categorias e determine o IEQ total para a amostra. Multiplique esse número pelo volume da fração. (por exemplo, 200 IEQs em 500 μL de uma fração de 250 mL = 200 x 2 x 250 = 100.000 IEQs).
- Conte as ilhotas manchadas dividindo-as nas categorias de tamanho listadas na Tabela 1. Use o fator de conversão para determinar o equivalente da ilhota (IEQ) de acordo com o tamanho.
- Cultura do ilhéu
- Centrifugar os ilhéus a 200 x g a 4 °C durante 1 min; descarte o sobrenadante.
- Adicione 5 mL de meio de cultura pré-aquecido para ressuspender as ilhotas e transfira para uma placa de Petri de 150 mm.
NOTA: Ressuspenda 10.000 ilhotas / prato. - Adicione mais meio de cultura para aumentar o volume para 30 mL na placa de Petri de 150 mm.
8. Avaliação da qualidade dos ilhéus
- Calceína AM (CA) - Coloração de iodeto de propídio (PI) de ilhotas
- Escolha a dedo 50 ilhotas em uma placa de 48 poços. Lave uma vez com 1 mL de HBSS.
- Adicione 200 μL da mistura contendo 1x CA e 1x PI de acordo com as instruções do kit de coloração de viabilidade celular.
- Cubra a placa de Petri e coloque-a em uma incubadora a 37 °C por 30 min.
- Visualize as ilhotas usando um microscópio de fluorescência e capture as imagens.
- Quantifique a viabilidade contando as células vivas (verde) e as células mortas (vermelho) após a coloração CA-PI.
- Secreção de insulina estimulada por glicose (GSIS)
- Adicione 1 mL de solução de baixa concentração de glicose a três poços de uma planta de 24 poços.
- Após pelo menos a cultura durante a noite, escolha manualmente 100 ilhotas de tamanho semelhante na faixa de 100-200 μm de diâmetro e transfira-as para os três poços da placa de 24 poços pré-preenchidos com solução de baixa concentração de glicose (como na etapa 8.2.1).
NOTA: Lave as ilhotas em um poço intermediário com HBSS antes de transferi-las para o poço para lavar o meio de cultura. - Incubar os ilhéus numa incubadora de CO2 a 5% a 37 °C durante 30 min.
- Remova o sobrenadante cuidadosamente com uma pipeta sem tocar nas ilhotas.
- Adicione 1 mL de nova solução de baixa concentração de glicose.
- Incubar as ilhotas em uma incubadora de CO5% 2 a 37 °C por 60 min.
- Colete o sobrenadante (sem ilhotas) e transfira pelo menos 500 μL dele para um tubo de centrífuga de 1,5 mL. Isso conterá insulina secretada sob estimulação de baixa glicose.
- Adicione 1 mL de solução de alta concentração de glicose cuidadosamente nos mesmos poços.
- Incubar as ilhotas em uma incubadora de CO5% 2 a 37 °C por 60 min.
- Transfira mais 500 μL do meio de cultura para um novo tubo de centrífuga de 1,5 mL. Isso conterá insulina secretada sob alta estimulação de glicose.
- Use kits de ensaio imunoenzimático (ELISA) para insulina suína para medir a concentração de insulina liberada após estimulação de glicose baixa e alta (etapas 8.2.7 e 8.2.10).
NOTA: O Índice de Estimulação (SI) é calculado como a razão entre a concentração de insulina medida após a estimulação com glicose alta dividida pela concentração de insulina após a estimulação com glicose baixa.
Resultados
A preparação do gabinete de biossegurança é mostrada na Figura 1. Três espaços operacionais independentes são configurados. O gabinete de biossegurança #1 é configurado com bacias renais, instrumentos cirúrgicos e copos para aparar o pâncreas (Figura 1A). O gabinete de biossegurança #2 é configurado com banho-maria, bomba peristáltica, suporte de tubo com tubo de recirculação e câmara de digestão para digestão de ilhotas (Figura 1B). O gabinete de biossegurança #3 é configurado com filtros descartáveis e tubos de centrífuga para preparação de enzimas, purificação de ilhotas e as seguintes etapas (Figura 1C).
O pâncreas (antes e depois da perfusão enzimática) é mostrado na Figura 2. A solução de colagenase tipo V é perfundida em todo o pâncreas através do ducto pancreático a partir da cabeça do pâncreas. Se o lóbulo de conexão não for perfundido com sucesso, ele precisa ser cortado em pedaços separados e cada um deve ser perfundido.
A digestão do pâncreas é realizada na câmara de digestão, conforme mostrado na Figura 3. O tecido pancreático após a ruptura mecânica e o tecido pancreático não digerido remanescente após a digestão são mostrados na figura. Uma pequena quantidade de tecido não digerido indica digestão completa; no entanto, também pode indicar digestão excessiva; portanto, se 15% a 25% do órgão pancreático permanecer na câmara, é aceitável. O tecido pancreático digerido é então lavado e centrifugado em gradientes de densidade descontínuos para separar as ilhotas das células acinares (purificação), conforme mostrado na Figura 4. As ilhotas pancreáticas são encontradas na camada intermediária.
A coloração DTZ das ilhotas é mostrada na Figura 5. O ponto em que a digestão é interrompida e a coleta começa (ou seja, quando as ilhotas livres aparecem) é mostrado na Figura 5A. As ilhotas de porco purificadas após a separação do gradiente de densidade são mostradas na Figura 5B. As ilhotas em campo claro são mostradas na Figura 6A. A qualidade das ilhotas é examinada pela coloração de Calceína AM (CA) -Iodeto de Propídio (PI), conforme mostrado na Figura 6B. As células vivas são verdes e as células mortas são vermelhas. O rendimento médio de isolamento de ilhotas deste protocolo é de 360.935 ± 114.279 IEQ/pâncreas e 2.439-3.252 IEQ/g do pâncreas, o que é semelhante ao estudo anterior (333.000 ± 129.000 IEQ/pâncreas). A viabilidade média do ilhéu por este protocolo é superior a 81%, ligeiramente inferior ao estudo anterior (86,7%). Um dos resultados representativos do índice de estimulação (SI = razão entre as quantidades de insulina (mU/L) liberadas durante condições de glicose alta e baixa glicose) obtido pelo teste de secreção de insulina estimulada por glicose (GSIS) medido por ELISA por esse protocolo é de 1,4 ± 0,3, semelhante ao estudo anterior (1,75 ± 0,60)24. Os resultados acima estão resumidos na Tabela 2.

Figura 1: A preparação do gabinete de biossegurança. (A) O gabinete de biossegurança #1 mostra a bacia renal, instrumentos cirúrgicos e béqueres no campo estéril. (B) Gabinete de biossegurança #2 com banho-maria (da esquerda para a direita), bomba peristáltica, suporte de tubo com tubo e tubo de recirculação e câmara de digestão. (C) Gabinete de biossegurança #3 com filtros descartáveis e tubos de centrífuga. Clique aqui para ver uma versão maior desta figura.
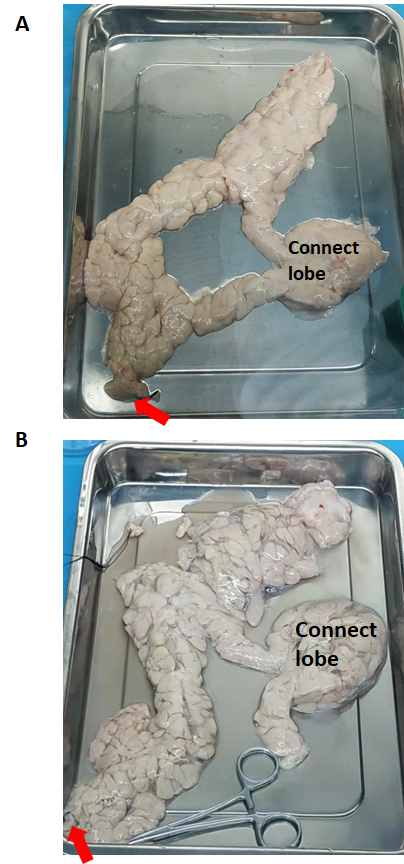
Figura 2: O pâncreas antes e depois da perfusão enzimática. (A) Antes da perfusão enzimática. (B) Pâncreas distendido após perfusão enzimática. A seta vermelha indica o fluxo da solução de colagenase tipo V. Clique aqui para ver uma versão maior desta figura.

Figura 3: O pâncreas na câmara de digestão. (A) Tecido pancreático após digestão e ruptura com bolinhas de gude. (B) Tecido pancreático remanescente após a digestão. Clique aqui para ver uma versão maior desta figura.
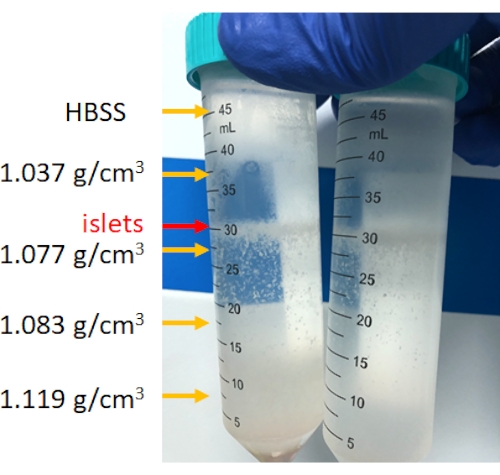
Figura 4: Estratificação de células pancreáticas após centrifugação com gradiente de densidade descontínuo. Após a centrifugação, as ilhotas estarão concentradas entre 1,077g/cm3 e a camada de HBSS, e o sedimento de fundo é tecido não ilhéu. Clique aqui para ver uma versão maior desta figura.
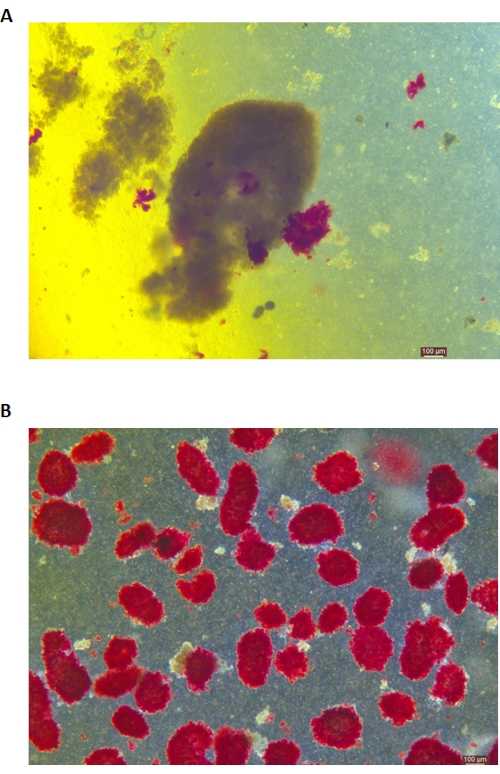
Figura 5: Coloração com ditizona (DTZ) das ilhotas durante a digestão. (A) As amostras são coletadas da sala digestiva. As ilhotas da amostra são tingidas de vermelho. O sinal para iniciar a coleta é quando 1-2 ilhotas são completamente liberadas do tecido exócrino. (B) Ilhotas purificadas separadas por gradiente de densidade descontínuo. A barra de escala é de 100 μm. Clique aqui para ver uma versão maior desta figura.
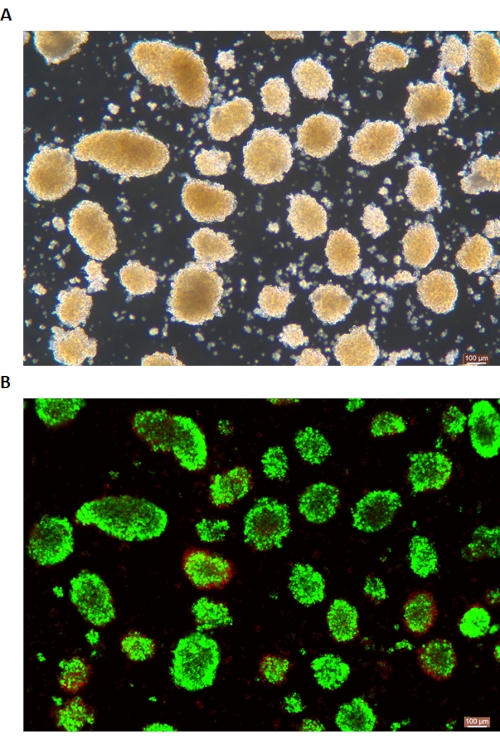
Figura 6: Coloração de viabilidade de ilhotas vivas / mortas. (A) Ilhotas em campo claro. (B) Calceína AM (CA) - Coloração de iodeto de propídio (PI) de ilhotas. As células vivas são verdes e as células mortas são vermelhas. A barra de escala é de 100 μm. Clique aqui para ver uma versão maior desta figura.
| Categoria | Faixa de diâmetro da ilhota (μm) | Fator de conversão IEQ |
| 1 | 50–100 | x 0,167 |
| 2 | 101–150 | x 0,648 |
| 3 | 151–200 | x 1.685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6.315 |
| 6 | 301–350 | x 10.352 |
| 7 | >350 | x 15.833 |
Tabela 1: Fatores de conversão para calcular equivalentes de ilhotas (IEQ).
| Este protocolo | Estudos anteriores24 | |
| Rendimento das ilhotas (IEQ/pâncreas) | 360.935 ± 114.279 | 333.000 ± 129.000 |
| Viabilidade das ilhotas | 81% | 86.70% |
| Índice de estimulação da insulina das ilhotas | 1,4 ± 0,3 | 1,75 ± 0,60 |
Tabela 2: Comparação dos resultados obtidos por este protocolo com estudos anteriores.
Discussão
O xenotransplante de ilhotas, utilizando porcos como fonte de ilhotas, é uma abordagem promissora para superar a escassez de ilhotas humanas. Embora o isolamento de ilhotas de porcos adultos seja desafiador, vários grupos estabeleceram protocolos para isolar com sucesso ilhotas de forma consistente10,11. Independentemente do método, a viabilidade das ilhotas e as propriedades funcionais devem ser demonstradas para confirmar a alta qualidade dos produtos. Esse protocolo é baseado naqueles publicados10,11 em formato de vídeo, de modo a ser de fácil compreensão e reprodução.
De acordo com relatos anteriores e nossa experiência, vários parâmetros são críticos para o isolamento bem-sucedido de ilhotas de porcos adultos13,14. Os parâmetros críticos incluem (1) Idade e sexo do porco doador: porcas com mais de duas ninhadas (as chamadas reprodutoras aposentadas) são preferidas aos porcos mais jovens porque podem facilmente fornecer um grande número de ilhotas de alta qualidade 25,26,27,28,29,30, (2) Tempo de isquemia quente: limite de 10 min para reduzir a autodigestão 14, (3) Enzima de digestão: a colagenase tipo V é uma opção válida, (4) Tempo de digestão: é essencial interromper a digestão cedo o suficiente para evitar a digestão excessiva. Assim que as ilhotas livres são observadas, o processo de coleta é iniciado, mesmo que estejam parcialmente presas. É muito cedo no processo.
Este protocolo tem várias vantagens. Comparado com gradientes de densidade contínuos ou descontínuos usando um processador de células COBE 2991 para purificação de ilhotas, este protocolo coloca ilhotas sobre soluções de gradiente de densidade usando tubos cônicos e uma centrífuga padrão. É econômico e fácil de dominar para iniciantes. Como esse método de purificação requer mais trabalho manual, a produção em massa e pellets grandes ainda podem exigir um processador de célula COBE para aumentar a eficiência.
Algumas etapas de solução de problemas também são discutidas aqui. (1) Suponha que mais de 25% do tecido pancreático não seja digerido ou que a maioria das ilhotas pancreáticas seja coberta por tecido acinar. Nesse caso, as possíveis razões incluem má perfusão, sangue residual que afeta a atividade enzimática, baixa concentração ou atividade enzimática ou baixa temperatura durante a digestão. (2) A digestão excessiva do tecido pancreático pode levar à fragmentação das ilhotas pancreáticas. A possível razão é que o tempo de isquemia quente não é bem controlado, alta concentração de enzimas digestivas, exposições mais longas de ilhotas digeridas à solução de enzimas digestivas ou alta temperatura de digestão. Isso só pode ser evitado pela padronização dos parâmetros enzimáticos/digestão e otimização do processo. (3) A perda da integridade das ilhotas pancreáticas também pode ocorrer durante o processo de cultura. Algumas razões para isso incluem contaminação acinar levando a baixa pureza das ilhotas pancreáticas, densidade de cultura de ilhotas muito alta, nutrição insuficiente ou danos mecânicos. Para superar a perda da integridade das ilhotas pancreáticas, aumente o volume do meio das ilhotas, aumente a densidade do meio e centrifugue as ilhotas mais lentamente e por menos tempo.
Em resumo, este protocolo foi empregado com sucesso para preparar ilhotas de porcos adultos para serem transplantadas em receptores de primatas não humanos. Será ainda usado para obter ilhotas para futuras investigações.
Divulgações
Os autores não relatam conflitos de interesse.
Agradecimentos
Agradecemos ao Professor David K. C. Cooper (Centro de Ciências de Transplantes, Hospital Geral de Massachusetts) por nos ajudar a configurar todo o sistema de xenotransplante. Agradecemos à Srta. Xingling Hu (Shenzhen Second People's Hospital), à Srta. Xiaohe Tian (Universidade da Califórnia, Berkeley), ao Sr. Bo Zhou (Universidade de Boston) pela discussão e sugestões úteis. Este trabalho foi apoiado por doações do Programa Nacional de P&D da China (2017YFC1103701, 2017YFC1103704), Fundos Especiais para a Construção de Hospitais de Alto Nível na Província de Guangdong (2019) e Projeto Sanming de Medicina em Shenzhen (SZSM201812079).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Referências
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados