Method Article
Aislamiento de islotes de cerdos adultos
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo detallado cubre los pasos metodológicos del aislamiento de los islotes de cerdos adultos, desde la fase de digestión , pasando por la purificación, hasta la evaluación funcional final de los islotes. Este esquema se puede utilizar como guía para el aislamiento de islotes de cerdos adultos en instituciones de investigación.
Resumen
La diabetes mellitus tipo 1 (DM1) es causada por la destrucción autoinmune de las células β pancreáticas, lo que resulta en poca o ninguna producción de insulina. El trasplante de islotes juega un papel importante en el tratamiento de la DM1, con un mejor control glucometabólico, la reducción de la progresión de las complicaciones, la reducción de los episodios de hipoglucemia en comparación con la terapia tradicional con insulina. Los resultados del ensayo clínico de fase III también demostraron la seguridad y eficacia del alotrasplante de islotes en la DM1. Sin embargo, la escasez de donantes de páncreas limita su uso generalizado. Los animales como fuente de islotes, como el cerdo, ofrecen una opción alternativa. Debido a que la arquitectura del páncreas de cerdo es diferente a la de los islotes de ratones o humanos, el procedimiento de aislamiento de islotes de cerdo sigue siendo un desafío. Dado que la traslación de fuentes alternativas de islotes porcinos (xenogénicos) al entorno clínico para el tratamiento de la DM1 mediante trasplante celular es de gran importancia, se necesita urgentemente un protocolo rentable, estandarizado y reproducible para aislar los islotes porcinos. Este manuscrito describe un método simplificado y rentable para aislar y purificar islotes porcinos adultos basado en los protocolos anteriores que han trasplantado con éxito islotes porcinos a primates no humanos. Esta será una guía para principiantes sin el uso de equipos especializados, como un procesador de celdas COBE 2991.
Introducción
La diabetes mellitus tipo 1 (DM1) es una enfermedad grave en la que la destrucción autoinmune de las células beta resulta en poca o ninguna producción de insulina 1,2,3. Un grupo sustancial de pacientes con DM1 no puede estabilizar la labilidad glucémica con terapia con insulina y experimenta episodios de hipoglucemia potencialmente mortales. El trasplante de islotes, cuando es exitoso, puede lograrlo. Más de 1.500 pacientes diabéticos se han sometido con éxito a un trasplante de islotes en todo el mundo, mostrando un menor riesgo pero un éxito de resultados a largo plazo que el trasplante de páncreas4.
En comparación con la terapia con insulina, el trasplante de islotes tiene mejores resultados en la reducción de la progresión de las complicaciones5. Los resultados del ensayo clínico de fase III también demostraron la seguridad y eficacia del alotrasplante de islotes en la DM1 6,7. El trasplante de islotes puede ser la mejor opción terapéutica disponible actualmente para los pacientes con DM1 que experimentan episodios de hipoglucemia potencialmente mortales.
Sin embargo, la escasez de islotes de donantes alogénicos humanos limita el uso generalizado del trasplante de islotes 8,9. Por lo tanto, es deseable el uso de islotes animales como reemplazo10. El cerdo ha sido elegido como donante de células de islotes en xenotrasplante preclínico, y es potencialmente traducible a la clínica debido a 1) disponibilidad, 2) similitudes metabólicas con humanos, 3) masa de células beta bastante grande, y 4) posibilidad de ingeniería genética para mejorar la compatibilidad inmunológica con los humanos11.
La alta pureza y viabilidad de los islotes son pasos clave para el éxito de los xenotrasplantes. Sin embargo, el procedimiento para aislar los islotes de los donantes de cerdos adultos es desafiante debido a la arquitectura del propio páncreas, que difiere de los islotes de ratones o humanos12. En términos generales, la forma de los islotes pancreáticos porcinos no es compacta12. En comparación con los islotes pancreáticos humanos y roedores, los islotes de cerdo se disocian más fácilmente12. Sin embargo, la disociación espontánea de la capa externa de las células de los islotes, acompañada de un largo tiempo de cultivo, conduce a una reducción sustancial del tamaño10 de los islotes pancreáticos.
Durante el proceso de aislamiento de los islotes, muchos factores influyen en la calidad de los islotes, como la edad del donante, el tiempo de isquemia caliente, la actividad enzimática, la distensión por inyección enzimática13,14. Aunque muchos estudios previos proporcionaron métodos para el aislamiento de islotes de cerdos, no existe un protocolo de video detallado paso a paso para los investigadores como una instrucción efectiva 10,15,16,17,18,19,20,21,22,23.
Para ello, este detallado protocolo abarca todas las etapas del aislamiento, desde la recuperación de órganos hasta la evaluación funcional post-aislamiento de los islotes, con el objetivo de ofrecer una visión general sencilla y comprensible del proceso para una fácil aplicabilidad. Este protocolo se basa en los métodos publicados anteriormente con las modificaciones 10,11.
Protocolo
Todos los procedimientos que involucran animales están aprobados por el Comité Institucional de Cuidado y Uso de Animales del Segundo Hospital Popular de Shenzhen y siguen todas las regulaciones nacionales. En este protocolo, se utilizaron como donantes pancreáticos cerdos Duroc-Landrace-Yorkshire (~6 meses de edad) comprados en el mercado. El peso del páncreas recogido fue de 123,63 g ± 22,50 g. Durante los experimentos se usa equipo de protección personal, que incluye ropa protectora, mascarillas, guantes y gorros.
1. Preparación de los medios
- Medio de limpieza: Para preparar 100 mL de medio de limpieza, mezcle la solución salina equilibrada de Hank (HBSS), suero porcino al 2%, ácido 4-(2-hidroxietil)-1-piperazinetinasulfónico (HEPES) y 20 mM de penicilina-estreptomicina (P/S).
- Medio colector: Mezclar RPMI 1640 con un 5% de suero porcino y un 1% de penicilina-estreptomicina (P/S).
- Medio de cultivo: Mezclar CMRL 1066 con 10% de suero porcino, 10 mmol/L de nicotinamida, 1% de P/S y 2 mmol/L de L-glutamina.
- Solución enzimática: Preparar 1 mg/mL de colagenasa tipo V (actividad: 918 unidades/mg sólido) solución en HBSS.
- Solución de baja concentración de glucosa: Para preparar una solución de baja concentración de glucosa, agregue 0,5% de albúmina sérica bovina (BSA) y 2,8 mM de D-glucosa a 1 mL de tampón de bicarbonato Ringer de Kreb (KRBB).
- Solución de alta concentración de glucosa: Para preparar una solución de alta concentración de glucosa, agregue 0,5% de albúmina sérica bovina (BSA) y 28 mM de D-glucosa a 1 mL de tampón de bicarbonato Ringer de Kreb (KRBB).
2. Recuperación del páncreas
- Anestesia y preparación de la piel de cerdo
- Anestesiar al cerdo donante con inyección intramuscular de los anestésicos Lumianning (2,5-5 mg/kg) y Propofol (2-3 mg/kg) (ver Tabla de Materiales para más detalles).
- Mantener la anestesia con isoflurano al 1%-3% en un volumen de ventilación de 1-1,5 L/min mediante máscaras de anestesia gaseosa.
- Controle la frecuencia cardíaca para confirmar la anestesia adecuada. Use ungüento veterinario en los ojos para prevenir la sequedad mientras está bajo anestesia.
- Afeita el abdomen, límpialo con yodóforo y cubre al cerdo con un paño quirúrgico estéril de manera adecuada.
- Apertura del abdomen
- Después de asegurarse de que las condiciones sean estériles, haga una incisión de laparotomía en la línea media desde el xifoides hasta el ombligo ligeramente cerca de la cola.
- Incide el diafragma.
- Aislar la aorta suprahepática y la vena cava inferior suprahepática (VCI) con pinzas vasculares, y luego aislar la aorta infrarrenal y la VCI infrahepática con el mismo método.
- Administrar heparina intravenosa (100 U/kg) al cerdo para prevenir la coagulación de la sangre.
- Exteriorice el intestino delgado y grueso, y empuje el hígado y el estómago hacia la cabeza para exponer completamente el páncreas.
- Perfusión pancreática
- Pinzar la aorta por encima del diafragma con pinzas vasculares, intubar la aorta por encima de la rama de la aorta renal a través de la cánula aórtica (16 G) y atar con hilo de sutura 2-0.
- Infundir al animal 2-3 litros de solución fría de HBSS (previamente embolsada y mantenida a 4 °C) a través de la cánula aórtica (16 G). Infundir la solución de HBSS a través de la cánula aórtica por gravedad, mientras se seccionan la VCI suprahepática y la VCI para liberar el líquido de perfusión.
NOTA: Continúe la infusión hasta que el flujo de salida de la VCI esté despejado.
- Extirpación del páncreas
- Pela el epiplón, encuentra los lóbulos del páncreas y el bazo junto con el bazo y sepáralos.
- Separe el lóbulo conectado del páncreas con el tejido adyacente.
- Encuentra el conducto pancreático principal en la parte descendente del duodeno. Lime el conducto biliar con una sutura (2-0) y transcórtelo con unas tijeras cerca del conducto pancreático.
- Pinzar una sección del duodeno que contiene la ampolla de Vater a cada lado de la cabeza del páncreas con pinzas vasculares, y luego resecar el duodeno con unas tijeras.
- Extraiga todo el páncreas, sumérjalo en HBSS frío y transpórtelo inmediatamente al centro de aislamiento de islotes.
NOTA: Los cerdos fueron sacrificados con pentobarbital sódico (100-200 mg/kg). La infusión intraductal de HBSS o la solución de conservación se puede utilizar para distender el páncreas en el sitio de obtención del órgano si el páncreas se obtiene en el matadero local.
3. Prepare tres cabinas de bioseguridad para los siguientes experimentos:
- Prepare el gabinete de bioseguridad #1 con cuenca de riñón, instrumentos quirúrgicos y vasos de precipitados para limpiar el páncreas (sección 4, Figura 1A).
- Configure el gabinete de bioseguridad #2 con un baño de agua, una bomba peristáltica, un soporte de tubo con el tubo de recirculación y una cámara de digestión para la digestión de los islotes (sección 5, Figura 1B).
- Configure el gabinete de bioseguridad #3 con filtros desechables y tubos de centrífuga para la preparación de enzimas, la purificación de islotes y los siguientes pasos (secciones 6-8, Figura 1C).
4. Limpieza del páncreas
- Limpiar y pesar el páncreas.
- Enjuague el páncreas con 200 mL de yodóforo durante 3 min en la cabina de bioseguridad #1. Enjuague el páncreas en 200 mL de HBSS frío dos veces, 2 min cada una.
- Coloque el páncreas limpio en un recipiente para riñones que contenga 100 ml de medio limpiador en hielo.
- Mantener la ampolla pinzada, resecar el duodeno. Limpiar el páncreas de grasa externa y tejido conectivo.
- Pesa el páncreas.
5. Digestión del páncreas
- Infusión de colagenasa
- Corte una sección transversal de una de las ramas anulares del páncreas e inserte un angiocatit de 18 G (si los diámetros del conducto son más pequeños, considere un angiotato de 20 G) en el conducto pancreático principal y suérelo en su lugar con una sutura de seda trenzada 2-0.
- Corte el puente de tejido que pasa a través del lóbulo de conexión cerca de la cabeza del páncreas y sujete el catéter en el lado de la incisión cerca de la cabeza del páncreas para reducir la fuga de enzimas.
- Colocar múltiples angiocaths para una mejor infusión de enzimas intraductales. Para ello, inserte angiocaths adicionales (tamaño 20-22 G) después de seccionar el órgano pancreático para exponer el conducto.
- Instale la tubería de llenado, incluido un tubo de silicona de 1 m (16#) con un conector Luer-lock. La sección central del tubo está incrustada en el cabezal de la bomba peristáltica.
- Encienda la bomba peristáltica para llenar el sistema de tubos (tamaño de tubo 16#) 300 mL de 1 mg/mL, Colagenasa Tipo V (actividad: 918 unidades/mg) precalentada a 24 °C y elimine las burbujas de aire en la tubería.
- Conecte el tubo de perfusión al angiotath y encienda la bomba peristáltica a una velocidad de 20 mL/min.
- Detenga la perfusión cuando la mayor parte de la enzima se haya infundido y el páncreas esté bien distendido (Figura 2B).
- Corta el tejido gelatinoso transparente que se forma alrededor del páncreas durante la perfusión.
NOTA: Este paso es muy importante porque el gel puede obstruir el filtro en la cámara y dificultar la recolección del tejido digerido (Figura 2B). - Retire los angiocaths después de la perfusión.
- Digestión de tejidos
- Precalentar 1 litro de solución de HBSS a 36 °C. Prepare de antemano el sistema de digestión que consiste en la cámara de digestión y el tubo conectados a un sistema cerrado y transfiera el serpentín de calentamiento del circuito a un baño de agua a 36 °C.
- Corta el páncreas en 3-4 trozos y viértelos con colagenasa tipo V en un vaso de precipitados de 500 ml.
- Cubra el vaso de precipitados con una tapa de placa de Petri estéril, transfiéralo a la cabina de bioseguridad # 2 y coloque el contenido del vaso en la cámara de digestión que contiene cuatro canicas de vidrio siliconadas y una malla de 500 μm.
- Cierre la cámara y apriete los tornillos. Coloque la enzima restante en el vaso de recirculación y encienda la bomba peristáltica a una velocidad de 80 mL/min.
- Agregue una solución tibia de HBSS (generalmente alrededor de 150 mL) precalentada en el paso 5.2.1 para llenar el circuito hasta su finalización. Agite la cámara suavemente y gírela para que las canicas de vidrio siliconado golpeen el tejido.
NOTA: Dado que los islotes de cerdo son más delicados que el tejido humano, las sacudidas deben ser uniformes y lentas para evitar daños. A medida que el tejido se digiere, comenzará a desmoronarse y a salir de la cámara. - Tome una muestra (aproximadamente 1 mL) del circuito cada 2 minutos para verificar si hay islotes libres después de agitar durante 1 minuto.
- Coloque la muestra en una placa de 6 pocillos con 80 μL de ditizona (DTZ). Agregue 2 mL de solución salina tamponada con fosfato (PBS) y examine la muestra bajo el microscopio con un aumento de 40x. DTZ teñirá los islotes en rojo.
- Recogida del compendio
- Continúe la digestión hasta que se observen islotes libres (incluso si muchos todavía están parcialmente atrapados en el exocrino).
NOTA: La liberación de los islotes tarda unos 10-15 minutos, pero el tiempo de digestión suele estar influenciado por la edad del donante, los lotes de enzimas, la concentración de enzimas, etc. - Abra el circuito y recoja el pañuelo liberado en botellas de 1 L. Mantenga los frascos en hielo mientras los recolecta para ayudar a inactivar la colagenasa tipo V.
- Añada la solución tibia de HBSS restante (~850 mL, paso 5.2.1) al vaso de recirculación y recoja el tejido digerido restante de la cámara de digestión.
- Añada medio colector en frío a la cámara (a través del vaso de recirculación).
NOTA: Detenga la recolección cuando los gránulos de tejido se hagan más pequeños. La fase de recolección (pasos 5.3.2-5.3.3) puede durar hasta 40-75 min y 5-8 L de medios de recolección. - Transfiera el tejido del frasco de recolección a tubos de centrífuga cónicos de 250 ml y centrifugue a 200 x g durante 3 min a 4 °C.
- Deseche el sobrenadante y vuelva a suspender el tejido en 500 mL de medio colector fresco.
- Continúe combinando los gránulos de celda en un medio de recolección frío (500 mL) hasta que se recoja todo el digesto.
- Lavar el pellet de celda suspendido en el medio frío por centrifugación (3 min a 200 x g, 4 °C).
- Deseche el sobrenadante. Evalúe y cuantifique el pellet de celda siguiendo los pasos mencionados en las secciones 6-8.
NOTA: El volumen final depende del tamaño del páncreas, pero se espera que esté dentro de los 40-80 ml.
- Continúe la digestión hasta que se observen islotes libres (incluso si muchos todavía están parcialmente atrapados en el exocrino).
6. Purificación de islotes
- Purificar los islotes de cerdos mediante separación por gradiente de densidad.
NOTA: Consulte la Tabla de Materiales para obtener los detalles de las soluciones de gradiente de densidad utilizadas.- Agregue 2 mL de tejido pancreático a tubos cónicos de 50 mL.
- Añadir 12 mL de gradiente de polisacarosa 1119 (1,119 g/cm3) para resuspender cada 2 mL de tejido pancreático.
- Añadir 10 mL de solución de polisacarosa 1083 (1,083 g/cm3), 10 mL de solución de polisacarosa 1077 (1,077 g/cm3), 10 mL de solución de polisacarosa 1037 (1,037 g/cm3) y 5 mL de HBSS, sucesivamente.
NOTA: La solución de polisacarosa 1037 (1,037 g/cm3) se prepara mezclando solución de polisacarosa 1077 (1,077 g/cm3) y solución de purina de citrato hipertónico (38,5 mL:11,5 mL). - Centrífuga a 900 x g sin freno durante 10 min a 4 °C.
- Aspire los islotes entre las capas de solución de polisacarosa 1077 y solución de polisacarosa 1037.
- Transfiera los islotes a un tubo de centrífuga de 50 ml, distribuya uniformemente el líquido en cada tubo y equilibre antes de la centrifugación.
- Lavar los islotes de los cerdos
- Centrifugar a 200 x g durante 3 min a 4 °C, desechar el sobrenadante. Agregue el medio colector para aumentar el volumen a 45 mL.
- Centrifugar a 200 x g durante 3 min a 4 °C, dejando unos 2 mL de sobrenadante; Agite suavemente para mezclar.
- Combine todos los gránulos en el mismo tubo de centrífuga de 50 ml. Agregue el medio colector para aumentar el volumen a 45 mL.
7. Recuento de equivalentes de islotes (IEQ) y cultivo de islotes
- Tinción DTZ de islotes
- Agrupe los islotes, agregue más medio colector para aumentar el volumen a 250 ml y vuelva a suspender los islotes.
- Tome 500 μL de la muestra representativa y colóquela en un plato de 35 mm con 80 μL de DTZ. Deje que se incube a temperatura ambiente durante 1-2 minutos y luego agregue 2 ml de PBS.
- Examine con un aumento de 40x bajo un microscopio invertido. Los agregados de los islotes se tiñen de rojo por la DTZ.
- Recuento de islotes manchados
- Cuente los islotes manchados dividiéndolos en las categorías de tamaño enumeradas en la Tabla 1. Utilice el factor de conversión para determinar el equivalente de islote (IEQ) según el tamaño.
NOTA: La conversión de IEQ se lleva a cabo cuando la mayoría del diámetro de los agregados positivos para DTZ es superior a 50 μm (en preparaciones de adultos (>2 años) y algunas preparaciones de adultos jóvenes (6-12 meses) proceden al paso 7.2.4). En todos los demás casos (en cerdos jóvenes de menos de 6 meses de edad y en el resto de cerdos adultos jóvenes), el número de islotes se estimó en función del volumen de partículas o del contenido de ADN (de acuerdo con los pasos 7.2.2-7.2.3). - (OPCIONAL) Centrifugar a 200 x g a 4 °C durante 2 min para medir los palets.
- (OPCIONAL) Evalúe el contenido de ADN de islotes individuales, así como de los gránulos de células de los islotes mediante el kit de ensayo de proliferación celular. Extrapolar el número de células beta de cerdo a partir del contenido de ADN y el análisis inmunocitoquímico.
- Agregue todas las categorías y determine el IEQ total para la muestra. Multiplica ese número por el volumen de la fracción. (por ejemplo, 200 IEQs en 500 μL de una fracción de 250 mL = 200 x 2 x 250 = 100.000 IEQs).
- Cuente los islotes manchados dividiéndolos en las categorías de tamaño enumeradas en la Tabla 1. Utilice el factor de conversión para determinar el equivalente de islote (IEQ) según el tamaño.
- Cultura de los islotes
- Centrifugar los islotes a 200 x g a 4 °C durante 1 min; Deseche el sobrenadante.
- Agregue 5 mL de medio de cultivo precalentado para resuspender los islotes y transfiéralos a una placa de Petri de 150 mm.
NOTA: Vuelva a suspender 10,000 islotes/plato. - Agregue más medio de cultivo para aumentar el volumen hasta 30 mL en la placa de Petri de 150 mm.
8. Evaluación de la calidad de los islotes
- Calceína AM (CA) -Tinción de yoduro de propidio (PI) de los islotes
- Escoja a mano 50 islotes en una placa de 48 pocillos. Lavar una vez con 1 mL de HBSS.
- Añadir 200 μL de la mezcla que contiene 1x CA y 1x PI de acuerdo con las instrucciones del kit de tinción de viabilidad celular.
- Cubra la placa de Petri y colóquela en una incubadora a 37 °C durante 30 min.
- Visualice los islotes utilizando un microscopio de fluorescencia y capture las imágenes.
- Cuantifique la viabilidad contando las células vivas (verde) y las células muertas (rojo) después de la tinción con CA-PI.
- Secreción de insulina estimulada por glucosa (GSIS)
- Agregue 1 mL de solución de baja concentración de glucosa a tres pocillos de una planta de 24 pocillos.
- Después de un cultivo de al menos la noche anterior, seleccione a mano 100 islotes de tamaño similar en el rango de 100-200 μm de diámetro y transfiéralos a los tres pocillos de la placa de 24 pocillos precargada con solución de baja concentración de glucosa (como en el paso 8.2.1).
NOTA: Lave los islotes en un pocillo intermedio con HBSS antes de transferirlos al pocillo para lavar el medio de cultivo. - Incubar los islotes en una incubadora de CO2 al 5% a 37 °C durante 30 min.
- Retire el sobrenadante con cuidado con una pipeta sin tocar los islotes.
- Agregue 1 mL de nueva solución de baja concentración de glucosa.
- Incubar los islotes en una incubadora de CO2 al 5% a 37 °C durante 60 min.
- Recoja el sobrenadante (sin islotes) y transfiera al menos 500 μL al tubo de centrífuga de 1,5 mL. Este contendrá insulina secretada bajo la estimulación de baja glucosa.
- Agregue 1 mL de solución de alta concentración de glucosa cuidadosamente en los mismos pocillos.
- Incubar los islotes en una incubadora de CO2 al 5% a 37 °C durante 60 min.
- Transfiera otros 500 μL del medio de cultivo a un nuevo tubo de centrífuga de 1,5 mL. Este contendrá insulina secretada bajo la estimulación de alta glucosa.
- Utilice kits de ensayo de inmunoadsorción enzimática (ELISA) para la insulina porcina para medir la concentración de insulina liberada después de la estimulación con glucosa baja y alta (pasos 8.2.7 y 8.2.10).
NOTA: El Índice de Estimulación (IS) se calcula como la relación entre la concentración de insulina medida después de la estimulación con glucosa alta dividida por la concentración de insulina después de la estimulación con glucosa baja.
Resultados
La preparación de la cabina de bioseguridad se muestra en la Figura 1. Se establecen tres espacios operativos independientes. La cabina de bioseguridad #1 está equipada con cuencas de riñón, instrumentos quirúrgicos y vasos de precipitados para el recorte del páncreas (Figura 1A). La cabina de bioseguridad #2 está equipada con un baño de agua, una bomba peristáltica, un soporte de tubo con el tubo de recirculación y una cámara de digestión para la digestión de los islotes (Figura 1B). El gabinete de bioseguridad #3 está configurado con filtros desechables y tubos de centrífuga para la preparación de enzimas, la purificación de islotes y los siguientes pasos (Figura 1C).
El páncreas (antes y después de la perfusión enzimática) se muestra en la Figura 2. La solución de colagenasa tipo V se perfunde en todo el páncreas a través del conducto pancreático comenzando desde la cabeza del páncreas. Si el lóbulo de conexión no se perfunde con éxito, es necesario cortarlo en partes separadas y cada una debe perfundirse.
La digestión del páncreas se realiza en la cámara de digestión, como se muestra en la Figura 3. En la figura se muestra el tejido pancreático después de la interrupción mecánica y el tejido pancreático no digerido que queda después de la digestión. Una pequeña cantidad de tejido no digerido indica una digestión completa; sin embargo, también puede indicar una digestión excesiva; Por lo tanto, si entre el 15% y el 25% del órgano pancreático permanece en la cámara, es aceptable. A continuación, el tejido pancreático digerido se lava y se centrifuga en gradientes de densidad discontinuos para separar los islotes de las células acinares (purificación), como se muestra en la Figura 4. Los islotes pancreáticos se encuentran en la capa media.
La tinción DTZ de los islotes se muestra en la Figura 5. El punto en el que se detiene la digestión y comienza la recolección (es decir, cuando aparecen los islotes libres) se muestra en la Figura 5A. Los islotes de cerdo purificados después de la separación en gradiente de densidad se muestran en la Figura 5B. Los islotes en campo claro se muestran en la Figura 6A. La calidad de los islotes se examina mediante la tinción de Calceína AM (CA) - Yoduro de propidio (PI), como se muestra en la Figura 6B. Las células vivas son verdes y las células muertas son rojas. El rendimiento medio de aislamiento de islotes de este protocolo es de 360.935 ± 114.279 IEQ/páncreas y 2.439-3.252 IEQ/g de páncreas, lo que es similar al estudio anterior (333.000 ± 129.000 IEQ/páncreas). La viabilidad media de los islotes por este protocolo está por encima del 81%, ligeramente inferior al estudio previo (86,7%). Uno de los resultados representativos del índice de estimulación (SI = relación entre las cantidades de insulina (mU/L) liberadas en condiciones de glucosa alta sobre glucosa baja) obtenido por la prueba de secreción de insulina estimulada por glucosa (GSIS) medida por ELISA por este protocolo es de 1,4 ± 0,3, similar al estudio previo (1,75 ± 0,60)24. Los resultados anteriores se resumen en la Tabla 2.

Figura 1: La preparación de la cabina de bioseguridad. (A) La cabina de bioseguridad #1 muestra la cuenca del riñón, los instrumentos quirúrgicos y los vasos de precipitados en el campo estéril. (B) Cabina de bioseguridad #2 con baño de agua (de izquierda a derecha), bomba peristáltica, soporte de tubo con tubo de recirculación y tubería, y cámara de digestión. (C) Cabina de bioseguridad #3 con filtros desechables y tubos centrífugos. Haga clic aquí para ver una versión más grande de esta figura.
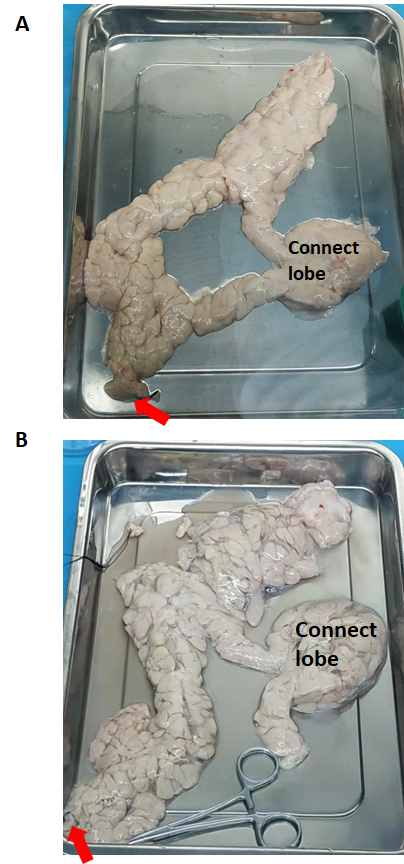
Figura 2: El páncreas antes y después de la perfusión enzimática. (A) Antes de la perfusión enzimática. (B) Páncreas distendido después de la perfusión enzimática. La flecha roja indica el flujo de la solución de colagenasa tipo V. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: El páncreas en la cámara de digestión. (A) Tejido pancreático después de la digestión y la interrupción con canicas. (B) Tejido pancreático restante después de la digestión. Haga clic aquí para ver una versión más grande de esta figura.
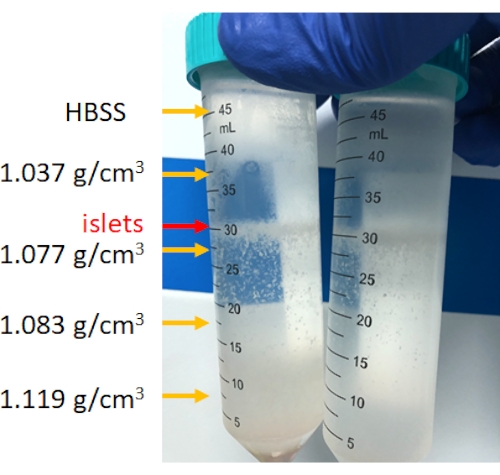
Figura 4: Estratificación de las células pancreáticas después de la centrifugación discontinua en gradiente de densidad. Después de la centrifugación, los islotes se concentrarán entre 1,077 g/cm3 y la capa de HBSS, y el sedimento del fondo es tejido no islote. Haga clic aquí para ver una versión más grande de esta figura.
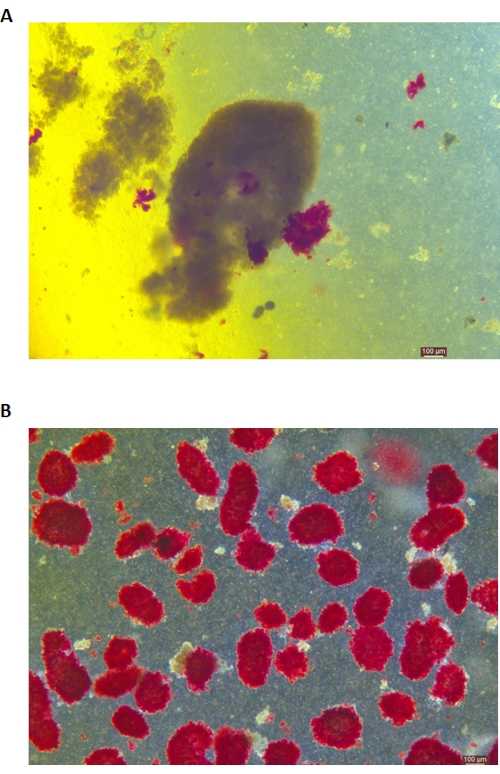
Figura 5: Tinción de ditizona (DTZ) de los islotes durante la digestión. (A) Las muestras se recogen de la sala digestiva. Los islotes de la muestra están teñidos de rojo. La señal para iniciar la recolección es cuando 1-2 islotes se liberan completamente del tejido exocrino. (B) Islotes purificados separados por gradiente de densidad discontinuo. La barra de escala es de 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
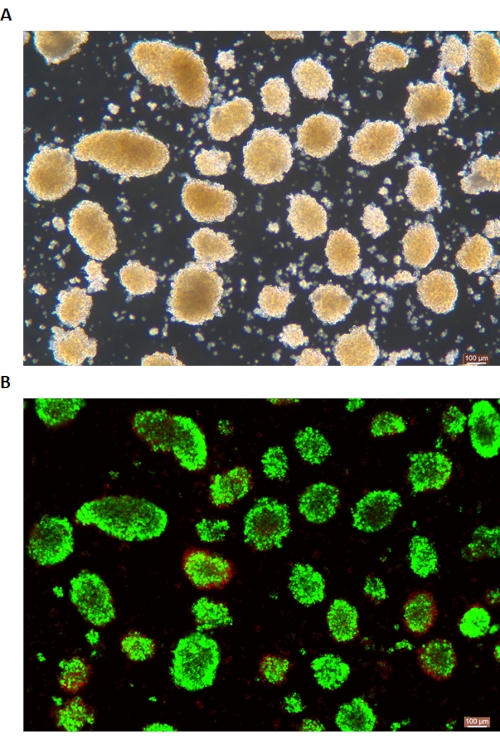
Figura 6: Tinción de viabilidad de células de islotes vivos/muertos. (A) Islotes en campo claro. (B) Calceína AM (CA) -Yoduro de propidio (PI) tinción de islotes. Las células vivas son verdes y las células muertas son rojas. La barra de escala es de 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Categoría | Rango de diámetro de islote (μm) | Factor de conversión IEQ |
| 1 | 50–100 | x 0,167 |
| 2 | 101–150 | x 0,648 |
| 3 | 151–200 | x 1.685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6.315 |
| 6 | 301–350 | x 10.352 |
| 7 | >350 | x 15.833 |
Tabla 1: Factores de conversión para calcular los equivalentes de islotes (IEQ).
| Este protocolo | Estudios previos24 | |
| Rendimiento de los islotes (IEQ/páncreas) | 360.935 ± 114.279 | 333.000 ± 129.000 |
| Viabilidad de los islotes | 81% | 86.70% |
| Índice de estimulación de la insulina de los islotes | 1,4 ± 0,3 | 1,75 ± 0,60 |
Tabla 2: Comparación de los resultados obtenidos por este protocolo con estudios previos.
Discusión
El xenotrasplante de islotes, utilizando cerdos como fuente de islotes, es un enfoque prometedor para superar la escasez de islotes humanos. A pesar de que el aislamiento de los islotes de cerdos adultos es un desafío, varios grupos establecieron protocolos para aislar con éxito los islotes de manera consistente10,11. Independientemente del método, se debe demostrar la viabilidad y las propiedades funcionales de los islotes para confirmar la alta calidad de los productos. Este protocolo se basa en los publicados 10,11 en formato de video para que sea fácil de entender y reproducir.
De acuerdo con reportes previos y nuestra experiencia, varios parámetros son críticos para el aislamiento exitoso de los islotes de cerdos adultos13,14. Los parámetros críticos incluyen (1) Edad y sexo del cerdo donante: las cerdas con más de dos camadas (las llamadas reproductoras retiradas) son preferibles a los cerdos más jóvenes porque pueden proporcionar fácilmente un gran número de islotes de alta calidad 25,26,27,28,29,30, (2) Tiempo de isquemia caliente: límite a 10 min para reducir la autodigestión14, (3) Enzima de digestión: la colagenasa tipo V es una opción válida, (4) Tiempo de digestión: es esencial detener la digestión lo suficientemente temprano para evitar la digestión excesiva. Tan pronto como se observan los islotes libres, se inicia el proceso de recolección incluso si están parcialmente atrapados. Es muy temprano en el proceso.
Este protocolo tiene varias ventajas. En comparación con gradientes de densidad continuos o discontinuos que utilizan un procesador de celdas COBE 2991 para la purificación de islotes, este protocolo supera islotes sobre soluciones de gradiente de densidad que utilizan tubos cónicos y una centrífuga estándar. Es rentable y fácil de dominar para los principiantes. Dado que este método de purificación requiere más mano de obra, la producción a granel y los pellets grandes aún pueden requerir un procesador de celdas COBE para aumentar la eficiencia.
Aquí también se analizan algunos pasos de solución de problemas. (1) Supongamos que más del 25% del tejido pancreático no se digiere, o que la mayoría de los islotes pancreáticos están cubiertos por tejido acinar. En ese caso, las posibles razones incluyen una mala perfusión, sangre residual que afecta la actividad enzimática, la baja concentración o actividad enzimática o baja temperatura durante la digestión. (2) La digestión excesiva del tejido pancreático puede provocar la fragmentación de los islotes pancreáticos. La posible razón es que el tiempo de isquemia caliente no está bien controlado, alta concentración de enzimas digestivas, exposiciones más prolongadas de los islotes digeridos a la solución de enzimas digestivas o alta temperatura de digestión. Esto solo puede evitarse mediante la estandarización de los parámetros enzimáticos/digestivos y la optimización del proceso. (3) La pérdida de la integridad de los islotes pancreáticos también puede ocurrir durante el proceso de cultivo. Algunas razones para esto incluyen la contaminación acinar que conduce a una baja pureza de los islotes pancreáticos, una densidad de cultivo de islotes demasiado alta, una nutrición insuficiente o daños mecánicos. Para superar la pérdida de la integridad de los islotes pancreáticos, aumente el volumen del medio de los islotes, aumente la densidad del medio y centrifugue los islotes más lentamente y durante menos tiempo.
En resumen, este protocolo se ha empleado con éxito para preparar islotes de cerdos adultos para ser trasplantados en receptores de primates no humanos. Se utilizará posteriormente para obtener islotes para futuras investigaciones.
Divulgaciones
Los autores no reportan conflictos de interés.
Agradecimientos
Agradecemos al profesor David K. C. Cooper (Centro de Ciencias de los Trasplantes, Hospital General de Massachusetts) por ayudarnos a establecer todo el sistema de xenotrasplantes. Agradecemos a la señorita Xingling Hu (Shenzhen Second People's Hospital), a la señorita Xiaohe Tian (Universidad de California, Berkeley), al Sr. Bo Zhou (Universidad de Boston) por su útil discusión y sugerencias. Este trabajo fue respaldado por subvenciones del Programa Nacional Clave de Investigación y Desarrollo de China (2017YFC1103701, 2017YFC1103704), Fondos Especiales para la Construcción de Hospitales de Alto Nivel en la provincia de Guangdong (2019) y el Proyecto de Medicina Sanming en Shenzhen (SZSM201812079).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Referencias
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), London, England. 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, Clifton, N.J. 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , Artechhouse. Norwood, MA. 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, Clifton, N.J. 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, Suppl 2 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados