Method Article
Isolamento delle isole di maiale adulto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo dettagliato copre le fasi metodologiche dell'isolamento delle isole di suini adulti, dalla fase di digestione alla purificazione fino alla valutazione funzionale finale delle isole. Questo schema può essere utilizzato come linea guida per l'isolamento delle isole di suini adulti negli istituti di ricerca.
Abstract
Il diabete mellito di tipo 1 (T1DM) è causato dalla distruzione autoimmune delle cellule β pancreatiche, che provoca una produzione minima o nulla di insulina. Il trapianto di isole gemine svolge un ruolo importante nel trattamento del diabete di tipo 1, con il miglioramento del controllo glicometabolico, la ridotta progressione delle complicanze, la riduzione degli episodi ipoglicemici rispetto alla terapia insulinica tradizionale. I risultati dello studio clinico di fase III hanno anche dimostrato la sicurezza e l'efficacia dell'allotrapianto di isole nel diabete di tipo 1. Tuttavia, la carenza di donatori di pancreas ne limita l'uso diffuso. Gli animali come fonte di isolotti come il maiale offrono una scelta alternativa. Poiché l'architettura del pancreas di maiale è diversa da quella delle isole dei topi o degli esseri umani, la procedura di isolamento delle isole di maiale è ancora impegnativa. Poiché la traduzione di fonti alternative di isole suine (xenogeniche) nel contesto clinico per il trattamento del T1DM attraverso il trapianto cellulare è di grande importanza, è urgentemente necessario un protocollo economico, standardizzato e riproducibile per isolare le isole suine. Questo manoscritto descrive un metodo semplificato ed economico per isolare e purificare le isole suine adulte sulla base dei precedenti protocolli che hanno trapiantato con successo le isole suine a primati non umani. Questa sarà una guida per principianti senza l'uso di apparecchiature specializzate come un processore di celle COBE 2991.
Introduzione
Il diabete mellito di tipo 1 (T1DM) è una malattia grave in cui la distruzione autoimmune delle cellule beta provoca una produzione di insulina scarsa o assente 1,2,3. Un gruppo consistente di pazienti con diabete di tipo 1 non è in grado di stabilizzare la labilità glicemica con la terapia insulinica e sperimenta episodi ipoglicemici potenzialmente letali. Il trapianto di isole, quando ha successo, può raggiungere questo obiettivo. Oltre 1.500 pazienti diabetici sono stati sottoposti con successo al trapianto di isole in tutto il mondo, mostrando un rischio inferiore ma un successo a lungo termine rispetto al trapianto di pancreas4.
Rispetto alla terapia insulinica, il trapianto di isole ha risultati migliori nel ridurre la progressione delle complicanze5. I risultati dello studio clinico di fase III hanno anche dimostrato la sicurezza e l'efficacia dell'allotrapianto di isole nel T1DM 6,7. Il trapianto di isole può essere la migliore opzione terapeutica attualmente disponibile per i pazienti con diabete di tipo 1 che sperimentano episodi ipoglicemici potenzialmente letali.
Tuttavia, la carenza di isole allogeniche umane da donatore limita l'uso diffuso del trapianto di isole 8,9. Pertanto, l'uso di isole animali come sostituto è auspicabile10. Il maiale è stato scelto come donatore per le cellule insulari nello xenotrapianto preclinico, ed è di potenziale traducibilità alla clinica a causa di 1) disponibilità, 2) somiglianze metaboliche con l'uomo, 3) massa di cellule beta piuttosto grande e 4) possibilità di ingegneria genetica per migliorare la compatibilità immunologica con l'uomo11.
L'elevata purezza e vitalità delle isole sono passaggi chiave per il successo dello xenotrapianto. Tuttavia, la procedura per isolare le isole da donatori di suini adulti è impegnativa a causa dell'architettura del pancreas stesso, che differisce dalle isole dei topi o degli esseri umani12. In generale, la forma delle isole pancreatiche suine non è compatta12. Rispetto alle isole pancreatiche umane e dei roditori, le isole di maiale si dissociano più facilmente12. Tuttavia, la dissociazione spontanea dello strato esterno delle cellule insulari, accompagnata da un lungo tempo di coltura, porta a una sostanziale riduzione della dimensione10 delle isole pancreatiche.
Durante il processo di isolamento delle isole, molti fattori influenzano la qualità delle isole, come l'età del donatore, il tempo di ischemia caldo, l'attività enzimatica, la distensione per iniezione enzimatica13,14. Sebbene molti studi precedenti abbiano fornito metodi per l'isolamento delle isole di maiale, non esiste un protocollo video dettagliato passo dopo passo per i ricercatori come istruzione efficace 10,15,16,17,18,19,20,21,22,23.
A tal fine, questo protocollo dettagliato copre tutte le fasi dell'isolamento, dal prelievo degli organi alla valutazione funzionale post-isolamento delle isole, sperando di offrire una panoramica semplice e comprensibile del processo per una facile applicabilità. Questo protocollo si basa sui metodi precedentemente pubblicati con le modifiche 10,11.
Protocollo
Tutte le procedure che coinvolgono gli animali sono approvate dal comitato istituzionale per la cura e l'uso degli animali del Secondo Ospedale del Popolo di Shenzhen e seguono tutte le normative nazionali. In questo protocollo, i suini Duroc-Landrace-Yorkshire (~6 mesi di età) acquistati dal mercato sono stati utilizzati come donatori pancreatici. Il peso del pancreas raccolto è stato di 123,63 g ± 22,50 g. Durante gli esperimenti vengono indossati dispositivi di protezione individuale, inclusi indumenti protettivi, maschere, guanti e berretti.
1. Preparazione dei terreni
- Terreno di pulizia: Per preparare 100 ml di terreno di pulizia, mescolare la soluzione salina bilanciata di Hank (HBSS), il siero suino al 2%, 20 mM di acido 4-(2-idrossietil)-1-piperazineetansolfonico (HEPES) e l'1% di penicillina-streptomicina (P/S).
- Mezzo di raccolta: Miscelare RPMI 1640 con il 5% di siero suino e l'1% di penicillina-streptomicina (P/S).
- Terreno di coltura: Miscelare CMRL 1066 con il 10% di siero suino, 10 mmol/L di nicotinamide, 1% di P/S e 2 mmol/L di L-glutammina.
- Soluzione enzimatica: Preparare 1 mg/mL di soluzione di collagenasi di tipo V (attività: 918 unità/mg solido) in HBSS.
- Soluzione a bassa concentrazione di glucosio: per preparare una soluzione a bassa concentrazione di glucosio, aggiungere lo 0,5% di albumina sierica bovina (BSA) e 2,8 mM di D-glucosio a 1 mL di tampone bicarbonato Ringer di Kreb (KRBB).
- Soluzione ad alta concentrazione di glucosio: per preparare una soluzione ad alta concentrazione di glucosio, aggiungere lo 0,5% di albumina sierica bovina (BSA) e 28 mM di D-glucosio a 1 mL di tampone bicarbonato Ringer di Kreb (KRBB).
2. Recupero del pancreas
- Anestesia suina e preparazione della pelle
- Anestetizzare il suino donatore con iniezione intramuscolare di anestetici Lumianning (2,5-5 mg/kg) e Propofol (2-3 mg/kg) (vedere la Tabella dei materiali per i dettagli).
- Mantenere l'anestesia con isoflurano all'1%-3% in un volume di ventilazione di 1-1,5 L/min mediante maschere per anestesia a gas.
- Monitorare la frequenza cardiaca per confermare la corretta anestesia. Usa un unguento veterinario sugli occhi per prevenire la secchezza durante l'anestesia.
- Radere l'addome, pulirlo con iodoforo e coprire adeguatamente il maiale con un telo chirurgico sterile.
- Apertura dell'addome
- Dopo aver assicurato le condizioni sterili, praticare un'incisione laparotomica sulla linea mediana dallo xifoide all'ombelico leggermente vicino alla coda.
- Incidere il diaframma.
- Isolare l'aorta sopraepatica e la vena cava inferiore sopraepatica (IVC) utilizzando una pinza vascolare, quindi isolare l'aorta infrarenale e l'IVC infraepatica con lo stesso metodo.
- Somministrare eparina per via endovenosa (100 U/kg) al suino per prevenire la coagulazione del sangue.
- Esteriorizzare l'intestino tenue e crasso e spingere il fegato e lo stomaco verso la testa per esporre completamente il pancreas.
- Perfusione del pancreas
- Bloccare l'aorta sopra il diaframma con una pinza vascolare, intubare l'aorta sopra il ramo dell'aorta renale tramite la cannula aortica (16 G) e legare con un filo di sutura 2-0.
- Infondere l'animale con 2-3 litri di soluzione fredda di HBSS (precedentemente insaccata e mantenuta a 4 °C) attraverso la cannula aortica (16 G). Infondere la soluzione HBSS attraverso la cannula aortica per gravità, mentre l'IVC sopraepatico e l'IVC vengono sezionati per rilasciare il liquido di perfusione.
NOTA: Continuare l'infusione fino a quando il deflusso dell'IVC non è chiaro.
- Escissione del pancreas
- Staccare l'omento, trovare il pancreas e i lobi della milza insieme alla milza e separarli.
- Separare il lobo collegato del pancreas con il tessuto adiacente.
- Trova il dotto pancreatico principale nella parte discendente del duodeno. Legare il dotto biliare con una sutura (2-0) e sezionarlo con le forbici vicino al dotto pancreatico.
- Bloccare una sezione del duodeno contenente l'ampolla di Vater su entrambi i lati della testa del pancreas con una pinza vascolare, quindi resecare il duodeno con le forbici.
- Estrarre l'intero pancreas, immergerlo in HBSS freddo e trasportarlo immediatamente alla struttura di isolamento delle isole.
NOTA: I suini sono stati soppressi con pentobarbital sodico (100-200 mg/kg). L'infusione intraduttale di HBSS o di soluzione conservante può essere utilizzata per distendere il pancreas nel sito di prelievo degli organi se il pancreas viene prelevato presso il macello locale.
3. Preparare tre cappe di biosicurezza per i seguenti esperimenti
- Allestire la cabina di biosicurezza #1 con bacinella renale, strumenti chirurgici e becher per la pulizia del pancreas (sezione 4, Figura 1A).
- Allestire la cabina di biosicurezza #2 con un bagno d'acqua, una pompa peristaltica, un supporto per tubi con il tubo di ricircolo e una camera di digestione per la digestione delle isole (sezione 5, Figura 1B).
- Installare la cabina di biosicurezza #3 con filtri monouso e provette da centrifuga per la preparazione degli enzimi, la purificazione delle isole e i passaggi successivi (sezioni 6-8, Figura 1C).
4. Pulizia del pancreas
- Pulite e pesate il pancreas.
- Sciacquare il pancreas in 200 ml di iodoforo per 3 minuti nella cabina di biosicurezza #1. Sciacquare il pancreas in 200 ml di HBSS freddo due volte, 2 minuti ciascuna.
- Mettere il pancreas pulito in una bacinella renale contenente 100 ml di terreno detergente su ghiaccio.
- Tenere l'ampolla serrata, resecare il duodeno. Pulisci il pancreas dal grasso esterno e dal tessuto connettivo.
- Pesare il pancreas.
5. Digestione del pancreas
- Infuso di collagenasi
- Tagliare una sezione trasversale di uno dei rami anulari del pancreas e inserire un angiocath da 18 G (se i diametri del dotto sono più piccoli, considerare un angiocath da 20 G) nel dotto pancreatico principale e suturarlo in posizione con una sutura di seta intrecciata 2-0.
- Tagliare il ponte tissutale che passa attraverso il lobo di collegamento vicino alla testa del pancreas e bloccare il catetere sul lato dell'incisione vicino alla testa del pancreas per ridurre la perdita di enzimi.
- Posizionare più angiocath per una migliore infusione intraduttale di enzimi. Per questo, inserire ulteriori angiocati (dimensione 20-22 G) dopo aver sezionato l'organo pancreatico per esporre il dotto.
- Installare la tubazione di riempimento, compreso un tubo in silicone da 1 m (16#) con un connettore Luer-lock. La sezione centrale del tubo è incorporata nella testa della pompa peristaltica.
- Accendere la pompa peristaltica per riempire il sistema di tubi (dimensione del tubo 16#) 300 mL di 1 mg/mL, collagenasi di tipo V (attività: 918 unità/mg) preriscaldato a 24 °C e rimuovere le bolle d'aria nelle tubazioni.
- Collegare il tubo di perfusione all'angiocath e accendere la pompa peristaltica alla velocità di 20 mL/min.
- Arrestare la perfusione quando la maggior parte dell'enzima è stata infusa e il pancreas è ben disteso (Figura 2B).
- Tagliare il tessuto gelatinoso chiaro che si forma intorno al pancreas durante la perfusione.
NOTA: Questo passaggio è molto importante perché il gel può ostruire il filtro nella camera e rendere difficile la raccolta del tessuto digerito (Figura 2B). - Rimuovere gli angiocati dopo l'infusione.
- Digestione dei tessuti
- Preriscaldare 1 L di soluzione HBSS a 36 °C. Preparare preventivamente il sistema di digestione costituito dalla camera di digestione e dai tubi collegati in un sistema chiuso e trasferire la serpentina di riscaldamento del circuito in un bagno d'acqua a 36 °C.
- Tagliare il pancreas in 3-4 pezzi e versarli con Collagenasi di tipo V in un becher da 500 ml.
- Coprire il becher con un coperchio sterile per piastre di Petri, trasferirlo nella cabina di biosicurezza #2 e mettere il contenuto del becher nella camera di digestione contenente quattro biglie di vetro siliconate e una rete da 500 μm.
- Chiudere la camera e serrare le viti. Inserire l'enzima rimanente nel becher a ricircolo e accendere la pompa peristaltica a una velocità di 80 mL/min.
- Aggiungere la soluzione calda di HBSS (in genere circa 150 ml) preriscaldata al passaggio 5.2.1 per riempire il circuito fino al completamento. Agitare delicatamente la camera e capovolgerla in modo che le biglie di vetro siliconato colpiscano il tessuto.
NOTA: Poiché le isole di maiale sono più delicate del tessuto umano, gli scuotimenti dovrebbero essere regolari e lenti per evitare danni. Man mano che il tessuto viene digerito, inizierà a sfaldarsi e a defluire fuori dalla camera. - Prelevare un campione (circa 1 ml) dal circuito ogni 2 minuti per verificare la presenza di isole libere dopo aver agitato per 1 minuto.
- Collocare il campione in una piastra a 6 pozzetti con 80 μL di ditizone (DTZ). Aggiungere 2 mL di soluzione salina tamponata con fosfato (PBS) ed esaminare il campione al microscopio con ingrandimento 40x. DTZ colorerà le isole di rosso.
- Raccolta del digest
- Continuare la digestione fino a quando non si osservano isole libere (anche se molte sono ancora parzialmente intrappolate nell'esocrino).
NOTA: Il rilascio delle isole richiede circa 10-15 minuti, ma il tempo di digestione è spesso influenzato dall'età del donatore, dai lotti di enzimi, dalla concentrazione dell'enzima, ecc. - Aprire il circuito e raccogliere il fazzoletto rilasciato in flaconi da 1 L. Tenere le bottiglie sul ghiaccio durante la raccolta per aiutare a inattivare la collagenasi di tipo V.
- Aggiungere la soluzione calda di HBSS rimanente (~850 mL, passaggio 5.2.1) al becher di ricircolo e raccogliere il tessuto digerito rimanente dalla camera di digestione.
- Aggiungere il terreno di raccolta freddo alla camera (tramite il becher a ricircolo).
NOTA: Interrompere la raccolta quando i pellet di tessuto diventano più piccoli. La fase di raccolta (passaggi 5.3.2-5.3.3) potrebbe richiedere fino a 40-75 minuti e 5-8 L di terreno di raccolta. - Trasferire il fazzoletto dal flacone di raccolta in provette da centrifuga coniche da 250 ml e centrifugare a 200 x g per 3 minuti a 4 °C.
- Scartare il surnatante e risospendere il fazzoletto in 500 mL di terreno di raccolta fresco.
- Continuare a combinare i pellet cellulari in un terreno di raccolta freddo (500 mL) fino a quando tutto il digestato non è raccolto.
- Lavare il pellet di cella sospeso nel mezzo freddo mediante centrifugazione (3 min a 200 x g, 4 °C).
- Scartare il surnatante. Valutare e quantificare il pellet cellulare seguendo i passaggi indicati nelle sezioni 6-8.
NOTA: Il volume finale dipende dalle dimensioni del pancreas, ma si prevede che sia compreso tra 40 e 80 ml.
- Continuare la digestione fino a quando non si osservano isole libere (anche se molte sono ancora parzialmente intrappolate nell'esocrino).
6. Depurazione delle isole
- Purificare le isole di maiale mediante separazione in gradiente di densità.
NOTA: Fare riferimento alla Tabella dei materiali per i dettagli delle soluzioni di gradiente di densità utilizzate.- Aggiungere 2 mL di tessuto pancreatico a provette coniche da 50 mL.
- Aggiungere 12 mL di gradiente di polisaccarosio 1119 (1,119 g/cm3) per risospendere ogni 2 mL di tessuto pancreatico.
- Aggiungere successivamente 10 mL di soluzione di polisaccarosio 1083 (1,083 g/cm3), 10 mL di soluzione di polisaccarosio 1077 (1,077 g/cm3), 10 mL di soluzione di polisaccarosio 1037 (1,037 g/cm3) e 5 mL di HBSS.
NOTA: La soluzione di polisaccarosio 1037 (1,037 g/cm3) viene preparata mescolando la soluzione di polisaccarosio 1077 (1,077 g/cm3) e la soluzione di purina citrato ipertonica (38,5 mL:11,5 mL). - Centrifugare a 900 x g senza freno per 10 min a 4 °C.
- Aspirare le isole tra gli strati della soluzione di polisaccarosio 1077 e della soluzione di polisaccarosio 1037.
- Trasferire le isole in una provetta da centrifuga da 50 ml, distribuire uniformemente il liquido in ciascuna provetta e bilanciare prima della centrifugazione.
- Lavare le isole di maiale
- Centrifugare a 200 x g per 3 minuti a 4 °C, eliminare il surnatante. Aggiungere il terreno di raccolta per portare il volume a 45 mL.
- Centrifugare a 200 x g per 3 min a 4 °C, lasciando circa 2 mL di surnatante; Agitare delicatamente per mescolare.
- Unire tutti i pellet nella stessa provetta da centrifuga da 50 ml. Aggiungere il terreno di raccolta per portare il volume a 45 mL.
7. Conteggio degli equivalenti delle isole (IEQ) e della cultura delle isole
- Colorazione DTZ di isole
- Raggruppare le isole, aggiungere altro terreno di raccolta per portare il volume fino a 250 ml e risospendere le isole.
- Prelevare 500 μl del campione rappresentativo e metterlo in una piastra da 35 mm con 80 μl di DTZ. Lasciarlo incubare a temperatura ambiente per 1-2 minuti, quindi aggiungere 2 ml di PBS.
- Esamina con un ingrandimento di 40x al microscopio invertito. Gli aggregati delle isole sono colorati in rosso dalla DTZ.
- Conteggio delle isole macchiate
- Contare le isole colorate dividendole nelle categorie di dimensioni elencate nella Tabella 1. Utilizzare il fattore di conversione per determinare l'equivalente dell'isolotto (IEQ) in base alle dimensioni.
NOTA: La conversione IEQ viene effettuata quando la maggior parte del diametro degli aggregati DTZ-positivi è maggiore di 50 μm (nelle preparazioni adulte (>2 anni) e in alcune preparazioni di giovani adulti (6-12 mesi) procedere al passaggio 7.2.4). In tutti gli altri casi (nei suini giovani di età inferiore a 6 mesi e nei restanti suini giovani adulti), il numero di isole è stato stimato in base al volume delle particelle o al contenuto di DNA (secondo le fasi 7.2.2-7.2.3). - (FACOLTATIVO) Centrifugare a 200 x g a 4 °C per 2 minuti per misurare i pallet.
- (FACOLTATIVO) Valutare il contenuto di DNA delle singole isole e dei pellet di cellule insulari mediante il kit di saggio sulla proliferazione cellulare. Estrapolare il numero di cellule beta di maiale dal contenuto di DNA e dall'analisi immunocitochimica.
- Aggiungere tutte le categorie e determinare l'IEQ totale per il campione. Moltiplica quel numero per il volume della frazione. (ad esempio, 200 IEQ in 500 μL di una frazione di 250 mL = 200 x 2 x 250 = 100.000 IEQ).
- Contare le isole colorate dividendole nelle categorie di dimensioni elencate nella Tabella 1. Utilizzare il fattore di conversione per determinare l'equivalente dell'isolotto (IEQ) in base alle dimensioni.
- Cultura dell'isolotto
- Centrifugare le isole a 200 x g a 4 °C per 1 min; Eliminare il surnatante.
- Aggiungere 5 mL di terreno di coltura preriscaldato per risospendere le isole e trasferire in una piastra di Petri da 150 mm.
NOTA: Risospendere 10.000 isolotti/parabola. - Aggiungere altro terreno di coltura per portare il volume fino a 30 mL nella piastra di Petri da 150 mm.
8. Valutazione della qualità delle isole
- Colorazione con calceina AM (CA) -ioduro di propidio (PI) di isole
- Prelevare manualmente 50 isolotti in una piastra a 48 pozzetti. Lavare una volta con 1 ml di HBSS.
- Aggiungere 200 μl della miscela contenente 1x CA e 1x PI secondo le istruzioni del kit di colorazione della vitalità cellulare.
- Coprite la capsula di Petri e mettetela in un'incubatrice a 37 °C per 30 minuti.
- Visualizza le isole utilizzando un microscopio a fluorescenza e cattura le immagini.
- Quantificare la vitalità contando le cellule vive (verde) e le cellule morte (rosso) dopo la colorazione CA-PI.
- Secrezione di insulina stimolata dal glucosio (GSIS)
- Aggiungere 1 mL di soluzione a bassa concentrazione di glucosio a tre pozzetti di un impianto a 24 pozzetti.
- Dopo almeno una notte di coltura, prelevare manualmente 100 isolotti di dimensioni simili nell'intervallo di 100-200 μm di diametro e trasferirli nei tre pozzetti della piastra a 24 pozzetti pre-riempita con una soluzione a bassa concentrazione di glucosio (come al punto 8.2.1).
NOTA: Lavare gli isolotti in un pozzetto intermedio con HBSS prima di trasferirli nel pozzetto per lavare il terreno di coltura. - Incubare le isole in un'incubatrice al 5% di CO2 a 37 °C per 30 minuti.
- Rimuovere il surnatante con cautela con una pipetta senza toccare le isole.
- Aggiungere 1 mL di nuova soluzione a bassa concentrazione di glucosio.
- Incubare le isole in un incubatore al 5% di CO2 a 37 °C per 60 minuti.
- Raccogliere il surnatante (senza isole) e trasferirne almeno 500 μL in una provetta da centrifuga da 1,5 mL. Questo conterrà insulina secreta sotto bassa stimolazione del glucosio.
- Aggiungere con cautela 1 mL di soluzione ad alta concentrazione di glucosio negli stessi pozzetti.
- Incubare le isole in un incubatore al 5% di CO2 a 37 °C per 60 minuti.
- Trasferire altri 500 μl del terreno di coltura in una nuova provetta da centrifuga da 1,5 mL. Questo conterrà insulina secreta sotto stimolazione glicemica elevata.
- Utilizzare kit ELISA (Enzyme-Linked Immunosorbent Assay) per l'insulina suina per misurare la concentrazione di insulina rilasciata dopo una stimolazione glicemica bassa e alta (passaggi 8.2.7 e 8.2.10).
NOTA: L'indice di stimolazione (SI) è calcolato come il rapporto tra la concentrazione di insulina misurata a seguito di un'elevata stimolazione del glucosio divisa per la concentrazione di insulina a seguito di una bassa stimolazione del glucosio.
Risultati
La preparazione della cabina di biosicurezza è illustrata nella Figura 1. Sono allestiti tre spazi operativi indipendenti. La cabina di biosicurezza #1 è dotata di vasche renali, strumenti chirurgici e becher per il taglio del pancreas (Figura 1A). La cabina di biosicurezza #2 è dotata di un bagno d'acqua, una pompa peristaltica, un supporto per tubi con il tubo di ricircolo e una camera di digestione per la digestione delle isole (Figura 1B). La cabina di biosicurezza #3 è dotata di filtri monouso e provette da centrifuga per la preparazione degli enzimi, la purificazione delle isole e le fasi successive (Figura 1C).
Il pancreas (prima e dopo la perfusione enzimatica) è mostrato nella Figura 2. La soluzione di collagenasi di tipo V viene perfusa nell'intero pancreas attraverso il dotto pancreatico a partire dalla testa del pancreas. Se il lobo di collegamento non viene perfuso correttamente, deve essere tagliato in pezzi separati e ciascuno di essi deve essere perfuso.
La digestione del pancreas viene eseguita nella camera di digestione, come mostrato nella Figura 3. Nella figura è mostrato il tessuto pancreatico dopo l'interruzione meccanica e il tessuto pancreatico non digerito che rimane dopo la digestione. Una piccola quantità di tessuto non digerito indica una digestione completa; tuttavia, può anche indicare una digestione eccessiva; Pertanto, se il 15%-25% dell'organo pancreatico rimane nella camera, è accettabile. Il tessuto pancreatico digerito viene quindi lavato e centrifugato su gradienti di densità discontinui per separare le isole dalle cellule acinose (purificazione), come mostrato nella Figura 4. Le isole pancreatiche si trovano nello strato intermedio.
La colorazione DTZ delle isole è mostrata nella Figura 5. Il punto in cui la digestione viene interrotta e inizia la raccolta (cioè quando compaiono le isole libere) è mostrato nella Figura 5A. Le isole di suino purificate dopo la separazione in gradiente di densità sono mostrate nella Figura 5B. Le isole in campo chiaro sono mostrate nella Figura 6A. La qualità delle isole viene esaminata mediante colorazione con Calceina AM (CA) -Ioduro di Propidio (PI), come mostrato nella Figura 6B. Le cellule vive sono verdi e le cellule morte sono rosse. La resa media di isolamento delle isole di questo protocollo è di 360.935 ± 114.279 IEQ/pancreas e 2.439-3.252 IEQ/g del pancreas, che è simile allo studio precedente (333.000 ± 129.000 IEQ/pancreas). La vitalità media dell'isola con questo protocollo è superiore all'81%, che è leggermente inferiore allo studio precedente (86,7%). Uno dei risultati rappresentativi dell'indice di stimolazione (SI = il rapporto tra le quantità di insulina (mU/L) rilasciate durante condizioni di glucosio alto rispetto a condizioni di glucosio basso) ottenuto dal test di secrezione di insulina stimolata dal glucosio (GSIS) misurato mediante ELISA con questo protocollo è 1,4 ± 0,3, che è simile allo studio precedente (1,75 ± 0,60)24. I risultati di cui sopra sono riassunti nella Tabella 2.

Figura 1: La preparazione della cappa di biosicurezza. (A) La cappa di biosicurezza #1 mostra la vasca renale, gli strumenti chirurgici e i becher nel campo sterile. (B) Armadio di biosicurezza #2 con bagnomaria (da sinistra a destra), pompa peristaltica, supporto per tubi con tubo e tubi di ricircolo e camera di digestione. (C) Armadio di biosicurezza #3 con filtri monouso e provette da centrifuga. Clicca qui per visualizzare una versione più grande di questa figura.
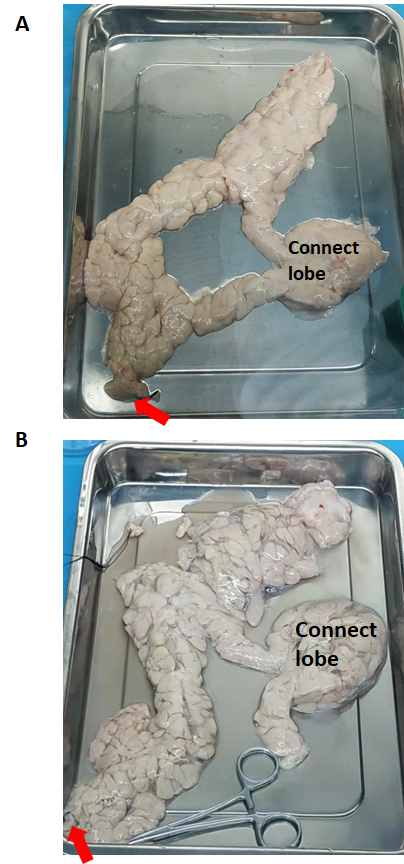
Figura 2: Il pancreas prima e dopo la perfusione enzimatica. (A) Prima della perfusione enzimatica. (B) Pancreas dilatato dopo perfusione enzimatica. La freccia rossa indica il flusso della soluzione di Collagenasi di Tipo V. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Il pancreas nella camera di digestione. (A) Tessuto pancreatico dopo la digestione e la rottura con le biglie. (B) Tessuto pancreatico che rimane dopo la digestione. Clicca qui per visualizzare una versione più grande di questa figura.
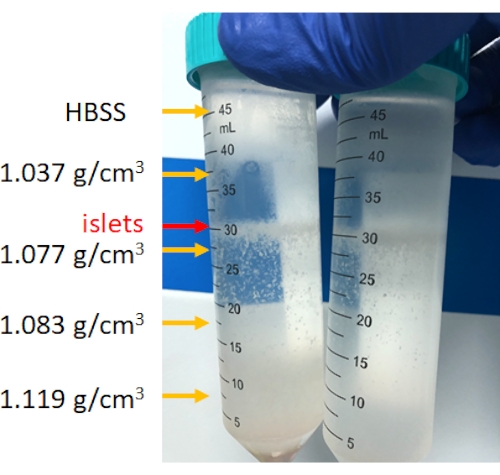
Figura 4: Stratificazione delle cellule pancreatiche dopo centrifugazione discontinua in gradiente di densità. Dopo la centrifugazione, le isole saranno concentrate tra 1,077 g/cm3 e lo strato HBSS e il sedimento di fondo è tessuto non insulare. Clicca qui per visualizzare una versione più grande di questa figura.
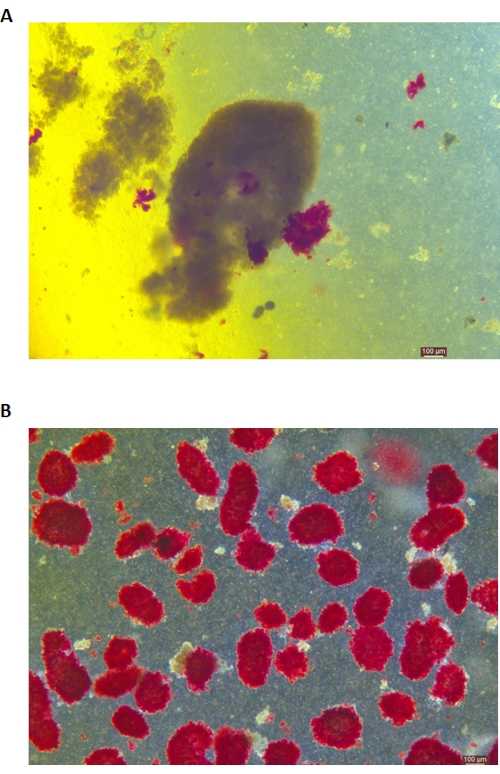
Figura 5: Colorazione con ditizone (DTZ) delle isole durante la digestione. (A) I campioni vengono raccolti dalla sala digestiva. Le isole nel campione sono tinte di rosso. Il segnale per iniziare la raccolta è quando 1-2 isole sono completamente rilasciate dal tessuto esocrino. (B) Isole purificate separate da gradiente di densità discontinuo. La barra della scala è di 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
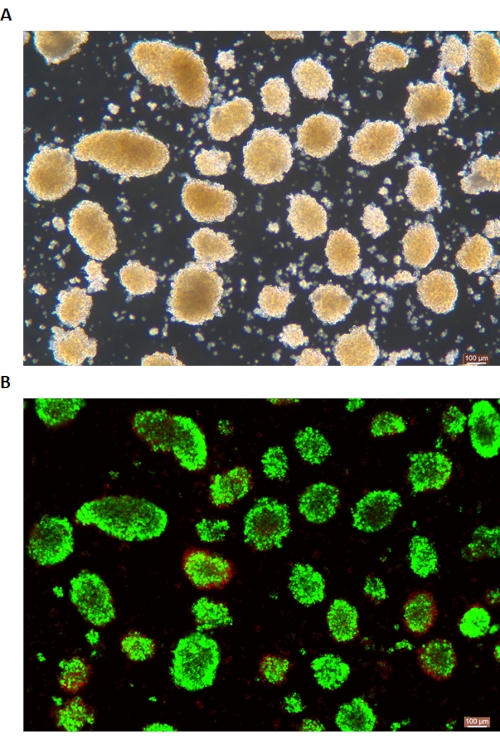
Figura 6: Colorazione della vitalità delle cellule insulari vive/morte. (A) Isolotti in campo chiaro. (B) Colorazione di ioduro di calceina AM (CA) -propidio (PI) di isolotti. Le cellule vive sono verdi e le cellule morte sono rosse. La barra della scala è di 100 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Categoria | Gamma di diametri dell'isolotto (μm) | Fattore di conversione IEQ |
| 1 | 50–100 | x 0,167 |
| 2 | 101–150 | x 0,648 |
| 3 | 151–200 | x 1,685 |
| 4 | 201–250 | x 3.500 |
| 5 | 251–300 | x 6,315 |
| 6 | 301–350 | x 10,352 |
| 7 | >350 | x 15.833 |
Tabella 1: Fattori di conversione per il calcolo degli equivalenti delle isole (IEQ).
| Questo protocollo | Studi precedenti24 | |
| Resa delle isole (IEQ/pancreas) | 360.935 ± 114.279 | 333.000 ± 129.000 |
| Viabilità dell'isolotto | 81% | 86.70% |
| Indice di stimolazione insulinica delle isole | 1,4 ± 0,3 | 1,75 ± 0,60 |
Tabella 2: Confronto dei risultati ottenuti da questo protocollo con studi precedenti.
Discussione
Lo xenotrapianto di isole, che utilizza i maiali come fonte di isolotti, è un approccio promettente per superare la carenza di isolotti umani. Sebbene l'isolamento delle isole di maiale adulte sia impegnativo, diversi gruppi hanno stabilito protocolli per isolare con successo le isole in modo coerente10,11. Indipendentemente dal metodo, la vitalità e le proprietà funzionali delle isole devono essere dimostrate per confermare l'alta qualità dei prodotti. Questo protocollo si basa su quelli pubblicatiil 10,11 in formato video in modo da essere di facile comprensione e riproduzione.
Secondo i rapporti precedenti e la nostra esperienza, diversi parametri sono fondamentali per il successo dell'isolamento delle isole di suini adulti13,14. I parametri critici includono (1) l'età e il sesso del suino donatore: le femmine con più di due cucciolate (le cosiddette riproduttrici in pensione) sono preferite rispetto ai suini più giovani perché possono facilmente fornire un gran numero di isole di alta qualità 25,26,27,28,29,30, (2) Tempo di ischemia calda: limite a 10 minuti per ridurre l'autodigestione14, (3) Enzima della digestione: la collagenasi di tipo V è un'opzione valida, (4) Tempo di digestione: è essenziale interrompere la digestione abbastanza presto per evitare una digestione eccessiva. Non appena si osservano gli isolotti liberi, viene avviato il processo di raccolta anche se sono parzialmente intrappolati. È molto presto nel processo.
Questo protocollo presenta diversi vantaggi. Rispetto ai gradienti di densità continui o discontinui che utilizzano un processore di celle COBE 2991 per la purificazione delle isole, questo protocollo stratifica le isole su soluzioni a gradiente di densità utilizzando tubi conici e una centrifuga standard. È economico e facile da padroneggiare per i principianti. Poiché questo metodo di purificazione richiede più lavoro manuale, la produzione di massa e i pellet di grandi dimensioni possono comunque richiedere un processore di celle COBE per aumentare l'efficienza.
Qui vengono illustrati anche alcuni passaggi per la risoluzione dei problemi. (1) Supponiamo che più del 25% del tessuto pancreatico non sia digerito, o che la maggior parte delle isole pancreatiche siano ricoperte da tessuto acinose. In tal caso, le possibili ragioni includono una scarsa perfusione, sangue residuo che influisce sull'attività enzimatica, bassa concentrazione o attività enzimatica o bassa temperatura durante la digestione. (2) Un'eccessiva digestione del tessuto pancreatico può portare alla frammentazione delle isole pancreatiche. La possibile ragione è che il tempo di ischemia calda non è ben controllato, l'alta concentrazione di enzimi digestivi, l'esposizione più lunga delle isole digerite alla soluzione di enzimi digestivi o l'alta temperatura di digestione. Questo può essere evitato solo con la standardizzazione dei parametri enzimatici/di digestione e l'ottimizzazione del processo. (3) Durante il processo di coltura può verificarsi anche la perdita dell'integrità delle isole pancreatiche. Alcune ragioni di ciò includono la contaminazione acinare che porta a una bassa purezza delle isole pancreatiche, una densità di coltura troppo elevata delle isole, una nutrizione insufficiente o danni meccanici. Per superare la perdita di integrità delle isole pancreatiche, aumentare il volume del terreno insulare, aumentare la densità del terreno e centrifugare le isole più lentamente e per un tempo più breve.
In sintesi, questo protocollo è stato impiegato con successo per preparare isole di maiale adulte da trapiantare in riceventi di primati non umani. Sarà inoltre utilizzato per ottenere isolotti per future indagini.
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Ringraziamo il professor David K. C. Cooper (Center for Transplantation Sciences, Massachusetts General Hospital) per averci aiutato a mettere a punto l'intero sistema di xenotrapianto. Ringraziamo la signorina Xingling Hu (Shenzhen Second People's Hospital), la signorina Xiaohe Tian (Università della California, Berkeley), il signor Bo Zhou (Boston University) per l'utile discussione e i suggerimenti. Questo lavoro è stato sostenuto da sovvenzioni del National Key R&D Program of China (2017YFC1103701, 2017YFC1103704), dai fondi speciali per la costruzione di ospedali di alto livello nella provincia del Guangdong (2019) e dal Sanming Project of Medicine a Shenzhen (SZSM201812079).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.22 µm 500 mL disposable filter | Corning | 431097 | |
| 1 L Plastic blue cap bottle | Celltrans | YKBH1 | |
| 10 mL, 25 mL disposable pipette | CORNING | 4488 | |
| 150 mm Petri dish | BIOLGIX | 66-1515 | |
| 1x HBSS basic | GIBCO | C14175500BT | |
| 200 mL conical centrifuge bottle | Falcon | 352075 | |
| 50 mL centrifuge tube | NEST | 602052/430829 | |
| 500 mL Ricordi Chamber | Biorep | 600-MDUR-03 | |
| 500-micron mesh | Yikang | YKBE | |
| 6 well-plate | COSTAR | 3511 | |
| Angiocatheter (16G, 18G, 20G) | BD | 682245, 383005, 383012 | |
| Anesthesia Machine | RWD | R620-S1 | |
| Anesthetics A: Lumianning (2.5–5 mg/kg) | Huamu, China | Animal Drugs GMP (2015) 070011777 | |
| Anesthetics B: Propofol (2–3 mg/kg) | Sigma Aldrich | S30930-100g | |
| Beaker (500 mL, 1000 mL) | Shuniu | SB500ml, SB1000ml | |
| Blood glucose meter | Sinocare | 2JJA0R05232 | |
| Blood glucose test strips | Sinocare | 41120 | |
| Calcein/PI cell viability assay kit | Beyotime | C2015M | |
| CMRL 1066 | Thermo Fisher scientific | 11530037 | |
| Collagenase V | Sigma Aldrich | C9263 | |
| CyQUANT cell proliferation assay kit | Molecular Probes | C7026 | |
| Digestive tract | Celltrans | YKBAO | |
| Disposable blood collection needle | FKE | 20153152149 | |
| Dithizone | Sigma Aldrich | D5130 | |
| Drapes | Xinwei | 20182640332 | |
| Flat chassis | Jinzhong | R0B010 | |
| Epidural catheter | Aoocn | No. 20163661148 | |
| Heparin Sodium | Chinawanbang | 99070 | |
| HEPES | GIBCO | 15630-080 | |
| Histopaque 1077 | Sigma Aldrich | 10771-100ml | 1077 Polysucrose solution |
| Histopaque 1083 | Sigma Aldrich | 10831-100ml | 1083 Polysucrose solution |
| Histopaque 1119 | Sigma Aldrich | 11191-100ml | 1119 Polysucrose solution |
| Infusion tube | BOON | 20163660440 | |
| Iodophor | LIRCON | Q/1400ALX002 | |
| Isoflurane | Rwdls | R510-22-16 | |
| No. 0-2 suture | Jinhuan | No. 20142650770 | |
| No. 22 surgical blade | Lianhui | 2011126 | |
| Penicillin/streptomycin | GIBCO | 15140-122 | |
| Peristaltic pump | LongerPump | BT300-2J | |
| Pig serum | Kangyuan | 20210601 | |
| RPMI-1640 Medium | GIBCO | C1875500BT | |
| Sampling syringe | Yikang | YKBB0 | |
| Scalpel | Jinzhong | J11030 | |
| Silicon nitride beads | Celltrans | YKBI0 | |
| Straight blood-vessel forceps | Jinzhong | J31120 | |
| Straight Sided Jar | Nalgene | 2118-0001 | |
| Tissue forceps | Jinzhong | J41010 | |
| Tissue scissors | Jinzhong | J21210 | |
| Toothed forceps | Jinzhong | JD1060 | |
| Towel forceps | Shinva | 154285 | |
| Vacutainer blood collection tube | Sanli | 20150049 | |
| Water bath | Yiheng | HWS-12 |
Riferimenti
- Atkinson, M. A., Eisenbarth, G. S., Michels, A. W. Type 1 diabetes. Lancet. 383 (9911), 69-82 (2014).
- Smith, M. J., Simmons, K. M., Cambier, J. C. B cells in type 1 diabetes mellitus and diabetic kidney disease. Nature Reviews. Nephrology. 13 (11), 712-720 (2017).
- Zullo, A., Sommese, L., Nicoletti, G., Donatelli, F., Mancini, F. P., Napoli, C. Epigenetics and type 1 diabetes: mechanisms and translational applications. Translational Research. 185, 85-93 (2017).
- Shapiro, A. M. J., Pokrywczynska, M., Ricordi, C. Clinical pancreatic islet transplantation. Nature Reviews. Endocrinology. 13 (5), 268-277 (2017).
- Warnock, G. L., et al. A multi-year analysis of islet transplantation compared with intensive medical therapy on progression of complications in type 1 diabetes. Transplantation. 86 (12), 1762-1766 (2008).
- Foster, E. D., et al. Improved health-related quality of life in a phase 3 islet transplantation trial in type 1 diabetes complicated by severe hypoglycemia. Diabetes Care. 41 (5), 1001-1008 (2018).
- Ricordi, C., et al. National Institutes of Health-sponsored clinical islet transplantation consortium phase 3 trial: manufacture of a complex cellular product at eight processing facilities. Diabetes. 65 (11), 3418-3428 (2016).
- Coe, T. M., Markmann, J. F., Rickert, C. G. Current status of porcine islet xenotransplantation. Current Opinion in Organ Transplantation. 25 (5), 449-456 (2020).
- Matsumoto, S., Shimoda, M. Current situation of clinical islet transplantation from allogeneic toward xenogeneic. Journal of Diabetes. 12 (10), 733-741 (2020).
- Bertera, S., et al. Pig-to-macaque islet xenotransplantation. Methods in Molecular Biology. 2110, 289-314 (2020).
- Bertera, S., Marigliano, M., Bottino, R., Trucco, M. Pancreatic islet isolation from swine. Methods in Bioengineering: Cell Transplantation. , 77-99 (2011).
- Kim, A., et al. Islet architecture: A comparative study. Islets. 1 (2), 129-136 (2009).
- Kim, H. -. I., et al. Parameters for successful pig islet isolation as determined using 68 specific-pathogen-free miniature pigs. Xenotransplantation. 16 (1), 11-18 (2009).
- Dufrane, D., et al. Parameters favouring successful adult pig islet isolations for xenotransplantation in pig-to-primate models. Xenotransplantation. 13 (3), 204-214 (2006).
- Ricordi, C., Finke, E. H., Lacy, P. E. A method for the mass isolation of islets from the adult pig pancreas. Diabetes. 35 (6), 649-653 (1986).
- Ulrichs, K., et al. Isolation of porcine pancreatic islets for xenotransplantation. Methods in Molecular Biology. 885, 213-232 (2012).
- Dufrane, D., et al. A simple method using a polymethylpenten chamber for isolation of human pancreatic islets. Pancreas. 30 (3), 51-59 (2005).
- Ching, C. D., et al. A reliable method for isolation of viable porcine islet cells. Archives of Surgery. 136 (3), 276-279 (2001).
- Brandhorst, D., Brandhorst, H., Hering, B. J., Federlin, K., Bretzel, R. G. Islet isolation from the pancreas of large mammals and humans: 10 years of experience. Experimental and Clinical Endocrinology & Diabetes: Official Journal, German Society of Endocrinology [and] German Diabetes Association. 103, 3-14 (1995).
- Takei, S., et al. Isolation and function of human and pig islets. Pancreas. 9 (2), 150-156 (1994).
- Marchetti, P., et al. Collagenase distension, two-step sequential filtration, and histopaque gradient purification for consistent isolation of pure pancreatic islets from the market-age (6-month-old) pig. Transplantation. 57 (10), 1532-1535 (1994).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Isolation of porcine pancreatic islets: low trypsin activity during the isolation procedure guarantees reproducible high islet yields. Journal of Clinical Laboratory Analysis. 8 (6), 407-411 (1994).
- Noguchi, H. Pancreatic islet purification from large mammals and humans using a COBE 2991 cell processor versus large plastic bottles. Journal of Clinical Medicine. 10 (1), (2020).
- Vanderschelden, R., Sathialingam, M., Alexander, M., Lakey, J. R. T. Cost and scalability analysis of porcine islet isolation for islet transplantation: Comparison of juvenile, neonatal and adult pigs. Cell Transplant. 28 (7), 967-972 (2019).
- Nagaraju, S., Bottino, R., Wijkstrom, M., Trucco, M., Cooper, D. K. C. Islet xenotransplantation: what is the optimal age of the islet-source pig. Xenotransplantation. 22 (1), 7-19 (2015).
- Liu, Z., et al. Pig-to-primate islet xenotransplantation: Past, present, and future. Cell Transplantation. 26 (6), 925-947 (2017).
- Jiang, X., et al. Islet isolation and purification from inbred Wuzhishan miniature pigs. Xenotransplantation. 19 (3), 159-165 (2012).
- Kim, J. H., et al. Influence of strain and age differences on the yields of porcine islet isolation: extremely high islet yields from SPF CMS miniature pigs. Xenotransplantation. 14 (1), 60-66 (2007).
- Heiser, A., Ulrichs, K., Müller-Ruchholtz, W. Influence of porcine strain, age, and pH of the isolation medium on porcine pancreatic islet isolation success. Transplantation Proceedings. 26 (2), 618-620 (1994).
- Steffen, A., et al. Production of high-quality islets from goettingen minipigs: Choice of organ preservation solution, donor pool, and optimal cold ischemia time. Xenotransplantation. 24 (1), (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon