Method Article
Интерферометрическая визуализация отдельных внеклеточных везикул и популяционной динамики с помощью интерферометрической визуализации отдельных внеклеточных везикул и популяционной динамики
В этой статье
Резюме
Этот протокол представляет собой одночастично-интерферометрическую визуализацию отражательной способности, которая предназначена для многоуровневых и всесторонних измерений размера внеклеточных везикул (ВВ), количества ВВ, фенотипа ВВ и колокализации биомаркеров ВВ.
Аннотация
Внеклеточные везикулы (ВВ) — это везикулы нанометрового размера с липидным бислоем, которые секретируются большинством клеток. ВВ несут множество различных биологических молекул, включая белки, липиды, ДНК и РНК, и постулируются для облегчения межклеточной коммуникации в различных тканях и органах. В последнее время ВВ привлекают значительное внимание в качестве биомаркеров для диагностики и терапевтических средств при различных заболеваниях. Для определения характеристик электромобилей было разработано множество методов. Тем не менее, все современные методы анализа электромобилей имеют различные ограничения. Таким образом, разработка эффективных и действенных методов выделения и определения характеристик электромобилей остается одним из важнейших шагов для этой передовой области исследований по мере ее развития. В этой статье мы предоставляем подробный протокол, описывающий одночастичный интерферометрический датчик отражения (SP-IRIS) в качестве метода, способного обнаруживать и характеризовать ВВ из неочищенных биологических источников и очищенных ВВ с помощью других методологий. Этот передовой метод может быть использован для многоуровневых и всесторонних измерений для анализа размера ВВ, количества ВВ, фенотипа ВВ и колокализации биомаркеров.
Введение
Внеклеточные везикулы (ВВ) представляют собой мембранные везикулы клеточного происхождения нанометрового размера, которые могут быть выделены из многочисленных биологических жидкостей, включая кровь, грудное молоко, слюну, мочу, желчь, сок поджелудочной железы, а также спинномозговую и перитонеальную жидкости. Образование ВВ происходит с помощью трех основных механизмов: апоптоза, высвобождения путем слияния многовезикулярных телец с плазматической мембраной и блеббинга плазматической мембраны. Данные о переносе компонентов донорских клеток в соседние или отдаленные клетки и ткани позволяют предположить, что эти мембранные пакеты могут играть важную роль в паракринных, а также дальних или эндокринных сигнальных каскадах 1,2,3. Поскольку ВВ могут обеспечить моментальный снимок фенотипа клетки, потенциал их использования в качестве диагностических и терапевтических инструментов для лечения различных заболеваний стал активной областью исследований 4,5,6,7,8.
Было разработано множество методов, направленных на определение характеристик EV 9,10,11,12,13. Большинство из этих методов предоставляют уникальную и ценную информацию о популяциях электромобилей, в первую очередь в массовом количестве. В то время как подмножество этих методов может предоставить подробную информацию о веществах внутри или на отдельных электромобилях, могут быть ограничения для характеристики электромобилей на уровне одного электромобиля. Например, иммуноэлектронная микроскопия может быть использована для понимания одиночных ВВ и их состава, но этот метод обладает низкой пропускной способностью, сильно ограничен в своих возможностях для описания популяционной динамики и требуетзначительного развития методов.
В последнее время в результате разработки и коммерциализации метода одночастичного интерферометрического датчика отражения (SP-IRIS) на платформе ExoView появилась возможность определения индивидуальных характеристик электромобилей с помощью рутинного и простого автоматизированного метода сбора данных. Ядром этой технологии является чип, представляющий собой двойной слой Si/SiO2 размером 1 см x 1 см, который позволяет проводить интерферометрические измерения отдельных биологических наночастиц. Чип оснащен микрочипом отдельных функционализированных пятен антител, что позволяет мультиплексировать до шести различных типов захвата. Стандартные чипы включают в себя общие маркеры тетраспанина (CD81, CD63 и CD9) для захвата на этапе инкубации, и пользователь может добавить дополнительные пользовательские точки захвата для выделения отдельных популяций EV отдельно от тетраспанинов. После этапа инкубации каждая точка захвата привязывает к себе множество EV, которые экспрессируют соответствующий маркер. Эти захваченные электромобили затем можно просто промыть, высушить и отсканировать в считывателе для количественной оценки размера везикул, связанных с точкой захвата в диапазоне от 50 до 200 нм, чтобы получить взвешенное распределение по размерам с помощью SP-IRIS15. Система также предлагает три канала флуоресцентного детектирования для иммуномаркировки захваченных ВВ и обеспечивает как среднюю интенсивность флуоресценции, которая не ограничена размером, таким как измерения SP-IRIS, так и аспекты колокализации для каждого флуоресцентного окрашивания. Это позволяет пользователю определять популяции отдельных ВВ на основе отображения четырех различных биомаркеров для каждого ВВ (захват плюс три иммунофлуоресцентные метки). Система может выйти за рамки измерения поверхностных белков с помощью иммунофлуоресценции, поскольку дополнительный грузовой протокол позволяет пользователю зондировать внутренние белки захваченных EV и люминальные эпитопы маркеров поверхности, охватывающей мембрану, а также позволяет пользователю проверить целостность мембраны EV. В этой статье мы предоставляем подробный протокол, в котором изложены шаги, необходимые для получения согласованных данных о размере и количестве ВВ, с учетом до четырех различных биомаркеров на одном уровне ВВ в больших популяциях ВВ. Этот метод может быть использован как на необработанных биологических жидкостях, так и на ВВ, выделенных с помощью любого количества методов, таких как ультрацентрифугирование, ультрафильтрация, преципитирующие агенты, захват иммуноаффинности, микрофлюидика и эксклюзионная хроматография.
В описанном ниже протоколе используют внеклеточные везикулы (EV), полученные из среды для культивирования клеток HEK 293 и из сыворотки мыши с использованием установленного метода выделения16. Протокол был применен ко многим другим биологическим жидкостям, средам для культивирования клеток и очищенным внеклеточным везикулам, выделенным из биологических жидкостей. Этот протокол разделен на двухдневную процедуру, рабочий процесс для типичного эксперимента показан на рисунке 1.

Рисунок 1: Рабочий процесс анализа. Рабочий процесс анализа для выбора типа анализа, который должен быть выполнен для образца между размером и количеством, подсчетом размера и окрашиванием поверхности, а также подсчетом размеров и окрашиванием груза. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
Образцы сыворотки были собраны у мышей в соответствии с утвержденным протоколом Институциональных комитетов по уходу за животными и их использованию (IACUC) в Медицинском центре Университета Канзаса (KUMC). Использование этих биологических образцов в этих экспериментах также было одобрено KUMC.
1. Подготовка образцов (День 1)
- Определение концентрации EV с помощью отслеживания наночастиц или аналогичного метода.
- Разбавить образец инкубационным раствором до концентрации 5 x 107-5 x 108 EVs/мл; необходимо минимум 50 μл.
ПРИМЕЧАНИЕ: Для образцов, в которых концентрация EV неизвестна, общий белок в концентрации 1 г/мл может быть использован в качестве заменителя. Если ожидается, что проба будет иметь низкую концентрацию, выполните разведение в инкубационном растворе не менее 1:1 перед загрузкой. - Поместите 24-луночный планшет на ровную поверхность, свободную от вибраций и резких движений.
ПРИМЕЧАНИЕ: Для повышения контрастности под пластину можно положить белый лист бумаги. - Добавьте воды в области, окружающие колодцы (рисунок 2).

Рисунок 2: Схема расположения 24-луночных планшетов. Показано местоположение, где нужно аликвотировать ddH,2O (синий краситель был добавлен только в целях визуализации) и скважины, в которых будут удерживаться чипы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Подготовка и предварительное сканирование чипов
- Снимите герметичную 48-луночную пластину с чипсами из холодильника при температуре 4-8 °C и дайте ей нагреться до комнатной температуры (~15 минут), прежде чем открывать крышку.
ПРИМЕЧАНИЕ: Это необходимо для того, чтобы избежать образования конденсата на стружке, который может повредить пятна. Если при извлечении стружки из упаковки на поверхности наблюдается конденсация, подождите дольше, прежде чем удалять другие. - Перейдите к шагу 8, чтобы извлечь патрон для подготовки к предварительному сканированию (рисунок 3).
ПРИМЕЧАНИЕ: Данные предварительного сканирования будут использоваться для идентификации любых частиц, которые могут быть обнаружены в точках захвата до инкубации с образцом, чтобы их можно было удалить на этапе анализа.

Рисунок 3: Изображение патрона, используемого для загрузки чипа в станок. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- С помощью пинцета удалите нужное количество стружки (по одной стружке на образец) с 48-луночного планшета и загрузите стружку непосредственно в патрон для выполнения предварительного сканирования. Когда все микросхемы, предназначенные для использования в эксперименте, загружены и предварительно отсканированы, как описано в шаге 8, перейдите к шагу 2.4.
ПРИМЕЧАНИЕ: При работе с чипами не прикасайтесь к квадратам в центре, так как пятна захвата антител находятся в этой области и могут быть повреждены при прикосновении пинцетом (Рисунок 4).

Рисунок 4: Чип и правильное обращение с чипом. (A) Желтая пунктирная линия указывает на расположение пятнистых антител или функциональную сторону чипа. ID чипа расположен ниже линии ("58"). На рисунке также показано правильное обращение. (B) Демонстрирует ненадлежащее обращение с чипом. (C) Нефункциональная сторона чипа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Поместите каждый предварительно отсканированный чип функционализированной поверхностью вверх в заранее подготовленный 24-луночный планшет. Функционализированную поверхность легко узнать по четкой нумерации, сеткам выравнивания и трем черным ящикам посередине. Нефункционализированная сторона представляет собой плоскую серебристую однородную поверхность.
- Используйте пинцет с тонким концом, чтобы убедиться, что каждая стружка находится по центру лунки (рис. 5).
ПРИМЕЧАНИЕ: Центрирование чипа в лунке имеет решающее значение, потому что если стружка соприкоснется со стенкой лунки, образец может отвалиться после загрузки.

Рисунок 5: Демонстрация правильного размещения стружки в скважине. (A) Стружка должна быть установлена в середине скважины так, чтобы углы не касались стенок скважины. (B) Изображение неправильного размещения чипа, где углы соприкасаются со стенками колодца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Загрузка и инкубация чипа и образца
- Пипеткой нанесите 35 мкл подготовленного образца (из шага 1) на чип.
ПРИМЕЧАНИЕ: Будьте осторожны, не добавляйте пузырьки и не прикасайтесь к чипу наконечником пипетки, так как это может помешать равномерному распределению образца на чипе или повредить пятна антител на чипе. Образец должен растекаться по всей поверхности чипа. В случае отслоения образца от чипа во время загрузки либо добавьте в лунку дополнительный образец объемом до 250 μЛ, либо добавьте инкубационный раствор до 250 μL и обратите внимание на измененный коэффициент разбавления для этого образца. - Запечатайте пластину, используя пленку для пластины, входящую в комплект, чтобы предотвратить испарение образца.
- Инкубируйте образец/чип в течение ночи (~16 часов) в герметичном планшете при комнатной температуре в месте, свободном от вибраций или движений.
ПРИМЕЧАНИЕ: После ночной инкубации пользователь выберет подходящий вариант дня 2 для своего исследовательского вопроса. Если вы хотите только размер и количество EV, перейдите к шагу 4 (день 2). Если требуется анализ нескольких поверхностных маркеров, перейдите к шагу 5 (День 2).
4. Определение размера и количества EV (День 2)
- Добавьте 1 мл раствора A на боковую сторону каждой лунки, содержащей чип, стараясь не добавлять раствор непосредственно на чип и не царапать чип наконечником пипетки.
- Поместите пластину на орбитальный шейкер, вращающийся со скоростью ~500 об/мин, на 3 минуты при комнатной температуре.
ПРИМЕЧАНИЕ: Если стружка дребезжит на пластине, немедленно уменьшите скорость так, чтобы жидкость закручивалась, но не дребезжала. - Удалите 750 μл жидкости. Избегайте наклона пластины во время удаления жидкости, чтобы предотвратить случайное высыхание стружки.
- Добавьте 750 мкл раствора B по методике, описанной в шаге 4.1, и встряхивайте при ~500 об/мин в течение 3 минут при комнатной температуре.
- Повторите шаги 4.3-4.4 еще дважды, всего три промывки раствором Б.
- В конце последней промывки удалите 750 мкл раствора, оставив в лунке 250 мкл раствора В.
- Добавьте 750 μL двойной дистиллированной воды (ddH2O) и встряхивайте при ~500 об/мин в течение 3 минут при комнатной температуре.
- Наполните чашку Петри диаметром 10 см 50 мл ddH2O и переложите по одной стружке из лунки в чашку с помощью пинцета.
ПРИМЕЧАНИЕ: Следите за тем, чтобы стружка передавалась горизонтально и следите за тем, чтобы она не высыхала. Перед заменой ddH2O можно мыть до восьми стружки. - В ddH2O держите чип за края с помощью пинцета и вращайте в чашке в течение трех оборотов, чтобы удалить мусор.
- Извлеките скол из воды под углом 45° и положите скол на впитывающую бумагу идентификатором скола вверх (Рисунок 6).
ПРИМЕЧАНИЕ: Теперь чипы готовы к чтению. Перейдите к шагу 8 для сканирования на считывателе SP-IRIS.

Рисунок 6: Правильный способ извлечения стружки из воды ddH2O под углом 45°. (A) Вид сверху и (B) вид сбоку, показывающий угол, под которым следует удалить стружку. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
5. Приготовление раствора антитела (день 2)
- Добавьте 300 мкл блокирующего раствора на каждый чип в пробирку соответствующего размера (от 0,5 до 3 мл).
- Добавьте 0,6 мкл антитела на 300 мкл блокирующего раствора. Аккуратно перемешайте, постукивая по тюбику и быстро отжимая.
Антитела к человеческим CD9, CD81 и CD63 или мышиным CD9, CD81 и CD63 включены в соответствующие наборы. Если требуются другие флуоресцентно конъюгированные антитела, определите оптимальную концентрацию окрашивания, используя типичное титрование в диапазоне от 0,1 до 10 мкг/мл с постоянной нагрузкой образца, как при проточной цитометрии.
6. Определение размера, количества и фенотипирования ВВ с помощью иммунофлуоресцентного окрашивания
- Добавьте 1 мл раствора A на боковую сторону каждой лунки, содержащей чип, стараясь не добавить раствор непосредственно на чип и не поцарапать чип наконечником пипетки.
- Поместите пластину на орбитальный шейкер, вращающийся со скоростью ~500 об/мин, на 3 минуты при комнатной температуре.
ПРИМЕЧАНИЕ: Если стружка дребезжит на пластине, немедленно уменьшите скорость так, чтобы жидкость закручивалась, но не дребезжала. - Удалите 750 мкл жидкости. Избегайте наклона пластины во время удаления жидкости, чтобы предотвратить случайное высыхание стружки.
- Добавьте 750 μL раствора А с помощью метода, описанного в шаге 6.1, и встряхивайте при ~500 об/мин в течение 3 минут при комнатной температуре.
- Повторите шаги 6.3 и 6.4 дважды, в общей сложности три промывки раствором А.
- В конце последней промывки удалите 750 мкл раствора, оставив в лунке 250 мкл раствора А.
ПРИМЕЧАНИЕ: Если пользователь хочет окрашивать груз, перейдите к шагу 7 на этом этапе. Если нет, перейдите к шагу 6.7 - Добавьте 250 мкл раствора антитела (шаг 5) в каждый чип в лунке. Накройте пластину фольгой для защиты от света и встряхивайте в течение 1 ч на орбитальном шейкере при комнатной температуре.
- Добавьте 500 мкл раствора А, чтобы общий объем на лунку составил ~1 000 мкл.
- Немедленно удалите 750 μL и добавьте 750 μL раствора A и встряхивайте при ~500 об/мин на орбитальном шейкере в течение 3 минут при комнатной температуре.
- Удалите 750 μL раствора, добавьте 750 μL раствора B и встряхивайте при ~500 об/мин в течение 3 минут при комнатной температуре.
- Повторите шаг 6.10 еще дважды, всего три стирки.
- Добавьте 750 μL двойной дистиллированной воды (ddH2O) и встряхивайте при ~500 об/мин в течение 3 минут при комнатной температуре.
- Наполните чашку Петри 10 см 50 мл ddH2O и переложите одну стружку из лунки в чашку с помощью пинцета.
ПРИМЕЧАНИЕ: Следите за тем, чтобы стружка передавалась горизонтально и следите за тем, чтобы она не высыхала. До восьми стружек можно промыть перед заменой на свежую ddH2O. - В ddH2O держите чип за края с помощью пинцета и вращайте в чашке в течение трех оборотов, чтобы удалить мусор.
- Извлеките скол из воды под углом 45° и положите скол на впитывающую бумагу идентификатором скола вверх (Рисунок 6).
ПРИМЕЧАНИЕ: Теперь чипы готовы к чтению. Перейдите к шагу 8 (Сбор данных) для получения инструкций по настройке чипов для сканирования на считывателе.
7. Опциональное окрашивание груза
ПРИМЕЧАНИЕ: Этот протокол позволяет одновременно маркировать внутренние и поверхностные маркеры.
- Если в каждой лунке осталось 250 мкл раствора А, добавьте в каждую лунку по 250 мкл раствора С.
- Немедленно поместите на орбитальный шейкер и установите на ~200 об/мин ровно на 10 минут.
ПРИМЕЧАНИЕ: На этом шаге и на шаге 7.8 ниже решающее значение имеют как время, так и более медленная скорость встряхивания; Убедитесь, что скорость дает только медленное закручивание в колодцах и используйте таймер. - После 10 мин инкубации с раствором С добавьте по 500 мкл раствора А в каждую лунку.
- Немедленно удалите 750 μL и добавьте 750 μL раствора A и встряхивайте при ~500 об/мин на орбитальном шейкере в течение 3 минут при комнатной температуре.
- Повторите шаг 7.4 еще дважды, всего три стирки.
- В конце последней промывки удалите 750 μL раствора, оставив ~250 μL раствора в лунке со стружкой.
- Добавьте в каждую лунку по 250 мкл раствора D.
- Немедленно установите орбитальный шейкер на ~200 об/мин ровно на 10 минут.
- После 10 мин инкубации с раствором С добавьте по 500 мкл раствора А в каждую лунку.
- Немедленно удалите 750 μL и добавьте 750 μL раствора A и встряхивайте при ~500 об/мин на орбитальном шейкере в течение 3 минут при комнатной температуре.
- Повторите шаг 7.10 дважды, всего три стирки.
- Удалите 750 мкл раствора после последней промывки и вернитесь к шагу 6.7 выше для окрашивания и завершения протокола анализа.
8. Сбор данных
ПРИМЕЧАНИЕ: Процедура сбора данных с чипов с помощью ExoView R100 автоматизирована и не требует ввода данных пользователем. Подробную инструкцию можно найти в Руководстве пользователя и соответствующем видео по загрузке держателя микросхемы, или «патрона», и сбору данных17.
- Включите платформу для определения характеристик электромобиля с помощью двух выключателей питания на задней панели прибора, а затем запустите программное обеспечение сканера, дважды щелкнув по значку на рабочем столе.
ПРИМЕЧАНИЕ: Когда программное обеспечение сканера запустится, считыватель автоматически перейдет на главный экран, а затем предложит пользователю «Открыть дверцу для загрузки чипов». - Откройте дверцу в передней части считывателя, подняв серебряную ручку. При этом столик будет извлечен, что позволит пользователю получить доступ к патрону и настроить новое сканирование в программном обеспечении.
- Определите местоположение, в котором пользователь хочет сохранить данные, щелкнув папку «Сохранить » и выбрав нужное место для сохранения данных.
ПРИМЕЧАНИЕ: Часто бывает полезно назвать место сохранения как-нибудь проницательно, например, название эксперимента, а затем создать две подпапки, одну для предварительного сканирования, а другую для последующего сканирования. Это облегчает поиск и сопоставление данных во время анализа. - Чтобы отсканировать микросхемы, найдите файлы микросхем на управляющем компьютере.
ПРИМЕЧАНИЕ: Файлы чипов представляют собой карты расположения пятен антител на используемом чипе и позволяют сканеру знать, где нужно сканировать каждый чип. В каждом комплекте есть USB-ключ с файлами микросхем внутри. Они должны быть сохранены в месте на управляющем компьютере после получения комплекта, где пользователи могут надежно их найти. - Загрузите микросхему в патрон с номером на микросхеме, обращенной к ручке патрона, а затем в раскрывающемся меню «Микросхема» на компьютере выберите каждую микросхему из списка файлов микросхем и поместите ее в соответствующее место в виртуальном патроне в программном обеспечении сканера. После завершения на экране появится запрос с просьбой разместить патрон на сцене.
- Поместите заряженный патрон на сцену; магнитное выравнивание патрона автоматически переместит его в нужное место на рабочей области, а затем нажмите OK рядом с пунктом «Разместить патрон на рабочей области». После этого сканер начнет автоматический сбор данных.
ПРИМЕЧАНИЕ: Данные готовы к анализу после того, как программное обеспечение сообщит о статусе сканирования каждого чипа как успешном.
9. Анализ данных
- Дважды щелкните по ExoView Analyzer на рабочем столе управляющего ПК. После загрузки программного обеспечения нажмите кнопку «Данные предварительного сканирования » и выберите расположение папки для набора данных предварительного сканирования в разделе 8.3.
- Нажмите на кнопку Postscan Data и выберите расположение папки для набора данных postscan в разделе 8.3.
ПРИМЕЧАНИЕ: Если данные правильно обнаружены в обеих папках, по крайней мере, для некоторых микросхем, программное обеспечение отобразит количество обнаруженных микросхем "X" рядом с кнопкой "Местоположение файла чипа". При правильном сохранении обнаруженные чипы должны совпадать с количеством отсканированных чипов. - Нажмите « Далее» в нижней части области загрузки данных.
- В выпадающем меню метатаблицы у каждой фишки будет своя ячейка. Введите названия образцов, коэффициенты разведения и то, какие маркеры окрашиваются в каждом канале обнаружения, щелкнув в соответствующем поле и введя информацию; Когда закончите, нажмите « Далее » еще раз.
ПРИМЕЧАНИЕ: Эти метаданные будут сохранены вместе с данными. - Контроль качества преформы (QC) путем нажатия на вкладку «Отключить » под кнопкой «QC» в левом верхнем углу.
ПРИМЕЧАНИЕ: Эта функция позволяет отключать определенные щупы и чипы для анализа. Программное обеспечение выдает два разных предупреждения о данных: одно для высоких значений, которые могут указывать на то, что определенный захват насыщен, и высокий коэффициент вариации (CV), который определяет, когда одна из реплик типа захвата отличается от других.- Нажмите на предупреждающее место для высокого CV, изучите пятна, которые выдаются программным обеспечением, и посмотрите, есть ли очевидные физические повреждения; Когда повреждение будет обнаружено, нажмите на номер пятна, чтобы выключить это пятно в анализе.
- Повторяйте до тех пор, пока все предупреждения не будут оценены, а затем нажмите «Далее».
- Преформируйте анализ отсечки, щелкнув вкладку Cutoff, расположенную рядом с вкладкой Disable под кнопкой QC в левом верхнем углу.
ПРИМЕЧАНИЕ: Это позволит отобразить флуоресцентный отклик контрольного пятна в виде диаграммы и предложить пользователю две настройки, минимум и максимум для каждого цветового канала (красный/зеленый/синий). Установка порогового значения для каждого канала флуоресцентного детектирования является единственной корректировкой данных, которую необходимо выполнить, и она относительно проста. Важно отметить, что окончательное пороговое значение, которое выбирается, должно быть последовательным на протяжении всего эксперимента и, как уже отмечалось, должно находиться в пределах эмпирических правил для 300-400 а.е. для красного и зеленого цветов и 400-700 а.е. для синего в типичных экспериментах; Программное обеспечение имеет цветовую кодировку для пользователя и для этих диапазонов.- Щелкните вкладку «Зеленый цвет», чтобы загрузить данные для этого канала и отобразить текущие пороговые значения. При исследовании контрольного пятна с отрицательным изотипом можно увидеть события обнаружения с очень низкими интенсивностями флуоресценции; В этом случае пользователи обычно должны ожидать установки зеленого цвета в диапазоне 300-400 а.е.
- Увеличивайте минимальное значение для каждого из каналов обнаружения до тех пор, пока на дисплее данных не появится «Среднее % обнаруженных частиц в контрольной точке, включенной выше порогового значения») под дисплеем данных, как показано красным или желтым выделением в этой ячейке.
ПРИМЕЧАНИЕ: Максимальное значение, как правило, не нужно регулировать по умолчанию, но его можно уменьшить, чтобы отфильтровать яркие частицы или ограничить обнаружение флуоресценции до более узкого диапазона. - Нажмите на кнопку «Далее ».
- Увеличивайте минимальное значение для каждого из каналов обнаружения до тех пор, пока на дисплее данных не появится «Среднее % обнаруженных частиц в контрольной точке, включенной выше порогового значения») под дисплеем данных, как показано красным или желтым выделением в этой ячейке.
- Щелкните вкладку Красный цвет, чтобы загрузить данные для этого канала и отобразить текущие пороговые значения. Опять же, исследуя отрицательное контрольное пятно изотипа, можно увидеть события обнаружения с очень низкой интенсивностью флуоресценции; В этом случае пользователи обычно должны ожидать установки красного цвета в диапазоне 300-400 а.е. Следуйте тем же процедурам, которые указаны в шагах 9.6.1.1-9.6.1.3.
- Перейдите на вкладку «Синий цвет », чтобы загрузить данные для этого канала и отобразить текущие пороговые значения. Опять же, исследуя пятно изотипа отрицательного контроля, следуйте тем же процедурам, которые указаны в шагах 9.6.1.1-9.6.1.3.
Примечание: Синий канал уникален тем, что антитело в пятне является автофлуоресцентным при достаточном уровне, чтобы потребовать несколько более высокого порога в 400-700 а.е. даже для пустых чипов.
- Щелкните вкладку «Зеленый цвет», чтобы загрузить данные для этого канала и отобразить текущие пороговые значения. При исследовании контрольного пятна с отрицательным изотипом можно увидеть события обнаружения с очень низкими интенсивностями флуоресценции; В этом случае пользователи обычно должны ожидать установки зеленого цвета в диапазоне 300-400 а.е.
- После завершения анализа Cutoff нажмите на кнопку Next , и появится график тепловой карты, который даст обзор связывания частиц в эксперименте. Существует несколько инструментов визуализации, которые пользователь может использовать для построения графиков данных. Эти графики и связанные с ними исходные данные можно добавить в отчет, нажав кнопку « Добавить отчет о графиках ».
ПРИМЕЧАНИЕ: Тепловая карта - это отображение данных по умолчанию, которое показывает все образцы, все захваты конкретного обнаружения. По умолчанию отображается общее количество уникальных электромобилей, привязанных к каждой точке съемки. - Нажмите кнопку «Экспортировать отчет» и выберите место сохранения отчета.
ПРИМЕЧАНИЕ: Отчет откроется в браузере. Найдите файл таблицы «Список отфильтрованных частиц», прикрепленный к отчету; это информация, которую необходимо отправить в EVTRACK. - Продолжайте добавлять отчеты, используя различные варианты выборок Образцы и Типы захвата в раскрывающихся меню в верхней части экрана. Управление отображаемыми данными осуществляется с помощью выбора кнопок обнаружения каналов в левом верхнем углу. Установите определенный канал фенотипа/выборки/захвата, нажав на каждую цветную кнопку, чтобы выключить этот канал обнаружения (серый цвет) или включить (цветной).
- Нажмите кнопку « Добавить график в отчет», чтобы объединить нужные графики в отчет.
- Нажмите « Экспортировать отчет» и укажите место сохранения итогового отчета.
Результаты
На рисунке 7 (левая панель) показано трехцветное составное изображение электромобилей, полученное из кондиционированного носителя HEK293, привязанного к пятну CD63 на чипе и окрашенного для CD81, CD63 и CD9 в следующих каналах: зеленый, красный и синий соответственно. На рисунке 7 (верхняя правая панель) показано увеличенное изображение, показывающее, что каждый из захваченных электромобилей может отображать колокализацию одного или нескольких цветов с различной интенсивностью в каждом канале. Разница в окрашивании захваченных EV представляет собой гетерогенность экспрессии трех тетраспанинов на отдельных везикулах и может быть количественно определена с помощью программного обеспечения для анализа данных. На рисунке 7 (нижняя правая панель) показаны гистограммы размеров электромобилей, которые имеют длину волны выше 50 нм. Гистограмма определения размеров показывает, что захваченные электромобили на точке CD63 имеют размер моды 50 нм. Цветовая колокализация, интенсивность и размер для каждого электромобиля, привязанного к изображению пятна, представляют собой фенотипические данные, которые составляют фундаментальные данные измерения.

Рисунок 7: Трехцветное изображение полного пятна показывает полное пятно захвата CD63 с EV, полученными от HEK293, связанными и окрашенными для antiCD9-CF488, antiCD81-CF555, antiCD63-CF647. Увеличенное изображение отображает цифровое обнаружение отдельных фенотипов ВВ с использованием флуоресцентной кололокализации. Распределение размеров, полученное от SP-IRIS, для этой микросхемы показано в правом нижнем углу. ВВ собирали из кондиционированной среды HEK293T клеток. Клетки культивировали до 80% конфлюенции, а затем промывали PBS и культивировали в течение 48 ч в средах, содержащих обедненный EV FBS (10% об./об.). Кондиционированная среда, собранная в конце 48 ч, затем была раскручена при 2500 x g для удаления клеточного мусора, и оставшаяся надосадочная жидкость, содержащая EV, была проанализирована. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунке 8 показано трехцветное составное изображение и гистограмма интенсивности для двух примеров типов реакций контроля изотипа, с которыми может столкнуться пользователь. Верхняя панель (пример 1, EX1) показывает номинальную работу, пятно управления изотипом не имеет привязки с интенсивностью флуоресценции большей, чем автофлуоресцентная сигнатура синим цветом (>500) и (>300 а.е.) красным и зеленым, что позволяет пользователю устанавливать низкие пороговые значения. Нижняя панель (образец неспецифический 1, NS1) показывает, когда EV связываются с контролем изотипа, что приводит к высокоинтенсивному окрашиванию, как показано на гистограмме. В этом сценарии данные о точках, специфичных для маркеров, ненадежны, поскольку они охватывают тот же диапазон интенсивности, что и EV в контрольной точке, вывод о том, что EV в активных точках специально задействованы там, больше не работает. Когда это явление происходит, оно обычно связано с состоянием образца.
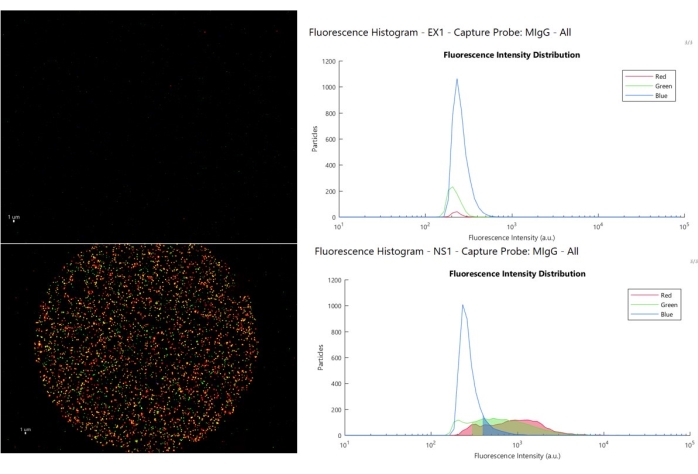
Рисунок 8: Анализ пороговых границ. На верхнем левом изображении показано номинальное контрольное пятно и связанные с ним флуоресцентные гистограммы (вверху справа), где частицы выше порогового значения показаны в затененной области, нижнее левое изображение представляет собой пример неспецифического связывания EV с контрольным пятном, а затененные области флуоресцентной гистограммы находятся выше порогового значения, в том же диапазоне, что и положительные EV в точке захвата. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
На рисунке 9 представлена колокализация одиночного белка EV, полученных из сыворотки крови человека. ВВ захватывали с использованием антител захвата анти-CD63, CD9, CD81 и mlgG и окрашивали на CD81 (зеленый), HSP72 (красный) и CD9 (синий). На рисунке 9 показано, что CD81 является наиболее аккумулируемым маркером в ВВ, полученных из сыворотки крови человека. При этом уровень CD63 является самым низким по сравнению с CD81 и CD9. Среди захваченных антител к CD63, CD9 и CD81 антитела отношение HSP72 в захваченных антителах CD63 выше, в то время как этот уровень аналогичен между захваченными антителами к CD9 и CD81. Обнаружение специфической локализации HSP72 и CD63 среди всех не-HSP72-положительных EV, которые также несут маркеры тетраспанина, демонстрирует уникальную способность сбора данных с помощью интерферометрии одиночных частиц и флуоресценции.

Рисунок 9: Колокализация белка одиночного ВВ. ВВ, полученные от человека, захватывали с помощью антител против CD63, CD9, CD81 и mlgG (изотип) и окрашивали на CD81 (зеленый), HSP72 (красный) и CD9 (синий). Популяция EV была визуализирована с использованием флуоресцентного режима. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Современные методы определения характеристик ЭВ в значительной степени опираются на очищенные ВВ, что ограничено текущими экспериментальными ограничениями методов очистки ЭВ 9,10,11,12,13. Одночастично-интерферометрическая визуализация отражательной способности (SP-IRIS) — это эффективная технология, которая позволяет исключить этапы очистки, необходимые для анализа образцов, и, таким образом, сэкономить время и снизить затраты, связанные с типичными рабочими процессами EV. Требуемый объем ввода образца, как правило, очень мал, что позволяет использовать оставшуюся часть образца для дополнительных аналитических методов.
Кроме того, возможность измерения ВВ антиген-специфичным способом очень важна для фундаментальных исследований ВВ, а также для обнаружения редких событий в диагностических и терапевтических приложениях. Тем не менее, специфические для заболевания ВВ могут присутствовать в крови в низких концентрациях по сравнению с другими циркулирующими ВВ и загрязнителями 2,11,12. Протокол может быть модифицирован для включения других антител для обнаружения этих субпопуляций с использованием флуоресцентно меченных антител с возбуждением на длине волны 488 нм, 555 нм или 647 нм соответственно. В этом случае следует разработать положительный и отрицательный биологический контроль, против которого можно использовать серию титрований для оптимизации обнаружения интересующего маркера. В данном случае следует отметить, что метод положительного отбора, используемый SP-IRIS, может оказаться неблагоприятным для данного эксперимента, поскольку интересующий его маркер не может сильно колокализоваться с уменьшением тетраспанина, что затрудняет обнаружение. Если такая ситуация возникает, выгодно захватывать ВВ на чипе с помощью интересующего маркера, тем самым преодолевая положительное смещение отбора на пятнах тетраспанина. Обобщенная способность визуализации SP-IRIS к мечению позволяет обнаруживать до четырех маркеров в определенном точке захвата, что требует обсуждения того, как разрабатывать и интерпретировать обнаружение новых маркеров с помощью SP-IRIS и соответствующих средств контроля. При использовании контрольного пятна изотипа в качестве единственного контрольного для чипа мы действительно рассматриваем вопрос о том, существует ли неспецифическое связывание образца антитела непосредственно с пятном захвата изотипа во время установки порогового значения. Если мы наблюдаем сходную колокализационную сигнатуру в контроле изотипа и маркер-специфичном пятне, это указывает на то, что ВВ неспецифически привязаны к контролю, и протокол следует изучить. Выбор хороших положительных и отрицательных контрольных образцов может помочь пользователям дифференцировать, является ли неспецифическое связывание антителами на чипе или флуоресцентно меченными первичными антителами. Если есть подозрение на связывание EV с контрольным пятном изотипа, то отрицательный контрольный образец EV может быть инкубирован при фиксированной концентрации на чипе и окрашен нормальной окрашивающей концентрацией представляющего интерес антитела. Настройки предельных значений должны быть выполнены, как описано в разделе 9 Сбор данных, шаг 9.6. Убедитесь, что на пятнах для интересующего маркера нет привязки. Пороговые значения, установленные на отрицательном образце EV, могут быть применены к остальным образцам в эксперименте. При наличии положительного контроля полезно провести тест на титрование для определения оптимальной концентрации окрашивания с дополнительными антителами.
Преимущество специфического обнаружения, используемого в SP-IRIS для электромобилей, также может иметь ограничения для этого метода. Стадия инкубации в разделе 3 по своей сути является методом положительного отбора, который не дает никакой информации о частицах, которые могут присутствовать в образце, но не отображает маркеры, соответствующие типам захвата на конкретном чипе, поскольку они будут смыты после захвата и не будут реализованы во время анализа. В связи с тем, что на всех электромобилях нет общепринятого универсального маркера, пользователи должны рассматривать свои данные как измеренную популяцию и учитывать количество захваченных частиц по отношению к ортогональным мерам общей концентрации частиц, чтобы решить, представляют ли данные захвата SP-IRIS все EV в конкретном образце.
Метод SP-IRIS был применен к другим биологическим наночастицам (например, патогенным вирусам и вирусным векторам)18. Чтобы применить SP-IRIS для обнаружения других биологических частиц, необходимо выбрать антитело захвата или зонд против поверхностного маркера, чтобы обеспечить его иммунозахват на чипе. В настоящее время биологические частицы диаметром до 200 нм могут быть охарактеризованы с помощью SP-IRIS. При использовании флуоресцентного считывания нижнего предела диаметра не существует, поскольку SP-IRIS имеет чувствительность одного датчика обнаружения. Для обеспечения точности и воспроизводимости исследований SP-IRIS и облегчения интеграции с другими данными EV мы предлагаем использовать платформу EV Track19. Загрузка общих данных непрактична (гигабайты) и доступна только тем, кто использует программное обеспечение ExoView. Поэтому мы предлагаем, чтобы для каждого исследованного образца и части публикации файл Filtered Particle List, который можно легко экспортировать вместе с тепловой картой, был загружен в EV Track. Этот файл содержит полные данные о частицах и настройки отсечения, с помощью которых можно проверить любую цифру или вопрос или получить ответ.
В заключение следует отметить, что SP-IRIS предлагает эффективный и действенный метод определения характеристик электромобилей, который обеспечивает простой способ проведения рутинных измерений размера одного электромобиля и отображения биомаркеров. Эти новые данные могут раскрыть скрытые детали стехиометрии загрузки электромобилей, непосредственно обнаруживать редкие субпопуляции и помочь проложить путь к дальнейшему прогрессу в нашем понимании важной роли электромобилей в здоровье и болезнях.
Раскрытие информации
Клейтон Дейган и Джордж Даабул являются сотрудниками и акционерами NanoView Biosciences Inc.
Благодарности
Эта работа была частично спонсирована Программой наград за научное оборудование и закупки ресурсов Медицинской школы Канзасского университета. PCG, LKC, FD и AR были поддержаны за счет средств NIA R21 AG066488-01.
Материалы
| Name | Company | Catalog Number | Comments |
| 10-cm sterile Petri dish | Fisher | FB0875712 | |
| 15mL sterile tube | n/a | various | |
| 24-well cell culture plate, flat bottom | Fisher | 08-772-1 | |
| Blocking Solution | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chipfiles | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chips | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Chuck | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Corning Easy Grip Disposable Polystyrene Sterile Bottles 250 ml | Fisher | 09-761-4 | |
| Corning Easy Grip Disposable Polystyrene Sterile Bottles 500 ml | Fisher | 09-761-10 | |
| Deionized (DI) water | Fisher | LC267404 | |
| EMS style tweezers with Carbon Fiber tips | Fisher | 50-193-0842 | |
| ExoView Human Tetraspanin Kit | NanoView Biosciences | EV-TETRA-C | Capture for hCD81, hCD9, hCD63, IgG Control + stains for hEV-A (hEV-CD63-647, hEV-CD81-555, hEV-CD9-488) 16 Chips per kit |
| ExoView R100 Imager | NanoView Biosciences | EV-R100 | Interferometric microscope including high specification camera including 3 color fluorescence and label free sizing and counting extracellular vesicles |
| Fluorescently labled huma CD9 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Fluorescently labled human CD63 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Fluorescently labled human CD81 IgG antibody | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Incubation Solution | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Orbital shaker or microplate shaker with digital settings capable of shaking at 500 rpm | n/a | various | |
| Plate Seal | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution A | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution B | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution C | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Solution D | NanoView Biosciences | EV-TETRA-C | Can be found in ExoView Human Tetraspanin Kit. |
| Square/flat tip tweezer | Fisher | 50-239-62 | |
| Straight strong point Boley style tweezers | Fisher | 16-100-124 | |
| Thermo Scientific Adhesive PCR Plate Seals | Fisher | AB-0558 |
Ссылки
- Maas, S. L. N., Breakefield, X. O., Weaver, A. M. Extracellular vesicles: Unique intercellular delivery vehicles. Trends in Cell Biology. 27 (3), 172-188 (2017).
- Shah, R., Patel, T., Freedman, J. E. Circulating extracellular vesicles in human disease. The New England Journal of Medicine. 379 (10), 958-966 (2018).
- Deng, F., Miller, J. A review on protein markers of exosome from different bio-resources and the antibodies used for characterization. Journal of Histotechnology. 42 (4), 226-239 (2019).
- Cohen, O., et al. ’Golden’ exosomes as delivery vehicles to target tumors and overcome intratumoral barriers: in vivo tracking in a model for head and neck cancer. Biomaterials Science. 9 (6), 2103-2114 (2021).
- Han, Y., et al. Overview and update on methods for cargo loading into extracellular vesicles. Processes (Basel). 9 (2), 356(2021).
- Lee, M., Im, W., Kim, M. Exosomes as a potential messenger unit during heterochronic parabiosis for amelioration of Huntington's disease. Neurobiology of Disease. 155, 105374(2021).
- Sun, B., et al. Characterization and biomarker analyses of post-COVID-19 complications and neurological manifestations. Cells. 10 (2), 386(2021).
- Jiang, L., Gu, Y., Du, Y., Liu, J. Exosomes: Diagnostic biomarkers and therapeutic delivery vehicles for cancer. Molecular Pharmaceutics. 16 (8), 3333-3349 (2019).
- Bachurski, D., et al. Extracellular vesicle measurements with nanoparticle tracking analysis - An accuracy and repeatability comparison between NanoSight NS300 and ZetaView. Journal of Extracellular Vesicles. 8 (1), 1596016(2019).
- Carmicheal, J., et al. Label-free characterization of exosome via surface enhanced Raman spectroscopy for the early detection of pancreatic cancer. Nanomedicine. 16, 88-96 (2019).
- Greening, D. W., Xu, R., Ji, H., Tauro, B. J., Simpson, R. J. A protocol for exosome isolation and characterization: evaluation of ultracentrifugation, density-gradient separation, and immunoaffinity capture methods. Methods in Molecular Biology. 1295, 179-209 (2015).
- Wu, Y., Deng, W., Klinke, D. J. Exosomes: improved methods to characterize their morphology, RNA content, and surface protein biomarkers. The Analyst. 140 (19), 6631-6642 (2015).
- van de Vlekkert, D., Qiu, X., Annunziata, I., d'Azzo, A. Isolation and characterization of exosomes from skeletal muscle fibroblasts. Journal of Visualized Experiments: JoVE. (159), (2020).
- Ayala-Mar, S., Donoso-Quezada, J., Gallo-Villanueva, R. C., Perez-Gonzalez, V. H., Gonzalez-Valdez, J. Recent advances and challenges in the recovery and purification of cellular exosomes. Electrophoresis. 40 (23-24), 3036-3049 (2019).
- Daaboul, G. G., et al. Digital detection of exosomes by interferometric imaging. Scientific Reports. 6, 37246(2016).
- Pohler, K. G., et al. Circulating microRNA as candidates for early embryonic viability in cattle. NMolecular Reproduction and Development. 84 (8), 731-743 (2017).
- NanoView Biosciences. ExoView R100 User Guide. v240.4. NanoView Biosciences. , 202(2021).
- Daaboul, G. G., et al. Enhanced light microscopy visualization of virus particles from Zika virus to filamentous ebolaviruses. PLoS One. 12, 0179728(2017).
- ET Consortium. EV-TRACK: transparent reporting and centralizing knowledge in extracellular vesicle research. Nature Methods. 14, 228-232 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены