Method Article
Упрощенная модель трансплантации гетеротопного клапана сердца у грызунов
В этой статье
Резюме
Этот протокол описывает простой и эффективный метод трансплантации листочков аортального клапана под почечную капсулу, чтобы позволить исследовать аллореактивность сердечных клапанов.
Аннотация
Существует острая клиническая потребность в замене сердечного клапана, которая может расти у детей. Трансплантация сердечного клапана предлагается в качестве нового типа трансплантации с потенциалом доставки прочных сердечных клапанов, способных к соматическому росту без необходимости антикоагуляции. Тем не менее, иммунобиология трансплантации сердечных клапанов остается неисследованной, подчеркивая необходимость животных моделей для изучения этого нового типа трансплантации. Предыдущие модели крыс для трансплантации гетеротопного аортального клапана в брюшную аорту были описаны, хотя они технически сложны и дорогостоящи. Для решения этой проблемы была разработана модель субкапсулярной трансплантации почек у грызунов в качестве практического и более простого метода изучения иммунобиологии трансплантации сердечного клапана. В этой модели один листок аортального клапана собирается и вводится в почечное субкапсулярное пространство. Почка легко доступна, а пересаженная ткань надежно содержится в субкапсулярном пространстве, которое хорошо васкуляризировано и может вместить различные размеры тканей. Кроме того, поскольку одна крыса может предоставить три донорских листочка аорты, а одна почка может обеспечить несколько участков для пересаженной ткани, для данного исследования требуется меньше крыс. Здесь описана методика трансплантации, обеспечивающая значительный шаг вперед в изучении трансплантатной иммунологии трансплантации сердечного клапана.
Введение
Врожденные пороки сердца являются наиболее распространенной врожденной инвалидностью у людей, затрагивая 7 из 1000 живорожденных детей каждый год1. В отличие от взрослых пациентов, у которых регулярно имплантируются различные механические и биопротезные клапаны, педиатрические пациенты в настоящее время не имеют хороших вариантов для замены клапанов. Эти обычные имплантаты не имеют потенциала для роста у детей-реципиентов. В результате, болезненные повторные операции требуются для замены имплантатов сердечного клапана на последовательно более крупные версии по мере роста детей, причем пострадавшим детям часто требуется до пяти или более операций на открытом сердце в течение их жизни 2,3. Исследования показали, что свобода от вмешательства или смерти значительно хуже для младенцев, чем для детей старшего возраста, причем 60% младенцев с протезными клапанами сердца сталкиваются с повторной операцией или смертью в течение 3 лет после их первоначальной операции4. Поэтому существует острая необходимость в доставке сердечного клапана, который может расти и поддерживать функцию у педиатрических пациентов.
На протяжении десятилетий попытки доставить растущие заменители сердечных клапанов были сосредоточены на тканевой инженерии и стволовых клетках. Однако попытки перевести эти клапаны в клинику пока не увенчались успехом 5,6,7,8. Для решения этой проблемы трансплантация сердечного клапана предлагается как более творческая операция для доставки растущих замен сердечных клапанов, обладающих способностью к самовосстановлению и предотвращению тромбогенеза. Вместо того, чтобы пересаживать все сердце, пересаживается только сердечный клапан, который затем будет расти вместе с ребенком-реципиентом, подобно обычным пересадкам сердца или легочному автографу Росса 9,10,11. После операции дети-реципиенты будут получать иммуносупрессию до тех пор, пока пересаженный клапан не будет заменен на механический протез взрослого размера, когда рост клапана больше не требуется. Тем не менее, биология трансплантации трансплантатов сердечного клапана остается неисследованной. Поэтому для изучения этого нового типа трансплантации необходимы животные модели.
Несколько моделей крыс были ранее описаны для гетеротопной трансплантации аортального клапана в брюшную аорту 12,13,14,15,16,17,18. Тем не менее, эти модели непомерно сложны, часто требуя обученных хирургов для успешной работы. Кроме того, они являются дорогостоящими и трудоемкими19. Новая модель крысы была разработана для создания более простой животной модели для изучения иммунобиологии трансплантации сердечных клапанов. Створки одиночного аортального клапана иссекают и вставляют в почечное субкапсулярное пространство. Почка особенно подходит для изучения отторжения трансплантата, так как она сильно васкуляризирована с доступом к циркулирующим иммунным клеткам20,21. В то время как некоторые другие использовали почечную субкапсулярную модель для изучения биологии трансплантации других трансплантатов аллотрансплантатов, таких как поджелудочная железа, печень, почки ироговица 22,23,24,25,26,27, это первое описание трансплантации сердечной ткани в этом положении. Здесь описана методика трансплантации, обеспечивающая значительный шаг вперед в изучении трансплантатной иммунологии трансплантации сердечного клапана.
протокол
Исследование было одобрено Комитетом по исследованиям животных в соответствии с Руководством Национальных институтов здравоохранения по уходу и использованию лабораторных животных.
1. Информация о животной модели (Крысы)
- Используйте операционный микроскоп (см. Таблицу материалов) с увеличением до 20 раз для всех хирургических процедур.
- Используйте сингенные (например, Льюис-Льюис) или аллогенные (например, Льюис-Браун Норвегия) штаммы для трансплантации по мере необходимости для эксперимента.
- Используют крыс возрастом от 5-7 недель и массой тела 100-200 г, которые подходят для экспериментального вопроса.
2. Удаление шерсти, подготовка кожи и анестезия
- Выполнять все операции в стерильных условиях.
ПРИМЕЧАНИЕ: Этап выполняется в специальном хирургическом помещении и в стерильных условиях. - Поместите крыс в индукционную камеру анестезии и индуцируйте анестезию с 5% изофлурана в кислороде. Поддерживайте анестезию с 3,5% изофлурана в кислороде на протяжении всей процедуры.
- Для донорской операции удалите шерсть крысы от пупка до грудинной выемки с помощью меховых кусачек. Для операции реципиента обрежьте волосы над хирургическим полем на задней подмышечной линии от ребер до таза. Далее подготовьте кожу хирургическим дезинфицирующим средством.
- Получите хирургическую плоскость анестезии перед началом процедуры. Подтвердите адекватную глубину анестезии, крепко сдавив пальцы ног крысы щипцами. Если крыса уходит от боли, титруйте анестетик по мере необходимости.
- Контролировать частоту дыхания и глубину анестезии клинически на протяжении всей процедуры; уровень изофлурана регулируют по мере необходимости для поддержания частоты дыхания 55-65 вдохов/мин.
3. Донорская операция
- Подготовьте и обезболите крысу, как указано в шаге 2. Разрезайте кожу от мечевидной до грудинной выемки с помощью рассекающих ножниц. Выполните стернэктомию, разрезав ребра с каждой стороны сбоку от грудины до тех пор, пока не будет достигнут оптимальный доступ к сердцу.
- Гепаринизировать крысу инъекцией 100 Ед/100 г в левое предсердие.
- Принесите донора в жертву через экссангинацию.
- Иссечение тимуса для улучшения визуализации крупных сосудов. Затем удаляют сердце блоком с восходящей аорты до уровня безымянной артерии.
4. Подготовка листовок аортального клапана
- Поместите донорское сердце в стерильную чашку Петри сразу после кардиэктомии. Рассечение донорского сердца в ледяном буфере холодного хранения (см. Таблицу материалов).
- Используя щипцы и пружинные ножницы Vannas, рассекайте донорское сердце до тех пор, пока не останется только корень аорты с 1 мм желудочковой манжетой проксимально к аортальному клапану.
- Откройте аортальный клапан, сделав продольный разрез, чтобы открыть синус Вальсальвы между левой и некоронической пазухами, чтобы визуализировать все три листочка.
ПРИМЕЧАНИЕ: Разрез должен быть по всей длине синуса Вальсальвы. Фактические размеры зависят от размера крысы. - Иссейте каждую створку аортального клапана по отдельности. В частности, используйте тупые щипцы, чтобы схватить край листка, и используйте пружинные ножницы Vannas, чтобы иссечь листок, разрезая от одной комиссуры до кольцевого кольца, а затем к следующему комиссару.
ПРИМЕЧАНИЕ: Будьте особенно осторожны, чтобы захватить только край листка, чтобы свести к минимуму разрушение клапанных эндотелиальных клеток. - Храните образцы после иссечения листовок в буферном растворе холодного хранения до тех пор, пока они не будут готовы к имплантации крысе-реципиенту. Имплантируйте все листочки в течение 4 часов после холодного хранения.
5. Операция с получателем
- Подготовьте и обезболите крысу, как указано в шаге 2. Используйте грелку при температуре 36-38 °C для выполнения операции.
- Вводят бупренорфин (0,03 мг/кг подкожно) всем крысам-реципиентам перед операцией и каждые 6-12 ч после операции по мере необходимости для облегчения боли.
- Поместите крысу в правое боковое лежачее положение, чтобы получить доступ к левой почке.
ПРИМЕЧАНИЕ: Левая почка предпочтительна из-за ее более каудального положения относительно правой почки. - Разрезайте кожу по бокам продольно более 1 дюйма с помощью ножниц.
ПРИМЕЧАНИЕ: Разрез должен оставаться меньше размера почки, чтобы обеспечить достаточное напряжение, чтобы предотвратить втягивание почки обратно в брюшную полость во время процедуры. - Аналогично разрезать нижележащую брюшную стенку.
- Экстернализация почек
- Используя большой и указательный пальцы, применяйте легкое давление дорсально и вентрально, используя изогнутые щипцы, чтобы поднять каудальный полюс почки через брюшной и кожный разрез. Аналогичным образом экстернализуют краниальный конец почки.
- Альтернативно, почка может быть экстернализована путем захвата периренального жира и вытягивания вверх с легким напряжением.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не захватывать почку или почечные сосуды напрямую. - Как только почка будет экстернализована, держите ее влажной с теплым физиологическим раствором, просачивающимся на почку.
- Создайте подкапсулярный карман.
- Слегка надавите на почечную капсулу с помощью одного набора тупых щипцов, чтобы почечную капсулу можно было четко отличить от нижележащей паренхимы. Одновременно используя еще один набор тупых щипцов, осторожно схватите капсулу и осторожно потяните вверх, чтобы создать отверстие в капсуле.
ПРИМЕЧАНИЕ: Из-за деликатного характера капсулы требуется минимальное усилие для установки этого разреза. - Продолжайте использовать тупые щипцы для расширения разреза до тех пор, пока не будет создано пространство ~ 2 мм для размещения листа аортального клапана.
- Развивайте неглубокий субкапсулярный карман, который немного больше, чем створка клапана, поднимая край разреза одним набором щипцов и продвигая тупой зонд под почечной капсулой.
- Слегка надавите на почечную капсулу с помощью одного набора тупых щипцов, чтобы почечную капсулу можно было четко отличить от нижележащей паренхимы. Одновременно используя еще один набор тупых щипцов, осторожно схватите капсулу и осторожно потяните вверх, чтобы создать отверстие в капсуле.
- Пересадите аортальный клапан в подкапсулярный карман.
- Извлеките листок аорты из холодного хранилища и поместите его в хирургическое поле.
- Поднимая край волокнистой капсулы, выдвиньте листок аорты в субкапсулярный карман тупыми щипцами.
ПРИМЕЧАНИЕ: Убедитесь, что ткань находится достаточно далеко от разреза, чтобы она прочно закрепилась под капсулой. Следует соблюдать осторожность, чтобы избежать повреждения нижележащей паренхимы или дальнейшего разрыва фиброзной капсулы. - Разрез в почечной капсуле можно оставить открытым.
- Осторожно верните почку обратно в анатомическое положение, используя встречное вытяжение, приложенное к краям разреза.
- Закройте разрез брюшной полости бегущим стерильным хирургическим швом. Закройте кожу скобами.
- Послеоперационный уход
- После операции поместите крысу в чистую клетку на грелку с доступом к пище и воде.
- Ежедневно контролируйте животное, чтобы оценить регулярное заживление ран и признаки боли или дистресса. Удалите скобы через 7-10 дней.
6. Сбор ткани для анализа
- В выбранных конечных точках после трансплантации усыпляют животное путем экссангинации. В частности, выполняют срединную лапаротомию и трансецируют брюшную аорту под 5% изофлурана в кислороде.
- Мобилизуйте почку и иссекните ее, разрезав ножницами почечную артерию, вену и мочеточник.
ПРИМЕЧАНИЕ: Следите за тем, чтобы не захватить область, содержащую пересаженный листок. - Поместите почку в формалин на ночь, вставьте ее в парафин и разделите для нужного окрашивания. Ориентируйте образец с почечной капсулой, обращенной к передней части, и паренхимой почки, обращенной кзади.
Результаты
Графическое изображение экспериментальной конструкции предусмотрено для модели крысы (рисунок 1). Кроме того, корень аорты, рассеченный из сердца донора, и индивидуальный листок аортального клапана, подготовленный для имплантации, также показаны на рисунке 2. Далее репрезентативное изображение положения створки аортального клапана под почечной капсулой для имплантации показано на рисунке 3А и через 3, 7 и 28 дней у крысы-реципиента (рисунки 3B-D), демонстрируя легкость обнаружения и восстановления пересаженной ткани.
Листочки аортального клапана сохраняют свою родную архитектуру после гетеротопной трансплантации у сингенных животных, демонстрируя полезность этой модели в качестве базового уровня для сравнения иммунного ответа при аллогенных трансплантациях. В частности, гистология с окрашиванием гематоксилина и эозина (H & E) показала, что клапанные листочки в сингенных трансплантатах через 7 дней были структурно неповрежденными без признаков отечного отека (рисунок 4A). Структурная целостность створки клапана была дополнительно подтверждена иммуногистохимией альфа-гладкомышечного актина (aSMA) и CD31 (рисунок 4B).
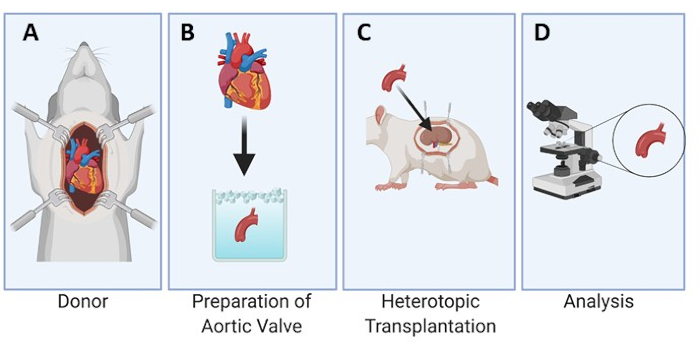
Рисунок 1: Экспериментальное проектирование гетеротопной трансплантации аортального клапана под почечную капсулу у крыс. Сердце собирается у крысы-донора (А). Створки аортального клапана рассекают и хранят в холодном хранилище (В) до процесса имплантации под почечную капсулу у крысы-реципиента (С). Затем листовки эксплантируются в заданные временные точки и анализируются микроскопически (D). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Подготовка створки аортального клапана к имплантации. Пример разрезания корня аорты из донорского сердца (А) и дальнейшего рассечения створки аортального клапана для имплантации (В). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Визуализация створки аортального клапана под почечной капсулой. Листок аортального клапана визуализируется под почечной капсулой при имплантации (A), через 3 (B), 7 (C) и 28 дней (D) у сингенных животных и через 3 (E), 7 (F) и 28 дней (G) у аллогенных животных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Листочки аортального клапана остаются структурно неповрежденными после трансплантации под почечную капсулу в течение 7 дней у сингенных животных. В верхнем ряду показано окрашивание H&E и иммуноокрашивание для DAPI, aSMA и CD31 для управления сердечными клапанами, которые были приобретены, но не пересажены. Нижний ряд показывает окрашивание H &E и иммуноокрашение для DAPI, aSMA и CD31 в сингенном клапанном листке, эксплантированном через 7 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Важность и потенциальные области применения
В то время как механические и биопротезные сердечные клапаны обычно используются у взрослых пациентов, нуждающихся в замене клапанов, эти клапаны не имеют потенциала для роста и, следовательно, являются неоптимальными для педиатрических пациентов. Трансплантация сердечного клапана - это экспериментальная операция, предназначенная для доставки растущих замен сердечных клапанов для новорожденных и младенцев с врожденными пороками сердца. Однако, в отличие от трансплантационной иммунобиологии обычных трансплантаций сердца, трансплантологическая иммунобиология этого нового типа трансплантации остается плохо изученной. Здесь описана уникальная крысиная модель субкапсулярной почечной трансплантации листочков аортального клапана, обеспечивающая значительный шаг вперед в изучении трансплантационной иммунобиологии трансплантации сердечного клапана.
Почечное субкапсулярное пространство обеспечивает оптимальную среду для изучения трансплантационной иммунобиологии сердечных клапанов. Трансплантированная ткань надежно содержится в хорошо васкуляризированном месте с доступом к циркулирующим иммунным клеткам20. Кроме того, субкапсулярные модели ранее успешно использовались для тестирования отторжения аллотрансплантата во многих тканях, таких как поджелудочная железа, печень, почки и другие типы клеток 22,23,24,25,26,27, что указывает на то, что эта модель оправдана при изучении иммуногенности листков аортального клапана.
Эта модель имеет несколько протенциональных приложений для изучения трансплантатной иммунологии аортальных клапанов. Во-первых, модель может быть использована для определения уровня системного подавления иммунитета, необходимого для трансплантации сердечного клапана для предотвращения отторжения трансплантата, такого как такролимус, микофенолат и стероиды. Кроме того, несколько исследований показали, что ткань клапана может быть иммунологически отличной от другой ткани сердца, поскольку клапаны относительно щадят во время молниеносного отторжения обычных трансплантаций сердца 28,29,30. Эта модель позволяет исследовать эту концепцию, поскольку субкапсулярное пространство может вмещать различные типы тканей, такие как клапанный листок и миокард, для сравнения иммуногенности этих тканей.
Эта модель выгодна, потому что она технически проста, быстра и имеет высокую выживаемость с низким риском осложнений. Поскольку каждый донор может предоставить три листка аортального клапана, одна крыса может служить донором для трех разных реципиентов. В среднем продолжительность операции донора составила 27,2 мин (n=12), а продолжительность операции реципиента – 29,7 мин (n=36). Выживаемость реципиентной операции составила 97,2% (n = 35/36), при одной интраоперационной смерти из-за угнетения дыхания. Минимальное кровотечение из-за травмы почечной паренхимы при создании субкапсулярного кармана отмечалось в 11,1% операций реципиента. Тем не менее, кровотечение легко контролировалось во всех случаях с помощью компрессии из аппликатора хлопкового наконечника. Один образец был выбит из субкапсулярного пространства и не восстановлен при объяснении даже через 7 дней.
Ранее створки клапана эксплантировали путем удаления их из субкапсулярного пространства и встраивали, секционировали и окрашивали без какой-либо прикрепленной ткани аорты. Однако этот метод является неоптимальным, так как сами листовки чрезвычайно малы, тонки и прозрачны, что приводит к потере нескольких образцов при обработке. Вместо этого рекомендуется удалить почку блоком и встроить и разрезать ткань, все еще закрепленную под почечной капсулой, чтобы гарантировать, что образцы не будут потеряны. Кроме того, такой подход сводит к минимуму травмы и манипуляции с листовкой.
Критические шаги
Критическими этапами процедуры являются установление хирургической плоскости анестезии, разрезание брюшной стенки над почками, потрошение почки, поднятие субкапсулярного лоскута, введение гетеротопной трансплантационной ткани, получение гемостаза, возвращение почки в анатомическое положение и закрытие кожи.
Изменения и устранение неполадок
Хотя это первое описание трансплантации сердечной ткани под почечную капсулу, несколько других описали трансплантацию других типов тканей в почечном субкапсулярном пространстве 20,22,23,24,25,26,27. В этом протоколе были внесены незначительные коррективы в предыдущие субкапсулярные модели для оптимизации техники и минимизации осложнений. В частности, в то время как другие рекомендовали использовать пружинные ножницы Vannas для первоначального разреза в почечной капсуле 20,26, этот метод с большей вероятностью вызовет травму основной паренхимы и приведет к образованию субкапсулярной гематомы. Слишком сильное кровотечение приведет к растяжению капсулы и поставит под угрозу безопасность пересаженного26. Поэтому для вскрытия капсулы следует использовать тупые щипцы. Кроме того, в то время как некоторые протоколы выступают за размещение коммерческих продуктов с гомостатическим свойством над капсульным разрезом26,31, этот шаг не нужен, пока ткань продвигается достаточно далеко в субкапсулярный карман.
У более крупных крыс почка может быть покрыта периренальным жиром, и экстернализация почки путем лифтинга с изогнутыми щипцами может быть невозможна. В этих случаях лучше всего экстернализировать почку, осторожно потянув периренальный жир щипцами и вытянув почку из брюшной полости, не вызывая повреждения или кровотечения.
Сравнение с существующими гетеротопными моделями трансплантации
В то время как несколько других животных моделей для гетеротопной трансплантации аортального клапана были ранее описаны 12,13,14,15,16,17,18, текущий протокол обеспечивает простую и более практичную альтернативу, которая улучшает предыдущие модели несколькими способами. Во-первых, из-за технически простого характера процедуры для успешной работы требуется очень мало подготовки. Это резко контрастирует с ранее описанными гетеротопными трансплантациями аортального клапана в брюшную аорту. Таким образом, эта модель обеспечивает более практичную и экономически эффективную альтернативу для изучения трансплантации аортального клапана, сводя к минимуму заболеваемость, боль и смертность крыс. Кроме того, поскольку для операции реципиента необходим только один листок аортального клапана, и каждая крыса-донор предоставляет три листка, для любого данного эксперимента требуется меньше крыс-доноров. Кроме того, имплантация ткани в контралатеральную почку или отдельный субкапсулярный карман может позволить внутренний контроль или сравнение иммунных реакций на различные ткани в пределах одной крысы. В этом случае лучшим подходом является разрез лапаротомии средней линии.
В дополнение к животным моделям, описывающим трансплантацию гетеротопного аортального клапана в брюшную аорту, в других исследованиях использовалась подкожная модель для изучения иммуногенности аортальных клапанов32. Хотя этот подход, несомненно, более прост, чем трансплантация в брюшную аорту, существующие данные свидетельствуют о том, что подкожная имплантация является менее эффективным методом представления антигена33,34. Имплантированный образец также сложно найти и проанализировать. Таким образом, почечное субкапсулярное пространство предлагается в качестве места имплантации, которое является одновременно упрощенным, но оптимальным для изучения биологии трансплантации аортального клапана.
Таким образом, недавно предложенная модель служит дополнением к арсеналу ученых для изучения трансплантации сердечного клапана и дополняет ранее описанные модели.
Ограничения
Хотя трансплантация листочков аортального клапана под почечную капсулу является эффективным методом изучения аллоиммунитета in vivo, существуют некоторые ограничения этой модели. Хотя субкапсулярное пространство хорошо васкуляризировано, оно не предлагает ту же гемодинамическую среду, что и субкоронарное положение. Это может повлиять на иммунный ответ на трансплантированную ткань. Некоторые предположили, что различные иммунные свойства, наблюдаемые в ткани клапана, могут быть результатом кровотока высокого давления над аортальным клапаном в субкоронарном положении, сводя на нет хемотаксический ответ28,35. Кроме того, эта модель недостаточна для изучения влияния аллорактивности на функцию клапана, поскольку листочки не выполняют свою физиологическую функцию под почечной капсулой. Тем не менее, аналогичные ограничения существуют для гетеротопных моделей трансплантации брюшной аорты, поскольку успех этих моделей зависит от того, чтобы сделать листочки клапана некомпетентными, чтобы избежать тромбоза трансплантата15,36.
Ограничения протокола включают возможность смещения тканей из почечного субкапсулярного пространства и невосстановимости (1 из 36 животных). Другим ограничением является смерть животного во время операции (1 из 36 животных); однако смерть была вызвана передозировкой бупренорфина, и могут быть использованы другие методы дозирования анальгезии.
Раскрытие информации
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Рисунок 1 был создан с помощью biorender.com. Эта работа была частично поддержана Программой хирургических исследователей Фонда AATS в TKR, Детским фондом передового опыта, проводимым Департаментом педиатрии в Медицинском университете Южной Каролины в TKR, грантом Emerson Rose Heart Foundation для TKR, филантропией сенатора Пола Кэмпбелла в TKR, грантами NIH-NHLBI Institutional Postdoctoral Training Grants (T32 HL-007260) для JHK и BG, и Медицинский колледж Медицинского университета Южной Каролины ( Медицинский колледж Южной Каролины — Исследовательский фонд FLEX для MAH.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlordie, USP | Baxter | NDC 0338-0048-04 | |
| 4-0 Polyglactin 910 | Ethicon | J415H | |
| 7.5% Povidone-Iodine | CareFusion | 29904-004 | |
| 70% ETOH | Fisher Scientific | BP82031GAL | |
| Anesthesia induction chamber | Harvard Apparatus | 75-2030 | Air-tight inducton chamber for rats |
| Anesthesia machine | Harvard Apparatus | 75-0238 | Mobile Anesthesia System with Passive Scavenging |
| Anesthesia Mask | Harvard Apparatus | 59-8255 | Rat anesthesia mask |
| Brown Norway Rats (BN/Crl) | Charles River | Strain Code 091 | Male, 5-7 weeks, 100-200 g |
| Buprenorphine Hydrochloride, 0.3 mg/mL | PAR Pharmaceutical | NDC 42023-179-05 | 0.03 mg/kg, administered subcutaneously |
| Electric hair clippers | WAHL | 79434 | |
| Electric Heating Pad | Harvard Apparatus | 72-0492 | Maintained at 36-38 °C |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | 100U/100g injection into the left atrium |
| Insulin Syringe, 1 mL | Fisher Scientific | 14-841-33 | |
| Iris forceps curved | World Precision Instruments | 15917 | |
| Iris forceps straight | World Precision Instruments | 15916 | |
| Isoflurane, USP | Piramal Critical Care | NDC 66794-017-25 | Induced at 5% isoflurance in oxygen and maintained with 3.5% isoflurane in oxygen |
| Lewis Rats (LEW/ Crl) | Charles River | Strain Code 004 | Male, 5-7 weeks, 100-200 g |
| Micro forceps | World Precision Instruments | 500233 | Dumont #5 |
| Micro scissors | World Precision Instruments | 501930 | Spring-loaded Vannas Scissors |
| Needle Driver | World Precision Instruments | 500226 | Ryder Needle Driver |
| Operating microscope | AmScope | SM-3BZ-80S | 3.5x - 90x Stereo Microscope |
| Petri Dish | Fisher Scientific | FB0875714 | |
| Petrolatum ophthalmic ointment | Dechra | NDC 17033-211-38 | |
| Skin staples | Ethicon | PXR35 | Proximate 35 |
| Sterile cotton swabs | Puritan | 25-806 1WC | |
| Sterile gauze sponges | Fisher Scientific | 22-037-902 | |
| Surgical Scissors | World Precision Instruments | 1962C | Metzenbaum Scissors |
| University of Wisconsin Buffer (Servator B) | S.A.L.F S.p.A. | 6484A1 | Stored at 4 °C |
Ссылки
- Van Der Linde, D., et al. Birth prevalence of congenital heart disease worldwide: A systematic review and meta-analysis. Journal of the American College of Cardiology. 58 (21), 2241-2247 (2011).
- Jacobs, J. P., et al. Reoperations for pediatric and congenital heart disease: An analysis of the Society of Thoracic Surgeons (STS) congenital heart surgery database. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 17 (1), 2-8 (2014).
- Syedain, Z. H., et al. Pediatric tri-tube valved conduits made from fibroblast-produced extracellular matrix evaluated over 52 weeks in growing lambs. Science Translational Medicine. 13 (585), 1-16 (2021).
- Khan, M. S., Samayoa, A. X., Chen, D. W., Petit, C. J., Fraser, C. D. Contemporary experience with surgical treatment of aortic valve disease in children. Journal of Thoracic and Cardiovascular Surgery. 146 (3), 512-521 (2013).
- Boyd, R., Parisi, F., Kalfa, D. State of the art: Tissue engineering in congenital heart surgery. Seminars in Thoracic and Cardiovascular Surgery. 31 (4), 807-817 (2019).
- Feins, E. N., Emani, S. M. Expandable valves, annuloplasty rings, shunts, and bands for growing children. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 23, 17-23 (2020).
- Lintas, V., et al. TCT-795 Human cell derived off-the-shelf tissue engineered heart valves for next generation transcatheter aortic valve replacement: a proof-of-concept study in adult sheep. Journal of the American College of Cardiology. 70 (18), 271 (2017).
- Blum, K. M., Drews, J. D., Breuer, C. K. Tissue-engineered heart valves: A call for mechanistic studies. Tissue Engineering Part B: Reviews. 24 (3), 240-253 (2018).
- Bernstein, D., et al. Cardiac growth after pediatric heart transplantation. Circulation. 85 (4), 1433-1439 (1992).
- Delmo Walter, E. M., et al. Adaptive growth and remodeling of transplanted hearts in children. Europeon Journal of Cardiothoracic Surgery. 40 (6), 1374-1383 (2011).
- Simon, P., et al. Growth of the pulmonary autograft after the Ross operation in childhood. Europeon Journal of Cardiothoracic Surgery. 19 (2), 118-121 (2001).
- Oei, F. B. S., et al. A size-matching heterotopic aortic valve implantation model in the rat. Journal of Surgical Research. 87 (2), 239-244 (1999).
- Oei, F. B. S., et al. Heart valve dysfunction resulting from cellular rejection in a novel heterotopic transplantation rat model. Transplant International. 13, (2000).
- El Khatib, H., Lupinetti, F. M. Antigenicity of fresh and cryopreserved rat valve allografts. Transplantation. 49 (4), 765-767 (1990).
- Yankah, A. C., Wottge, H. U. Allograft conduit wall calcification in a model of chronic arterial graft rejection. Journal of Cardiac Surgery. 12 (2), 86-92 (1997).
- Moustapha, A., et al. Aortic valve grafts in the rat: Evidence for rejection. Journal of Thoracic and Cardiovascualr Surgery. 114 (6), 891-902 (1997).
- Légaré, J. F., et al. Prevention of allograft heart valve failure in a rat model. Journal of Thoracic and Cardiovascualr Surgery. 122 (2), 310-317 (2001).
- Legare, J. F., Lee, T. D. G., Creaser, K., Ross, D. B., Green, M. T lymphocytes mediate leaflet destruction and allograft aortic valve failure in rats. The Annals of Thoracic Surgery. 70 (4), 1238-1245 (2000).
- Niimi, M. The technique for heterotopic cardiac transplantation in mice: Experience of 3000 operations by one surgeon. Journal of Heart and Lung Transplantation. 20 (10), 1123-1128 (2001).
- Burgin, M., et al. Kidney Subcapsular Allograft Transplants as a Model to Test Virus-Derived Chemokine-Modulating Proteins as Therapeutics. Methods in molecular biology. 2225, 257-273 (2021).
- Foglia, R. P., DiPreta, J., Donahoe, P. K., Statter, M. B. Fetal allograft survival in immunocompetent recipients is age dependent and organ specific. Annals of Surgery. 204 (4), 402-410 (1986).
- Cunha, G. R., Baskin, L. Use of sub-renal capsule transplantation in developmental biology. Differentiation. 91 (4-5), 4-9 (2016).
- Hori, J., Joyce, N., Streilein, J. W. Epithelium-deficient corneal allografts display immune privilege beneath the kidney capsule. Investigative Opthalmology & Visual Science. 41 (2), 443-452 (2000).
- Mandel, T., et al. transplantation of organ cultured fetal pig pancreas in non-obese diabetic (NOD) mice and primates (Macaca fascicularis). Xenotransplantation. 2 (3), 128-132 (1995).
- Ricordi, C., Flye, M. W., Lacy, P. E. Renal subcapsular transplantation of clusters of hepatocytes in conjunction with pancreatic islets. Transplantation. 45 (6), 1148-1150 (1988).
- Shultz, L. D., et al. Subcapsular transplantation of tissue in the kidney. Cold Spring Harbor Protocols. 2014 (7), 737-740 (2014).
- Vanden Berg, C. W., et al. Renal subcapsular transplantation of PSC-derived kidney organoids induces neo-vasculogenesis and significant glomerular and tubular maturation in vivo. Stem Cell Reports. 10 (3), 751-765 (2018).
- Mitchell, R. N., Jonas, R. A., Schoen, F. J. Pathology of explanted cryopreserved allograft heart valves: Comparison with aortic valves from orthotopic heart transplants. Journal of Thoracic and Cardiovasular Surgery. 115 (1), 118-127 (1998).
- Valante, M., et al. The aortic valve after heart transplantation. Annals of Thoracic Surgery. 60, (1995).
- O'Brien, M. F., Stafford, E. G., Gardner, M. A. H., Pohlner, P. G., McGiffin, D. C. A comparison of aortic valve replacement with viable cryopreserved and fresh allograft valves, with a note on chromosomal studies. Journal of Thoracic and Cardiovascular Surgery. 94 (6), 812-823 (1987).
- Ng, T. F., Osawa, H., Hori, J., Young, M. J., Streilein, J. W. Allogeneic neonatal neuronal retina grafts display partial immune privilege in the subcapsular space of the kidney. The Journal of Immunology. 169 (10), 5601-5606 (2002).
- Heslop, B. F., Wilson, S. E., Hardy, B. E. Antigenicity of aortic valve allografts. Annals of Surgery. 177 (3), 301-306 (1973).
- Steinmuller, D., Weiner, L. J. Evocation and persistence of transplantation immunity in rats. Transplantation. 1 (1), 97-106 (1963).
- Billingham, R. E., Brent, L., Brown, J. B., Medawar, P. B. Time of onset and duration of transplantation immunity. Plastic and Reconstructive Surgery. 24 (1), 410-413 (1959).
- Tector, A. J., Boyd, W. C., Korns, M. E. Aortic valve allograft rejection. Journal of Thoracic and Cardiovascular Surgery. 62 (4), 592-601 (1971).
- Sugimura, Y., Schmidt, A. K., Lichtenberg, A., Akhyari, P., Assmann, A. A rat model for the in vivo assessment of biological and tissue-engineered valvular and vascular grafts. Tissue Engineering Methods (Part C). 23 (12), 982-994 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены