Method Article
מודל פשוט להשתלת מסתם לב הטרוטופי במכרסמים
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר שיטה פשוטה ויעילה להשתלת עלוני מסתם אבי העורקים מתחת לכמוסה הכליתית כדי לאפשר מחקר של אלוראקטיביות של מסתמי הלב.
Abstract
יש צורך קליני דחוף בתחליפי מסתמי לב שיכולים לגדול אצל ילדים. השתלת מסתם הלב מוצעת כסוג חדש של השתלה עם פוטנציאל לספק מסתמי לב עמידים המסוגלים לצמיחה סומטית ללא צורך בנוגדי קרישה. עם זאת, האימונוביולוגיה של השתלות מסתמי לב עדיין לא נחקרה, מה שמדגיש את הצורך במודלים של בעלי חיים כדי לחקור סוג חדש זה של השתלה. מודלים קודמים של חולדות להשתלת מסתם אבי העורקים ההטרוטופי באבי העורקים הבטני תוארו, אם כי הם מאתגרים מבחינה טכנית ויקרים. כדי להתמודד עם אתגר זה, פותח מודל השתלה תת-קפסולרית של הכליה במכרסמים כשיטה מעשית ופשוטה יותר לחקר אימונוביולוגיה של השתלת מסתמי לב. במודל זה, עלון שסתום אבי העורקים יחיד נקטף ומוכנס לחלל התת-קפסולרי הכלייתי. הכליה נגישה בקלות, והרקמה המושתלת מוכלת היטב בחלל תת-קפסולרי שהוא כלי דם היטב ויכול להכיל מגוון גדלי רקמות. יתר על כן, מכיוון שחולדה בודדת יכולה לספק שלושה עלוני אבי העורקים של התורם וכליה אחת יכולה לספק מספר אתרים לרקמות מושתלות, פחות חולדות נדרשות למחקר נתון. כאן מתוארת טכניקת ההשתלה, המספקת צעד משמעותי קדימה בחקר אימונולוגיה של השתלת מסתמי לב.
Introduction
מומי לב מולדים הם הנכות המולדת הנפוצה ביותר בבני אדם, המשפיעים על 7 מתוך 1,000 ילדים שנולדו חיים בכל שנה1. בניגוד לחולים מבוגרים בהם מושתלים באופן שגרתי מסתמים מכניים וביו-פרוסטטיים שונים, למטופלים בילדים אין כיום אפשרויות טובות להחלפת מסתם. לשתלים קונבנציונליים אלה אין פוטנציאל לגדול אצל ילדים מושתלים. כתוצאה מכך, ניתוחים חוזרים חולניים נדרשים כדי להחליף את שתלי מסתם הלב בגרסאות גדולות יותר ברצף ככל שהילדים גדלים, כאשר ילדים מושפעים נזקקים לעתים קרובות לעד חמישה ניתוחי לב פתוח או יותר במהלך חייהם 2,3. מחקרים הראו כי החופש מהתערבות או ממוות דל באופן משמעותי בתינוקות מאשר בילדים גדולים יותר, כאשר 60% מהתינוקות עם מסתמי לב תותבים עומדים בפני ניתוח חוזר או מוות תוך 3 שנים מהניתוח הראשוני שלהם4. לכן, יש צורך דחוף לספק מסתם לב שיכול לגדול ולשמור על תפקוד בחולי ילדים.
במשך עשרות שנים, ניסיונות לספק תחליפי מסתמי לב הולכים וגדלים התרכזו בהנדסת רקמות ובתאי גזע. עם זאת, הניסיונות לתרגם מסתמים אלה למרפאה לא צלחו עד כה 5,6,7,7,8. כדי להתמודד עם זה, השתלת מסתם לב מוצעת כפעולה יצירתית יותר למתן תחליפי מסתמי לב הולכים וגדלים בעלי יכולת לתקן את עצמם ולהימנע מתרומבוגנזה. במקום להשתיל את כל הלב, רק מסתם הלב מושתל ואז יגדל עם הילד המושתל, בדומה להשתלת לב קונבנציונלית או לחתימה ריאתית של רוס 9,10,11. לאחר הניתוח, ילדים מושתלים יקבלו דיכוי חיסוני עד שניתן יהיה להחליף את המסתם המושתל בתותבת מכנית בגודל מבוגר כאשר צמיחת המסתם אינה נדרשת עוד. עם זאת, הביולוגיה של ההשתלות של השתלות מסתמי הלב נותרה ללא בדיקה. לכן, יש צורך במודלים של בעלי חיים כדי לחקור סוג חדש זה של השתלה.
מספר מודלים של חולדות תוארו בעבר להשתלה הטרוטופית של המסתם אבי העורקים לתוך אבי העורקים הבטני12,13,14,15,16,17,18. עם זאת, מודלים אלה הם מסובכים מאוד, ולעתים קרובות דורשים מנתחים מיומנים לנתח בהצלחה. בנוסף, הם יקרים וגוזלים זמןרב 19. מודל חדש של חולדות פותח כדי ליצור מודל חייתי פשוט יותר לחקר האימונוביולוגיה של השתלות מסתמי לב. עלוני מסתם אבי העורקים הבודדים נכרתים ומוכנסים לחלל התת-קפסולרי הכלייתי. הכליה מתאימה במיוחד לחקר דחיית ההשתלה מכיוון שהיא מאוד וסקולרית עם גישה לתאי חיסון במחזור20,21. בעוד שכמה אחרים השתמשו במודל תת-קפסולרי כלייתי כדי לחקור את הביולוגיה של ההשתלות של השתלות אלוגרפט אחרות כגון לבלב, כבד, כליה וקרנית 22,23,24,25,26,27, זהו התיאור הראשון של השתלת רקמת לב במצב זה. כאן מתוארת טכניקת ההשתלה, המספקת צעד משמעותי קדימה בחקר אימונולוגיה של השתלת מסתמי לב.
Protocol
המחקר אושר על ידי הוועדה לחקר בעלי חיים בעקבות המדריך הלאומי של המכונים הלאומיים לבריאות לטיפול בחיות מעבדה ולשימוש בהן.
1. מידע על מודל החיה (חולדות)
- השתמש במיקרוסקופ ניתוח (ראה טבלת חומרים) עם הגדלה של עד פי 20 עבור כל ההליכים הכירורגיים.
- השתמש בזנים סינגניים (כגון לואיס-לואיס) או אלוגניים (כגון לואיס-בראון נורבגיה) עבור ההשתלות לפי הצורך לניסוי.
- השתמש בחולדות בגיל בין 5-7 שבועות ומשקל גוף של 100-200 גרם המתאימים לשאלת הניסוי.
2. הסרת פרווה, הכנת העור והרדמה
- בצע את כל הפעולות בתנאים סטריליים.
הערה: הצעד מבוצע בחלל כירורגי ייעודי ובתנאים סטריליים. - מכניסים את החולדות לתא אינדוקציה להרדמה וגורמים להרדמה עם 5% איזופלורן בחמצן. יש לשמור על הרדמה עם 3.5% איזופלורן בחמצן לאורך כל ההליך.
- לצורך ניתוח התורם, יש להסיר את פרוות החולדה מהטבור אל חריץ החזה באמצעות קוצץ פרווה. עבור הניתוח המקבל, מקצצים את השיער מעל שדה הניתוח בקו בית השחי האחורי מהצלעות לאגן. לאחר מכן, להכין את העור עם חיטוי כירורגי.
- קבל מישור כירורגי של הרדמה לפני תחילת ההליך. לאשר עומק נאות של הרדמה על ידי דחיסה חזקה של בהונות החולדה עם מלקחיים. אם החולדה נסוגה מכאבים, תעבירו את חומר ההרדמה לפי הצורך.
- לפקח על קצב הנשימה ואת עומק ההרדמה באופן קליני לאורך ההליך; רמת האיזופלורן מותאמת לפי הצורך כדי לשמור על קצב נשימה של 55-65 נשימות לדקה.
3. פעולת התורם
- להכין ולהרדים את החולדה כאמור בשלב 2. מכניסים את העור מהחריץ ה-xiphoid לחריץ החזה באמצעות מספריים מנתחים. בצע כריתת עצם על ידי חיתוך הצלעות מכל צד לרוחב עצם החזה עד להשגת גישה אופטימלית ללב.
- הפרין את החולדה עם זריקה של 100 U/100 גרם לאטריום השמאלי.
- להקריב את התורם באמצעות אקסנגווינציה.
- לבלות את התימוס כדי לשפר את ההדמיה של הכלים הגדולים. לאחר מכן, הסר את גוש הלב עם אבי העורקים העולה עד לרמת העורק המועמד.
4. הכנת עלוני מסתם אבי העורקים
- מניחים את לב התורם בצלחת פטרי סטרילית מיד לאחר כריתת הלב. נתחו את לב התורם במאגר אחסון קר כקרח (ראו טבלת חומרים).
- באמצעות מלקחיים ומספריים קפיציים של Vannas, מנתחים את לב התורם עד שנותר רק שורש אבי העורקים עם שרוול חדרי בקוטר 1 מ"מ פרוקסימלי למסתם אבי העורקים.
- פתח את המסתם אבי העורקים על ידי ביצוע חתך אורכי כדי לפתוח את הסינוסים של Valsalva בין הסינוסים השמאליים והלא כליליים כדי לדמיין את כל שלושת העלונים.
הערה: החתך צריך להיות לכל אורכו של הסינוס של Valsalva. הממדים בפועל תלויים בגודל החולדה. - בלו כל עלון שסתום אבי העורקים בנפרד. באופן ספציפי, השתמש במלקחיים קהים כדי לתפוס את קצה העלון והשתמש במספריים של קפיצי Vannas כדי לכרות את העלון על ידי חיתוך מאחד הקומיסורים עד האנולוס, ולאחר מכן לכיוון הקומיסורה הבאה.
הערה: הקפידו במיוחד לתפוס רק את קצה העלון כדי למזער את ההפרעה לתאי האנדותל הוולולריים. - אחסנו את הדגימות לאחר כריתת העלון בתמיסת מאגר אחסון קר כקרח עד שיהיו מוכנות להשתלה בחולדה המקבלת. שתלו את כל העלונים תוך 4 שעות מאחסון קר.
5. פעולת הנמען
- להכין ולהרדים את החולדה כאמור בשלב 2. השתמש בכרית חימום המתוחזקת בטמפרטורה של 36-38 מעלות צלזיוס כדי לבצע את הניתוח.
- יש לתת בופרנורפין (0.03 מ"ג/ק"ג תת עורי) לכל החולדות המושתלות לפני הניתוח וכל 6-12 שעות לאחר הניתוח לפי הצורך כדי להקל על הכאב.
- מניחים את החולדה בתנוחת משענת צידית ימנית כדי לגשת לכליה השמאלית.
הערה: הכליה השמאלית עדיפה בשל מיקומה הקאודאלי יותר ביחס לכליה הימנית. - העבירו את העור מעל האגף לאורך לאורך 1 אינץ' באמצעות מספריים.
הערה: החתך חייב להישאר קטן מגודל הכליה כדי לספק מספיק מתח כדי למנוע מהכליה לסגת בחזרה לחלל הבטן במהלך ההליך. - באופן דומה, יש לנטות את דופן הבטן הבסיסית.
- החצינו את הכליה
- באמצעות האגודל והאצבע הקדמית, הפעילו לחץ קל באופן דורסלי וגחוני תוך שימוש במלקחיים מעוקלים כדי להרים את הקוטב הקאודלי של הכליה דרך חתך הבטן והעור. להחצין את קצה הגולגולת של הכליה באופן דומה.
- לחלופין, הכליה עשויה להיות מוחצנת על ידי אחיזת השומן הפרירני ומשיכה כלפי מעלה במתח קל.
הערה: היזהרו שלא לתפוס את הכליה או את כלי הכליה ישירות. - לאחר שהכליה מוחצנת, יש לשמור אותה לחה עם מלח חם המטפטף על הכליה.
- צור כיס תת-קפסולרי.
- הפעילו לחץ קלות על הקפסולה הכליתית באמצעות קבוצה אחת של מלקחיים קהים, כך שניתן להבחין בבירור בין הקפסולה הכליתית לבין הפרנכימה הבסיסית. בו זמנית באמצעות קבוצה נוספת של מלקחיים קהים, תפסו בזהירות את הקפסולה ומשכו בעדינות כלפי מעלה כדי ליצור חור בקפסולה.
הערה: בשל האופי העדין של הקפסולה, נדרש כוח מינימלי כדי לבסס חתך זה. - המשך להשתמש במלקחיים קהים כדי להאריך את החתך עד שייווצר רווח של כ-2 מ"מ כדי להכיל את עלון המסתם של אבי העורקים.
- לפתח כיס תת-קפסולרי רדוד שהוא מעט גדול יותר מעלון השסתום תוך הרמת קצה החתך עם קבוצה אחת של מלקחיים וקידום גשושית קהה מתחת לקפסולת הכליה.
- הפעילו לחץ קלות על הקפסולה הכליתית באמצעות קבוצה אחת של מלקחיים קהים, כך שניתן להבחין בבירור בין הקפסולה הכליתית לבין הפרנכימה הבסיסית. בו זמנית באמצעות קבוצה נוספת של מלקחיים קהים, תפסו בזהירות את הקפסולה ומשכו בעדינות כלפי מעלה כדי ליצור חור בקפסולה.
- השתלת המסתם אבי העורקים בכיס התת-קפסולרי.
- שלפו את עלון אבי העורקים מאחסון קר והניחו אותו בשדה הניתוח.
- תוך כדי הרמת הקפסולה הסיבית בקצה, מקדמים את עלון אבי העורקים לכיס התת-קפסולרי עם מלקחיים קהים.
הערה: ודא שהרקמה רחוקה מספיק מהחתך, כך שהיא מאובטחת היטב מתחת לקפסולה. יש להקפיד כדי למנוע נזק לפרנכימה הבסיסית או לקריעה נוספת של הקפסולה הסיבית. - את החתך בקפסולת הכליה ניתן להשאיר פתוח.
- דוחפים את הכליה בעדינות בחזרה למקומה האנטומי באמצעות מתיחה נגדית המופעלת על קצוות החתך.
- סגור את חתך הבטן עם תפר כירורגי סטרילי רץ. סגור את העור עם סיכות.
- טיפול לאחר הניתוח
- לאחר הניתוח, הניחו את החולדה בכלוב נקי על משטח חימום עם גישה למזון ולמים.
- עקוב אחר בעל החיים מדי יום כדי להעריך ריפוי פצעים שגרתי וסימני כאב או מצוקה. הסר את המצרכים לאחר 7-10 ימים.
6. איסוף רקמות לניתוח
- בנקודות קצה נבחרות לאחר ההשתלה, המתת החסד את החיה על ידי אקסנגווינציה. באופן ספציפי, לבצע לפרוטומיה חציונית ולהעביר את אבי העורקים הבטני מתחת 5% isoflurane בחמצן.
- גייסו את הכליה וכרתו אותה על ידי חיתוך עורק הכליה, הווריד והשופכן במספריים.
הערה: היזהרו שלא לתפוס את האזור המכיל את העלון המושתל. - מניחים את הכליה בפורמלין למשך הלילה, מטמיעים אותה בפרפין, וחותכים אותה לצורך הכתם הרצוי. כוון את הדגימה כאשר קפסולת הכליה פונה קדמית ופרנכימה הכליה פונה לאחור.
תוצאות
תיאור גרפי של העיצוב הניסיוני מסופק עבור מודל החולדה (איור 1). בנוסף, שורש אבי העורקים המנותק מלבו של התורם ועלון מסתם אבי העורקים הבודד המוכן להשתלה מוצגים גם הם באיור 2. לאחר מכן, תמונה מייצגת של מיקום עלון המסתם האאורטלי מתחת לקפסולת הכליה לצורך השתלה מוצגת באיור 3A ולאחר 3, 7 ו-28 ימים בתוך החולדה המושתלת (איורים 3B-D), מה שמדגים את הקלות של איתור והתאוששות הרקמה המושתלת.
עלוני המסתם האאורטלי שומרים על הארכיטקטורה הטבעית שלהם לאחר השתלה הטרוטופית בבעלי חיים סינגניים, מה שמדגים את התועלת של מודל זה כבסיס להשוואת התגובה החיסונית בהשתלות אלוגניות. באופן ספציפי, היסטולוגיה עם צביעת המטוקסילין ואוזין (H&E) גילתה כי עלוני מסתמים בהשתלות סינגניות לאחר 7 ימים היו שלמים מבחינה מבנית ללא סימנים של נפיחות אדמטית (איור 4A). השלמות המבנית של עלון המסתם אושרה עוד יותר על-ידי אימונוהיסטוכימיה עבור אלפא חלק שריר אקטין (aSMA) ו-CD31 (איור 4B).
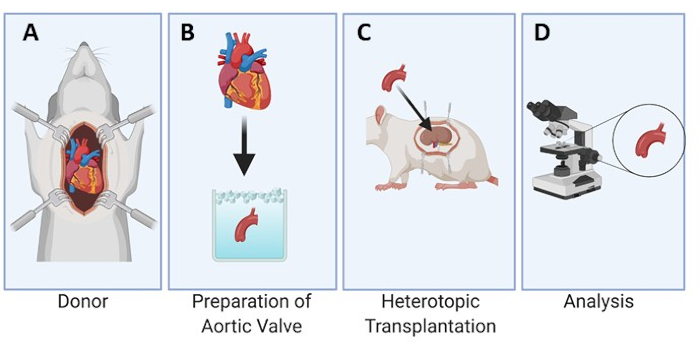
איור 1: תכנון ניסיוני של ההשתלה ההטרוטופית של המסתם אבי העורקים מתחת לקפסולת הכליה בחולדות. הלב נאסף מהחולדת התורמת (A). עלוני מסתם אבי העורקים מנותחים ונשמרים באחסון קר (B) עד לתהליך ההשתלה מתחת לקפסולת הכליה בחולדה המקבלת (C). לאחר מכן מוסברים העלונים בנקודות זמן מוגדרות ומנותחים באופן מיקרוסקופי (D). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הכנת עלון מסתם אבי העורקים להשתלה. דוגמה לשורש אבי העורקים המנותק מהלב התורם (A) ולנתיחה נוספת של עלון מסתם אבי העורקים לצורך השתלה (B). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: הדמיה של עלון מסתם אבי העורקים מתחת לקפסולת הכליה. עלון המסתם אבי העורקים מוצג תחת הקפסולה הכליתית בהשתלה (A), לאחר 3 (B), 7 (C) ו-28 ימים (D) בבעלי חיים סינגניים ולאחר 3 (E), 7 (F) ו-28 ימים (G) בבעלי חיים אלוגניים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: עלוני מסתם אבי העורקים נשארים שלמים מבחינה מבנית לאחר ההשתלה תחת הקפסולה הכליתית במשך 7 ימים בבעלי חיים סינגניים. השורה העליונה מציגה צביעת H&E ושמירה חיסונית עבור DAPI, aSMA ו-CD31 לבקרת מסתמי לב שנרכשו אך לא הושתלו. השורה התחתונה מציגה צביעת H&E ושמירה חיסונית עבור DAPI, aSMA ו-CD31 בעלון מסתם סינגני שהוסבר לאחר 7 ימים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
חשיבות ויישומים פוטנציאליים
בעוד שמסתמי לב מכניים וביו-פרוסטטיים משמשים באופן שגרתי בחולים מבוגרים הזקוקים להחלפת מסתם, מסתמים אלה חסרים פוטנציאל לגדול, ולכן הם אינם אופטימליים עבור מטופלים ילדים. השתלת מסתמי לב היא פעולה ניסיונית שנועדה לספק תחליפי מסתמי לב הולכים וגדלים לילודים ולתינוקות עם מחלות לב מולדות. עם זאת, בניגוד לאימונוביולוגיה של השתלות לב קונבנציונליות, אימונוביולוגיה של השתלה מסוג חדש זה עדיין נחקרת בצורה גרועה. כאן מתואר מודל ייחודי של חולדות להשתלת כליה תת-קפסולרית של עלוני מסתם אבי העורקים, המספק צעד משמעותי קדימה בחקר האימונוביולוגיה של השתלת מסתמי הלב.
החלל התת-קפסולרי הכליתי מספק סביבה אופטימלית לחקר אימונוביולוגיה מושתלת של מסתמי לב. הרקמה המושתלת מוכלת היטב במיקום וסקולרי היטב עם גישה לתאי חיסון במחזור20. בנוסף, מודלים תת-קפסולריים שימשו בעבר בהצלחה לבדיקת דחיית אלוגרפט ברקמות רבות כגון הלבלב, הכבד, הכליות וסוגי התאים האחרים 22,23,24,25,26,27, מה שמצביע על כך שמודל זה מוצדק בחקר האימונוגניות של עלוני מסתמי אבי העורקים.
מודל זה יש מספר יישומים protentional לחקר אימונולוגיה השתלה של מסתמי אבי העורקים. ראשית, ניתן להשתמש במודל כדי לקבוע את רמת הדיכוי החיסוני המערכתי הנדרשת להשתלת מסתמי לב כדי למנוע דחיית שתל, כגון טקרולמוס, מיקופנולט וסטרואידים. יתר על כן, מספר מחקרים הצביעו על כך שרקמת המסתם עשויה להיות שונה מבחינה אימונולוגית מרקמת לב אחרת, שכן המסתמים נחסכים יחסית במהלך דחייה של השתלות לב קונבנציונליות 28,29,30. מודל זה מאפשר לחקור תפיסה זו מכיוון שהחלל התת-קפסולרי יכול להכיל סוגי רקמות שונים, כגון עלון מסתם ומיוקרדיום, כדי להשוות את האימונוגניות של רקמות אלה.
מודל זה הוא יתרון מכיוון שהוא פשוט מבחינה טכנית, מהיר, ויש לו שיעור הישרדות גבוה עם סיכון נמוך לסיבוכים. מכיוון שכל תורם יכול לספק שלושה עלוני מסתם אבי העורקים, חולדה אחת יכולה לשמש כתורמת לשלושה מושתלים שונים. בממוצע, אורך הפעולה של התורם היה 27.2 דקות (n = 12), ומשך הפעולה של המקבל היה 29.7 דקות (n = 36). שיעור ההישרדות של הניתוח המקבל היה 97.2% (n = 35/36), עם מקרה מוות תוך ניתוחי אחד עקב דיכאון נשימתי. דימום מינימלי עקב טראומה מהפרנכימה הכליתית בעת יצירת הכיס התת-קפסולרי נצפה ב-11.1% מניתוחי המקבל. עם זאת, הדימום היה נשלט בקלות בכל המקרים עם דחיסה מן המוליך קצה כותנה. דגימה אחת נוקתה מהחלל התת-קפסולרי ולא שוחזרה בהסבר גם לאחר 7 ימים.
בעבר, עלוני המסתם הוסברו על ידי הסרתם מהחלל התת-קפסולרי והוטמעו, נחתכו והוכתמו ללא כל רקמת אבי העורקים המחוברת. עם זאת, שיטה זו אינה אופטימלית מכיוון שהעלים עצמם קטנים מאוד, דקים ושקופים, וכתוצאה מכך אובדן של מספר דגימות בעיבוד. במקום זאת, מומלץ להסיר את הכליה בגוש ולהטמיע ולחתוך את הרקמה בעודה מאובטחת מתחת לקפסולת הכליה כדי להבטיח שלא יאבדו דגימות. בנוסף, גישה זו מצמצמת את הטראומה והמניפולציה של העלון.
שלבים קריטיים
השלבים הקריטיים של ההליך הם להקים מישור כירורגי של הרדמה, חתך דופן הבטן מעל הכליות, פינוי הכליה, העלאת הדש התת-קפסולרי, החדרת רקמת ההשתלה ההטרוטופית, קבלת המוסטזיס, החזרת הכליה למצב האנטומי וסגירת העור.
שינויים ופתרון בעיות
בעוד שזהו התיאור הראשון של השתלת רקמת לב מתחת לקפסולת הכליה, כמה אחרים תיארו השתלה של סוגי רקמות אחרים בחלל התת-קפסולרי הכלייתי 20,22,23,24,25,26,27. בפרוטוקול זה נעשו התאמות קלות במודלים תת-קפסולריים קודמים כדי לייעל את הטכניקה ולמזער סיבוכים. באופן ספציפי, בעוד שאחרים המליצו להשתמש במספריים האביביים של Vannas כדי להפוך את החתך הראשוני לקפסולת הכליה20,26, שיטה זו נוטה יותר לגרום לטראומה לפרנצ'ימה הבסיסית ולגרום להיווצרות המטומה תת-קפסולרית. דימום רב מדי יגרום להתפרקות הקפסולה ויפגע בביטחון שלהמושתל 26. לכן, יש להשתמש במלקחיים קהים כדי לפתוח את הקפסולה. בנוסף, בעוד שפרוטוקולים מסוימים תומכים בהצבת מוצרים מסחריים בעלי תכונה הומוסטטית על פני החתך הקפסולרי 26,31, שלב זה מיותר כל עוד הרקמה מתקדמת מספיק רחוק לתוך הכיס התת-קפסולרי.
בחולדות גדולות יותר, הכליה עשויה להיות מכוסה בשומן פריינלי, והחצנת הכליה באמצעות הרמה עם מלקחיים מעוקלים עשויה שלא להיות אפשרית. במקרים אלה, עדיף להחצין את הכליה על ידי גרירה עדינה של השומן הפריניאלי עם מלקחיים ומשיכת הכליה מתוך חלל הבטן מבלי לגרום נזק או דימום.
השוואה עם מודלים קיימים של השתלות הטרוטופיות
בעוד שכמה מודלים אחרים של בעלי חיים להשתלת מסתם אבי העורקים ההטרוטופי תוארו בעבר 12,13,14,15,16,17,18, הפרוטוקול הנוכחי מספק חלופה פשוטה ומעשית יותר המשפרת מודלים קודמים במספר דרכים. ראשית, בשל האופי הפשוט מבחינה טכנית של ההליך, נדרשת הכשרה מועטה מאוד כדי לפעול בהצלחה. זאת בניגוד מוחלט להשתלות מסתם אבי העורקים ההטרוטופי שתוארו קודם לכן באבי העורקים הבטני. לכן, מודל זה מספק חלופה מעשית וחסכונית יותר לחקר השתלת מסתם אבי העורקים תוך מזעור התחלואה, הכאב והתמותה של החולדות. בנוסף, מכיוון שנדרש רק עלון אחד של מסתם אבי העורקים לניתוח המקבל וכל חולדה תורמת מספקת שלושה עלונים, פחות חולדות תורמות נדרשות לכל ניסוי נתון. יתר על כן, השתלת רקמות בכליה הקונטרה-צדדית או בכיס תת-קפסולרי נפרד עשויה לאפשר בקרה פנימית או השוואה של תגובות חיסוניות לרקמות משתנות בתוך חולדה אחת. במקרה זה, הגישה הטובה ביותר היא באמצעות חתך לפרוטומיה בקו האמצע.
בנוסף למודלים של בעלי חיים המתארים השתלת מסתם אבי העורקים ההטרוטופי באבי העורקים הבטני, מחקרים אחרים השתמשו במודל תת עורי כדי לחקור את האימונוגניות של מסתמי אבי העורקים32. בעוד שגישה זו היא ללא ספק פשוטה יותר מאשר השתלה באבי העורקים הבטני, הראיות הקיימות מצביעות על כך שהשתלה תת עורית היא שיטה פחות יעילה להצגת אנטיגן33,34. הדגימה המושתלת גם היא מאתגרת למציאה ולניתוח. לכן, המרחב התת-קפסולרי הכלייתי מוצע כאתר של השתלה שהוא גם פשוט וגם אופטימלי לחקר הביולוגיה של השתלת מסתם אבי העורקים.
לסיכום, המודל החדש שהוצע משמש כתוספת לחימוש של מדענים לחקר השתלת מסתם הלב ומשלים את המודלים שתוארו קודם לכן.
מגבלות
למרות שהשתלת עלוני מסתם אבי העורקים תחת הקפסולה הכליתית היא שיטה יעילה לחקר אלואימוניות in vivo, קיימות כמה מגבלות של מודל זה. בעוד שהחלל התת-קפסולרי הוא בעל כלי דם טובים, הוא אינו מציע את אותה סביבה המודינמית כמו המיקום התת-כלילית. זה עשוי להשפיע על התגובה החיסונית לרקמות מושתלות. יש המשערים כי התכונות החיסוניות המובחנות שנצפו ברקמת המסתם עשויות לנבוע מזרימת הדם בלחץ גבוה מעל המסתם אבי העורקים במיקום התת-כלילית, ובכך לבטל את התגובה הכימוטקטית28,35. יתר על כן, מודל זה אינו מספיק כדי לחקור את השפעת האלאוראקטיביות על תפקוד המסתם מכיוון שהעלים אינם מבצעים את תפקידם הפיזיולוגי תחת קפסולת הכליה. עם זאת, מגבלות דומות קיימות עבור מודלים של השתלת אבי העורקים הבטני ההטרוטופי, שכן הצלחתם של מודלים אלה מסתמכת על הפיכת עלוני המסתם לבלתי כשירים כדי למנוע פקקת שתל15,36.
המגבלות על הפרוטוקול כוללות את האפשרות שהרקמות יתנתקו מהמרחב התת-כלייתי ובלתי ניתנות לשחזור (1 מכל 36 בעלי חיים). מגבלה נוספת היא מות החיה במהלך הניתוח (1 מכל 36 בעלי חיים); עם זאת, המוות נגרם על ידי מנת יתר של buprenorphine, ושיטות אחרות עבור מינון של משכך כאבים עשוי להיות בשימוש.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים פוטנציאלי.
Acknowledgements
איור 1 נוצר עם biorender.com. עבודה זו נתמכה בחלקה על ידי תוכנית החוקרים הכירורגיים של קרן AATS ל- TKR, קרן המצוינות לילדים המוחזקת על ידי המחלקה לרפואת ילדים באוניברסיטה הרפואית של דרום קרוליינה ל- TKR, מענק קרן אמרסון רוז לב ל- TKR, פילנתרופיה על ידי הסנאטור פול קמפבל ל- TKR, מענקי הכשרה לפוסט-דוקטורט מוסדיים של NIH-NHLBI (T32 HL-007260) ל- JHK ו- BG, והאוניברסיטה הרפואית של דרום קרוליינה קולג ' לרפואה לפני פקידות קרן מחקר FLEX ל- MAH.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlordie, USP | Baxter | NDC 0338-0048-04 | |
| 4-0 Polyglactin 910 | Ethicon | J415H | |
| 7.5% Povidone-Iodine | CareFusion | 29904-004 | |
| 70% ETOH | Fisher Scientific | BP82031GAL | |
| Anesthesia induction chamber | Harvard Apparatus | 75-2030 | Air-tight inducton chamber for rats |
| Anesthesia machine | Harvard Apparatus | 75-0238 | Mobile Anesthesia System with Passive Scavenging |
| Anesthesia Mask | Harvard Apparatus | 59-8255 | Rat anesthesia mask |
| Brown Norway Rats (BN/Crl) | Charles River | Strain Code 091 | Male, 5-7 weeks, 100-200 g |
| Buprenorphine Hydrochloride, 0.3 mg/mL | PAR Pharmaceutical | NDC 42023-179-05 | 0.03 mg/kg, administered subcutaneously |
| Electric hair clippers | WAHL | 79434 | |
| Electric Heating Pad | Harvard Apparatus | 72-0492 | Maintained at 36-38 °C |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | 100U/100g injection into the left atrium |
| Insulin Syringe, 1 mL | Fisher Scientific | 14-841-33 | |
| Iris forceps curved | World Precision Instruments | 15917 | |
| Iris forceps straight | World Precision Instruments | 15916 | |
| Isoflurane, USP | Piramal Critical Care | NDC 66794-017-25 | Induced at 5% isoflurance in oxygen and maintained with 3.5% isoflurane in oxygen |
| Lewis Rats (LEW/ Crl) | Charles River | Strain Code 004 | Male, 5-7 weeks, 100-200 g |
| Micro forceps | World Precision Instruments | 500233 | Dumont #5 |
| Micro scissors | World Precision Instruments | 501930 | Spring-loaded Vannas Scissors |
| Needle Driver | World Precision Instruments | 500226 | Ryder Needle Driver |
| Operating microscope | AmScope | SM-3BZ-80S | 3.5x - 90x Stereo Microscope |
| Petri Dish | Fisher Scientific | FB0875714 | |
| Petrolatum ophthalmic ointment | Dechra | NDC 17033-211-38 | |
| Skin staples | Ethicon | PXR35 | Proximate 35 |
| Sterile cotton swabs | Puritan | 25-806 1WC | |
| Sterile gauze sponges | Fisher Scientific | 22-037-902 | |
| Surgical Scissors | World Precision Instruments | 1962C | Metzenbaum Scissors |
| University of Wisconsin Buffer (Servator B) | S.A.L.F S.p.A. | 6484A1 | Stored at 4 °C |
References
- Van Der Linde, D., et al. Birth prevalence of congenital heart disease worldwide: A systematic review and meta-analysis. Journal of the American College of Cardiology. 58 (21), 2241-2247 (2011).
- Jacobs, J. P., et al. Reoperations for pediatric and congenital heart disease: An analysis of the Society of Thoracic Surgeons (STS) congenital heart surgery database. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 17 (1), 2-8 (2014).
- Syedain, Z. H., et al. Pediatric tri-tube valved conduits made from fibroblast-produced extracellular matrix evaluated over 52 weeks in growing lambs. Science Translational Medicine. 13 (585), 1-16 (2021).
- Khan, M. S., Samayoa, A. X., Chen, D. W., Petit, C. J., Fraser, C. D. Contemporary experience with surgical treatment of aortic valve disease in children. Journal of Thoracic and Cardiovascular Surgery. 146 (3), 512-521 (2013).
- Boyd, R., Parisi, F., Kalfa, D. State of the art: Tissue engineering in congenital heart surgery. Seminars in Thoracic and Cardiovascular Surgery. 31 (4), 807-817 (2019).
- Feins, E. N., Emani, S. M. Expandable valves, annuloplasty rings, shunts, and bands for growing children. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 23, 17-23 (2020).
- Lintas, V., et al. TCT-795 Human cell derived off-the-shelf tissue engineered heart valves for next generation transcatheter aortic valve replacement: a proof-of-concept study in adult sheep. Journal of the American College of Cardiology. 70 (18), 271 (2017).
- Blum, K. M., Drews, J. D., Breuer, C. K. Tissue-engineered heart valves: A call for mechanistic studies. Tissue Engineering Part B: Reviews. 24 (3), 240-253 (2018).
- Bernstein, D., et al. Cardiac growth after pediatric heart transplantation. Circulation. 85 (4), 1433-1439 (1992).
- Delmo Walter, E. M., et al. Adaptive growth and remodeling of transplanted hearts in children. Europeon Journal of Cardiothoracic Surgery. 40 (6), 1374-1383 (2011).
- Simon, P., et al. Growth of the pulmonary autograft after the Ross operation in childhood. Europeon Journal of Cardiothoracic Surgery. 19 (2), 118-121 (2001).
- Oei, F. B. S., et al. A size-matching heterotopic aortic valve implantation model in the rat. Journal of Surgical Research. 87 (2), 239-244 (1999).
- Oei, F. B. S., et al. Heart valve dysfunction resulting from cellular rejection in a novel heterotopic transplantation rat model. Transplant International. 13, (2000).
- El Khatib, H., Lupinetti, F. M. Antigenicity of fresh and cryopreserved rat valve allografts. Transplantation. 49 (4), 765-767 (1990).
- Yankah, A. C., Wottge, H. U. Allograft conduit wall calcification in a model of chronic arterial graft rejection. Journal of Cardiac Surgery. 12 (2), 86-92 (1997).
- Moustapha, A., et al. Aortic valve grafts in the rat: Evidence for rejection. Journal of Thoracic and Cardiovascualr Surgery. 114 (6), 891-902 (1997).
- Légaré, J. F., et al. Prevention of allograft heart valve failure in a rat model. Journal of Thoracic and Cardiovascualr Surgery. 122 (2), 310-317 (2001).
- Legare, J. F., Lee, T. D. G., Creaser, K., Ross, D. B., Green, M. T lymphocytes mediate leaflet destruction and allograft aortic valve failure in rats. The Annals of Thoracic Surgery. 70 (4), 1238-1245 (2000).
- Niimi, M. The technique for heterotopic cardiac transplantation in mice: Experience of 3000 operations by one surgeon. Journal of Heart and Lung Transplantation. 20 (10), 1123-1128 (2001).
- Burgin, M., et al. Kidney Subcapsular Allograft Transplants as a Model to Test Virus-Derived Chemokine-Modulating Proteins as Therapeutics. Methods in molecular biology. 2225, 257-273 (2021).
- Foglia, R. P., DiPreta, J., Donahoe, P. K., Statter, M. B. Fetal allograft survival in immunocompetent recipients is age dependent and organ specific. Annals of Surgery. 204 (4), 402-410 (1986).
- Cunha, G. R., Baskin, L. Use of sub-renal capsule transplantation in developmental biology. Differentiation. 91 (4-5), 4-9 (2016).
- Hori, J., Joyce, N., Streilein, J. W. Epithelium-deficient corneal allografts display immune privilege beneath the kidney capsule. Investigative Opthalmology & Visual Science. 41 (2), 443-452 (2000).
- Mandel, T., et al. transplantation of organ cultured fetal pig pancreas in non-obese diabetic (NOD) mice and primates (Macaca fascicularis). Xenotransplantation. 2 (3), 128-132 (1995).
- Ricordi, C., Flye, M. W., Lacy, P. E. Renal subcapsular transplantation of clusters of hepatocytes in conjunction with pancreatic islets. Transplantation. 45 (6), 1148-1150 (1988).
- Shultz, L. D., et al. Subcapsular transplantation of tissue in the kidney. Cold Spring Harbor Protocols. 2014 (7), 737-740 (2014).
- Vanden Berg, C. W., et al. Renal subcapsular transplantation of PSC-derived kidney organoids induces neo-vasculogenesis and significant glomerular and tubular maturation in vivo. Stem Cell Reports. 10 (3), 751-765 (2018).
- Mitchell, R. N., Jonas, R. A., Schoen, F. J. Pathology of explanted cryopreserved allograft heart valves: Comparison with aortic valves from orthotopic heart transplants. Journal of Thoracic and Cardiovasular Surgery. 115 (1), 118-127 (1998).
- Valante, M., et al. The aortic valve after heart transplantation. Annals of Thoracic Surgery. 60, (1995).
- O'Brien, M. F., Stafford, E. G., Gardner, M. A. H., Pohlner, P. G., McGiffin, D. C. A comparison of aortic valve replacement with viable cryopreserved and fresh allograft valves, with a note on chromosomal studies. Journal of Thoracic and Cardiovascular Surgery. 94 (6), 812-823 (1987).
- Ng, T. F., Osawa, H., Hori, J., Young, M. J., Streilein, J. W. Allogeneic neonatal neuronal retina grafts display partial immune privilege in the subcapsular space of the kidney. The Journal of Immunology. 169 (10), 5601-5606 (2002).
- Heslop, B. F., Wilson, S. E., Hardy, B. E. Antigenicity of aortic valve allografts. Annals of Surgery. 177 (3), 301-306 (1973).
- Steinmuller, D., Weiner, L. J. Evocation and persistence of transplantation immunity in rats. Transplantation. 1 (1), 97-106 (1963).
- Billingham, R. E., Brent, L., Brown, J. B., Medawar, P. B. Time of onset and duration of transplantation immunity. Plastic and Reconstructive Surgery. 24 (1), 410-413 (1959).
- Tector, A. J., Boyd, W. C., Korns, M. E. Aortic valve allograft rejection. Journal of Thoracic and Cardiovascular Surgery. 62 (4), 592-601 (1971).
- Sugimura, Y., Schmidt, A. K., Lichtenberg, A., Akhyari, P., Assmann, A. A rat model for the in vivo assessment of biological and tissue-engineered valvular and vascular grafts. Tissue Engineering Methods (Part C). 23 (12), 982-994 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved