Method Article
Un modello semplificato per il trapianto di valvole cardiache eterotopiche nei roditori
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un metodo semplice ed efficiente per il trapianto di foglietti valvolari aortici sotto la capsula renale per consentire lo studio dell'alloreattività delle valvole cardiache.
Abstract
C'è un urgente bisogno clinico di sostituzioni delle valvole cardiache che possono crescere nei bambini. Il trapianto di valvole cardiache è proposto come un nuovo tipo di trapianto con il potenziale per fornire valvole cardiache durevoli in grado di crescere somaticamente senza necessità di anticoagulazione. Tuttavia, l'immunobiologia dei trapianti di valvole cardiache rimane inesplorata, evidenziando la necessità di modelli animali per studiare questo nuovo tipo di trapianto. Sono stati descritti precedenti modelli di ratto per il trapianto di valvola aortica eterotopica nell'aorta addominale, sebbene siano tecnicamente impegnativi e costosi. Per affrontare questa sfida, è stato sviluppato un modello di trapianto sottocapsulare renale nei roditori come metodo pratico e più semplice per studiare l'immunobiologia del trapianto di valvole cardiache. In questo modello, un singolo foglietto della valvola aortica viene raccolto e inserito nello spazio sottocapsulare renale. Il rene è facilmente accessibile e il tessuto trapiantato è contenuto in modo sicuro in uno spazio sottocapsulare che è ben vascolarizzato e può ospitare una varietà di dimensioni del tessuto. Inoltre, poiché un singolo ratto può fornire tre foglietti aortici donatori e un singolo rene può fornire più siti per il tessuto trapiantato, sono necessari meno ratti per un determinato studio. Qui viene descritta la tecnica del trapianto, fornendo un significativo passo avanti nello studio dell'immunologia del trapianto di valvole cardiache.
Introduzione
I difetti cardiaci congeniti sono la disabilità congenita più comune negli esseri umani, che colpisce 7 su 1.000 bambini nati vivi ogni anno1. A differenza dei pazienti adulti in cui vengono impiantate di routine varie valvole meccaniche e bioprotesiche, i pazienti pediatrici attualmente non hanno buone opzioni per la sostituzione della valvola. Questi impianti convenzionali non hanno il potenziale per crescere nei bambini riceventi. Di conseguenza, sono necessarie ri-operazioni morbose per scambiare gli impianti della valvola cardiaca con versioni successive più grandi man mano che i bambini crescono, con i bambini affetti che spesso richiedono fino a cinque o più interventi chirurgici a cuore aperto nella loro vita 2,3. Gli studi hanno dimostrato che la libertà dall'intervento o dalla morte è significativamente scarsa per i neonati rispetto ai bambini più grandi, con il 60% dei neonati con valvole cardiache protesiche che affrontano il rinogomento o la morte entro 3 anni dalla loro operazione iniziale4. Pertanto, vi è un urgente bisogno di fornire una valvola cardiaca in grado di crescere e mantenere la funzione nei pazienti pediatrici.
Per decenni, i tentativi di fornire sostituzioni delle valvole cardiache in crescita sono stati incentrati sull'ingegneria tissutale e sulle cellule staminali. Tuttavia, i tentativi di tradurre queste valvole nella clinica non hanno avuto successo finora 5,6,7,8. Per affrontare questo problema, un trapianto di valvole cardiache viene proposto come un'operazione più creativa per fornire sostituzioni della valvola cardiaca in crescita che hanno la capacità di autoripararsi ed evitare la trombogenesi. Invece di trapiantare l'intero cuore, solo la valvola cardiaca viene trapiantata e crescerà con il bambino ricevente, simile ai trapianti di cuore convenzionali o a un autografo polmonare di Ross 9,10,11. Post-operatoriamente, i bambini riceventi riceveranno immunosoppressione fino a quando la valvola trapiantata non può essere sostituita con una protesi meccanica di dimensioni adulte quando la crescita della valvola non è più necessaria. Tuttavia, la biologia dei trapianti di trapianto di valvole cardiache rimane inesplorata. Pertanto, sono necessari modelli animali per studiare questo nuovo tipo di trapianto.
Diversi modelli di ratto sono stati precedentemente descritti per il trapianto eterotopico della valvola aortica nell'aorta addominale 12,13,14,15,16,17,18. Tuttavia, questi modelli sono proibitivamente complicati, spesso richiedono chirurghi addestrati per operare con successo. Inoltre, sono costosi e richiedono molto tempo19. Un nuovo modello di ratto è stato sviluppato per creare un modello animale più semplice per studiare l'immunobiologia dei trapianti di valvole cardiache. I singoli lembi della valvola aortica vengono asportati e inseriti nello spazio sottocapsulare renale. Il rene è particolarmente adatto per studiare il rigetto del trapianto in quanto è altamente vascolarizzato con accesso alle cellule immunitarie circolanti20,21. Mentre molti altri hanno utilizzato un modello sottocapsulare renale per studiare la biologia del trapianto di altri trapianti di allotrapianto come pancreas, fegato, rene e cornea 22,23,24,25,26,27, questa è la prima descrizione del trapianto di tessuto cardiaco in questa posizione. Qui viene descritta la tecnica del trapianto, fornendo un significativo passo avanti nello studio dell'immunologia del trapianto di valvole cardiache.
Protocollo
Lo studio è stato approvato dal Comitato di ricerca sugli animali a seguito della Guida nazionale degli istituti di salute per la cura e l'uso degli animali da laboratorio.
1. Informazioni sul modello animale (Ratti)
- Utilizzare un microscopio operatorio (vedi Tabella dei materiali) con ingrandimento fino a 20x per tutte le procedure chirurgiche.
- Utilizzare ceppi singenici (come Lewis-Lewis) o allogenici (come Lewis-Brown Norway) per i trapianti secondo necessità per l'esperimento.
- Utilizzare ratti di età compresa tra 5-7 settimane e peso corporeo di 100-200 g che sono appropriati per la domanda sperimentale.
2. Rimozione della pelliccia, preparazione della pelle e anestesia
- Eseguire tutte le operazioni in condizioni sterili.
NOTA: Il passaggio viene eseguito in uno spazio chirurgico dedicato e in condizioni sterili. - Posizionare i ratti in una camera di induzione anestetica e indurre l'anestesia con il 5% di isoflurano in ossigeno. Mantenere l'anestesia con il 3,5% di isoflurano in ossigeno durante tutta la procedura.
- Per l'operazione del donatore, rimuovere la pelliccia del ratto dall'ombelico alla tacca sternale usando tagliacapelli. Per l'operazione ricevente, tagliare i capelli sul campo chirurgico sulla linea ascellare posteriore dalle costole al bacino. Quindi, preparare la pelle con un disinfettante chirurgico.
- Ottenere un piano chirurgico di anestesia prima di iniziare la procedura. Confermare un'adeguata profondità di anestesia comprimendo saldamente le dita dei piedi del ratto con una pinza. Se il ratto si ritira al dolore, titolare l'anestetico secondo necessità.
- Monitorare clinicamente la frequenza respiratoria e la profondità dell'anestesia durante la procedura; il livello di isoflurano viene regolato secondo necessità per mantenere una frequenza respiratoria di 55-65 respiri/min.
3. Operazione del donatore
- Preparare e anestetizzare il ratto come indicato nel passaggio 2. Incidere la pelle dallo xifoide alla tacca sternale usando le forbici di dissezione. Eseguire una sternectomia tagliando le costole su ciascun lato lateralmente allo sterno fino a raggiungere un accesso ottimale al cuore.
- Eparino il ratto con 100 U/100 g di iniezione nell'atrio sinistro.
- Sacrifica il donatore attraverso il dissanguamento.
- Asportare il timo per migliorare la visualizzazione dei grandi vasi. Quindi, rimuovere il cuore in blocco con l'aorta ascendente fino al livello dell'arteria innominata.
4. Preparazione dei foglietti della valvola aortica
- Mettere il cuore donatore in una capsula di Petri sterile immediatamente dopo la cardiectomia. Sezionare il cuore del donatore in un tampone di conservazione a freddo ghiacciato (vedere Tabella dei materiali).
- Usando pinze e forbici a molla Vannas, sezionare il cuore del donatore fino a quando rimane solo la radice aortica con un bracciale ventricolare di 1 mm prossimale alla valvola aortica.
- Aprire la valvola aortica effettuando un taglio longitudinale per aprire il seno di Valsalva tra i seni sinistro e non coronarico per visualizzare tutti e tre i volantini.
NOTA: Il taglio deve essere dell'intera lunghezza del seno di Valsalva. Le dimensioni effettive dipendono dalle dimensioni del ratto. - Asportare singolarmente ogni foglietto della valvola aortica. In particolare, utilizzare pinze smussate per afferrare il bordo del volantino e utilizzare le forbici a molla Vannas per asportare il volantino tagliando da una commessura fino all'anulus, e poi verso la commessura successiva.
NOTA: Prestare particolare attenzione a cogliere solo il bordo del foglietto illustrativo per ridurre al minimo l'interruzione delle cellule endoteliali valvolari. - Conservare i campioni dopo l'escissione del foglio illustrativo in soluzione tampone di conservazione ghiacciata fino a quando non sono pronti per essere impiantati nel ratto ricevente. Impiantare tutti i foglietti entro 4 ore dalla conservazione a freddo.
5. Operazione del destinatario
- Preparare e anestetizzare il ratto come indicato nel passaggio 2. Utilizzare una piastra riscaldante mantenuta a 36-38 °C per eseguire l'intervento chirurgico.
- Somministrare buprenorfina (0,03 mg/kg per via sottocutanea) a tutti i ratti riceventi prima dell'intervento chirurgico e ogni 6-12 ore post-operatoriamente secondo necessità per alleviare il dolore.
- Posizionare il ratto in una posizione sdraiata laterale destra per accedere al rene sinistro.
NOTA: Il rene sinistro è preferito a causa della sua posizione più caudale rispetto al rene destro. - Incidere la pelle sul fianco longitudinalmente oltre 1 pollice usando le forbici.
NOTA: L'incisione deve rimanere più piccola della dimensione del rene per fornire una tensione sufficiente per impedire al rene di ritrarsi nella cavità addominale durante la procedura. - Allo stesso modo, incidere la parete addominale sottostante.
- Esternalizzare il rene
- Usando il pollice e l'indice, applicare una leggera pressione dorsale e ventrale mentre si utilizza una pinza curva per sollevare il polo caudale del rene attraverso l'incisione addominale e cutanea. Esternalizzare l'estremità cranica del rene in modo simile.
- In alternativa, il rene può essere esternalizzato afferrando il grasso perirenale e tirando verso l'alto con leggera tensione.
NOTA: Fare attenzione a non afferrare direttamente il rene o i vasi renali. - Una volta che il rene è esternalizzato, tenerlo umido con soluzione salina calda gocciolata sul rene.
- Creare una tasca sottocapsulare.
- Applicare leggermente la pressione sulla capsula renale utilizzando una serie di pinze smussate in modo che la capsula renale possa essere chiaramente distinta dal parenchima sottostante. Contemporaneamente utilizzando un altro set di pinze smussate, afferrare con attenzione la capsula e tirare delicatamente verso l'alto per creare un foro nella capsula.
NOTA: A causa della natura delicata della capsula, è necessaria una forza minima per stabilire questa incisione. - Continuare a utilizzare pinze smussate per estendere l'incisione fino a quando non è stato creato uno spazio di ~ 2 mm per ospitare il lembo della valvola aortica.
- Sviluppare una tasca sottocapsulare poco profonda che sia leggermente più grande del lembo della valvola mentre si solleva il bordo dell'incisione con una serie di pinze e si avanza una sonda smussata sotto la capsula renale.
- Applicare leggermente la pressione sulla capsula renale utilizzando una serie di pinze smussate in modo che la capsula renale possa essere chiaramente distinta dal parenchima sottostante. Contemporaneamente utilizzando un altro set di pinze smussate, afferrare con attenzione la capsula e tirare delicatamente verso l'alto per creare un foro nella capsula.
- Trapiantare la valvola aortica nella tasca sottocapsulare.
- Recuperare il foglietto aortico dalla cella frigorifera e posizionarlo nel campo chirurgico.
- Mentre si solleva la capsula fibrosa del bordo, far avanzare il foglietto aortico nella tasca sottocapsulare con pinza smussata.
NOTA: Assicurarsi che il tessuto sia abbastanza lontano dall'incisione in modo che sia saldamente fissato sotto la capsula. Bisogna fare attenzione per evitare danni al parenchima sottostante o ulteriori strappi della capsula fibrosa. - L'incisione nella capsula renale può essere lasciata aperta.
- Spingere delicatamente il rene nella sua posizione anatomica usando la controtrazione applicata ai bordi dell'incisione.
- Chiudere l'incisione addominale con una sutura chirurgica sterile in esecuzione. Chiudere la pelle con le graffette.
- Assistenza post-operatoria
- Dopo l'operazione, posizionare il topo in una gabbia pulita su una piastra riscaldante con accesso a cibo e acqua.
- Monitorare l'animale ogni giorno per valutare la guarigione delle ferite di routine e segni di dolore o angoscia. Rimuovere le graffette dopo 7-10 giorni.
6. Raccolta del tessuto per l'analisi
- A endpoint selezionati dopo il trapianto, l'eutanasia dell'animale mediante dissanguamento. In particolare, eseguire una laparotomia mediana e transettare l'aorta addominale sotto il 5% di isoflurano in ossigeno.
- Mobilitare il rene e asportare tagliando l'arteria renale, la vena e l'uretere con le forbici.
NOTA: Fare attenzione a non afferrare l'area contenente il foglietto illustrativo trapiantato. - Posizionare il rene in formalina durante la notte, incorporarlo nella paraffina e sezionarlo per la colorazione desiderata. Orientare il campione con la capsula renale rivolta anteriormente e il parenchima renale rivolto posteriormente.
Risultati
Una rappresentazione grafica del disegno sperimentale è fornita per il modello di ratto (Figura 1). Inoltre, una radice aortica sezionata dal cuore del donatore e un singolo foglietto della valvola aortica preparato per l'impianto sono mostrati anche nella Figura 2. Successivamente, un'immagine rappresentativa della posizione del foglietto della valvola aortica sotto la capsula renale per l'impianto è mostrata nella Figura 3A e dopo 3, 7 e 28 giorni all'interno del ratto ricevente (Figure 3B-D), dimostrando la facilità di localizzazione e recupero del tessuto trapiantato.
I lembi valvolari aortici mantengono la loro architettura nativa dopo il trapianto eterotopico in animali singenici, dimostrando l'utilità di questo modello come linea di base per confrontare la risposta immunitaria nei trapianti allogenici. In particolare, l'istologia con colorazione di ematossilina ed eosina (H & E) ha rivelato che i lembi valvolari nei trapianti singenici dopo 7 giorni erano strutturalmente intatti senza segni di gonfiore edematoso (Figura 4A). L'integrità strutturale del foglietto valvolare è stata ulteriormente confermata dall'immunoistochimica per Alpha Smooth Muscle Actin (aSMA) e CD31 (Figura 4B).
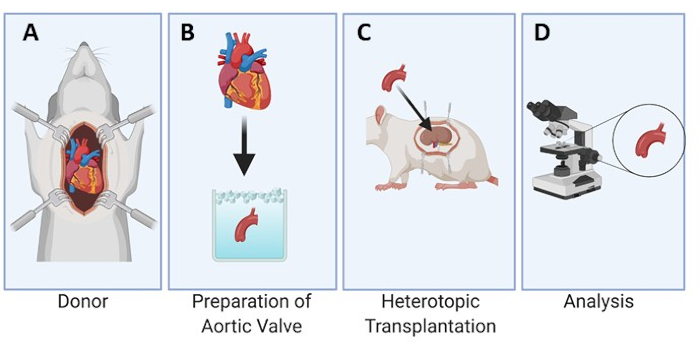
Figura 1: Progettazione sperimentale del trapianto eterotopico della valvola aortica sotto la capsula renale nei ratti. Il cuore viene raccolto dal ratto donatore (A). I lembi della valvola aortica vengono sezionati e conservati in celle frigorifere (B) fino al processo di impianto sotto la capsula renale nel ratto ricevente (C). I foglietti vengono quindi espiantati in punti temporali prestabiliti e analizzati al microscopio (D). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Preparazione del foglietto illustrativo della valvola aortica per l'impianto. Esempio di radice aortica sezionata dal cuore donatore (A) e ulteriore dissezione di un foglietto valvolare aortico per l'impianto (B). Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Visualizzazione del foglietto della valvola aortica sotto la capsula renale. Il foglietto della valvola aortica viene visualizzato sotto la capsula renale all'impianto (A), dopo 3 (B), 7 (C) e 28 giorni (D) negli animali singenici e dopo 3 (E), 7 (F) e 28 giorni (G) negli animali allogenici. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: I lembi della valvola aortica rimangono strutturalmente intatti dopo il trapianto sotto la capsula renale per 7 giorni negli animali singenici. La riga superiore mostra la colorazione H & E e l'immunocolorazione per DAPI, aSMA e CD31 per le valvole cardiache di controllo che sono state procurate ma non trapiantate. La riga inferiore mostra la colorazione H & E e l'immunocolorazione per DAPI, aSMA e CD31 in un foglietto valvolare singenico espiantato dopo 7 giorni. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Importanza e potenziali applicazioni
Mentre le valvole cardiache meccaniche e bioprotesiche sono abitualmente utilizzate nei pazienti adulti che richiedono la sostituzione della valvola, queste valvole non hanno il potenziale per crescere e, quindi, non sono ottimali per i pazienti pediatrici. Il trapianto di valvole cardiache è un'operazione sperimentale progettata per fornire sostituzioni valvolari cardiache in crescita per neonati e neonati con cardiopatia congenita. Tuttavia, a differenza dell'immunobiologia dei trapianti di cuore convenzionali, l'immunobiologia dei trapianti di questo nuovo tipo di trapianto rimane scarsamente esplorata. Qui, viene descritto un modello di ratto unico per il trapianto renale subcapsulare di foglietti valvolari aortici, fornendo un significativo passo avanti nello studio dell'immunobiologia del trapianto di valvole cardiache.
Lo spazio sottocapsulare renale fornisce un ambiente ottimale per studiare l'immunobiologia del trapianto delle valvole cardiache. Il tessuto trapiantato è contenuto in modo sicuro in una posizione ben vascolarizzata con accesso alle cellule immunitarie circolanti20. Inoltre, i modelli sottocapsulari sono stati precedentemente utilizzati con successo per testare il rigetto dell'allotrapianto in molti tessuti come il pancreas, il fegato, i reni e gli altri tipi di cellule 22,23,24,25,26,27, indicando che questo modello è giustificato nello studio dell'immunogenicità dei foglietti della valvola aortica.
Questo modello ha diverse applicazioni protenzionali per lo studio dell'immunologia del trapianto di valvole aortiche. In primo luogo, il modello può essere utilizzato per determinare il livello di soppressione immunitaria sistemica necessaria per il trapianto di valvole cardiache per prevenire il rigetto dell'innesto, come tacrolimus, micofenolato e steroidi. Inoltre, diversi studi hanno indicato che il tessuto valvolare può essere immunologicamente distinto da altri tessuti cardiaci, poiché le valvole sono relativamente risparmiate durante il rigetto fulminante dei trapianti di cuore convenzionali 28,29,30. Questo modello consente di esplorare questo concetto in quanto lo spazio sottocapsulare può ospitare vari tipi di tessuto, come il foglietto valvolare e il miocardio, per confrontare l'immunogenicità di questi tessuti.
Questo modello è vantaggioso perché è tecnicamente semplice, veloce e ha un alto tasso di sopravvivenza con un basso rischio di complicanze. Poiché ogni donatore può fornire tre foglietti della valvola aortica, un ratto può fungere da donatore per tre diversi riceventi. In media, la durata dell'operazione del donatore era di 27,2 minuti (n = 12) e la durata dell'operazione ricevente era di 29,7 minuti (n = 36). Il tasso di sopravvivenza dell'operazione ricevente è stato del 97,2% (n = 35/36), con una morte intraoperatoria dovuta a depressione respiratoria. Il sanguinamento minimo dovuto a traumi al parenchima renale durante la creazione della tasca sottocapsulare è stato notato nell'11,1% delle operazioni riceventi. Tuttavia, il sanguinamento è stato facilmente controllato in tutti i casi con compressione da un applicatore di punta di cotone. Un campione è stato rimosso dallo spazio sottocapsulare e non recuperato dopo la spiegazione anche dopo 7 giorni.
In precedenza, i lembi della valvola venivano espiantati rimuovendoli dallo spazio sottocapsulare e incorporati, sezionati e macchiati senza alcun tessuto aortico attaccato. Tuttavia, questo metodo non è ottimale in quanto i foglietti stessi sono estremamente piccoli, sottili e trasparenti, con conseguente perdita di diversi campioni durante l'elaborazione. Invece, si raccomanda di rimuovere il rene in blocco e incorporare e sezionare il tessuto mentre è ancora fissato sotto la capsula renale per garantire che nessun campione venga perso. Inoltre, questo approccio riduce al minimo il trauma e la manipolazione del volantino.
Passaggi critici
I passaggi critici della procedura sono stabilire un piano chirurgico di anestesia, incidendo la parete addominale sui reni, sviscerando il rene, sollevando il lembo sottocapsulare, inserendo il tessuto del trapianto eterotopico, ottenendo l'emostasi, riportando il rene in posizione anatomica e chiudendo la pelle.
Modifiche e risoluzione dei problemi
Mentre questa è la prima descrizione del trapianto di tessuto cardiaco sotto la capsula renale, molti altri hanno descritto il trapianto di altri tipi di tessuto nello spazio sottocapsulare renale 20,22,23,24,25,26,27. In questo protocollo, sono state apportate piccole modifiche ai precedenti modelli sottocapsulari per ottimizzare la tecnica e ridurre al minimo le complicazioni. In particolare, mentre altri hanno raccomandato l'uso di forbici a molla Vannas per effettuare l'incisione iniziale nella capsula renale20,26, questo metodo ha maggiori probabilità di causare traumi al parenchima sottostante e provocare la formazione di ematoma subcapsulare. Troppo sanguinamento comporterà la distensione della capsula e comprometterà la sicurezza del26 trapiantato. Pertanto, una pinza smussata deve essere utilizzata per aprire la capsula. Inoltre, mentre alcuni protocolli sostengono il posizionamento di prodotti commerciali con proprietà omostatiche sull'incisione capsulare26,31, questo passaggio non è necessario finché il tessuto è abbastanza avanzato nella tasca sottocapsulare.
Nei ratti più grandi, il rene può essere coperto di grasso perirenale e l'esternalizzazione del rene tramite sollevamento con pinze curve potrebbe non essere fattibile. In questi casi, è meglio esternalizzare il rene tirando delicatamente il grasso perirenale con una pinza e tirando fuori il rene dalla cavità addominale senza causare danni o sanguinamento.
Confronto con i modelli di trapianto eterotopico esistenti
Mentre diversi altri modelli animali per il trapianto di valvole aortiche eterotopiche sono stati precedentemente descritti 12,13,14,15,16,17,18, il protocollo attuale fornisce un'alternativa semplice e più pratica che migliora i modelli precedenti in diversi modi. In primo luogo, a causa della natura tecnicamente semplice della procedura, è necessaria pochissima formazione per operare con successo. Questo è in netto contrasto con i trapianti di valvola aortica eterotopica precedentemente descritti nell'aorta addominale. Pertanto, questo modello fornisce un'alternativa più pratica ed economica per studiare il trapianto di valvole aortiche riducendo al minimo la morbilità, il dolore e la mortalità dei ratti. Inoltre, poiché è necessario un solo foglietto della valvola aortica per l'operazione ricevente e ogni ratto donatore fornisce tre foglietti illustrativi, sono necessari meno ratti donatori per ogni esperimento. Inoltre, l'impianto di tessuto nel rene controlaterale o in una tasca sottocapsulare separata può consentire il controllo interno o il confronto delle risposte immunitarie a tessuti diversi all'interno di un singolo ratto. In questo caso, l'approccio migliore è attraverso un'incisione laparotomia della linea mediana.
Oltre ai modelli animali che descrivono il trapianto di valvole aortiche eterotopiche nell'aorta addominale, altri studi hanno utilizzato un modello sottocutaneo per studiare l'immunogenicità delle valvole aortiche32. Mentre questo approccio è senza dubbio più semplice del trapianto nell'aorta addominale, le prove esistenti suggeriscono che l'impianto sottocutaneo è un metodo meno efficace di presentazione dell'antigene33,34. Il campione impiantato è anche difficile da trovare e analizzare. Pertanto, lo spazio sottocapsulare renale è proposto come un sito di impianto che è sia semplificato ma ottimale per lo studio della biologia del trapianto di valvola aortica.
In sintesi, il modello appena proposto funge da aggiunta all'armamentario degli scienziati per studiare il trapianto di valvole cardiache e integra i modelli precedentemente descritti.
Limitazioni
Sebbene il trapianto di foglietti valvolari aortici sotto la capsula renale sia un metodo efficace per studiare l'alloimmunità in vivo, esistono alcune limitazioni di questo modello. Mentre lo spazio sottocapsulare è ben vascolarizzato, non offre lo stesso ambiente emodinamico della posizione sub-coronarica. Ciò può influenzare la risposta immunitaria al tessuto trapiantato. Alcuni hanno ipotizzato che le distinte proprietà immunitarie osservate nel tessuto valvolare possano derivare dal flusso sanguigno ad alta pressione sopra la valvola aortica in posizione sub-coronarica, annullando la risposta chemiotattica28,35. Inoltre, questo modello non è sufficiente per studiare l'effetto dell'alloreattività sulla funzione valvolare in quanto i foglietti illustrativi non svolgono la loro funzione fisiologica sotto la capsula renale. Tuttavia, limitazioni simili esistono per i modelli di trapianto di aorta addominale eterotopica in quanto il successo di questi modelli si basa sul rendere i lembi valvolari incompetenti per evitare la trombosi dell'innesto15,36.
Le limitazioni al protocollo includono la possibilità che il tessuto venga spostato dallo spazio sottocapsulare renale e non recuperabile (1 animale su 36). Un'altra limitazione è la morte dell'animale durante l'intervento chirurgico (1 su 36 animali); tuttavia, la morte è stata causata dal sovradosaggio di buprenorfina e possono essere impiegati altri metodi per il dosaggio dell'analgesia.
Divulgazioni
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
La Figura 1 è stata creata con biorender.com. Questo lavoro è stato sostenuto in parte dal programma di ricerca chirurgica della Fondazione AATS a TKR, dal Fondo di eccellenza per bambini detenuto dal Dipartimento di Pediatria presso la Medical University of South Carolina a TKR, da una sovvenzione della Emerson Rose Heart Foundation a TKR, dalla filantropia del senatore Paul Campbell a TKR, dalle sovvenzioni di formazione post-dottorato istituzionale NIH-NHLBI (T32 HL-007260) a JHK e BG, e la Medical University of South Carolina College of Medicine Pre-clerkship FLEX Research Fund to MAH.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chlordie, USP | Baxter | NDC 0338-0048-04 | |
| 4-0 Polyglactin 910 | Ethicon | J415H | |
| 7.5% Povidone-Iodine | CareFusion | 29904-004 | |
| 70% ETOH | Fisher Scientific | BP82031GAL | |
| Anesthesia induction chamber | Harvard Apparatus | 75-2030 | Air-tight inducton chamber for rats |
| Anesthesia machine | Harvard Apparatus | 75-0238 | Mobile Anesthesia System with Passive Scavenging |
| Anesthesia Mask | Harvard Apparatus | 59-8255 | Rat anesthesia mask |
| Brown Norway Rats (BN/Crl) | Charles River | Strain Code 091 | Male, 5-7 weeks, 100-200 g |
| Buprenorphine Hydrochloride, 0.3 mg/mL | PAR Pharmaceutical | NDC 42023-179-05 | 0.03 mg/kg, administered subcutaneously |
| Electric hair clippers | WAHL | 79434 | |
| Electric Heating Pad | Harvard Apparatus | 72-0492 | Maintained at 36-38 °C |
| Heparin | Sagent Pharmaceuticals | NDC 25021-400-10 | 100U/100g injection into the left atrium |
| Insulin Syringe, 1 mL | Fisher Scientific | 14-841-33 | |
| Iris forceps curved | World Precision Instruments | 15917 | |
| Iris forceps straight | World Precision Instruments | 15916 | |
| Isoflurane, USP | Piramal Critical Care | NDC 66794-017-25 | Induced at 5% isoflurance in oxygen and maintained with 3.5% isoflurane in oxygen |
| Lewis Rats (LEW/ Crl) | Charles River | Strain Code 004 | Male, 5-7 weeks, 100-200 g |
| Micro forceps | World Precision Instruments | 500233 | Dumont #5 |
| Micro scissors | World Precision Instruments | 501930 | Spring-loaded Vannas Scissors |
| Needle Driver | World Precision Instruments | 500226 | Ryder Needle Driver |
| Operating microscope | AmScope | SM-3BZ-80S | 3.5x - 90x Stereo Microscope |
| Petri Dish | Fisher Scientific | FB0875714 | |
| Petrolatum ophthalmic ointment | Dechra | NDC 17033-211-38 | |
| Skin staples | Ethicon | PXR35 | Proximate 35 |
| Sterile cotton swabs | Puritan | 25-806 1WC | |
| Sterile gauze sponges | Fisher Scientific | 22-037-902 | |
| Surgical Scissors | World Precision Instruments | 1962C | Metzenbaum Scissors |
| University of Wisconsin Buffer (Servator B) | S.A.L.F S.p.A. | 6484A1 | Stored at 4 °C |
Riferimenti
- Van Der Linde, D., et al. Birth prevalence of congenital heart disease worldwide: A systematic review and meta-analysis. Journal of the American College of Cardiology. 58 (21), 2241-2247 (2011).
- Jacobs, J. P., et al. Reoperations for pediatric and congenital heart disease: An analysis of the Society of Thoracic Surgeons (STS) congenital heart surgery database. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 17 (1), 2-8 (2014).
- Syedain, Z. H., et al. Pediatric tri-tube valved conduits made from fibroblast-produced extracellular matrix evaluated over 52 weeks in growing lambs. Science Translational Medicine. 13 (585), 1-16 (2021).
- Khan, M. S., Samayoa, A. X., Chen, D. W., Petit, C. J., Fraser, C. D. Contemporary experience with surgical treatment of aortic valve disease in children. Journal of Thoracic and Cardiovascular Surgery. 146 (3), 512-521 (2013).
- Boyd, R., Parisi, F., Kalfa, D. State of the art: Tissue engineering in congenital heart surgery. Seminars in Thoracic and Cardiovascular Surgery. 31 (4), 807-817 (2019).
- Feins, E. N., Emani, S. M. Expandable valves, annuloplasty rings, shunts, and bands for growing children. Seminars in Thoracic and Cardiovascular Surgery: Pediatric Cardiac Surgery Annual. 23, 17-23 (2020).
- Lintas, V., et al. TCT-795 Human cell derived off-the-shelf tissue engineered heart valves for next generation transcatheter aortic valve replacement: a proof-of-concept study in adult sheep. Journal of the American College of Cardiology. 70 (18), 271 (2017).
- Blum, K. M., Drews, J. D., Breuer, C. K. Tissue-engineered heart valves: A call for mechanistic studies. Tissue Engineering Part B: Reviews. 24 (3), 240-253 (2018).
- Bernstein, D., et al. Cardiac growth after pediatric heart transplantation. Circulation. 85 (4), 1433-1439 (1992).
- Delmo Walter, E. M., et al. Adaptive growth and remodeling of transplanted hearts in children. Europeon Journal of Cardiothoracic Surgery. 40 (6), 1374-1383 (2011).
- Simon, P., et al. Growth of the pulmonary autograft after the Ross operation in childhood. Europeon Journal of Cardiothoracic Surgery. 19 (2), 118-121 (2001).
- Oei, F. B. S., et al. A size-matching heterotopic aortic valve implantation model in the rat. Journal of Surgical Research. 87 (2), 239-244 (1999).
- Oei, F. B. S., et al. Heart valve dysfunction resulting from cellular rejection in a novel heterotopic transplantation rat model. Transplant International. 13, (2000).
- El Khatib, H., Lupinetti, F. M. Antigenicity of fresh and cryopreserved rat valve allografts. Transplantation. 49 (4), 765-767 (1990).
- Yankah, A. C., Wottge, H. U. Allograft conduit wall calcification in a model of chronic arterial graft rejection. Journal of Cardiac Surgery. 12 (2), 86-92 (1997).
- Moustapha, A., et al. Aortic valve grafts in the rat: Evidence for rejection. Journal of Thoracic and Cardiovascualr Surgery. 114 (6), 891-902 (1997).
- Légaré, J. F., et al. Prevention of allograft heart valve failure in a rat model. Journal of Thoracic and Cardiovascualr Surgery. 122 (2), 310-317 (2001).
- Legare, J. F., Lee, T. D. G., Creaser, K., Ross, D. B., Green, M. T lymphocytes mediate leaflet destruction and allograft aortic valve failure in rats. The Annals of Thoracic Surgery. 70 (4), 1238-1245 (2000).
- Niimi, M. The technique for heterotopic cardiac transplantation in mice: Experience of 3000 operations by one surgeon. Journal of Heart and Lung Transplantation. 20 (10), 1123-1128 (2001).
- Burgin, M., et al. Kidney Subcapsular Allograft Transplants as a Model to Test Virus-Derived Chemokine-Modulating Proteins as Therapeutics. Methods in molecular biology. 2225, 257-273 (2021).
- Foglia, R. P., DiPreta, J., Donahoe, P. K., Statter, M. B. Fetal allograft survival in immunocompetent recipients is age dependent and organ specific. Annals of Surgery. 204 (4), 402-410 (1986).
- Cunha, G. R., Baskin, L. Use of sub-renal capsule transplantation in developmental biology. Differentiation. 91 (4-5), 4-9 (2016).
- Hori, J., Joyce, N., Streilein, J. W. Epithelium-deficient corneal allografts display immune privilege beneath the kidney capsule. Investigative Opthalmology & Visual Science. 41 (2), 443-452 (2000).
- Mandel, T., et al. transplantation of organ cultured fetal pig pancreas in non-obese diabetic (NOD) mice and primates (Macaca fascicularis). Xenotransplantation. 2 (3), 128-132 (1995).
- Ricordi, C., Flye, M. W., Lacy, P. E. Renal subcapsular transplantation of clusters of hepatocytes in conjunction with pancreatic islets. Transplantation. 45 (6), 1148-1150 (1988).
- Shultz, L. D., et al. Subcapsular transplantation of tissue in the kidney. Cold Spring Harbor Protocols. 2014 (7), 737-740 (2014).
- Vanden Berg, C. W., et al. Renal subcapsular transplantation of PSC-derived kidney organoids induces neo-vasculogenesis and significant glomerular and tubular maturation in vivo. Stem Cell Reports. 10 (3), 751-765 (2018).
- Mitchell, R. N., Jonas, R. A., Schoen, F. J. Pathology of explanted cryopreserved allograft heart valves: Comparison with aortic valves from orthotopic heart transplants. Journal of Thoracic and Cardiovasular Surgery. 115 (1), 118-127 (1998).
- Valante, M., et al. The aortic valve after heart transplantation. Annals of Thoracic Surgery. 60, (1995).
- O'Brien, M. F., Stafford, E. G., Gardner, M. A. H., Pohlner, P. G., McGiffin, D. C. A comparison of aortic valve replacement with viable cryopreserved and fresh allograft valves, with a note on chromosomal studies. Journal of Thoracic and Cardiovascular Surgery. 94 (6), 812-823 (1987).
- Ng, T. F., Osawa, H., Hori, J., Young, M. J., Streilein, J. W. Allogeneic neonatal neuronal retina grafts display partial immune privilege in the subcapsular space of the kidney. The Journal of Immunology. 169 (10), 5601-5606 (2002).
- Heslop, B. F., Wilson, S. E., Hardy, B. E. Antigenicity of aortic valve allografts. Annals of Surgery. 177 (3), 301-306 (1973).
- Steinmuller, D., Weiner, L. J. Evocation and persistence of transplantation immunity in rats. Transplantation. 1 (1), 97-106 (1963).
- Billingham, R. E., Brent, L., Brown, J. B., Medawar, P. B. Time of onset and duration of transplantation immunity. Plastic and Reconstructive Surgery. 24 (1), 410-413 (1959).
- Tector, A. J., Boyd, W. C., Korns, M. E. Aortic valve allograft rejection. Journal of Thoracic and Cardiovascular Surgery. 62 (4), 592-601 (1971).
- Sugimura, Y., Schmidt, A. K., Lichtenberg, A., Akhyari, P., Assmann, A. A rat model for the in vivo assessment of biological and tissue-engineered valvular and vascular grafts. Tissue Engineering Methods (Part C). 23 (12), 982-994 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon