Method Article
Прехиазматическая однократная инъекция аутологичной крови для индукции экспериментального субарахноидального кровоизлияния на крысиной модели
В этой статье
Резюме
Субарахноидальное кровоизлияние продолжает нести высокое бремя смертности и заболеваемости человека. Для облегчения дальнейших исследований состояния и его патофизиологии представлена дохиазматическая модель однократной инъекции.
Аннотация
Несмотря на успехи, достигнутые в лечении за последние десятилетия, субарахноидальное кровоизлияние (САК) по-прежнему несет на себе тяжелое бремя заболеваемости и смертности, в основном затрагивая довольно молодое население. Было разработано несколько моделей САК на животных для исследования патофизиологических механизмов, лежащих в основе САК, и для тестирования фармакологических вмешательств. Прехиазматическая модель однократной инъекции на крысах, представленная в этой статье, представляет собой экспериментальную модель САК с заданным объемом крови. Вкратце, животное обезболивают, интубируют и держат под искусственной вентиляцией легких. Температура регулируется с помощью грелки. Катетер помещается в хвостовую артерию, что позволяет непрерывно измерять артериальное давление, а также брать кровь. Атлантоокципитальная мембрана разрезается, и катетер для регистрации давления помещается в большую цистерну, чтобы обеспечить измерение внутримозгового давления. Этот катетер также может быть использован для интратекальных терапевтических вмешательств. Крысу помещают в стереотаксическую рамку, просверливают отверстие для заусенца спереди от брегмы, а через отверстие для заусенца вводят катетер и помещают прямо перед хиазмой зрительного нерва. Аутологичная кровь (0,3 мл) извлекается из хвостового катетера и вводится вручную. Это приводит к повышению внутримозгового давления и уменьшению мозгового кровотока. Животное держат под действием седативных препаратов в течение 30 минут и дают подкожный физиологический раствор и анальгетики. Животное экстубируют и возвращают в клетку. Дохиазматическая модель имеет высокую скорость воспроизводимости и ограниченную вариабельность между животными из-за заранее определенного объема крови. Он имитирует САК у людей, что делает его подходящей моделью для исследований САК.
Введение
Нетравматическое субарахноидальное кровоизлияние (САК) является одной из форм инсульта, составляющей около 5% всех случаев. Наиболее распространенной причиной нетравматического САК является внезапный разрыв аневризмы (САК), на долю которого приходится 85% САК. Другие причины включают разрыв артериовенозной мальформации, коагулопатии и разрыв вен при перимезенцефальном кровоизлиянии1. Уровень заболеваемости составляет 9 на 100 000 человеко-лет, при этом смертность составляет примерно каждый третий, а другая треть требует поддержки повседневной жизни послеSAH 2,3.
После первоначальной стабилизации и подтверждения диагноза лечение зависит от тяжести кровоизлияния. Пациентам с наиболее тяжелыми заболеваниями будет вставлен внежелудочковый дренаж в желудочки для снижения внутримозгового давления (ВЧД), и они будут госпитализированы в отделение нейроинтенсивной терапии, где они будут находиться под пристальным наблюдением. Пациенты будут проходить ангиографию для выявления (вероятной) аневризмы, а затем аневризму скручивать или зажимать, чтобы предотвратить повторное кровотечение4. Несмотря на многочисленные испытания фармакологической терапии, только нимодипин, антагонист кальциевых каналов, показал улучшение исходов5. В настоящее время проводятся многочисленные клинические испытания. Пожалуйста, ознакомьтесь с обзором Дау и его коллег для получения обширного списка6.
Разрыв аневризмы был описан как внезапное начало самой сильной головной боли, которую когда-либо испытывали, или головной боли, вызванной ударом грома. Разрыв приводит к резкому повышению ВЧД с последующим снижением мозгового кровотока (КБФ). Это снижение приводит к глобальной ишемии мозга, что может привести к потере сознания. Этот более механистический путь, наряду с инициированным распадом экстравазированных элементов крови, приводит к высвобождению цитокинов и активации врожденной иммунной системы, что приводит к стерильному нейровоспалению. Кроме того, часто наблюдается разрушение гематоэнцефалического барьера, что приводит к отеку мозга и нарушению ионного гомеостаза. Все эти и другие изменения, названные ранней черепно-мозговой травмой (EBI), происходят в течение первых нескольких дней и приводят к потере нейронов и апоптозу7.
Примерно у 1/3 пациентов, страдающих аСАК, развивается отсроченная ишемия головного мозга (DCI) между 4-14 днями8. DCI определяется либо как дебют очагового, неврологического нарушения, либо как снижение минимум на два балла по шкале комы Глазго, продолжающееся не менее 1 часа, когда другие причины, включая судороги и повторное кровотечение, исключаются. DCI связан с повышенным риском смерти и снижением функционального исхода после aSAH9. Церебральный вазоспазм (CVS), сужение мозговых артерий, как известно, связан с DCI на протяжении десятилетий и ранее считался единственной причиной DCI. С тех пор было показано, что CVS может возникать без развития DCI, и с тех пор было выявлено больше факторов, включая микрососудистый тромбоз и сужение, корковую депрессию и воспалительную реакцию EBI10,11,12.
Из-за большого влияния EBI и DCI на течение заболевания и исход пациентов, животные модели должны имитировать их в максимально возможной степени, оставаясь при этом воспроизводимыми. Исследователи использовали широкий спектр различных моделей на различных животных, от мышей до приматов, чтобы попытаться смоделировать aSAH. Крысы дикого типа Sprague-Dawley и Wistar в настоящее время являются наиболее часто используемыми лабораторными животными, и наиболее распространенными моделями являются модель эндоваскулярной перфорации, модель двойной инъекции цистерна-магна и, наконец, прехиазматическая модель однократной инъекции, которая будет описана в этой статье13.
Дохиазматическая модель с одной инъекцией была первоначально разработана Прунеллом и его коллегами для противодействия некоторым недостаткам других экспериментальных моделей14. Операция, когда она освоена, обладает высокой воспроизводимостью и сводит к минимуму различия между животными. Модель имитирует САК у людей по нескольким пунктам, включая внезапный рост ВЧД после инъекции крови, что приводит к преходящей глобальной ишемии из-за падения CBF15,16. Он влияет на переднее кровообращение, где происходит большинство аСАК у людей17. Летальность колеблется от 10% до 33% в зависимости от исследования и количества введенной крови14,18. Отсроченная гибель клеток и нейровоспаление могут быть обнаружены на 2-й и 7-й день, что обеспечивает переменные для изучения последствий EBI и DCI19,20.
В исследовании представлено обновленное описание прехиазматической модели однократной инъекции у крыс, а также описание того, как использовать ICP-зонд в качестве порта для интратекального введения фармацевтических препаратов.
протокол
Эта процедура выполняется в соответствии с Директивой Европейского Союза 2010/63/ЕС о защите животных, используемых в научных целях, и одобрена Датской инспекцией по экспериментам на животных (лицензия No 2016-15-0201-00940). Хирургическое вмешательство проводится с использованием асептической техники в максимально широком объеме, включая стерильные инструменты, перчатки, катетеры и швы. В исследовании использовались самцы и самки крыс Sprague-Dawley весом 230-350 г, группа, размещенная в 12-часовом цикле света / темноты, с постоянной температурой 22 ° C (± 2 ° C) и влажностью 55% (± 10%). Животные обеспечиваются стандартным кормом и водой ad libitum. После операции животные размещаются в одиночных клетках, но могут быть возвращены в групповую клетку после удаления ICP-зонда. Анестетиком в этом протоколе является газ изофлуран, но 1,5 мл / кг внутрибрюшинной смеси кетамина (100 мг / мл) и ксилазина (20 мг / мл) 3: 2 также эффективен21.
1. Подготовка
- Модифицируйте катетер периферической вены 16 G для интубации. Чтобы модифицировать, укоротите иглу на 1 см и согните оставшуюся дистальную 1 см на 30° по направлению к клапану впрыска. Удалите створки катетера (многократное использование).
- Чтобы сделать зонд ICP, отрежьте 20-миллиметровый кусок полиэтиленовой трубки (внутренний диаметр (ID): 0,58 мм, внешний диаметр (OD): 0,96 мм) и сожгите один конец, чтобы получилась круглая пластина, сохраняющая открытый просвет. Обойдите полиэтиленовую трубку силиконовой трубкой диаметром 1 мм (внутренний диаметр: 1,0 мм, внешний диаметр: 3,0 мм) перед подсоединением 10 мм силиконовой трубки (внутренний диаметр: 0,76 мм, внешний диаметр: 2,4 мм) к концу полиэтиленовой трубки.
- Включите ноутбук и откройте программное обеспечение для сбора данных. Откалибруйте датчики артериального давления (АД) и внутримозгового давления (ВЧД), а также лазерный допплер в соответствии с инструкциями производителя.
- Подготовьте аппарат анализатора газов крови.
ВНИМАНИЕ: Убедитесь, что в испарителе достаточно изофлурана. - Включите O2 и поток атмосферного воздуха. Установите расход O2 на уровне 30% и атмосферного воздуха на уровне 70%.
- Поместите грелку и установите температуру 37 °C.
2. Анестезия
- Поместите крысу в наркозную камеру с потоком 30%О2 и 70% атмосферного воздуха. Введите в камеру 5% изофлуранового газа. Адекватная анестезия займет около 4 минут. Тщательно контролируйте дыхание.
- После анестезии поместите крысу в положение лежа на спине на тяжелой пластине, обойденной резинкой. Поместите передние зубы крысы ниже резинки.
- Осторожно вытяните язык изогнутыми щипцами. Очистите гортань ватным наконечником. Поместите внешний свет на среднюю линию горла, чтобы визуализировать голосовые связки.
- Интубация во время вдоха с помощью модифицированного катетера периферических вен 16 G. При правильной вставке снимите шпильку. Подключите катетер к аппарату искусственной вентиляции легких.
ПРИМЕЧАНИЕ: Правильное размещение трубки подтверждается движениями грудной клетки, синхронизированными с частотой дыхания. Если видны движения брюшной полости, экстубируют и снова вводят крысу в наркозный колокол. Не повторяйте процедуру более трех раз из-за риска повреждения дыхательных путей. - После интубации держите животное на искусственном дыхании с 30%О2 и 70% атмосферного воздуха. Поддерживайте анестезию на уровне 1,5%-3% изофлурана. Отрегулируйте изофлуран, чтобы поддерживать артериальное давление в пределах 80-100 мм рт.ст.
- Держите объем вдоха респиратора на уровне 3 мл и частоту на уровне 40-45 вдохов / мин. Отрегулируйте объем вдоха в соответствии с анализом газов крови.
- Сделайте шов через внутренние мягкие ткани щеки швом 2-0. Обвяжите шов вокруг инъекционной трубки и инъекционного клапана катетера периферической вены, чтобы закрепить катетер.
- Переместите крысу на операционное поле и поместите ее в положение лежа на спине хвостом в сторону хирурга.
- Наносите гель для глаз, когда это необходимо, чтобы противостоять сухости глаз.
- Выполните щепотку пальца ноги, чтобы подтвердить достаточную глубину анестезии. Оцените и поддерживайте глубину анестезии во время операции.
3. Хвостовой катетер
- Проксимальный отдел 3-4 см хвоста дезинфицируют 0,5% хлоргексидином этанолом.
ПРИМЕЧАНИЕ: Отныне используйте хирургический микроскоп по усмотрению хирурга. - Сделайте разрез кожи 15-20 мм в проксимальном конце хвоста с вентральной стороны. Будьте осторожны, чтобы не перерезать артерию.
- Освободите кожу от подлежащей соединительной ткани с помощью изогнутых щипцов.
- Осторожно проникают в фасцию, обнажая артерию.
- Осторожно освободите хвостовую артерию от подлежащих тканей с помощью изогнутых щипцов.
- Подсуньте под сосуд три черные шелковые нити. Поместите одну нить как можно дальше и плотно завяжите хирургический узел вокруг артерии. Зажмите свободные концы нити гемостатом.
- Свободно завяжите две оставшиеся нити вокруг артерии.
- Надавите на проксимальную нить как можно проксимальнее. Нанесите гемостат, чтобы удерживать концы проксимальной нити. Слегка потяните гемостат, но достаточно, чтобы ограничить и перекрыть кровоток. Поместите гемостат на живот.
- Разрежьте кончик катетера под углом 45°. Срежьте острый конец, чтобы предотвратить проникновение в артериальную стенку.
- С помощью ножниц Vannas сделайте разрез артерии на 1/3 диаметра артерии под углом 30°, в 3-5 мм от дистального узла.
- Вставьте катетер в артерию с помощью двух прямых щипцов. Используйте одни щипцы, чтобы удерживать катетер, а другие, чтобы осторожно натянуть артерию на катетер.
- Вставьте катетер вверх по сосуду к проксимальному узлу и ослабьте узел гемостата. Визуализируйте кровоток в катетере. Неплотно прикрепите среднюю нить к катетеру.
- Продолжайте вставлять и, если возможно, сразу после точки, где артерия снова покрыта фасцией.
- Контролируйте размещение катетера и возможную утечку, промывая физиологическим раствором.
- Скрепите две проксимальные нити с помощью хирургических узлов.
ПРИМЕЧАНИЕ: Измерение артериального давления должно быть пульсирующим; В противном случае катетер установлен неправильно. - Закрепите катетер в конце разреза, завязав хирургический узел с помощью дистальной нити.
- Неплотно сшить разрез кожи двумя нерассасывающимися монофиламентными швами 4-0. Будьте осторожны, чтобы не проникнуть в катетер.
ПРИМЕЧАНИЕ: На протяжении всей операции помните об амплитуде пульсации. Если он низкий, промойте катетер физиологическим раствором. - Ослабьте артериальный катетер от датчика давления, чтобы обеспечить кровоток для забора газов крови. Поместите микрокапиллярную трубку на конец катетера. Дайте крови течь в трубку. Повторно присоедините катетер к датчику после сбора крови и промойте катетер.
- Вставьте капиллярную трубку в анализатор газов крови. Измерьте pH, pCO2 и pO2 и запишите их
ПРИМЕЧАНИЕ: В зависимости от газов крови и значений артериального давления измените скорость вентиляции. Если среднее артериальное давление (MAP) слишком низкое, попробуйте уменьшить скорость потока изофлурана. Проверьте рефлексы, чтобы обеспечить надлежащую глубину анестезии.
4. Зонд ICP
- Поместите крысу в стереотаксическую рамку. Важно расположить крысу симметрично.
- Подложите цилиндрическую подушку под стереотаксическую раму, чтобы создать переднее сгибание шеи.
- Побрейте кожу головы, шею и область за ушами крысы. Удалите лишние волосы.
- Продезинфицируйте область 0,5% хлоргексидином этанолом.
- Анестезируют местно 0,7 мл 10 мг / 5 мкг / мл лидокаина с адреналином, вставляют иглу в каудальный конец черепа по средней линии. Вводят в мускулатуру шеи 0,3-0,4 мл. Остальную часть вводят подкожно вокруг и спереди от брегмы.
- Сделайте разрез кожи от прокола иглы ~8 мм каудально по средней линии.
- Рассеките все мышцы тупо слоями, чтобы определить атлантозатылочную мембрану (треугольник мраморного цвета каудально к черепу по средней линии).
- Используйте втягивающее устройство Alm для сдерживания мускулатуры шеи. При необходимости установите втягивающее устройство каудально.
- Проверьте, подключен ли стерильный ICP-зонд к датчику ICP. Промойте зонд ICP физиологическим раствором. Убедитесь, что в датчике ICP нет пузырьков воздуха.
- Надрежьте атлантозатылочную оболочку с помощью иглы 23 G. Сделайте отверстие, чтобы пропустить зонд ICP через мембрану.
- Осторожно проведите зонд через атлантоокципитальную мембрану. Слегка потяните зонд и убедитесь, что он показывает пульсирующую кривую в диапазоне от 0 до 5 мм рт.ст. Если нет, снимите щуп, проверьте соединение с датчиком и подтвердите поток через просвет.
- Нанесите две капли тканевого клея. Переместите силиконовую трубку диаметром 1 мм вперед к мембране и нанесите дополнительный клей, чтобы свести к минимуму риск смещения ICP-зонда.
- Извлеките втягивающие устройства.
- Сделайте один горизонтальный шов матраса на головном конце разреза и один простой прерывистый шов на каудальный конец с помощью нерассасывающегося монофиламентного шва 4-0.
5. Размещение иглы и лазерно-доплеровского зонда
- Сделайте разрез по средней линии спереди от глаз, 15 мм каудально.
- Удалите соединительную ткань и мышцы щипцами. Используйте конец стерильного ватного тампона в качестве румяна, позволяющего идентифицировать брегму и коронарные швы.
- Установите втягивающее устройство Alm.
- Поместите спинномозговую иглу 25 G в стереотаксическую рамку. Поместите иглу точно на брегму и отметьте положение.
ПРИМЕЧАНИЕ: Расположите срединный стык стереотаксической рамы под углом 30° к животному в вертикальной плоскости. - Извлеките иглу из брегмы, сдвиньте рамку на 65 мм вперед, а затем замените иглу по средней линии, чтобы отметить место сверления.
- Сверлите до тех пор, пока твердая мозговая оболочка не будет определена ниже кости. Аккуратно удалите костные отломки с помощью прямых щипцов и заполните полость костным воском.
- Просверлите еще одно отверстие на 3-4 мм сбоку справа от брегмы и прямо перед коронковым швом для лазерно-допплеровского аппарата. Не обязательно сверлить кость насквозь. Будьте осторожны, чтобы не проникнуть в твердую мозговую оболочку.
- Ищите сосуды, где лазер-допплер может измерить кровоток. Установите лазер-допплер и проверьте значения. Требуется минимальное значение 100 FU. Снимите микроскоп (искусственный свет).
- Если значения все еще приемлемы, добавьте одну каплю клея, чтобы зафиксировать зонд.
- Еще раз проверьте, не превышает ли значение 80 FU. Если значение ниже 80 FU, снимите и переместите зонд, чтобы достичь значения выше 80 FU.
ПРИМЕЧАНИЕ: Значение, FU, является произвольной единицей, показывающей мозговой кровоток (CBF).
6. Индукция САК
- Осторожно введите иглу через череп по средней линии между полушариями, пока не почувствуется сопротивление основания черепа. Втяните иглу на 1 мм, чтобы обеспечить правильное расположение прямо перед хиазмой зрительного нерва.
- Поверните иглу на 90° по часовой стрелке так, чтобы кончик иглы был направлен вправо, чтобы обеспечить наиболее однородный результат при введении крови. Снимите шпильку (рис. 3).
- Уравновешивают в течение 15 мин и регулируют уровень анестезии для получения среднего артериального давления в диапазоне 80-100 мм рт.ст.
- Проведите анализ газов крови. Отрегулируйте уровень анестезии соответствующим образом.
- Извлеките 500 мкл крови из хвостового катетера с помощью шприца объемом 1 мл с тупой иглой 23 G.
- Заполните мертвое пространство спинномозговой игольчатой камеры кровью, чтобы избежать впрыска воздуха. Извлеките иглу 23 G из заполненного кровью шприца и убедитесь, что шприц содержит 300 мкл крови.
- Подсоедините шприц к спинномозговой игле. Крепко возьмитесь и введите кровь вручную, чтобы превзойти MAP.
- Наблюдайте резкий рост ICP и резкое падение CBF на ноутбуке.
ПРИМЕЧАНИЕ: CBF должен быть 50% или ниже по сравнению с исходным баллом в течение не менее 5 минут, чтобы операция была успешной, см. Рисунок 4. Фиктивные крысы не проходят этапы 6.1-6.7, тем самым пропуская введение спинномозговой иглы в головной мозг, сводя к минимуму возможные спонтанные кровоизлияния и ятрогенные повреждения головного мозга.
7. Восстановление и пробуждение
- Подкожно вводят 0,1 мл / 100 г массы животного 5,0 мг / мл карпрофена и 1 мл / 100 г массы животного изотонического физиологического раствора. Перед введением убедитесь, что жидкости имеют как минимум комнатную температуру.
- Затем держите крысу под наркозом в течение 30 минут после САК.
- Извлеките иглу, лазерный допплеровский зонд, а затем заполните полости костным воском. Закройте разрез двумя горизонтальными матрасными швами с нерассасывающимся монофиламентным швом 4-0.
- Чтобы использовать зонд ICP для инъекций в большой бачок, снимите силиконовую трубку и вставьте точечный адаптер в полиэтиленовую трубку.
- Если вмешательство не планируется, разрезают простой, прерванный шов. Максимально укоротите зонд ВЧД с помощью ножниц, а затем приклейте конец, чтобы предотвратить утечку спинномозговой жидкости (ликвора). Закройте разрез нерассасывающимся монофиламентным швом 4-0.
- Извлеките крысу из стереотаксического каркаса и поставьте в положение лежа на спине. Снимите ослабленные швы с разреза хвоста.
- Наложите один шов проксимальнее и глубоко на артериальный катетер. Извлеките катетер и завяжите шов, чтобы предотвратить кровотечение. Зашить разрез хвоста нерассасывающимся монофиламентным швом 4-0.
- Выключите изофлуран.
- Очистите крысу и ее шерсть как можно больше.
- Когда рефлекс отмены педали восстановится, и у крысы возникнет спонтанное дыхание при отключении от аппарата искусственной вентиляции легких, экстубируйте ее.
- Поместите крысу в одну клетку с едой и водой ad libitum. Поместите одну половину клетки под нагревательную пластину и поместите крысу в эту область клетки.
- Выполняйте интратекальное введение, адаптируя инъектор pinport к прецизионному шприцу, и проводите лечение через адаптер pinport. Это вмешательство возможно у животных, которые бодрствуют. Смотрите рисунок 5.
8. Удаление ICP-зонда (если он не был удален во время операции)
ПРИМЕЧАНИЕ: Используйте хирургический микроскоп по усмотрению хирурга.
- Поместите крысу в анестезиологическую камеру, как описано ранее.
- После обезболивания поместите крысу в положение лежа на спине в операционном поле с помощью грелки.
- Поместите нос в маску для анестезии. Установите уровниО2 до 30%, атмосферного воздуха до 70% и изофлурана до 2%.
- Непрерывно наносите гель для глаз, чтобы противостоять сухости глаз.
- Разрезают каудальный простой прерывистый шов. Вскрывают разрез и удаляют возможную некротическую ткань или сгустки крови.
- Максимально укоротите зонд ВЧД с помощью ножниц и приклейте конец, чтобы предотвратить утечку спинномозговой жидкости (ликвора). Закройте разрез нерассасывающимся монофиламентным швом 4-0.
- Выключите изофлуран.
- Когда крыса начнет двигаться, поместите ее в одну клетку с едой и водой вволю. Поместите одну половину клетки на нагревательную пластину и поместите крысу в эту область.
- При возвращении в привычное состояние повторно вводите животных друг к другу в совместную клетку под наблюдением в течение первых 15 минут.
Результаты
Женщины имеют повышенный риск развития аСАК по сравнению с мужчинами. Несмотря на это, самцы грызунов в основном используются в экспериментах из-за возможного смещения из-за гетерогенности цикла течки у самок. Репрезентативные результаты, представленные здесь, взяты из недавней публикации, сравнивающей самок и самцов крыс, подтверждая, что модель дает аналогичные результаты у самок животных по сравнению с самцами21. В исследование были включены 34 самки крыс Sprague-Dawley (18 SAH и 16 Shams). Шамсу не опускали спинномозговую иглу на хиазму зрительного нерва и не вводили кровь. Все остальные процедуры выполнялись на шамах, идентичных САКам. Все физиологические параметры между группами были сопоставимы. Наконец, был проведен метаанализ данных предыдущих экспериментов на крысах-самцах, который был сопоставлен с результатами настоящего исследования21.
Тест на вращающийся полюс - это тест грубой сенсомоторной функции. Животное помещается на один конец шеста размером 150 см на 45 мм, который может вращаться до 10 оборотов в минуту. Цель состоит в том, чтобы добраться до дальнего конца столба, где находится клетка. Крысы SAH показали значительно худшие результаты на 1-й и 2-й день по сравнению с фиктивными животными на вращающемся полюсе (рис. 1).
После SAH семейство рецепторов ET-1 и 5-HT активируется в мозговых артериях, что приводит к увеличению сокращения при стимуляции и, таким образом, способствует CVS22,23. Базилярная артерия (БА) и средние мозговые артерии (МКА) были удалены после обезглавливания и использованы для экспериментов с миографом. И эндотелин 1 (ET-1), агонист семейства рецепторов ET-1, и 5-карбоксамидотриптамин (5-CT), агонист семейства 5-HT-рецепторов, вызывали значительно повышенное сокращение сосудов при САК по сравнению с фиктивным (рис. 2). Чувствительность можно наблюдать по более низким концентрациям, необходимым для того, чтобы вызвать сокращение после САК у обоих полов.
Повышенное содержание воды (отек) после САК является мерой снижения функционального исхода у людей24. Значительно повышенный отек мозга был обнаружен при САК по сравнению с фиктивным на 2-й день. Также наблюдалась тенденция к усилению отека гиппокампа, но это не было статистически значимым (p = 0,0508)21.
При сравнении вышеупомянутых данных с историческими данными о мужчинах результаты сопоставимы. Метаданные показывают повышенную сократимость у мужчин САК после добавления ET-1 или 5-CT (рис. 2). Кроме того, крысы SAH показали значительно худшие результаты по сравнению с фиктивными при проведении теста с вращающимся полюсом. Результат показал снижение сенсомоторной функции (рис. 1).
На рисунке 5А показано распределение аутологичной, введенной крови после перфузии физиологического раствора через 30 мин после индукции САК. На рисунке видно, что кровь распределилась в субарахноидальном пространстве после прехиазматической инъекции.
На рисунках 5В и 5С показано распределение интратекально вводимых красителей с последующей перфузией физиологического раствора по всему телу в течение 30 мин после инъекции. На рисунке 5B показано распределение 25 мкл 20 мМ Evans Blue (растворимый в воде), а на рисунке 5C показано распределение 25 мкл 10 мМ Oil Red O (нерастворимый в воде). Было обнаружено, что оба красителя распределены в субарахноидальном пространстве после инъекции в гигантскую цистерну, что подтверждает, что это возможная модель интратекальной инъекции как водорастворимых, так и нерастворимых соединений. Стоит отметить образование отложений вокруг артерий для нерастворимого в воде соединения.

Рисунок 1: Анализ сенсомоторного познания в первые 2 дня после САК у самцов и самок крыс. Испытание вращающегося полюса проводили на 1-й и 2-й день после САК. Крысы обоих полов имели значительный дефицит по сравнению с фиктивными крысами того же пола. Статистические различия в поведении между группами были проверены с помощью 2-way ANOVA в день 0, день 1 и день 2. Женский без вращения и 3 об/мин: p < 0,05. Женские 10 об/мин и все мужские данные: p < 0,01. Значения являются средствами ± SEM. Публикуется с разрешения Spray, S. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
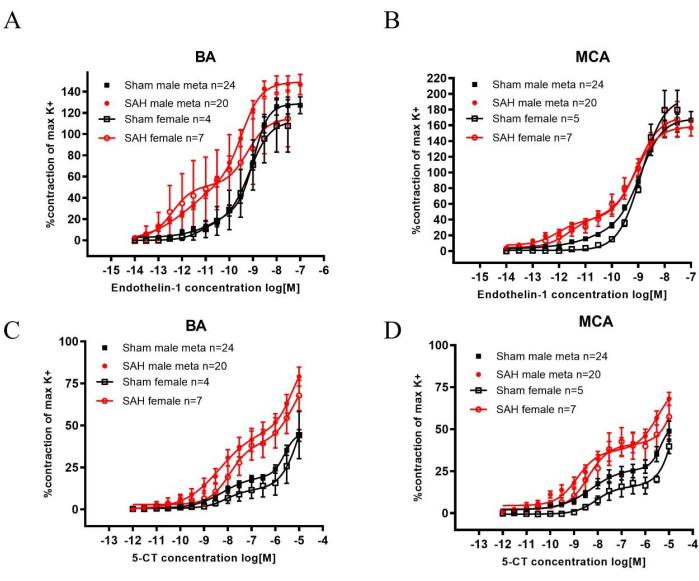
Рисунок 2: Анализ повышенной чувствительности к сокращениям, индуцированным ET-1 и 5-CT, в основной артерии (БА) и средней мозговой артерии (МКА) через 2 дня после САК у самцов и самок крыс. (А, Б) 60 мМ К+-вызванные (К+макс) сократительные реакции использовались в качестве референсных значений для нормализации ответов, вызванных агонистами. Чувствительность к ET-1 была значительно повышена через 2 дня после САК по сравнению с фиктивно оперированными крысами того же пола как в БА, так и в МКА. (С,Д) Чувствительность к 5-КТ была значительно повышена через 2 дня после САК по сравнению с фиктивно оперированными крысами того же пола как в БА, так и в МКА. Кривые «концентрация-реакция» были статистически сравнены с двусторонней ANOVA. Все данные: p < 0,001. Значения являются средними ± SEM. Публикуется с разрешения Spray, S. et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Обзор установки перед индукцией SAH. В верхней части рисунка обратите внимание, что 1) инъекционная игла, 2) лазерно-доплеровский зонд и 3) датчик ICP находятся на месте. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: След образца после интратекальной инъекции. На красном графике показано артериальное давление в мм рт.ст. На синем графике показано ВЧД в мм рт.ст., а на зеленом графике показан КБФ в произвольной единице ФУ. Всплеск ВЧД является результатом инъекции крови. Обратите внимание, что это приводит к снижению CBF > 50% от исходного уровня более чем на 5 минут. Кроме того, повышение ВЧД приводит к небольшому повышению артериального давления, которое нормализуется в течение нескольких секунд. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
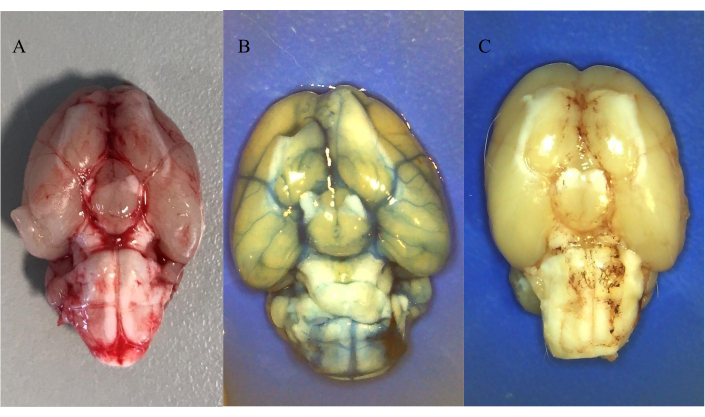
Рисунок 5: Распределение интратекально вводимой крови и цветных красителей . (A) Распределение аутологичной крови через 30 мин после индукции САК. (B) Распределение 25 мкл 20 мМ Evans Blue после интратекальной инъекции через катетер ICP. (C) Распределение 25 мкл 10 мМ Oil Red O после интратекальной инъекции через катетер ICP. Всем животным вводили внутрибрюшинную смесь кетамина и ксилазина с последующей перфузией физиологического раствора. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Прехиазматическая модель САК с однократной инъекцией имитирует несколько важных элементов САК человека, включая всплеск ВЧД, снижение CBF, транзиторную глобальную ишемию, активацию нейровоспалительных маркеров и CVS 14,15,16,18,19,20. ICP-зонд также использовался в качестве порта для интратекального введения (рис. 5). Кроме того, исследование показывает, что модель работает одинаково у самцов и самокживотных 21. Модель не учитывает развитие и последующий разрыв аневризмы. В ряде моделей была предпринята попытка получить САК из разорванной аневризмы путем индукции системной гипертензии хирургическим или фармакологическим путем и ослабления артериальной стенки с использованием эластазы25,26,27. Все попытки привели к аневризме САК у подгруппы животных, но эти модели имеют присущую им изменчивость, включая неспособность предсказать, когда аневризма разорвется. Модели не очень подходят для доклинических исследований SAH18,28.
Среди других мышиных моделей SAH модель эндоваскулярной перфорации включает разрыв сосуда, несколько имитирующий разрыв аневризмы, но склонный к высокой вариабельности и смертности. Описанная здесь модель лучше отслеживается и воспроизводима, поскольку объем крови заранее определен и давление инъекции можно контролировать. Модель двойной инъекции имеет более высокую вероятность возникновения отсроченного CVS, но в первую очередь влияет на заднее кровообращение и включает нефизиологичную вторую инъекцию крови. Для сравнения, эта модель напоминает САК у людей, поскольку это однократная инъекция переднего круга кровообращения и вызывает воспроизводимый рост ВЧД18.
Влияние различных режимов анестезии на экспериментальный САК неясно, а экспериментальные данные противоречивы. В одном исследовании сообщалось о возможном ингибировании цитокинов и общего нейровоспаления в модели эндоваскулярной перфорации у мышей при использовании ингаляций изофлурана29. Другая модель грызунов привела к снижению параметров дыхания и увеличению отека мозга, а также к уменьшению регионального CBF при использовании изофлуранов30. Однако метаанализ, сравнивающий смертность на мышиных моделях, не показал различий в смертности между изофлураном и другими типами анестезии31. В соответствии с приведенным выше протоколом успешно использовалась либо ингаляция изофлурана, либо внутрибрюшинная смесь кетамина/ксилазина с аналогичными результатами в обеих группах21.
Для обеспечения высокой воспроизводимости и надлежащего сбора данных основное внимание уделяется шагам, касающимся размещения оборудования для мониторинга. Правильное размещение хвостового катетера способствует постоянному мониторингу артериального давления и возможности проводить анализы газов крови. Правильная установка катетера ВЧД обеспечивает правильный мониторинг ВЧД и последующую возможность интратекального вмешательства. Правильное размещение лазерно-допплеровского зонда обеспечивает возможность контроля снижения CBF, где снижение исходного балла на 50% или ниже в течение не менее 5 минут после индукции САК обеспечивает сильную ишемию32. Убедившись, что все этапы мониторинга в порядке, исследователь может обеспечить правильный сбор данных после индукции SAH.
В протоколе описана прехиазматическая одноинъекционная модель субарахноидального кровоизлияния с обновлениями и модификациями. Модель была ценна для исследований САК и, вероятно, будет продолжать способствовать лучшему пониманию субарахноидального кровоизлияния, включая раннюю черепно-мозговую травму и отсроченную ишемию головного мозга.
Раскрытие информации
У авторов нет противоречащих друг другу интересов, о которых можно было бы заявить.
Благодарности
Работа была поддержана Фондом Лундбека и Грантом передового опыта Лундбека (No R59-A5404). Спонсоры не играли никакой роли ни в одной части рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 16 G peripheral vein catheter | BD Venflon | 393229 | Needle shortened, distal 1 cm curved. Wings removed |
| Anesthesia bell/ chamber | Unknown | ||
| Blood gas analyzer | Radiometer | ABL80 | |
| Blood pressure (BP) monitor | Adinstruments | ML117 | Connects to Powerlab |
| Curved forceps, 12 cm x 3 | F.S.T | 11001-12 | For anesthesia |
| Cylindrical pillow, 28 cm x 4 cm | Homemade | Made from surgical towels | |
| Data acquisition hardware | Adinstruments | ML870 Powerlab | |
| Data acquistion software | Adinstruments | LabChart 6.0 | |
| Drill | KMD | 1189 | |
| Drill controller | Silfradent | 300 IN | |
| Flexible light | Schott | KL200 | |
| Heating pad | Minco | 1135 | |
| Hypodermic needle, 20 G | KD Medical | 301300 | Connects to stereotaxic frame |
| ICP monitor | Adinstruments | ML117 | Connects to Powerlab |
| Isoflurane vaporizer | Ohmeda | TEC3 | |
| Laptop | Lenovo | T410 | |
| Laser doppler monitor | Adinstruments | ML191 | |
| Laser doppler probe | Oxford Optronics | MSF100XP | Connects to laser doppler monitor |
| Needle holder, 13 cm | F.S.T | 12001-13 | For anesthesia |
| Precision syringe, 0.025 mL | Hamilton | 547407 | |
| Stereotaxic frame | Kopf Instruments | M900 | |
| Surgical microscope | Carl Zeiss | F170 | |
| Suture needle | Allgaier | 1245 | For anesthesia |
| Temperaure controller | CWE,INC. | TC-1000 | |
| Transducer x 2 | Adinstruments | MLT0699 | Connects to BP and ICP monitor |
| Ventilator | Ugo Basile | 7025 | |
| Veterinary clipper | Aesculap | GT421 | |
| 3-pronged Blair retractor, 13.5 cm | Agnthos | 17022--13 | |
| Blunt Alm retractor | F.S.T | 17008-07 | |
| Curved forceps, 12 cm x 2 | F.S.T | 11001-12 | |
| Needle holder, 13 cm | F.S.T | 12001-13 | |
| Straight Dumont forceps, 11 cm | F.S.T | 11252-00 | |
| Straight Halsted-Mosquito hemostat x 2 | F.S.T | 13008-12 | |
| Straight Iris scissor, 9 cm | F.S.T | 14090-09 | |
| Straight Vannas scissor, 10.5 cm | F.S.T | 15018-10 | |
| Absorpable swabs | Kettenbach | 31603 | |
| Black silk thread, 4-0, 5 x 15 cm | Vömel | 14757 | |
| Bone wax | Aesculap | 1029754 | |
| Carbomer eye gel 2 mg/g | Paranova | ||
| Cotton swab | Heinz Herenz | WA-1 | |
| Cotton tipped applicator x 4 | Selefa | 120788 | |
| Hypodermic needle, 23 G x2 | KD Medical | 900284 | Connects to stopcock. Remove distal end |
| Hypodermic needle, 23 G x3 | KD Medical | 900284 | Remove distal end. 2 connects to stopcock, 1 to syringe |
| ICP probe: | Homemade | Made of the following: | |
| Polythene tubing, 20 mm | Smiths medical | 800/100/200 | Inner diameter (ID): 0.58 mm, Outer diameter (OD): 0.96 mm. |
| Silicone tubing, 10 mm | Fisher | 15202710 | ID: 0.76 mm, OD: 2.4 mm. |
| Silicone tubing, 2 mm | Fisher | 11716513 | ID: 1.0 mm, OD: 3.0 mm. |
| Micro hematocrit tubes | Brand | 7493 11 | |
| OP-towel, 45 cm x75 cm | Mölnlycke | 800430 | |
| PinPort adapter, 22 G | Instech | PNP3F22 | |
| PinPort injector | Instech | PNP3M | |
| Polythene tubing, 2 x 20 cm | Smiths medical | 800/100/200 | Connects to syringe. ID: 0.58 mm, OD: 0.96 mm. |
| Rubberband | Unknown | ||
| Scalpel, 10 blade | Kiato | 23110 | |
| Spinalneedle, 25 G x 3.5'' | Braun | 5405905-01 | |
| Stopcock system, Discofix x 2 | Braun | 16494C | Connects to transducer |
| Suture, 4-0, monofil, non-resorbable x 3 | Ethicon | EH7145H | |
| Syringe, 1 mL | BD Plastipak | 1710023 | |
| Syringe, luer-lock, 10 mL x 4 | BD Plastipak | 305959 | Connects to transducer |
| Tissue adhesive glue | 3M | 1469SB | |
| 0.5% Chlorhexidine spirit | Faaborg Pharma | 210918 | |
| Carprofen 50 mg/mL | ScanVet | 43715 | Diluted 1:10 |
| Isoflurane | Baxter | ||
| Isotonic saline | Amgros | 16404 | |
| Lidocaine-Adrenaline 10 mg/5 µg/mL | Amgros | 16318 |
Ссылки
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. Lancet. 369 (9558), London, England. 306-318 (2007).
- de Rooij, N. K., Linn, F. H. H., vander Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12), 1365-1372 (2007).
- Feigin, V. L., Lawes, C. M., Bennett, D. A., Barker-Collo, S. L., Parag, V. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review. The Lancet, Neurology. 8 (4), 355-369 (2009).
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of spontaneous subarachnoid hemorrhage: guidelines and gaps. Stroke. 51 (4), 1326-1332 (2020).
- Pickard, J. D., et al. Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial. British Medical Journal (Clinical Research ed.). 298 (6674), 636-642 (1989).
- Daou, B. J., Koduri, S., Thompson, B. G., Chaudhary, N., Pandey, A. S. Clinical and experimental aspects of aneurysmal subarachnoid hemorrhage. CNS Neuroscience and Therapeutics. 25 (10), 1096-1112 (2019).
- Fujii, M., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Translational Stroke Research. 4 (4), 432-446 (2013).
- Roos, Y. B., et al. Complications and outcome in patients with aneurysmal subarachnoid haemorrhage: A prospective hospital based cohort study in the Netherlands. Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3), 337-341 (2000).
- Vergouwen, M. D. I., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Brown, R. J., Kumar, A., Dhar, R., Sampson, T. R., Diringer, M. N. The relationship between delayed infarcts and angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery. 72 (5), 702-707 (2013).
- Dhar, R., et al. Relationship between angiographic vasospasm and regional hypoperfusion in aneurysmal subarachnoid hemorrhage. Stroke. 43 (7), 1788-1794 (2012).
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews. Neurology. 10 (1), 44-58 (2014).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. -A. A new experimental model in rats for study of the pathophysiology of subarachnoid hemorrhage. Neuroreport. 13 (18), 2553-2556 (2002).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52 (1), 165-176 (2003).
- Prunell, G. F., et al. Experimental Subarachnoid Hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54 (2), 426-437 (2004).
- Velthuis, B. K., et al. Subarachnoid hemorrhage: Aneurysm detection and preoperative evaluation with CT angiography. Radiology. 208 (2), 423-430 (1998).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71(2018).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Inflammation in the brain after experimental subarachnoid hemorrhage. Neurosurgery. 56 (5), 1082-1091 (2005).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain. Journal of Neurosurgery. 102 (6), 1046-1054 (2005).
- Spray, S., Haanes, K. A., Edvinsson, L., Johansson, S. E. Subacute phase of subarachnoid haemorrhage in female rats: increased intracranial pressure, vascular changes and impaired sensorimotor function. Microvascular Research. 135, 104127(2020).
- Ansar, S., Vikman, P., Nielsen, M., Edvinsson, L. Cerebrovascular ETB, 5-HT1B, and AT1 receptor upregulation correlates with reduction in regional CBF after subarachnoid hemorrhage. American Journal of Physiology - Heart and Circulatory Physiology. 293 (6), 3750-3758 (2007).
- Hansen-Schwartz, J., et al. Subarachnoid hemorrhage enhances endothelin receptor expression and function in rat cerebral arteries. Neurosurgery. 52 (5), 1188-1194 (2003).
- Hayman, E. G., Wessell, A., Gerzanich, V., Sheth, K. N., Simard, J. M. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage. Neurocritical Care. 26 (2), 301-310 (2017).
- Miyata, H., et al. Vasa vasorum formation is associated with rupture of intracranial aneurysms. Journal of Neurosurgery. , 1-11 (2019).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), Dallas, Tex. 1337-1344 (1979).
- Marbacher, S., Wanderer, S., Strange, F., Grüter, B. E., Fandino, J. Saccular aneurysm models featuring growth and rupture: A systematic review. Brain Sciences. 10 (2), 101(2020).
- Altay, O., et al. Isoflurane on brain inflammation. Neurobiology of Disease. 62, 365-371 (2014).
- Hockel, K., Trabold, R., Schöller, K., Török, E., Plesnila, N. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats. Experimental and Translational Stroke Medicine. 4 (1), 5(2012).
- Kamp, M. A., et al. A Systematic and meta-analysis of mortality in experimental mouse models analyzing delayed cerebral ischemia after subarachnoid hemorrhage. Translational Stroke Research. 8 (3), 206-219 (2017).
- Povlsen, G. K., Johansson, S. E., Larsen, C. C., Samraj, A. K., Edvinsson, L. Early events triggering delayed vasoconstrictor receptor upregulation and cerebral ischemia after subarachnoid hemorrhage. BMC Neuroscience. 14, 34(2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены