Method Article
Inyección única prequiasmática de sangre autóloga para inducir hemorragia subaracnoidea experimental en un modelo de rata
En este artículo
Resumen
La hemorragia subaracnoidea sigue conllevando una alta carga de mortalidad y morbilidad en el hombre. Para facilitar la investigación adicional sobre la condición y su fisiopatología, se presenta un modelo pre-quiasmático de inyección única.
Resumen
A pesar de los avances en el tratamiento en las últimas décadas, la hemorragia subaracnoidea (HSA) sigue conllevando una alta carga de morbilidad y mortalidad, afectando en gran medida a una población bastante joven. Se han desarrollado varios modelos animales de HSA para investigar los mecanismos fisiopatológicos detrás de la HSA y para probar intervenciones farmacológicas. El modelo de inyección única pre-quiasmático en la rata presentado en este artículo es un modelo experimental de HSA con un volumen sanguíneo predeterminado. Brevemente, el animal es anestesiado, intubado y mantenido bajo ventilación mecánica. La temperatura se regula con una almohadilla térmica. Se coloca un catéter en la arteria caudal, lo que permite la medición continua de la presión arterial, así como la toma de muestras de sangre. La membrana atlantooccipital se incide y se coloca un catéter para el registro de presión en la cisterna magna para permitir la medición de la presión intracerebral. Este catéter también se puede utilizar para intervenciones terapéuticas intratecales. La rata se coloca en un marco estereotáxico, se perfora un orificio de rebabas anteriormente al bregma, y se inserta un catéter a través del orificio de rebaba y se coloca justo antes del quiasma óptico. La sangre autóloga (0,3 ml) se extrae del catéter de la cola y se inyecta manualmente. Esto resulta en un aumento de la presión intracerebral y una disminución del flujo sanguíneo cerebral. El animal se mantiene sedado durante 30 min y se le administra solución salina subcutánea y analgésicos. El animal es extubado y devuelto a su jaula. El modelo prequiasmático tiene una alta tasa de reproducibilidad y una variación limitada entre animales debido al volumen sanguíneo predeterminado. Imita la HSA en humanos, lo que la convierte en un modelo relevante para la investigación de la HAS.
Introducción
La hemorragia subaracnoidea no traumática (HSA) es una forma de accidente cerebrovascular, que representa alrededor del 5% de todos los casos. La causa más común de HSA no traumática es la ruptura repentina de un aneurisma (HASA), que representa el 85% de los HSA. Otras causas incluyen la ruptura de una malformación arterio-venosa, coagulopatías y ruptura de venas en hemorragia perimesencefálica1. La tasa de incidencia es de 9 por 100.000 años-persona, con una mortalidad de alrededor de uno de cada tres y otro tercio que requiere el apoyo de la vida diaria después de la HAS 2,3.
Después de la estabilización inicial y la confirmación del diagnóstico, el tratamiento depende de la gravedad de la hemorragia. A los pacientes más gravemente afectados se les insertará un drenaje extraventricular en los ventrículos para reducir la presión intracerebral (PIC) y serán ingresados en la unidad de cuidados neurointensivos, donde serán monitoreados de cerca. Los pacientes se someterán a una angiografía para identificar el aneurisma (probable) y luego tendrán el aneurisma enrollado o recortado para evitar que vuelva a sangrar4. A pesar de numerosos ensayos de terapias farmacológicas, sólo la nimodipina, un antagonista de los canales de calcio, ha demostrado mejorar los resultados5. Actualmente se están llevando a cabo múltiples ensayos clínicos. Consulte la revisión de Daou y sus colegas para obtener una lista extensa6.
La ruptura de un aneurisma se ha descrito como la aparición repentina del peor dolor de cabeza jamás experimentado o un dolor de cabeza de trueno. La ruptura resulta en un fuerte aumento de la PIC seguido de una reducción en el flujo sanguíneo cerebral (CBF). Esta reducción resulta en isquemia global del cerebro, lo que puede resultar en una pérdida de conciencia. Esta vía más mecanicista, junto con la descomposición iniciada de los elementos extravasados de la sangre, da lugar a la liberación de citoquinas y la activación del sistema inmune innato que resulta en neuroinflamación estéril. Además, a menudo se observa la ruptura de la barrera hematoencefálica, lo que resulta en edema cerebral y alteración en la homeostasis iónica. Todos estos cambios y más, acuñados como lesión cerebral temprana (EBI), ocurren dentro de los primeros días y resultan en pérdida neuronal y apoptosis7.
Aproximadamente 1/3 de los pacientes afectados por aSAH desarrollarán isquemia cerebral retardada (DCI) entre el día 4-148. La DCI se define como el debut de un deterioro neurológico focal o una caída de un mínimo de dos puntos en la escala de coma de Glasgow que dura un mínimo de 1 h, cuando se excluyen otras causas, incluidas las convulsiones y el nuevo sangrado. La DCI se asocia con un mayor riesgo de muerte y una disminución del resultado funcional después de la HSA9. Se sabe que el vasoespasmo cerebral (CVS), el estrechamiento de las arterias cerebrales, está asociado con DCI durante décadas y anteriormente se pensaba que era la única razón para DCI. Desde entonces se ha demostrado que CVS puede ocurrir sin el desarrollo de DCI y desde entonces se han identificado más factores, incluyendo trombosis microvascular y constricción, depresión de propagación cortical y una respuesta inflamatoria de EBI10,11,12.
Debido a la gran influencia de EBI y DCI en el curso de la enfermedad y el resultado de los pacientes afectados, los modelos animales necesitan imitarlos en el mayor grado posible, sin dejar de ser reproducibles. Los investigadores han empleado una amplia gama de modelos diferentes en una variedad de animales, desde ratones hasta primates no humanos, para tratar de simular aSAH. Las ratas salvajes Sprague-Dawley y Wistar son actualmente los animales de laboratorio más utilizados, y los modelos más comunes son el modelo de perforación endovascular, el modelo de doble inyección cisterna-magna y, por último, el modelo de inyección única prequiasmática, que se describirá en este artículo13.
El modelo pre-quiasmático de inyección única fue desarrollado originalmente por Prunell y colegas para contrarrestar algunas de las deficiencias de los otros modelos experimentales14. La cirugía, cuando se domina, es altamente reproducible y minimiza la variación entre animales. El modelo imita la HSA en humanos en múltiples puntos, incluido el aumento repentino de la PIC después de la inyección de sangre, lo que resulta en isquemia global transitoria debido a una caída en el CBF15,16. Afecta la circulación anterior, que es donde ocurre la mayoría de los aSAH en humanos17. La mortalidad oscila entre el 10% y el 33% dependiendo del estudio y de la cantidad de sangre inyectada14,18. La muerte celular retardada y la neuroinflamación pueden detectarse en los días 2 y 7, proporcionando variables para estudiar las consecuencias de EBI y DCI19,20.
El estudio presenta una descripción actualizada del modelo de inyección única prequiasmática en la rata junto con una descripción de cómo utilizar la sonda ICP como puerto para la administración intratecal de productos farmacéuticos.
Protocolo
Este procedimiento se realiza de acuerdo con la Directiva 2010/63/UE de la Unión Europea relativa a la protección de los animales utilizados con fines científicos y aprobado por la Inspección Danesa de Experimentación Animal (licencia no. 2016-15-0201-00940). La cirugía se realiza utilizando una técnica aséptica en la mayor medida posible, incluyendo instrumentos estériles, guantes, catéteres y suturas. El estudio utilizó ratas Sprague-Dawley macho y hembra con un peso de 230-350 g, agrupadas en ciclo de luz/oscuridad de 12 h, con temperatura constante de 22 °C (± 2 °C) y humedad del 55% (± 10%). Los animales están provistos de comida estándar y agua ad libitum. Los animales se alojan en jaulas individuales después de la cirugía, pero pueden ser devueltos a la jaula grupal cuando se haya retirado la sonda ICP. El anestésico en este protocolo es gas isoflurano, pero una mezcla intraperitoneal 3:2 de 1,5 mL/kg de ketamina (100 mg/mL) y xilazina (20 mg/mL) también es efectiva21.
1. Preparativos
- Modificar un catéter de vena periférica de 16 G para la intubación. Para modificar, acorte la aguja en 1 cm y doble el resto distal 1 cm por 30° hacia la válvula de inyección. Retire las alas del catéter (uso múltiple).
- Para hacer una sonda ICP, corte una pieza de 20 mm de tubo de polietileno (diámetro interior (ID): 0,58 mm, diámetro exterior (OD): 0,96 mm) y queme un extremo para hacer una placa circular, manteniendo una luz abierta. Evite el tubo de polietileno con 1 mm de tubo de silicona (ID: 1,0 mm, OD: 3,0 mm) antes de conectar 10 mm de tubo de silicona (ID: 0,76 mm, OD: 2,4 mm) al extremo del tubo de polietileno.
- Encienda la computadora portátil y abra el software de adquisición de datos. Calibre los transductores de presión arterial (PA) e intracerebral (PIC), y el Laser-Doppler de acuerdo con las instrucciones del fabricante.
- Prepare el aparato analizador de gases en sangre.
PRECAUCIÓN: Asegúrese de que haya suficiente isoflurano en el vaporizador. - Encienda el O2 y el flujo de aire atmosférico. Ajuste el flujo deO2 al 30% y el aire atmosférico al 70%.
- Coloque la almohadilla térmica y ajuste la temperatura a 37 °C.
2. Anestesia
- Coloque la rata en la cámara de anestesia con un flujo de 30% deO2 y 70% de aire atmosférico. Administrar 5% de gas isoflurano en la cámara. La anestesia adecuada tomará alrededor de 4 minutos. Controle la respiración cuidadosamente.
- Cuando esté anestesiado, coloque a la rata en posición supina sobre una placa pesada eludida por una banda elástica. Coloque los dientes frontales de la rata debajo de la banda elástica.
- Saca la lengua con cuidado con pinzas curvas. Limpie la laringe con una punta de algodón. Coloque una luz externa en la línea media de la garganta para visualizar las cuerdas vocales.
- Intubar durante la inspiración utilizando el catéter de vena periférica 16 G modificado. Cuando esté insertado correctamente, retire el estilete. Conecte el catéter al ventilador.
NOTA: La colocación correcta del tubo se confirma por los movimientos del pecho en sincronía con la frecuencia respiratoria. Si se observan movimientos del abdomen, extubar y reintroducir a la rata en la campana de anestesia. No repita el procedimiento más de tres veces debido al riesgo de dañar las vías respiratorias. - Cuando esté intubado, mantenga al animal en respiración artificial con 30% deO2 y 70% de aire atmosférico. Mantener la anestesia al 1,5%-3% de isoflurano. Ajuste el isoflurano para mantener la presión arterial entre 80-100 mmHg.
- Mantenga el volumen inspiratorio del respirador a 3 ml y la frecuencia a 40-45 inspiraciones/min. Ajustar el volumen inspiratorio de acuerdo con el análisis de gases en sangre.
- Haga una sutura a través del tejido blando interno de la mejilla con una sutura 2-0. Ate la sutura alrededor del tubo de inyección y la válvula de inyección del catéter de vena periférica para sujetar el catéter.
- Mueva la rata al campo de operaciones y colóquela en posición supina con la cola mirando hacia el cirujano.
- Aplique el gel para los ojos cuando sea necesario para contrarrestar los ojos secos.
- Realice un pellizco del dedo del pie para confirmar una profundidad adecuada de anestesia. Evaluar y mantener la profundidad de la anestesia durante la cirugía.
3. Catéter de cola
- Desinfecte los 3-4 cm proximales de la cola con 0,5% de etanol de clorhexidina.
NOTA: A partir de ahora, use el microscopio quirúrgico a discreción del cirujano. - Haga una incisión cutánea de 15-20 mm en el extremo proximal de la cola en el lado ventral. Tenga cuidado de no incidir la arteria.
- Afloje la piel del tejido conectivo subyacente con un fórceps curvo.
- Penetre cuidadosamente la fascia exponiendo la arteria.
- Suelte cuidadosamente la arteria de la cola del tejido subyacente con un fórceps curvo.
- Deslice tres hilos de seda negra debajo del recipiente. Coloque un hilo lo más distalmente posible y ate un nudo quirúrgico firmemente alrededor de la arteria. Sostenga los extremos sueltos del hilo con un hemostático.
- Ate los dos hilos restantes libremente alrededor de la arteria.
- Empuje el hilo proximal lo más proximal posible. Aplique un hemostático para sostener los extremos del hilo proximal. Tire del hemostático ligeramente, pero lo suficiente como para restringir y bloquear el flujo sanguíneo. Coloque el hemostático en el abdomen.
- Corte la punta del catéter en un ángulo de 45°. Corte la punta afilada para evitar la penetración de la pared arterial.
- Usando una tijera Vannas, haga una incisión en la arteria 1/3 del diámetro de la arteria en un ángulo de 30 °, a 3-5 mm del nudo distal.
- Inserte el catéter en la arteria con dos fórceps rectos. Use uno de los fórceps para sostener el catéter y el otro para tirar cuidadosamente de la arteria sobre el catéter.
- Inserte el catéter hasta el vaso hasta el nudo proximal y afloje el nudo del hemostático. Visualice el flujo sanguíneo en el catéter. Sujete la rosca central holgadamente al catéter.
- Continúe la inserción a, y si es posible, justo más allá, del punto donde la arteria está cubierta nuevamente por la fascia.
- Controle la colocación del catéter y la posible fuga enjuagando con solución salina.
- Sujete los dos hilos proximales con nudos quirúrgicos.
NOTA: La medición de la presión arterial debe ser pulsátil; De lo contrario, el catéter no se coloca correctamente. - Sujete el catéter al final de la incisión atando un nudo quirúrgico con el hilo distal.
- Cose la incisión de la piel con dos suturas 4-0 de monofilamento no reabsorbibles. Tenga cuidado de no penetrar el catéter.
NOTA: Durante toda la cirugía tenga en cuenta la amplitud de la pulsación. Si esto es bajo, enjuague el catéter con solución salina. - Afloje el catéter arterial del transductor de presión para permitir el flujo sanguíneo para la toma de muestras de gases en sangre. Coloque un tubo microcapilar en el extremo del catéter. Deje que la sangre fluya hacia el tubo. Vuelva a colocar el catéter en el transductor después de la extracción de sangre y enjuague el catéter.
- Inserte el tubo capilar en el analizador de gases en sangre. Mida el pH, el pCO2 y el pO2 y anótelos
NOTA: Dependiendo de los valores de gases en sangre y presión arterial, cambie la tasa de ventilación. Si la presión arterial media (PAM) es demasiado baja, trate de reducir el caudal de isoflurano. Pruebe los reflejos para asegurar la profundidad adecuada de la anestesia.
4. Sonda ICP
- Coloque la rata en el marco estereotáxico. Es importante colocar la rata simétricamente.
- Coloque una almohada cilíndrica debajo del marco estereotáxico para crear una flexión anterior del cuello.
- Afeite el cuero cabelludo, el cuello y el área detrás de las orejas de la rata. Eliminar el vello superfluo.
- Desinfecte el área con 0,5% de etanol de clorhexidina.
- Anestesiar localmente con 0,7 mL de lidocaína de 10 mg/5 μg/mL con adrenalina, insertar la aguja en el extremo caudal del cráneo en la línea media. Inyectar en la musculatura del cuello con 0.3-0.4 mL. Inyecte el resto por vía subcutánea alrededor y antes del bregma.
- Haga una incisión en la piel de la punción de la aguja ~ 8 mm caudalmente en la línea media.
- Diseccionar todos los músculos sin rodeos en capas para identificar la membrana atlantooccipital (triángulo de color mármol caudalmente al cráneo en la línea media).
- Use el retractor Alm para restringir la musculatura del cuello. Coloque el retractor con puntas caudalmente si es necesario.
- Compruebe si la sonda ICP estéril está conectada al transductor ICP. Enjuague la sonda ICP con solución salina. Asegúrese de que no haya burbujas de aire en la sonda ICP.
- Incidir la membrana atlantooccipital con una aguja de 23 G. Haga un orificio para persuadir a la sonda ICP a través de la membrana.
- Persuada suavemente la sonda a través de la membrana atlantooccipital. Tire de la sonda ligeramente y asegúrese de que muestre una curva pulsante que oscile entre 0 y 5 mmHg. Si no es así, retire la sonda, compruebe la conexión al transductor y confirme el flujo a través del lumen.
- Aplicar dos gotas del pegamento de tejido. Mueva el tubo de silicona de 1 mm hacia adelante hasta la membrana y aplique pegamento adicional para minimizar el riesgo de desplazamiento de la sonda ICP.
- Retire el(los) retractor(es).
- Haga una sutura horizontal de colchón en el extremo cefálico de la incisión y una sutura interrumpida simple en el extremo caudal utilizando una sutura 4-0 de monofilamento no reabsorbible.
5. Colocación de la aguja y la sonda láser-Doppler
- Haga una incisión en la línea media justo anterior a los ojos, 15 mm caudalmente.
- Retire el tejido conectivo y los músculos con fórceps. Utilice el extremo de un hisopo de algodón estéril como rougine que permite identificar el bregma y las suturas coronales.
- Coloque el retractor Alm.
- Coloque una aguja espinal de 25 G en el marco estereotáxico. Coloque la aguja exactamente en el bregma y anote la posición.
NOTA: Coloque la articulación de la línea media del marco estereotáxico a 30° hacia el animal en el plano vertical. - Retire la aguja del bregma, mueva el marco 65 mm anteriormente y luego reemplace la aguja en la línea media para marcar el sitio de perforación.
- Perfore hasta que la duramadre se identifique debajo del hueso. Retire suavemente los fragmentos de hueso con pinzas rectas y llene la cavidad con cera ósea.
- Perforar otro orificio 3-4 mm lateral a la derecha del bregma y justo anterior a la sutura coronal para el Laser-Doppler. No es necesario perforar todo el camino a través del hueso. Tenga cuidado de no penetrar la duramadre.
- Busque los vasos donde el láser-doppler puede medir el flujo sanguíneo. Coloque el láser-doppler y compruebe los valores. Se requiere un valor mínimo de 100 FU. Retire el microscopio (luz artificial).
- Si los valores siguen siendo aceptables, agregue una gota de pegamento para fijar la sonda.
- Vuelva a comprobar para confirmar si el valor es superior a 80 FU. Si el valor es inferior a 80 FU, retire y vuelva a colocar la sonda para alcanzar un valor superior a 80 FU.
NOTA: El valor, FU, es una unidad arbitraria que muestra el flujo sanguíneo cerebral (CBF).
6. Inducción de la HAS
- Inserte la aguja suavemente a través del cráneo en la línea media entre los hemisferios hasta que se sienta la resistencia de la base del cráneo. Retraiga la aguja 1 mm para asegurar la colocación correcta justo antes del quiasma óptico.
- Gire la aguja 90° en el sentido de las agujas del reloj para que la punta de la aguja apunte hacia la derecha para garantizar el resultado más homogéneo al inyectar la sangre. Retire el estilete (Figura 3).
- Equilibrar durante 15 min y ajustar el nivel de anestesia para obtener una presión arterial media en el rango 80-100 mmHg.
- Realice un análisis de gases en sangre. Ajuste el nivel de anestesia en consecuencia.
- Extraiga 500 μL de sangre del catéter de cola con una jeringa de 1 ml con una aguja roma de 23 G.
- Llene el espacio muerto de la cámara de la aguja espinal con sangre para evitar la inyección de aire. Retire la aguja de 23 G de la jeringa llena de sangre y confirme que la jeringa contiene 300 μL de sangre.
- Conecte la jeringa a la aguja espinal. Agarre firmemente e inyecte la sangre manualmente para superar la MAP.
- Observe un fuerte aumento en ICP y una fuerte caída en CBF en la computadora portátil.
NOTA: El CBF debe ser del 50% o inferior en comparación con la puntuación inicial durante al menos 5 minutos para que la cirugía sea exitosa, ver Figura 4. Las ratas simuladas no se someten a los pasos 6.1-6.7, omitiendo así la introducción de la aguja espinal en el cerebro, minimizando la posible hemorragia espontánea y el daño cerebral iatrogénico.
7. Recuperación y despertar
- Administrar 0,1 mL/100 g de peso animal de 5,0 mg/mL de carprofeno y 1 mL/100 g de peso animal de solución salina isotónica por vía subcutánea. Asegúrese de que los líquidos estén al menos a temperatura ambiente antes de administrarlos.
- Posteriormente, mantenga a la rata bajo anestesia durante 30 minutos después de la HSA.
- Retire la aguja, la sonda láser Doppler y luego llene las cavidades con cera ósea. Cierre la incisión con dos suturas horizontales de colchón con sutura 4-0 de monofilamento no reabsorbible.
- Para utilizar la sonda ICP para inyecciones en la cisterna magna, retire el tubo de silicona e inserte un adaptador de punta en el tubo de polietileno.
- Si no se planea ninguna intervención, corte la sutura simple e interrumpida. Acorte la sonda ICP tanto como sea posible con una tijera y luego pegue el extremo para evitar fugas de líquido cefalorraquídeo (LCR). Cerrar la incisión con una sutura 4-0 de monofilamento no absorbible.
- Retire la rata del marco estereotáxico y colóquela en posición supina. Retire las suturas sueltas de la incisión de la cola.
- Coloque una sola sutura proximal y profunda al catéter arterial. Retire el catéter y ate la sutura para evitar el sangrado. Sutura la incisión de la cola con una sutura 4-0 monofilamento no absorbible.
- Apague el isoflurano.
- Limpie la rata y su pelaje tanto como sea posible.
- Cuando se recupere el reflejo de retirada del pedal y la rata tenga respiración espontánea cuando se desacopla del ventilador, extubarlo.
- Coloque a la rata en una sola jaula con comida y agua ad libitum. Coloque la mitad de la jaula debajo de una placa calefactora y coloque la rata en esta área de la jaula.
- Realice la administración intratecal adaptando el inyector pinport a una jeringa de precisión y administre el tratamiento a través del adaptador pinport. Esta intervención es factible en animales que están despiertos. Consulte la figura 5.
8. Extracción de la sonda ICP (si no se retira durante la cirugía)
NOTA: Use un microscopio quirúrgico a discreción del cirujano.
- Coloque la rata en la cámara de anestesia como se describió anteriormente.
- Cuando esté anestesiado, coloque a la rata en posición supina en el campo de operación con almohadilla térmica.
- Coloque la nariz en la máscara de anestesia. Establezca los niveles deO2 a 30%, aire atmosférico a 70% e isoflurano a 2%.
- Aplique continuamente el gel para los ojos para contrarrestar los ojos secos.
- Cortar la sutura interrumpida simple caudal. Abra la incisión y retire el posible tejido necrótico o coágulos de sangre.
- Acorte la sonda ICP tanto como sea posible con una tijera y pegue el extremo para evitar la fuga de líquido cefalorraquídeo (LCR). Cerrar la incisión con una sutura 4-0 de monofilamento no absorbible.
- Apague el isoflurano.
- Cuando la rata comience a moverse, colóquela en una sola jaula con comida y agua ad libitum. Coloque la mitad de la jaula sobre una placa calefactora y coloque la rata en esta área.
- Cuando vuelva al estado habitual, vuelva a introducir a los animales entre sí en una jaula conjunta bajo supervisión durante los primeros 15 minutos.
Resultados
Las mujeres tienen un mayor riesgo de aSAH en comparación con los hombres. A pesar de esto, los roedores machos se utilizan principalmente en experimentos debido al posible sesgo de la heterogeneidad del ciclo del estro en las hembras. Los resultados representativos presentados aquí provienen de una publicación reciente que compara ratas hembras y machos, lo que confirma que el modelo produce resultados similares en animales hembras en comparación con machos21. El estudio incluyó 34 ratas Sprague-Dawley hembras (18 SAH y 16 simuladas). Shams no tenía la aguja espinal descendida al quiasma óptico o sangre inyectada. Todos los demás procedimientos se realizaron en Shams idénticos a los HSA. Todos los parámetros fisiológicos entre los grupos fueron comparables. Por último, se realizó un metaanálisis de datos de experimentos previos en ratas macho y se comparó con los resultados del presente estudio21.
La prueba del polo giratorio es una prueba de la función sensoriomotora gruesa. El animal se coloca en un extremo de un poste de 150 cm por 45 mm, que puede girar hasta 10 rpm. El objetivo es llegar al extremo más alejado del poste donde se coloca una jaula. Las ratas con HSA empeoraron significativamente en los días 1 y 2, en comparación con los animales simulados en el polo giratorio (Figura 1).
Después de la HSA, tanto la familia de receptores ET-1 como la 5-HT están reguladas al alza en las arterias cerebrales, lo que resulta en una mayor contracción cuando se estimula y, por lo tanto, contribuye a la MVC22,23. La arteria basilar (BA) y las arterias cerebrales medias (ACM) se extirparon después de la decapitación y se utilizaron para experimentos con miógrafos. Tanto la endotelina 1 (ET-1), un agonista para la familia de receptores ET-1 como la 5-carboxamidotryptamine (5-CT), un agonista para la familia de receptores 5-HT, produjeron un aumento significativo de la contracción vascular en la HSA en comparación con la simulada (Figura 2). La sensibilidad se puede observar por las concentraciones más bajas necesarias para provocar la contracción después de la HSA en ambos sexos.
El aumento del contenido de agua (edema) después de la HSA es una medida del resultado funcional reducido en humanos24. Se encontró un aumento significativo del edema cerebral en la HSA en comparación con el simulacro en el día 2. También hubo tendencia al aumento del edema en el hipocampo, pero esto no fue estadísticamente significativo (p = 0,0508)21.
Al comparar los datos mencionados anteriormente con los datos históricos masculinos, los resultados son comparables. Los metadatos muestran un aumento de la contractilidad en los HSA masculinos después de la adición de ET-1 o 5-CT (Figura 2). Además, las ratas SAH se desempeñaron significativamente peor en comparación con las simuladas al realizar la prueba del poste giratorio. El resultado indicó una disminución de la función sensoriomotora (Figura 1).
La Figura 5A muestra la distribución de la sangre autóloga inyectada después de la perfusión salina 30 min después de la inducción de la HSA. La figura muestra que la sangre se ha distribuido en el espacio subaracnoideo después de la inyección prequiasmática.
La Figura 5B y la Figura 5C muestran la distribución de los colorantes inyectados por vía intratecal, seguidos de perfusión salina de cuerpo entero durante 30 minutos después de la inyección. La Figura 5B muestra la distribución de 25 μL de 20 mM de Azul Evans (soluble en agua) y la Figura 5C muestra la distribución de 25 μL de 10 mM de Aceite Rojo O (insoluble en agua). Se encontró que ambos colorantes estaban distribuidos en el espacio subaracnoideo después de la inyección en la cisterna magna, confirmando que este es un modelo factible de inyección intratecal de compuestos solubles e insolubles en agua. Vale la pena notar la formación de depósitos alrededor de las arterias para el compuesto insoluble en agua.

Figura 1: Análisis de la cognición sensorio-motora en los primeros 2 días después de la HSA en ratas macho y hembra. La prueba del poste giratorio se realizó el día 1 y el día 2 después de la HSA. Las ratas de ambos sexos tenían déficits significativos en comparación con las ratas operadas simuladas del mismo sexo. Las diferencias estadísticas en el comportamiento entre los grupos se probaron mediante ANOVA de 2 vías el día 0, el día 1 y el día 2. Hembra sin rotación y 3 rpm: p < 0,05. Hembra 10 rpm y todos los datos masculinos: p < 0.01. Los valores son medios ± SEM. Publicado con permiso de Spray, S. et al.21. Haga clic aquí para ver una versión más grande de esta figura.
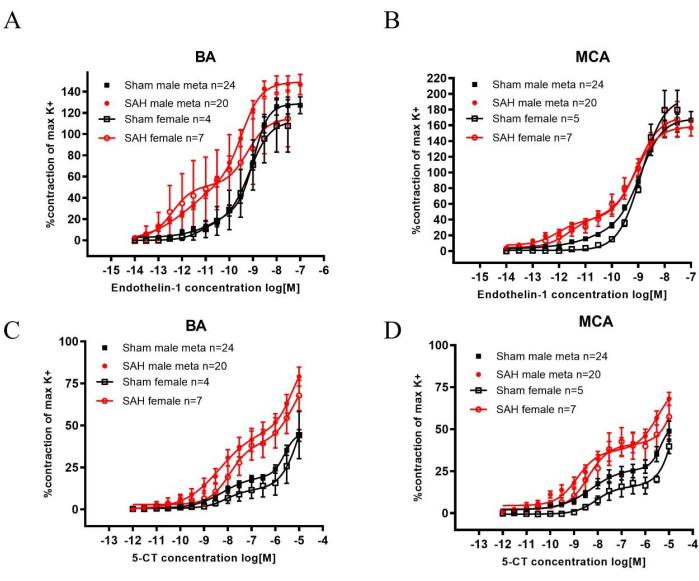
Figura 2: Análisis del aumento de la sensibilidad a las contracciones inducidas por ET-1 y 5-CT en la arteria basilar (BA) y la arteria cerebral media (ACM) 2 días después de la HSA en ratas macho y hembra. (A,B) Se utilizaron respuestas contráctiles evocadas por K+ (K+max) de 60 mM como valores de referencia para la normalización de las respuestas inducidas por agonistas. La sensibilidad a ET-1 aumentó significativamente 2 días después de la HSA en comparación con las ratas operadas simuladamente del mismo sexo tanto en el BA como en el MCA. (C,D) La sensibilidad a la 5-TC aumentó significativamente 2 días después de la HSA en comparación con las ratas operadas con simulacro del mismo sexo tanto en el BA como en el MCA. Las curvas de concentración-respuesta se compararon estadísticamente con el ANOVA bidireccional. Todos los datos: p < 0,001. Los valores son medios ± SEM. Publicado con permiso de Spray, S. et al.21. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Descripción general de la configuración antes de la inducción de la HSA. Desde la parte superior de la imagen, tenga en cuenta que 1) la aguja de inyección, 2) la sonda láser Doppler y 3) la sonda ICP están todas en su lugar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Traza de muestra después de la inyección intratecal. El gráfico rojo muestra la presión arterial en mmHg. El gráfico azul muestra el ICP en mmHg y el gráfico verde muestra el CBF en la unidad arbitraria FU. El aumento en la PIC es el resultado de la inyección de sangre. Tenga en cuenta que esto resulta en una caída en el CBF > el 50% de la línea de base durante más de 5 minutos. El aumento de la PIC además resulta en un pequeño aumento de la presión arterial que se normaliza en cuestión de segundos. Haga clic aquí para ver una versión más grande de esta figura.
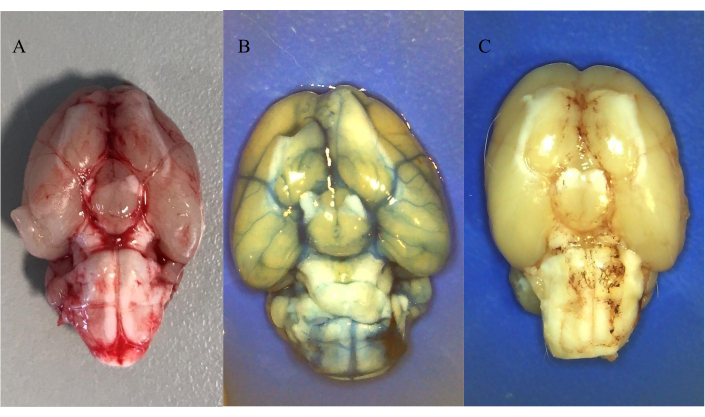
Figura 5: Distribución de sangre inyectada por vía intratecal y colorantes. (A) Distribución de sangre autóloga 30 min después de la inducción de la HSA. (B) Distribución de 25 μL de 20 mM Evans Blue después de la inyección intratecal a través de catéter PIC. (C) Distribución de 25 μL de 10 mM Oil Red O después de la inyección intratecal a través de catéter ICP. Todos los animales fueron anestesiados con una mezcla intraperitoneal de ketamina/xilazina seguida de perfusión salina. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El modelo de inyección única prequiasmática de la HSA imita varios elementos importantes de la HSA humana, incluido el aumento de la PIC, la reducción de la CBF, la isquemia global transitoria, la regulación positiva de los marcadores neuroinflamatorios y la MVC 14,15,16,18,19,20. La sonda ICP también se utilizó como puerto para la administración intratecal (Figura 5). Además, el estudio muestra que el modelo funciona de manera similar en animales machos y hembras21. El modelo no incluye el desarrollo y la posterior ruptura de un aneurisma. Una serie de modelos han intentado producir HAS a partir de un aneurisma roto por inducción de hipertensión sistémica quirúrgica o farmacológicamente y debilitando la pared arterial utilizando elastasa25,26,27. Todos los intentos han producido HSA por aneurisma en un subconjunto de animales, pero estos modelos tienen una variabilidad inherente que incluye la incapacidad de predecir cuándo se romperá el aneurisma. Los modelos no son muy adecuados para la investigación preclínica en la HAS18,28.
Entre otros modelos murinos, SAH, el modelo de perforación endovascular incluye la ruptura de un vaso, imitando un poco la ruptura de un aneurisma, pero propenso a una alta variabilidad y mortalidad. El modelo descrito aquí es mejor trazable y más reproducible, ya que el volumen de sangre está predeterminado y se puede controlar la presión de inyección. El modelo de doble inyección tiene una mayor probabilidad de producir CVS retardado, pero afecta principalmente a la circulación posterior e incluye una segunda inyección de sangre no fisiológica. En comparación, este modelo se asemeja a la HSA en humanos, ya que es una inyección única de la circulación anterior y produce un aumento reproducible de la PIC18.
La influencia de los diferentes regímenes de anestesia en la HSA experimental no está clara y los datos experimentales son contradictorios. Un estudio informó posible inhibición de citoquinas y neuroinflamación general en un modelo de perforación endovascular en ratones cuando se utilizaron inhalaciones de isoflurano29. Otro modelo de roedores resultó en parámetros respiratorios reducidos y aumento del edema cerebral junto con CBF regional reducido cuando se usaron isofluranos30. Sin embargo, un metaanálisis que comparó la mortalidad en modelos de ratón no mostró diferencias en la mortalidad entre el isoflurano y otros tipos de anestesia31. De acuerdo, el protocolo anterior ha utilizado con éxito la inhalación de isoflurano o una mezcla intraperitoneal de ketamina/xilazina con resultados similares en ambos grupos21.
Para garantizar una alta reproducibilidad y una adquisición adecuada de datos, el énfasis general está en los pasos relacionados con la colocación del equipo de monitoreo. La colocación correcta del catéter de cola facilita la monitorización continua de la presión arterial y la capacidad de realizar análisis de gases en sangre. La colocación adecuada del catéter de PIC garantiza la correcta monitorización de la PIC y la posterior posibilidad de intervención intratecal. La colocación adecuada de la sonda láser-Doppler asegura que la reducción de CBF pueda ser monitoreada, donde una reducción del 50% o menos de la puntuación basal durante al menos 5 minutos después de la inducción de HSA asegura una isquemia fuerte32. Al asegurarse de que todos los pasos de monitoreo estén en orden, el investigador puede asegurar la recopilación correcta de datos después de la inducción de la HSA.
El protocolo describe el modelo de inyección única prequiasmática de hemorragia subaracnoidea con actualizaciones y modificaciones. El modelo ha sido valioso para la investigación de la HSA y probablemente continuará contribuyendo a una mejor comprensión de la hemorragia subaracnoidea, incluida la lesión cerebral temprana y la isquemia cerebral tardía.
Divulgaciones
Los autores no tienen intereses contradictorios que declarar.
Agradecimientos
El trabajo fue apoyado por la Fundación Lundbeck y la Beca de Excelencia Lundbeck (no. R59-A5404). Los financiadores no tuvieron ningún papel en ninguna parte del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 16 G peripheral vein catheter | BD Venflon | 393229 | Needle shortened, distal 1 cm curved. Wings removed |
| Anesthesia bell/ chamber | Unknown | ||
| Blood gas analyzer | Radiometer | ABL80 | |
| Blood pressure (BP) monitor | Adinstruments | ML117 | Connects to Powerlab |
| Curved forceps, 12 cm x 3 | F.S.T | 11001-12 | For anesthesia |
| Cylindrical pillow, 28 cm x 4 cm | Homemade | Made from surgical towels | |
| Data acquisition hardware | Adinstruments | ML870 Powerlab | |
| Data acquistion software | Adinstruments | LabChart 6.0 | |
| Drill | KMD | 1189 | |
| Drill controller | Silfradent | 300 IN | |
| Flexible light | Schott | KL200 | |
| Heating pad | Minco | 1135 | |
| Hypodermic needle, 20 G | KD Medical | 301300 | Connects to stereotaxic frame |
| ICP monitor | Adinstruments | ML117 | Connects to Powerlab |
| Isoflurane vaporizer | Ohmeda | TEC3 | |
| Laptop | Lenovo | T410 | |
| Laser doppler monitor | Adinstruments | ML191 | |
| Laser doppler probe | Oxford Optronics | MSF100XP | Connects to laser doppler monitor |
| Needle holder, 13 cm | F.S.T | 12001-13 | For anesthesia |
| Precision syringe, 0.025 mL | Hamilton | 547407 | |
| Stereotaxic frame | Kopf Instruments | M900 | |
| Surgical microscope | Carl Zeiss | F170 | |
| Suture needle | Allgaier | 1245 | For anesthesia |
| Temperaure controller | CWE,INC. | TC-1000 | |
| Transducer x 2 | Adinstruments | MLT0699 | Connects to BP and ICP monitor |
| Ventilator | Ugo Basile | 7025 | |
| Veterinary clipper | Aesculap | GT421 | |
| 3-pronged Blair retractor, 13.5 cm | Agnthos | 17022--13 | |
| Blunt Alm retractor | F.S.T | 17008-07 | |
| Curved forceps, 12 cm x 2 | F.S.T | 11001-12 | |
| Needle holder, 13 cm | F.S.T | 12001-13 | |
| Straight Dumont forceps, 11 cm | F.S.T | 11252-00 | |
| Straight Halsted-Mosquito hemostat x 2 | F.S.T | 13008-12 | |
| Straight Iris scissor, 9 cm | F.S.T | 14090-09 | |
| Straight Vannas scissor, 10.5 cm | F.S.T | 15018-10 | |
| Absorpable swabs | Kettenbach | 31603 | |
| Black silk thread, 4-0, 5 x 15 cm | Vömel | 14757 | |
| Bone wax | Aesculap | 1029754 | |
| Carbomer eye gel 2 mg/g | Paranova | ||
| Cotton swab | Heinz Herenz | WA-1 | |
| Cotton tipped applicator x 4 | Selefa | 120788 | |
| Hypodermic needle, 23 G x2 | KD Medical | 900284 | Connects to stopcock. Remove distal end |
| Hypodermic needle, 23 G x3 | KD Medical | 900284 | Remove distal end. 2 connects to stopcock, 1 to syringe |
| ICP probe: | Homemade | Made of the following: | |
| Polythene tubing, 20 mm | Smiths medical | 800/100/200 | Inner diameter (ID): 0.58 mm, Outer diameter (OD): 0.96 mm. |
| Silicone tubing, 10 mm | Fisher | 15202710 | ID: 0.76 mm, OD: 2.4 mm. |
| Silicone tubing, 2 mm | Fisher | 11716513 | ID: 1.0 mm, OD: 3.0 mm. |
| Micro hematocrit tubes | Brand | 7493 11 | |
| OP-towel, 45 cm x75 cm | Mölnlycke | 800430 | |
| PinPort adapter, 22 G | Instech | PNP3F22 | |
| PinPort injector | Instech | PNP3M | |
| Polythene tubing, 2 x 20 cm | Smiths medical | 800/100/200 | Connects to syringe. ID: 0.58 mm, OD: 0.96 mm. |
| Rubberband | Unknown | ||
| Scalpel, 10 blade | Kiato | 23110 | |
| Spinalneedle, 25 G x 3.5'' | Braun | 5405905-01 | |
| Stopcock system, Discofix x 2 | Braun | 16494C | Connects to transducer |
| Suture, 4-0, monofil, non-resorbable x 3 | Ethicon | EH7145H | |
| Syringe, 1 mL | BD Plastipak | 1710023 | |
| Syringe, luer-lock, 10 mL x 4 | BD Plastipak | 305959 | Connects to transducer |
| Tissue adhesive glue | 3M | 1469SB | |
| 0.5% Chlorhexidine spirit | Faaborg Pharma | 210918 | |
| Carprofen 50 mg/mL | ScanVet | 43715 | Diluted 1:10 |
| Isoflurane | Baxter | ||
| Isotonic saline | Amgros | 16404 | |
| Lidocaine-Adrenaline 10 mg/5 µg/mL | Amgros | 16318 |
Referencias
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. Lancet. 369 (9558), London, England. 306-318 (2007).
- de Rooij, N. K., Linn, F. H. H., vander Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12), 1365-1372 (2007).
- Feigin, V. L., Lawes, C. M., Bennett, D. A., Barker-Collo, S. L., Parag, V. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review. The Lancet, Neurology. 8 (4), 355-369 (2009).
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of spontaneous subarachnoid hemorrhage: guidelines and gaps. Stroke. 51 (4), 1326-1332 (2020).
- Pickard, J. D., et al. Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial. British Medical Journal (Clinical Research ed.). 298 (6674), 636-642 (1989).
- Daou, B. J., Koduri, S., Thompson, B. G., Chaudhary, N., Pandey, A. S. Clinical and experimental aspects of aneurysmal subarachnoid hemorrhage. CNS Neuroscience and Therapeutics. 25 (10), 1096-1112 (2019).
- Fujii, M., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Translational Stroke Research. 4 (4), 432-446 (2013).
- Roos, Y. B., et al. Complications and outcome in patients with aneurysmal subarachnoid haemorrhage: A prospective hospital based cohort study in the Netherlands. Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3), 337-341 (2000).
- Vergouwen, M. D. I., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Brown, R. J., Kumar, A., Dhar, R., Sampson, T. R., Diringer, M. N. The relationship between delayed infarcts and angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery. 72 (5), 702-707 (2013).
- Dhar, R., et al. Relationship between angiographic vasospasm and regional hypoperfusion in aneurysmal subarachnoid hemorrhage. Stroke. 43 (7), 1788-1794 (2012).
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews. Neurology. 10 (1), 44-58 (2014).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. -A. A new experimental model in rats for study of the pathophysiology of subarachnoid hemorrhage. Neuroreport. 13 (18), 2553-2556 (2002).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52 (1), 165-176 (2003).
- Prunell, G. F., et al. Experimental Subarachnoid Hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54 (2), 426-437 (2004).
- Velthuis, B. K., et al. Subarachnoid hemorrhage: Aneurysm detection and preoperative evaluation with CT angiography. Radiology. 208 (2), 423-430 (1998).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71(2018).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Inflammation in the brain after experimental subarachnoid hemorrhage. Neurosurgery. 56 (5), 1082-1091 (2005).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain. Journal of Neurosurgery. 102 (6), 1046-1054 (2005).
- Spray, S., Haanes, K. A., Edvinsson, L., Johansson, S. E. Subacute phase of subarachnoid haemorrhage in female rats: increased intracranial pressure, vascular changes and impaired sensorimotor function. Microvascular Research. 135, 104127(2020).
- Ansar, S., Vikman, P., Nielsen, M., Edvinsson, L. Cerebrovascular ETB, 5-HT1B, and AT1 receptor upregulation correlates with reduction in regional CBF after subarachnoid hemorrhage. American Journal of Physiology - Heart and Circulatory Physiology. 293 (6), 3750-3758 (2007).
- Hansen-Schwartz, J., et al. Subarachnoid hemorrhage enhances endothelin receptor expression and function in rat cerebral arteries. Neurosurgery. 52 (5), 1188-1194 (2003).
- Hayman, E. G., Wessell, A., Gerzanich, V., Sheth, K. N., Simard, J. M. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage. Neurocritical Care. 26 (2), 301-310 (2017).
- Miyata, H., et al. Vasa vasorum formation is associated with rupture of intracranial aneurysms. Journal of Neurosurgery. , 1-11 (2019).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), Dallas, Tex. 1337-1344 (1979).
- Marbacher, S., Wanderer, S., Strange, F., Grüter, B. E., Fandino, J. Saccular aneurysm models featuring growth and rupture: A systematic review. Brain Sciences. 10 (2), 101(2020).
- Altay, O., et al. Isoflurane on brain inflammation. Neurobiology of Disease. 62, 365-371 (2014).
- Hockel, K., Trabold, R., Schöller, K., Török, E., Plesnila, N. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats. Experimental and Translational Stroke Medicine. 4 (1), 5(2012).
- Kamp, M. A., et al. A Systematic and meta-analysis of mortality in experimental mouse models analyzing delayed cerebral ischemia after subarachnoid hemorrhage. Translational Stroke Research. 8 (3), 206-219 (2017).
- Povlsen, G. K., Johansson, S. E., Larsen, C. C., Samraj, A. K., Edvinsson, L. Early events triggering delayed vasoconstrictor receptor upregulation and cerebral ischemia after subarachnoid hemorrhage. BMC Neuroscience. 14, 34(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados