Method Article
쥐 모델에서 실험적 지주막하 출혈을 유도하기 위한 자가 혈액의 Pre-chiasmatic, 단일 주사
요약
지주막하 출혈은 계속해서 사람의 사망률과 이환율에 대한 높은 부담을 안고 있습니다. 상태와 병태생리학에 대한 추가 연구를 용이하게 하기 위해 pre-chiasmatic, 단일 주입 모델이 제시됩니다.
초록
지난 수십 년 동안 치료의 발전에도 불구하고 지주막하 출혈(SAH)은 계속해서 높은 이환율과 사망률 부담을 안고 있으며 주로 상당히 젊은 인구를 괴롭히고 있습니다. SAH의 병태생리학적 메커니즘을 조사하고 약리학적 개입을 테스트하기 위해 SAH의 여러 동물 모델이 개발되었습니다. 이 기사에 제시된 쥐의 pre-chiasmatic, 단일 주사 모델은 미리 결정된 혈액량을 가진 SAH의 실험 모델입니다. 간단히 말해서, 동물은 마취되고, 삽관되고, 기계적 환기하에 보관됩니다. 온도는 가열 패드로 조절됩니다. 꼬리 동맥에 카테터를 삽입하여 지속적인 혈압 측정과 혈액 샘플링이 가능합니다. 대서양 후두막을 절개하고 압력 기록을 위한 카테터를 수조 마그나에 배치하여 뇌내 압력 측정이 가능합니다. 이 카테터는 척수강내 치료 중재에도 사용할 수 있습니다. 쥐를 정위 프레임에 넣고, 버 구멍을 브레그마 앞쪽으로 뚫고, 카테터를 버 구멍을 통해 삽입하고 시신경 바로 앞쪽에 배치합니다. 자가 혈액 (0.3 mL)을 꼬리 카테터에서 빼내어 수동으로 주입합니다. 이로 인해 뇌내압이 상승하고 뇌 혈류가 감소합니다. 동물을 30 분 동안 진정시키고 피하 식염수와 진통제를 투여합니다. 동물은 발관되어 새장으로 돌아갑니다. pre-chiasmatic 모델은 높은 재현성 및 미리 결정된 혈액량으로 인해 동물 간의 제한된 변동을 갖는다. 인간의 SAH를 모방하여 SAH 연구의 관련 모델입니다.
서문
비외상성 지주막하 출혈(SAH)은 뇌졸중의 한 형태로, 전체 사례의 약 5%를 차지합니다. 비외상성 SAH의 가장 흔한 원인은 SAH의 85%를 차지하는 동맥류(aSAH)의 갑작스러운 파열입니다. 다른 원인으로는 동동맥-정맥 기형의 파열, 응고병증, 뇌주위 출혈의 정맥 파열등이 있다 1. 발병률은 100,000인년당 9명이며 사망률은 약 3분의 1이고 또 다른 3분의 1은 SAH 2,3에 따라 일상 생활의 지원이 필요합니다.
초기 안정화 및 진단 확인 후 치료는 출혈의 중증도에 따라 다릅니다. 가장 심하게 고통받는 환자는 뇌내압(ICP)을 낮추기 위해 심실에 심실 외 배액관을 삽입하고 신경 집중 치료실에 입원하여 면밀히 모니터링합니다. 환자는 (가능한) 동맥류를 확인하기 위해 혈관 조영술을 받은 후 재발혈을 방지하기 위해 동맥류를 감거나 잘라냅니다4. 수많은 약물 요법 시도에도 불구하고, 칼슘 채널 길항제인 니모디핀만이 결과를 개선하는 것으로 나타났다5. 현재 여러 임상 시험이 진행 중입니다. 광범위한 목록은 Daou와 동료의 리뷰를 참조하십시오6.
동맥류의 파열은 지금까지 경험한 최악의 두통 또는 벼락 같은 두통의 갑작스러운 발병으로 설명되었습니다. 파열로 인해 ICP가 급격히 상승하고 대뇌 혈류(CBF)가 감소합니다. 이러한 감소는 뇌의 전반적인 허혈을 초래하여 의식 상실을 초래할 수 있습니다. 이 보다 기계적인 경로는 혈액의 유출된 요소의 시작적인 분해와 함께 사이토카인 방출과 선천성 면역 체계의 활성화를 일으켜 무균 신경염증을 유발합니다. 또한, 혈액 뇌 장벽의 파괴로 인해 뇌부종과 이온 항상성 장애가 종종 관찰됩니다. 초기 뇌 손상(early brain injury, EBI)이라고 불리는 이러한 모든 변화는 처음 며칠 이내에 발생하며 신경 세포 소실과 세포자멸사를 초래한다7.
aSAH를 앓고 있는 환자의 약 1/3은 4-14일 사이에 지연성 뇌허혈(DCI)이 발생합니다8. DCI는 발작 및 재출혈을 포함한 다른 원인을 제외할 때 국소적, 신경학적 장애의 데뷔 또는 최소 1시간 동안 지속되는 글래스고 혼수 척도에서 최소 2점 하락으로 정의됩니다. DCI는 aSAH9 이후 사망 위험 증가 및 기능적 결과 감소와 관련이 있습니다. 대뇌 동맥이 좁아지는 뇌 혈관 경련(CVS)은 수십 년 동안 DCI와 관련이 있는 것으로 알려져 왔으며 이전에는 DCI의 유일한 원인으로 여겨졌습니다. 이후 CVS는 DCI의 발달 없이 발생할 수 있으며 미세혈관 혈전증 및 수축, 피질 확산 억제 및 EBI의 염증 반응을 포함한 더 많은 요인이 확인되었습니다10,11,12.
EBI와 DCI가 질병의 경과와 고통받는 환자의 결과에 미치는 영향이 크기 때문에 동물 모델은 재현 가능하면서도 가능한 한 최대한 모방해야 합니다. 연구원들은 aSAH를 시도하고 시뮬레이션하기 위해 생쥐에서 인간이 아닌 영장류에 이르기까지 다양한 동물에서 다양한 모델을 사용했습니다. Sprague-Dawley 및 Wistar 야생형 쥐는 현재 가장 일반적으로 사용되는 실험실 동물이며, 가장 일반적인 모델은 혈관내 천공 모델, 수조-마그나 이중 주입 모델, 그리고 마지막으로 이 기사13에서 설명될 pre-chiasmatic 단일 주입 모델입니다.
pre-chiasmatic, single injection model은 원래 Prunell과 동료들에 의해 다른 실험 모델들의 단점들 중 일부를 상쇄하기 위해 개발되었다14. 수술을 숙달하면 재현성이 높고 동물 간의 변이를 최소화합니다. 이 모델은 혈액 주입 후 ICP의 급격한 상승을 포함하여 여러 지점에서 인간의 SAH를 모방하여 CBF15,16의 감소로 인한 일시적인 글로벌 허혈을 초래합니다. 이는 전방 순환에 영향을 미치는데, 전방 순환계는 인간의 aSAH가 가장 많이 발생하는 곳이다17. 사망률은 연구에 따라 10%-33%이며 주입된 혈액의 양은14,18입니다. 지연된 세포 사멸 및 신경 염증은 2일째 및 7일째에 검출될 수 있으며, 따라서 EBI 및 DCI19,20의 결과를 연구하기 위한 변수를 제공할 수 있습니다.
이 연구는 약학의 척수강내 투여를 위한 포트로 ICP-프로브를 활용하는 방법에 대한 설명과 함께 쥐의 pre-chiasmatic 단일 주사 모델에 대한 업데이트된 설명을 제공합니다.
프로토콜
이 절차는 과학적 목적으로 사용되는 동물 보호에 관한 유럽 연합의 지침 2010/63/EU에 따라 수행되며 덴마크 동물 실험 검사관(라이선스 번호 2016-15-0201-00940)의 승인을 받았습니다. 수술은 멸균 기구, 장갑, 카테터 및 봉합사를 포함하여 가능한 한 광범위한 무균 기술을 사용하여 수행됩니다. 이 연구는 체중이 230-350g인 수컷과 암컷 Sprague-Dawley 쥐를 사용했으며, 그룹은 22°C(± 2°C)의 일정한 온도와 55%(± 10%)의 일정한 온도로 12시간 명암주기로 사육되었습니다. 동물에게는 표준 차우와 물이 임의로 제공됩니다. 동물은 수술 후 단일 케이지에 수용되지만 ICP 프로브가 제거되면 그룹 케이지로 되돌릴 수 있습니다. 이 프로토콜에서 마취제는 이소플루란 가스이지만 케타민(100mg/mL)과 자일라진(20mg/mL)의 3:2 복강내 혼합물 1.5mL/kg도 효과가 있다21.
1. 준비
- 삽관을 위해 16G 말초 정맥 카테터를 수정합니다. 수정하려면 바늘을 1cm 줄이고 나머지 말단부를 주입 밸브 쪽으로 1cm 30° 구부립니다. 카테터 날개를 제거합니다(다중 사용).
- ICP 프로브를 만들려면 20mm 폴리에틸렌 튜브(내경(ID): 0.58mm, 외경(OD): 0.96mm)를 자르고 한쪽 끝을 태워 루멘을 열린 상태로 유지하면서 원형 플레이트를 만듭니다. 폴리에틸렌 튜브 끝에 1mm 실리콘 튜브(ID: 1.0mm, OD: 3.0mm)를 연결하기 전에 10mm의 실리콘 튜브(ID: 0.76mm, OD: 2.4mm)로 폴리에틸렌 튜브를 우회합니다.
- 노트북의 전원을 켜고 데이터 수집 소프트웨어를 엽니다. 제조업체의 지침에 따라 혈압(BP) 및 뇌압내(ICP) 변환기와 레이저 도플러를 보정합니다.
- 혈액 가스 분석기 장치를 준비합니다.
주의 : 기화기에 이소플루란이 충분한지 확인하십시오. - O2 및 대기 공기 흐름을 켭니다. O2 의 흐름을 30 %로, 대기 공기를 70 %로 설정하십시오.
- 가열 패드를 놓고 온도를 37°C로 설정합니다.
2. 마취
- O2 의 30 %와 대기의 70 %의 흐름으로 마취 챔버에 쥐를 놓습니다. 이소플루란 가스의 5%를 챔버에 투여합니다. 적절한 마취는 약 4분이 소요됩니다. 호흡을 조심스럽게 조절하십시오.
- 마취되면 고무 밴드로 둘러싸인 두꺼운 판 위에 쥐를 앙와위 자세로 놓습니다. 쥐의 앞니를 고무 밴드 아래에 놓습니다.
- 구부러진 집게로 혀를 조심스럽게 빼냅니다. 면봉으로 후두를 청소하십시오. 성대를 시각화하기 위해 목구멍의 정중선에 외부 조명을 배치합니다.
- 수정된 16G 말초 정맥 카테터를 사용하여 흡기하는 동안 삽관합니다. 올바르게 삽입되면 스틸레토를 제거합니다. 카테터를 인공 호흡기에 연결하십시오.
알림: 튜브의 올바른 배치는 호흡수와 동기화된 가슴 움직임으로 확인됩니다. 복부의 움직임이 보이면 쥐를 발관하고 마취 벨에 다시 넣으십시오. 기도가 손상 될 위험이 있으므로 절차를 세 번 이상 반복하지 마십시오. - 삽관시 30 %의 O2 와 70 %의 대기로 인공 호흡을하십시오. 이소플루란의 1.5%-3%에서 마취를 유지하십시오. 혈압을 80-100 mmHg 사이로 유지하도록 이소플루란을 조정하십시오.
- 호흡기의 흡기 부피를 3mL로 유지하고 빈도를 40-45회/분으로 유지하십시오. 혈액 가스 분석에 따라 흡기 부피를 조정하십시오.
- 2-0 봉합사로 뺨의 안쪽 연조직을 꿰매십시오. 주사 튜브와 말초 정맥 카테터의 주입 밸브 주위에 봉합사를 묶어 카테터를 고정합니다.
- 쥐를 수술장으로 옮기고 꼬리가 외과의를 향하도록 앙와위 자세로 놓습니다.
- 안구 건조증에 대응하기 위해 필요할 때 아이 젤을 바르십시오.
- 적절한 마취 깊이를 확인하기 위해 발가락 꼬집을 수행하십시오. 수술 중 마취 깊이를 평가하고 유지합니다.
3. 꼬리 카테터
- 꼬리의 근위 3-4cm를 0.5 %의 클로르헥시딘 에탄올로 소독하십시오.
알림: 이제부터는 외과 의사의 재량에 따라 수술용 현미경을 사용하십시오. - 복부 쪽 꼬리의 근위 끝에 15-20mm의 피부 절개를하십시오. 동맥을 절개하지 않도록 주의하십시오.
- 구부러진 집게를 사용하여 밑에있는 결합 조직에서 피부를 풉니 다.
- 동맥을 노출시키는 근막을 조심스럽게 관통하십시오.
- 구부러진 집게를 사용하여 밑에있는 조직에서 꼬리 동맥을 조심스럽게 분리하십시오.
- 세 개의 검은 실크 실을 배 아래에 밀어 넣습니다. 가능한 한 원위부에 하나의 실을 놓고 동맥 주위에 수술 매듭을 단단히 묶습니다. 지혈제로 실의 느슨한 끝을 잡으십시오.
- 나머지 두 개의 실을 동맥 주위에 느슨하게 묶습니다.
- 근위 나사산을 가능한 한 근위부로 밉니다. 근위 실의 끝을 잡기 위해 지혈제를 바르십시오. 지혈제를 가볍게 당기되 혈류를 제한하고 차단하기에 충분합니다. 복부에 지혈제를 놓습니다.
- 카테터 끝을 45° 각도로 자릅니다. 동맥벽 침투를 방지하기 위해 날카로운 부분을 자릅니다.
- Vannas 가위를 사용하여 동맥 직경의 1/3을 원위 매듭에서 30-3mm 각도로 3-5mm 각도로 절개합니다.
- 두 개의 직선 집게를 사용하여 카테터를 동맥에 삽입하십시오. 하나의 집게를 사용하여 카테터를 잡고 다른 집게를 사용하여 동맥을 카테터 위로 조심스럽게 당깁니다.
- 카테터를 혈관 위쪽 근위 매듭까지 삽입하고 지혈기에서 매듭을 풉니다. 카테터의 혈류를 시각화하십시오. 중간 나사산을 카테터에 느슨하게 고정하십시오.
- 동맥이 근막으로 다시 덮여있는 지점에 삽입을 계속하고 가능하면 바로 그 너머에 삽입하십시오.
- 식염수로 세척하여 카테터 배치와 누출 가능성을 제어하십시오.
- 외과용 매듭을 사용하여 두 개의 근위 나사산을 고정합니다.
알림: 혈압 측정은 박동성이어야 합니다. 그렇지 않으면 카테터가 제대로 배치되지 않은 것입니다. - 원위 실을 사용하여 수술 매듭을 묶어 절개 끝에 카테터를 고정합니다.
- 두 개의 비흡수성 모노필라멘트 4-0 봉합사로 피부 절개 부위를 느슨하게 꿰매십시오. 카테터를 관통하지 않도록 주의하십시오.
알림: 수술 내내 맥동의 진폭을 알고 있어야 합니다. 이 값이 낮 으면 식염수로 카테터를 씻어 내십시오. - 혈액 가스 샘플링을 위한 혈류를 허용하기 위해 압력 변환기에서 동맥 카테터를 풉니다. 카테터 끝에 마이크로 모세관을 놓습니다. 혈액이 튜브로 흐르게하십시오. 채혈 후 카테터를 변환기에 다시 부착하고 카테터를 세척합니다.
- 혈액 가스 분석기에 모세관을 삽입합니다. pH, pCO2 및 pO2를 측정하고 기록해 둡니다.
알림: 혈액 가스 및 혈압 값에 따라 환기율을 변경하십시오. 평균 동맥압(MAP)이 너무 낮으면 이소플루란의 유속을 낮추십시오. 적절한 마취 깊이를 보장하기 위해 반사 신경을 테스트하십시오.
4. ICP 프로브
- 쥐를 입체 프레임에 넣으십시오. 쥐를 대칭으로 배치하는 것이 중요합니다.
- 입체 프레임 아래에 원통형 베개를 놓아 목의 전방 굴곡을 만듭니다.
- 쥐의 두피, 목, 귀 뒤를 면도합니다. 불필요한 머리카락을 제거하십시오.
- 0.5 %의 클로르헥시딘 에탄올로 해당 부위를 소독하십시오.
- 아드레날린이 함유된 10mg/5μg/mL 리도카인 0.7mL로 국소 마취하고 정중선의 두개골 꼬리 끝에 바늘을 삽입합니다. 목의 근육 조직에 0.3-0.4 mL를 주입하십시오. 나머지는 브레그마 주변과 앞쪽에 피하 주사합니다.
- 바늘 구멍에서 정중선의 꼬리 방향으로 ~8mm 피부 절개를 합니다.
- 모든 근육을 층으로 뭉툭하게 해부하여 atlantooccipital membrane (정중선의 두개골에 꼬리 모양으로 대리석 색 삼각형)을 식별합니다.
- Alm 견인기를 사용하여 목 근육 조직을 억제하십시오. 필요한 경우 갈래 견인기를 꼬리 모양으로 놓습니다.
- 멸균 ICP 프로브가 ICP 변환기에 연결되어 있는지 확인하십시오. ICP 프로브를 식염수로 세척합니다. ICP 프로브에 기포가 없는지 확인합니다.
- 23G 바늘을 사용하여 대서양 후두막을 절개합니다. 멤브레인을 통해 ICP 프로브를 감축하기 위해 구멍을 뚫습니다.
- 탐침이 대서양 후두막을 통해 부드럽게 감축됩니다. 프로브를 가볍게 당기고 0-5mmHg 범위의 맥동 곡선이 나타나는지 확인합니다. 그렇지 않은 경우 프로브를 제거하고 변환기에 대한 연결을 확인한 다음 루멘을 통한 흐름을 확인하십시오.
- 티슈 접착제 두 방울을 바릅니다. 1mm 실리콘 튜브를 멤브레인 쪽으로 이동하고 추가 접착제를 도포하여 ICP 프로브 변위 위험을 최소화합니다.
- 견인기를 제거합니다.
- 비흡수성 모노필라멘트 4-0 봉합사를 사용하여 절개 부위의 두부 끝에 수평 매트리스 봉합사 1개를 만들고 꼬리 끝 부분에 단순 중단 봉합사 1개를 만듭니다.
5. 바늘과 레이저 도플러 프로브의 배치
- 눈 바로 앞쪽의 정중선을 꼬리 방향으로 15mm 절개합니다.
- 집게로 결합 조직과 근육을 제거하십시오. 멸균 면봉의 끝을 루진으로 사용하여 브레그마와 관상 봉합사를 식별할 수 있습니다.
- Alm 견인기를 놓습니다.
- 25G 척추 바늘을 정위 프레임에 놓습니다. 바늘을 브레그마에 정확히 놓고 위치를 기록하십시오.
알림: 정위 프레임의 정중선 조인트를 수직면의 동물을 향해 30°로 놓습니다. - 브레그마에서 바늘을 제거하고 프레임을 65mm 전방으로 이동 한 다음 정중선의 바늘을 교체하여 드릴링 부위를 표시하십시오.
- 경질막이 뼈 아래에서 확인될 때까지 드릴합니다. 직선 집게를 사용하여 뼈 조각을 부드럽게 제거하고 뼈 왁스로 구멍을 채 웁니다.
- 브레그마 오른쪽 측면으로 3-4mm, 레이저 도플러용 관상 봉합사 바로 앞쪽에 또 다른 구멍을 뚫습니다. 뼈를 완전히 뚫을 필요는 없습니다. 경막을 관통하지 않도록 주의하십시오.
- 레이저 도플러가 혈류를 측정할 수 있는 혈관을 찾으십시오. 레이저 도플러를 놓고 값을 확인합니다. 최소 100FU가 필요합니다. 현미경 (인공 조명)을 제거하십시오.
- 값이 여전히 허용되는 경우 접착제 한 방울을 추가하여 프로브를 고정합니다.
- 값이 80FU 이상인지 다시 확인하십시오. 값이 80FU 미만인 경우 프로브를 제거하고 위치를 변경하여 80FU 이상의 값에 도달합니다.
참고: FU 값은 뇌혈류(CBF)를 나타내는 임의의 단위입니다.
6. SAH의 유도
- 두개골 기저부의 저항이 느껴질 때까지 반구 사이의 정중선에 있는 두개골을 통해 바늘을 부드럽게 삽입합니다. 바늘을 1mm 후퇴시켜 시신경 바로 앞쪽에 올바른 위치를 보장합니다.
- 바늘 끝이 오른쪽을 가리키도록 바늘을 시계 방향으로 90° 돌려 혈액을 주입할 때 가장 균일한 결과를 얻으십시오. 단검을 분리합니다(그림 3).
- 15 분 동안 평형을 유지하고 마취 수준을 조정하여 80-100 mmHg 범위의 평균 동맥 혈압을 얻습니다.
- 혈액 가스 분석을 수행합니다. 그에 따라 마취 수준을 조정하십시오.
- 뭉툭한 23G 바늘이 있는 1mL 주사기를 사용하여 꼬리 카테터에서 500μL의 혈액을 채취합니다.
- 공기의 주입을 피하기 위하여 혈액으로 척추 바늘 약실의 죽은 공간을 채우십시오. 혈액이 채워진 주사기에서 23G 바늘을 제거하고 주사기에 300μL의 혈액이 들어 있는지 확인합니다.
- 주사기를 척추 바늘에 연결하십시오. 단단히 잡고 수동으로 혈액을 주입하여 MAP를 능가합니다.
- 노트북에서 ICP의 급격한 상승과 CBF의 급격한 하락을 관찰합니다.
참고: 수술이 성공하려면 최소 5분 동안 CBF가 기준선 점수와 비교하여 50% 이낮아야 합니다( 그림 4 참조). 가짜 쥐는 6.1-6.7 단계를 거치지 않으므로 척추 바늘이 대뇌에 도입되는 것을 생략하고 자연 출혈 및 의원 성 뇌 손상을 최소화합니다.
7. 회복과 각성
- 동물용 중량 0.1mL/100g, 카프로펜 5.0mg/mL, 동물중량 1mL/100g의 등장성 식염수를 피하 투여한다. 투여하기 전에 액체가 최소한 실온에 있는지 확인하십시오.
- 그 후, SAH 후 30분 동안 쥐를 마취 상태로 유지합니다.
- 바늘, 레이저 도플러 프로브를 제거한 다음 뼈 왁스로 충치를 채 웁니다. 비흡수성 모노필라멘트 4-0 봉합사가 있는 두 개의 수평 매트리스 봉합사를 사용하여 절개를 닫습니다.
- 수조에 주입하기 위해 ICP 프로브를 사용하려면 실리콘 튜브를 제거하고 폴리에틸렌 튜브에 핀 포인트 어댑터를 삽입합니다.
- 개입이 계획되지 않은 경우 단순하고 중단 된 봉합사를 자릅니다. ICP 프로브는 가위로 최대한 짧게 한 후 뇌척수액(CSF)의 누출을 방지하기 위해 끝을 붙입니다. 비 흡수성 모노 필라멘트 4-0 봉합사로 절개 부위를 봉합하십시오.
- 입체 프레임에서 쥐를 제거하고 앙와위 자세로 놓습니다. 꼬리 절개 부위에서 느슨한 봉합사를 제거합니다.
- 동맥 카테터에 근위부와 깊숙이 단일 봉합사를 놓습니다. 출혈을 방지하기 위해 카테터를 제거하고 봉합사를 묶습니다. 비 흡수성 모노 필라멘트 4-0 봉합사로 꼬리 절개 부위를 봉합하십시오.
- 이소플루란을 끕니다.
- 쥐와 털을 가능한 한 많이 청소하십시오.
- 페달 금단 반사가 회복되고 쥐가 인공호흡기에서 분리될 때 자발 호흡을 하면 발관합니다.
- 쥐를 음식과 물이 있는 단일 케이지에 자유롭게 놓습니다. 케이지의 절반을 가열판 아래에 놓고 케이지의이 영역에 쥐를 놓습니다.
- 핀포트 인젝터를 정밀 주사기에 적용하여 척수강내 투여를 수행하고 핀포트 어댑터를 통해 치료를 시행합니다. 이 개입은 깨어있는 동물에서 가능합니다. 그림 5를 참조하십시오.
8. ICP-프로브 제거(수술 중 제거하지 않은 경우)
알림: 외과 의사의 재량에 따라 수술용 현미경을 사용하십시오.
- 앞에서 설명한대로 쥐를 마취실에 놓습니다.
- 마취되면 가열 패드로 수술장에서 쥐를 앙와위 자세로 놓습니다.
- 마취 마스크에 코를 놓습니다. O 2 수준을 30 %, 대기 수준을 70 %, 이소 플루 란 수준을2 %로 설정하십시오.
- 안구건조증에 대응하기 위해 아이젤을 지속적으로 바르십시오.
- 꼬리 단순 중단 봉합사를 자르십시오. 절개 부위를 열고 괴사 가능한 조직이나 혈전을 제거하십시오.
- ICP 프로브는 가위로 최대한 짧게 하고 끝을 붙여서 뇌척수액(CSF)의 누출을 방지한다. 비 흡수성 모노 필라멘트 4-0 봉합사로 절개 부위를 봉합하십시오.
- 이소플루란을 끕니다.
- 쥐가 움직이기 시작하면 음식과 물이 있는 단일 케이지에 넣습니다. 케이지의 절반을 가열판 위에 놓고 쥐를 이 부위에 놓습니다.
- 습관 상태로 돌아 오면 처음 15 분 동안 감독하에 공동 케이지에서 동물을 서로 다시 소개하십시오.
결과
여성은 남성에 비해 aSAH의 위험이 증가합니다. 그럼에도 불구하고, 수컷 설치류는 암컷에서 발정주기의 이질성으로 인한 편견 때문에 주로 실험에 사용됩니다. 여기에 제시된 대표적인 결과는 암컷과 수컷 쥐를 비교한 최근 간행물에서 나온 것으로, 이 모델이 수컷21마리에 비해 암컷 동물에서 유사한 결과를 산출한다는 것을 확인시켜줍니다. 이 연구에는 34마리의 암컷 Sprague-Dawley 쥐(SAH 18마리와 샴 16마리)가 포함되었습니다. Shams는 척추 바늘을 시신경으로 내려 가거나 혈액을 주입하지 않았습니다. 다른 모든 절차는 SAH와 동일한 Shams에서 수행되었습니다. 그룹 간의 모든 생리적 매개 변수는 비슷했습니다. 마지막으로, 수컷 랫트에 대한 이전 실험의 데이터를 메타 분석하여 본 연구의 결과와 비교하였다21.
회전 극 테스트는 총 감각 운동 기능 테스트입니다. 동물은 최대 10rpm까지 회전 할 수있는 150cm x 45mm 기둥의 한쪽 끝에 놓습니다. 목표는 케이지가 놓인 기둥의 맨 끝에 도달하는 것입니다. SAH 쥐는 회전 기둥에 있는 가짜 동물에 비해 1일차와 2일차에 유의하게 더 나빴습니다(그림 1).
SAH 후, ET-1 및 5-HT 수용체 패밀리는 모두 대뇌 동맥에서 상향 조절되어 자극을 받으면 수축이 증가하여 CVS22,23에 기여합니다. 기저 동맥(BA)과 중대뇌 동맥(MCA)은 참수 후 제거되어 근사진 실험에 사용되었습니다. ET-1 수용체 패밀리의 작용제인 엔도텔린 1(ET-1)과 5-HT 수용체 패밀리의 작용제인 5-카르복스아미도트립타민(5-CT)은 모두 가짜에 비해 SAH에서 혈관 수축을 유의하게 증가시켰습니다(그림 2). 민감도는 남녀 모두에서 SAH 후 수축을 유도하는 데 필요한 더 낮은 농도로 관찰할 수 있습니다.
SAH에 따른 수분 함량 증가(부종)는 인간의 기능적 결과 감소를 나타내는 척도이다24. 2일째에 가짜에 비해 SAH에서 유의하게 증가된 뇌부종이 발견되었습니다. 또한 해마의 부종이 증가하는 경향이 있었지만 통계적으로 유의하지 않았습니다(p = 0.0508)21.
위에서 언급한 데이터를 과거 남성 데이터와 비교할 때 결과는 비슷합니다. 메타데이터는 ET-1 또는 5-CT를 추가한 후 남성 SAH의 수축성 증가를 보여줍니다(그림 2). 또한, SAH 쥐는 회전 극 테스트를 수행할 때 가짜에 비해 훨씬 더 나쁜 성능을 보였습니다. 결과는 감각 운동 기능이 감소한 것으로 나타났습니다(그림 1).
도 5A 는 SAH의 유도 후 30분 후에 식염수 관류 후 자가 주입된 혈액의 분포를 나타낸다. 그림은 혈액이 pre-chiasmatic 주사 후 지주막하 공간에 분포되었음을 보여줍니다.
도 5B 및 도 5C는 주사 후 30분 동안 전신 식염수 관류에 이어 경막내 주입된 염료의 분포를 나타낸다. 도 5B는 20 mM 에반스 블루 (수용성)의 25 μL의 분포를 나타내고 도 5C는 10 mM 오일 레드 O (수용성)의 25 μL의 분포를 나타낸다. 두 염료 모두 수조 마그나에 주입한 후 지주막하 공간에 분포하는 것으로 밝혀졌으며, 이는 수용성 및 불용성 화합물 모두의 척수강내 주입의 실현 가능한 모델임을 확인했습니다. 주목할 가치가있는 것은 수 불용성 화합물에 대한 동맥 주위에 침전물이 형성된다는 것입니다.

그림 1: 수컷과 암컷 쥐의 SAH 후 처음 2일 동안의 감각-운동 인지 분석. 회전 극 테스트는 SAH 후 1일과 2일에 수행되었습니다. 두 성별의 쥐는 같은 성별의 가짜 수술 쥐에 비해 상당한 적자를 보였습니다. 그룹 간 행동의 통계적 차이는 0일, 1일 및 2일에 2-way ANOVA에 의해 테스트되었습니다. 암회전 및 3 rpm: p < 0.05. 암컷 10 rpm 및 모든 수컷 데이터: p < 0.01. 값은 SEM± 평균입니다. Spray, S. et al.21의 허가를 받아 재출판되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
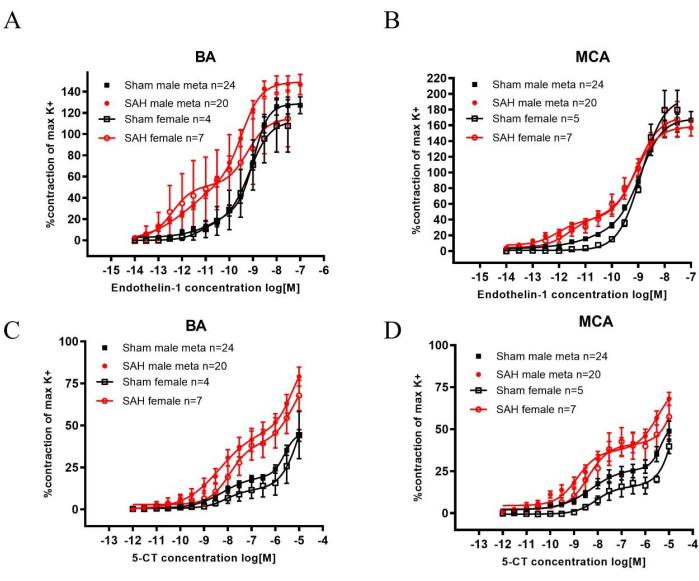
그림 2: 수컷 및 암컷 쥐의 SAH 2일 후 기저 동맥(BA) 및 중대뇌 동맥(MCA)에서 ET-1 및 5-CT 유도 수축에 대한 민감도 증가 분석. (A,B) 60mM K+-유발(K+max) 수축 반응은 작용제 유도 반응의 정상화를 위한 기준값으로 사용되었습니다. ET-1에 대한 민감도는 BA 및 MCA 모두에서 동일한 성별의 가짜 수술 쥐에 비해 SAH 후 2일에 유의하게 증가했습니다. (씨, 디) 5-CT에 대한 민감도는 BA와 MCA 모두에서 동일한 성별의 가짜 수술 쥐에 비해 SAH 후 2일에 유의하게 증가했습니다. 농도-반응 곡선은 통계적으로 양방향 ANOVA와 비교되었습니다. 모든 데이터: p < 0.001. 값은 SEM± 평균입니다. Spray, S. et al.21의 허가를 받아 재출판되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: SAH 유도 전 설정 개요. 그림 상단에서 1) 주사 바늘, 2) 레이저 도플러 프로브 및 3) ICP 프로브가 모두 제자리에 있음을 알 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 척수강내 주입 후 샘플 추적. 빨간색 그래프는 혈압(mmHg)을 나타냅니다. 파란색 그래프는 mmHg 단위의 ICP를 나타내고 녹색 그래프는 임의 단위 FU의 CBF를 나타냅니다. ICP의 급증은 혈액 주사의 결과입니다. 이로 인해 CBF가 5분 이상 기준선의 50%> 감소합니다. ICP 상승은 또한 몇 초 내에 정상화되는 약간의 혈압 상승을 초래합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
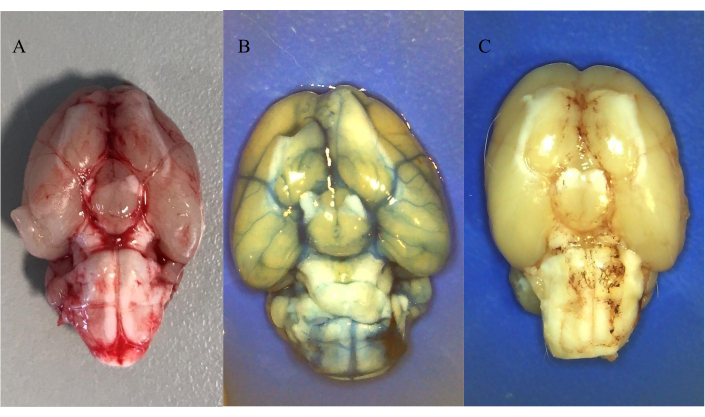
그림 5: 척수강내 주입된 혈액 및 유색 염료의 분포. (A) SAH 유도 후 30분 동안의 자가 혈액 분포. (B) ICP-카테터를 통한 척수강내 주사 후 20mM Evans Blue 25μL 분포. (C) ICP-카테터를 통한 척수강내 주사 후 10mM Oil Red O 25μL 분포. 모든 동물을 복강내 케타민/자일라진 혼합물로 마취시킨 후 식염수 관류로 마취시켰다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
SAH의 전-chiasmatic 단일 주사 모델은 ICP의 스파이크, CBF의 감소, 일시적인 글로벌 허혈, 신경 염증 마커의 상향 조절 및 CVS 14,15,16,18,19,20을 포함하여 인간 SAH의 몇 가지 중요한 요소를 모방합니다. ICP-프로브는 척수강내 투여를 위한 포트로도 사용되었습니다(그림 5). 또한, 이 연구는 이 모델이 수컷과 암컷 동물에서 유사하게 수행된다는 것을 보여준다21. 이 모델에는 동맥류의 발달 및 후속 파열이 포함되지 않습니다. 다양한 모델이 외과적 또는 약리학적으로 전신성 고혈압을 유도하고 엘라스타제25,26,27을 사용하여 동맥벽을 약화시켜 파열된 동맥류로부터 SAH를 생성하려고 시도했습니다. 모든 시도는 동물의 하위 집합에서 동맥류 SAH를 생성했지만 이러한 모델은 동맥류가 언제 파열될지 예측할 수 없는 것을 포함하여 고유한 가변성을 가지고 있습니다. 이 모델은 SAH18,28에 대한 전임상 연구에 적합하지 않습니다.
다른 쥐, SAH 모델 중에서 혈관 내 천공 모델에는 동맥류의 파열을 다소 모방하지만 높은 변동성과 사망률이 발생하기 쉬운 혈관 파열이 포함됩니다. 여기에 설명된 모델은 혈액량이 미리 결정되고 주입 압력을 제어할 수 있기 때문에 더 잘 추적 가능하고 재현 가능합니다. 이중 주사 모델은 지연된 CVS를 생성할 확률이 더 높지만 주로 후방 순환에 영향을 미치며 비생리학적 2차 혈액 주입을 포함합니다. 이에 비해 이 모델은 전방 순환계의 단일 주입이고 재현 가능한 ICP 상승을 생성하기 때문에 인간의 SAH와 유사합니다18.
실험적 SAH에 대한 다양한 마취 요법의 영향은 불분명하고 실험 데이터는 모순됩니다. 한 연구에서는 이소플루란 흡입을 사용할 때 생쥐의 혈관내 천공 모델에서 사이토카인과 일반적인 신경염증이 억제될 수 있다고 보고했다29. 또 다른 설치류 모델은 이소플루란을 사용할 때 호흡기 매개변수가 감소하고 뇌부종이 증가했으며 국소 CBF가 감소했습니다30. 그러나, 마우스 모델의 사망률을 비교한 메타 분석에서는 이소플루란과 다른 유형의 마취 사이에 사망률에 차이가 없는 것으로 나타났다31. 이에 따라, 상기 프로토콜은 이소플루란 흡입 또는 복강내 케타민/자일라진 혼합물을 성공적으로 사용하였으며, 두 그룹 모두에서 유사한 결과를 보였다21.
높은 재현성과 적절한 데이터 수집을 보장하기 위해 모니터링 장비 배치와 관련된 단계가 전반적으로 강조됩니다. 꼬리 카테터를 올바르게 배치하면 혈압을 지속적으로 모니터링하고 혈액 가스 분석을 수행할 수 있습니다. ICP 카테터의 적절한 배치는 올바른 ICP 모니터링과 그에 따른 척수강내 개입 가능성을 보장합니다. 레이저-도플러 프로브의 적절한 배치는 CBF의 감소가 모니터링될 수 있도록 보장하며, 여기서 SAH 유도 후 적어도 5분 동안 기준선 점수의 50% 이하의 감소는 강한 허혈을 보장한다32. 모든 모니터링 단계가 순서대로 진행되고 있는지 확인함으로써 연구원은 SAH 유도 후 올바른 데이터 수집을 확보할 수 있습니다.
이 프로토콜은 업데이트 및 수정이 포함된 지주막하 출혈의 pre-chiasmatic 단일 주사 모델을 설명합니다. 이 모델은 SAH 연구에 가치가 있었으며 초기 뇌 손상 및 지연된 뇌 허혈을 포함한 지주막하 출혈에 대한 더 나은 이해에 계속 기여할 것입니다.
공개
저자는 선언 할 상충되는 이해 관계가 없습니다.
감사의 말
이 작업은 룬드벡 재단(Lundbeck Foundation)과 룬드벡 우수 그랜트(Lundbeck Grant of Excellence, 번호 R59-A5404)의 지원을 받았습니다. 자금 제공자는 원고의 어떤 부분에서도 아무런 역할도 하지 않았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 16 G peripheral vein catheter | BD Venflon | 393229 | Needle shortened, distal 1 cm curved. Wings removed |
| Anesthesia bell/ chamber | Unknown | ||
| Blood gas analyzer | Radiometer | ABL80 | |
| Blood pressure (BP) monitor | Adinstruments | ML117 | Connects to Powerlab |
| Curved forceps, 12 cm x 3 | F.S.T | 11001-12 | For anesthesia |
| Cylindrical pillow, 28 cm x 4 cm | Homemade | Made from surgical towels | |
| Data acquisition hardware | Adinstruments | ML870 Powerlab | |
| Data acquistion software | Adinstruments | LabChart 6.0 | |
| Drill | KMD | 1189 | |
| Drill controller | Silfradent | 300 IN | |
| Flexible light | Schott | KL200 | |
| Heating pad | Minco | 1135 | |
| Hypodermic needle, 20 G | KD Medical | 301300 | Connects to stereotaxic frame |
| ICP monitor | Adinstruments | ML117 | Connects to Powerlab |
| Isoflurane vaporizer | Ohmeda | TEC3 | |
| Laptop | Lenovo | T410 | |
| Laser doppler monitor | Adinstruments | ML191 | |
| Laser doppler probe | Oxford Optronics | MSF100XP | Connects to laser doppler monitor |
| Needle holder, 13 cm | F.S.T | 12001-13 | For anesthesia |
| Precision syringe, 0.025 mL | Hamilton | 547407 | |
| Stereotaxic frame | Kopf Instruments | M900 | |
| Surgical microscope | Carl Zeiss | F170 | |
| Suture needle | Allgaier | 1245 | For anesthesia |
| Temperaure controller | CWE,INC. | TC-1000 | |
| Transducer x 2 | Adinstruments | MLT0699 | Connects to BP and ICP monitor |
| Ventilator | Ugo Basile | 7025 | |
| Veterinary clipper | Aesculap | GT421 | |
| 3-pronged Blair retractor, 13.5 cm | Agnthos | 17022--13 | |
| Blunt Alm retractor | F.S.T | 17008-07 | |
| Curved forceps, 12 cm x 2 | F.S.T | 11001-12 | |
| Needle holder, 13 cm | F.S.T | 12001-13 | |
| Straight Dumont forceps, 11 cm | F.S.T | 11252-00 | |
| Straight Halsted-Mosquito hemostat x 2 | F.S.T | 13008-12 | |
| Straight Iris scissor, 9 cm | F.S.T | 14090-09 | |
| Straight Vannas scissor, 10.5 cm | F.S.T | 15018-10 | |
| Absorpable swabs | Kettenbach | 31603 | |
| Black silk thread, 4-0, 5 x 15 cm | Vömel | 14757 | |
| Bone wax | Aesculap | 1029754 | |
| Carbomer eye gel 2 mg/g | Paranova | ||
| Cotton swab | Heinz Herenz | WA-1 | |
| Cotton tipped applicator x 4 | Selefa | 120788 | |
| Hypodermic needle, 23 G x2 | KD Medical | 900284 | Connects to stopcock. Remove distal end |
| Hypodermic needle, 23 G x3 | KD Medical | 900284 | Remove distal end. 2 connects to stopcock, 1 to syringe |
| ICP probe: | Homemade | Made of the following: | |
| Polythene tubing, 20 mm | Smiths medical | 800/100/200 | Inner diameter (ID): 0.58 mm, Outer diameter (OD): 0.96 mm. |
| Silicone tubing, 10 mm | Fisher | 15202710 | ID: 0.76 mm, OD: 2.4 mm. |
| Silicone tubing, 2 mm | Fisher | 11716513 | ID: 1.0 mm, OD: 3.0 mm. |
| Micro hematocrit tubes | Brand | 7493 11 | |
| OP-towel, 45 cm x75 cm | Mölnlycke | 800430 | |
| PinPort adapter, 22 G | Instech | PNP3F22 | |
| PinPort injector | Instech | PNP3M | |
| Polythene tubing, 2 x 20 cm | Smiths medical | 800/100/200 | Connects to syringe. ID: 0.58 mm, OD: 0.96 mm. |
| Rubberband | Unknown | ||
| Scalpel, 10 blade | Kiato | 23110 | |
| Spinalneedle, 25 G x 3.5'' | Braun | 5405905-01 | |
| Stopcock system, Discofix x 2 | Braun | 16494C | Connects to transducer |
| Suture, 4-0, monofil, non-resorbable x 3 | Ethicon | EH7145H | |
| Syringe, 1 mL | BD Plastipak | 1710023 | |
| Syringe, luer-lock, 10 mL x 4 | BD Plastipak | 305959 | Connects to transducer |
| Tissue adhesive glue | 3M | 1469SB | |
| 0.5% Chlorhexidine spirit | Faaborg Pharma | 210918 | |
| Carprofen 50 mg/mL | ScanVet | 43715 | Diluted 1:10 |
| Isoflurane | Baxter | ||
| Isotonic saline | Amgros | 16404 | |
| Lidocaine-Adrenaline 10 mg/5 µg/mL | Amgros | 16318 |
참고문헌
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. Lancet. 369 (9558), London, England. 306-318 (2007).
- de Rooij, N. K., Linn, F. H. H., vander Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12), 1365-1372 (2007).
- Feigin, V. L., Lawes, C. M., Bennett, D. A., Barker-Collo, S. L., Parag, V. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review. The Lancet, Neurology. 8 (4), 355-369 (2009).
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of spontaneous subarachnoid hemorrhage: guidelines and gaps. Stroke. 51 (4), 1326-1332 (2020).
- Pickard, J. D., et al. Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial. British Medical Journal (Clinical Research ed.). 298 (6674), 636-642 (1989).
- Daou, B. J., Koduri, S., Thompson, B. G., Chaudhary, N., Pandey, A. S. Clinical and experimental aspects of aneurysmal subarachnoid hemorrhage. CNS Neuroscience and Therapeutics. 25 (10), 1096-1112 (2019).
- Fujii, M., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Translational Stroke Research. 4 (4), 432-446 (2013).
- Roos, Y. B., et al. Complications and outcome in patients with aneurysmal subarachnoid haemorrhage: A prospective hospital based cohort study in the Netherlands. Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3), 337-341 (2000).
- Vergouwen, M. D. I., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Brown, R. J., Kumar, A., Dhar, R., Sampson, T. R., Diringer, M. N. The relationship between delayed infarcts and angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery. 72 (5), 702-707 (2013).
- Dhar, R., et al. Relationship between angiographic vasospasm and regional hypoperfusion in aneurysmal subarachnoid hemorrhage. Stroke. 43 (7), 1788-1794 (2012).
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews. Neurology. 10 (1), 44-58 (2014).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. -A. A new experimental model in rats for study of the pathophysiology of subarachnoid hemorrhage. Neuroreport. 13 (18), 2553-2556 (2002).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52 (1), 165-176 (2003).
- Prunell, G. F., et al. Experimental Subarachnoid Hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54 (2), 426-437 (2004).
- Velthuis, B. K., et al. Subarachnoid hemorrhage: Aneurysm detection and preoperative evaluation with CT angiography. Radiology. 208 (2), 423-430 (1998).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71(2018).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Inflammation in the brain after experimental subarachnoid hemorrhage. Neurosurgery. 56 (5), 1082-1091 (2005).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain. Journal of Neurosurgery. 102 (6), 1046-1054 (2005).
- Spray, S., Haanes, K. A., Edvinsson, L., Johansson, S. E. Subacute phase of subarachnoid haemorrhage in female rats: increased intracranial pressure, vascular changes and impaired sensorimotor function. Microvascular Research. 135, 104127(2020).
- Ansar, S., Vikman, P., Nielsen, M., Edvinsson, L. Cerebrovascular ETB, 5-HT1B, and AT1 receptor upregulation correlates with reduction in regional CBF after subarachnoid hemorrhage. American Journal of Physiology - Heart and Circulatory Physiology. 293 (6), 3750-3758 (2007).
- Hansen-Schwartz, J., et al. Subarachnoid hemorrhage enhances endothelin receptor expression and function in rat cerebral arteries. Neurosurgery. 52 (5), 1188-1194 (2003).
- Hayman, E. G., Wessell, A., Gerzanich, V., Sheth, K. N., Simard, J. M. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage. Neurocritical Care. 26 (2), 301-310 (2017).
- Miyata, H., et al. Vasa vasorum formation is associated with rupture of intracranial aneurysms. Journal of Neurosurgery. , 1-11 (2019).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), Dallas, Tex. 1337-1344 (1979).
- Marbacher, S., Wanderer, S., Strange, F., Grüter, B. E., Fandino, J. Saccular aneurysm models featuring growth and rupture: A systematic review. Brain Sciences. 10 (2), 101(2020).
- Altay, O., et al. Isoflurane on brain inflammation. Neurobiology of Disease. 62, 365-371 (2014).
- Hockel, K., Trabold, R., Schöller, K., Török, E., Plesnila, N. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats. Experimental and Translational Stroke Medicine. 4 (1), 5(2012).
- Kamp, M. A., et al. A Systematic and meta-analysis of mortality in experimental mouse models analyzing delayed cerebral ischemia after subarachnoid hemorrhage. Translational Stroke Research. 8 (3), 206-219 (2017).
- Povlsen, G. K., Johansson, S. E., Larsen, C. C., Samraj, A. K., Edvinsson, L. Early events triggering delayed vasoconstrictor receptor upregulation and cerebral ischemia after subarachnoid hemorrhage. BMC Neuroscience. 14, 34(2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유