Method Article
视交叉前,单次注射自体血以诱导大鼠模型中实验性蛛网膜下腔出血
摘要
蛛网膜下腔出血继续给人类带来很高的死亡率和发病率负担。为了便于进一步研究病情及其病理生理学,提出了一种视交叉前的单次注射模型。
摘要
尽管过去几十年在治疗方面取得了进展,但蛛网膜下腔出血(SAH)仍然具有很高的发病率和死亡率负担,主要困扰着相当年轻的人群。已经开发了几种SAH动物模型来研究SAH背后的病理生理机制并测试药物干预。本文介绍的大鼠的视交叉前单次注射模型是具有预定血容量的SAH的实验模型。简而言之,对动物进行麻醉、插管并保持在机械通气下。温度通过加热垫调节。在尾动脉中放置导管,可以连续测量血压和进行血液采样。切开寰枕膜,并在大池中放置用于压力记录的导管,以测量脑内压。该导管也可用于鞘内治疗干预。将大鼠置于立体定位框架中,在前膛前钻一个毛刺孔,并通过毛刺孔插入导管并放置在视交叉前方。从尾导管抽出自体血 (0.3 mL) 并手动注射。这导致脑内压升高和脑血流量减少。将动物保持镇静30分钟,并给予皮下盐水和镇痛药。动物被拔管并返回笼子。前交叉模型具有很高的重现率,并且由于预先确定的血容量,动物之间的差异有限。它模仿人类的SAH,使其成为SAH研究的相关模型。
引言
非创伤性蛛网膜下腔出血(SAH)是卒中的一种形式,约占所有病例的5%。非创伤性 SAH 最常见的原因是动脉瘤 (aSAH) 突然破裂,占 SAH 的 85%。其他原因包括动脉静脉畸形破裂、凝血病和中脑周围出血的静脉破裂1。发病率为 9/100,000 人年,死亡率约为三分之一,另外三分之一需要在 SAH2,3 后维持日常生活。
初步稳定和确诊后,治疗取决于出血的严重程度。病情最严重的患者将在心室中插入心室外引流管以降低脑内压(ICP),并被收入神经重症监护室,在那里他们受到密切监测。患者将接受血管造影以识别(可能的)动脉瘤,然后将动脉瘤盘绕或夹住以防止再出血4.尽管进行了大量药物治疗试验,但只有尼莫地平(一种钙通道拮抗剂)已被证明可以改善结局5。目前正在进行多项临床试验。请参阅Daou及其同事的评论,以获取广泛的列表6。
动脉瘤的破裂被描述为有史以来最严重的头痛或霹雳性头痛的突然发作。破裂导致ICP急剧上升,随后脑血流量(CBF)减少。这种减少导致大脑的整体缺血,这可能导致意识丧失。这种更机械的途径,以及血液中外渗元素的启动分解,引起细胞因子释放和先天免疫系统的激活,导致无菌性神经炎症。此外,经常观察到血脑屏障的破坏,导致脑水肿和离子稳态紊乱。所有这些变化以及更多被称为早期脑损伤(EBI)的变化发生在头几天内,并导致神经元丢失和细胞凋亡7。
大约 1/3 的 aSAH 患者在第 4-14 天之间会出现迟发性脑缺血 (DCI)8。DCI被定义为局灶性神经损伤的首次出现,或者在格拉斯哥昏迷量表上至少下降两个点,持续至少1小时,当排除其他原因,包括癫痫发作和再出血时。DCI 与 aSAH9 后死亡风险增加和功能结局降低有关。脑血管痉挛(CVS)是脑动脉的狭窄,几十年来一直已知与DCI有关,以前被认为是DCI的唯一原因。此后已经表明,CVS可以在没有DCI发展的情况下发生,并且已经确定了更多因素,包括微血管血栓形成和收缩,皮质扩散抑制和EBI的炎症反应10,11,12。
由于EBI和DCI对疾病进程和患者结果的巨大影响,动物模型需要尽可能模仿这些,同时仍然可重复。研究人员在从小鼠到非人类灵长类动物的各种动物中采用了各种不同的模型来尝试模拟aSAH。Sprague-Dawley和Wistar野生型大鼠是目前最常用的实验动物,最常见的模型是血管内穿孔模型,cisterna-magna双注射模型,最后是视交叉前单次注射模型,本文将在本文中描述13。
前交叉单次注射模型最初由Prunell及其同事开发,以应对其他实验模型的一些缺点14。掌握手术后,具有高度可重复性,并最大限度地减少了动物之间的差异。该模型在多个点上模拟了人类的 SAH,包括注射血液后 ICP 突然升高,导致由于 CBF15,16 下降而导致短暂性整体缺血。它影响前循环,这是人类大多数aSAH发生的地方17。死亡率在 10%-33% 之间,具体取决于研究和注射的血液量14,18。延迟性细胞死亡和神经炎症可以在第2天和第7天检测到,从而为研究EBI和DCI19,20的后果提供变量。
该研究提供了大鼠交叉前单次注射模型的更新描述,以及如何利用ICP探针作为鞘内给药的端口的描述。
研究方案
该程序是根据欧盟关于保护用于科学目的的动物的指令2010/63 / EU完成的,并由丹麦动物实验检查局批准(许可证号2016-15-0201-00940)。尽可能使用无菌技术进行手术,包括无菌器械、手套、导管和缝合线。该研究使用体重230-350g的雄性和雌性Sprague-Dawley大鼠,组饲养12小时光照/黑暗循环,恒温22°C(±2°C),湿度为55%(±10%)。为动物提供标准的食物和随意的水。手术后将动物饲养在单笼中,但当ICP探针被移除时,可以返回群体笼子。该方案中的麻醉剂是异氟醚气体,但氯胺酮(100 mg / mL)和甲苯噻嗪(20mg / mL)的1.5mL / kg的3:2腹腔内混合物也是有效的21。
1. 准备工作
- 修改 16 G 外周静脉导管进行插管。要修改,请将针头缩短 1 厘米,并将剩余的远端向注射阀弯曲 1 厘米30°。移除导管翼(多次使用)。
- 要制作ICP探头,请切割一块20毫米的聚乙烯管(内径(内径(ID):0.58毫米,外径(外径):0.96毫米)并燃烧一端以制成圆形板,保持开放的管腔。在将 10 mm 硅胶管(内径:0.76 毫米,外径:2.4 毫米)连接到聚乙烯管的末端之前,用 1 毫米硅胶管(内径:1.0 毫米,外径:3.0 毫米)绕过聚乙烯管。
- 打开笔记本电脑电源并打开数据采集软件。根据制造商的说明校准血压 (BP) 和脑内压 (ICP) 传感器以及激光多普勒。
- 准备血气分析仪装置。
注意:确保蒸发器中有足够的异氟醚。 - 打开 O2 和大气气流。将O2 的流量设置为30%,将大气的流量设置为70%。
- 放置加热垫并将温度设置为37°C。
2. 麻醉
- 将大鼠置于麻醉室中,流量为O2 的30%和大气的70%。将5%的异氟醚气体注入腔室。充分麻醉大约需要 4 分钟。仔细控制呼吸。
- 麻醉时,将大鼠仰卧放在由橡皮筋绕过的厚板上。将大鼠的门牙放在橡皮筋下方。
- 用弯曲的镊子小心地将舌头拉出。用棉头清洁喉部。在喉咙中线放置外部灯以观察声带。
- 吸气时使用改良的 16 G 外周静脉导管插管。正确插入后,取下细高跟鞋。将导管连接到呼吸机。
注意:通过胸部运动与呼吸频率同步来确认管子的正确放置。如果看到腹部运动,拔管并将大鼠重新引入麻醉铃。不要重复该过程超过三次,因为有损坏气道的风险。 - 插管时,用 30% 的 O2 和 70% 的大气保持动物的人工呼吸。将麻醉维持在异氟醚的1.5%-3%。调整异氟醚以保持血压在80-100 mmHg之间。
- 将呼吸器的吸气量保持在 3 mL,频率保持在 40-45 次吸气/分钟。根据血气分析调整吸气量。
- 用2-0缝合线缝合脸颊的内部软组织。将注射管和外周静脉导管的注射阀周围的缝合线系好,以固定导管。
- 将大鼠移动到手术区域并将其置于仰卧位,尾巴朝向外科医生。
- 需要时涂抹眼部凝胶以对抗眼睛干涩。
- 捏住脚趾以确认足够的麻醉深度。在手术期间评估并保持麻醉深度。
3. 尾导管
- 用0.5%的洗必泰乙醇消毒尾巴的近端3-4厘米。
注意:从现在开始,请根据外科医生的判断使用手术显微镜。 - 在腹侧尾巴的近端做一个15-20毫米的皮肤切口。小心不要切开动脉。
- 使用弯曲的镊子从下面的结缔组织中松开皮肤。
- 小心地穿透暴露动脉的筋膜。
- 使用弯曲的镊子小心地将尾动脉从下面的组织中释放出来。
- 将三根黑色丝线滑入容器下方。将一根线尽可能放在远处,并在动脉周围紧紧地打一个手术结。用止血器握住线的松动端。
- 将剩余的两根线松散地绑在动脉上。
- 将近端线尽可能靠近。使用止血器来固定近端线的末端。轻轻拉动止血器,但足以限制和阻塞血液流动。将止血器放在腹部。
- 以 45° 角切割导管尖端。切尖点以防止动脉壁穿透。
- 使用Vannas剪刀,以30°角将动脉直径的1/3切口,距离远端结3-5毫米。
- 使用两个直镊子将导管插入动脉。用一个镊子固定导管,另一个小心地将动脉拉过导管。
- 将导管向上插入血管至近端结,并从止血器上松开结。可视化导管中的血流。将中间螺纹松散地固定在导管上。
- 继续插入,如果可能的话,直到动脉再次被筋膜覆盖的点。
- 通过用生理盐水冲洗来控制导管的位置和可能的泄漏。
- 用手术结固定两个近端线。
注意:血压测量需要是脉动的;否则,导管放置不正确。 - 通过使用远端线打一个手术结,将导管固定在切口末端。
- 用两条不可吸收的单丝4-0缝合线将皮肤切口松散地缝合在一起。小心不要穿透导管。
注意:在整个手术过程中,请注意脉动的幅度。如果此值较低,请用生理盐水冲洗导管。 - 从压力传感器上松开动脉导管,让血流进行血气采样。在导管末端放置一根微毛细管。让血液流入管中。采血后将导管重新连接到换能器并冲洗导管。
- 将毛细管插入血气分析仪。测量 pH、pCO2 和 pO2 并记下它们
注意:根据血气和血压值,更改通气速率。如果平均动脉压(MAP)太低,请尝试降低异氟醚的流速。测试反射以确保适当的麻醉深度。
4. ICP探头
- 将大鼠置于立体定位框架中。对称放置大鼠很重要。
- 在立体定位框架下放置一个圆柱形枕头,以产生颈部的前屈。
- 剃掉老鼠的头皮、脖子和耳朵后面的区域。去除多余的头发。
- 用0.5%的氯己定乙醇消毒该区域。
- 用 0.7 mL 的 10 mg/5 μg/mL 利多卡因和肾上腺素局部麻醉,将针头插入颅骨尾端的中线。用0.3-0.4毫升注射到颈部肌肉组织。其余部分在前膛周围和前方皮下注射。
- 从针刺中线尾部~8毫米处做一个皮肤切口。
- 将所有肌肉分层钝化,以识别寰枕膜(大理石色三角形,尾部至颅骨中线)。
- 使用 Alm 牵开器来抑制颈部肌肉组织。如果需要,将叉式牵开器放在尾部。
- 检查无菌ICP探头是否连接到ICP传感器。用生理盐水冲洗ICP探头。确保ICP探头中不存在气泡。
- 使用23 G针切开寰枕膜。打一个孔以诱导ICP探头穿过膜。
- 轻轻地诱导探头穿过寰枕膜。轻轻拉动探头,确保其显示0-5 mmHg之间的脉动曲线。如果没有,请取下探头,检查与换能器的连接,并确认流过管腔的流量。
- 涂上两滴纸巾胶。将 1 mm 硅胶管向前移动到膜上并涂上额外的胶水,以最大限度地降低 ICP 探头移位的风险。
- 卸下牵开器。
- 使用不可吸收的单丝4-0缝合线将一条水平床垫缝合到切口的头端,将一条简单的间断缝合线缝合到尾端。
5. 针和激光多普勒探头的放置
- 在眼睛正前方的中线切开一个切口,尾部15毫米。
- 用镊子去除结缔组织和肌肉。使用无菌棉签的末端作为胭脂,可以识别前膛和冠状缝合线。
- 放置 Alm 牵开器。
- 将 25 G 脊髓针放在立体定位框架中。将针精确地放在前膛上并注意位置。
注意:将立体定位框架的中线关节在垂直平面上朝向动物 30°。 - 从前膛取下针,将框架向前移动 65 毫米,然后在中线更换针以标记钻孔部位。
- 钻孔直到在骨骼下方识别出硬脑膜。用直镊子轻轻去除骨碎片,并用骨蜡填充腔。
- 在前膛右侧3-4毫米处再钻一个孔,就在激光多普勒的冠状缝合线的前方。没有必要一直钻穿骨头。注意不要穿透硬脑膜。
- 寻找激光多普勒可以测量血流的血管。放置激光多普勒并检查值。最小值为 100 FU 是必需的。取出显微镜(人造光)。
- 如果这些值仍然可以接受,请添加一滴胶水以固定探针。
- 重新检查以确认该值是否高于 80 FU。如果该值低于 80 FU,请卸下并重新定位探头以达到高于 80 FU 的值。
注意:值 FU 是显示脑血流量 (CBF) 的任意单位。
6. 诱导 SAH
- 将针头轻轻插入半球之间中线的颅骨,直到感觉到颅底的阻力。将针头缩回 1 毫米,以确保正确放置在视交叉前方。
- 将针头顺时针旋转90°,使针尖指向右侧,以确保注射血液时获得最均匀的结果。卸下细高跟鞋(图3)。
- 平衡15分钟并调整麻醉水平以获得80-100mmHg范围内的平均动脉血压。
- 进行血气分析。相应地调整麻醉水平。
- 使用 1 mL 注射器和钝 23 G 针头从尾导管中提取 500 μL 血液。
- 用血液填充脊髓针室的死区,以避免注入空气。从充满血液的注射器中取出 23 G 针头,并确认注射器含有 300 μL 血液。
- 将注射器连接到脊髓针。牢牢抓住并手动注射血液以超越MAP。
- 在笔记本电脑上观察ICP的急剧上升和CBF的急剧下降。
注意:CBF应比基线评分低50%或更低,至少5分钟,手术成功,见 图4。假鼠不经历步骤6.1-6.7,从而省略了脊髓针引入大脑,最大限度地减少可能的自发性出血和医源性脑损伤。
7. 恢复和觉醒
- 皮下注射 0.1 mL/100 g 动物重量的 5.0 mg/mL 卡洛芬和 1 mL/100 g 动物重量的等渗盐水。在给药前,请确保液体至少处于室温。
- 随后在SAH后将大鼠麻醉30分钟。
- 取下针头,激光多普勒探头,然后用骨蜡填充腔。使用两条水平床垫缝合线与不可吸收的单丝4-0缝合线关闭切口。
- 要使用ICP探头注射到大型水池中,请取下硅胶管并将精确适配器插入聚乙烯管。
- 如果没有计划干预,则切断简单的中断缝合线。使用剪刀尽可能缩短ICP探头,然后粘合末端以防止脑脊液(CSF)泄漏。用不可吸收的单丝4-0缝合线关闭切口。
- 将大鼠从立体定位框架中取出并置于仰卧位。从尾部切口取下松动的缝合线。
- 将单条缝合线放在动脉导管近端和深处。取下导管并系好缝合线以防止出血。用不可吸收的单丝4-0缝合尾切口。
- 关闭异氟醚。
- 尽可能清洁老鼠及其皮毛。
- 当踏板撤回反射恢复并且大鼠与呼吸机分离时具有自发呼吸时,将其拔管。
- 将老鼠放在一个笼子里,随意食物和水。将笼子的一半放在加热板下,并将大鼠放在笼子的该区域。
- 通过将针端口注射器调整为精密注射器来进行鞘内给药,并通过针端口适配器进行治疗。这种干预在清醒的动物中是可行的。参见 图 5。
8. 取出ICP探头(如果在手术过程中未移除)
注意:根据外科医生的判断使用手术显微镜。
- 如前所述将大鼠置于麻醉室中。
- 麻醉时,用加热垫将大鼠置于手术场的仰卧位。
- 将鼻子放在麻醉面罩中。将O2 至30%,大气为70%,异氟醚为2%。
- 持续使用眼部凝胶以对抗干眼症。
- 剪断尾部简单断续缝合线。打开切口并去除可能的坏死组织或血凝块。
- 使用剪刀尽可能缩短ICP探头,并将末端粘合,以防止脑脊液(CSF)泄漏。用不可吸收的单丝4-0缝合线关闭切口。
- 关闭异氟醚。
- 当老鼠开始移动时,将其随意放在一个装有食物和水的笼子里。将笼子的一半放在加热板上,并将老鼠放在该区域。
- 当恢复到习惯状态时,在监督下的联合笼中重新将动物相互引入前15分钟。
结果
与男性相比,女性患 aSAH 的风险更高。尽管如此,雄性啮齿动物主要用于实验,因为雌性发情周期的异质性可能存在偏差。这里介绍的代表性结果来自最近比较雌性和雄性大鼠的出版物,证实该模型在雌性动物中产生的结果与雄性21相似。该研究包括34只雌性Sprague-Dawley大鼠(18只SAH和16只shams)。Shams没有将脊髓针下降到视交叉或注射血液。所有其他程序均在与SAH相同的Shams上进行。组间生理参数均相当。最后,对先前雄性大鼠实验的数据进行了荟萃分析,并与本研究的结果进行了比较21。
旋转极测试是对粗大感觉运动功能的测试。将动物放置在 150 厘米 x 45 毫米杆的一端,该杆可以旋转到 10 rpm。目标是到达放置笼子的杆子的远端。与旋转杆上的假动物相比,SAH大鼠在第1天和第2天的表现明显更差(图1)。
SAH后,ET-1和5-HT受体家族在脑动脉中均上调,导致刺激时收缩增加,从而导致CVS22,23。基底动脉(BA)和大脑中动脉(MCA)在斩首后被移除并用于肌图实验。与假手术相比,ET-1受体家族激动剂内皮素1(ET-1)和5-HT受体家族激动剂5-羧酰胺色胺(5-CT)均显著增加SAH血管收缩(图2)。敏感性可以通过两性SAH后引起收缩所需的较低浓度来观察到。
SAH后含水量增加(水肿)是人类功能结果降低的指标24。与第2天的假手术相比,SAH患者的脑水肿明显增加。海马体也有水肿增加的趋势,但这没有统计学意义(p = 0.0508)21。
将上述数据与男性历史数据进行比较时,结果具有可比性。元数据显示,添加ET-1或5-CT后,男性SAH的收缩力增加(图2)。此外,在进行旋转极测试时,SAH大鼠的表现明显较差。结果表明感觉运动功能下降(图1)。
图5A 显示了诱导SAH后30分钟盐水灌注后自体注射血液的分布。该图显示,视交叉前注射后,血液已分布在蛛网膜下腔。
图5B 和 图5C 显示了鞘内注射染料的分布,然后在注射后全身盐水灌注30分钟。 图5B 显示了25 μL 20 mM埃文斯蓝(水溶性)的分布, 图5C 显示了25 μL 10 mM油红O(水不溶性)的分布。发现两种染料在注射到大池后分布在蛛网膜下腔中,证实了这是鞘内注射水溶性和不溶性化合物的可行模型。值得注意的是动脉周围形成水不溶性化合物的沉积物。

图1:雄性和雌性大鼠SAH后前2天的感觉运动认知分析。 旋转极测试在SAH后第1天和第2天进行。与同性别的假手术大鼠相比,两性大鼠都有显着的缺陷。在第0天、第1天和第2天通过2因子方差分析测试组间行为的统计差异。母头无旋转和 3 rpm:p < 0.05。内螺纹 10 rpm 和所有外螺纹数据:p < 0.01。值是 SEM ±手段。 经 Spray, S. et al.21 许可重新发布。 请点击此处查看此图的大图。
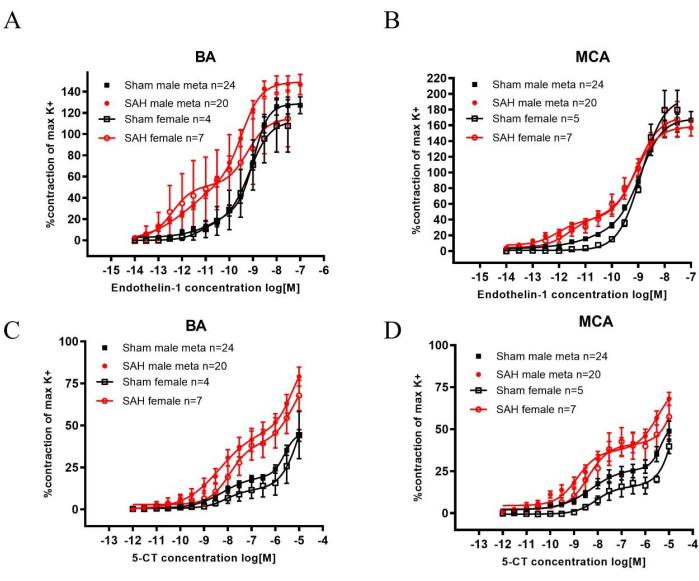
图 2:雄性和雌性大鼠 SAH 后 2 天对 ET-1 和 5-CT 诱导的基底动脉 (BA) 和大脑中动脉 (MCA) 收缩敏感性增加的分析。 (A,B) 60 mM K+诱发(K + max)收缩反应用作激动剂诱导反应正常化的参考值。在BA和MCA中,与同性别的假手术大鼠相比,SAH后2天对ET-1的敏感性显着增加。(中,四)在BA和MCA中,与同性别的假手术大鼠相比,SAH后2天对5-CT的敏感性显着增加。将浓度-响应曲线与双向方差分析进行统计学比较。所有数据:p < 0.001。值是 SEM ±均值。 经 Spray, S. et al.21 许可重新发布。请点击此处查看此图的大图。

图 3:诱导 SAH 之前的设置概述。 从图片顶部开始,请注意 1) 注射针、2) 激光多普勒探头和 3) ICP 探头都已就位。 请点击此处查看此图的大图。

图4:鞘内注射后的样品迹线。 红色图表显示血压(以毫米汞柱为单位)。蓝色图表显示以毫米汞柱为单位的ICP值,绿色图以任意单位FU表示CBF。ICP的峰值是血液注射的结果。请注意,这会导致CBF下降>基线的50%超过5分钟。ICP升高进一步导致血压小幅升高,在几秒钟内恢复正常。 请点击此处查看此图的大图。
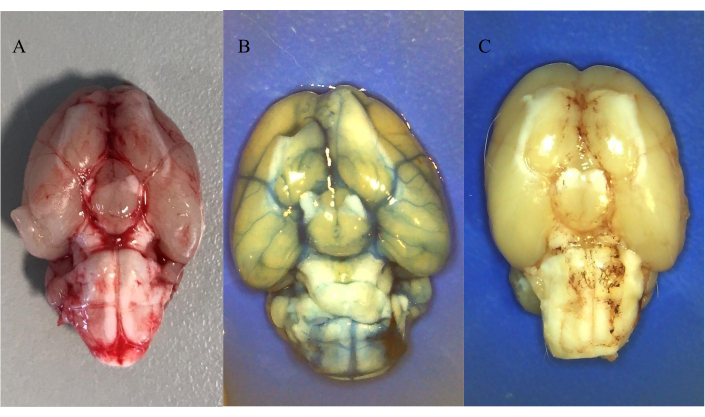
图5:鞘内注射血液和有色染料的 分布。 (A)SAH诱导后30分钟自体血的分布。(B) 通过ICP导管鞘内注射后25μL20mM埃文斯蓝的分布。(C) 通过 ICP 导管鞘内注射后 25 μL 10 mM 油红 O 的分布。所有动物均用腹膜内氯胺酮/甲苯噻嗪混合物麻醉,然后盐水灌注。 请点击此处查看此图的大图。
讨论
SAH的视交叉前单次注射模型模拟了人类SAH的几个重要元素,包括ICP峰值,CBF降低,短暂性全面缺血,神经炎症标志物上调和CVS14,15,16,18,19,20。ICP探针也用作鞘内给药的端口(图5)。此外,研究表明,该模型在雄性和雌性动物中的表现相似21。该模型不包括动脉瘤的发展和随后的破裂。一系列模型试图通过手术或药理诱导全身高血压以及通过使用弹性蛋白酶25,26,27削弱动脉壁,从破裂的动脉瘤中产生SAH。所有尝试都在动物亚群中产生了动脉瘤SAH,但这些模型具有固有的可变性,包括无法预测动脉瘤何时破裂。这些模型不太适合SAH18,28的临床前研究。
在其他鼠SAH模型中,血管内穿孔模型包括血管破裂,有点类似于动脉瘤的破裂,但容易出现高变异性和死亡率。这里描述的模型具有更好的可追溯性和可重复性,因为血容量是预先确定的,并且可以控制注射压力。双注射模型产生延迟性CVS的可能性较高,但主要影响后循环,包括非生理性的第二次血液注射。相比之下,该模型类似于人类的SAH,因为它是前循环的单次注射,并且产生可重复的ICP上升18。
不同麻醉方案对实验性SAH的影响尚不清楚,实验数据相互矛盾。一项研究报告了使用异氟醚吸入时,小鼠血管内穿孔模型中的细胞因子和一般神经炎症可能受到抑制29。当使用异氟烷30时,另一种啮齿动物模型导致呼吸参数降低,脑水肿增加,区域CBF降低。然而,比较小鼠模型中死亡率的荟萃分析显示,异氟醚和其他类型的麻醉之间的死亡率没有差异31。一致,上述方案已成功使用异氟烷吸入或腹膜内氯胺酮/甲苯噻嗪混合物,在两组中的结果相似21。
为了确保高可重复性和正确的数据采集,总体重点是有关监测设备放置的步骤。正确放置尾导管有助于连续监测血压和进行血气分析的能力。正确放置 ICP 导管可确保正确的 ICP 监测以及随后进行鞘内干预的可能性。激光多普勒探头的适当放置可确保监测CBF的降低,其中在SAH诱导后至少5分钟内基线评分降低50%或更低可确保强烈的缺血32。通过确保所有监测步骤井然有序,研究人员可以在SAH诱导后确保正确的数据收集。
该协议描述了蛛网膜下腔出血的视交叉前单次注射模型,并进行了更新和修改。该模型对SAH研究很有价值,并可能继续有助于更好地了解蛛网膜下腔出血,包括早期脑损伤和迟发性脑缺血。
披露声明
作者没有利益冲突要声明。
致谢
这项工作得到了灵北基金会和灵北卓越奖(编号R59-A5404)的支持。资助者在手稿的任何部分都没有角色。
材料
| Name | Company | Catalog Number | Comments |
| 16 G peripheral vein catheter | BD Venflon | 393229 | Needle shortened, distal 1 cm curved. Wings removed |
| Anesthesia bell/ chamber | Unknown | ||
| Blood gas analyzer | Radiometer | ABL80 | |
| Blood pressure (BP) monitor | Adinstruments | ML117 | Connects to Powerlab |
| Curved forceps, 12 cm x 3 | F.S.T | 11001-12 | For anesthesia |
| Cylindrical pillow, 28 cm x 4 cm | Homemade | Made from surgical towels | |
| Data acquisition hardware | Adinstruments | ML870 Powerlab | |
| Data acquistion software | Adinstruments | LabChart 6.0 | |
| Drill | KMD | 1189 | |
| Drill controller | Silfradent | 300 IN | |
| Flexible light | Schott | KL200 | |
| Heating pad | Minco | 1135 | |
| Hypodermic needle, 20 G | KD Medical | 301300 | Connects to stereotaxic frame |
| ICP monitor | Adinstruments | ML117 | Connects to Powerlab |
| Isoflurane vaporizer | Ohmeda | TEC3 | |
| Laptop | Lenovo | T410 | |
| Laser doppler monitor | Adinstruments | ML191 | |
| Laser doppler probe | Oxford Optronics | MSF100XP | Connects to laser doppler monitor |
| Needle holder, 13 cm | F.S.T | 12001-13 | For anesthesia |
| Precision syringe, 0.025 mL | Hamilton | 547407 | |
| Stereotaxic frame | Kopf Instruments | M900 | |
| Surgical microscope | Carl Zeiss | F170 | |
| Suture needle | Allgaier | 1245 | For anesthesia |
| Temperaure controller | CWE,INC. | TC-1000 | |
| Transducer x 2 | Adinstruments | MLT0699 | Connects to BP and ICP monitor |
| Ventilator | Ugo Basile | 7025 | |
| Veterinary clipper | Aesculap | GT421 | |
| 3-pronged Blair retractor, 13.5 cm | Agnthos | 17022--13 | |
| Blunt Alm retractor | F.S.T | 17008-07 | |
| Curved forceps, 12 cm x 2 | F.S.T | 11001-12 | |
| Needle holder, 13 cm | F.S.T | 12001-13 | |
| Straight Dumont forceps, 11 cm | F.S.T | 11252-00 | |
| Straight Halsted-Mosquito hemostat x 2 | F.S.T | 13008-12 | |
| Straight Iris scissor, 9 cm | F.S.T | 14090-09 | |
| Straight Vannas scissor, 10.5 cm | F.S.T | 15018-10 | |
| Absorpable swabs | Kettenbach | 31603 | |
| Black silk thread, 4-0, 5 x 15 cm | Vömel | 14757 | |
| Bone wax | Aesculap | 1029754 | |
| Carbomer eye gel 2 mg/g | Paranova | ||
| Cotton swab | Heinz Herenz | WA-1 | |
| Cotton tipped applicator x 4 | Selefa | 120788 | |
| Hypodermic needle, 23 G x2 | KD Medical | 900284 | Connects to stopcock. Remove distal end |
| Hypodermic needle, 23 G x3 | KD Medical | 900284 | Remove distal end. 2 connects to stopcock, 1 to syringe |
| ICP probe: | Homemade | Made of the following: | |
| Polythene tubing, 20 mm | Smiths medical | 800/100/200 | Inner diameter (ID): 0.58 mm, Outer diameter (OD): 0.96 mm. |
| Silicone tubing, 10 mm | Fisher | 15202710 | ID: 0.76 mm, OD: 2.4 mm. |
| Silicone tubing, 2 mm | Fisher | 11716513 | ID: 1.0 mm, OD: 3.0 mm. |
| Micro hematocrit tubes | Brand | 7493 11 | |
| OP-towel, 45 cm x75 cm | Mölnlycke | 800430 | |
| PinPort adapter, 22 G | Instech | PNP3F22 | |
| PinPort injector | Instech | PNP3M | |
| Polythene tubing, 2 x 20 cm | Smiths medical | 800/100/200 | Connects to syringe. ID: 0.58 mm, OD: 0.96 mm. |
| Rubberband | Unknown | ||
| Scalpel, 10 blade | Kiato | 23110 | |
| Spinalneedle, 25 G x 3.5'' | Braun | 5405905-01 | |
| Stopcock system, Discofix x 2 | Braun | 16494C | Connects to transducer |
| Suture, 4-0, monofil, non-resorbable x 3 | Ethicon | EH7145H | |
| Syringe, 1 mL | BD Plastipak | 1710023 | |
| Syringe, luer-lock, 10 mL x 4 | BD Plastipak | 305959 | Connects to transducer |
| Tissue adhesive glue | 3M | 1469SB | |
| 0.5% Chlorhexidine spirit | Faaborg Pharma | 210918 | |
| Carprofen 50 mg/mL | ScanVet | 43715 | Diluted 1:10 |
| Isoflurane | Baxter | ||
| Isotonic saline | Amgros | 16404 | |
| Lidocaine-Adrenaline 10 mg/5 µg/mL | Amgros | 16318 |
参考文献
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. Lancet. 369 (9558), London, England. 306-318 (2007).
- de Rooij, N. K., Linn, F. H. H., vander Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12), 1365-1372 (2007).
- Feigin, V. L., Lawes, C. M., Bennett, D. A., Barker-Collo, S. L., Parag, V. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review. The Lancet, Neurology. 8 (4), 355-369 (2009).
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of spontaneous subarachnoid hemorrhage: guidelines and gaps. Stroke. 51 (4), 1326-1332 (2020).
- Pickard, J. D., et al. Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial. British Medical Journal (Clinical Research ed.). 298 (6674), 636-642 (1989).
- Daou, B. J., Koduri, S., Thompson, B. G., Chaudhary, N., Pandey, A. S. Clinical and experimental aspects of aneurysmal subarachnoid hemorrhage. CNS Neuroscience and Therapeutics. 25 (10), 1096-1112 (2019).
- Fujii, M., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Translational Stroke Research. 4 (4), 432-446 (2013).
- Roos, Y. B., et al. Complications and outcome in patients with aneurysmal subarachnoid haemorrhage: A prospective hospital based cohort study in the Netherlands. Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3), 337-341 (2000).
- Vergouwen, M. D. I., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Brown, R. J., Kumar, A., Dhar, R., Sampson, T. R., Diringer, M. N. The relationship between delayed infarcts and angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery. 72 (5), 702-707 (2013).
- Dhar, R., et al. Relationship between angiographic vasospasm and regional hypoperfusion in aneurysmal subarachnoid hemorrhage. Stroke. 43 (7), 1788-1794 (2012).
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews. Neurology. 10 (1), 44-58 (2014).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. -A. A new experimental model in rats for study of the pathophysiology of subarachnoid hemorrhage. Neuroreport. 13 (18), 2553-2556 (2002).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52 (1), 165-176 (2003).
- Prunell, G. F., et al. Experimental Subarachnoid Hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54 (2), 426-437 (2004).
- Velthuis, B. K., et al. Subarachnoid hemorrhage: Aneurysm detection and preoperative evaluation with CT angiography. Radiology. 208 (2), 423-430 (1998).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71(2018).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Inflammation in the brain after experimental subarachnoid hemorrhage. Neurosurgery. 56 (5), 1082-1091 (2005).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain. Journal of Neurosurgery. 102 (6), 1046-1054 (2005).
- Spray, S., Haanes, K. A., Edvinsson, L., Johansson, S. E. Subacute phase of subarachnoid haemorrhage in female rats: increased intracranial pressure, vascular changes and impaired sensorimotor function. Microvascular Research. 135, 104127(2020).
- Ansar, S., Vikman, P., Nielsen, M., Edvinsson, L. Cerebrovascular ETB, 5-HT1B, and AT1 receptor upregulation correlates with reduction in regional CBF after subarachnoid hemorrhage. American Journal of Physiology - Heart and Circulatory Physiology. 293 (6), 3750-3758 (2007).
- Hansen-Schwartz, J., et al. Subarachnoid hemorrhage enhances endothelin receptor expression and function in rat cerebral arteries. Neurosurgery. 52 (5), 1188-1194 (2003).
- Hayman, E. G., Wessell, A., Gerzanich, V., Sheth, K. N., Simard, J. M. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage. Neurocritical Care. 26 (2), 301-310 (2017).
- Miyata, H., et al. Vasa vasorum formation is associated with rupture of intracranial aneurysms. Journal of Neurosurgery. , 1-11 (2019).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), Dallas, Tex. 1337-1344 (1979).
- Marbacher, S., Wanderer, S., Strange, F., Grüter, B. E., Fandino, J. Saccular aneurysm models featuring growth and rupture: A systematic review. Brain Sciences. 10 (2), 101(2020).
- Altay, O., et al. Isoflurane on brain inflammation. Neurobiology of Disease. 62, 365-371 (2014).
- Hockel, K., Trabold, R., Schöller, K., Török, E., Plesnila, N. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats. Experimental and Translational Stroke Medicine. 4 (1), 5(2012).
- Kamp, M. A., et al. A Systematic and meta-analysis of mortality in experimental mouse models analyzing delayed cerebral ischemia after subarachnoid hemorrhage. Translational Stroke Research. 8 (3), 206-219 (2017).
- Povlsen, G. K., Johansson, S. E., Larsen, C. C., Samraj, A. K., Edvinsson, L. Early events triggering delayed vasoconstrictor receptor upregulation and cerebral ischemia after subarachnoid hemorrhage. BMC Neuroscience. 14, 34(2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。