Method Article
Injection unique pré-chiasmatique de sang autologue pour induire une hémorragie sous-arachnoïdienne expérimentale chez un rat
Dans cet article
Résumé
L’hémorragie sous-arachnoïdienne continue de porter un lourd fardeau de mortalité et de morbidité chez l’homme. Pour faciliter la poursuite des recherches sur la maladie et sa physiopathologie, un modèle pré-chiasmatique à injection unique est présenté.
Résumé
Malgré les progrès réalisés dans le traitement au cours des dernières décennies, l’hémorragie sous-arachnoïdienne (HSA) continue de porter un lourd fardeau de morbidité et de mortalité, touchant en grande partie une population assez jeune. Plusieurs modèles animaux d’HSA ont été développés pour étudier les mécanismes physiopathologiques à l’origine de l’HSA et tester des interventions pharmacologiques. Le modèle pré-chiasmatique à injection unique chez le rat présenté dans cet article est un modèle expérimental d’HSA avec un volume sanguin prédéterminé. Brièvement, l’animal est anesthésié, intubé et maintenu sous ventilation mécanique. La température est régulée avec un coussin chauffant. Un cathéter est placé dans l’artère de la queue, permettant une mesure continue de la pression artérielle ainsi que des prélèvements sanguins. La membrane atlanto-occipitale est incisée et un cathéter pour l’enregistrement de la pression est placé dans la citerne magna pour permettre la mesure de la pression intracérébrale. Ce cathéter peut également être utilisé pour des interventions thérapeutiques intrathécales. Le rat est placé dans un cadre stéréotaxique, un trou de bavure est percé antérieurement au bregma, et un cathéter est inséré à travers le trou de bavure et placé juste avant le chiasme optique. Le sang autologue (0,3 mL) est prélevé du cathéter de queue et injecté manuellement. Il en résulte une augmentation de la pression intracérébrale et une diminution du flux sanguin cérébral. L’animal est maintenu sous sédation pendant 30 minutes et reçoit une solution saline sous-cutanée et des analgésiques. L’animal est extubé et retourné dans sa cage. Le modèle pré-chiasmatique a un taux de reproductibilité élevé et une variation limitée entre les animaux en raison du volume sanguin prédéterminé. Il imite l’HSA chez l’homme, ce qui en fait un modèle pertinent pour la recherche sur les SEP.
Introduction
L’hémorragie sous-arachnoïdienne non traumatique (HSA) est une forme d’AVC, représentant environ 5% de tous les cas. La cause la plus fréquente d’HSA non traumatique est la rupture soudaine d’un anévrisme (HSAa), qui représente 85% des HSA. D’autres causes incluent la rupture d’une malformation artério-veineuse, des coagulopathies et la rupture des veines dans l’hémorragie périmésencéphale1. Le taux d’incidence est de 9 pour 100 000 années-personnes avec une mortalité d’environ une sur trois et un autre tiers nécessitant le soutien de la vie quotidienne après l’HSA 2,3.
Après la stabilisation initiale et la confirmation du diagnostic, le traitement dépend de la gravité de l’hémorragie. Les patients les plus sévèrement atteints auront un drain extra-ventriculaire inséré dans les ventricules pour réduire la pression intracérébrale (PIC) et seront admis à l’unité de soins neurointensifs, où ils seront étroitement surveillés. Les patients subiront une angiographie pour identifier l’anévrisme (probable) et ensuite auront l’anévrisme enroulé ou coupé pour éviter une récidive hémorragique4. Malgré de nombreux essais de thérapies pharmacologiques, seule la nimodipine, un antagoniste des canaux calciques, a montré qu’elle améliorait les résultats5. Plusieurs essais cliniques sont actuellement en cours. Veuillez consulter l’examen par Daou et ses collègues pour une liste complète6.
La rupture d’un anévrisme a été décrite comme l’apparition soudaine du pire mal de tête jamais connu ou d’un coup de tonnerre. La rupture entraîne une forte augmentation de l’ICP suivie d’une réduction du débit sanguin cérébral (CBF). Cette réduction entraîne une ischémie globale du cerveau, ce qui peut entraîner une perte de conscience. Cette voie plus mécaniste, ainsi que la dégradation initiée des éléments extravasés du sang, donne lieu à la libération de cytokines et à l’activation du système immunitaire inné, ce qui entraîne une neuroinflammation stérile. En outre, une dégradation de la barrière hémato-encéphalique, entraînant un œdème cérébral et une perturbation de l’homéostasie ionique, est souvent observée. Tous ces changements et plus encore, appelés lésions cérébrales précoces (EBI), se produisent dans les deux premiers jours et entraînent une perte neuronale et une apoptose7.
Environ 1/3 des patients atteints d’HSAa développeront une ischémie cérébrale retardée (ICD) entre le 4e et le 14e jour8. L’ICD est définie comme le début d’une déficience neurologique focale ou une chute d’au moins deux points sur l’échelle de coma de Glasgow pendant au moins 1 h, lorsque d’autres causes, y compris les convulsions et les saignements répétés, sont exclues. L’ICD est associée à un risque accru de décès et à une diminution des résultats fonctionnels après l’HSAa9. Le vasospasme cérébral (CVS), le rétrécissement des artères cérébrales, est connu pour être associé à l’ICD depuis des décennies et était autrefois considéré comme la seule raison de l’ICD. Il a depuis été démontré que le SVC peut se produire sans le développement d’ICD et d’autres facteurs, y compris la thrombose et la constriction microvasculaires, la dépression de propagation corticale et une réponse inflammatoire de l’EBI ont depuis été identifiés10,11,12.
En raison de la grande influence de l’EBI et du DCI sur l’évolution de la maladie et l’issue des patients atteints, les modèles animaux doivent les imiter dans la plus grande mesure possible, tout en restant reproductibles. Les chercheurs ont utilisé un large éventail de modèles différents chez une variété d’animaux, des souris aux primates non humains, pour essayer de simuler l’HSA. Les rats sauvages Sprague-Dawley et Wistar sont actuellement les animaux de laboratoire les plus couramment utilisés, et les modèles les plus courants sont le modèle de perforation endovasculaire, le modèle de double injection citerne-magna, et enfin le modèle pré-chiasmatique à injection unique, qui sera décrit dans cet article13.
Le modèle pré-chiasmatique à injection unique a été développé à l’origine par Prunell et ses collègues pour remédier à certaines des lacunes des autres modèles expérimentaux14. La chirurgie, lorsqu’elle est maîtrisée, est hautement reproductible et minimise les variations entre les animaux. Le modèle imite l’HSA chez l’homme sur plusieurs points, y compris l’augmentation soudaine de la PIC suite à l’injection de sang, entraînant une ischémie globale transitoire due à une chute du CBF15,16. Il affecte la circulation antérieure, qui est l’endroit où la plupart des HSA chez l’homme se produisent17. La mortalité varie de 10% à 33% selon l’étude et la quantité de sang injectée14,18. La mort cellulaire retardée et la neuroinflammation peuvent être détectées les jours 2 et 7, fournissant ainsi des variables pour étudier les conséquences de l’EBI et de l’ICD19,20.
L’étude présente une description mise à jour du modèle d’injection unique pré-chiasmatique chez le rat ainsi qu’une description de la façon d’utiliser la sonde ICP comme port pour l’administration intrathécale de produits pharmaceutiques.
Protocole
Cette procédure est effectuée conformément à la directive 2010/63/UE de l’Union européenne concernant la protection des animaux utilisés à des fins scientifiques et approuvée par l’Inspection danoise de l’expérimentation animale (licence n° 2016-15-0201-00940). La chirurgie est réalisée en utilisant la technique aseptique dans la mesure du possible, y compris des instruments stériles, des gants, des cathéters et des sutures. L’étude a utilisé des rats Sprague-Dawley mâles et femelles pesant de 230 à 350 g, un groupe logé dans un cycle lumière/obscurité de 12 heures, avec une température constante de 22 °C (± 2 °C) et une humidité de 55 % (± 10 %). Les animaux reçoivent du chow standard et de l’eau ad libitum. Les animaux sont logés dans des cages individuelles après la chirurgie, mais peuvent être retournés dans une cage de groupe lorsque la sonde ICP a été retirée. L’anesthésique dans ce protocole est le gaz isoflurane, mais un mélange intrapéritonéal 3:2 de kétamine (100 mg/mL) et de xylazine (20 mg/mL) de 1,5 mL/kg est également efficace21.
1. Préparatifs
- Modifier un cathéter veineux périphérique de 16 G pour l’intubation. Pour modifier, raccourcir l’aiguille de 1 cm et plier le reste distal de 1 cm sur 30° vers la valve d’injection. Retirez les ailes du cathéter (usage multiple).
- Pour fabriquer une sonde ICP, coupez un morceau de tube en polyéthylène de 20 mm (diamètre intérieur (ID): 0,58 mm, diamètre extérieur (OD): 0,96 mm) et brûlez une extrémité pour faire une plaque circulaire, en gardant une lumière ouverte. Contourner le tube en polyéthylène avec 1 mm de tube en silicone (ID: 1,0 mm, OD: 3,0 mm) avant de connecter 10 mm de tube en silicone (ID: 0,76 mm, OD: 2,4 mm) à l’extrémité du tube en polyéthylène.
- Allumez l’ordinateur portable et ouvrez le logiciel d’acquisition de données. Calibrez les transducteurs de pression artérielle (PA) et de pression intracérébrale (ICP) et le Laser-Doppler conformément aux instructions du fabricant.
- Préparez l’appareil d’analyse des gaz du sang.
ATTENTION : Assurez-vous qu’il y a suffisamment d’isoflurane dans le vaporisateur. - Allumez l’O2 et le flux d’air atmosphérique. Réglez le débitd’O2 à 30% et celui de l’air atmosphérique à 70%.
- Placez le coussin chauffant et réglez la température à 37 °C.
2. Anesthésie
- Placez le rat dans la chambre d’anesthésie avec un débit de 30% d’O2 et 70% d’air atmosphérique. Administrer 5% de gaz isoflurane dans la chambre. Une anesthésie adéquate prendra environ 4 minutes. Contrôlez soigneusement la respiration.
- Une fois anesthésié, placez le rat en décubitus dorsal sur une plaque lourde contournée par un élastique. Placez les dents de devant du rat sous l’élastique.
- Tirez soigneusement la langue avec des pinces incurvées. Nettoyez le larynx avec une pointe en coton. Placez une lumière externe dans la ligne médiane de la gorge pour visualiser les cordes vocales.
- Intuber pendant l’inspiration à l’aide du cathéter veineux périphérique modifié de 16 G. Lorsqu’il est correctement inséré, retirez le talon aiguille. Connectez le cathéter au ventilateur.
REMARQUE: Le placement correct du tube est confirmé par des mouvements thoraciques synchronisés avec la fréquence respiratoire. Si des mouvements de l’abdomen sont observés, extuber et réintroduire le rat dans la cloche d’anesthésie. Ne répétez pas la procédure plus de trois fois en raison du risque d’endommager les voies respiratoires. - Une fois intubé, garder l’animal sous respiration artificielle avec 30% d’O2 et 70% d’air atmosphérique. Maintenir l’anesthésie à 1,5%-3% d’isoflurane. Ajustez l’isoflurane pour maintenir la pression artérielle entre 80 et 100 mmHg.
- Maintenir le volume inspiratoire du respirateur à 3 mL et la fréquence à 40-45 inspirations/min. Ajuster le volume inspiratoire en fonction de l’analyse des gaz du sang.
- Faites un point à travers les tissus mous internes de la joue avec une suture 2-0. Attachez la suture autour du tube d’injection et de la valve d’injection du cathéter veineux périphérique pour fixer le cathéter.
- Déplacez le rat vers le champ opératoire et placez-le en décubitus dorsal, la queue tournée vers le chirurgien.
- Appliquez le gel pour les yeux au besoin pour contrer les yeux secs.
- Effectuez un pincement des orteils pour confirmer une profondeur d’anesthésie adéquate. Évaluer et maintenir la profondeur de l’anesthésie pendant la chirurgie.
3. Cathéter de queue
- Désinfecter les 3-4 cm proximaux de la queue avec 0,5% d’éthanol chlorhexidine.
REMARQUE: Dorénavant, utilisez le microscope chirurgical à la discrétion du chirurgien. - Faites une incision cutanée de 15 à 20 mm à l’extrémité proximale de la queue sur la face ventrale. Attention à ne pas inciser l’artère.
- Desserrez la peau du tissu conjonctif sous-jacent à l’aide d’une pince incurvée.
- Pénétrez soigneusement le fascia exposant l’artère.
- Libérez soigneusement l’artère de la queue du tissu sous-jacent à l’aide d’une pince incurvée.
- Glissez trois fils de soie noire sous le récipient. Placez un fil aussi distalement que possible et attachez un nœud chirurgical étroitement autour de l’artère. Tenez les extrémités lâches du fil avec un hémostatique.
- Attachez les deux fils restants lâchement autour de l’artère.
- Poussez le fil proximal aussi proximale que possible. Appliquez un hémostatique pour maintenir les extrémités du fil proximal. Tirez l’hémostatique légèrement, mais suffisamment pour restreindre et bloquer le flux sanguin. Placez l’hémostatique sur l’abdomen.
- Coupez l’extrémité du cathéter à un angle de 45°. Coupez la pointe tranchante pour empêcher la pénétration de la paroi artérielle.
- À l’aide d’un ciseau Vannas, faites une incision artérielle à 1/3 du diamètre de l’artère à un angle de 30°, à 3-5 mm du nœud distal.
- Insérez le cathéter dans l’artère à l’aide de deux pinces droites. Utilisez une pince pour tenir le cathéter et l’autre pour tirer soigneusement l’artère sur le cathéter.
- Insérez le cathéter dans le vaisseau jusqu’au nœud proximal et desserrez le nœud de l’hémostatique. Visualisez le flux sanguin dans le cathéter. Fixez le fil du milieu lâchement au cathéter.
- Continuez l’insertion jusqu’au point où l’artère est recouverte d’un fascia et, si possible, juste au-delà.
- Contrôlez l’emplacement du cathéter et la fuite possible en rinçant avec une solution saline.
- Fixez les deux fils proximaux à l’aide de nœuds chirurgicaux.
REMARQUE: La mesure de la pression artérielle doit être pulsatile; Sinon, le cathéter n’est pas correctement placé. - Fixez le cathéter à l’extrémité de l’incision en nouant un nœud chirurgical à l’aide du fil distal.
- Coudre l’incision cutanée lâchement avec deux sutures monofilament 4-0 non résorbables. Veillez à ne pas pénétrer dans le cathéter.
REMARQUE: Tout au long de la chirurgie, soyez conscient de l’amplitude de la pulsation. Si celui-ci est faible, rincez le cathéter avec une solution saline. - Desserrez le cathéter artériel du transducteur de pression pour permettre la circulation sanguine pour l’échantillonnage des gaz du sang. Placez un microtube capillaire à l’extrémité du cathéter. Laissez le sang couler dans le tube. Rattachez le cathéter au transducteur après le prélèvement sanguin et rincez le cathéter.
- Insérez le tube capillaire dans l’analyseur de gaz du sang. Mesurez le pH, le pCO2 et le pO2 et notez-les
REMARQUE: Selon les valeurs de gaz sanguins et de pression artérielle, modifiez le taux de ventilation. Si la pression artérielle moyenne (MAP) est trop faible, essayez de baisser le débit de l’isoflurane. Testez les réflexes pour vous assurer d’une bonne profondeur d’anesthésie.
4. Sonde du PIC-
- Placez le rat dans le cadre stéréotaxique. Il est important de positionner le rat symétriquement.
- Placez un oreiller cylindrique sous le cadre stéréotaxique pour créer une flexion antérieure du cou.
- Rasez le cuir chevelu, le cou et la zone derrière les oreilles du rat. Enlevez les poils superflus.
- Désinfectez la zone avec 0,5% d’éthanol chlorhexidine.
- Anesthésier localement avec 0,7 mL de lidocaïne à 10 mg/5 μg/mL avec adrénaline, insérer l’aiguille à l’extrémité caudale du crâne dans la ligne médiane. Injecter dans la musculature du cou avec 0,3-0,4 mL. Injectez le reste par voie sous-cutanée autour et avant le bregma.
- Faites une incision cutanée à partir de la ponction de l’aiguille ~ 8 mm caudale dans la ligne médiane.
- Disséquez tous les muscles en couches pour identifier la membrane atlanto-occipitale (triangle de couleur marbre caudale au crâne dans la ligne médiane).
- Utilisez l’enrouleur Alm pour retenir la musculature du cou. Placez l’écarteur à broches caudalement si nécessaire.
- Vérifiez si la sonde ICP stérile est connectée au transducteur ICP. Rincer la sonde ICP avec une solution saline. Assurez-vous qu’aucune bulle d’air n’est présente dans la sonde ICP.
- Inciser la membrane atlanto-occipitale à l’aide d’une aiguille de 23 G. Faites un trou pour faire passer la sonde ICP à travers la membrane.
- Cajoler doucement la sonde à travers la membrane atlanto-occipitale. Tirez légèrement la sonde et assurez-vous qu’elle présente une courbe pulsée comprise entre 0 et 5 mmHg. Si ce n’est pas le cas, retirez la sonde, vérifiez la connexion au transducteur et confirmez le flux à travers la lumière.
- Appliquez deux gouttes de colle à tissu. Déplacez le tube en silicone de 1 mm vers l’avant de la membrane et appliquez de la colle supplémentaire pour minimiser le risque de déplacement de la sonde ICP.
- Retirez le(s) rétracteur(s).
- Faites une suture horizontale du matelas à l’extrémité céphalique de l’incision et une suture simple interrompue à l’extrémité caudale à l’aide d’une suture monofilament 4-0 non résorbable.
5. Placement de l’aiguille et de la sonde Laser-Doppler
- Faites une incision dans la ligne médiane juste avant les yeux, 15 mm caudale.
- Retirez le tissu conjonctif et les muscles à l’aide d’une pince. Utiliser l’extrémité d’un coton-tige stérile comme rougine permettant d’identifier le bregma et les sutures coronales.
- Placez l’enrouleur Alm.
- Placez une aiguille vertébrale de 25 G dans le cadre stéréotaxique. Placez l’aiguille exactement sur le bregma et notez la position.
NOTE: Placez l’articulation médiane du cadre stéréotaxique à 30° vers l’animal dans le plan vertical. - Retirez l’aiguille du bregma, déplacez le cadre de 65 mm vers l’avant, puis replacez l’aiguille dans la ligne médiane pour marquer le site de forage.
- Forer jusqu’à ce que la dure-mère soit identifiée sous l’os. Retirez délicatement les fragments d’os à l’aide d’une pince droite et remplissez la cavité avec de la cire d’os.
- Percez un autre trou de 3-4 mm latéral à droite du bregma et juste avant la suture coronale pour le Laser-Doppler. Il n’est pas nécessaire de percer tout le chemin à travers l’os. Attention à ne pas pénétrer dans la dure-mère.
- Recherchez les vaisseaux où le laser-doppler peut mesurer le flux sanguin. Placez le laser-doppler et vérifiez les valeurs. Une valeur minimale de 100 FU est requise. Retirez le microscope (lumière artificielle).
- Si les valeurs sont toujours acceptables, ajoutez une goutte de colle pour fixer la sonde.
- Vérifiez à nouveau si la valeur est supérieure à 80 FU. Si la valeur est inférieure à 80 FU, retirez et repositionnez la sonde pour atteindre une valeur supérieure à 80 FU.
REMARQUE: La valeur, FU, est une unité arbitraire montrant le flux sanguin cérébral (CBF).
6. Induction de l’HSA
- Insérez doucement l’aiguille à travers le crâne dans la ligne médiane entre les hémisphères jusqu’à ce que la résistance de la base du crâne soit ressentie. Rétractez l’aiguille de 1 mm pour assurer un placement correct juste avant le chiasme optique.
- Tournez l’aiguille de 90° dans le sens des aiguilles d’une montre de sorte que l’extrémité de l’aiguille pointe vers la droite pour assurer le résultat le plus homogène lors de l’injection de sang. Retirez le stiletto (Figure 3).
- Équilibrez pendant 15 min et ajustez le niveau d’anesthésie pour obtenir une pression artérielle moyenne comprise entre 80 et 100 mmHg.
- Effectuer une analyse des gaz du sang. Ajustez le niveau d’anesthésie en conséquence.
- Prélever 500 μL de sang du cathéter de queue à l’aide d’une seringue de 1 mL munie d’une aiguille émoussée de 23 G.
- Remplissez l’espace mort de la chambre de l’aiguille vertébrale avec du sang pour éviter l’injection d’air. Retirez l’aiguille de 23 G de la seringue remplie de sang et confirmez que la seringue contient 300 μL de sang.
- Connectez la seringue à l’aiguille vertébrale. Saisissez fermement et injectez le sang manuellement pour surpasser la MAP.
- Observez une forte augmentation de l’ICP et une forte baisse du CBF sur l’ordinateur portable.
REMARQUE: La FBC doit être de 50% ou moins par rapport au score de base pendant au moins 5 minutes pour que la chirurgie réussisse, voir Figure 4. Les rats fictifs ne subissent pas les étapes 6.1 à 6.7, omettant ainsi l’introduction de l’aiguille vertébrale dans le cerveau, minimisant ainsi les hémorragies spontanées possibles et les lésions cérébrales iatrogène.
7. Récupération et réveil
- Administrer 0,1 mL/100 g de poids animal de 5,0 mg/mL de carprofène et 1 mL/100 g de poids animal de solution saline isotonique par voie sous-cutanée. Assurez-vous que les liquides sont au moins à température ambiante avant de les administrer.
- Par la suite, gardez le rat sous anesthésie pendant 30 minutes après l’HSA.
- Retirez l’aiguille, la sonde Doppler laser, puis remplissez les cavités avec de la cire osseuse. Fermez l’incision à l’aide de deux sutures horizontales avec une suture monofilament 4-0 non résorbable.
- Pour utiliser la sonde ICP pour les injections dans la citerne magna, retirez le tube en silicone et insérez un adaptateur précis dans le tube en polyéthylène.
- Si aucune intervention n’est prévue, coupez la suture simple et interrompue. Raccourcissez la sonde ICP autant que possible à l’aide d’un ciseau, puis collez l’extrémité pour éviter toute fuite de liquide céphalorachidien (LCR). Fermez l’incision avec une suture monofilament 4-0 non résorbable.
- Retirez le rat du cadre stéréotaxique et placez-le en décubitus dorsal. Retirez les sutures lâches de l’incision de la queue.
- Placez une seule suture proximale et profonde au cathéter artériel. Retirez le cathéter et attachez la suture pour éviter les saignements. Suturer l’incision de la queue avec une suture monofilament 4-0 non résorbable.
- Éteignez l’isoflurane.
- Nettoyez le rat et sa fourrure autant que possible.
- Lorsque le réflexe de retrait de la pédale est retrouvé et que le rat a une respiration spontanée lorsqu’il est découplé du ventilateur, extuberez-le.
- Placez le rat dans une seule cage avec de la nourriture et de l’eau ad libitum. Placez la moitié de la cage sous une plaque chauffante et placez le rat dans cette zone de la cage.
- Effectuer une administration intrathécale en adaptant l’injecteur à port d’épingle à une seringue de précision et administrer le traitement à l’aide de l’adaptateur à hublot. Cette intervention est réalisable chez les animaux éveillés. Voir la figure 5.
8. Retrait de la sonde ICP (si elle n’est pas retirée pendant la chirurgie)
REMARQUE: Utilisez un microscope chirurgical à la discrétion du chirurgien.
- Placez le rat dans la chambre d’anesthésie comme décrit précédemment.
- Une fois anesthésié, placez le rat en décubitus dorsal dans le champ d’opération avec un coussin chauffant.
- Placez le nez dans le masque d’anesthésie. Fixer les niveauxd’O2 à 30 %, d’air atmosphérique à 70 % et d’isoflurane à 2 %.
- Appliquez continuellement le gel pour les yeux pour contrer les yeux secs.
- Couper la suture caudale simple interrompue. Ouvrez l’incision et retirez le tissu nécrotique ou les caillots sanguins possibles.
- Raccourcissez la sonde ICP autant que possible à l’aide d’un ciseau et collez l’extrémité pour éviter la fuite de liquide céphalorachidien (LCR). Fermez l’incision avec une suture monofilament 4-0 non résorbable.
- Éteignez l’isoflurane.
- Lorsque le rat commence à bouger, placez-le dans une seule cage avec de la nourriture et de l’eau ad libitum. Placez la moitié de la cage sur une plaque chauffante et placez le rat dans cette zone.
- Une fois ramenés à l’état habituel, réintroduire les animaux les uns aux autres dans une cage commune sous surveillance pendant les 15 premières minutes.
Résultats
Les femmes ont un risque accru d’HSAA par rapport aux hommes. Malgré cela, les rongeurs mâles sont principalement utilisés dans les expériences en raison du biais possible de l’hétérogénéité du cycle de l’oestrus chez les femelles. Les résultats représentatifs présentés ici proviennent d’une publication récente comparant les rats femelles et mâles, confirmant que le modèle produit des résultats similaires chez les animaux femelles par rapport aux rats mâles21. L’étude comprenait 34 rats Sprague-Dawley femelles (18 SEP et 16 simulacres). Shams n’a pas fait descendre l’aiguille vertébrale vers le chiasme optique ou injecté du sang. Toutes les autres procédures ont été effectuées sur Shams identique aux SEP. Tous les paramètres physiologiques entre les groupes étaient comparables. Enfin, une méta-analyse des données d’expériences antérieures sur les rats mâles a été effectuée et comparée aux résultats de la présente étude21.
L’essai des pôles tournants est un test de la fonction sensorimotrice globale. L’animal est placé sur une extrémité d’une perche de 150 cm sur 45 mm, qui peut pivoter jusqu’à 10 tr / min. L’objectif est d’atteindre l’extrémité du poteau où une cage est placée. Les rats HSA ont fait significativement pire aux jours 1 et 2, comparativement aux animaux fictifs sur le pôle rotatif (Figure 1).
Après l’HSA, les familles de récepteurs ET-1 et 5-HT sont régulées à la hausse dans les artères cérébrales, ce qui entraîne une contraction accrue lorsqu’elle est stimulée et contribue ainsi au SVC22,23. L’artère basilaire (BA) et les artères cérébrales moyennes (MCA) ont été retirées après décapitation et utilisées pour des expériences myographiques. L’endothéline 1 (ET-1), un agoniste de la famille des récepteurs ET-1, et la 5-carboxamidotryptamine (5-CT), un agoniste de la famille des récepteurs 5-HT, ont produit une contraction vasculaire significativement accrue dans l’HSA par rapport au simulacre (Figure 2). La sensibilité peut être observée par les concentrations plus faibles nécessaires pour provoquer une contraction après l’HSA chez les deux sexes.
L’augmentation de la teneur en eau (œdème) après l’HSA est une mesure du résultat fonctionnel réduit chez l’homme24. Une augmentation significative de l’œdème cérébral a été observée dans l’HSA par rapport au simulacre au jour 2. Il y avait aussi une tendance à l’augmentation de l’œdème dans l’hippocampe, mais cela n’était pas statistiquement significatif (p = 0,0508)21.
Lorsque l’on compare les données susmentionnées aux données historiques sur les hommes, les résultats sont comparables. Les métadonnées montrent une contractilité accrue chez les SEP masculins après l’ajout d’ET-1 ou de 5-CT (Figure 2). De plus, les rats HSA ont obtenu des résultats significativement moins bons que les rats simulés lors du test de la perche rotative. Le résultat a indiqué une diminution de la fonction sensorimotrice (Figure 1).
La figure 5A montre la distribution du sang autologue injecté après perfusion saline 30 minutes après l’induction de l’HSA. La figure montre que le sang a été distribué dans l’espace sous-arachnoïdien après injection pré-chiasmatique.
La figure 5B et la figure 5C montrent la distribution des colorants injectés par voie intrathécale, suivie d’une perfusion saline dans tout le corps pendant 30 minutes après l’injection. La figure 5B montre la distribution de 25 μL de 20 mM d’Evans Blue (soluble dans l’eau) et la figure 5C montre la distribution de 25 μL de 10 mM Oil Red O (insoluble dans l’eau). On a constaté que les deux colorants étaient distribués dans l’espace sous-arachnoïdien après l’injection dans la citerne magna, ce qui confirme qu’il s’agit d’un modèle réalisable d’injection intrathécale de composés solubles dans l’eau et insolubles. Il convient de noter la formation de dépôts autour des artères pour le composé insoluble dans l’eau.

Figure 1 : Analyse de la cognition sensori-motrice dans les 2 premiers jours suivant l’HSA chez les rats mâles et femelles. L’essai de la perche rotative a été effectué le jour 1 et le jour 2 après l’HSA. Les rats des deux sexes présentaient des déficits importants par rapport aux rats du même sexe exploités par des simulacres. Les différences statistiques de comportement entre les groupes ont été testées par ANOVA à 2 voies le jour 0, le jour 1 et le jour 2. Femelle sans rotation et 3 tours: p < 0,05. Femmes 10 tours et données sur tous les hommes: p < 0,01. Les valeurs sont des moyennes ± SEM. Republié avec la permission de Spray, S. et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
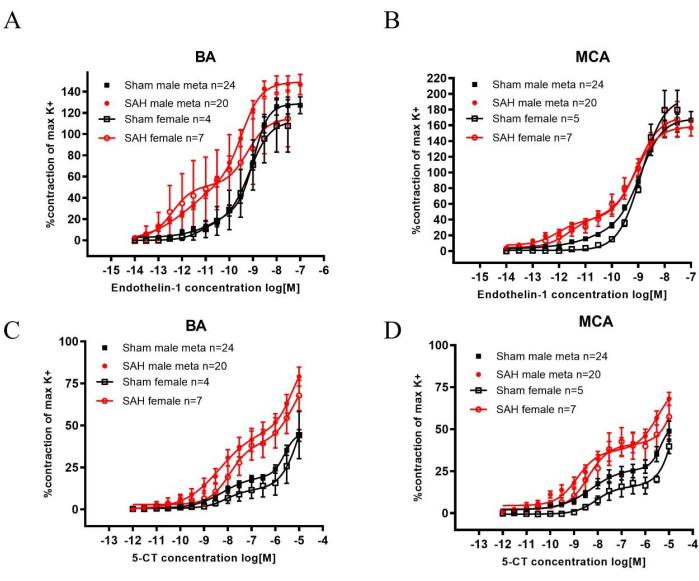
Figure 2 : Analyse de la sensibilité accrue aux contractions induites par ET-1 et 5-CT dans l’artère basilaire (BA) et l’artère cérébrale moyenne (MCA) 2 jours après l’HSA chez les rats mâles et femelles. (A,B) 60 mM de réponses contractiles évoquées par K+ (K+max) ont été utilisées comme valeurs de référence pour la normalisation des réponses induites par les agonistes. La sensibilité à ET-1 a été significativement augmentée 2 jours après l’HSA par rapport aux rats du même sexe opérés de manière simulée dans le BA et le MCA. (C, D) La sensibilité à la 5-TDM a été significativement augmentée 2 jours après l’HSA par rapport aux rats du même sexe opérés de manière simulée dans le BA et le MCA. Les courbes concentration-réponse ont été comparées statistiquement à l’ANOVA bidirectionnelle. Toutes les données: p < 0,001. Les valeurs sont des moyennes ± SEM. Republié avec la permission de Spray, S. et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Vue d’ensemble de la configuration avant l’induction de l’HSA. Du haut de l’image, notez que 1) l’aiguille d’injection, 2) la sonde laser-Doppler et 3) la sonde ICP sont toutes en place. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Trace de l’échantillon après injection intrathécale. Le graphique rouge montre la pression artérielle en mmHg. Le graphique bleu montre le PCI en mmHg et le graphique vert montre le CBF dans l’unité arbitraire FU. Le pic de PIC est le résultat d’une injection de sang. Notez que cela entraîne une baisse du CBF > 50% de la ligne de base pendant plus de 5 min. L’augmentation de l’ICP entraîne en outre une légère augmentation de la pression artérielle qui se normalise en quelques secondes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
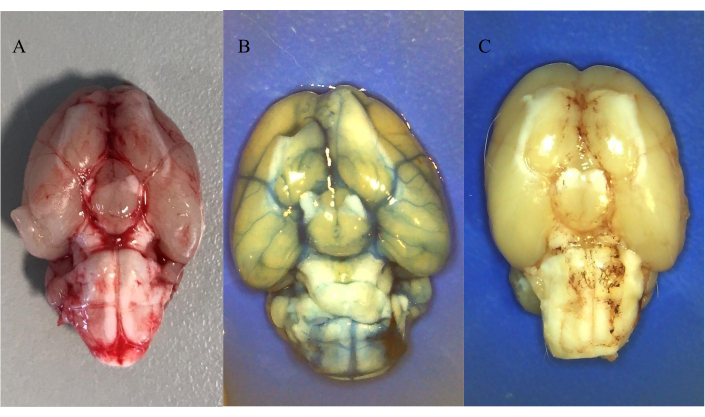
Figure 5 : Distribution du sang injecté par voie intrathétique et des colorants. (A) Distribution du sang autologue 30 min après l’induction de l’HSA. (B) Distribution de 25 μL de 20 mM Evans Blue après injection intrathécale par cathéter ICP. (C) Distribution de 25 μL de 10 mM d’Oil Red O après injection intrathécale par cathéter ICP. Tous les animaux ont été anesthésiés avec un mélange intrapéritonéal kétamine/xylazine suivi d’une perfusion saline. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le modèle pré-chiasmatique à injection unique de SAH imite plusieurs éléments importants de l’HSA humain, y compris le pic de la PIC, la réduction de la CBF, l’ischémie globale transitoire, la régulation positive des marqueurs neuroinflammatoires et CVS 14,15,16,18,19,20. La sonde ICP a également été utilisée comme orifice pour l’administration intrathécale (Figure 5). En outre, l’étude montre que le modèle fonctionne de manière similaire chez les animaux mâles et femelles21. Le modèle n’inclut pas le développement et la rupture ultérieure d’un anévrisme. Une gamme de modèles ont tenté de produire une HSA à partir d’un anévrisme rompu par induction d’hypertension systémique chirurgicale ou pharmacologique et en affaiblissant la paroi artérielle à l’aide d’élastase25,26,27. Toutes les tentatives ont produit une HSA anévrysmale chez un sous-ensemble d’animaux, mais ces modèles ont une variabilité inhérente, y compris l’incapacité de prédire quand l’anévrisme se rompra. Les modèles ne sont pas très adaptés à la recherche préclinique sur SAH18,28.
Parmi les autres modèles murins, SAH, le modèle de perforation endovasculaire comprend la rupture d’un vaisseau, imitant quelque peu la rupture d’un anévrisme, mais sujette à une variabilité et une mortalité élevées. Le modèle décrit ici est mieux traçable et plus reproductible car le volume sanguin est prédéterminé et la pression d’injection peut être contrôlée. Le modèle à double injection a une probabilité plus élevée de produire un SVC retardé, mais affecte principalement la circulation postérieure et comprend une deuxième injection de sang non physiologique. En comparaison, ce modèle ressemble à l’HSA chez l’homme car il s’agit d’une injection unique de la circulation antérieure et il produit une augmentation reproductible de la PIC18.
L’influence des différents régimes d’anesthésie sur l’HSA expérimentale n’est pas claire et les données expérimentales sont contradictoires. Une étude a rapporté une inhibition possible des cytokines et de la neuroinflammation générale dans un modèle de perforation endovasculaire chez la souris lors de l’utilisation d’inhalations d’isoflurane29. Un autre modèle de rongeurs a entraîné une réduction des paramètres respiratoires et une augmentation de l’œdème cérébral ainsi qu’une réduction du CBF régional lors de l’utilisation d’isofluranes30. Cependant, une méta-analyse comparant la mortalité dans des modèles murins n’a montré aucune différence de mortalité entre l’isoflurane et les autres types d’anesthésie31. En accord, le protocole ci-dessus a utilisé avec succès soit l’inhalation d’isoflurane, soit un mélange intrapéritonéal kétamine/xylazine avec des résultats similaires dans les deux groupes21.
Pour assurer une reproductibilité élevée et une acquisition correcte des données, l’accent est mis sur les étapes concernant le placement de l’équipement de surveillance. Le placement correct du cathéter de queue facilite la surveillance continue de la pression artérielle et la capacité d’effectuer des analyses de gaz du sang. Le placement correct du cathéter ICP garantit une surveillance correcte de l’ICP et la possibilité ultérieure d’intervention intrathécale. Un placement approprié de la sonde Laser-Doppler garantit que la réduction du CBF peut être surveillée, où une réduction de 50% ou moins du score de base pendant au moins 5 minutes après l’induction de l’HSA assure une forte ischémie32. En s’assurant que toutes les étapes de surveillance sont en ordre, le chercheur peut obtenir une collecte de données correcte après l’induction de l’HSA.
Le protocole décrit le modèle pré-chiasmatique d’injection unique de l’hémorragie sous-arachnoïdienne avec mises à jour et modifications. Le modèle a été utile pour la recherche sur les SEP et continuera probablement de contribuer à une meilleure compréhension de l’hémorragie sous-arachnoïdienne, y compris les lésions cérébrales précoces et l’ischémie cérébrale retardée.
Déclarations de divulgation
Les auteurs n’ont pas d’intérêts conflictuels à déclarer.
Remerciements
Le travail a été soutenu par la Fondation Lundbeck et la bourse d’excellence Lundbeck (n° R59-A5404). Les bailleurs de fonds n’ont joué aucun rôle dans aucune partie du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 16 G peripheral vein catheter | BD Venflon | 393229 | Needle shortened, distal 1 cm curved. Wings removed |
| Anesthesia bell/ chamber | Unknown | ||
| Blood gas analyzer | Radiometer | ABL80 | |
| Blood pressure (BP) monitor | Adinstruments | ML117 | Connects to Powerlab |
| Curved forceps, 12 cm x 3 | F.S.T | 11001-12 | For anesthesia |
| Cylindrical pillow, 28 cm x 4 cm | Homemade | Made from surgical towels | |
| Data acquisition hardware | Adinstruments | ML870 Powerlab | |
| Data acquistion software | Adinstruments | LabChart 6.0 | |
| Drill | KMD | 1189 | |
| Drill controller | Silfradent | 300 IN | |
| Flexible light | Schott | KL200 | |
| Heating pad | Minco | 1135 | |
| Hypodermic needle, 20 G | KD Medical | 301300 | Connects to stereotaxic frame |
| ICP monitor | Adinstruments | ML117 | Connects to Powerlab |
| Isoflurane vaporizer | Ohmeda | TEC3 | |
| Laptop | Lenovo | T410 | |
| Laser doppler monitor | Adinstruments | ML191 | |
| Laser doppler probe | Oxford Optronics | MSF100XP | Connects to laser doppler monitor |
| Needle holder, 13 cm | F.S.T | 12001-13 | For anesthesia |
| Precision syringe, 0.025 mL | Hamilton | 547407 | |
| Stereotaxic frame | Kopf Instruments | M900 | |
| Surgical microscope | Carl Zeiss | F170 | |
| Suture needle | Allgaier | 1245 | For anesthesia |
| Temperaure controller | CWE,INC. | TC-1000 | |
| Transducer x 2 | Adinstruments | MLT0699 | Connects to BP and ICP monitor |
| Ventilator | Ugo Basile | 7025 | |
| Veterinary clipper | Aesculap | GT421 | |
| 3-pronged Blair retractor, 13.5 cm | Agnthos | 17022--13 | |
| Blunt Alm retractor | F.S.T | 17008-07 | |
| Curved forceps, 12 cm x 2 | F.S.T | 11001-12 | |
| Needle holder, 13 cm | F.S.T | 12001-13 | |
| Straight Dumont forceps, 11 cm | F.S.T | 11252-00 | |
| Straight Halsted-Mosquito hemostat x 2 | F.S.T | 13008-12 | |
| Straight Iris scissor, 9 cm | F.S.T | 14090-09 | |
| Straight Vannas scissor, 10.5 cm | F.S.T | 15018-10 | |
| Absorpable swabs | Kettenbach | 31603 | |
| Black silk thread, 4-0, 5 x 15 cm | Vömel | 14757 | |
| Bone wax | Aesculap | 1029754 | |
| Carbomer eye gel 2 mg/g | Paranova | ||
| Cotton swab | Heinz Herenz | WA-1 | |
| Cotton tipped applicator x 4 | Selefa | 120788 | |
| Hypodermic needle, 23 G x2 | KD Medical | 900284 | Connects to stopcock. Remove distal end |
| Hypodermic needle, 23 G x3 | KD Medical | 900284 | Remove distal end. 2 connects to stopcock, 1 to syringe |
| ICP probe: | Homemade | Made of the following: | |
| Polythene tubing, 20 mm | Smiths medical | 800/100/200 | Inner diameter (ID): 0.58 mm, Outer diameter (OD): 0.96 mm. |
| Silicone tubing, 10 mm | Fisher | 15202710 | ID: 0.76 mm, OD: 2.4 mm. |
| Silicone tubing, 2 mm | Fisher | 11716513 | ID: 1.0 mm, OD: 3.0 mm. |
| Micro hematocrit tubes | Brand | 7493 11 | |
| OP-towel, 45 cm x75 cm | Mölnlycke | 800430 | |
| PinPort adapter, 22 G | Instech | PNP3F22 | |
| PinPort injector | Instech | PNP3M | |
| Polythene tubing, 2 x 20 cm | Smiths medical | 800/100/200 | Connects to syringe. ID: 0.58 mm, OD: 0.96 mm. |
| Rubberband | Unknown | ||
| Scalpel, 10 blade | Kiato | 23110 | |
| Spinalneedle, 25 G x 3.5'' | Braun | 5405905-01 | |
| Stopcock system, Discofix x 2 | Braun | 16494C | Connects to transducer |
| Suture, 4-0, monofil, non-resorbable x 3 | Ethicon | EH7145H | |
| Syringe, 1 mL | BD Plastipak | 1710023 | |
| Syringe, luer-lock, 10 mL x 4 | BD Plastipak | 305959 | Connects to transducer |
| Tissue adhesive glue | 3M | 1469SB | |
| 0.5% Chlorhexidine spirit | Faaborg Pharma | 210918 | |
| Carprofen 50 mg/mL | ScanVet | 43715 | Diluted 1:10 |
| Isoflurane | Baxter | ||
| Isotonic saline | Amgros | 16404 | |
| Lidocaine-Adrenaline 10 mg/5 µg/mL | Amgros | 16318 |
Références
- van Gijn, J., Kerr, R. S., Rinkel, G. J. Subarachnoid haemorrhage. Lancet. 369 (9558), London, England. 306-318 (2007).
- de Rooij, N. K., Linn, F. H. H., vander Plas, J. A., Algra, A., Rinkel, G. J. E. Incidence of subarachnoid haemorrhage: a systematic review with emphasis on region, age, gender and time trends. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12), 1365-1372 (2007).
- Feigin, V. L., Lawes, C. M., Bennett, D. A., Barker-Collo, S. L., Parag, V. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review. The Lancet, Neurology. 8 (4), 355-369 (2009).
- Maher, M., Schweizer, T. A., Macdonald, R. L. Treatment of spontaneous subarachnoid hemorrhage: guidelines and gaps. Stroke. 51 (4), 1326-1332 (2020).
- Pickard, J. D., et al. Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial. British Medical Journal (Clinical Research ed.). 298 (6674), 636-642 (1989).
- Daou, B. J., Koduri, S., Thompson, B. G., Chaudhary, N., Pandey, A. S. Clinical and experimental aspects of aneurysmal subarachnoid hemorrhage. CNS Neuroscience and Therapeutics. 25 (10), 1096-1112 (2019).
- Fujii, M., et al. Early brain injury, an evolving frontier in subarachnoid hemorrhage research. Translational Stroke Research. 4 (4), 432-446 (2013).
- Roos, Y. B., et al. Complications and outcome in patients with aneurysmal subarachnoid haemorrhage: A prospective hospital based cohort study in the Netherlands. Journal of Neurology, Neurosurgery, and Psychiatry. 68 (3), 337-341 (2000).
- Vergouwen, M. D. I., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 41 (10), 2391-2395 (2010).
- Brown, R. J., Kumar, A., Dhar, R., Sampson, T. R., Diringer, M. N. The relationship between delayed infarcts and angiographic vasospasm after aneurysmal subarachnoid hemorrhage. Neurosurgery. 72 (5), 702-707 (2013).
- Dhar, R., et al. Relationship between angiographic vasospasm and regional hypoperfusion in aneurysmal subarachnoid hemorrhage. Stroke. 43 (7), 1788-1794 (2012).
- Macdonald, R. L. Delayed neurological deterioration after subarachnoid haemorrhage. Nature Reviews. Neurology. 10 (1), 44-58 (2014).
- Marbacher, S., et al. Systematic review of in vivo animal models of subarachnoid hemorrhage: species, standard parameters, and outcomes. Translational Stroke Research. 10 (3), 250-258 (2019).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. -A. A new experimental model in rats for study of the pathophysiology of subarachnoid hemorrhage. Neuroreport. 13 (18), 2553-2556 (2002).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52 (1), 165-176 (2003).
- Prunell, G. F., et al. Experimental Subarachnoid Hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54 (2), 426-437 (2004).
- Velthuis, B. K., et al. Subarachnoid hemorrhage: Aneurysm detection and preoperative evaluation with CT angiography. Radiology. 208 (2), 423-430 (1998).
- Leclerc, J. L., et al. A comparison of pathophysiology in humans and rodent models of subarachnoid hemorrhage. Frontiers in Molecular Neuroscience. 11, 71(2018).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Inflammation in the brain after experimental subarachnoid hemorrhage. Neurosurgery. 56 (5), 1082-1091 (2005).
- Prunell, G. F., Svendgaard, N. A., Alkass, K., Mathiesen, T. Delayed cell death related to acute cerebral blood flow changes following subarachnoid hemorrhage in the rat brain. Journal of Neurosurgery. 102 (6), 1046-1054 (2005).
- Spray, S., Haanes, K. A., Edvinsson, L., Johansson, S. E. Subacute phase of subarachnoid haemorrhage in female rats: increased intracranial pressure, vascular changes and impaired sensorimotor function. Microvascular Research. 135, 104127(2020).
- Ansar, S., Vikman, P., Nielsen, M., Edvinsson, L. Cerebrovascular ETB, 5-HT1B, and AT1 receptor upregulation correlates with reduction in regional CBF after subarachnoid hemorrhage. American Journal of Physiology - Heart and Circulatory Physiology. 293 (6), 3750-3758 (2007).
- Hansen-Schwartz, J., et al. Subarachnoid hemorrhage enhances endothelin receptor expression and function in rat cerebral arteries. Neurosurgery. 52 (5), 1188-1194 (2003).
- Hayman, E. G., Wessell, A., Gerzanich, V., Sheth, K. N., Simard, J. M. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage. Neurocritical Care. 26 (2), 301-310 (2017).
- Miyata, H., et al. Vasa vasorum formation is associated with rupture of intracranial aneurysms. Journal of Neurosurgery. , 1-11 (2019).
- Tada, Y., et al. Roles of hypertension in the rupture of intracranial aneurysms. Stroke. 45 (2), 579-586 (2014).
- Nuki, Y., et al. Elastase-induced intracranial aneurysms in hypertensive mice. Hypertension. 54 (6), Dallas, Tex. 1337-1344 (1979).
- Marbacher, S., Wanderer, S., Strange, F., Grüter, B. E., Fandino, J. Saccular aneurysm models featuring growth and rupture: A systematic review. Brain Sciences. 10 (2), 101(2020).
- Altay, O., et al. Isoflurane on brain inflammation. Neurobiology of Disease. 62, 365-371 (2014).
- Hockel, K., Trabold, R., Schöller, K., Török, E., Plesnila, N. Impact of anesthesia on pathophysiology and mortality following subarachnoid hemorrhage in rats. Experimental and Translational Stroke Medicine. 4 (1), 5(2012).
- Kamp, M. A., et al. A Systematic and meta-analysis of mortality in experimental mouse models analyzing delayed cerebral ischemia after subarachnoid hemorrhage. Translational Stroke Research. 8 (3), 206-219 (2017).
- Povlsen, G. K., Johansson, S. E., Larsen, C. C., Samraj, A. K., Edvinsson, L. Early events triggering delayed vasoconstrictor receptor upregulation and cerebral ischemia after subarachnoid hemorrhage. BMC Neuroscience. 14, 34(2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon