Method Article
Генерация индуцированных плюрипотентных стволовых клеток из фетальных клеток синдрома Тернера (45XO) для последующего моделирования неврологического дефицита, связанного с синдромом
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает генерацию свободных от интеграции ИПСК из фибробластов тканей плода путем доставки эписомальных плазмид путем нуклеофекции с последующим описанием методов, используемых для характеристики iPSC и дифференцировки нейронов.
Аннотация
Хромосомные анеуплоидии вызывают тяжелые врожденные пороки развития, включая пороки развития центральной нервной системы и гибель плода. Пренатальный генетический скрининг является чисто диагностическим и не проясняет механизм заболевания. Хотя клетки анеуплоидных плодов являются ценным биологическим материалом, несущим хромосомную анеуплоидию, эти клетки недолговечны, что ограничивает их использование для последующих исследовательских экспериментов. Генерация моделей индуцированных плюрипотентных стволовых клеток (iPSC) является эффективным методом подготовки клеток к постоянному сохранению анеуплоидных признаков. Они самообновляются и дифференцируются в специализированные клетки, напоминающие эмбриональное развитие. Таким образом, ИПСК служат отличными инструментами для изучения событий раннего развития. Синдром Тернера (TS) является редким состоянием, связанным с полностью или частично отсутствующей Х-хромосомой. Синдром характеризуется бесплодием, невысоким ростом, эндокринными, метаболическими, аутоиммунными и сердечно-сосудистыми нарушениями и нейрокогнитивными дефектами. Следующий протокол описывает выделение и культивирование фибробластов из ткани плода TS (45XO), генерацию свободных от интеграции TSiPSCs путем доставки эписомальных перепрограммированных плазмид путем нуклеофекции с последующей характеристикой. Перепрограммирование TSiPSCs первоначально было проверено окрашиванием щелочной фосфатазой живых клеток с последующим обширным прощупыванием биомаркеров плюрипотентности. Отобранные колонии механически рассекались, проходили несколько раз и для дальнейших экспериментов использовались устойчивые самообновляющиеся клетки. В клетках экспрессировались факторы транскрипции плюрипотентности OCT4, NANOG, SOX2, маркеры клеточной поверхности SSEA 4 и TRA1-81, характерные для плюрипотентных стволовых клеток. Оригинальный кариотип 45XO был сохранен после перепрограммирования. TSiPSCs смогли сформировать эмбриоидные тела и дифференцироваться в клетки эндодермы, мезодермы и эктодермы, экспрессируя специфические биомаркеры линии ((SRY BOX17), (MYOSIN ЖЕЛУДОЧКОВЫЙ ТЯЖЕЛЫЙ CHAINα/β), (βIII TUBULIN)). Экзогенные эписомальные плазмиды были потеряны спонтанно и не обнаружены после прохождения 15 в клетках. Эти TSiPSCs являются ценным клеточным ресурсом для моделирования дефектного молекулярного и клеточного нервного развития, вызывающего нейрокогнитивный дефицит, связанный с синдромом Тернера.
Введение
Анеуплоидии приводят к врожденным дефектам / врожденным порокам развития и потере беременности у людей. ~ 50%-70% образцов от потерь беременности показывают цитогенетические аномалии. Анеуплоидные эмбрионы, потерянные на ранних сроках беременности, не могут быть легко получены для экспериментального анализа, что свидетельствует о необходимости разработки других моделей, близко представляющих эмбриогенез человека. Индуцированные плюрипотентные стволовые клетки (ИПСК), полученные из клеток с диагнозом генетических нарушений, были использованы для моделирования репрезентативных генетических нарушений и их последствий для развития плода1,2,3,4. Эти ИПСК напоминают клетки эпибластов развивающегося эмбриона и могут рекапитулировать ранние события формирования эмбриона. Они позволяют понять и охарактеризовать программу развития клеточных линий и паттернов у ранних эмбрионов млекопитающих. иПСК, полученные ранее из фибробластов кожи и амниоцитов из пренатальных диагностических тестов синдромов анеуплоидии, таких как моносомия X (синдром Тернера), трисомия 8 (синдром Варкани 2), трисомия 13 (синдром Патау) и частичная трисомия 11; 22 (синдром Эмануэля) предоставили ценную информацию о неудачном развитии4.
Синдром Тернера (ТС) является редким состоянием, характеризующимся женским бесплодием, невысоким ростом, эндокринными и метаболическими нарушениями, повышенным риском аутоиммунных заболеваний и предрасположенностью к сердечно-сосудистым заболеваниям5. Хотя это единственный выживающий синдром моносомии, он также смертелен для развивающегося эмбриона, вызывая самопроизвольный аборт6. Выжившие особи с ТС присутствуют со степенями изменения X-хромосомного материала в своих клетках. Кариотипы варьируются от полной потери одной Х-хромосомы (45,XO) до мозаики, такой как 45,XO/46,XX; 45,XO/47,XXX, наличие кольцевых хромосом, наличие Y-хромосомного материала и т.д.5.
Диагностика синдрома обычно проводится путем кариотипирования крови симптоматических лиц и забора ворсинок хориона (CVS) для выявления синдромов ранней анеуплоидии. Поскольку синдромы анеуплоидии составляют ~ 30% самопроизвольных абортов, кариотипировать продукт зачатия (POC) при самопроизвольном аборте является обычным делом. Эти клетки плода, включая ворсинки хориона, обладающие цитогенетической аномалией, и полученные из них ИПСК, обеспечивают ценный источник биологического материала для изучения синдромов анеуплоидии4,6. TS iPSCs были ранее установлены из амниоцитов с помощью ретровирусного перепрограммирования4,фибробластов хорионических ворсинок (полученных путем пренатальной диагностики) путем ретровирусного перепрограммирования6,из мононуклеарных клеток крови7 через перепрограммирование вируса Сендай и из фибробластов кожи лиц TS через лентивирусное перепрограммирование4 . Поскольку основной задачей нашей лаборатории является понимание неудач в развитии, мы создали TS iPSC из POC, в частности, компонент ворсинок хориона самопроизвольного аборта8. Все клетки, выделенные из этой ткани плода, имели кариотип 45XO и давали ИПСК с тем же кариотипом. Эти ИПСК уникальны, поскольку они первыми генерируются абортированным плодом и обеспечивают ценный ресурс для изучения сбоев беременности, связанных с анеуплоидией. В этой статье представлена подробная методология генерации ИПСК из этого уникального источника клеток посредством эписомального перепрограммирования.
Ранние методы генерации iPSC использовали вирусную трансдукцию и транспозоны для доставки факторов перепрограммирования. Методы индуцирования клеток к плюрипотентности эволюционировали от использования интегрируемых ретровирусных векторов9,подакцизных лентивирусных векторов10,11 и транспозонных методов12 к неинтеграционируемым аденовирусным векторам13 и векторам на основе вируса Сендай14. Ретровирусное и лентивирусное перепрограммирование, хотя и эффективное, включает интеграцию факторов перепрограммирования в хромосомы хозяина, вызывая мутации вставки, которые имеют непредвиденные эффекты в иПСК. Кроме того, вирусное перепрограммирование предотвращает трансляционный применение иПСК. Системы15 на основе РНК и прямая доставка белка16 были исследованы для полного устранения потенциальных рисков, связанных с использованием вирусов и трансфекций ДНК. Однако эти методы оказались неэффективными.
В 2011 году Okita et al. сообщили об улучшении эффективности перепрограммирования эписомальными плазмидами, дополненными подавлением TP53 через шРНК. Они также заменили cMYC на нетрансформирующий LMYC (МЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО, ассоциированный MYC) для повышения безопасности hiPSCs. Эти эписомальные плазмиды экспрессуют 5 факторов перепрограммирования: OCT4, LIN28, SOX2, KLF4, LMYC и шРНК для TP5317,18. Эти векторы поддерживаются внехромосомно и теряются из перепрограммированных клеток при непрерывной культуре, что делает линии свободными от трансгенов в течение 10-15 проходов. Нуклеофекция представляет собой специализированную форму электропорации, которая доставляет нуклеиновые кислоты непосредственно в ядро клеток-хозяев. Это эффективный метод доставки перепрограммированных плазмид в различные типы клеток. Эписомальные плазмиды экономически эффективны и компенсируют высокие затраты на нуклеофекцию. Этот метод эффективен и воспроизводим в оптимизированных условиях, что дает стабильные ИПСК из различных соматических клеток. В этом протоколе описан способ генерации иПСК из фибробластов, выделенных из ткани плода нуклеофекции эписомальных перепрограммированных плазмид. Вот подробные протоколы выделения фибробластов из ворсин хориона плода, очистки плазмид, нуклеофекции, отбора колоний из перепрограммируемой пластины и установления стабильных иПСК.
Важно подтвердить наличие признаков плюрипотентности во вновь генерируемых иПСК. Это включает в себя демонстрацию факторов, связанных с плюрипотентностью (например, экспрессия щелочной фосфатазы, NANOG, SSEA4, Tra 1-80, Tra 1-81, E-кадгерин; обычно показан с помощью иммунофлуоресценции или анализов экспрессии генов), идентификацию трех зародышевых слоев с помощью анализов дифференцировки in vitro для проверки их потенциалов дифференцировки, кариотипирование для определения хромосомного содержания, типирование STR для установления идентичности с родительскими клетками, проверку потери экзогенных генов, и более строгие анализы in vivo, такие как образование тератомы и тетраплоидная комплементация. Здесь описываются протоколы характеризации кариотипирования, окрашивания щелочной фосфатазы живых клеток, обнаружения связанных с плюрипотентностью биомаркеров иммунофлуоресценцией, анализов дифференцировки in vitro и метода демонстрации потери экзогенных генов19.
протокол
FCV были получены из больницы Манипал, Бангалор, в соответствии с одобрением Комитета по этике больниц Манипала.
ПРИМЕЧАНИЕ: Состав всех буферов и растворов см. в таблице 1.
1. Выделение фибробластов из ворсин хориона плода (FCV)
-
Забор проб и распад тканей в коллагеназе
- Сбор FCV в стерильных условиях в фосфатно-буферном физиологическом растворе (PBS) и транспортировка (при комнатной температуре) в клеточную культуру.
- Переложите ворсинки на посуду Петри 60 мм и вымойте несколько раз (минимум 4 раза) в PBS, содержащей 1x Антимикотический раствор антибиотика (PBS-AA). Полностью удалите PBS-AA путем пипетки.
- Обработайте ворсинки хориона смесью коллагеназы 1 мл (5 мг/мл) в течение 5 мин при 37 °C.
- Нейтрализуют клеточной культуральной средой, содержащей 10% фетальной быцкой сыворотки (FBS), переложат переварить в пробирку объемом 15 мл и центрифугу при 225 х г в течение 5 минут для сбора распавленных ворсинок и высвобождают клетки в виде гранулы.
-
Расширение субкультуры и фондового запаса
- Пластинчатые распавляющиеся ворсинки вместе с высвобождаемыми клетками в колбе культуры Т25, содержащей 5 мл полной среды (например, AmnioMAX) и растут до получения сливаемой культуры фибробластов.
- Расширить фибробласты в культуре для подготовки запасов для использования в последующих экспериментах по трансфекции и характеристике следующим образом:
- Добавьте 2 мл 0,05% трипсина в колбу T25, содержащую фибробласты FCV, и инкубируют при 37 °C в течение 3-5 мин для диссоциации клеток.
- После инкубации нейтрализуют трипсин путем добавления FBS (в том же объеме, что и трипсин).
ПРИМЕЧАНИЕ: Культуральная среда, содержащая FBS, также может быть использована для нейтрализации трипсина при добавлении в соотношении 1:3 трипсин: среда. - Соберите диссоциированные клетки в трубку 15 мл и центрифугу при 225 х г в течение 5 мин для получения клеточной гранулы.
- Декант супернатант и гранула повторного суспендирования в 1 мл полной среды.
- Переложите по 500 мкл на каждую ткань обработанной культурой посуды и долейте объем до 5 мл. Это соотношение расщепления 1:2 также использовалось для последующих проходов.
-
Криоконсервация
- Выполняют ферментативную диссоциацию с использованием 0,05% трипсина, как описано в шагах 1.2.2.1 - 1.2.2.3, и получают клеточную гранулу.
- Откажитесь от супернатанта и повторно суспендировать клеточную гранулу в 1 мл морозильной смеси, содержащей 1:9 диметилсульфоксид (DMSO): FBS.
- Переложите содержимое в стерильный криовиал и поместите флакон в морозильную емкость.
- Заморозить на ночь при -80 °C, а затем перевести флаконы в жидкий азот (-196 °C) на следующий день.
2. Выделение и верификация ДНК плазмид
-
Бактериальный клеточный препарат
- Полосы глицериновых запасов E. coli, содержащие три отдельные плазмиды pCXLE-hOCT3/4-shp53-F, pCXLE-hSK и pCXLE-hUL (из Addgene) на отдельных пластинах агаров Luria Bertani-ampicillin.
- Инокулируют одиночные колонии в заквасочные культуры 5 мл среды Лурия Бертани-ампициллина. Инкубировать в течение 8 часов при 37 °C с встряхиванием (10 х г).
- Инокулируют 200 мкл этой закваски в 100 мл среды Лурия Бертани-ампициллина. Насиживать на ночь при 37 °C с встряхиванием.
- Собирают ночной бактериальный культивирование центрифугированием при 6000 х г в течение 15 мин при 4 °C.
-
Изоляция плазмид с помощью комплекта для очистки плазмид Midi
- Ресуспендирование бактериальной гранулы в буфере ресуспензии 4 мл.
- Добавьте 4 мл лизисного буфера и тщательно перемешайте, энергично инвертируя 4-6 раз и инкубируя при комнатной температуре в течение 5 мин.
- Добавьте 4 мл предварительно охлажденного нейтрализуемого буфера и инвертируемую трубку 4-6 раз тщательно перемешайте. Насиживать на льду в течение 15 мин.
- Центрифуга при ≥20 000 х г в течение 30 мин при 4 °C. Соберите супернатант в свежем тюбике и повторно центрифугировать при ≥20 000 х г в течение 15 мин при 4 °C.
- Уравновешивайте столбец, применяя 4 мл буфера равновесия.
- Примените супернатант к столбцу.
- Дважды вымойте колонну 10 мл промывного буфера.
- Элюированная ДНК с 5 мл теплого (65 °C) буфера элюации.
- Осаждение ДНК путем добавления 3,5 мл изопропанола к элюированной ДНК. Хорошо перемешать. Центрифуга при ≥15 000 х г в течение 30 мин при 4 °C. Декант супернатант осторожно.
- Промыть гранулу ДНК 2 мл 70% этанола и центрифугу при ≥15 000 х г в течение 10 мин. Декант супернатант осторожно.
- Воздушно-сухую гранулу в течение 5-10 мин и растворяют ДНК в подходящем объеме воды класса ПЦР для получения конечной концентрации 1 мкг/мл.
ПРИМЕЧАНИЕ: Не растворяйте ДНК в буферах, так как она не подходит для электропорации. Старые препараты плазмидной ДНК не дают перепрограммированных колоний.
-
Проверка плазмид с помощью рестрикции пищеварения EcoRI
- Объедините 15 мкл воды без нуклеазы, 2 мкл 10x буфера, 1 мкг плазмидной ДНК и 1 мкл фермента EcoRI. Аккуратно перемешать.
- Инкубировать смесь при 37 °C в течение 15 мин в тепловом блоке.
- Смешайте переваренные образцы плазмиды с 6-кратным красителем, нагружающим ДНК-гель, и электрофорезом на 1% агарозном геле в 1x буфере TAE с 0,5 мкг/мл бромида этидия. Включите стандартную лестницу ДНК. Визульсии на гель после того, как ДНК разрешилась соответствующим образом. Ожидаемые размеры диапазона EcoRI pCXLE-hOCT3/ 4-shp53-F составляют 6 834 bp, 3 758 bp и 1 108 bp; pCXLE-hUL составляют 10 200 bp и 1 900 bp; pCXLE-hSK составляют 10 200 bp и 2 500 bp.
3. Нуклеофекция
-
Гранулирование клеток
- Культивировать изолированные фибробласты ворсин хорионовых ворсин плода в колбу Т25 в 5 мл полной среды до 80-90% стечения.
- Дважды промыть ячейки PBS и трипсинизировать, как описано на этапах 1.2.2.1 - 1.2.2.3.
- Удалите супернатант, повторно суспендированную гранулу в 5 мл восстановленной сывороточной среды (например, Opti-MEM). Подсчитайте клетки с помощью гемоцитометра и возьмите10 6 клеток для нуклеофекции. Центрифуга при 225 х г в течение 5 мин. Удалите супернатант полностью.
-
Подготовка реагентов и нуклеофекция
- Готовят реагент нуклеофектора путем смешивания 0,5 мл добавки и 2,25 мл раствора нуклеофектора (оба в комплекте).
- Добавьте 100 мкл раствора нуклеофектора в пробирку 1,5 мл. Добавьте в трубку по 1 мкг pCXLE-hOCT3/4-shp53-F, pCXLE-hSK и pCXLE-hUL. Осторожно повторно суспендируйте 106 клеток (из шага 3.1.2) в этой смеси.
- Перенесите суспензию клеточной ДНК в кювету, убедившись, что образец покрывает дно кюветы (входит в комплект) без каких-либо пузырьков воздуха. Заткнуть кювету крышкой и вставить в держатель. Выберите нуклеофекторную программу U-23 (для высокой эффективности) и примените.
- Выньте кювету из держателя и добавьте 1 мл полной среды. Аккуратно перенесите содержимое в 60 мм обработанную культурой ткани чашку Петри, заполненную 4 мл полной среды (в общей сложности 5 мл среды). Инкубировать клетки в увлажненный инкубатор CO2 при 37 °C.
- Через 24 ч проверьте, не прикреплены ли ячейки. Замените носитель полностью.
ПРИМЕЧАНИЕ: Скорость гибели клеток высока при нуклеофекции, оставляя несколько жизнеспособных клеток, которые прикрепляются. - Поддерживайте клетки в полной среде в течение 10 дней и переходите на плюрипотентные среды в течение следующих 20 дней.
ПРИМЕЧАНИЕ: Регулярно визуализируйте клетки, чтобы следить за морфологическими изменениями, происходящими в перепрограммируемых клетках (такими как морфология эпителия и образование компактных колоний), чтобы подтвердить, работает ли эксперимент. Около 25 колоний iPSC можно увидеть после 20 дней культуры в плюрипотентных средах.
4. Сбор и размножение колоний iPSC
-
Сбор колонии из перепрограммированной пластины
- Вручную рассекают колонии, подобные эмбриональным стволовым клеткам, образующиеся в чашке для перепрограммирования, используя вытянутые стеклянные пипетки или иглы шприца 1 мл, и переносят на предварительно приготовленную пластину с инактивированными эмбриональными фибробластами мыши со средой плюрипотентности или устанавливают свободные от кормушки культуры на пластинах с покрытием Matrigel со средой mTESR.
ПРИМЕЧАНИЕ: Эмбриональные фибробласты мышей (MEF) были получены с использованием ферментативной изоляции из эмбрионов мышей (рассеченных на 13-14 день беременности самками мышей) и были митотически инактивированы лечением митомицином С. Создавайте популяции одиночных клонов, выращивая одиночные колонии из перепрограммируемой тарелки в отдельные чашки или смешанные популяции клонов, перемещая множество колоний с перепрограммируемой тарелки на одну тарелку.
- Вручную рассекают колонии, подобные эмбриональным стволовым клеткам, образующиеся в чашке для перепрограммирования, используя вытянутые стеклянные пипетки или иглы шприца 1 мл, и переносят на предварительно приготовленную пластину с инактивированными эмбриональными фибробластами мыши со средой плюрипотентности или устанавливают свободные от кормушки культуры на пластинах с покрытием Matrigel со средой mTESR.
-
Механическая передача возникающих колоний в свежие кормушки и пассирование для создания стабильных ИПСК
- Размножают иПСК в среде плюрипотентности, кормя каждый второй день и разделяя 1:3 каждые 5-7 дней. Готовят бульбы путем криоконсервации в морозильной смеси KnockOut Serum Replacement и DMSO в соотношении 9:1.
ПРИМЕЧАНИЕ: KnockOut Serum Replacement используется в смеси замораживания для криоконсервации иПСК вместо FBS, поскольку компоненты в FBS могут индуцировать дифференцировку плюрипотентных клеток при длительном сохранении.
- Размножают иПСК в среде плюрипотентности, кормя каждый второй день и разделяя 1:3 каждые 5-7 дней. Готовят бульбы путем криоконсервации в морозильной смеси KnockOut Serum Replacement и DMSO в соотношении 9:1.
5. Характеристика ИПСК
ПРИМЕЧАНИЕ: Исследования характеристик, включая ПЦР и иммуноокрашивание биомаркера плюрипотентности, проводились после пятого проходного номера. Кариотипирование было выполнено под более поздним номером прохода.
- Кариотипирование
- Обработать 60-миллиметровую чашку Петри из иПСК колцемидом в течение 45 мин в увлажненном инкубатореСО2 при 37 °C.
- Собирают 0,05% трипсина обработкой и центрифугой. Удалите надпотоплив и пипетку с оставшимися следами среды, чтобы ослабить ячейку гранулы.
- Добавить 5 мл гипотонического раствора. Перемешать путем инвертирования и инкубировать в течение 20 минут при 37 °C. Центрифуга при 225 х г в течение 5 мин.
ПРИМЕЧАНИЕ: Полученная гранула должна казаться пушистой. - Медленно добавьте 2,5 мл фиксаторного раствора Карной, одновременно постукивая, чтобы ослабить гранулу.
- Подготовьте спреды для кариотипирования, опустив клеточную суспензию на чистые стеклянные горки.
- Обработайте слайды 0,15% трипсином в течение 1 минуты и вымойте один раз PBS. Затем окрашивают раствором Гиемса в течение 4 мин и заканчивают промывкой дистиллированной водой. Приобретайте и обрабатывайте с помощью соответствующего программного обеспечения.
- Демонстрация статуса свободного от трансгенов
-
Выделение геномной ДНК
- Пипетка 20 мкл протеазы в дно микроцентрифужной трубки 1,5 мл.
- Добавьте 200 мкл TSiPSCs, повторно суспендированных в PBS, в микроцентрифужную трубку.
- Добавьте к образцу 200 мкл буферного AL и перемешайте в течение 15 с путем импульсно-вихревого.
- Инкубировать в течение 10 мин при 56 °C.
- Кратковременно центрифугировать трубку микроцентрифуги, чтобы удалить капли с внутренней стороны крышки.
- Добавьте 200 мкл этанола (96-100%) в образец и снова перемешайте в течение 15 с путем импульсно-вихревого. После перемешивания ненадолго центрифугируют трубку, чтобы удалить капли с внутренней стороны крышки.
- Осторожно нанесите смесь с предыдущей ступени на мини-отжимную колонну (в коллекторной трубке 2 мл), не смачивая обод. Закройте колпачок и центрифугу при 6000 х г в течение 1 мин. Выбросьте трубку, содержащую фильтрат, и поместите мини-отжимную колонну в чистую трубку для сбора 2 мл.
- Осторожно откройте мини-колонку отжима и, не смачивая обод, добавьте 500 мкл буфера AW1. Закройте колпачок и центрифугу при 6000 х г на 1 мин. Поместите мини-отжимную колонну в чистую трубку для сбора 2 мл и выбросьте трубку для сбора, содержащую фильтрат.
- Осторожно откройте мини-колонку отжима и добавьте 500 мкл буфера AW2, не смачивая обод. Закройте крышку и центрифугу на полной скорости (20 000 х г) на 3 мин.
- Поместите мини-отжимную колонну в новую коллекционную трубку 2 мл и выбросьте старую коллекционную трубку с фильтратом. Центрифуга на полной скорости в течение 1 мин исключает вероятность возможного переноса буфера AW2.
- Поместите мини-отжимную колонну в чистую микроцентрифужную трубку 1,5 мл и выбросьте сборную трубку, содержащую фильтрат. Осторожно откройте мини-отжимную колонну и добавьте 200 мкл буфера AE или дистиллированной воды. Инкубируют при комнатной температуре (15-25 °С) в течение 5 мин, а затем центрифугу при 6000 х г в течение 1 мин.
-
ПЦР без трансгенного статуса (с использованием набора KAPA HiFi PCR KR0368)
- Убедитесь, что все реагенты правильно разморожены и перемешаны.
- Приготовьте мастер-смесь ПЦР, содержащую соответствующий объем всех реакционных компонентов на основе таблицы 2 (настройте реакции на льду).
- Перенесите соответствующие объемы мастер-смеси, шаблона и праймера ПЦР в отдельные трубки ПЦР.
- Заколочены отдельные реакции, кратко перемешивают и центрифугируют.
- Выполните ПЦР по таблице 3.
-
Выделение геномной ДНК
- Идентификация биомаркеров плюрипотентности
-
Окрашивание щелочной фосфатазой (AP)
- Приготовьте 1x AP живого рабочего раствора, разбавляя 3 мкл 500x запасного раствора в 1,5 мл DMEM/F-12 на каждые 10см2 посевной площади.
- Извлеките носитель из блюда iPSC для культуры. Вымойте культуру DMEM/F-12 один раз. Добавьте 1x AP живой пятен раствор на iPSCs. Инкубировать при 37 °C в течение 45 мин.
- Удалите пятно AP и дважды смойте DMEM/F-12. Добавьте свежий DMEM/F-12 и изображение под флуоресцентным микроскопом с помощью стандартного фильтра FITC в течение 30-90 минут после окрашивания.
-
Иммуноокрашивание для биомаркеров плюрипотентности
- Зафиксируйте слежки iPSC культур с 4% параформальдегидом на ночь при 4 °C. Трижды мойте pBS Tween 20 (PBST), каждую стирку в течение 5 минут.
- Пермеабилизируют клетки 0,3% тритоном Х-100 в ПБСТ в течение 15 минут при комнатной температуре. Трижды промыть ПБСТ.
ПРИМЕЧАНИЕ: Пермеабилизацию следует проводить только для внутриклеточных антигенов. - Блокируйте клетки с 3% бычным сывороточным альбумином (BSA) в PBST в течение 30 мин при комнатной температуре. Окрашивают клетки первичными антителами (разбавленными 1:1000 в 1% BSA) на ночь. После первичной инкубации антител трижды промыть ПБСТ.
- Инкубировать клетки с вторичным антителом (разбавленным 1:1000 в 1% BSA) в течение 5 ч при комнатной температуре. Трижды промыть ПБСТ.
- Метьте ядра 0,5 мкг/мл 4',6-диамидино-2-фенилиндол (DAPI) в течение 1 минуты. Промыть ячейки один раз с PBST.
- Захват изображений под флуоресцентным микроскопом.
-
Окрашивание щелочной фосфатазой (AP)
6. Анализы дифференцировкиin vitro
- Дифференциация эмбриониозного тела (EB)
- Колонии iPSC разрезать на мелкие кусочки, собрать и разбить в чашки Петри с низким прикреплением в эмбриоидной среде тела. Выращивайте клетки в течение 15 дней, заменяя среду каждые 3 дня.
ПРИМЕЧАНИЕ: День 15 ЭБ может быть использован непосредственно для обнаружения трех биомаркеров зародышевого слоя. Альтернативно, специфические клеточные линии могут быть индуцированы факторами роста с последующим обнаружением биомаркеров.
- Колонии iPSC разрезать на мелкие кусочки, собрать и разбить в чашки Петри с низким прикреплением в эмбриоидной среде тела. Выращивайте клетки в течение 15 дней, заменяя среду каждые 3 дня.
- Дифференцировка эндодермы (гепатоцитов)
- Выращивайте иПСК в однослойных культурах в среде плюрипотентности.
- После слияния переходят на rpmI 1640 среды с 1x инсулином трансферрином селенитом и 100 нг/мл активина А в течение 2 дней с последующим ростом в средах RPMI 1640 с 30 нг/мл bFGF и 20 нг/мл BMP4 в течение 9 дней. Заменяйте средний каждые 2 дня.
- Начиная с 10-го дня, добавляем в среду 0,1 мкМ дексаметазона. Завершите эксперимент на 20-й день.
- Дифференцировка мезодермы (кардиомиоцитов)
- Пластина день 8 ЭБ на пластинах с 0,5% покрытием Матригелем в эмбриоидной среде тела. Разрешите ЭБ присоединяться и сворачиваться.
- Дополнить 20 нг/мл BMP4 и расти в течение 20 дней. Заменяйте среду каждые 2-3 дня. Завершите эксперимент на 20-й день.
- Эктодермная (нейрональная) дифференциация
- Пластина день 4 ЭБ на 2 мкг/см2 коллагеновых пластинах iv типа в эмбриоидной среде тела. Разрешите ЭБ присоединяться и сворачиваться.
- На следующий день переключите среду на DMEM F-12 с 2 мг / мл глюкозы, 1x инсулина трансферрина селенита и 2,5 мкг / мл фибронектина. Завершите эксперимент на 15-й день.
- Образование церебральных органоидов
- Выращивайте ЦИПСК в 35 мм чашке для культуры тканей на MEF до 70-80% конфюлюента. Колонии разрезать и собрать в пробирку по 15 мл. Центрифугировать ячейки при 225 х г в течение 5 мин. Выбросьте супернатант.
- Промыть кусочки колоний путем повторного усвоения в 2 мл PBS и центрифуги для удаления супернатанта.
- Добавьте 1 мл 0,05% трипсина и постучите по трубке, чтобы выбить клетки. Инкубируют трубку при 37 °C в течение 3-4 мин, чтобы диссоциировать кусочки колонии в одноклеточную суспензию.
- Нейтрализуют трипсин путем разбавления 4 мл плюрипотентных сред, содержащих 10 мкг/мл rho-ассоциированного ингибитора протеинкиназы (ROCK) Y-27632 дигидрохлорида (ROCKi) для предотвращения диссоциации, индуцированной гибелью клеток.
- Центрифуга для получения гранулы. Отбросьте супернатант и повторно суспендируем клетки в 2 мл эмбриоидной среды тела, содержащей 10 мкг/мл ROCKi.
- Удалите 10 мкл клеточной суспензии для подсчета клеток. Добавьте 10 мкл трипана синего цвета для обнаружения мертвых клеток. Подсчитайте клетки с помощью гемоцитометра.
- Добавьте соответствующий объем эмбриоидной среды тела с ROCKi к клеточной суспензии для получения 9000 живых клеток на 150 мкл.
- Пластина 150 мкл в каждой скважине пластины с низким креплением из 96 скважин и инкубируется в увлажненный CO2-инкубатор при 37 °C. Проверьте пластины на агрегацию через 24 часа. На 2 день аккуратно удалить среду и заменить свежей эмбриоидной средой без ROCKi.
- На 6-й день перенесите ЭБ в скважины с 24-й пластиной с низким прикреплением, содержащей 500 мкл нейронной индукционной среды, состоящей из DMEM-F12 с 1% добавкой N2, добавкой GlutaMAX 2 мМ и 1 мМ незаменимых аминокислот и 1 мкг/мл гепарина. Меняйте среду каждые 2 дня.
- Через 5 дней в нейронную индукционную среду встраивают нейроэпителиальные агрегаты в Матригель, наслаивая квадрат парапленки 2 см х 2 см на пустой лоток из кончиков 200 мкл. Нажмите на парапленку пальцами в перчатках над каждым отверстием в лотке для кончиков, чтобы сделать небольшие вмятины. Очистить парапленку с 70% этанолом для стерилизации.
- Переложите квадрат парафильма в тарелку 60 мм. Используйте вырезанные наконечники 200 мкл для переноса нейроэпителиальных агрегатов на вмятины в парапленке. Удалите лишнюю среду путем пипетки.
- Добавьте 30 мкл размороженных матригелей на нейроэпитлиальные агрегаты и расположите агрегат в центре Матрегеля с помощью наконечника пипетки. Поместите тарелку размером 60 мм на 20-30 мин в инкубатор при 37 °C для полимеризации Матригеля.
- Добавьте 5 мл церебральной органоидной дифференцировки среды, состоящей из 1:1 DMEM-F12: нейробазальной среды, 0,5% добавки N2, 2,5 мкг/мл инсулина, 2 мМ добавки GlutaMAX, 0,5 мМ NEAA, 1% добавки B27 и 2,5 мл пенициллина-стрептомицина.
- С помощью стерильных щипцов переверните лист парапленки и перемешивайте блюдо до тех пор, пока встроенные в Matrigel агрегаты не упадут с листа в среду. Выращивайте встроенные агрегаты в увлажненный инкубатор CO2 при 37 °C в течение 4 дней, внося изменения в среду в разные дни.
- После 4 дней статической культуры поместите 60-миллиметровую посуду на орбитальный шейкер, установленный внутри инкубатора, встряхивая при 50 оборотах в минуту. Культивировать органоиды в течение 3 месяцев, давая полные изменения среды с церебральной органоидной дифференцировкой среды каждые 3 дня.
Результаты
Генерация безинтегрированных IPSC от спонтанно абортированного плода с кариотипом 45XO
Мы выделили фибробласты из FCV с синдромом Тернера (TS), специфичным для кариотипа 45XO, и заразили их эписомальными плазмидами перепрограммирования для генерации TSiPSCs, которые могут быть использованы для последующего моделирования синдрома, в частности связанных неврологических дефицитов(рисунок 1a& b). Мы использовали неинтеграционные эписомальные векторы и нуклеофекцию для экспериментов по трансфекции(рисунок 1 c &d). Мы следили за морфологическими изменениями клеток, чтобы контролировать успех перепрограммирования. Наблюдался переход от фибробластов к морфологии эпителия с последующим очерченным компактным колониеобразованием(рис. 2а). TSiPSCs приобрели морфологию эмбриональных стволовых клеток человека с отчетливыми краями и высоким соотношением ядра к цитоплазме около 20 дня после трансфекции(рисунок 2b). Напротив, неполностью перепрограммированные клетки приобретают эпителиальную морфологию, но не образуют компактных колоний. (Рисунок 2c).
Характеристика TSiPSCs
Кариотипирование TSiPSCs выявило кариотип 45XO, связанный с синдромомТернера (рисунок 3a). Иммунофлуоресценция TSiPSCs показала экспрессию факторов транскрипции плюрипотентности OCT4, NANOG, SOX2 и маркеров клеточной поверхности SSEA4, E-Cadherin и TRA-1-81. Человеческие эмбриональные стволовые клетки являются золотым стандартом плюрипотентных стволовых клеток. Одновременно мы проводили иммунофлуоресценцию HUES 1, которая использовалась в качестве положительного контроля для сравнения экспрессии плюрипотентного биомаркера TSiPSC(рисунок 3b). Трансгенный свободный статус TSiPSCs был продемонстрирован геномной ПЦР ДНК для эписомальных плазмидных маркеров OriP и EBNA. К проходу 15 гены OriP и EBNA были потеряны в TSiPSCs.Эписомальные гены OriP и EBNA были амплифицированы и показали полосы в прохождении 9 TSiPSCs, указывающие на наличие эписомальных плазмид на этой стадии. Однако эти гены не были амплифицированы в прохождении 15 TSiPSCs, что указывает на потерю эписомальных плазмид и, следовательно, на трансгенное свободное состояние(рисунок 3c).
Анализы дифференциации in vitro
Потенциал дифференциации линий TSiPSC был продемонстрирован in vitro. ЦиПСК при агрегации в пластинах низкого присоединения образуются эмбриоидные тела(рисунок 4а). Индуцированная фактором роста дифференцировка TSiPSCs использовалась для генерации типов клеток трех зародышевых слоев. Иммунофлуоресцентный анализ с использованием специфических биомаркеров линии подтвердил, что TSiPSCs дифференцировались на репрезентативные производные эндодермы (SOX17), мезодермы (MYOSIN VENTRICULAR HEAVY CHAINα/β) и эктодермы (βIII TUBULIN)(Рисунок 4b).
Дифференциация церебральных органоидов.
TSiPSCs были дифференцированы как церебральные органоиды поэтапно. Одноклеточные суспензии TSiPSCs были агрегированы в эмбриональные тела для стимуляции развития зародышевых слоев в течение первых 6 дней с последующей индукцией нейроэпителиального развития в течение 5 дней. Нейроэпителиальные агрегированные были встроены в Матригель, который обеспечивал внеклеточный матрикс и компоненты базальной мембраны, которые поддерживают правильную ориентацию апикобаз, вырост нейроэпителиальных почек, которые расширяются и образуют просветы. Иммунофлуоресценцию нейроэпителиальным маркером NESTIN проводили для наблюдения за общей морфологией органоидов(рисунок 5b). Нейроэпителий окружает желудочек, похожий на полость(Рисунок 5с - белая линия). Органоиды морфологически отображают желудочковые зоны (VZ), субвентрикулярную зону (SVZ) и кору, подобные областям(рисунок 5c - красные, оранжевые и желтые линии соответственно)

Рисунок 1:Выделение и перепрограммирование фибробластов посредством нуклеофекции. (a) Микроскопическое изображение ворсин хориона плода до лечения коллагеназы. (b) Фибробласты, выделенные из ворсин хориона плода для экспериментов по перепрограммированию. (c)Проверка перепрограммирования плазмид с помощью рестрикции сбраживания EcoRI. (d)Принципиальная схема протокола трансфекции, используемого для генерации iPSC из фибробластов ворсин плода с использованием эписомального перепрограммирования плазмид посредством нуклеофекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
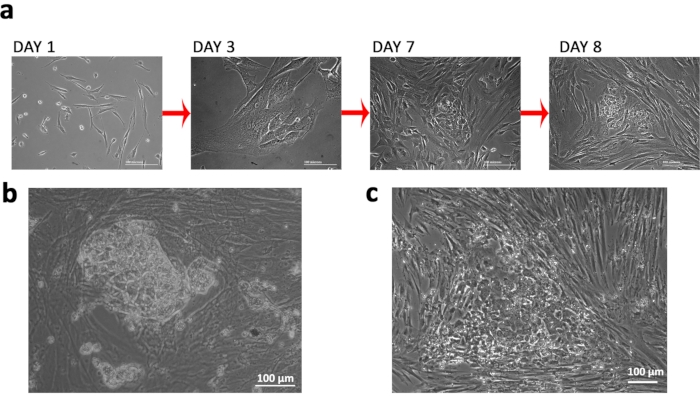
Рисунок 2:Установление синдрома Тернера, индуцированного плюрипотентными стволовыми клетками. (a)Изменения морфологии клеток, наблюдаемые в ходе перепрограммирования. (b)Полностью перепрограммированная колония TSiPSC. (c)Репрезентативное изображение колонии с неправильно перепрограммированными клетками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
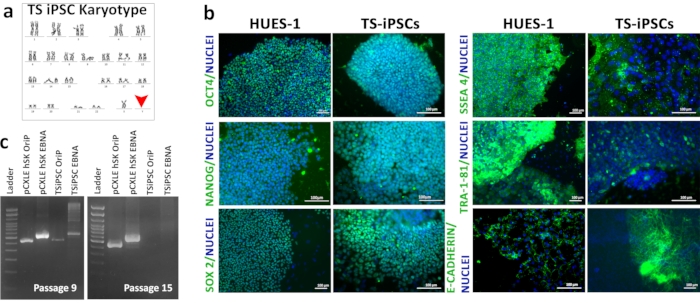
Рисунок 3:Характеристика TSiPSCs. (a)Кариотип ЦИПСК. (b)Иммунофлуоресцентный анализ биомаркеров плюрипотентности OCT4, NANOG, SOX2, SSEA-4 и TRA-1-81 в TSiPSCs по сравнению с HUES1 эмбриональных стволовых клеток. Ядра окрашиваются 4', 6-диамидино-2-фенилиндолом. 3с. Демонстрация трансгенного свободного статуса TSiPSCs. Полоса 1 - лестница ДНК, полоса 2 - OriP положительный контроль с pCXLE-hSK, полоса 3 - EBNA положительный контроль с pCXLE-hSK, полоса 4- OriP с TSiPSCs, полоса 5-EBNA с TSiPSCs. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
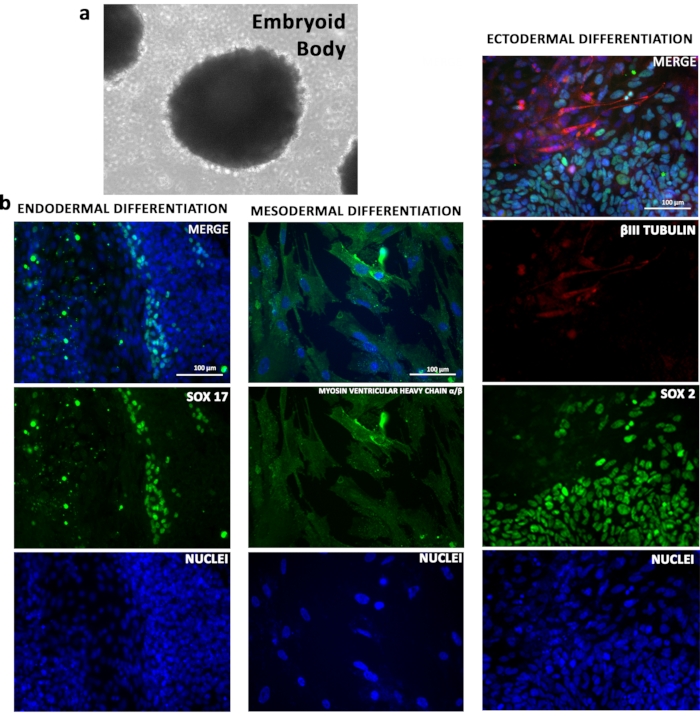
Рисунок 4:Потенциал дифференциации in vitro TSiPSCs. (a) TSiPSC дифференцирован до эмбриональных тел. (b)Иммунофлуоресцентный анализ TSiPSCs на эндодермальный маркер SOX17, мезодермальный маркер миозина желудочковой тяжелой цепи α/β и эктодермальные маркеры βIII тубулина и SOX2. Ядра окрашиваются 4', 6-диамидино-2-фенилиндолом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
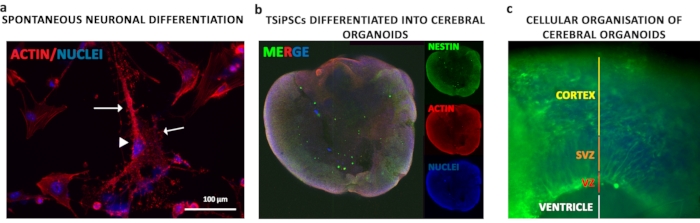
Рисунок 5:Нейрональная и церебральная органоидная дифференциация ЦИПСК. (a) Чтобы понять цитоархитектуру дифференцированных нейронов, было сделано окрашивание фаллоидином актина. Нейроны, полученные из TSiPSC, отображали пирамидальную нейрональную сому (наконечник стрелы) с дендритами и аксонами (стрелками). Ядра окрашиваются 4', 6-диамидино-2-фенилиндолом. Иммуноразнаживающий. (a)Иммуноокрашивание нестина и актина для наблюдения за грубой морфологией органоидов. (c)Окрашивание для Нестина для визуализации апикально и базально организованных нейронных слоев. Ядра окрашиваются 4', 6-диамидино-2-фенилиндолом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Состав носителей, буферов и решений Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2: Реакционная смесь ПЦР Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3: Программа ПЦР для циклов Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Генерация стабильных клеточных моделей цитогенетически аномальной ткани плода необходима для увековечения дефектного фенотипа. Путь iPSC является наиболее эффективным методом клеточной подготовки к бессрочному сохранению дефектных свойств20.
Плюрипотентные стволовые клетки (ПСК) проявляют свойства самообновления и дифференцировки в специализированные клетки, напоминающие эмбрионы раннего расщепления21. Следовательно, PSC могут служить отличными моделями для изучения ранних молекулярных, клеточных дефектов и дефектов развития у преждевременно абортированных плодов.
В этой статье мы описали генерацию iPSC человека с использованием нуклеофекции в сочетании с улучшенными эписомальными векторами. Результаты показывают, что эта комбинация содержит надежный метод генерации свободных от интеграции человеческих линий iPSC, о чем свидетельствует тот факт, что одиночных трансфекций было достаточно для успешного перепрограммирования. Мы отслеживали прогрессирующее превращение фибробластов FCV в плюрипотентные клетки микроскопически. Через 20 дней после трансфекции мы наблюдали колонии перепрограммированных TSiPSCs, окруженных неперепрограммированными ФИБРОБЛАСТАМИ FCV. Морфологически полученные человеческие ИПСК напоминали эмбриональные стволовые клетки, выращенные рядом в лаборатории. Как правило, клетки агрегируются в виде компактных колоний с блестящими границами. Клетки колоний имели большие ядра и плотно упакованы, что свидетельствует о тесном мембранном контакте между клетками. Неперепрограммированные фибробласты дугообразно и окружали эти колонии. После перехода в iMEF они продолжают распространяться в культуре более 30 передач, демонстрируя свойство непрерывного самообновления.
Поскольку TSiPSCs были получены из фибробластов 45XO, мы кариотипировали клетки, чтобы проверить, сохранили ли они хромосомный состав. TSiPSCs поддерживали кариотип 45XO в непрерывной клеточной культуре, предполагая стабильный генетический состав хромосомы 45XO. Чтобы быть полезным в качестве клеточного ресурса, представляющего анеуплоидию 45XO, TSiPSCs должны быть свободны от экзогенной ДНК, используемой в экспериментах по перепрограммированию. Мы проверили наличие остаточных эписомальных плазмид, выполнив геномную ПЦР ДНК для эписомальных специфических маркеров - OriP и EBNA. Мы не обнаружили никаких следов этих маркеров в клетках TSiPS после 15 проходов, предполагающих, что TSiPSCs постепенно теряли эписомальные перепрограммирующие векторы в пролонгированной культуре.
Отличительной чертой плюрипотентных клеток является их потенциал для дифференцировки в клетки трех зародышевых линий как in vitro, так и in vivo. Чтобы проверить эту способность в производных TSiPSCs, мы подвергли их in vitro эмбриональному образованию тела и дифференцировке анализов, направленных по линии, определяющей цитокины и факторы роста. ЦИПСК образовывали эмбриоидные тела и дифференцировались в эктодермальные клетки, экспрессирующие нейрональные маркеры, мезодермальные клетки, экспрессирующие сердечные маркеры, и эндодермальные клетки, экспрессирующие SOX17 как биомаркер судьбы эндодермы. Мы также проверили способность TSiPSCs дифференцироваться в 3D-органоиды головного мозга более высокого порядка, используя ранее установленные протоколы22. TSiPSCs постепенно самоорганизуются из-за своих собственных внутренних программ развития в мини-ткани, называемые органоидами. TSiPSCs дали церебральные органоиды, показывающие цитоархитектуру, похожую на ткань мозга с нейроэпителием, окружающим желудочек, подобный полости. Однако эти органоиды должны быть дополнительно охарактеризованы, чтобы выявить точные типы клеток и сравнить с нормальными ИПСК, чтобы различать внутренние свойства паттернов нервной ткани TSiPSCs. Эти церебральные органоиды и другие типы органоидов мозга, полученные из TSiPSCs, могут быть использованы для моделирования несоответствий в развитии и функциональных несоответствий, которые могут способствовать симптомам неврологических недостатков лиц tS. TSiPSCs продемонстрировали биомаркерные характеристики плюрипотентности, а также отличительную черту дифференциации, что подчеркивает успех перепрограммирования на индуцированную плюрипотентность.
Вышеописанный метод эффективно работает при перепрограммировании дермальных фибробластов и мезенхимальных клеток, полученных из различных источников в нашей лаборатории (данные других линий не показаны). По нашему опыту, следующие шаги имеют решающее значение для успеха эксперимента по перепрограммированию:
а) Качество плазмидного препарата: старые препараты не дают иПСК.
b) Качество клеток, используемых для трансфекции: пролиферация клеток необходима для генерации iPSC. От 0,5 до 1 миллиона клеток на трансфекцию дали воспроизводимую эффективность перепрограммирования.
c) Свежереконструированные реагенты нуклеофектора: восстановленные реагенты нуклеофектора, хранимые более месяца, не давали иПСК.
г) Поддержание банка главных клеток механической субкультурой ИПСК, дающих стабильные линии. Ферментативная диссоциация использовалась в соответствии с требованиями эксперимента.
Будущая цель лаборатории состоит в том, чтобы создать панель хромосомно аномальных иПСК для последующего развития, функционального моделирования и моделирования заболеваний с использованием этого эффективного метода. Анеуплоидии плода вызывают потерю беременности и пороки развития органов у живорождений. Анеуплоидные иПСК, полученные из тканей спонтанных абортов, являются ценным ресурсом для моделирования и изучения неудачных событий эмбрионального развития. Системы культур in vitro 2D и 3D, включая эмбриоидные тела и тканеспецифические органоиды22, позволят исследователям понять молекулярные и клеточные нарушения, такие как аберрантная пролиферация клеток и гибель клеток в клетках, специфичных для линии, которые могут проявляться в виде аномалий развития и неудач беременности, связанных с синдромами анеуплоидии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Финансовую поддержку вышеуказанному исследованию оказала Академия высшего образования Манипал. Характеристика линии проводилась частично в лаборатории М.M. Паникера в НЦБС. Благодарим Диагностическую лабораторию Ананда за помощь в кариотипии.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.15% trypsin | Thermo Fisher Scientific | 27250018 | G Banding |
| 2-mercaptoethanol | Thermo Fisher Scientific | 21985023 | Pluripotency and Embryoid body medium |
| 4', 6 diamidino-2-phenylindole | Sigma Aldrich | D8417 | Immunocytochemistry |
| Activin A | Sigma Aldrich | SRP3003 | Differentiation assays |
| Alkaline Phosphatase Live Stain | Thermo Fisher Scientific | A14353 | AP staining |
| AMAXA Nucleofector II | Lonza | - | Nucleofection |
| AmnioMAX II complete media | Thermo Fisher Scientific, Gibco | 11269016 | Medium specific for foetal chorionic villi cell cultures |
| Ampicillin | HiMedia | TC021 | Plasmid purification |
| Anti Mouse IgG (H+L) Alexa Fluor 488 | Invitrogen | A11059 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 488 | Invitrogen | A11034 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 546 | Invitrogen | A11035 | Immunocytochemistry |
| Antibiotic-Antimycotic | Thermo Fisher Scientific, Gibco | 15240096 | Contamination control |
| Anti-E-Cadherin | BD Biosciences | 610181 | Immunocytochemistry |
| Anti-Nanog | BD Biosciences | 560109 | Immunocytochemistry |
| Anti-OCT3/4 | BD Biosciences | 611202 | Immunocytochemistry |
| Anti-SOX17 | BD Biosciences | 561590 | Immunocytochemistry |
| Anti-SOX2 | BD Biosciences | 561469 | Immunocytochemistry |
| Anti-SSEA4 | BD Biosciences | 560073 | Immunocytochemistry |
| Anti-TRA 1-81 | Millipore | MAB4381 | Immunocytochemistry |
| basic Fibroblast Growth Factor[FGF2] | Sigma Aldrich | F0291 | Pluripotency medium |
| Bone Morphogenetic Factor 4 | Sigma Aldrich | SRP3016 | Differentiation assays |
| Bovine Serum Albumin | Sigma Aldrich | A3059 | Blocking |
| Collagen Human Type IV | BD Biosciences | 354245 | Differentiation assays |
| Collagenase blend | Sigma Aldrich | C8051 | Digestion of foetal chorionic villi |
| Dexamethasone | Sigma Aldrich | D4902 | Differentiation assays |
| DMEM F12 | Thermo Fisher Scientific | 11320033 | Differentiation assays |
| FastDigest EcoR1 | Thermo Scientific | FD0274 | Restriction digestion |
| Fibronectin | Sigma Aldrich | F2518 | Differentiation assays |
| Giemsa Stain | HiMedia | S011 | G Banding |
| Glacial Acetic Acid | HiMedia | AS001 | Fixative for karyotyping |
| Glucose | Sigma Aldrich | G7528 | Differentiation assays |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Pluripotency and Embryoid body medium |
| Heparin sodium | Sigma Aldrich | H3149 | Differentiation assays |
| Insulin solution human | Sigma Aldrich | I9278 | Differentiation assays |
| Insulin Transferrin Selenite | Sigma Aldrich | I1884 | Differentiation assays |
| KAPA HiFi PCR kit | Kapa Biosystems | KR0368 | OriP, EBNA1 PCR |
| KaryoMAX Colcemid | Thermo Fisher Scientific | 15210040 | Mitotic arrest for karyotyping |
| KnockOut DMEM | Thermo Fisher Scientific | 10829018 | Pluripotency and Embryoid body medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Pluripotency and Embryoid body medium |
| Luria Bertani agar | HiMedia | M1151F | Plasmid purification |
| Matrigel | BD Biosciences | 356234 | Differentiation assays |
| MEM Non-essential amino acids | Thermo Fisher Scientific | 11140035 | Pluripotency and Embryoid body medium |
| Methanol | HiMedia | MB113 | Fixative for karyotyping |
| Myosin ventricular heavy chain α/β | Millipore | MAB1552 | Immunocytochemistry |
| NHDF Nucleofector Kit | Lonza | VAPD-1001 | Nucleofection |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | Fixing cells |
| pCXLE-hOCT3/ 4-shp53-F | Addgene | 27077 | Episomal reprogramming Plasmid |
| pCXLE-hSK | Addgene | 27078 | Episomal reprogramming Plasmid |
| pCXLE-hUL | Addgene | 27080 | Episomal reprogramming Plasmid |
| Penicillin Streptomycin | Thermo Fisher Scientific, | 15070063 | Pluripotency and Embryoid body medium |
| Phalloidin- Tetramethylrhodamine B isothiocyanate | Sigma Aldrich | P1951 | Immunocytochemistry |
| Phosphate buffered saline | Sigma Aldrich | P4417 | 1 X PBS 1 tablet of PBS dissolved in 200mL of deionized water and sterilized by autoclaving Storage: Room temperature. PBST- 0.05% Tween 20 in 1X PBS. Storage: Room temperature. |
| Plasmid purification Kit- Midi prep | QIAGEN | 12143 | Plasmid purification |
| Potassium Chloride Solution | HiMedia | MB043 | Hypotonic solution for karyotyping |
| QIAamp DNA Blood Kit | Qiagen | 51104 | Genomic DNA isolation |
| RPMI 1640 | Thermo Fisher Scientific | 11875093 | Hepatocyte differentiation medium |
| Sodium Citrate | HiMedia | RM255 | Hypotonic solution for karyotyping |
| Triton X-100 | HiMedia | MB031 | Permeabilisation |
| Trypsin-EDTA (0.05%) | Thermo Fisher Scientific, Gibco | 25300054 | Subculture of foetal chorionic villi fibroblasts |
| Tween 20 | HiMedia | MB067 | Preparation of PBST |
| β III tubulin | Sigma Aldrich | T8578 | Immunocytochemistry |
| Y-27632 dihydrochloride | Sigma Aldrich | Y0503 | Differentiation assays |
Ссылки
- Verlinsky, Y., et al. Human embryonic stem cell lines with genetic disorders. Reproductive BioMedicine Online. 10, 105-110 (2005).
- Eiges, R., et al. Developmental Study of Fragile X Syndrome Using Human Embryonic Stem Cells Derived from Preimplantation Genetically Diagnosed Embryos. Cell Stem Cell. 1, 568-577 (2007).
- Biancotti, J. -. C., et al. Human Embryonic Stem Cells as Models for Aneuploid Chromosomal Syndromes. STEM CELLS. 28, 1530-1540 (2010).
- Li, W., et al. Modeling abnormal early development with induced pluripotent stem cells from aneuploid syndromes. Human Molecular Genetics. 21, 32-45 (2012).
- Gravholt, C. H., Viuff, M. H., Brun, S., Stochholm, K., Andersen, N. H. Turner syndrome: mechanisms and management. Nature Reviews Endocrinology. 15, 601-614 (2019).
- Luo, Y., et al. Uniparental disomy of the entire X chromosome in Turner syndrome patient-specific induced pluripotent stem cells. Cell Discovery. 1, 15022 (2015).
- Luo, Y., et al. Generation of an induced pluripotent stem cell line from an adult male with 45,X/46,XY mosaicism. Stem Cell Research. 27, 42-45 (2018).
- Parveen, S., Panicker, M. M., Gupta, P. K. Generation of an induced pluripotent stem cell line from chorionic villi of a Turner syndrome spontaneous abortion. Stem Cell Research. 19, (2017).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872 (2007).
- Soldner, F., et al. Parkinson's Disease Patient-Derived Induced Pluripotent Stem Cells Free of Viral Reprogramming Factors. Cell. 136, 964-977 (2009).
- Somers, A., et al. Generation of Transgene-Free Lung Disease-Specific Human Induced Pluripotent Stem Cells Using a Single Excisable Lentiviral Stem Cell Cassette. STEM CELLS. 28, 1728-1740 (2010).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G., Hochedlinger, K. Induced Pluripotent Stem Cells Generated Without Viral Integration. Science. 322, 945-949 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proceedings of the Japan Academy, Series B. 85, 348-362 (2009).
- Warren, L., et al. Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324, 797-801 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Martí, M., et al. Characterization of pluripotent stem cells. Nature Protocols. 8, 223-253 (2013).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nature Reviews Molecular Cell Biology. 17, 170-182 (2016).
- Ambartsumyan, G., Clark, A. T. Aneuploidy and early human embryo development. Human Molecular Genetics. 17, 10-15 (2008).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9, 2329-2340 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены