Method Article
ターナー症候群(45XO)の胎児細胞による、その症候群に伴う神経障害の下流モデリングのための人工多能性幹細胞の生成
要約
このプロトコルは、核軟部によるエピソームプラスミドの送達を通じた胎児組織線維芽細胞からの統合自由なiPSCの生成と、iPSC特性評価および神経分化に用いられる方法の記述を記述する。
要約
染色体の無数化は、中枢神経系奇形や胎児死を含む重度の先天性奇形を引き起こす。出生前の遺伝子スクリーニングは純粋に診断であり、疾患メカニズムを解明するものではありません。無数性胎児の細胞は染色体異数化を有する貴重な生物学的物質であるが、これらの細胞は短命であり、下流の研究実験への使用を制限している。誘導多能性幹細胞(iPSC)モデルの生成は、無数形質の永久保存のための細胞調製の有効な方法である。彼らは自己更新し、胚発生を連想させる特殊な細胞に分化しています。したがって、iPSCは初期の発生事象を研究するための優れたツールとして機能します。ターナー症候群(TS)は、完全にまたは部分的に欠けているX染色体に関連する稀な状態である。この症候群は、不妊症、低身長、内分泌、代謝、自己免疫障害および心血管障害および神経認知障害を特徴とする。以下のプロトコルは、TS(45XO)胎児組織からの線維芽細胞の単離および培養、核整形によるエピソームリプログラミングプラスミドの送達を介した統合自由TSiPSCの生成、その後の特徴付けについて説明する。TSiPSCのリプログラミングは、最初は生細胞アルカリホスファターゼ染色によってスクリーニングされ、続いて多能性バイオマーカーの広範な調査が行われました。選択したコロニーを機械的に解剖し、数回通過し、安定した自己更新細胞を更なる実験に使用した。細胞は、多能性転写因子OCT4、NANOG、SOX2、細胞表面マーカーSSEA 4およびTRA1-81の多能性幹細胞の典型的な転写因子を発現した。元の45XOの核型はポストリプログラミングを保持していた。TSiPSCは胚体を形成し、系統特異的バイオマーカー((SRY BOX17)(ミオシンヴェントリーキュラーヘビーチャイエンα/β)(βIII TUBULIN)を発現する内胚体、中胚および外胚の細胞に分化することができた。外因性エピソームプラスミドは、細胞内で15を通過した後、自発的に失われ、検出されなかった。これらのTSiPSCは、ターナー症候群に関連する神経認知障害を引き起こす欠陥のある分子および細胞性神経発達をモデル化するための貴重な細胞資源である。
概要
無数化は、出生時欠損/先天性奇形およびヒトにおける妊娠喪失を引き起こす。妊娠喪失から50%~70%の検体が細胞遺伝学的異常を示す。妊娠初期に失われた無数胚は、ヒト胚発生を密接に表す他のモデルを開発する必要性を高める実験分析では容易には得られない。遺伝性疾患と診断された細胞由来の誘導多能性幹細胞(iPSC)は、胎児の発達における代表的な遺伝的不規則性とその結果をモデル化するために用いられてきた。これらのiPSCは、現像性胚のエピブラスト細胞に似ており、胚形成の初期の事象を再現することができる。これらは、初期の哺乳類胚における細胞系統およびパターニングの発達プログラムの理解と特徴付けを可能にする。iPSCは、単一体性X(ターナー症候群)、トリソミー8(ワルカニー症候群2)、トリソミー13(パタウ症候群)および部分トリソミー11のような無数数分解症候群の出生前診断試験から以前に由来する皮膚線維芽細胞およびアミオサイトから誘導された。22(エマニュエル症候群)は、失敗した開発4に関する貴重な洞察を提供しています。
ターナー症候群(TS)は、女性の不妊、低身長、内分泌および代謝障害、自己免疫疾患のリスクの増加、および心血管疾患に対する素因を特徴とする稀な状態である5。それは唯一の生存可能な単一体症候群であるが、それはまた、自発的な中絶を引き起こす発達中の胚に致命的である6.TSを有する生存者は、細胞内のX染色体物質の変化の程度を有する。核型は、1つのX染色体(45,XO)の完全な損失から45、XO / 46、XXのようなモザイクまで及ぶ。45、XO/47、XXX、環染色体の存在、Y染色体物質の存在、5.
この症候群の診断は、一般的に、症状のある個人の核型血液と、初期の異性数体症候群を検出するための絨毛絨毛サンプリング(CVS)によって行われる。無数性症候群は、自然流産の30%を占めるので、自然流産時に受胎(POC)の産物を核型化することは日常的である。これらの胎児細胞は、細胞遺伝学的異常を有する絨毛性絨毛およびそれらに由来するiPSCを含む、無数性症候群4,6を研究するための有用な生物材料源を提供する。TS iPSCは、レトロウイルスリプログラミング4を介してアニオサイトから以前に確立されており、レトロウイルスリプログラミング6を介して絨毛性絨毛絨毛菌の線維芽細胞(出生前診断を通じて得られる)、センダイウイルスリプログラミングを介した血液単核細胞7から、およびレンチウイルスリプログラミングを介したTS個体の皮膚線維芽細胞から4.私たちの研究室の主な焦点は発達障害を理解することなので、私たちはPOCからTS iPSC、特に自発的中絶の絨毛絨毛性絨毛成分を生成しました 8.この胎児組織から単離された細胞は全て45XOの核型を有し、同じ核型のiPSCを生み出した。これらのiPSCは、中絶された胎児から最初に生成され、妊娠障害に関連する妊娠障害を研究するための貴重なリソースを提供するので、ユニークです。この記事では、エピソームリプログラミングを通じて、このユニークな細胞源からのiPSCの生成の詳細な方法論を提供します。
iPSC生成の初期の方法では、ウイルス伝達とトランスポゾンを使用してリプログラミング因子を提供しました。細胞を多能性に誘導する方法は、レトロウイルスベクター9、切除可能なレンチウイルスベクター10、11およびトランスポゾンベースの方法12を用い、非統合型アデノウイルスベクター13およびセンダイウイルスベースベクター14に進化した。レトロウイルスおよびレンチウイルスベースのリプログラミングは、効率的ではあるが、宿主染色体へのリプログラミング因子の統合を伴い、iPSCに予期せぬ影響を及ぼす挿入突然変異を引き起こす。さらに、ウイルスベースのリプログラミングは、iPSCの翻訳適用を防ぎます。RNA系システム15および直接タンパク質送達16は、ウイルスおよびDNAトランスフェクションの使用に関連する潜在的なリスクを完全に排除するために検討されている。しかし、これらの方法は非効率的であることが証明されています。
2011年、沖田らは、shRNAを介したTP53抑制によって増強されたエピソームプラスミドによるリプログラミングの効率向上を報告した。彼らはまた、cMYCを非変形型LMYC(小細胞肺癌関連MYC)に置き換え、hipscの安全性を高めました。これらのエピソームプラスミドは、5つのリプログラミング因子を発現する:OCT4、LIN28、SOX2、KLF4、LMYCおよびSHRNA用TP5317,18。これらのベクターは、余分な染色体的に維持され、連続培養時に再プログラムされた細胞から失われ、10〜15の通過以内にラインをトランスジーンフリーにします。核細胞は、宿主細胞の核に直接核酸を送達するエレクトロポレーションの特殊な形態です。これは、様々な細胞タイプにリプログラミングプラスミドを送達するための効率的な方法です。上皮プラスミドは費用効果が高く、核の高い費用を補います。この方法は、様々な体細胞から安定したiPSCを生み出す最適化された条件下で効率的かつ再現可能です。本プロトコルでは、エピソームリプログラミングプラスミドの核形成によって胎児組織から単離された線維芽細胞からのiPSCの生成方法について述べている。ここでは、胎児絨毛絨毛絨毛、プラスミド精製、核整離、リプログラミングプレートからのコロニーの摘出、安定したiPSCの確立からの線維芽細胞の分離のための詳細なプロトコルを示します。
新たに生成されたiPSCにおける多能性特性の存在を確認することが不可欠である。これには、多能性関連因子のデモンストレーションが含まれます(例えば、 アルカリホスファターゼ発現、ナノグ、SSEA4、Tra 1-80、Tra 1-81、E-カドヘリン;通常、免疫蛍光または遺伝子発現アッセイで示される)、インビトロ分化アッセイによる3つの胚芽層の同定、染色体含有量を決定するための核型入力、染色体含有量を決定するためのカルギタイピング、同定を確立するためのSTRタイピング そして、テラトーマ形成および四数相補解のようなインビボアッセイでより厳しい。ここでは、核型の特徴付けプロトコル、生細胞アルカリホスファターゼ染色、免疫蛍光による多能性関連バイオマーカーの検出、外因性遺伝子19の喪失を実証する体外分化アッセイおよび方法について説明する。
プロトコル
FCVは、マニパル病院の倫理委員会の承認の下、バンガロールのマニパル病院から入手されました。
注: すべてのバッファーとソリューションの構成については、 表 1 を参照してください。
1. 胎児絨毛(FCV)からの線維芽細胞の分離
-
コラゲナーゼにおけるサンプル採取と組織崩壊
- リン酸緩衝生理食塩水(PBS)で無菌条件下でFCVを収集し、細胞培養施設に(室温で)輸送します。
- 絨毛を60mmのペトリ皿に移し、1x抗生物質抗ミコティック溶液(PBS-AA)を含むPBSで数回(最低4回)洗浄します。ピペットでPBS-AAを完全に除去します。
- チョリオニック絨毛を37°Cで5分間、1 mLコラゲターゼブレンド(5mg/mL)で5分間お取り扱いします。
- 10%ウシ胎児血清(FBS)を含む細胞培養培地で中和し、225xgで15mLチューブと遠心分離機に消化を5分間移し、崩壊した絨毛と放出細胞をペレットとして回収する。
-
サブカルチャーと在庫拡大
- プレートは、完全な培地(例えば、AmnioMAX)の5 mLを含むT25培養フラスコ中の放出細胞と共に絨毛を崩壊させ、コンフルエント線維芽細胞培養が得られるまで増殖する。
- 培養で繊維芽細胞を拡大し、次のようにトランスフェクションおよび特性評価実験で使用するストックを準備します。
- FCV線維芽細胞を含むT25フラスコに0.05%トリプシンの2mLを加え、37°Cで3〜5分間インキュベートして細胞を解体する。
- インキュベーション後、FBS(トリプシンと同じボリューム)を加えてトリプシンを中和します。
注:FBSを含む培養培地は、1:3トリプシン:メディア比で添加した場合、トリプシンを中和するためにも使用できます。 - 解水細胞を15mLチューブに集め、遠心分離機を225 x gで5分間回収し、細胞ペレットを得る。
- デカント上清および完全な培地の1 mLの細胞ペレットを再懸濁する。
- 500 μLを60mmの組織培養処理皿に移し、容積を5 mLにする。この分割比は1:2で、後続の通路にも使用されました。
-
凍結保存
- ステップ1.2.2.1 -1.2.2.3で説明したように0.05%トリプシンを使用して酵素解離を行い、細胞ペレットを得る。
- 上清を捨て、1 mLの凍結混合で細胞ペレットを再懸濁し、1:9ジメチルスルホキシド(DMSO):FBSを含む。
- 内容物を無菌の凍結に移し、バイアルを凍結容器に入れます。
- -80°Cで一晩凍結し、翌日にバイアルを液体窒素(-196°C)に移します。
2. プラスミドDNAの分離と検証
-
細菌細胞の調製
- 3つの個々のプラスミドpCXLE-hOCT3/4-shp53-F、pCXLE-hSKおよびpCXLE-hUL(アジーンから)を別々のルリアベルタニアンピシリン寒天プレートに含む 大腸菌 のストリークグリセロールストック。
- 単一コロニーを5mLのルリア・ベルタニアンピシリン培地のスターター培養物に接種する。37°Cで8時間のインキュベート(10xg)を振る。
- このスターター培養液の200μLを、ルリア・ベルタニアンピシリン培地の100mLに接種します。37°Cで一晩、振盪を行ってインキュベートする。
- 4°Cで15分間6000xgで遠心分離機で一晩細菌培養を収穫する。
-
ミディプラスミド精製キットを使用したプラスミド分離
- 4 mL リサスペンション バッファーで細菌ペレットを再懸濁します。
- 4 mLのリシスバッファーを加え、4~6回激しく反転して十分に混ぜ合わせ、室温で5分間インキュベートします。
- 4 mLの前冷やされた中和バッファーと反転チューブを4~6回加えて、十分に混合します。氷の上で15分間インキュベートします。
- 4°Cで30分間≥20,000xgの遠心分離機。 新鮮なチューブに上澄み液を回収し、4°Cで15分間≥20,000 x gで再遠心分離機を回収します。
- 4 mLの平衡バッファーを適用してカラムを平衡化します。
- 上清を列に適用します。
- 10 mLの洗浄バッファーでカラムを2回洗います。
- 5 mLの温かい(65°C)溶出緩衝液を有するエルテDNA。
- 溶出したDNAに3.5mLのイソプロパノールを加えてDNAを沈殿させる。よく混ぜます。遠心分離機 ≥15,000 x g で 30 分 4 °Cで デカント上清は慎重に。
- 70%エタノールと遠心分離機の2 mLでDNAペレットを10分間≥15,000 x gで洗浄します。デカント上清は慎重に。
- 空気乾燥ペレットは5〜10分間、適当な量のPCRグレードの水にDNAを溶解し、1μg/mLの最終濃度を得ます。
メモ:エレクトロポレーションには適さないため、DNAを緩衝液に溶解しないでください。古いプラスミドDNA調製物は、再プログラムされたコロニーを生み出さない。
-
エコRI制限消化によるプラスミド検証
- ヌクレアーゼを含まない15μL、10xバッファー2μL、プラスミドDNA1μg、EcoRI酵素1μLを組み合わせます。やさしく混ぜます。
- 37°Cで15分間、ヒートブロックでインキュベートします。
- 消化したプラスミドサンプルを6x DNAゲルローディング色素とエレクトロファーズを1%アガロースゲルに1%のアガロースゲルで0.5 μg/mLのエチジウム臭化物で混ぜます。標準的なDNAの梯子を含める。DNAが適切に分解した後のゲルを画像化する。pCXLE-hOCT3/ 4-shp53-F の期待される EcoRI バンド サイズは 6,834 bp、3,758 bp、および 1,108 bp;pCXLE-hULは10,200 bpおよび1,900 bpである;pCXLE-hSKは10,200 bpおよび2,500 bpである。
3. 核の切除
-
細胞ペレット
- 80〜90%の合流まで完全な培地の5 mLのT25フラスコで単離された胎児絨毛線維芽細胞を培養する。
- PBSで細胞を2回洗浄し、ステップ1.2.2.1 - 1.2.2.3に記載されているようにトリプシン化します。
- 上清を取り除き、ペレットを5mLの減らされた血清培地(例えば、Opti-MEM)に再懸濁させる。ヘモサイトメーターで細胞を数え、核の106 細胞を取る。225 x g で 5 分間遠心分離機。上清を完全に除去する。
-
試薬調製および核整離
- 0.5 mLのサプリメントと2.25 mLの核整元溶液(いずれもキットに提供)を混合して、核形成剤試薬を調製します。
- 1.5 mLチューブに100μLの核包核水溶液を加えます。各pCXLE-hOCT3/4-shp53-F、pCXLE-hSKおよびpCXLE-hULをチューブに1μg加えます。このミックスでは、10個の細胞 (ステップ3.1.2から)を穏やかに再懸濁します。
- 細胞-DNA懸濁液をキュベットに移し、サンプルが気泡を使わずにキュベットの底部(キットに用意)を覆っていることを確認します。キュベットをキャップし、ホルダーに挿入します。核の核のU-23(高効率のために)を選択し、適用する。
- ホルダーからキュベットを取り出し、1 mLの完全なメディアを追加します。4 mLの完全な培地(合計5 mLの培地)で満たされたペトリ皿を処理した60 mmの組織培養物に内容物を穏やかに移します。37°Cで加湿CO2 インキュベーターで細胞をインキュベートする。
- 24時間後、セルが接続されているかどうかを確認します。メディアを完全に交換してください。
注:細胞死率は核分裂で高く、結合する生存可能な細胞はほとんど残っている。 - 完全なメディアのセルを 10 日間維持し、次の 20 日間、多能性メディアに移行します。
注:細胞を定期的に視覚化して、リプログラミング細胞(上皮形態やコンパクトコロニー形成など)で起こる形態学的変化に従い、実験が機能しているかどうかを確認します。約25のiPSCコロニーは、多能性培地で培養20日後に見ることができる。
4. iPSCコロニーの摘み取りと伝播
-
リプログラミングプレートからのコロニーのピッキング
- プルドガラスピペットまたは1mLシリンジ針を使用して再プログラム皿に形成された胚性幹細胞様コロニーを手動で解剖し、多能性培地を備えた不活性化マウス胚性線維芽細胞フィーダーを備えた以前に調製されたプレートに移管するか、mTESR培地でマトリゲルコーティングプレートにフィーダーフリー培養を確立する。
注:マウス胚性線維芽細胞(MEF)は、マウス胚(妊娠13〜14日妊娠雌マウスから解剖)からの酵素的単離を用いて誘導され、マイトマイシンC治療によってマイトチーブト不活性化された。単一の皿から単一の皿に多くのコロニーを移すことによって別の皿または混合クローン集団の版からの単一のコロニーを成長させることによって単一のクローン集団を確立する。
- プルドガラスピペットまたは1mLシリンジ針を使用して再プログラム皿に形成された胚性幹細胞様コロニーを手動で解剖し、多能性培地を備えた不活性化マウス胚性線維芽細胞フィーダーを備えた以前に調製されたプレートに移管するか、mTESR培地でマトリゲルコーティングプレートにフィーダーフリー培養を確立する。
-
新しいコロニーを新鮮なフィーダーに機械的に移動させ、安定したiPSCを確立するパス
- iPSCを多能性培地で伝播し、2日おきに給餌し、5~7日ごとに1:3を分割します。比率9:1でノックアウト血清交換とDMSOの凍結ミックスで凍結保存することによって株式を準備します。
注意:ノックアウト血清置換は、FBSの成分が長期保存中に多能性細胞の分化を誘発する可能性があるとして、FBSの代わりにiPSCの凍結保存のための凍結混合で使用される。
- iPSCを多能性培地で伝播し、2日おきに給餌し、5~7日ごとに1:3を分割します。比率9:1でノックアウト血清交換とDMSOの凍結ミックスで凍結保存することによって株式を準備します。
5. iPSCの特性
注:PCRおよび多能性バイオマーカーの免疫染色を含む特性評価試験は、5番目の通過数の後に行われました。後の通路番号で、カリョタイピングを行いました。
- カリョータイピング
- 37°Cの加湿CO2 インキュベーターで45分間コルセミドを使用したiPSCのコンフルエント60mmペトリ皿を扱います。
- 0.05%トリプシン処理と遠心分離機による収穫。上清を取り除き、残ったミディアムの痕跡をピペットにして細胞ペレットを緩めます。
- 5 mLの低張性溶液を加えます。チューブを反転して混ぜ、37°Cで20分間インキュベートします。 225 x g で 5 分間遠心分離機。
注:取得したペレットはふわふわに見えるはずです。 - 2.5 mLのカーノイの固定液をゆっくりと加え、タップしてペレットを緩めます。
- きれいなガラススライドに細胞の懸濁液を落とすことによって、核型の形にスプレッドを準備します。
- スライドを0.15%トリプシンで1分間処理し、PBSで1回洗います。その後、4分間ギムサ溶液で汚し、蒸留水洗浄で終了します。適切なソフトウェアを取得し、処理します。
- トランスジーンフリーステータスのデモンストレーション
-
ゲノムDNA分離
- 1.5 mLマイクロ遠心チューブの底にプロテアーゼのピペット20 μL。
- 200 μL の TSiPSC を PBS に再懸濁してマイクロ遠心チューブに加えます。
- サンプルに200 μLのバッファーALを加え、パルス渦によって15秒混合します。
- 56°Cで10分間インキュベートします。
- マイクロ遠心分離チューブを簡単に遠心分離して蓋の内側から滴を取り除きます。
- エタノールを200μL(96~100%)をサンプルに加え、パルス渦によって15秒ずつ混ぜます。混合後、蓋の内側から滴を除去するためにチューブを短く遠心分離する。
- 前のステップの混合物を、リムを濡らさずにミニスピンカラム(2 mLコレクションチューブ)に慎重に塗布します。キャップを閉じ、遠心分離機を6000 x gで1分間閉じます。濾液を含むチューブを捨て、ミニスピンカラムを清潔な2mLのコレクションチューブに入れ。
- ミニスピンカラムを慎重に開け、リムを濡らさずに、バッファAW1の500 μLを追加します。キャップと遠心分離機を6000 x gで1分間閉じます。ミニスピンカラムをクリーンな2mLコレクションチューブに入れ、濾液を含む回収管を廃棄します。
- ミニスピンカラムを慎重に開き、リムを濡らさずにバッファAW2の500 μLを追加します。キャップと遠心分離機をフルスピード(20,000 x g)で3分間閉じます。
- ミニスピンカラムを新しい2 mLコレクションチューブに入れ、古いコレクションチューブを濾液で捨てます。バッファー AW2 の持ち越しの可能性を排除するために 1 分間フルスピードで遠心分離機。
- ミニスピンカラムをクリーンな1.5 mLマイクロ遠心分離チューブに入れ、濾液を含む回収管を捨てます。ミニスピンカラムを慎重に開き、200 μL バッファ AE または蒸留水を追加します。室温(15〜25°C)で5分間インキュベートし、6000 x gで遠心分離機を1分間インキュベートします。
-
トランスジーンフリーステータス PCR(KAPA ハイファイ PCR キット KR0368 を使用)
- すべての試薬が適切に解凍され、混合されていることを確認します。
- 表2に基づいてすべての反応成分の適切な量を含むPCRマスターミックスを準備します(氷上での反応を設定する)。
- 個々のPCRチューブにPCRマスターミックス、テンプレート、プライマーの適切な量を転送します。
- 個々の反応をキャップ, ミックスと遠心分離機簡単に.
- 表 3に従って PCR を実行します。
-
ゲノムDNA分離
- 多能性バイオマーカー同定
-
アルカリホスファターゼ(AP)染色
- 培養領域の10cm2 ごとに1.5 mL DMEM/F-12に3μLの500xストック溶液を希釈して、1x APライブステイン作業ソリューションを準備します。
- iPSC培養皿から培地を取り出します。DMEM/F-12で一度培養を洗浄してください。1x AP ライブステインソリューションを iPSC に追加します。37°Cで45分間インキュベートします。
- AP染色を取り除き、DMEM/F-12で2回洗います。染色から30~90分以内に標準FITCフィルターを使用して、蛍光顕微鏡下で新鮮なDMEM/F-12と画像を追加します。
-
多能性バイオマーカーの免疫染色
- コンフルエントiPSC培養物を4%パラホルムアルデヒドで一晩4°Cで固定します。 PBSトゥイーン20(PBST)で3回洗浄し、各々5分間洗浄します。
- PBSTで0.3%トリトンX-100で細胞を室温で15分間透過させます。PBSTで3回洗います。
注:透過性は細胞内抗原に対してのみ行う必要があります。 - PBSTで3%ウシ血清アルブミン(BSA)を室温で30分間ブロックします。一次抗体で細胞を染色する(1%BSAで1:1000を希釈する)一晩。一次抗体インキュベーション後、PBSTで3回洗浄します。
- 二次抗体を用いた細胞をインキュベートし(1%BSAで1:1000を希釈)、室温で5時間培養する。PBSTで3回洗います。
- 0.5 μg/mL 4',6-ジミジノ-2 フェニリンドール(DAPI)で1分間、核にラベルを付けます。PBSTで細胞を一度洗います。
- 蛍光顕微鏡で画像をキャプチャします。
-
アルカリホスファターゼ(AP)染色
6.インビトロ 分化アッセイ
- 胚体(EB)分化
- iPSCコロニーを小片にカットし、胚性体培地の低着着電ペトリ皿で収集し、プレートします。3日ごとに培地を交換して細胞を15日間増殖させます。
注:日15のEBは、3つの胚芽層バイオマーカーの検出に直接使用することができます。あるいは、特異的細胞系統は、増殖因子を用いて誘導することができ、続いてバイオマーカー検出を行う。
- iPSCコロニーを小片にカットし、胚性体培地の低着着電ペトリ皿で収集し、プレートします。3日ごとに培地を交換して細胞を15日間増殖させます。
- 内胚葉(肝細胞)分化
- iPSCを多能性培地で単層培養で成長させる。
- 一度コンフルエント, 1xインスリントランスフェリンセレニンセレニットと100 ng /mLアクティビンAでRPMI 1640メディアに2日間シフトし、RPMI 1640培地の成長は30 ng /mL bFGFと20 ng /mL BMP4で9日間。2日ごとに培地交換を行います。
- 10日目以降、0.1 μMデキサメタゾンでメディアを補います。20日目に実験を終了します。
- 中皮(心筋細胞)分化
- プレート8日のEBは、胚性体培地中の0.5%マトリゲルコーティングされたプレートに付着した。EB をアタッチおよび折りたたむことを許可します。
- 20 ng / mL BMP4でメディアを補い、20日間成長します。2~3日ごとに培地交換を行います。20日目に実験を終了します。
- 外皮(神経細胞)分化
- プレート4日のEBを2μg/cm2 コラーゲン型IVコーティングプレートで胚状の体型でコーティングした。EB をアタッチおよび折りたたむことを許可します。
- 翌日、2mg/mLグルコース、1xインスリントランスフェリンセレニンセレニン、および2.5μg / mLフィブロネクチンを用いて、培地をDMEM F-12にシフトします。15日目に実験を終了します。
- 大脳オルガノイドの形成
- 70-80%コンフルエントまでMEFで35 mmの組織培養皿でTSiPSCを成長させます。コロニーをカットし、15 mLチューブに集める。225 x gで細胞を5分間遠心分離します。上清を捨てます。
- 上清を除去するためにPBSと遠心分離機の2 mLで再懸濁してコロニーの断片を洗浄します。
- 0.05%トリプシンの1 mLを追加し、細胞を取り除くためにチューブをタップします。37°Cで3~4分間チューブをインキュベートし、コロニー片を単一の細胞懸濁液に解体します。
- 10 μg/mLのrho関連プロテインキナーゼ(ROCK)阻害剤Y-27632二塩酸塩(ROCKi)を含む4mLの多能性培地で希釈することによりトリプシンを中和し、解離誘導細胞死を防ぎます。
- 遠心分離機はペレットを得る。上清を捨て、10μg/mL ROCKiを含む2mL胚体培地で細胞を再懸濁します。
- 細胞のカウントのための細胞懸濁液の10 μLを取り除きます。死んだ細胞を検出するためにトリパンブルーの10 μLを追加します。ヘモサイトメーターを使用して細胞を数えます。
- 細胞懸濁液にROCKiを含む胚体培地の適切な体積を加えると、150μL当たり9,000個の生細胞が得られます。
- 低い付着96-ウェルのプレートの各ウェルに150 μLをプレートし、37°Cで加湿CO2インキュベーターでインキュベートします。 プレートが24時間後に凝集したか確認してください。2日目に培地を静かに取り出し、ROCKiなしで新鮮な胚培地に交換します。
- 6日目に、1%N2サプリメント、2 mM GlutaMAXサプリメント、1 mM非必須アミノ酸と1 μg/mLヘパリンを含むDMEM-F12で構成される神経誘導培地500μLを含む低い添付着24ウェルプレートのウェルにEBを移します。2日ごとにメディアを変更します。
- 神経誘導媒体で5日後に200 μLの先端の空の先端の皿の上に2cm x 2 cmのパラフィルムの正方形を重ねることによってMatrigelの神経上皮の凝集物を埋め込む。小さなへこみを作るために先端の皿の各穴の上に手袋をした指でパラフィルムを押してください。70%エタノールを用いて洗浄したパラフィルムを殺菌する。
- パラフィルムスクエアを60mm皿に移します。切り取られた200 μLの先端を使用して、パラフィルム内のへこみ上に神経上皮骨材を移します。ピペットで余分な培地を除去します。
- 30 μLの解凍したマトリゲルを神経エピトリアル凝集体に加え、ピペットチップを使用してマトリゲルの中心に集合体を配置します。マトリゲルを重合するために37°Cインキュベーターに20〜30分間60mm皿を入れます。
- 1:1 DMEM-F12で構成される脳オルガノイド分化培地5 mLを加える:神経基底培地、0.5%N2サプリメント、インスリン2.5μg/mL、2 mMグルタマックスサプリメント、0.5 mM NEAA、1%B27サプリメント、ペニシリンストレプトマイシン2.5 mL。
- 無菌鉗子を使用してパラフィルムシートをひっくり返し、マトリゲル埋め込み骨材がシートから媒体に落ちるまで皿を攪拌する。加湿CO2 インキュベーターで37°Cで埋め込み骨材を4日間成長させ、代替日にメディアを変更します。
- 4日間の静電気培養の後、60mmの皿を50rpmで揺れるインキュベーターの中に取り付けた軌道シェーカーの上に置きます。3日毎に大脳オルガノイド分化培地で完全な培地変化を与える3ヶ月間オルガノイドを培養する。
結果
45XO核型を用いた自発的に中止された胎児からの統合自由なiPSCの生成
我々は、ターナー症候群(TS)特異的な45XO核型を有するFCVから線維芽細胞を単離し、エピソームリプログラミングプラスミドでこれらを核感染させ、症候群の下流モデリングに使用できるTSiPSC、特に関連する神経学的欠損を生成した(図1a&b)。トランスフェクション実験に非インテクティングエピソームベクターと核分裂を用いた(図1 c&d)。我々は、リプログラミングの成功を監視するために細胞の形態学的変化に従った。線維芽細胞から上皮形態への移行は、続いて、縮合コロニー形成を示した。.図2a)。TSiPSCは、トランスフェクション20日目頃に、異なるエッジと高い核対細胞質比を有する形態のようなヒト胚性幹細胞を獲得した(図2b)。対照的に、不完全に再プログラムされた細胞は上皮形態を獲得するが、コンパクトなコロニーを形成することができない。(図2c)。
TSiPSCの特徴付け
TSiPSCの核型のカリョタイピングは、ターナー症候群に関連する45XOの核型を明らかにした(図3a)。TSiPSCの免疫蛍光は、多能性転写因子OCT4、ナノグ、SOX2、および細胞表面マーカーSSEA4、E-カドヘリン、およびTRA-1-81の発現を示した。ヒト胚性幹細胞は、多能性幹細胞のゴールドスタンダードである。TSiPSCによる多能性バイオマーカー発現の比較に陽性対照として用いたHUES1の免疫蛍光を同時に行った(図3b)。TSiPSCのトランスジーンフリー状態は、エピソマルプラスミドマーカーOriPおよびEBNAに対するゲノムDNA PCRによって実証された。15を通過させることにより、TSiPSCではOriP遺伝子とEBNA遺伝子が失われ、エピソーム遺伝子を増幅し、この段階でエピソマルプラスミドの存在を示す9つのTSiPSCを通過に示した。しかし、これらの遺伝子は、エピソームプラスミドの消失を示す15のTSiPSCを通過中に増幅せず、したがってトランスジーンフリー状態である(図3c)。
インビトロ 分化アッセイ
TSiPSCラインの分化ポテンシャルは、インビトロで実証された。低い付着プレートで凝集したTSiPSCは、胚体を形成した(図4a)。TSiPSCの増殖因子誘導分化は、3つの生殖層の細胞タイプを生成するために使用された。系統特異的バイオマーカーを用いた免疫蛍光分析は、TSiPSCが内胚葉(SOX17)の代表的誘導体に分化したことを確認し、中胚葉(ミオシン室重いCHAINα/β)および外胚葉(βIII TUBULIN)(図4b)。
大脳オルガノイド分化。
TSiPSCは、ステージ賢明な方法で大脳オルガノイドとして分化された。TSiPSCの単一細胞懸濁液を胚体に凝集し、胚層の発育を最初の6日間刺激し、その後5日間の神経上皮発育の誘導を行った。神経上皮凝集体は、適切なアピコ基配向を支える細胞外マトリックスおよび基底膜成分を提供するMatrigelに埋め込まれ、内腔を膨張および形成する神経上皮芽の成長であった。神経上皮マーカーを用いた免疫蛍光を行い、オルガノイドの全体的な形態を観察した(図5b)。神経エピテリウムは、空洞のような心室を囲む(図5c - 白線)。器官は形態学的に心室領域(VZ)、サブ心室領域(SVZ)および皮質のような領域を表示する(図5c - 赤、オレンジおよび黄色の線)

図1:線維芽細胞の単離と核形成による再プログラミング (a)コラゲサーゼ治療の前に胎児絨毛絨毛絨毛の顕微鏡像。(b) リプログラミング実験のために胎児絨毛絨毛絨毛から単離された線維芽細胞。(c) EcoRI制限消化によるプレコンセドプラスミドの検証(d) エピソウレクションを介したエピソマルリプログラミングプラスミドを用いた胎児絨毛絨毛線維芽細胞からのiPSC生成に用いたトランスフェクションプロトコルの概略図。この図の大きなバージョンを表示するには、ここをクリックしてください。
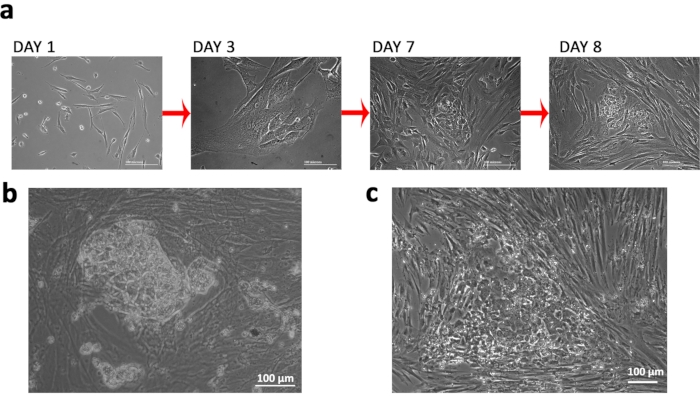
図2:ターナー症候群の樹立は多能性幹細胞を誘発した。() リプログラミングの時間経過中に観察される細胞形態変化(b) 完全に再プログラムされた TSiPSC コロニー。(c) 不適切に再プログラムされた細胞を有するコロニーの代表的な画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
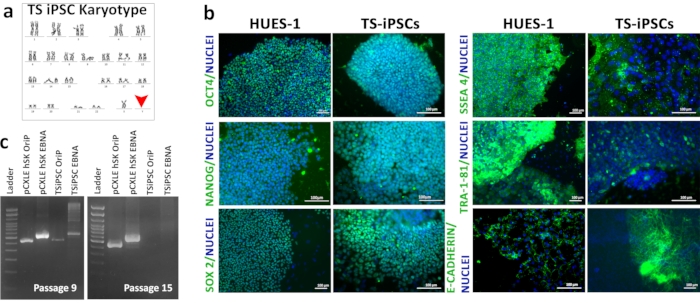
図3: TSiPSCの特徴 ()TSiPSCの核型。(b) TSiPSCにおける多能性バイオマーカーOCT4、NANOG、SOX2、SSEA-4およびTRA-1-81の免疫蛍光分析を、胚性幹細胞HUES1と比較した。核は4'、6-ジミディノ-2-フェニリンドールで染色されます。3c.TSiPSCのトランスジーンフリーステータスの実証レーン1-DNAラダー、レーン2-OriP陽性対照、pCXLE-hSK、レーン3-EBNA陽性対照、TSiPSC付きレーン4-オリP、TSiPSCを備えたレーン5-EBNA。この図の大きなバージョンを表示するには、ここをクリックしてください。
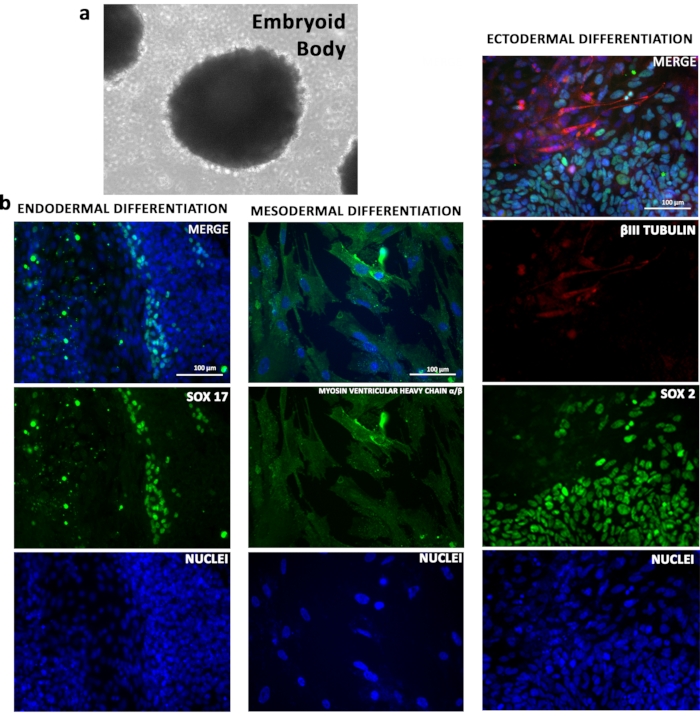
図4:TSiPSCのインビトロ分化ポテンシャル () TSiPSCは、胚体に分化した。(b)内皮マーカーSOX17、中胚葉マーカーミオシン心室重鎖α/βおよび外胚葉マーカーβIIIチューブリンおよびSOX2の免疫蛍光分析。核は4'、6-ジミディノ-2-フェニリンドールで染色されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
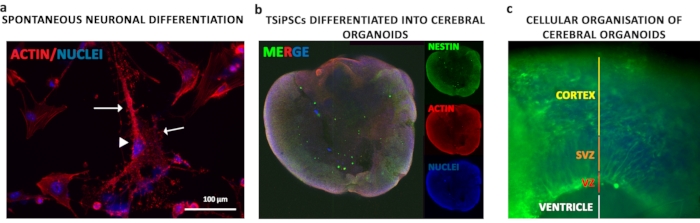
図5:TSiPSCの神経および脳オルガノイド分化 (a ) 分化したニューロンの細胞構造を理解するために、アクチンのファロイジン染色が行われた。TSiPSC由来のニューロンは、ピラミッド型の神経細胞ソーマ(矢印頭)を樹状突起と軸索(矢印)で表示した。核は4'、6-ジミディノ-2-フェニリンドールで染色されます。免疫染色。() ネチンおよびアクチンの免疫染色は、オルガノイドの総形態を観察する。(c) ネスチンの染色は、アパス的および基底的に組織化された神経層を可視化する。核は4'、6-ジミディノ-2-フェニリンドールで染色されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
表1:メディア、バッファ、およびソリューションの構成は、こちらをクリックしてこの表をダウンロードしてください。
表2:PCR反応ミックスこの表をダウンロードするには、ここをクリックしてください。
表3:PCRサイクリングプログラムこちらをクリックして、この表をダウンロードしてください。
ディスカッション
細胞遺伝学的に異常な胎児組織の安定した細胞モデルの生成は、欠陥表現型を永続させるために必要である。iPSC経路は、欠陥物20の永久保存のための細胞調製の最も効果的な方法である。
多能性幹細胞(PSC)は、初期の切断胚21を連想させる特殊な細胞への自己複製および分化の特性を示す。したがって、PSCは、早期に中絶された胎児の初期の分子、細胞および発達上の欠陥を研究するための優れたモデルとして役立つことができる。
本稿では、核分裂を用いたヒトiPSC生成と改善されたエピソームベクターについて説明した。この結果は、単一トランスフェクションがリプログラミングを成功させるために十分であったという事実によって証明されるように、この組み合わせは、統合のないヒトiPSCラインを生成するための堅牢な方法を含みであることを示している。我々は、FCV線維芽細胞から微小顕微鏡的に多能性細胞への進行性転換を追跡した。トランスフェクション後20日、我々は、非再プログラムされたFCV線維芽細胞に囲まれた再プログラムされたTSiPSCのコロニーを観察した。形態学的には、派生したヒトiPSCは、実験室で一緒に成長した胚性幹細胞に似ている。典型的には、細胞は光沢のある境界線を有するコンパクトなコロニーとして凝集した。コロニーの細胞は大きな核を有し、細胞間の密接な膜接触を示唆する緊密に詰め込まれた。非再プログラムされた線維芽細胞はアーチ状にし、これらのコロニーを取り囲んだ。iMEFへの移行後、彼らは継続的な自己更新の特性を示す30以上の転送のための文化で増殖し続けています。
TSiPSCが45XO線維芽細胞から生成されたので、我々は、彼らが染色体組成物を保持しているかどうかを確認するために細胞を型付けしました。TSiPSCは、安定な45XO染色体遺伝子組み立てを示唆する細胞連続培養において45XO核型を維持した。45XOの無数性を表す細胞資源として有用とするためには、TSiPSCは、リプログラミング実験で使用される外因性DNAを含まないべきである。エピソーム特異的マーカーオリPおよびEBNAに対してゲノムDNA PCRを行うことにより、残存エピソードプラスミドの存在を確認した。15の通過後にTSiPS細胞にこれらのマーカーの痕跡は見つからず、TSiPSCが長期培養中にエピソームリプログラミングベクターを徐々に失ったことを示唆した。
多能性細胞の特徴は、 インビトロ と インビボ の両方の3つの生殖系統の細胞に分化する可能性がある。この能力を誘導TSiPSCで試験するために、細胞腫体形成およびサイトカインおよび成長因子を特定する系統による分化アッセイを インビトロで 行った。TSiPSCは胚体を形成し、ニューロンマーカーを発現する外胚細胞に分化し、心マーカーを発現する中皮細胞およびエンドデドル運命のバイオマーカーをSOX17に発現する内胚細胞である。我々はまた、以前に確立されたプロトコル22を用いて、より高次の3D大脳オルガノイドに分化するTSiPSCの能力をテストした。TSiPSCは、オルガノイドと呼ばれるミニ組織への独自の本質的な発達プログラムのために徐々に自己組織化する。TSiPSCは、空洞のような心室を囲む神経エピテリウムを有する脳組織に類似した細胞アーキテクチャを示す脳オルガノイドを生み出した。しかし、これらのオルガノイドは、正確な細胞タイプを明らかにするためにさらに広範囲に特徴付け、TSiPSCの内在性神経組織パターニング特性を区別するために通常のiPSCと比較する必要があります。TSiPSCから生成されたこれらの脳オルガノイドおよび他のタイプの脳オルガノイドは、TS個人の神経学的欠乏の症状に寄与する可能性のある発達および機能的な矛盾をモデル化するために使用することができる。TSiPSCは多能性のバイオマーカー特性と分化の特徴を示し、多能性を誘発するリプログラミングの成功を強調した。
上述の方法は、我々の研究室で様々な供給源から導出された真皮線維芽細胞および間葉細胞の再プログラミングにおいて効率的に働いている(他の線のデータは示さない)。この経験では、リプログラミング実験を成功させるためには、次の手順が重要です。
a) プラスミド調製の品質: 古い準備は、iPSCを生成しません。
b) トランスフェクションに使用される細胞の品質:増殖細胞はiPSC生成に不可欠です。トランスフェクションあたり0.5~100万個の細胞が再現可能なリプログラミング効率を実現しました。
c) 新たに再構成された核の核形成試薬:1ヶ月以上保存された再構成された核原子試薬は、iPSCを生じなかった。
d) iPSCの機械的サブカルチャーによるマスターセルバンクの維持は安定したラインを生み出した。酵素解離は実験要件に従って用いた。
今後の目的は、この効率的な方法を用いて、下流の発達、機能および疾患モデリングのための染色体異常iPSCのパネルを確立することです。胎児の無数は、出生時に妊娠喪失および臓器奇形を引き起こす。自発的な中止の組織に由来する無数のiPSCは、失敗した胚発生事象をモデル化し、研究するための貴重なリソースです。胚体および組織特異的オルガノイド22を含むin vitro 2Dおよび3D培養システムは、異数体症候群に関連する発達異常および妊娠不全として現れる可能性のある系統特異的細胞における異常細胞増殖および細胞死などの分子および細胞の不規則性を理解することを可能にする。
開示事項
著者らは開示するものは何もない。
謝辞
上記の研究のための財政支援は、高等教育のマニパルアカデミーによって提供されました.ラインの特徴付けは、NCBSのM.Mパニッカーの研究室で部分的に行われました。アナンド診断研究所のカリョタイピングに関する支援に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.15% trypsin | Thermo Fisher Scientific | 27250018 | G Banding |
| 2-mercaptoethanol | Thermo Fisher Scientific | 21985023 | Pluripotency and Embryoid body medium |
| 4', 6 diamidino-2-phenylindole | Sigma Aldrich | D8417 | Immunocytochemistry |
| Activin A | Sigma Aldrich | SRP3003 | Differentiation assays |
| Alkaline Phosphatase Live Stain | Thermo Fisher Scientific | A14353 | AP staining |
| AMAXA Nucleofector II | Lonza | - | Nucleofection |
| AmnioMAX II complete media | Thermo Fisher Scientific, Gibco | 11269016 | Medium specific for foetal chorionic villi cell cultures |
| Ampicillin | HiMedia | TC021 | Plasmid purification |
| Anti Mouse IgG (H+L) Alexa Fluor 488 | Invitrogen | A11059 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 488 | Invitrogen | A11034 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 546 | Invitrogen | A11035 | Immunocytochemistry |
| Antibiotic-Antimycotic | Thermo Fisher Scientific, Gibco | 15240096 | Contamination control |
| Anti-E-Cadherin | BD Biosciences | 610181 | Immunocytochemistry |
| Anti-Nanog | BD Biosciences | 560109 | Immunocytochemistry |
| Anti-OCT3/4 | BD Biosciences | 611202 | Immunocytochemistry |
| Anti-SOX17 | BD Biosciences | 561590 | Immunocytochemistry |
| Anti-SOX2 | BD Biosciences | 561469 | Immunocytochemistry |
| Anti-SSEA4 | BD Biosciences | 560073 | Immunocytochemistry |
| Anti-TRA 1-81 | Millipore | MAB4381 | Immunocytochemistry |
| basic Fibroblast Growth Factor[FGF2] | Sigma Aldrich | F0291 | Pluripotency medium |
| Bone Morphogenetic Factor 4 | Sigma Aldrich | SRP3016 | Differentiation assays |
| Bovine Serum Albumin | Sigma Aldrich | A3059 | Blocking |
| Collagen Human Type IV | BD Biosciences | 354245 | Differentiation assays |
| Collagenase blend | Sigma Aldrich | C8051 | Digestion of foetal chorionic villi |
| Dexamethasone | Sigma Aldrich | D4902 | Differentiation assays |
| DMEM F12 | Thermo Fisher Scientific | 11320033 | Differentiation assays |
| FastDigest EcoR1 | Thermo Scientific | FD0274 | Restriction digestion |
| Fibronectin | Sigma Aldrich | F2518 | Differentiation assays |
| Giemsa Stain | HiMedia | S011 | G Banding |
| Glacial Acetic Acid | HiMedia | AS001 | Fixative for karyotyping |
| Glucose | Sigma Aldrich | G7528 | Differentiation assays |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Pluripotency and Embryoid body medium |
| Heparin sodium | Sigma Aldrich | H3149 | Differentiation assays |
| Insulin solution human | Sigma Aldrich | I9278 | Differentiation assays |
| Insulin Transferrin Selenite | Sigma Aldrich | I1884 | Differentiation assays |
| KAPA HiFi PCR kit | Kapa Biosystems | KR0368 | OriP, EBNA1 PCR |
| KaryoMAX Colcemid | Thermo Fisher Scientific | 15210040 | Mitotic arrest for karyotyping |
| KnockOut DMEM | Thermo Fisher Scientific | 10829018 | Pluripotency and Embryoid body medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Pluripotency and Embryoid body medium |
| Luria Bertani agar | HiMedia | M1151F | Plasmid purification |
| Matrigel | BD Biosciences | 356234 | Differentiation assays |
| MEM Non-essential amino acids | Thermo Fisher Scientific | 11140035 | Pluripotency and Embryoid body medium |
| Methanol | HiMedia | MB113 | Fixative for karyotyping |
| Myosin ventricular heavy chain α/β | Millipore | MAB1552 | Immunocytochemistry |
| NHDF Nucleofector Kit | Lonza | VAPD-1001 | Nucleofection |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | Fixing cells |
| pCXLE-hOCT3/ 4-shp53-F | Addgene | 27077 | Episomal reprogramming Plasmid |
| pCXLE-hSK | Addgene | 27078 | Episomal reprogramming Plasmid |
| pCXLE-hUL | Addgene | 27080 | Episomal reprogramming Plasmid |
| Penicillin Streptomycin | Thermo Fisher Scientific, | 15070063 | Pluripotency and Embryoid body medium |
| Phalloidin- Tetramethylrhodamine B isothiocyanate | Sigma Aldrich | P1951 | Immunocytochemistry |
| Phosphate buffered saline | Sigma Aldrich | P4417 | 1 X PBS 1 tablet of PBS dissolved in 200mL of deionized water and sterilized by autoclaving Storage: Room temperature. PBST- 0.05% Tween 20 in 1X PBS. Storage: Room temperature. |
| Plasmid purification Kit- Midi prep | QIAGEN | 12143 | Plasmid purification |
| Potassium Chloride Solution | HiMedia | MB043 | Hypotonic solution for karyotyping |
| QIAamp DNA Blood Kit | Qiagen | 51104 | Genomic DNA isolation |
| RPMI 1640 | Thermo Fisher Scientific | 11875093 | Hepatocyte differentiation medium |
| Sodium Citrate | HiMedia | RM255 | Hypotonic solution for karyotyping |
| Triton X-100 | HiMedia | MB031 | Permeabilisation |
| Trypsin-EDTA (0.05%) | Thermo Fisher Scientific, Gibco | 25300054 | Subculture of foetal chorionic villi fibroblasts |
| Tween 20 | HiMedia | MB067 | Preparation of PBST |
| β III tubulin | Sigma Aldrich | T8578 | Immunocytochemistry |
| Y-27632 dihydrochloride | Sigma Aldrich | Y0503 | Differentiation assays |
参考文献
- Verlinsky, Y., et al. Human embryonic stem cell lines with genetic disorders. Reproductive BioMedicine Online. 10, 105-110 (2005).
- Eiges, R., et al. Developmental Study of Fragile X Syndrome Using Human Embryonic Stem Cells Derived from Preimplantation Genetically Diagnosed Embryos. Cell Stem Cell. 1, 568-577 (2007).
- Biancotti, J. -. C., et al. Human Embryonic Stem Cells as Models for Aneuploid Chromosomal Syndromes. STEM CELLS. 28, 1530-1540 (2010).
- Li, W., et al. Modeling abnormal early development with induced pluripotent stem cells from aneuploid syndromes. Human Molecular Genetics. 21, 32-45 (2012).
- Gravholt, C. H., Viuff, M. H., Brun, S., Stochholm, K., Andersen, N. H. Turner syndrome: mechanisms and management. Nature Reviews Endocrinology. 15, 601-614 (2019).
- Luo, Y., et al. Uniparental disomy of the entire X chromosome in Turner syndrome patient-specific induced pluripotent stem cells. Cell Discovery. 1, 15022 (2015).
- Luo, Y., et al. Generation of an induced pluripotent stem cell line from an adult male with 45,X/46,XY mosaicism. Stem Cell Research. 27, 42-45 (2018).
- Parveen, S., Panicker, M. M., Gupta, P. K. Generation of an induced pluripotent stem cell line from chorionic villi of a Turner syndrome spontaneous abortion. Stem Cell Research. 19, (2017).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872 (2007).
- Soldner, F., et al. Parkinson's Disease Patient-Derived Induced Pluripotent Stem Cells Free of Viral Reprogramming Factors. Cell. 136, 964-977 (2009).
- Somers, A., et al. Generation of Transgene-Free Lung Disease-Specific Human Induced Pluripotent Stem Cells Using a Single Excisable Lentiviral Stem Cell Cassette. STEM CELLS. 28, 1728-1740 (2010).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G., Hochedlinger, K. Induced Pluripotent Stem Cells Generated Without Viral Integration. Science. 322, 945-949 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proceedings of the Japan Academy, Series B. 85, 348-362 (2009).
- Warren, L., et al. Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324, 797-801 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Martí, M., et al. Characterization of pluripotent stem cells. Nature Protocols. 8, 223-253 (2013).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nature Reviews Molecular Cell Biology. 17, 170-182 (2016).
- Ambartsumyan, G., Clark, A. T. Aneuploidy and early human embryo development. Human Molecular Genetics. 17, 10-15 (2008).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9, 2329-2340 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved