Method Article
Geração de Células-Tronco Pluripotentes Induzidas da Síndrome de Turner (45XO) Células Fetais para Modelagem A Jusante de Déficits Neurológicos Associados à Síndrome
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo descreve a geração de iPSCs livres de integração a partir de fibroblastos de tecido fetal através da entrega de plasmídeos epissomais por nucleofecção seguida pela descrição dos métodos utilizados para caracterização do iPSC e diferenciação neuronal.
Resumo
Aneuploidies cromossômicos causam malformações congênitas graves, incluindo malformações do sistema nervoso central e morte fetal. O rastreamento genético pré-natal é puramente diagnóstico e não elucida mecanismo da doença. Embora as células de fetos aneuploides sejam materiais biológicos valiosos que suportam a aneuploide cromossômica, essas células têm vida curta, limitando seu uso para experimentos de pesquisa a jusante. A geração de modelos de células-tronco pluripotentes induzidas (iPSC) é um método eficaz de preparação celular para conservação perpétua de traços aneuploides. São auto-renovados e diferenciados em células especializadas que lembram o desenvolvimento embrionário. Assim, os iPSCs servem como excelentes ferramentas para estudar eventos de desenvolvimento precoce. Síndrome de Turner (TS) é uma condição rara associada a um cromossomo X completamente ou parcialmente ausente. A síndrome é caracterizada por infertilidade, baixa estatura, endócrina, metabolica, autoimune e doenças cardiovasculares e defeitos neurocognitivos. O protocolo a seguir descreve o isolamento e a culminação de fibroblastos do tecido fetal TS (45XO), geração de TSiPSCs livres de integração através da entrega de plasmídeos de reprogramação epissomal por nucleosfeitivo seguido de caracterização. Os TSiPSCs de reprogramação foram inicialmente examinados por manchas de fosfatesas alcalinas de células vivas seguidas de sondagem extensiva para biomarcadores de pluripotência. Colônias selecionadas foram dissecadas mecanicamente, passagens várias vezes e células estáveis de auto-renovação foram utilizadas para outros experimentos. As células expressaram fatores de transcrição de pluripotência OCT4, NANOG, SOX2, marcadores de superfície celular SSEA 4 e TRA1-81 típicos de células-tronco pluripotentes. O karyotype 45XO original foi mantido após a reprogramação. Os TSiPSCs foram capazes de formar corpos embrionários e diferenciar-se em células de endoderme, mesoderme e ectoderme expressando biomarcadores específicos de linhagem ((SRY BOX17), (MYOSIN VENTRICULAR HEAVY CHAINα/β), (βIII TUBULIN)). Os plasmídeos episômicos exógenos foram perdidos espontaneamente e não detectados após a passagem 15 nas células. Estes TSiPSCs são um recurso celular valioso para modelar neurodesenvolvimento molecular e celular defeituoso causando déficits neurocognitivos associados à síndrome de Turner.
Introdução
As aneuploidias levam a defeitos congênitos/malformações congênitas e perda de gravidez em humanos. ~50%-70% dos espécimes de perdas de gravidez mostram anormalidades citogenéticas. Embriões aneuploides perdidos no início da gravidez não podem ser facilmente obtidos para análise experimental, levantando a necessidade de desenvolver outros modelos representando de perto a embriogênese humana. Células-tronco pluripotentes induzidas (iPSCs) derivadas de células diagnosticadas com distúrbios genéticos têm sido utilizadas para modelar as irregularidades genéticas representativas e suas consequências no desenvolvimento fetal1,2,3,4. Estes iPSCs se assemelham a células epiblastos do embrião em desenvolvimento e podem recapitular os primeiros eventos da formação de embriões. Permitem a compreensão e caracterização do programa de desenvolvimento de linhagens celulares e padronização em embriões mamíferos primitivos. iPSCs derivados anteriormente de fibroblastos de pele e amniócitos de testes de diagnóstico pré-natal de síndromes de aneuploidia como monosomia X (síndrome de Turner), trissomia 8 (síndrome warkany 2), trissomia 13 (síndrome de Patau) e trissomia parcial 11; 22 (síndrome de Emanuel) forneceram insights valiosos sobre o desenvolvimento fracassado4.
A síndrome de Turner (TS) é uma condição rara caracterizada pela infertilidade feminina, baixa estatura, distúrbios endócrinos e metabólicos, um risco aumentado de doença autoimune e uma predisposição à doença cardiovascular5. Embora seja a única síndrome de monossomia sobrevivente, também é letal para o embrião em desenvolvimento causando abortos espontâneos6. Indivíduos sobreviventes com TS apresentam graus de alteração de material x-cromossômico em suas células. Os karyótipos variam da perda completa de um cromossomo X (45,XO) a mosaicos como 45,XO/46,XX; 45,XO/47,XXX, a presença de cromossomos de anel, a presença de material cromossômico Y, etc5.
O diagnóstico da síndrome é geralmente feito por karyotipping sangue de indivíduos sintomáticos e amostragem de villi coriônica (CVS) para detectar síndromes de aneuploidia precoce. Como as síndromes de aneuploidia são responsáveis por ~30% dos abortos espontâneos, é rotina o karyótipo do produto da concepção (POC) após um aborto espontâneo. Essas células fetais, incluindo o villi coriônico que possui a anormalidade citogenética e os iPSCs derivados delas fornecem uma valiosa fonte de material biológico para estudar as síndromes de aneuploide4,6. Os IPSCs de TS foram previamente estabelecidos a partir de amniocitos via reprogramação retroviral4, fibroblastos de villi coriônico (obtidos através de diagnóstico pré-natal) via reprogramação retroviral6, a partir de células mononucleares de sangue7 via reprogramação do vírus Sendai e de fibroblastos de pele de indivíduos TS via reprogramação lentitina4 . Como o foco principal do nosso laboratório é entender a falha no desenvolvimento, geramos iPSCs de TS do POC, especificamente o componente de villi coriônico de um aborto espontâneo8. Todas as células isoladas deste tecido fetal tinham um karyótipo 45XO e produziam iPSCs com o mesmo karyótipo. Esses iPSCs são únicos, pois são os primeiros a serem gerados a partir de um feto abortado e fornecem um recurso valioso para estudar falhas relacionadas à aneuploidey. Este artigo fornece uma metodologia detalhada da geração de iPSCs a partir desta fonte celular única através da reprogramação epissomal.
Os primeiros métodos de geração iPSC utilizaram transdução viral e transposons para entregar os fatores de reprogramação. Os métodos de induzir células à pluripotência evoluíram do uso de vetores retrovirais integradores9, vetores lentiviras excisáveis10,11 e métodos baseados em transposon12 para vetores adenovirais não integradores13 e vetores baseados em vírus Sendai14. A reprogramação baseada em retroviral e lentiviral, embora eficiente, envolve a integração dos fatores de reprogramação nos cromossomos hospedeiros, causando mutações de inserção que têm efeitos imprevistos nos iPSCs. Além disso, a reprogramação baseada em virais impede a aplicação translacional de iPSCs. Os sistemas baseados em RNA15 e a entrega direta deproteínas 16 foram explorados para eliminar completamente os riscos potenciais associados ao uso de vírus e transfecções de DNA. No entanto, esses métodos têm se mostrado ineficientes.
Em 2011, Okita et al. relataram maior eficiência de reprogramação por plasmídeos episômicos aumentados com supressão TP53 via shRNA. Eles também substituíram o cMYC por LMYC não transformador (carcinoma pulmonar de células pequenas associados myc) para aumentar a segurança dos hiPSCs. Estes plasmídeos episômicos expressam 5 fatores de reprogramação: OCT4, LIN28, SOX2, KLF4, LMYC e shRNA para TP5317,18. Esses vetores são mantidos extra-cromosomally e perdidos das células reprogramadas sobre a cultura contínua, tornando as linhas livres de transgene dentro de 10-15 passagens. A nucleofecção é uma forma especializada de eletroporação que fornece ácidos nucleicos diretamente no núcleo das células hospedeiras. É um método eficiente para a entrega dos plasmídeos de reprogramação em vários tipos de células. Plasmídeos episômicos são econômicos e compensam os altos custos de nucleosfeição. Este método é eficiente e reprodutível em condições otimizadas, produzindo iPSCs estáveis de uma variedade de células somáticas. Neste protocolo, descrevemos o método de geração de iPSCs a partir de fibroblastos isolados do tecido fetal por nucleofecção de plasmídeos de reprogramação epissomal. Aqui estão os protocolos detalhados para o isolamento do fibroblasto a partir de villi coriônico fetal, purificação plasmida, nucleofecção, colheita de colônias da placa de reprogramação e estabelecimento de iPSCs estáveis.
É essencial confirmar a presença de traços de pluripotência nos iPSCs recém-gerados. Isso inclui a demonstração de fatores relacionados à pluripotência (por exemplo, expressão alcalina fosfatase, NANOG, SSEA4, Tra 1-80, Tra 1-81, E-cadherin; geralmente mostrado com imunofluorescência ou ensaios de expressão genética), identificação das três camadas de germes por ensaios de diferenciação in vitro para validar seus potenciais de diferenciação, karyotyping para determinar conteúdo cromossômico, digitação STR para estabelecer identidade com células-pais, verificar perda de genes exógenos, e ensaios in vivo mais rigorosos, como formação de teratoma e complementação tetraploide. Aqui descrevemos protocolos de caracterização de kariotipagem, coloração alcalina de fosfatese de células vivas, detecção de biomarcadores relacionados à pluripotência por imunofluorescência, ensaios de diferenciação in vitro e método para demonstrar perda de genes exógenos19.
Protocolo
A FCV foi obtida no Hospital Manipal, Bengaluru, sob aprovação do Comitê de Ética dos Hospitais Manipal.
NOTA: Consulte a Tabela 1 para a composição de todos os buffers e soluções.
1. Isolamento de fibroblastos de villi coriônico fetal (FCV)
-
Coleta de amostras e desintegração tecidual em colagemnase
- Colete FCV em condições estéreis em soro fisiológico tamponado de fosfato (PBS) e transporte (à temperatura ambiente) para a instalação de cultura celular.
- Transfira o villi para uma placa de Petri de 60 mm e lave várias vezes (mínimo 4 vezes) em PBS contendo 1x solução antimíctica antibiótico (PBS-AA). Remova o PBS-AA completamente por pipetação.
- Trate o villi coriônico com 1 mL de mistura de colagenase (5 mg/mL) por 5 min a 37 °C.
- Neutralizar com meio de cultura celular contendo 10% de soro bovino fetal (FBS), transferir digestão para um tubo de 15 mL e centrífuga a 225 x g por 5 minutos para coletar as villi desintegradas e células liberadas como pelota.
-
Subcultura e expansão de estoque
- Placa desintegrou villi junto com células liberadas em um frasco de cultura T25 contendo 5 mL de mídia completa (por exemplo, AmnioMAX) e crescer até que uma cultura fibroblasto confluente seja obtida.
- Expandir os fibroblastos na cultura para preparar estoques para uso em experimentos subsequentes de transfecção e caracterização da seguinte forma:
- Adicione 2 mL de 0,05% de trippsina ao frasco T25 contendo fibroblastos FCV e incubar a 37 °C por 3-5 min para dissociar as células.
- Após a incubação, neutralize a trippsina adicionando FBS (no mesmo volume que a trippsina).
NOTA: O meio cultural contendo FBS também pode ser usado para neutralizar a trippsina, quando adicionado a uma trippsina de 1:3: proporção de mídia. - Colete as células dissociadas em um tubo de 15 mL e centrífuga a 225 x g por 5 min para obter pelota celular.
- Decant supernatant e resuspend cell pellet in 1 mL de mídia completa.
- Transfira 500 μL cada para 60 mm pratos tratados com cultura de tecido e compor o volume para 5 mL. Esta razão de divisão de 1:2, também foi utilizada para passagens subsequentes.
-
Criopreservação
- Realizar dissociação enzimática utilizando trippsina de 0,05% conforme descrito nas etapas 1.2.2.1 - 1.2.2.3 e obter pelota celular.
- Descarte o supernaspe e resuspenque a pelota celular em 1 mL de mistura de congelamento, compreendendo 1:9 dimetil sulfoxida (DMSO): FBS.
- Transfira o conteúdo para um criovial estéril e coloque o frasco em um recipiente de congelamento.
- Congele durante a noite a -80 °C e depois transfira frascos para nitrogênio líquido (-196 °C) no dia seguinte.
2. Plasmids DNA Isolamento e verificação
-
Preparação de células bacterianas
- Estoques de glicerol de E. coli contendo os três plasmídeos individuais pCXLE-hOCT3/4-shp53-F, pCXLE-hSK e pCXLE-hUL (de Addgene) em placas separadas de ágar Luria Bertani-ampicillin.
- Inoculam colônias únicas em culturas iniciais de 5 mL do meio Luria Bertani-ampicillin. Incubar por 8 horas a 37 °C com agitação (10 x g).
- Inocular 200 μL desta cultura inicial em 100 mL de meio Luria Bertani-ampicillin. Incubar durante a noite a 37 °C com agitação.
- Colher cultura bacteriana durante a noite por centrifugação a 6000 x g por 15 min a 4 °C.
-
Isolamento plasmídeo com kit de purificação Midi Plasmid
- Resuspend pelotas bacterianas em tampão de resuspensão de 4 mL.
- Adicione 4 mL de tampão de lise e misture bem invertendo vigorosamente 4-6 vezes e incubar à temperatura ambiente por 5 minutos.
- Adicione 4 mL de tampão de neutralização pré-refrigerado e inverta tubo 4-6 vezes para misturar bem. Incubar no gelo por 15 minutos.
- Centrifugar a ≥ 20.000 x g por 30 min a 4 °C. Colete supernante em um tubo fresco e re-centrífuga a ≥20.000 x g por 15 min a 4 °C.
- Equilibre a coluna aplicando 4 mL de tampão de equilíbrio.
- Aplique o supernatante à coluna.
- Lave a coluna duas vezes com 10 mL de tampão de lavagem.
- DNA eluto com 5 mL de tampão de eluição quente (65 °C).
- Precipitar DNA adicionando 3,5 mL de isopropanol ao DNA elucido. Misture bem. Centrifugar a ≥15.000 x g por 30 min a 4 °C. Decant supernatant com cuidado.
- Lave a pelota de DNA com 2 mL de 70% de etanol e centrífuga a ≥15.000 x g por 10 min. Decant supernatant com cuidado.
- Pelota seca a ar por 5-10 min e dissolver o DNA em um volume adequado de água de grau PCR para obter uma concentração final de 1 μg/mL.
NOTA: Não dissolva o DNA em buffers, pois não é adequado para eletroporação. A velha preparação de DNA plasmídeo não produz colônias reprogramadas.
-
Verificação plasmid por digestão de restrição EcoRI
- Combine 15 μL de água sem nuclease, 2 μL de tampão de 10x, 1 μg de DNA plasmídeo e 1 μL de enzima EcoRI. Misture suavemente.
- Incubar a mistura a 37 °C por 15 min em um bloco de calor.
- Misture as amostras de plasmídeo digeridas com corante de carregamento de gel de DNA 6x e eletroforese em gel de 1% de agarose em 1x tampão TAE com 0,5 μg/mL de brometo de ethidium. Inclua a escada de DNA padrão. Imagem do gel depois que o DNA se resolveu apropriadamente. Os tamanhos esperados de banda EcoRI de pCXLE-hOCT3/ 4-shp53-F são de 6.834 bp, 3.758 bp e 1.108 bp; pCXLE-hUL são 10.200 bp e 1.900 bp; pCXLE-hSK são 10.200 bp e 2.500 bp.
3.Nucleofecção
-
Pelotização celular
- Cultura os isolados fibroblastos de villi coriônicos em frasco T25 em 5 mL de mídia completa até 80-90% de confluência.
- Lave as células duas vezes com PBS e trypsinize conforme descrito nas etapas 1.2.2.1 - 1.2.2.3.
- Remova a pelota supernascida e resuspendada em 5 mL de mídia soro reduzida (por exemplo, Opti-MEM). Conte células com hemócito e pegue 106 células para nucleofeipulação. Centrifugar a 225 x g por 5 min. Remova o supernatante completamente.
-
Preparação de reagentes e nucleofeipulação
- Prepare o reagente nucleofectador misturando 0,5 mL de suplemento e 2,25 mL de solução nucleosfectora (ambas fornecidas no kit).
- Adicione 100 μL de solução nucleosfectora em um tubo de 1,5 mL. Adicione 1μg cada um de pCXLE-hOCT3/4-shp53-F, pCXLE-hSK e pCXLE-hUL ao tubo. Resuspenque suavemente 106 células (a partir do passo 3.1.2) nesta mistura.
- Transfira a suspensão do DNA celular para cuvette, garantindo que a amostra cubra a parte inferior do cuvette (fornecido no kit) sem bolhas de ar. Tampe a cuvette e insira no suporte. Selecione o programa nucleofector U-23 (para alta eficiência) e aplique.
- Retire o cuvette do suporte e adicione 1 mL de mídia completa. Transfira o conteúdo suavemente para uma placa de Petri tratada com 60 mm de cultura de tecido, preenchida com 4 mL de mídia completa (para um total de 5 mL de mídia). Incubar as células em uma incubadora de CO2 umidificada a 37 °C.
- Depois das 24h, verifique se as células se anexaram. Substitua completamente o meio.
NOTA: A taxa de morte celular é alta na nucleofecção deixando poucas células viáveis que se prendem. - Mantenha as células em mídia completa por 10 dias e mude para mídia de pluripotência pelos próximos 20 dias.
NOTA: Visualize as células regularmente para seguir alterações morfológicas ocorridas nas células de reprogramação (como morfologia epitelial e formação de colônias compactas) para confirmar se o experimento está funcionando. Cerca de 25 colônias iPSC podem ser vistas após 20 dias de cultura em mídia pluripotência.
4. Colheita e propagação de colônias iPSC
-
Colônia de colheita da placa de reprogramação
- Dissecar manualmente as colônias embrionárias semelhantes a células-tronco formadas na placa de reprogramação usando pipetas de vidro puxadas ou agulhas de seringa de 1 mL e transferir para placa previamente preparada com alimentadores de fibroblasto embrionários de camundongos inativados com meio pluripotency ou estabelecer culturas livres de alimentadores em placas revestidas de Matrigel com meio mTESR.
NOTA: Os fibroblastos embrionários do camundongo (MEFs) foram derivados usando isolamento enzimático de embriões de camundongos (dissecados de camundongos gestantes de 13 a 14 dias) e foram mitoticamente inativados pelo tratamento mitomicina C. Estabeleça populações de clones únicos, cultivando colônias únicas de placas de reprogramação em pratos separados ou populações de clones mistos, transferindo muitas colônias de placa de reprogramação para um único prato.
- Dissecar manualmente as colônias embrionárias semelhantes a células-tronco formadas na placa de reprogramação usando pipetas de vidro puxadas ou agulhas de seringa de 1 mL e transferir para placa previamente preparada com alimentadores de fibroblasto embrionários de camundongos inativados com meio pluripotency ou estabelecer culturas livres de alimentadores em placas revestidas de Matrigel com meio mTESR.
-
Transferência mecânica de colônias emergentes para alimentadores frescos e passaging para estabelecer iPSCs estáveis
- Propagar iPSCs em meio pluripotência alimentando-se a cada dois dias e dividindo 1:3 a cada 5-7 dias. Prepare os estoques criopreservando em uma mistura de congelamento de KnockOut Serum Replacement e DMSO na proporção 9:1.
NOTA: A substituição do soro knockout é usada no mix de congelamento para criopreservação de iPSCs em vez de FBS, pois componentes no FBS poderiam induzir a diferenciação das células pluripotentes durante a preservação a longo prazo.
- Propagar iPSCs em meio pluripotência alimentando-se a cada dois dias e dividindo 1:3 a cada 5-7 dias. Prepare os estoques criopreservando em uma mistura de congelamento de KnockOut Serum Replacement e DMSO na proporção 9:1.
5. Caracterização de iPSCs
NOTA: Estudos de caracterização, incluindo PCR e imunostaining para biomarcador pluripotency foram feitos após o quinto número de passagem. Karyotyping foi realizado em um número de passagem posterior.
- Karyotyping
- Trate uma placa de Petri confluente de 60 mm de iPSCs com colcemid por 45 min na incubadora de CO2 umidificada a 37 °C.
- Colheita em 0,05% de tratamento de trippsina e centrífuga. Remova o supernatante e pipeta os traços restantes do meio para soltar a pelota celular.
- Adicione 5 mL de solução hipotônica. Misture invertendo o tubo e incubar por 20 minutos a 37 °C. Centrifugar a 225 x g por 5 min.
NOTA: A pelota obtida deve parecer fofa. - Adicione 2,5 mL da solução fixativa de Carnoy lentamente, enquanto toca para soltar a pelota.
- Prepare os spreads para karyotipagem, deixando cair a suspensão da célula em lâminas de vidro limpas.
- Trate os slides com 0,15% de trippsina por 1 minuto e lave uma vez com PBS. Em seguida, colora com solução Giemsa por 4 min e final com uma lavagem de água destilada. Adquirir e processar com software adequado.
- Demonstração do status livre de transgene
-
Isolamento genômico do DNA
- Pipeta 20 μL de protease na parte inferior de um tubo de microcentrifuuge de 1,5 mL.
- Adicione 200 μL de TSiPSCs resuspendidos em PBS ao tubo de microcentrifusagem.
- Adicione 200 μL de Buffer AL à amostra e misture por 15 s por vórtice de pulso.
- Incubar por 10 min a 56 °C.
- Centrifufique brevemente o tubo de microcentrifuuagem para remover gotas do interior da tampa.
- Adicione 200 μL de etanol (96-100%) à amostra, e misture novamente por 15 s por vórtice de pulso. Após a mistura, centrifufique brevemente o tubo para remover gotas do interior da tampa.
- Aplique cuidadosamente a mistura da etapa anterior à coluna mini spin (em um tubo de coleta de 2 mL) sem molhar a borda. Feche a tampa e centrífugas a 6000 x g por 1 min. Descarte o tubo que contém o filtrado e coloque a coluna mini spin em um tubo de coleta limpo de 2 mL.
- Abra cuidadosamente a coluna mini spin e sem molhar a borda, adicione 500 μL de Buffer AW1. Feche a tampa e centrífuga a 6000 x g por 1 min. Coloque a coluna mini spin em um tubo de coleta limpo de 2 mL e descarte o tubo de coleta contendo o filtrado.
- Abra cuidadosamente a coluna mini spin e adicione 500 μL de Buffer AW2 sem molhar a borda. Feche a tampa e a centrífuga a toda velocidade (20.000 x g) por 3 min.
- Coloque a coluna mini spin em um novo tubo de coleta de 2 mL e descarte o tubo de coleta antigo com o filtrado. Centrifugar a toda velocidade por 1 min para eliminar a chance de possível transferência tampão AW2.
- Coloque a coluna mini spin em um tubo de microcentrifusagem de 1,5 mL limpo e descarte o tubo de coleta contendo o filtrado. Abra cuidadosamente a coluna mini spin e adicione 200 μL buffer AE ou água destilada. Incubar à temperatura ambiente (15-25 °C) por 5 min e, em seguida, centrífugas a 6000 x g por 1 min.
-
Pcr de status sem transgene (usando kapa hifi pcr kit KR0368)
- Certifique-se de que todos os reagentes estão devidamente descongelados e misturados.
- Prepare uma mistura mestre pcr contendo o volume apropriado de todos os componentes de reação com base na Tabela 2 (configurar reações no gelo).
- Transfira os volumes apropriados de mix, modelo e primer pcr para tubos PCR individuais.
- Cap reações individuais, misture e centrifuge brevemente.
- Execute o PCR seguindo a Tabela 3.
-
Isolamento genômico do DNA
- Identificação biomarcador de pluripotência
-
Mancha de fosfatismo alcalino (AP)
- Prepare uma solução de trabalho de 1x AP live stain diluindo 3 μL de solução de estoque de 500x em 1,5 mL DMEM/F-12 para cada 10 cm2 de área de cultura.
- Remova o meio do prato de cultura iPSC. Lave a cultura com DMEM/F-12 uma vez. Adicione a solução de mancha viva 1x AP aos iPSCs. Incubar a 37 °C por 45 min.
- Remova a mancha AP e lave duas vezes com DMEM/F-12. Adicione DMEM/F-12 frescos e imagem sob microscópio fluorescente usando um filtro FITC padrão dentro de 30-90 minutos de coloração.
-
Imunostaining para biomarcadores de pluripotência
- Corrija culturas confluentes de iPSC com 4% de paraformaldeído durante a noite a 4 °C. Lave três vezes com PBS Tween 20 (PBST), cada lavagem por 5 min.
- Permeabilize as células com 0,3% Triton X-100 em PBST por 15 minutos em temperatura ambiente. Lave três vezes com PBST.
NOTA: A permeabilização deve ser feita apenas para antígenos intracelulares. - Bloqueie células com 3% de albumina de soro bovino (BSA) em PBST por 30 minutos a temperatura ambiente. Manche as células com anticorpos primários (diluídos 1:1000 em 1% BSA) durante a noite. Após a incubação primária de anticorpos, lave três vezes com PBST.
- Incubar células com o anticorpo secundário (diluído 1:1000 em 1% BSA) por 5 h à temperatura ambiente. Lave três vezes com PBST.
- Rotule os núcleos com 0,5 μg/mL 4',6-diamidino-2-fenilôdole (DAPI) por 1 minuto. Lave as células uma vez com PBST.
- Capture imagens sob microscópio fluorescente.
-
Mancha de fosfatismo alcalino (AP)
6.Ensaios de diferenciação in vitro
- Diferenciação do corpo embrionário (EB)
- Corte as colônias iPSC em pequenos pedaços, colete e emplaque em placas de Petri de baixa fixação em meio de corpo embrionário. Cresça as células por 15 dias substituindo o meio a cada 3 dias.
NOTA: O dia 15 EBs pode ser usado diretamente para detecção dos três biomarcadores de camada de germes. Alternativamente, as linhagens celulares específicas podem ser induzidas com fatores de crescimento, seguidas pela detecção de biomarcadores.
- Corte as colônias iPSC em pequenos pedaços, colete e emplaque em placas de Petri de baixa fixação em meio de corpo embrionário. Cresça as células por 15 dias substituindo o meio a cada 3 dias.
- Diferenciação do endoderm (Hepatocite)
- Cultivar os iPSCs em culturas de monocamadas em meio de pluripotência.
- Uma vez confluente, mude para mídia RPMI 1640 com 1x Insulina Transferrin Selenite e 100 ng/mL activin A por 2 dias, seguido de crescimento em mídia RPMI 1640 com 30 ng/mL bFGF e 20 ng/mL BMP4 por 9 dias. Substitua o meio a cada 2 dias.
- A partir do dia 10, complemente a mídia com dexametasona de 0,1 μM. Termine o experimento no dia 20.
- Mesodermia (Cardiomiocócito) diferenciação
- Placa dia 8 EBs em placas revestidas de Matrigel em meio de corpo embrionário. Permitir que os EBs se conectem e entrem em colapso.
- Complementar mídia com 20 ng/mL BMP4 e crescer por 20 dias. Substitua o meio a cada 2-3 dias. Termine o experimento no dia 20.
- Diferenciação do ectoderm (neuronal)
- Placa dia 4 EBs em 2 μg/cm2 placas revestidas de colágeno tipo IV em meio de corpo embrionário. Permitir que os EBs se conectem e entrem em colapso.
- No dia seguinte, mude de médio para DMEM F-12 com glicose de 2mg/mL, 1x Insulina Transferrin Selenite e fibronectina de 2,5μg/mL. Termine o experimento no dia 15.
- Formação de organoides cerebrais
- Cultivar TSiPSCs em um prato de cultura de tecido de 35 mm em MEFs até 70-80% confluentes. Corte as colônias e colete em um tubo de 15 mL. Centrifugar as células a 225 x g por 5 min. Descarte o supernatante.
- Lave os pedaços das colônias reutilizando em 2 mL de PBS e centrífuga para remover o supernaspe.
- Adicione 1 mL de trippsina de 0,05% e toque no tubo para desalojar as células. Incubar o tubo a 37 °C por 3-4 min para dissociar as peças da colônia em uma única suspensão celular.
- Neutralizar a trippsina por diluição com 4 mL de mídia pluripotency contendo 10 μg/mL rho-associated protein quinase (ROCK) inibidor Y-27632 dihidrocloreto (ROCKi) para evitar a dissociação induzida morte celular.
- Centrífuga para obter uma pelota. Descarte o supernaspe e resuspenja as células em meio de corpo embrióide de 2mL contendo 10 μg/mL ROCKi.
- Remova 10 μL de suspensão celular para contagem de células. Adicione 10 μL de azul Trypan para detectar células mortas. Conte as células usando um hemócito.
- Adicione o volume apropriado do meio do corpo embrionário com ROCKi à suspensão celular para obter 9.000 células vivas por 150 μL.
- Placa 150 μL em cada poço de uma placa de baixa fixação de 96 poços e incubar em uma incubadora de CO2 umidificada a 37 °C. Verifique se as placas estão agregando após 24 horas. No dia 2, remova suavemente o meio e substitua-o por meio embrionário fresco sem ROCKi.
- No dia 6, transfira EBs para poços de baixa fixação 24 placas de bem contendo 500 μL de meio de indução neural composto por DMEM-F12 com suplemento N2 de 1%, suplemento glutaMAX de 2 mM e 1 mM aminoácidos não essenciais e heparina de 1 μg/mL. Troque o meio a cada 2 dias.
- Após 5 dias em meio de indução neural incorporar os agregados neuroepiteliois em Matrigel, colocando em camadas um quadrado de 2 cm x 2 cm quadrados de parafilm sobre uma bandeja de ponta vazia de 200 pontas μL. Pressione o parafilm com os dedos enluvados sobre cada orifício na bandeja de ponta para fazer pequenos amassados. Parafilme limpo com 70% de etanol para esterilizar.
- Transfira o quadrado do parafilm em um prato de 60 mm. Use pontas de corte de 200 μL para transferir os agregados neuroepiteliois para os amassados no parafilm. Remova o excesso de meio por pipetação.
- Adicione 30 μL de Matrigel descongelado nos agregados neuroepithlial e posicione o agregado ao centro do Matrigel usando uma ponta de pipeta. Coloque o prato de 60 mm por 20-30 min em uma incubadora de 37 °C para o Matrigel polimerizar.
- Adicionar 5 mL de meio de diferenciação organoide cerebral composto por 1:1 DMEM-F12: Médio neurobásal, suplemento de 0,5% N2, 2,5 μg/mL de insulina, suplemento glutaMAX de 2 mM, 0,5 mM NEAA, 1% suplemento B27 e 2,5 mL de penicilina-estreptomia.
- Usando uma fórceps estéril, gire a folha de parafilm e agitar o prato até que os agregados incorporados do Matrigel caiam da folha no meio. Cresça os agregados incorporados em uma incubadora de CO2 umidificada a 37 °C durante 4 dias, dando alterações na mídia em dias alternados.
- Após 4 dias de cultura estática coloque os pratos de 60 mm em um agitador orbital instalado dentro da incubadora tremendo a 50 rpm. Cultura os organoides por 3 meses dando mudanças completas na mídia com meio de diferenciação organoide cerebral a cada 3 dias.
Resultados
Geração de iPSCs livres de integração de um feto abortado espontaneamente com karyótipo 45XO
Isolamos os fibroblastos da FCV com uma síndrome de Turner (TS) específica do karyótipo 45XO e os nucleofectamos com plasmídeos de reprogramação epissomal para gerar TSiPSCs que podem ser usados para modelagem a jusante da síndrome, especificamente os déficits neurológicos associados(Figura 1a&b). Utilizamos vetores episômicos não intencionais e nucleofecção para os experimentos de transfecção(Figura 1 c&d). Seguimos mudanças morfológicas das células para monitorar o sucesso da reprogramação. Observou-se a mudança do fibroblasto para a morfologia epitelial, seguida de formação de colônia compacta delineada(Figura 2a). Os TSiPSCs adquiriram células-tronco embrionárias humanas como a morfologia com bordas distintas e uma alta relação núcleo-citoplasma por volta do dia 20 após a transfecção(Figura 2b). Em contraste, células incompletamente reprogramadas adquirem morfologias epiteliais, mas não conseguem formar colônias compactas. (Figura 2c).
Caracterização de TSiPSCs
O karyotyping de TSiPSCs revelou o karyótipo 45XO associado à Síndrome de Turner (Figura 3a). A imunofluorescência dos TSiPSCs mostrou expressão dos fatores de transcrição de pluripotência OCT4, NANOG, SOX2 e marcadores de superfície celular SSEA4, E-Cadherin e TRA-1-81. Células-tronco embrionárias humanas são o padrão-ouro das células-tronco pluripotentes. Realizamos simultaneamente a imunofluorescência do HUES 1 que foi utilizado como controle positivo para comparação da expressão biomarcador de pluripotência por TSiPSC (Figura 3b). O status livre transgene dos TSiPSCs foi demonstrado por um PCR de DNA genômico para marcadores pládicos plasmídeos OriP e EBNA. Na passagem 15, os genes OriP e EBNA foram perdidos nos TSiPSCs.Os genes epissomais OriP e EBNA foram amplificados e mostraram bandas na passagem 9 TSiPSCs indicando a presença dos plasmídeos episômicos nesta fase. No entanto, esses genes não foram amplificados na passagem 15 TSiPSCs indicando a perda dos plasmídeos epissomais e, portanto, um estado livre transgene(Figura 3c).
Ensaios de diferenciação in vitro
O potencial de diferenciação das linhas TSiPSC foi demonstrado in vitro. TSiPSCs após agregação em placas de baixa fixação formaram corpos embrionários(Figura 4a). O fator de crescimento induzido diferenciação de TSiPSCs foi utilizado para gerar tipos celulares das três camadas de germes. A análise da imunofluorescência utilizando biomarcadores específicos de linhagem confirmou que os TSiPSCs diferenciados em derivados representativos do endoderm (SOX17), mesoderm (MYOSIN VENTRICULAR HEAVY CHAINα/β) e ectoderm (βIII TUBULIN)(Figura 4b).
Diferenciação organoide cerebral.
Os TSiPSCs foram diferenciados como organoides cerebrais de forma sábia. As suspensões de células únicas de TSiPSCs foram agregadas em corpos embrionários para estimular o desenvolvimento de camadas germinativas durante os 6 dias iniciais seguidos pela indução do desenvolvimento neuroepiteliol por 5 dias. Os agregados neuroepiteliois foram eles incorporados em Matrigel, que forneceu a matriz extracelular e componentes da membrana do porão que suportam orientação apicobasal adequada, crescimento de brotos neuroepiteliol que se expandem e formam lúmens. A imunofluorescência com marcador neuroepiteliol NESTIN foi realizada para observar a morfologia geral dos organoides(Figura 5b). O neuroepithelium envolve um ventrículo como a cavidade (Figura 5c - linha branca). Os organoides exibem morfologicamente zonas ventriculares (VZ), zona sub ventricular (SVZ) e córtex como regiões(Figura 5c - linhas vermelhas, laranjas e amarelas, respectivamente)

Figura 1: Isolamento do fibroblasto e reprogramação via nucleosfeicialização. aImagem microscópica de villi coriônico fetal antes do tratamento de colagenase. (b) Fibroblastos isolados de villi coriônico fetal para experimentos de reprogramação. cVerificação de plasmídeos de reprogramação por digestão de restrição EcoRI. (d) Diagrama esquemático do protocolo de transfecção empregado para a geração iPSC a partir de fibroblastos de villi coriônicos fetais utilizando plasmídeos de reprogramação epissomal através de nucleofeipulação. Clique aqui para ver uma versão maior desta figura.
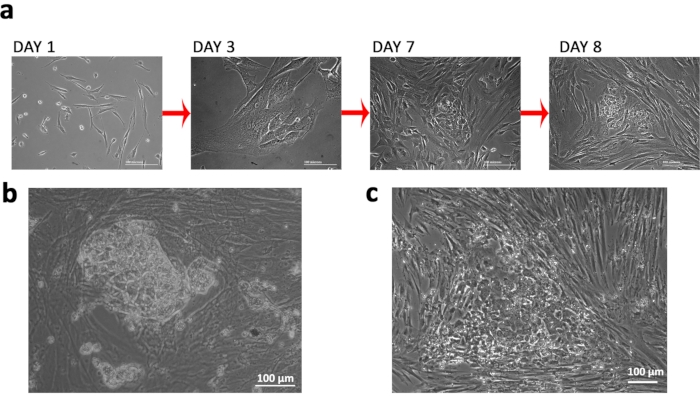
Figura 2: Estabelecimento de Células-tronco pluripotentes induzidas pela Síndrome de Turner. aAlterações de morfologia celular observadas durante o período de reprogramação. (b) Uma colônia TSiPSC totalmente reprogramada. (c) Uma imagem representativa de uma colônia com células reprogramadas incorretamente. Clique aqui para ver uma versão maior desta figura.
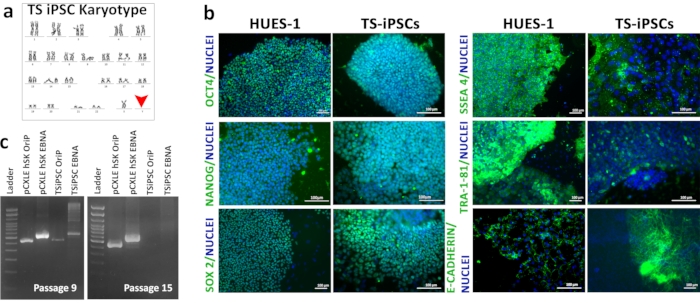
Figura 3: Caracterização de TSiPSCs. (a) Karyótipo de TSiPSCs. (b) Análise de imunofluorescência de biomarcadores pluripotência OCT4, NANOG, SOX2, SSEA-4 e TRA-1-81 em TSiPSCs em comparação com células-tronco embrionárias HUES1. Os núcleos estão manchados com 4', 6-diamidino-2-fenilômado. 3c. Demonstração do status livre de transgenes de TSiPSCs. Pista 1- escada de DNA, Lane 2- OriP controle positivo com pCXLE-hSK, Lane 3-EBNA controle positivo com pCXLE-hSK, Lane 4-OriP com TSiPSCs, Pista 5-EBNA com TSiPSCs. Clique aqui para ver uma versão maior desta figura.
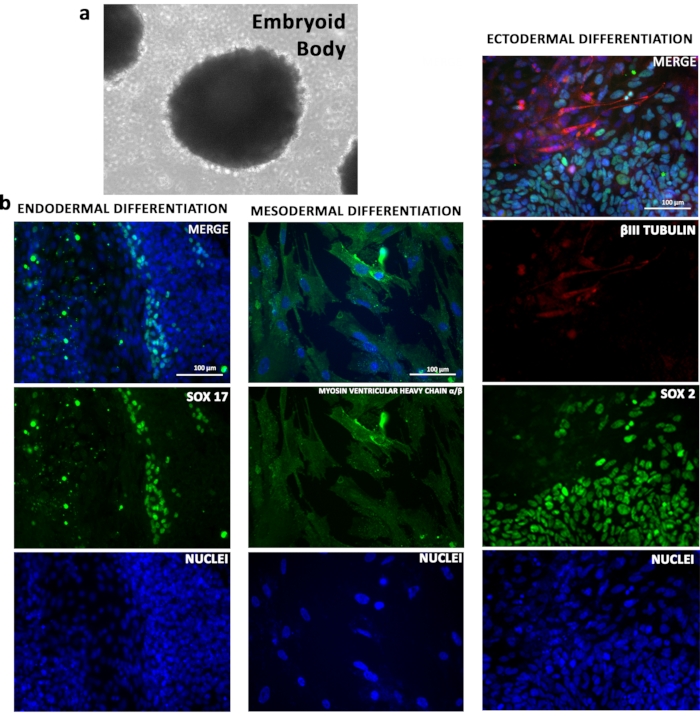
Figura 4: Potencial de diferenciação in vitro dos TSiPSCs. aTSiPSC diferenciado aos Corpos Embriid. (b) Análises de imunofluorescência de TSiPSCs para marcador endodérmico SOX17, rede pesada de minodeso-americano ventricular α/β e marcadores ectodérmicos βIII tubulin e SOX2. Os núcleos estão manchados com 4', 6-diamidino-2-fenilômado. Clique aqui para ver uma versão maior desta figura.
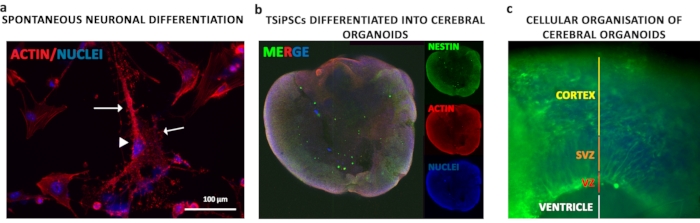
Figura 5: Diferenciação organoide neuronal e cerebral dos TSiPSCs. (a) Para entender a citoarquitetura de neurônios diferenciados, foi feita a coloração de faloides de Actin. Os neurônios derivados do TSiPSC exibiam soma neuronal em forma piramixal (ponta de flecha) com dendritos e axônios (setas). Os núcleos estão manchados com 4', 6-diamidino-2-fenilômado. Imunostaining. aImunostaining para Nestin e actin para observar morfologia bruta dos organoides. (c) Coloração para Nestin visualizar as camadas neuronais apicamente e basally organizadas. Os núcleos estão manchados com 4', 6-diamidino-2-fenilômado. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Composição de mídia, buffers e soluções Clique aqui para baixar esta Tabela.
Tabela 2: PCR Reaction Mix Clique aqui para baixar esta Tabela.
Tabela 3: Programa de Ciclismo PCR Clique aqui para baixar esta Tabela.
Discussão
A geração de modelos celulares estáveis de tecido fetal citogeneticamente anormal é necessária para perpetuar o fenótipo defeituoso. A rota iPSC é o método mais eficaz de preparação celular para conservação perpétua de propriedades defeituosas20.
Células-tronco pluripotentes (PSC) apresentam propriedades de auto-renovação e diferenciação em células especializadas que lembram os embriões de decote precoce21. Assim, os PSCs podem servir como excelentes modelos para estudar defeitos moleculares, celulares e de desenvolvimento precoces em fetos abortados prematuramente.
Neste artigo, descrevemos a geração iPSC humana usando nucleofecção combinada com os vetores epissomais melhorados. Os resultados mostram que essa combinação compreende um método robusto para gerar linhas iPSC humanas livres de integração, evidenciadas pelo fato de que transfecções únicas foram suficientes para uma reprogramação bem sucedida. Rastreamos a conversão progressiva de fibroblastos fcv para células pluripotentes microscopicamente. 20 dias após a transfecção observamos colônias de TSiPSCs reprogramados cercados com fibroblastos FCV não reprogramados. Morfologicamente, os iPSCs humanos derivados se assemelhavam a células-tronco embrionárias cultivadas ao lado do laboratório. Normalmente, as células se agregavam como colônias compactas com bordas brilhantes. As células das colônias tinham grandes núcleos e firmemente embaladas sugerindo contato próximo de membrana entre as células. Os fibroblastos não reprogramados arquearam e cercaram essas colônias. Após a transferência para o IMEFs, eles continuam proliferando na cultura por mais de 30 transferências demonstrando a propriedade da autoconexão contínua.
Como os TSiPSCs foram gerados a partir de fibroblastos 45XO nós karyotipados as células para verificar se eles retiveram a composição cromossômica. Os TSiPSCs mantiveram o karyotype 45XO na cultura contínua celular sugerindo uma composição genética de cromossomo 45XO estável. Para ser útil como recurso celular representando a aneuploidy 45XO, os TSiPSCs devem estar livres de DNA exógeno usado nos experimentos de reprogramação. Verificamos a presença de plasmídeos episômicos residuais realizando um PCR de DNA genômico para marcadores específicos epissomais-OriP e EBNA. Não encontramos nenhum vestígio desses marcadores em células TSiPS após 15 passagens sugerindo que os TSiPSCs progressivamente perderam vetores de reprogramação episômica em cultura prolongada.
A marca registrada de células pluripotentes é seu potencial para se diferenciar às células de três linhagens germinativas, tanto in vitro quanto in vivo. Para testar essa capacidade nos TSiPSCs derivados, submetemos-os in vitro à formação corporal embrionária e ensaios de diferenciação direcionados pela linhagem especificando citocinas e fatores de crescimento. Os TSiPSCs formaram corpos embrionários e diferenciados em células ectodérmicas expressando marcadores neuronais, células mesodérmicas expressando marcadores cardíacos e células endodérmicas expressando SOX17 um biomarcador do destino do endóderme. Também testamos a capacidade dos TSiPSCs de se diferenciar em organoides cerebrais 3D de ordem superior usando protocolos previamente estabelecidos22. Os TSiPSCs se auto-organizam progressivamente devido aos seus próprios programas intrínsecos de desenvolvimento em mini tecidos chamados organoides. TSiPSCs produziram organoides cerebrais mostrando uma citoarquitetura semelhante ao tecido cerebral com neuroepithelium em torno de um ventrículo como a cavidade. No entanto, esses organoides devem ser caracterizados extensivamente para revelar os tipos celulares exatos e comparados com iPSCs normais para distinguir as propriedades intrínsecas de padronização do tecido neural dos TSiPSCs. Esses organoides cerebrais e outros tipos de organoides cerebrais gerados a partir de TSiPSCs podem ser usados para modelar inconsistências de desenvolvimento e funcionais que podem contribuir para os sintomas de deficiências neurológicas de indivíduos com TS. Os TSiPSCs apresentaram características biomarcadores de pluripotência, bem como o traço marcante da diferenciação, destacando assim o sucesso da reprogramação para pluripotência induzida.
O método acima descrito tem funcionado eficientemente na reprogramação de fibroblastos dérmicos e células mesenquimais derivadas de várias fontes em nosso laboratório (dados de outras linhas não mostradas). Em nossa experiência, os seguintes passos são fundamentais para o sucesso do experimento de reprogramação:
a) Qualidade da preparação plasmida: preparações antigas não produzem iPSCs.
b) Qualidade das células utilizadas para transfecções: células proliferadoras são essenciais para a geração de iPSC. 0,5 a 1 milhão de células por transfecção produziram uma eficiência de reprogramação reprodutível.
c) Reagentes nucleofectantes recém-reconstituídos: reagentes nucleofectados reconstituídos armazenados por mais de um mês não produziram iPSCs.
d) A manutenção do banco de células mestres por subcultura mecânica dos iPSCs rendeu linhas estáveis. A dissociação enzimática foi utilizada conforme exigência de experimento.
O objetivo futuro do laboratório é estabelecer um painel de iPSCs cromosomally anormais para desenvolvimento a jusante, modelagem funcional e de doenças usando este método eficiente. As aneuploidias fetais causam perda de gravidez e malformações de órgãos em nascidos vivos. IPSCs aneuploides derivados de tecidos de abortos espontâneos são um recurso valioso para modelar e estudar eventos de desenvolvimento embrionários fracassados. Sistemas de cultura 2D e 3D in vitro, incluindo corpos embrionários e organoides específicos de tecido22 permitirão que os pesquisadores entendam irregularidades moleculares e celulares, como a proliferação celular aberrante e morte celular em células específicas de linhagem que poderiam se manifestar como anomalias de desenvolvimento e falhas de gravidez associadas a síndromes de aneuploidia.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O apoio financeiro para a pesquisa acima foi fornecido pela Manipal Academy of Higher Education. A caracterização da linha foi conduzida parcialmente no laboratório de M.M. Panicker na NCBS. Agradecemos ao Laboratório de Diagnóstico anand pela ajuda com o karyotyping.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.15% trypsin | Thermo Fisher Scientific | 27250018 | G Banding |
| 2-mercaptoethanol | Thermo Fisher Scientific | 21985023 | Pluripotency and Embryoid body medium |
| 4', 6 diamidino-2-phenylindole | Sigma Aldrich | D8417 | Immunocytochemistry |
| Activin A | Sigma Aldrich | SRP3003 | Differentiation assays |
| Alkaline Phosphatase Live Stain | Thermo Fisher Scientific | A14353 | AP staining |
| AMAXA Nucleofector II | Lonza | - | Nucleofection |
| AmnioMAX II complete media | Thermo Fisher Scientific, Gibco | 11269016 | Medium specific for foetal chorionic villi cell cultures |
| Ampicillin | HiMedia | TC021 | Plasmid purification |
| Anti Mouse IgG (H+L) Alexa Fluor 488 | Invitrogen | A11059 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 488 | Invitrogen | A11034 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 546 | Invitrogen | A11035 | Immunocytochemistry |
| Antibiotic-Antimycotic | Thermo Fisher Scientific, Gibco | 15240096 | Contamination control |
| Anti-E-Cadherin | BD Biosciences | 610181 | Immunocytochemistry |
| Anti-Nanog | BD Biosciences | 560109 | Immunocytochemistry |
| Anti-OCT3/4 | BD Biosciences | 611202 | Immunocytochemistry |
| Anti-SOX17 | BD Biosciences | 561590 | Immunocytochemistry |
| Anti-SOX2 | BD Biosciences | 561469 | Immunocytochemistry |
| Anti-SSEA4 | BD Biosciences | 560073 | Immunocytochemistry |
| Anti-TRA 1-81 | Millipore | MAB4381 | Immunocytochemistry |
| basic Fibroblast Growth Factor[FGF2] | Sigma Aldrich | F0291 | Pluripotency medium |
| Bone Morphogenetic Factor 4 | Sigma Aldrich | SRP3016 | Differentiation assays |
| Bovine Serum Albumin | Sigma Aldrich | A3059 | Blocking |
| Collagen Human Type IV | BD Biosciences | 354245 | Differentiation assays |
| Collagenase blend | Sigma Aldrich | C8051 | Digestion of foetal chorionic villi |
| Dexamethasone | Sigma Aldrich | D4902 | Differentiation assays |
| DMEM F12 | Thermo Fisher Scientific | 11320033 | Differentiation assays |
| FastDigest EcoR1 | Thermo Scientific | FD0274 | Restriction digestion |
| Fibronectin | Sigma Aldrich | F2518 | Differentiation assays |
| Giemsa Stain | HiMedia | S011 | G Banding |
| Glacial Acetic Acid | HiMedia | AS001 | Fixative for karyotyping |
| Glucose | Sigma Aldrich | G7528 | Differentiation assays |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Pluripotency and Embryoid body medium |
| Heparin sodium | Sigma Aldrich | H3149 | Differentiation assays |
| Insulin solution human | Sigma Aldrich | I9278 | Differentiation assays |
| Insulin Transferrin Selenite | Sigma Aldrich | I1884 | Differentiation assays |
| KAPA HiFi PCR kit | Kapa Biosystems | KR0368 | OriP, EBNA1 PCR |
| KaryoMAX Colcemid | Thermo Fisher Scientific | 15210040 | Mitotic arrest for karyotyping |
| KnockOut DMEM | Thermo Fisher Scientific | 10829018 | Pluripotency and Embryoid body medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Pluripotency and Embryoid body medium |
| Luria Bertani agar | HiMedia | M1151F | Plasmid purification |
| Matrigel | BD Biosciences | 356234 | Differentiation assays |
| MEM Non-essential amino acids | Thermo Fisher Scientific | 11140035 | Pluripotency and Embryoid body medium |
| Methanol | HiMedia | MB113 | Fixative for karyotyping |
| Myosin ventricular heavy chain α/β | Millipore | MAB1552 | Immunocytochemistry |
| NHDF Nucleofector Kit | Lonza | VAPD-1001 | Nucleofection |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | Fixing cells |
| pCXLE-hOCT3/ 4-shp53-F | Addgene | 27077 | Episomal reprogramming Plasmid |
| pCXLE-hSK | Addgene | 27078 | Episomal reprogramming Plasmid |
| pCXLE-hUL | Addgene | 27080 | Episomal reprogramming Plasmid |
| Penicillin Streptomycin | Thermo Fisher Scientific, | 15070063 | Pluripotency and Embryoid body medium |
| Phalloidin- Tetramethylrhodamine B isothiocyanate | Sigma Aldrich | P1951 | Immunocytochemistry |
| Phosphate buffered saline | Sigma Aldrich | P4417 | 1 X PBS 1 tablet of PBS dissolved in 200mL of deionized water and sterilized by autoclaving Storage: Room temperature. PBST- 0.05% Tween 20 in 1X PBS. Storage: Room temperature. |
| Plasmid purification Kit- Midi prep | QIAGEN | 12143 | Plasmid purification |
| Potassium Chloride Solution | HiMedia | MB043 | Hypotonic solution for karyotyping |
| QIAamp DNA Blood Kit | Qiagen | 51104 | Genomic DNA isolation |
| RPMI 1640 | Thermo Fisher Scientific | 11875093 | Hepatocyte differentiation medium |
| Sodium Citrate | HiMedia | RM255 | Hypotonic solution for karyotyping |
| Triton X-100 | HiMedia | MB031 | Permeabilisation |
| Trypsin-EDTA (0.05%) | Thermo Fisher Scientific, Gibco | 25300054 | Subculture of foetal chorionic villi fibroblasts |
| Tween 20 | HiMedia | MB067 | Preparation of PBST |
| β III tubulin | Sigma Aldrich | T8578 | Immunocytochemistry |
| Y-27632 dihydrochloride | Sigma Aldrich | Y0503 | Differentiation assays |
Referências
- Verlinsky, Y., et al. Human embryonic stem cell lines with genetic disorders. Reproductive BioMedicine Online. 10, 105-110 (2005).
- Eiges, R., et al. Developmental Study of Fragile X Syndrome Using Human Embryonic Stem Cells Derived from Preimplantation Genetically Diagnosed Embryos. Cell Stem Cell. 1, 568-577 (2007).
- Biancotti, J. -. C., et al. Human Embryonic Stem Cells as Models for Aneuploid Chromosomal Syndromes. STEM CELLS. 28, 1530-1540 (2010).
- Li, W., et al. Modeling abnormal early development with induced pluripotent stem cells from aneuploid syndromes. Human Molecular Genetics. 21, 32-45 (2012).
- Gravholt, C. H., Viuff, M. H., Brun, S., Stochholm, K., Andersen, N. H. Turner syndrome: mechanisms and management. Nature Reviews Endocrinology. 15, 601-614 (2019).
- Luo, Y., et al. Uniparental disomy of the entire X chromosome in Turner syndrome patient-specific induced pluripotent stem cells. Cell Discovery. 1, 15022 (2015).
- Luo, Y., et al. Generation of an induced pluripotent stem cell line from an adult male with 45,X/46,XY mosaicism. Stem Cell Research. 27, 42-45 (2018).
- Parveen, S., Panicker, M. M., Gupta, P. K. Generation of an induced pluripotent stem cell line from chorionic villi of a Turner syndrome spontaneous abortion. Stem Cell Research. 19, (2017).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872 (2007).
- Soldner, F., et al. Parkinson's Disease Patient-Derived Induced Pluripotent Stem Cells Free of Viral Reprogramming Factors. Cell. 136, 964-977 (2009).
- Somers, A., et al. Generation of Transgene-Free Lung Disease-Specific Human Induced Pluripotent Stem Cells Using a Single Excisable Lentiviral Stem Cell Cassette. STEM CELLS. 28, 1728-1740 (2010).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G., Hochedlinger, K. Induced Pluripotent Stem Cells Generated Without Viral Integration. Science. 322, 945-949 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proceedings of the Japan Academy, Series B. 85, 348-362 (2009).
- Warren, L., et al. Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324, 797-801 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Martí, M., et al. Characterization of pluripotent stem cells. Nature Protocols. 8, 223-253 (2013).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nature Reviews Molecular Cell Biology. 17, 170-182 (2016).
- Ambartsumyan, G., Clark, A. T. Aneuploidy and early human embryo development. Human Molecular Genetics. 17, 10-15 (2008).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9, 2329-2340 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados