Method Article
דור תאי גזע פלוריפוטנטים מושרים מתסמונת טרנר (45XO) תאים עובריים למידול במורד הזרם של ליקויים נוירולוגיים הקשורים לתסמונת
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מתאר את הדור של IPSCs חינם אינטגרציה מפיברובלסטים רקמת העובר באמצעות משלוח של plasmids אפיזומלי על ידי נוקלאופקטציה ואחריו תיאור של שיטות המשמשות לאפיון IPSC ובידול עצבי.
Abstract
aneuploidies כרומוזומלי לגרום מומים מולדים חמורים כולל מומים במערכת העצבים המרכזית ומוות עוברי. הקרנה גנטית טרום הנדסית היא אבחון גרידא ואינה מזרזת מנגנון מחלה. למרות שתאים מעוברים אנופלואידיים הם חומר ביולוגי בעל ערך הנושא את האנופלואידיה הכרומוזומלית, תאים אלה קצרי מועד, ומגבילים את השימוש בהם לניסויים מחקריים במורד הזרם. יצירת מודלים של תאי גזע פלוריפוטנטים המושרים (iPSC) היא שיטה יעילה להכנת תאים לשימור תמידי של תכונות aneuploid. הם מחדשים את עצמם ומבדילים לתאים מיוחדים המזכירים התפתחות עוברית. לכן, IPSCs לשמש כלים מצוינים ללמוד אירועים התפתחותיים מוקדמים. תסמונת טרנר (TS) היא מצב נדיר הקשורים כרומוזום X חסר לחלוטין או חלקית. התסמונת מאופיינת באי פוריות, קומתו הקצרה, האנדוקרינית, המטבולית, הפרעות אוטואימוניות וקרדיווסקולריות ופגמים נוירו-קוגניטיביים. הפרוטוקול הבא מתאר בידוד ופולחן של פיברובלסטים מרקמת עובר TS (45XO), יצירת TSiPSCs ללא שילוב באמצעות משלוח של פלסמידים לתכנות מחדש אפיזומלי על ידי נוקלאופקטציה ואחריו אפיון. TSiPSCs תכנות מחדש הוקרנו בתחילה על ידי כתמי פוספטאז תא חי ואחריו בדיקה נרחבת עבור סמנים ביולוגיים pluripotency. מושבות נבחרות נותחו באופן מכני, עברו מספר פעמים ותאים יציבים המתחדשים העצמית שימשו לניסויים נוספים. התאים הביעו גורמי שעתוק pluripotency OCT4, NANOG, SOX2, סמני פני השטח של התא SSEA 4 ו TRA1-81 אופייני לתאי גזע פלוריפוטנטים. קריוטיפ 45XO המקורי נשמר לאחר תכנות מחדש. ה- TSiPSCs הצליחו ליצור גופים עובריים ולהבדיל לתאים של אנדודרם, מסודרם וקטודרם המבטאים סמנים ביולוגיים ספציפיים לשושלת (SRY BOX17), (MYOSIN חדרית כבד צ'אי נין/β), (βIII TUBULIN)). הפלסמידים האפיזומליים האקסוגניים אבדו באופן ספונטני ולא זוהו לאחר מעבר 15 בתאים. TSiPSCs אלה הם משאב תאי יקר ערך עבור דוגמנות מולקולרית פגומה נוירו-פיתוח תאי גרימת ליקויים נוירו-קוגניטיביים הקשורים תסמונת טרנר.
Introduction
Aneuploidies להוביל מומים מולדים / מומים מולדים ואובדן הריון בבני אדם. ~ 50%-70% מהדגימות מאובדן הריון מראות חריגות ציטוגנטיות. עוברים Aneuploid שאבדו בשלב מוקדם של ההריון לא ניתן להשיג בקלות לניתוח ניסיוני מעלה את הצורך לפתח מודלים אחרים המייצגים מקרוב עוברי אדם. תאי גזע פלוריפוטנטים המושרים (iPSCs) הנגזרים מתאים שאובחנו עם הפרעות גנטיות שימשו כדי לדגמן את אי סדרים גנטיים מייצגים ואת התוצאה שלהם על התפתחות העובר1,2,3,4. IPSCs אלה דומים לתאי אפיבלסט של העובר המתפתח ויכולים לשחזר את האירועים המוקדמים של היווצרות העובר. הם מאפשרים הבנה ואפיון של התוכנית ההתפתחותית של שושלות התאים ודפוסים בעוברים יונקים מוקדמים. IPSCs נגזר בעבר פיברובלסטים בעור מי השפיר מבדיקות אבחון טרום לידה של תסמונות aneuploidy כמו מונוזומיה X (תסמונת טרנר), טריזומיה 8 (תסמונת Warkany 2), טריזומיה 13 (תסמונת פאטאו) וטריזומיה חלקית 11; 22 (תסמונת עמנואל) סיפקו תובנות חשובות לגבי התפתחות כושלת4.
תסמונת טרנר (TS) היא מצב נדיר המאופיין באי פוריות נשית, קומתו הקצרה, הפרעות אנדוקריניות ומטבוליות, סיכון מוגבר למחלות אוטואימוניות, נטייה למחלות לב וכלי דם5. למרות שזו התסמונת המונוסומית היחידה ששרדה, היא קטלנית גם לעובר המתפתח הגורמת להפלות ספונטניות6. אנשים ששרדו עם TS נוכחים עם דרגות של שינוי של חומר X-כרומוזומלי בתאים שלהם. קריוטיפים נעים בין אובדן מוחלט של כרומוזום X אחד (45,XO) לפסיפסים כמו 45,XO/46,XX; 45, XO/47, XXX, נוכחות של כרומוזומי טבעת, נוכחות של חומר Y-כרומוזומלי, וכו'5.
אבחון התסמונת נעשה בדרך כלל על ידי דם קריוטיפינג של אנשים סימפטומטיים ודגימת villi כוריוני (CVS) כדי לזהות תסמונות aneuploidy מוקדם. מאז תסמונות aneuploidy מהווים ~ 30% של הפלות ספונטניות, זה שגרתי קריוטיפ המוצר של התעברות (POC) על הפלה ספונטנית. תאים עובריים אלה כולל villi chorionic בעל חריגות ציטוגנטית IPSCs נגזר מהם לספק מקור יקר של חומר ביולוגי כדי ללמוד תסמונות aneuploidy4,6. TS iPSCs הוקמו בעבר ממי השפיר באמצעות תכנות מחדש רטרו-ויראלי4, פיברובלסטים של villi כוריוני (המתקבל באמצעות אבחון טרום היילוד) באמצעות תכנות מחדש רטרו-ויראלי6, מתאי מונונוקלאריים בדם7 באמצעות תכנות מחדש של וירוס סנדאי ומפיברובלסטים בעור של אנשים TS באמצעות תכנות מחדש lentiviral4 . מאז המוקד העיקרי של המעבדה שלנו היא להבין כישלון התפתחותי, יצרנו IPSCs TS מ POC, במיוחד את רכיב villi כוריוני של הפלה ספונטנית8. כל התאים המבודדים מרקמת העובר הזו היו בעלי קריוטיפ של 45XO והניבו IPSCs עם אותו קריוטיפ. IPSCs אלה הם ייחודיים כפי שהם הראשונים שנוצר מעובר שהופלה ולספק משאב יקר לחקר כשלי הריון הקשורים aneuploidy. מאמר זה מספק מתודולוגיה מפורטת של יצירת IPSCs ממקור תא ייחודי זה באמצעות תכנות מחדש אפיזומלי.
השיטות המוקדמות של דור iPSC השתמשו בהעברת נגיפים ותמרות כדי לספק את גורמי התכנות מחדש. שיטות של גרימת תאים לפלוריפוטנטיות התפתחו משימוש בווקטורים רטרו-ויראליים9, וקטורים lentiviral נסלחים10,11 ושיטות מבוססות טרנספוסון12 כדי לא שילוב וקטורים אדנו-ויראליים13 וקטורים מבוססי וירוססנדאי 14. תכנות מחדש מבוסס רטרו-ויראלי ולנטיוויראלי, אם כי יעיל, כרוך בשילוב של גורמי תכנות מחדש לתוך כרומוזומי המארח, גרימת מוטציות הכנסה אשר יש השפעות בלתי צפויות ב- iPSCs. יתר על כן, תכנות מחדש מבוסס ויראלי מונע יישום תרגום של iPSCs. מערכות מבוססות RNA15 ואספקת חלבונים ישירה16 נחקרו כדי לחסל לחלוטין את הסיכונים הפוטנציאליים הקשורים לשימוש בווירוסים ובהעברות DNA. עם זאת, שיטות אלה הוכיחו לא יעיל.
בשנת 2011, Okita ואח ' דיווחו על יעילות משופרת של תכנות מחדש על ידי פלסמידים אפיזומליים מוגברת עם דיכוי TP53 באמצעות shRNA. הם גם החליפו את cMYC ב- LMYC שאינו משתנה (קרצינומה של ריאות תאים קטנים הקשורים ל- MYC) כדי לשפר את הבטיחות של hiPSCs. פלסמידים אפיזומליים אלה מבטאים 5 גורמי תכנות מחדש: OCT4, LIN28, SOX2, KLF4, LMYC ו- shRNA עבור TP5317,18. וקטורים אלה נשמרים במיוחד כרומוזומלית ומאבדים מהתאים המתוכנתים מחדש על תרבית רציפה, ובכך הופכים את הקווים ללא טרנסג'נים בתוך 10-15 מעברים. Nucleofection היא צורה מיוחדת של אלקטרופורציה המספקת חומצות גרעין ישירות לתוך הגרעין של תאים מארחים. זוהי שיטה יעילה למסירה של פלסמידים תכנות מחדש לסוגי תאים שונים. פלסמידים אפיזומליים הם חסכוניים ולפצות על העלויות הגבוהות של nucleofection. שיטה זו יעילה ווניתנת לשחזור בתנאים ממוטבים המניבים IPSCs יציבים ממגוון תאים סומטיים. בפרוטוקול זה, אנו מתארים את השיטה ליצירת IPSCs מפיברובלסטים המבודדים מרקמת העובר על ידי נוקלאופקט של פלסמידים לתכנות מחדש אפיזומלי. הנה הפרוטוקולים המפורטים לבידוד פיברובלסט מווילי כוריוני עוברי, טיהור פלסמיד, נוקלאופקט, קטיף מושבות מצלחת התכנות מחדש והקמת IPSCs יציבים.
זה חיוני כדי לאשר את נוכחותם של תכונות pluripotency ב- iPSCs שנוצרו לאחרונה. זה כולל הדגמה של גורמים הקשורים pluripotency (למשל, ביטוי פוספטאז אלקליין, NANOG, SSEA4, Tra 1-80, Tra 1-81, E-cadherin; מוצג בדרך כלל עם אימונופלואורסצנטיות או ביטוי גנים), זיהוי של שלוש שכבות נבט על ידי בדיקות בידול במבחנה כדי לאמת את פוטנציאל הבידול שלהם, קריוטיפינג כדי לקבוע תוכן כרומוזומלי, הקלדת STR כדי לקבוע זהות עם תאי אב, לאמת אובדן של גנים אקסוגניים, ומחמירים יותר ב- vivo assays כגון היווצרות טרטומה והשלמת טטרפלואיד. כאן אנו מתארים פרוטוקולי אפיון של קריוטיפינג, תאים חיים מכתימים פוספטאז אלקליין, זיהוי של סמנים ביולוגיים הקשורים pluripotency על ידי אימונופלואורסצנטיות, במבחנה הבחנה assays ושיטה כדי להדגים אובדן של גנים אקסוגניים19.
Protocol
FCV התקבלו מבית החולים מניפל, בנגאלורו, באישור ועדת האתיקה של בתי החולים מניפל.
הערה: ראה טבלה 1 להרכב של כל המאגרים והפתרונות.
1. בידוד של פיברובלסטים מווילי כוריוני עוברי (FCV)
-
איסוף דגימות והתפוררות רקמות בקולגנאז
- לאסוף FCV בתנאים סטריליים מלוחים חוצץ פוספט (PBS) ולהעביר (בטמפרטורת החדר) למתקן תרבית התא.
- מעבירים את הווילי לצלחת פטרי 60 מ"מ ושטפו מספר פעמים (מינימום 4 פעמים) ב-PBS המכילים 1x פתרון אנטי-ממיקוטי אנטישמי (PBS-AA). הסר PBS-AA לחלוטין על ידי pipetting.
- פנקו את הווילי הכוריוני בתערובת קולגנאז 1 מ"ל (5 מ"ג/מ"ל) למשך 5 דקות ב-37 מעלות צלזיוס.
- לנטרל עם תרבית תאים בינוני המכיל 10% סרום בקר עוברי (FBS), להעביר תקציר צינור 15 מ"ל צנטריפוגה ב 225 x g במשך 5 דקות כדי לאסוף את villi התפרק ו תאים משוחררים כדור.
-
תת-תרבות והרחבת מלאי
- צלחת התפרק villi יחד עם תאים משוחררים בקבוקון תרבות T25 המכיל 5 מ"ל של מדיה מלאה (למשל, AmnioMAX) ולגדול עד תרבות פיברובלסט confluent מתקבלת.
- להרחיב פיברובלסטים בתרבות כדי להכין מלאי לשימוש בניסויי טרנס-זיהום ואפיון הבאים כדלקמן:
- הוסף 2 מ"ל של טריפסין 0.05% לבקבוק T25 המכיל פיברובלסטים FCV ודגרה ב 37 °C (3-5 דקות) כדי לנתק את התאים.
- לאחר הדגירה, לנטרל טריפסין על ידי הוספת FBS (באותו נפח כמו טריפסין).
הערה: ניתן להשתמש במדיום תרבות המכיל FBS גם כדי לנטרל טריפסין, כאשר הוא נוסף בטריפסין של 1:3: יחס מדיה. - לאסוף את התאים מנותקים בצינור 15 מ"ל צנטריפוגה ב 225 x g במשך 5 דקות כדי להשיג גלולה תא.
- גלולה של תא-על דקאנט ו-resuspend ב-1 מ"ל של מדיה שלמה.
- מעבירים 500 μL כל אחד עד 60 מ"מ רקמה תרבית מטופלים כלים לפצות את הנפח ל 5 מ"ל. יחס פיצול זה של 1:2, שימש גם למעברים הבאים.
-
שימור הקפאה
- בצע דיסוציאציה אנזימטית באמצעות 0.05% טריפסין כמתואר בשלבים 1.2.2.1 - 1.2.2.3 ולקבל גלולה תא.
- השלך את supernatant ו resuspend כדורי התא ב 1 מ"ל של תערובת הקפאה, הכולל 1:9 דימתיל גופרתיקס (DMSO): FBS.
- מעבירים את התכולה להקפאה סטרילית ומניחים את הנקניקיון במיכל הקפאה.
- להקפיא לילה ב -80 °C (80 °F) ולאחר מכן להעביר בקבוקונים חנקן נוזלי (-196 °C (50 °F) למחרת.
2. פלסמידים בידוד ואימות DNA
-
הכנת תאים חיידקים
- מניות פסים של E. coli המכילות את שלושת הפלסמידים הבודדים pCXLE-hOCT3/4-shp53-F, pCXLE-hSK ו- pCXLE-hUL (מ Addgene) על לוחות אגר אגר נפרדים של לוריא ברטני-אמפיצלין.
- לחסן מושבות בודדות לתוך תרבויות המתנע של 5 מ"ל של לוריא ברטאני-אמפיצ'ין מדיום. דגירה במשך 8 שעות ב 37 °C (37 °F) עם רועד (10 x גרם).
- לחסן 200 μL של תרבות זו המתנע לתוך 100 מ"ל של לוריא ברטני-אמפיצ'ין מדיום. לדגור לילה ב 37 °C (50 °F) עם רועד.
- קציר תרבות חיידקים לילה על ידי צנטריפוגה ב 6000 x גרם במשך 15 דקות ב 4 °C (70 °F).
-
בידוד פלסמיד עם ערכת טיהור מידי פלסמיד
- כדור חיידקי resuspend ב 4 מ"ל resuspension חוצץ.
- מוסיפים 4 מ"ל של חיץ תמוגה ומערבבים היטב על ידי היפוך נמרץ 4-6 פעמים ודגרה בטמפרטורת החדר במשך 5 דקות.
- הוסף 4 מ"ל של חיץ נטרול מצונן מראש וצינור הפוך 4-6 פעמים לערבב ביסודיות. דגירה על קרח במשך 15 דקות.
- צנטריפוגה ב-≥20,000 x גרם למשך 30 דקות ב-4 מעלות צלזיוס. לאסוף supernatant בצינור טרי וצנטריפוגה מחדש ב ≥20,000 x g במשך 15 דקות ב 4 °C (70 °F).
- שפל את העמודה על-ידי החלת 4 מ"ל של מאגר שוויון.
- החל את הסופר-טבעי על העמודה.
- לשטוף את העמודה פעמיים עם 10 מ"ל של חוצץ לשטוף.
- יש לבחון דנ"א עם 5 מ"ל של חיץ חמימה (65 °C).
- לזרז DNA על ידי הוספת 3.5 מ"ל של איזופרופנול לדנ"א הנבה. מערבבים היטב. צנטריפוגה ב-≥15,000 x גרם למשך 30 דקות ב-4 מעלות צלזיוס. דקאנט סופר-טבעי בזהירות.
- לשטוף את כדורי ה- DNA עם 2 מ"ל של 70% אתנול וצנטריפוגה ב 15,000 x גרם ≥ במשך 10 דקות. דקאנט סופר-טבעי בזהירות.
- גלולה יבשה לאוויר למשך 5-10 דקות וממיסה DNA בנפח מתאים של מים באיכות PCR כדי להשיג ריכוז סופי של 1 מיקרוגרם / מ"ל.
הערה: אין להמיס DNA במאגרים מכיוון שהוא אינו מתאים לאלקטרופורציה. הכנת DNA פלסמיד ישנה אינה מניבה מושבות מתוכנתות מחדש.
-
אימות Plasmid על ידי עיכול הגבלת EcoRI
- שלבו 15 מיקרו-אל של מים נטולי נוקלאז, 2 מיקרו-אל של חיץ 10x, מיקרוגרם אחד של DNA פלסמיד ו-1 מיקרו-אל של אנזים EcoRI. מערבבים בעדינות.
- לדגור על התערובת ב 37 °C (5 °F) במשך 15 דקות בלוק חום.
- מערבבים את דגימות הפלסמיד המעוכלות עם צבע טעינת ג'ל DNA 6x ואלקטרופורזי על ג'ל אגרוז 1% במאגר 1x TAE עם 0.5 מיקרוגרם /מ"ל של אתידיום ברומיד. כלול סולם דנ"א סטנדרטי. צלם את הג'ל לאחר שהדנ"א נפתר כראוי. גדלי רצועת EcoRI הצפויים של pCXLE-hOCT3/ 4-shp53-F הם 6,834 bp, 3,758 bp ו- 1,108 bp; pCXLE-hUL הם 10,200 bp ו 1,900 bp; pCXLE-hSK הם 10,200 bp ו 2,500 bp.
3. נוקלאופקטיון
-
גלולה של תאים
- תרבות פיברובלסטים כוריוניים עובריים מבודדים בבקבוקון T25 ב 5 מ"ל של מדיה מלאה עד 80-90% השפעה.
- לשטוף תאים פעמיים עם PBS ו trypsinize כמתואר בשלבים 1.2.2.1 - 1.2.2.3.
- הסר את גלולה supernatant, resuspend ב 5 מ"ל של מדיה בסרום מופחת (למשל, Opti-MEM). לספור תאים עם hemocytometer ולקחת 106 תאים עבור nucleofection. צנטריפוגה ב 225 x g במשך 5 דקות. הסר supernatant לחלוטין.
-
הכנה ריאגנט ונוקלאופקט
- הכן ריאגנט נוקלאוfector על ידי ערבוב 0.5 מ"ל של תוספת ו 2.25 מ"ל של פתרון nucleofector (שניהם מסופקים בערכה).
- הוסף 100 μL של פתרון נוקלאוfector בצינור 1.5 מ"ל. הוסף 1μg כל אחד pCXLE-hOCT3/4-shp53-F, pCXLE-hSK ו pCXLE-hUL לצינור. יש תקיף מחדש בעדינות 106 תאים (משלב 3.1.2) בתערובת זו.
- העבר את התלוי תא-DNA לתוך cuvette, להבטיח כי המדגם מכסה את החלק התחתון של cuvette (מסופק בערכה) ללא כל בועות אוויר. מכסים את הקובט ומכניסים למחזיק. בחר את תוכנית הנוקלאוfector U-23 (ליעילות גבוהה) והחל.
- הסר cuvette מתוך המחזיק ולהוסיף 1 מ"ל של מדיה מלאה. מעבירים את התוכן בעדינות לצלחת פטרי רקמות 60 מ"מ שטופלה במילוי 4 מ"ל של מדיה מלאה (לסך הכל 5 מ"ל של מדיה). לדגור את התאים באינקובטור CO2 לח ב 37 °C (50 °F).
- לאחר השעה 24 שעות, בדוק אם התאים מחוברים. החלף את המדיום לחלוטין.
הערה: שיעור המוות של תאים הוא גבוה נוקלאוfection משאיר כמה תאים קיימא אשר לצרף. - שמור על התאים במדיה מלאה במשך 10 ימים ועבר למדיה פלוריפוטורית במשך 20 הימים הבאים.
הערה: דמיינו תאים באופן קבוע כדי לעקוב אחר שינויים מורפולוגיים המתרחשים בתאים המתכנתים מחדש (כמו מורפולוגיה אפיתל ויצירת מושבה קומפקטית) כדי לאשר אם הניסוי עובד. כ -25 מושבות IPSC ניתן לראות לאחר 20 ימים של תרבות בתקשורת pluripotency.
4. קטיף והפצה של מושבות IPSC
-
קטיף מושבה מצלחת תכנות מחדש
- לנתח באופן ידני את המושבות דמויי תא גזע עוברי שנוצר בצלחת התכנות מחדש באמצעות pipettes זכוכית משך או מחטי מזרק 1 מ"ל ולהעביר לצלחת מוכנה בעבר עם מאכילי פיברובלסט עוברי עכבר מומת עם מדיום pluripotency או להקים תרבויות חינם מאכיל על לוחות מצופים מטריג עם מדיום mTESR.
הערה: פיברובלסטים עובריים עכבר (MEFs) נגזרו באמצעות בידוד אנזימטי מעוברי עכבר (נותחו מעכברים נשיים בהריון 13-14 ימים) והוכנסו באופן מיוטיטי על ידי טיפול mitomycin C. להקים אוכלוסיות שיבוט יחיד על ידי גידול מושבות בודדות מצלחת תכנות מחדש במנות נפרדות או באוכלוסיות שיבוט מעורבות על ידי העברת מושבות רבות מצלחת תכנות מחדש למנה אחת.
- לנתח באופן ידני את המושבות דמויי תא גזע עוברי שנוצר בצלחת התכנות מחדש באמצעות pipettes זכוכית משך או מחטי מזרק 1 מ"ל ולהעביר לצלחת מוכנה בעבר עם מאכילי פיברובלסט עוברי עכבר מומת עם מדיום pluripotency או להקים תרבויות חינם מאכיל על לוחות מצופים מטריג עם מדיום mTESR.
-
העברה מכנית של מושבות מתפתחות למאכילים טריים ועוברת להקמת IPSCs יציבים
- להפיץ iPSCs במצב בינוני pluripotency על ידי האכלה כל יום שני ולפצל 1:3 כל 5-7 ימים. הכן מניות על ידי cryopreserving בתמהיל הקפאה של החלפת סרום נוקאאוט ו- DMSO ביחס 9:1.
הערה: החלפת סרום KnockOut משמשת בתמהיל ההקפאה עבור cryopreservation של iPSCs במקום FBS כמו רכיבים ב- FBS יכול לגרום בידול של תאים pluripotent במהלך שימור לטווח ארוך.
- להפיץ iPSCs במצב בינוני pluripotency על ידי האכלה כל יום שני ולפצל 1:3 כל 5-7 ימים. הכן מניות על ידי cryopreserving בתמהיל הקפאה של החלפת סרום נוקאאוט ו- DMSO ביחס 9:1.
5. אפיון של IPSCs
הערה: מחקרי אפיון כולל PCR וחיסון עבור סמן ביולוגי pluripotency נעשו לאחר מספר המעבר החמישי. קריוטיפינג בוצע במספר מעבר מאוחר יותר.
- קריוטיפינג
- לטפל בצלחת פטרי 60 מ"מ של iPSCs עם colcemid במשך 45 דקות בחממה CO2 לח ב 37 °C (50 °F).
- קציר על ידי 0.05% טיפול טריפסין וצנטריפוגה. הסר את supernatant ו pipette את שאריות עקבות של בינוני כדי לשחרר את גלולה התא.
- הוסף 5 מ"ל של פתרון היפוטוני. מערבבים על ידי היפוך צינור ודגרה במשך 20 דקות ב 37 °C (50 °F). צנטריפוגה ב 225 x g במשך 5 דקות.
הערה: הכדור המתקבל צריך להיראות רך. - הוסף 2.5 מ"ל מהפתרון הקיבווני של קרנוי לאט, תוך הקשה כדי לשחרר את הכדור.
- הכן ממרחים עבור קריוטיפינג על ידי שחרור מתלה התא על מגלשות זכוכית נקייה.
- פנקו את השקופיות עם 0.15% טריפסין למשך דקה אחת, ושטפו פעם אחת עם PBS. לאחר מכן מכתימים עם תמיסת Giemsa במשך 4 דקות ומסתיים בשטיפת מים מזוקקת. לרכוש ולעבד באמצעות תוכנה מתאימה.
- הדגמה של מעמד חופשי טרנסג'ין
-
בידוד דנ"א גנומי
- Pipette 20 μL של פרוטאז לתחתית צינור microcentrifuge 1.5 מ"ל.
- הוסף 200 μL של TSiPSCs respended ב- PBS לצינור microcentrifuge.
- הוסף 200 μL של חוצץ AL לדגימה ומערבבים עבור 15 s על ידי דופק-מערבולת.
- דגירה במשך 10 דקות ב 56 °C (56 °F).
- צנטריפוגה בקצרה צינור microcentrifuge כדי להסיר טיפות מבפנים של המכסה.
- הוסף 200 μL של אתנול (96-100%) לדגימה, ומערבבים שוב במשך 15 s על ידי דופק-מערבולת. לאחר ערבוב, צנטריפוגות קצרות את הצינור כדי להסיר טיפות מבפנים של המכסה.
- יש למרוח בזהירות את התערובת מהשלב הקודם על עמודת הספין הקטנה (בצינור איסוף של 2 מ"ל) מבלי להרטיב את שפתו. סגור את המכסה, וצנטריפוגה ב 6000 x גרם במשך 1 דקות. השלך את הצינור המכיל את הסינון והנח את עמוד הספין הקטן בצינור איסוף נקי של 2 מ"ל.
- פתח בזהירות את עמודת הספין הקטנה וללא הרטבת השפה, הוסף 500 μL של Buffer AW1. סגור את המכסה ואת הצנטריפוגה ב 6000 x גרם במשך 1 דקות. מקם את עמודת הספין הקטנה בצינור איסוף נקי של 2 מ"ל והשלך את צינור האיסוף המכיל את הסינון.
- פתח בזהירות את עמודת הספין הקטנה והוסף 500 μL של Buffer AW2 מבלי להרטיב את שפת. סגור את המכסה ואת הצנטריפוגה במלוא המהירות (20,000 x גרם) במשך 3 דקות.
- מקם את עמודת הספין הקטנה בצינור אוסף חדש של 2 מ"ל והשלך את צינור האוסף הישן עם הסינון. צנטריפוגה במלוא המהירות במשך 1 דקות כדי לחסל את הסיכוי של חיץ AW2 אפשרי לשאת.
- מקם את עמוד הספין הקטן בצינור מיקרוצנטריפוגה נקי של 1.5 מ"ל, והשלך את צינור האיסוף המכיל את הסינון. פתחו בזהירות את עמודת הספין הקטנה והוסיפו 200 μL Buffer AE או מים מזוקקים. דגירה בטמפרטורת החדר (15-25 מעלות צלזיוס) למשך 5 דקות, ולאחר מכן צנטריפוגה ב 6000 x גרם במשך 1 דקות.
-
PCR במצב ללא טרנסג'ין (באמצעות ערכת PCR KAPA HiFi KR0368)
- ודא שכל הריאגנטים מופשרים ומעורבים כראוי.
- הכן תערובת ראשית של PCR המכילה את הנפח המתאים של כל רכיבי התגובה בהתבסס על טבלה 2 (הגדר תגובות על קרח).
- העבר את אמצעי האחסון המתאימים של תמהיל ראשי PCR, תבנית פריימר לצינורות PCR בודדים.
- מכסים תגובות אישיות, מערבבים וצנטריפוגות בקצרה.
- בצע PCR בעקבות טבלה 3.
-
בידוד דנ"א גנומי
- זיהוי סמן ביולוגי פלוריפונסי
-
כתמי פוספטאז אלקליין (AP)
- הכן פתרון עבודה של 1x AP לכתמים חיים על ידי דילול 3 μL של פתרון מלאי 500x ב- 1.5 מ"ל DMEM / F-12 עבור כל 10 ס"מ2 של אזור התרבות.
- מוציאים את המדיום ממנת התרבות של IPSC. לשטוף את התרבות עם DMEM / F-12 פעם אחת. הוסף את פתרון הכתם החי של 1x AP ל- iPSCs. דגירה ב 37 °C (55 °F) במשך 45 דקות.
- הסר את כתם AP ולשטוף פעמיים עם DMEM / F-12. הוסף DMEM/F-12 טרי ותמונה תחת מיקרוסקופ פלואורסצנטי באמצעות מסנן FITC סטנדרטי בתוך 30-90 דקות של כתמים.
-
חיסונים עבור סמנים ביולוגיים פלוריפונטיים
- תקן תרביות iPSC קונבנסביות עם 4% paraformaldehyde לילה ב 4 °C (50 °F). לשטוף שלוש פעמים עם PBS Tween 20 (PBST), כל לשטוף במשך 5 דקות.
- לתמימה את התאים עם 0.3% טריטון X-100 ב-PBST למשך 15 דקות בטמפרטורת החדר. לשטוף שלוש פעמים עם PBST.
הערה: Permeabilization צריך להיעשות רק עבור אנטיגנים תאיים. - לחסום תאים עם 3% אלבומין סרום בקר (BSA) ב- PBST למשך 30 דקות בטמפרטורת החדר. מכתימים את התאים בנוגדנים ראשוניים (מדוללים 1:1000 ב-1% BSA) במהלך הלילה. לאחר הדגירה העיקרית של הנוגדנים, יש לשטוף שלוש פעמים עם PBST.
- תאי דגירה עם הנוגדן המשני (מדולל 1:1000 ב 1% BSA) עבור 5 שעות בטמפרטורת החדר. לשטוף שלוש פעמים עם PBST.
- סמן את הגרעינים עם 0.5 מיקרוגרם / מ"ל 4 ',6-דימידינו-2-פנילינדול (DAPI) למשך דקה אחת. לשטוף את התאים פעם אחת עם PBST.
- לכוד תמונות תחת מיקרוסקופ פלואורסצנטי.
-
כתמי פוספטאז אלקליין (AP)
6.במבחנה הבחנה בחן
- בידול גוף עוברי (EB)
- חותכים את מושבות iPSC לחתיכות קטנות, לאסוף צלחת בצלחות פטרי מצורף נמוך במדיום הגוף העוברי. לגדל את התאים במשך 15 ימים על ידי החלפת מדיום כל 3 ימים.
הערה: היום 15 EBs ניתן להשתמש ישירות לגילוי של שלושה סמנים ביולוגיים שכבת נבט. לחלופין, שושלות תאים ספציפיות יכולות להיגרם עם גורמי גדילה, ואחריו זיהוי סמנים ביולוגיים.
- חותכים את מושבות iPSC לחתיכות קטנות, לאסוף צלחת בצלחות פטרי מצורף נמוך במדיום הגוף העוברי. לגדל את התאים במשך 15 ימים על ידי החלפת מדיום כל 3 ימים.
- הבחנה אנדודרם (הפטוציט)
- הגדל את ה- IPSCs בתרבויות חד שכבתיות במדיום פלוריפונס.
- לאחר המפגש, לעבור RPMI 1640 מדיה עם 1x אינסולין העברת סלניט ו 100 ng / mL activin A במשך 2 ימים, ואחריו צמיחה במדיה RPMI 1640 עם 30 ננוגרם / מ"ל bFGF ו 20 ננוגרם / mL BMP4 במשך 9 ימים. החלף מדיום כל יומיים.
- מהיום 10 ואילך, תוספת מדיה עם 0.1 μM דקסמתזון. לסיים את הניסוי ביום ה -20.
- בידול מסודרם (קרדיומיוצייט)
- צלחת יום 8 EBs על 0.5% צלחות מצופות מטריג'ל במדיום גוף עוברי. אפשר ל- EBs להתחבר ולכווץ.
- תוספת מדיה עם 20 ננוגרם / mL BMP4 ולגדול במשך 20 ימים. החלף מדיום כל 2-3 ימים. לסיים את הניסוי ביום ה -20.
- הבחנה Ectoderm (נוירוני)
- צלחת יום 4 EBs על 2 מיקרוגרם / ס"מ2 קולגן סוג צלחות מצופות IV במדיום הגוף העוברי. אפשר ל- EBs להתחבר ולכווץ.
- למחרת, להעביר בינוני ל- DMEM F-12 עם גלוקוז 2 מ"ג / מ"ל, 1x אינסולין העברה סלניט, ו 2.5μg / mL פיברונקטין. לסיים את הניסוי ביום ה -15.
- היווצרות של אורגנוידים מוחיים
- לגדל TSiPSCs בצלחת תרבית רקמות 35 מ"מ על MEFs עד 70-80% confluent. חותכים את המושבות ואוספים בצינור 15 מ"ל. צנטריפוגות התאים ב 225 x g במשך 5 דקות. זרוק את סופר-טבעי.
- לשטוף את חתיכות המושבות על ידי שימוש חוזר ב 2 מ"ל של PBS וצנטריפוגה כדי להסיר את supernatant.
- הוסף 1 מ"ל של 0.05% טריפסין והקש על הצינור כדי לנטרל את התאים. לדגור על הצינור ב 37 °C (3-4 דקות) כדי לנתק את חלקי המושבה לתוך השעיה תא אחד.
- לנטרל את טריפסין על ידי דילול עם 4 מ"ל של מדיה pluripotency המכיל 10 מיקרוגרם / mL הקשורים rho חלבון קינאז (ROCK) מעכב Y-27632 דיהידרוכלוריד (ROCKi) כדי למנוע מוות תאי המושרה דיסוציאציה.
- צנטריפוגה כדי להשיג גלולה. להשליך את supernatant ו resuspend התאים במדיום הגוף העוברי 2mL המכיל 10 מיקרוגרם / mL ROCKi.
- הסר 10 μL של השעיית תא לספירת תאים. הוסף 10 μL של כחול טריפאן כדי לזהות תאים מתים. תספור את התאים באמצעות המוצ'ימומטר.
- הוסף נפח מתאים של מדיום הגוף העוברי עם ROCKi להשעיית התא כדי להשיג 9,000 תאים חיים לכל 150 μL.
- צלחת 150 μL בכל באר של צלחת 96-באר התקשרות נמוכה ודגרה בחממה CO2 לח ב 37 °C (50 °F). בדוק את הצלחות לצבירה לאחר 24 שעות. ביום 2 מסירים בעדינות את המדיום ומחליפים במדיום עוברי טרי ללא ROCKi.
- ביום 6, להעביר EBs לבארות של חיבור נמוך 24 צלחת היטב המכיל 500 μL של אינדוקציה עצבית מדיום המורכב DMEM-F12 עם תוספת 1% N2, 2 mM GlutaMAX תוספת 1 mM חומצות אמינו לא חיוניות 1 מיקרוגרם / mL הפרין. לשנות את המדיום כל 2 ימים.
- לאחר 5 ימים במדיום אינדוקציה עצבית הטמיעו את אגרגטים neuroepithelial ב Matrigel על ידי שכבות 2 ס"מ x 2 ס"מ מרובע של parafilm מעל מגש קצה ריק של 200 טיפים μL. לחץ על parafilm עם אצבעות כפפות מעל כל חור במגש הקצה כדי להפוך שקעים קטנים. פרפילם נקי עם 70% אתנול לעיקור.
- מעבירים את ריבוע הפרפילם לצלחת 60 מ"מ. השתמש לחתוך 200 טיפים μL להעביר את אגרגטים neuroepithelial על שקעים בפרפילם. הסר מדיום עודף על ידי pipetting.
- הוסף 30 μL של מטריג'ל מופשר על אגרגטים neuroepithlial ולמקם את הצבירה למרכז מטריג'ל באמצעות טיפ פיפטה. מניחים את צלחת 60 מ"מ במשך 20-30 דקות בחממה 37 °C עבור מטריגה כדי פולימר.
- הוסף 5 מ"ל של בידול אורגנויד מוחי בינוני המורכב מ- 1:1 DMEM-F12: מדיום נוירו-בסל, תוספת N2 0.5%, 2.5 מיקרוגרם/מ"ל של אינסולין, תוספת גלוטמקס 2 מ"מ, 0.5 מ"מ NEAA, תוספת B27 ו-2.5 מ"ל של פניצילין-סטרפטומיצין.
- בעזרת מלקחיים סטריליים הופכים את גיליון הפרפילם ומסעירים את המנה עד שהמצרפים המוטמעים של מטריגל נופלים מהסדין למדיום. הגדל את האגרגטים המוטמעים בחממה CO2 לחה ב 37 °C (50 °F) במשך 4 ימים מתן שינויי מדיה בימים חלופיים.
- לאחר 4 ימים של תרבות סטטית מניחים את הכלים 60 מ"מ על שייקר מסלולית המותקנת בתוך האינקובטור רועד ב 50 סל"ד. תרבות האורגנוידים במשך 3 חודשים נותן שינויים מדיה מלאה עם בינוני בידול organoid מוחי כל 3 ימים.
תוצאות
יצירת IPSCs ללא אינטגרציה מעובר שהופלה באופן ספונטני עם קריוטיפ 45XO
בודדנו פיברובלסטים מ- FCV עם תסמונת טרנר (TS) קריוטיפ ספציפי 45XO ו nucleofected אותם עם פלסמידים לתכנות מחדש אפיזומלי כדי ליצור TSiPSCs אשר ניתן להשתמש בהם עבור מידול במורד הזרם של התסמונת, במיוחד את הגירעונות הנוירולוגיים הקשורים (איור 1a& b). השתמשנו בוקטורים אפיזומליים לא מכוונים ובנוקלאופקטציה לניסויי טרנספקטציה(איור 1 c&d). עקבנו אחר שינויים מורפולוגיים של תאים כדי לעקוב אחר ההצלחה של תכנות מחדש. המעבר מהפיברובלסט למורפולוגיה אפיתל, ואחריו היווצרות מושבה קומפקטית משורת נצפתה(איור 2a). TSiPSCs רכשו תא גזע עוברי אנושי כמו מורפולוגיה עם קצוות ברורים ויחס גרעין-לציטופלזמה גבוה סביב היום 20 לאחר transfection (איור 2b). לעומת זאת, תאים המתוכנתים מחדש באופן חלקי רוכשים מורפולוגיות אפיתל אך אינם מצליחים ליצור מושבות קומפקטיות. (איור 2c).
אפיון של TSiPSCs
קריוטיפינג של TSiPSCs חשף את קריוטיפ 45XO הקשורים לתסמונת טרנר (איור 3a). אימונופלואורסצנטיות של TSiPSCs הראתה ביטוי של גורמי שעתוק פלוריפונטיים OCT4, NANOG, SOX2, וסמני פני השטח של התא SSEA4, E-Cadherin ו- TRA-1-81. תאי גזע עובריים אנושיים הם תקן הזהב של תאי גזע פלוריפוטנטים. ביצענו בו זמנית אימונופלואורסצנטיות של HUES 1 ששימשה כשליטה חיובית להשוואה של ביטוי סמנים ביולוגיים פלוריפונטיים על ידי TSiPSC (איור 3b). מצב חופשי טרנסג'ין של TSiPSCs הודגם על ידי PCR DNA גנומי עבור סמני plasmid אפיזומליים OriP ו- EBNA. על ידי מעבר 15, גן OriP ו- EBNA אבדו ב- TSiPSCs.הגנים האפיזומליים OriP ו- EBNA הוגברו והראו להקות במעבר 9 TSiPSCs המציינות את נוכחותם של פלסמידים אפיזומליים בשלב זה. עם זאת, גנים אלה לא הוגברו במעבר 15 TSiPSCs המצביעים על אובדן של plasmids האפיזומלי ומכאן מצב חופשי טרנסג'ן (איור 3c).
במבחנה הבחנה assays
פוטנציאל הבידול של קווי TSiPSC הודגם במבחנה. TSiPSCs עם צבירה בלוחות התקשרות נמוכים יצרו גופים עובריים(איור 4a). גורם גדילה המושרה הבחנה של TSiPSCs שימש ליצירת סוגי תאים של שלוש שכבות נבט. ניתוח אימונופלואורסצנטיות באמצעות סמנים ביולוגיים ספציפיים לשושלת היוחסין אישר כי TSiPSCs נבדלו לנגזרות מייצגות של אנדודרם (SOX17), מסודרם (MYOSIN חדרית כבד צ'אי נין/β) ו ectoderm (βIII TUBULIN)(איור 4b).
הבחנה אורגנויד מוחית.
TSiPSCs הובדלו כמו organoids המוח בצורה נבונה במה. השעיות תאים בודדים של TSiPSCs הצטברו לתוך גופים עובריים כדי לעורר התפתחות של שכבות נבט במשך 6 ימים ראשוניים ואחריו אינדוקציה של התפתחות נוירו-אפיתל במשך 5 ימים. הנוירו-אפיתל המצטבר היו הם מוטבעים מטריגל אשר סיפק את מטריצה חוץ תאית ורכיבי קרום המרתף התומכים אוריינטציה apicobasal נכונה, תולדות של ניצנים neuroepithelial אשר להרחיב וליצור לומן. אימונונופלואורסצנטיות עם סמן נוירו-אפיטלי NESTIN בוצעה כדי לבחון את המורפולוגיה הכללית של האורגנוידים (איור 5b). הנוירופיליום מקיף חדר כמו חלל(איור 5c - קו לבן). האורגנוידים מציגים באופן מורפולוגי אזורי חדר (VZ), אזור תת חדרי (SVZ) וקליפת המוח כמו אזורים(איור 5c - קווים אדומים, כתומים וצהובים בהתאמה)

איור 1: בידוד פיברובלסט ותכנות מחדש באמצעות נוקלאופקט. (א)תמונה מיקרוסקופית של וילי כוריוני עוברי לפני הטיפול בקולגנאז. (ב)פיברובלסטים מבודדים מווילי כוריוני עוברי לניסויים בתכנות מחדש. (ג)אימות של תכנות מחדש plasmids על ידי עיכול הגבלת EcoRI. (ד)תרשים סכמטי של פרוטוקול transfection המועסק עבור דור iPSC מפיברובלסטים כוריוניים עובריים באמצעות פלסמידים לתכנות מחדש אפיזומלי באמצעות נוקלאופקט. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
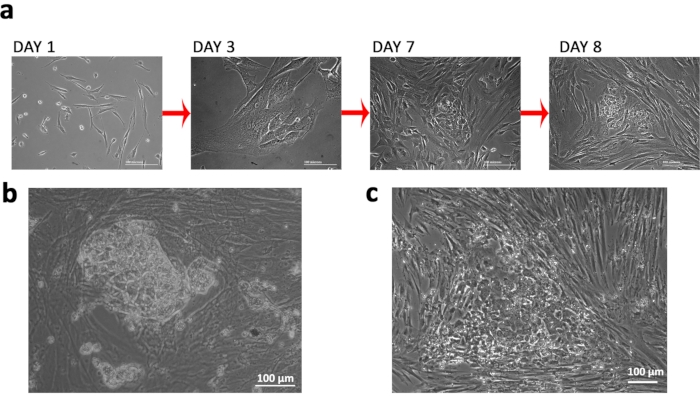
איור 2: הקמת תסמונת טרנר המושרה בתאי גזע פלוריפוטנטים. (א)שינויים במורפולוגיה של התאים שנצפו במהלך התכנות מחדש. (ב)מושבת TSiPSC המתוכנתת מחדש במלואה. (ג)תמונה מייצגת של מושבה עם תאים מתוכנתים מחדש שלא כהלכה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
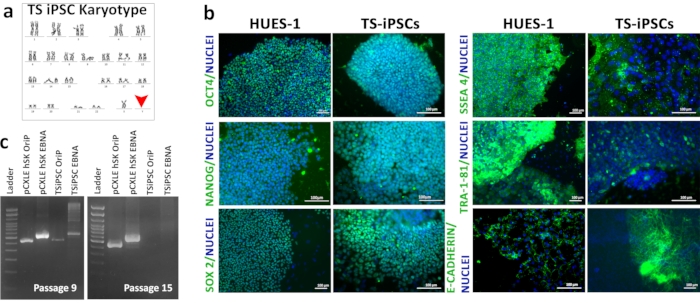
איור 3: אפיון של TSiPSCs. (א)קריוטיפ של TSiPSCs. (ב)ניתוח אימונופלואורסצנטיות של סמנים ביולוגיים pluripotency OCT4, NANOG, SOX2, SSEA-4 ו TRA-1-81 ב- TSiPSCs בהשוואה לתאי גזע עובריים HUES1. גרעינים מוכתמים עם 4', 6-דיאמידינו-2-פנילינדול. 3 ג'י. הדגמה של מעמד חופשי טרנסג'ין של TSiPSCs. ליין 1 - סולם DNA, ליין 2- שליטה חיובית OriP עם pCXLE-hSK, ליין 3- בקרת EBNA חיובית עם pCXLE-hSK, ליין 4-OriP עם TSiPSCs, ליין 5-EBNA עם TSiPSCs. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
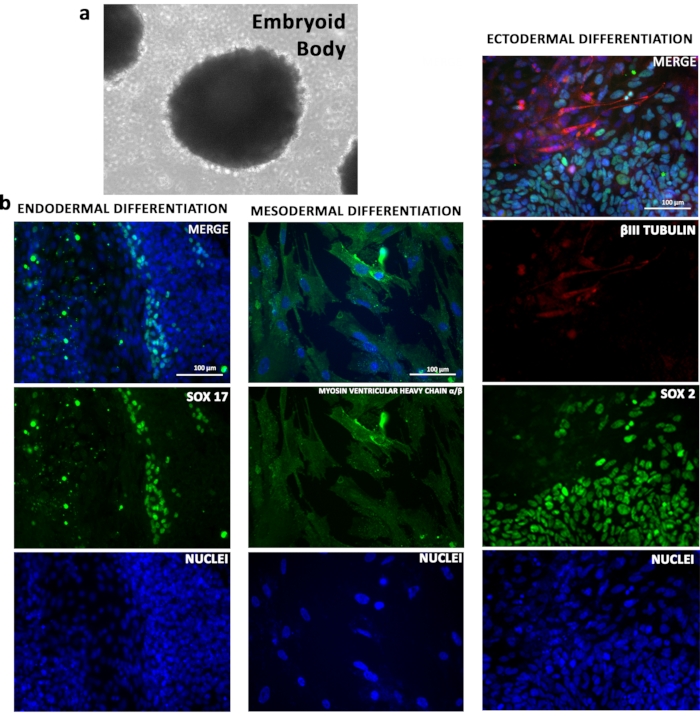
איור 4: פוטנציאל הבידול במבחנה של TSiPSCs. (א)TSiPSC מובחנת לגופים עובריים. (ב)ניתוחי אימונופלואורסצנטיות של TSiPSCs עבור סמן אנדודרמלי SOX17, סמן מזודרמלי מיוסין שרשרת כבדה חדרית α /β וסמנים ectodermal βII טובולין ו SOX2. גרעינים מוכתמים עם 4', 6-דיאמידינו-2-פנילינדול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
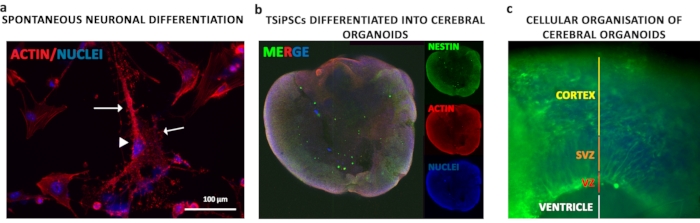
איור 5: הבחנה אורגנויד עצבית ומונית של TSiPSCs. (א)כדי להבין ציטוארכיקטורה של נוירונים מובחנים, הכתמת פאלואידין של Actin נעשה. נוירונים שמקורם ב- TSiPSC הציגו סומה עצבית בצורת פירמידה (ראש חץ) עם דנדריטים ואקסונים (חצים). גרעינים מוכתמים עם 4', 6-דיאמידינו-2-פנילינדול. חיסון. (א)חיסון לנסטין ואקטין כדי להתבונן במורפולוגיה הגסה של האורגנוידים. (ג)כתמים עבור Nestin לדמיין את השכבות העצביות המאורגנות בחדות ובבס. גרעינים מוכתמים עם 4', 6-דיאמידינו-2-פנילינדול. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
טבלה 1: הרכב של מדיה, מאגרים ופתרונות נא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: תמהיל תגובות PCR אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: תוכנית רכיבה על אופניים PCR אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
ייצור של מודלים תאיים יציבים של רקמת עובר חריגה ציטוגנטית יש צורך להנציח פנוטיפ פגום. מסלול IPSC הוא השיטה היעילה ביותר של הכנת תאים לשימור תמידי של תכונות פגומות20.
תאי גזע פלוריפוטנטים (PSC) מציגים תכונות של התחדשות עצמית ובידול לתאים מיוחדים המזכירים עוברים מחשוף מוקדם21. לפיכך, מחשבים אישיים יכולים לשמש מודלים מצוינים לחקר פגמים מולקולריים, תאיים והתפתחותיים מוקדמים בעוברים שהופלו בטרם עת.
במאמר זה תיארנו את דור iPSC האנושי באמצעות נוקלאופקטציה בשילוב עם הווקטורים האפיזומליים המשופרים. התוצאות מראות כי שילוב זה מהווה שיטה חזקה ליצירת קווי IPSC אנושיים ללא אינטגרציה כפי שמעידים העובדה שתמרות בודדות הספיקו לתכנות מחדש מוצלח. עקבנו אחר ההמרה המתקדמת של פיברובלסטים FCV לתאים פלוריפוטנטים מיקרוסקופיים. 20 ימים לאחר טרנספקטציה ראינו מושבות של TSiPSCs מתוכנתים מחדש מוקפים פיברובלסטים FCV שאינם מתוכנתים מחדש. מבחינה מורפולוגית, ה- IPSCs האנושי הנגזר דמה לתאי גזע עובריים שגדלו לצדם במעבדה. בדרך כלל, התאים מצטברים כמושבות קומפקטיות עם גבולות מבריקים. לתאי המושבות היו גרעינים גדולים וארזו היטב מה שמרמז על מגע קרוב בין התאים. הפיברובלסטים הלא מתוכנתים מחדש קישתו והקיף את המושבות האלה. עם המעבר ל- iMEFs הם ממשיכים להתרבות בתרבות במשך למעלה מ -30 העברות הממחישת את רכוש ההתחדשות העצמית המתמשכת.
כמו TSiPSCs נוצרו מפיברובלסטים 45XO אנחנו קריוטי התאים כדי לבדוק אם הם שמרו על הרכב כרומוזומלי. ה- TSiPSCs שמרו על קריוטיפ 45XO בתרבית תאים רציפה המצביעים על מבנה גנטי יציב של כרומוזום 45XO. כדי להיות שימושי כמו משאב הסלולר המייצג 45XO aneuploidy TSiPSCs צריך להיות ללא DNA אקסוגני המשמש בניסויים לתכנות מחדש. בדקנו לנוכחות של שאריות פלסמידים אפיזומליים על ידי ביצוע PCR DNA גנומי עבור סמנים ספציפיים אפיזומליים-OriP ו- EBNA. לא מצאנו זכר לסמנים אלה בתאי TSiPS לאחר 15 קטעים המצביעים על כך שה- TSiPSCs איבדו בהדרגה וקטורים לתכנות מחדש אפיזומליים בתרבות ממושכת.
סימן ההיכר של תאים פלוריפוטנטיים הוא הפוטנציאל שלו להבדיל לתאים של שלוש שושלות נבט הן במבחנה והן ב- vivo. כדי לבחון יכולת זו ב- TSiPSCs הנגזר הנחיה חשפנו אותם במבחנה להיווצרות גוף עוברי ובדיקות בידול המכוונות על ידי שושלת שושלת המפרטת ציטוקינים וגורמי גדילה. TSiPSCs יצרו גופים עובריים והובדלו לתאים אקטודרמליים המבטאים סמנים עצביים, תאים מזודרמליים המבטאים סמני לב ותאים אנדודרמליים המבטאים SOX17 סמן ביולוגי של גורל אנדודרם. בדקנו גם את היכולת של TSiPSCs להבדיל לתוך אורגנוידים מוחיים 3D בסדר גבוה יותר באמצעות פרוטוקולים שנקבעו בעבר22. TSiPSCs בהדרגה לארגן את עצמם בשל תוכניות התפתחותיות מהותיות משלהם לתוך רקמות מיני הנקראות organoids. TSiPSCs הניבו אורגנוידים מוחיים המראים ציטורכיטקטורה הדומה לרקמת המוח עם נוירופיליום המקיף חדר כמו חלל. עם זאת organoids אלה צריכים להיות מאופיינים בהרחבה כדי לחשוף את סוגי התאים המדויקים לעומת iPSCs נורמלי כדי להבחין בין תכונות דפוס רקמות עצביות מהותיות של TSiPSCs. אורגנוידים מוחיים אלה וסוגים אחרים של אורגנוידים במוח שנוצרו מ- TSiPSCs יכולים לשמש למודל חוסר עקביות התפתחותית ופונקציונלית שעשויה לתרום לתסמינים של ליקויים נוירולוגיים של אנשים TS. TSiPSCs הציגו מאפיינים סמנים ביולוגיים של pluripotency, כמו גם את התכונה סימן ההיכר של בידול ובכך להדגיש את ההצלחה של תכנות מחדש כדי pluripotencency המושרה.
השיטה המתוארת לעיל עבדה ביעילות בתכנות מחדש של פיברובלסטים עוריים ותאים מזנכימליים שמקורם במקורות שונים במעבדה שלנו (נתונים של קווים אחרים לא הוצגו). מניסיוננו, השלבים הבאים הם קריטיים להצלחת הניסוי לתכנות מחדש:
א) איכות הכנת פלסמיד: הכנות ישנות אינן מניבות IPSCs.
ב) איכות התאים המשמשים לתמרות: תאים מתרבים חיוניים ליצירת iPSC. 0.5 עד 1 מיליון תאים לכל טרנספקט הניבו יעילות תכנות מחדש לשחזור.
ג) ריאגנטים נוקלאוfector משוחזרים טריים: ריאגנטים נוקלאוfector משוחזרים המאוחסנים במשך יותר מחודש לא הניבו iPSCs.
ד) תחזוקת בנק התא הראשי על ידי תת-תרבות מכנית של ה- IPSCs הניבה קווים יציבים. דיסוציאציה אנזימטית שימשה לפי דרישת הניסוי.
המטרה העתידית של המעבדה היא להקים פאנל של IPSCs חריגים כרומוזומלית לפיתוח במורד הזרם, מידול פונקציונלי ומחלות בשיטה יעילה זו. aneuploidies עוברי לגרום לאובדן הריון ומומים איברים בלידות חיות. IPSCs Aneuploid נגזר רקמות של אבונטולים ספונטניים הם משאב בעל ערך לדגמן ומחקר אירועים התפתחותיים עובריים כושלים. במערכות תרבית 2D ו-3D במבחנה, כולל גופים עובריים ואורגנוידים ספציפיים לרקמות22, יאפשרו לחוקרים להבין אי סדרים מולקולריים ותאיים כגון התפשטות תאים חריגים ומוות תאים בתאים ספציפיים לשושלת היוחז שיכולים להתבטא כחריגות התפתחותיות וכשלים בהריון הקשורים לתסמונות אנופלואידיות.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
תמיכה כספית במחקר הנ"ל ניתנה על ידי האקדמיה להשכלה גבוהה מניפל. אפיון הקו נערך בחלקו במעבדה של M.M. Panicker ב- NCBS. אנו מודים למעבדת האבחון Anand על הסיוע בקריוטיפינג.
Materials
| Name | Company | Catalog Number | Comments |
| 0.15% trypsin | Thermo Fisher Scientific | 27250018 | G Banding |
| 2-mercaptoethanol | Thermo Fisher Scientific | 21985023 | Pluripotency and Embryoid body medium |
| 4', 6 diamidino-2-phenylindole | Sigma Aldrich | D8417 | Immunocytochemistry |
| Activin A | Sigma Aldrich | SRP3003 | Differentiation assays |
| Alkaline Phosphatase Live Stain | Thermo Fisher Scientific | A14353 | AP staining |
| AMAXA Nucleofector II | Lonza | - | Nucleofection |
| AmnioMAX II complete media | Thermo Fisher Scientific, Gibco | 11269016 | Medium specific for foetal chorionic villi cell cultures |
| Ampicillin | HiMedia | TC021 | Plasmid purification |
| Anti Mouse IgG (H+L) Alexa Fluor 488 | Invitrogen | A11059 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 488 | Invitrogen | A11034 | Immunocytochemistry |
| Anti Rabbit IgG (H+L) Alexa Fluor 546 | Invitrogen | A11035 | Immunocytochemistry |
| Antibiotic-Antimycotic | Thermo Fisher Scientific, Gibco | 15240096 | Contamination control |
| Anti-E-Cadherin | BD Biosciences | 610181 | Immunocytochemistry |
| Anti-Nanog | BD Biosciences | 560109 | Immunocytochemistry |
| Anti-OCT3/4 | BD Biosciences | 611202 | Immunocytochemistry |
| Anti-SOX17 | BD Biosciences | 561590 | Immunocytochemistry |
| Anti-SOX2 | BD Biosciences | 561469 | Immunocytochemistry |
| Anti-SSEA4 | BD Biosciences | 560073 | Immunocytochemistry |
| Anti-TRA 1-81 | Millipore | MAB4381 | Immunocytochemistry |
| basic Fibroblast Growth Factor[FGF2] | Sigma Aldrich | F0291 | Pluripotency medium |
| Bone Morphogenetic Factor 4 | Sigma Aldrich | SRP3016 | Differentiation assays |
| Bovine Serum Albumin | Sigma Aldrich | A3059 | Blocking |
| Collagen Human Type IV | BD Biosciences | 354245 | Differentiation assays |
| Collagenase blend | Sigma Aldrich | C8051 | Digestion of foetal chorionic villi |
| Dexamethasone | Sigma Aldrich | D4902 | Differentiation assays |
| DMEM F12 | Thermo Fisher Scientific | 11320033 | Differentiation assays |
| FastDigest EcoR1 | Thermo Scientific | FD0274 | Restriction digestion |
| Fibronectin | Sigma Aldrich | F2518 | Differentiation assays |
| Giemsa Stain | HiMedia | S011 | G Banding |
| Glacial Acetic Acid | HiMedia | AS001 | Fixative for karyotyping |
| Glucose | Sigma Aldrich | G7528 | Differentiation assays |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | Pluripotency and Embryoid body medium |
| Heparin sodium | Sigma Aldrich | H3149 | Differentiation assays |
| Insulin solution human | Sigma Aldrich | I9278 | Differentiation assays |
| Insulin Transferrin Selenite | Sigma Aldrich | I1884 | Differentiation assays |
| KAPA HiFi PCR kit | Kapa Biosystems | KR0368 | OriP, EBNA1 PCR |
| KaryoMAX Colcemid | Thermo Fisher Scientific | 15210040 | Mitotic arrest for karyotyping |
| KnockOut DMEM | Thermo Fisher Scientific | 10829018 | Pluripotency and Embryoid body medium |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828028 | Pluripotency and Embryoid body medium |
| Luria Bertani agar | HiMedia | M1151F | Plasmid purification |
| Matrigel | BD Biosciences | 356234 | Differentiation assays |
| MEM Non-essential amino acids | Thermo Fisher Scientific | 11140035 | Pluripotency and Embryoid body medium |
| Methanol | HiMedia | MB113 | Fixative for karyotyping |
| Myosin ventricular heavy chain α/β | Millipore | MAB1552 | Immunocytochemistry |
| NHDF Nucleofector Kit | Lonza | VAPD-1001 | Nucleofection |
| Paraformaldehyde (PFA) | Sigma Aldrich | P6148 | Fixing cells |
| pCXLE-hOCT3/ 4-shp53-F | Addgene | 27077 | Episomal reprogramming Plasmid |
| pCXLE-hSK | Addgene | 27078 | Episomal reprogramming Plasmid |
| pCXLE-hUL | Addgene | 27080 | Episomal reprogramming Plasmid |
| Penicillin Streptomycin | Thermo Fisher Scientific, | 15070063 | Pluripotency and Embryoid body medium |
| Phalloidin- Tetramethylrhodamine B isothiocyanate | Sigma Aldrich | P1951 | Immunocytochemistry |
| Phosphate buffered saline | Sigma Aldrich | P4417 | 1 X PBS 1 tablet of PBS dissolved in 200mL of deionized water and sterilized by autoclaving Storage: Room temperature. PBST- 0.05% Tween 20 in 1X PBS. Storage: Room temperature. |
| Plasmid purification Kit- Midi prep | QIAGEN | 12143 | Plasmid purification |
| Potassium Chloride Solution | HiMedia | MB043 | Hypotonic solution for karyotyping |
| QIAamp DNA Blood Kit | Qiagen | 51104 | Genomic DNA isolation |
| RPMI 1640 | Thermo Fisher Scientific | 11875093 | Hepatocyte differentiation medium |
| Sodium Citrate | HiMedia | RM255 | Hypotonic solution for karyotyping |
| Triton X-100 | HiMedia | MB031 | Permeabilisation |
| Trypsin-EDTA (0.05%) | Thermo Fisher Scientific, Gibco | 25300054 | Subculture of foetal chorionic villi fibroblasts |
| Tween 20 | HiMedia | MB067 | Preparation of PBST |
| β III tubulin | Sigma Aldrich | T8578 | Immunocytochemistry |
| Y-27632 dihydrochloride | Sigma Aldrich | Y0503 | Differentiation assays |
References
- Verlinsky, Y., et al. Human embryonic stem cell lines with genetic disorders. Reproductive BioMedicine Online. 10, 105-110 (2005).
- Eiges, R., et al. Developmental Study of Fragile X Syndrome Using Human Embryonic Stem Cells Derived from Preimplantation Genetically Diagnosed Embryos. Cell Stem Cell. 1, 568-577 (2007).
- Biancotti, J. -. C., et al. Human Embryonic Stem Cells as Models for Aneuploid Chromosomal Syndromes. STEM CELLS. 28, 1530-1540 (2010).
- Li, W., et al. Modeling abnormal early development with induced pluripotent stem cells from aneuploid syndromes. Human Molecular Genetics. 21, 32-45 (2012).
- Gravholt, C. H., Viuff, M. H., Brun, S., Stochholm, K., Andersen, N. H. Turner syndrome: mechanisms and management. Nature Reviews Endocrinology. 15, 601-614 (2019).
- Luo, Y., et al. Uniparental disomy of the entire X chromosome in Turner syndrome patient-specific induced pluripotent stem cells. Cell Discovery. 1, 15022 (2015).
- Luo, Y., et al. Generation of an induced pluripotent stem cell line from an adult male with 45,X/46,XY mosaicism. Stem Cell Research. 27, 42-45 (2018).
- Parveen, S., Panicker, M. M., Gupta, P. K. Generation of an induced pluripotent stem cell line from chorionic villi of a Turner syndrome spontaneous abortion. Stem Cell Research. 19, (2017).
- Takahashi, K., et al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell. 131, 861-872 (2007).
- Soldner, F., et al. Parkinson's Disease Patient-Derived Induced Pluripotent Stem Cells Free of Viral Reprogramming Factors. Cell. 136, 964-977 (2009).
- Somers, A., et al. Generation of Transgene-Free Lung Disease-Specific Human Induced Pluripotent Stem Cells Using a Single Excisable Lentiviral Stem Cell Cassette. STEM CELLS. 28, 1728-1740 (2010).
- Woltjen, K., et al. piggyBac transposition reprograms fibroblasts to induced pluripotent stem cells. Nature. 458, 766-770 (2009).
- Stadtfeld, M., Nagaya, M., Utikal, J., Weir, G., Hochedlinger, K. Induced Pluripotent Stem Cells Generated Without Viral Integration. Science. 322, 945-949 (2008).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proceedings of the Japan Academy, Series B. 85, 348-362 (2009).
- Warren, L., et al. Highly Efficient Reprogramming to Pluripotency and Directed Differentiation of Human Cells with Synthetic Modified mRNA. Cell Stem Cell. 7, 618-630 (2010).
- Kim, D., et al. Generation of human induced pluripotent stem cells by direct delivery of reprogramming proteins. Cell Stem Cell. 4, 472-476 (2009).
- Yu, J., et al. Human Induced Pluripotent Stem Cells Free of Vector and Transgene Sequences. Science. 324, 797-801 (2009).
- Okita, K., et al. A more efficient method to generate integration-free human iPS cells. Nature Methods. 8, 409-412 (2011).
- Martí, M., et al. Characterization of pluripotent stem cells. Nature Protocols. 8, 223-253 (2013).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nature Reviews Molecular Cell Biology. 17, 170-182 (2016).
- Ambartsumyan, G., Clark, A. T. Aneuploidy and early human embryo development. Human Molecular Genetics. 17, 10-15 (2008).
- Lancaster, M. A., Knoblich, J. A. Generation of cerebral organoids from human pluripotent stem cells. Nature Protocols. 9, 2329-2340 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved