Method Article
Сверхбыстрая экстракция лигнина из необычных средиземноморских лигноцеллюлозных остатков
В этой статье
Резюме
Глубокая эвтектическая предварительная обработка на основе растворителей с помощью микроволновой печи — это зеленый, быстрый и эффективный процесс фракционирования лигноцеллюлозы и восстановления лигнина высокой чистоты.
Аннотация
Предварительная обработка по-прежнему является самым дорогим этапом в лигноцеллюлозных процессах биоперерабатывающего производства. Он должен быть экономически эффективным за счет минимизации химических требований, а также потребления энергии и тепла и использования экологически чистых растворителей. Глубокие эвтектические растворители (DES) являются ключевыми, зелеными и недорогими растворителями на устойчивых биообиплавательных предприятиях. Они представляют собой прозрачные смеси, характеризующиеся низкими температурами замерзания, возникающими в результате по меньшей мере одного донора водородной связи и одного акцептора водородных связей. Хотя DES являются перспективными растворителями, для конкурентоспособной рентабельности их необходимо сочетать с экономичной технологией отопления, такой как микроволновое облучение. Микроволновое облучение является многообещающей стратегией для сокращения времени нагрева и повышения фракционирования, поскольку оно может быстро достичь соответствующей температуры. Целью этого исследования была разработка одноэтапного, быстрого метода фракционирования биомассы и экстракции лигнина с использованием недорогого и биоразлагаемого растворителя.
В этом исследовании проводилась предварительная обработка DES с помощью микроволновой печи в течение 60 с при 800 Вт с использованием трех видов DES. Смеси DES были легко приготовлены из холина хлорида (ChCl) и трех доноров водородных связей (HBD): монокарбоновой кислоты (молочной кислоты), дикарбоновой кислоты (щавелевой кислоты) и мочевины. Эта предварительная обработка использовалась для фракционирования биомассы и извлечения лигнина из морских остатков (листья Posidonia и aegagropile), агропищевых побочных продуктов (миндальные раковины и оливковое жмых), лесных остатков (сосновые шишки) и многолетних лигноцеллюлозных трав(Stipa tenacissima). Дальнейшие анализы были проведены для определения выхода, чистоты и молекулярно-массового распределения восстановленного лигнина. Кроме того, влияние ДСС на химические функциональные группы в экстрагированном лигнине определяли методом инфракрасной спектроскопии с преобразованием Фурье (FTIR). Результаты показывают, что смесь ChCl-щавелевой кислоты обеспечивает самую высокую чистоту лигнина и самый низкий выход. Настоящее исследование показывает, что процесс DES-микроволновой печи является сверхбыстрой, эффективной и конкурентоспособной по стоимости технологией фракционирования лигноцеллюлозной биомассы.
Введение
Устойчивые процессы биопереработки интегрируют переработку биомассы, ее фракционирование в молекулы, представляющие интерес, и их преобразование в продукты с добавленной стоимостью1. При биорефинировки второго поколения предварительная обработка считается необходимой для фракционирования биомассы на ее основные компоненты2. Широко применяются традиционные методы предварительной обработки с использованием химических, физических или биологических стратегий3. Однако такая предварительная обработка считается самым дорогим этапом биопереработки и имеет другие недостатки, такие как длительное время обработки, высокое потребление тепла и энергии, а также примеси растворителя4. В последнее время DES, свойства которых аналогичны свойствам ионных жидкостей3,появились в качестве зеленых растворителей благодаря таким преимуществам, как биоразлагаемость, экологичность, простота синтеза и восстановление после обработки5.
DES представляют собой смеси по меньшей мере одного HBD, такого как молочная кислота, яблочная кислота или щавелевая кислота, и акцептора водородных связей (HBA), такого как бетаин или холинхлорид(ChCl)6. Взаимодействия HBA-HBD обеспечивают каталитический механизм, который позволяет расщеплять химические связи, вызывая фракционирование биомассы и разделение лигнина. Многие исследователи сообщали о предварительной обработке на основе DES лигноцеллюлозного сырья, такого как ChCl-глицерин на початках кукурузы и стовер7,8,ChCl-мочевина и ChCl-щавелевая кислота на пшеничной соломе9,ChCl-молочная кислота на эвкалиптовых опилках10и ChCl-уксусная кислота11 и ChCl-этиленгликоль на древесине11. Для повышения эффективности ДЭС предварительную обработку следует сочетать с микроволновой обработкой для ускорения фракционирования биомассы5. Многие исследователи сообщали о такой комбинированной предварительной обработке (DES и микроволновой печи) древесины8 и кукурузы, травы и Мискантуса5,что дает новое представление о способности DES для лигноцеллюлозного фракционирования и экстракции лигнина за один простой шаг в течение короткого периода.
Лигнин представляет собой фенольные макромолекулы, валоризированные в качестве сырья для производства биополимеров и представляющие собой альтернативу для производства химических веществ, таких как ароматические мономеры и олигомеры12. Кроме того, лигнин обладает антиоксидантной и ультрафиолетовой абсорбционной активностью13. В нескольких исследованиях сообщалось о применении лигнина в косметических продуктах14,15. Его интеграция в коммерческие солнцезащитные продукты улучшила фактор защиты от солнца (SPF) продукта с SPF 15 до SPF 30 с добавлением только 2 мас.% лигнина и до SPF 50 с добавлением 10 мас.% лигнина16. В данной работе описывается сверхбыстрый подход к расщеплению лигнин-углеводов, поддерживаемый комбинированной DES-микроволновой предварительной обработкой средиземноморских биомасс. Эти биомассы состоят из побочных продуктов сельскохозяйственной пищи, особенно оливкового выжимки и миндальных оболочек. Другими биомассами, которые были исследованы, были биомассы морского происхождения (листья Посидонии и агагропиле) и биомассы, происходящие из леса (сосновые шишки и дикие травы). Основное внимание в этом исследовании было уделено тестированию недорогих зеленых растворителей для оценки влияния этой комбинированной предварительной обработки на фракционирование сырья, изучения его влияния на чистоту и выход лигнина, а также изучения его влияния на молекулярные массы и химические функциональные группы в экстрагированном лигнине.
протокол
1. Подготовка биомассы
- Сушка биомассы
- Поместите листья Посидонии и шарики aegagropile(Posidonia oceanica),собранные на средиземноморских пляжах, в духовку при 40 °C в течение 72 ч.
- Поместите миндальные раковины(Prunus dulcis),полученные в пищевой промышленности, и оливковыйжмых (Olea europaea L.),полученный из мельниц оливкового масла, в печь при 40 °C в течение 72 ч.
- Поместите сосновые шишки(Pinus halepensis),собранные из леса, и листья альфа(Stipa tenacissima), собранныеиз южного средиземноморского бассейна, в печь при 40 °C в течение 72 ч.
ПРИМЕЧАНИЕ: Если биомасса содержит песок, ее необходимо промыть дистиллированной водой перед тем, как поместить в духовку. Биомассы показаны на рисунке 1A-F.
- Измельчение биомассы
- Поместите 20 г каждой биомассы в молотковый резак, оснащенный ситом 1 мм. Соберите полученную порошок в 0,25 л и подайте его в молотковый резак, оснащенный ситом 0,5 мм. Соберите порошок в 0,25 л.
2. Сверхбыстрая экстракция лигнина с помощью микроволновой печи
- Препарат глубокого эвтектического растворителя (DES)
- Готовят DES1 (ChCl-щавелевую кислоту) в молярном соотношении 1:1, смешивая 174 г ChCl со 126 г дигидрата щавелевой кислоты в колбе круглого дна объемом 500 мл и плавя их в ванне при 70 °C в течение 4 ч до образования однородной и прозрачной жидкости.
- Готовят DES2 (ChCl-молочная кислота) в молярном соотношении 1:1, смешивая 174 г ChCl с 90 г молочной кислоты в колбе круглого дна объемом 500 мл и плавя их в ванне при 70 °C в течение 4 ч до образования однородной и прозрачной жидкости.
- Готовят DES3 (ChCl-мочевину) в молярном соотношении 1:12, смешивая 174 г ChCl со 120 г мочевины в колбе круглого дна объемом 500 мл и плавя их в ванне при 70 °C в течение 4 ч до образования однородной и прозрачной жидкости.
ПРИМЕЧАНИЕ: Непрерывно перемешивать эти смеси с помощью перемешивания при 500 об/мин.
- Комбинированная микроволново-DES обработка
- Поместите 5 г исходного сырья в микроволновую печь в закрытом политетрафторэтиленовом реакторе. Добавьте 50 мл ДЭС и поместите в образец перемешивающий батончик. Закройте контейнер для микроволновой печи соответствующим колпачком и прикрепите температурный колпачок.
- Поместите микроволновый контейнер на край поворотного стола, следя за тем, чтобы он постоянно перемешивался. Установите мощность микроволновой печи на 800 Вт в течение 1 мин. Используя подходящие перчатки, доньте контейнер из микроволновой печи и дайте смеси остыть. Повторите эту обработку, используя три DES для каждого образца биомассы.
ПРИМЕЧАНИЕ: Проверьте и убедитесь, что датчик температуры правильно размещен, а микроволновый контейнер имеет однородную температуру.
- Выделение лигнина
- Готовят однородный раствор антирастворимого действия, смешивая этанол:вода в соотношении 50:50 (v:v). Добавить 50 мл антирастворимого раствора в обработанное сырье, поместить смесь в контейнер для центрифугирования (250 мл) и центрифугу в течение 5 мин при 3000 × г.
- После центрифугирования фильтруют супернатант (богатую лигнином фракцию) с помощью стеклянного фильтрующего тигля (пористость 4, 10-16 мкм, диаметр 10 мм). Оставшийся целлюлозный остаток, собранный после центрифугирования, промыть 25 мл раствора антирастворимого.
- Центрифуга по 3000 × г в течение 5 мин после каждой стирки. Повторные промывки 4x, а затем собирают и фильтруют промывки через стеклянный фильтр тигель (пористость N 4, 10-16 мкм, диаметр 10 мм).
- Добавьте отфильтрованную фракцию, богатую лигнином, со ступени 2.3.2 в фильтрованные промывки со ступени 2.3.3 в колбу с круглым дном 500 мл. Выпаривание этанола с помощью роторного испарителя при 50 °C и 110 мбар.
- Добавьте 150 мл деионизированной воды в концентрированный щелок (фракция, богатая лигнином) и осадите лигнин центрифугированием. Собрать лигнин в виде гранулы и промыть его 25 мл дистиллированной воды; повторите стирки 4x. Лиофилизируйте лигнин или высушите его в духовке при 40 °C.
ПРИМЕЧАНИЕ: При необходимости промывайте лигнин >4x для удаления солей из растворителей. - Используйте следующую формулу для определения урожайности:

ПРИМЕЧАНИЕ: Экстракцию лигнина также проводили с двумя другими DES: холина хлорида + резорцина и холина хлорида + масляной кислоты через 1 мин. Однако количества лигнина, восстановленные с использованием этих DES, были чрезвычайно малы (и невосстановимы) по сравнению с количествами, полученными с использованием трех других DES.
3. Определение чистоты экстрагированного лигнина klason
- Пробоподготовка для гидролиза Класона
- Поместите тигель фильтра (пористость 4, диаметр 4,5 мм) в муфельную печь при 550 °C на 4 ч (рампа 2 ч, от 25°С). Снимите тигель, когда духовка остынет до 150 °C, поместите его в адсорбатор для охлаждения и взвесьте.
- Добавьте приблизительно 30 мг лигнина в боросиликатную стеклянную трубку (см. Таблицу материалов)и обратите внимание на вес образца. Добавьте к образцу 1 мл 72% серной кислоты(H2SO4),поместите образец в ванну с 30 °C в течение 60 мин и перемешайте каждые 10 мин путем вихря.
- Извлеките образец, переложите его в стеклянную бутылку объемом 100 мл и добавьте 28 мл дистиллированной воды, чтобы разбавить кислоту до концентрации 4%. Поместите стеклянную бутылку в автоклав при 121 °C в течение 60 мин. Снимите стеклянную бутылку и дайте ей остыть.
- Анализ кислотно-нерастворимого лигнина
- Отфильтруйте гидролизат с помощью тигля под вакуумом. Соберите все твердые вещества в стеклянную бутылку, содержащую деионизированную воду. Промойте тигель 50 мл деионизированной воды.
- Высушите тигель, содержащий твердые вещества, поместив его в духовку при 105 °C в течение 16 ч. Достаньте тигель из духовки, поместите его в адсорбатор и дайте остыть. Взвесьте образец.
- Поместите тигель в муфельную печь при 550 °C в течение 4 ч (рампа 2 ч). Снимите его и поместите в адсорбатор. Взвесьте образец.
- Используйте следующую формулу для расчета процента кислотно-нерастворимого остатка (AIR):

WCSA: вес тигля + образец после извлечения их из духовки
Туалет: вес тигля
WCSMF: вес тигля после извлечения его из муфельной печи
ODW: сухой вес образца в духовке
- Анализ кислоторастворимого лигнина
- Измерьте поглощение фильтрата, полученного на этапе 3.2.1, с помощью спектрофотометра на 205 нм с помощью кварцевых кювет. Используйте дистиллированную воду в качестве заготовки.
- Используйте следующую формулу для расчета процента кислоторастворимого остатка (ASL):
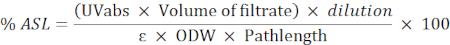
ПРИМЕЧАНИЕ: Поглощение должно составлять от 0,2 до 0,7. При необходимости разбавьте образец.
UVabs: поглощение при 205 нм
Длина контура: световой путь измерительной ячейки (в см)
ε: поглощение биомассы на определенной длине волны
4. Содержание азота в экстрагированном лигнине
- Приготовление раствора щелочей
- В объемной колбе объемом 2,5 л взвесьте 1 кг гидроксида натрия (NaOH) и добавьте деионизированную воду до отметки. Поместите магнитный стержень в колбу и перемешивайте до тех пор, пока NaOH полностью не растворится.
- Приготовление раствора серной кислоты
- Возьмите 0,1 N H2SO4 (см. Таблицу материалов)в объемную колбу объемом 5 л, добавьте деионизированную воду до отметки 5 л, поместите магнитный стержень и перемешивайте до тех пор, пока содержимое не растворится.
- Приготовление приемного раствора
- В объемной колбе объемом 5 л растворить 100 г H3BO3 (борной кислоты) в деионизированной воде и довести объем до отметки.
- Взвесьте 100 мг бромокресола зеленого в объемной колбе объемом 100 мл и добавьте технический метанол до отметки.
- Взвесьте 100 мг метилового красного в объемной колбе объемом 100 мл и добавьте технический метанол до отметки.
- В емкость влейте 5 л раствораH3BO3 со ступени 4.3.1, 100 мл зеленого раствора бромокресола со ступени 4.3.2, 70 мл метилового красного раствора со ступени 4.3.3 и 5 л деионизированной воды в емкость. Хорошо встряхните приемный раствор в течение 30 мин.
ПРИМЕЧАНИЕ: Конечный цвет раствора должен быть зеленым. Если цвет не зеленый, добавьте 50 мл 1 N раствора NaOH.
- Пробоподготовка
- В пробирку Кьельдала поместите 100 мг взвешенного лигнина на безазотную бумагу, добавьте таблетку Кьелдхала (1,5 г сульфата калия (K2SO4)+ 0,045 г пентагидрата сульфата меди (CuSO4,5H2O) + 0,045 г диоксида титана (TiO2))и добавьте 7,2 мл концентрированного H2SO4.
ПРИМЕЧАНИЕ: Используйте четыре пробирки только с безазотистой бумагой (без образцов) в качестве заготовок.
- В пробирку Кьельдала поместите 100 мг взвешенного лигнина на безазотную бумагу, добавьте таблетку Кьелдхала (1,5 г сульфата калия (K2SO4)+ 0,045 г пентагидрата сульфата меди (CuSO4,5H2O) + 0,045 г диоксида титана (TiO2))и добавьте 7,2 мл концентрированного H2SO4.
- Переваривание проб
- Включите термостат на реакторе за 1 ч при 360 °C.
- Поместите пробоотборники на стойку, поместите четыре пустые трубки в четыре угла стойки и заполните отверстия (если таковые есть) стойки пустыми трубками.
- Поместите стойку в предварительно нагретый реактор, накройте систему всасывания и откройте водяной насос.
ПРИМЕЧАНИЕ: Позаботьтесь о том, чтобы избежать паров; увеличить поток воды при появлении паров. - Через 2 ч выключите нагрев, извлеките образцы и поместите их на металлическую опору. Дайте стойке остыть в течение примерно 40 минут при включенной системе всасывания.
- Процедура дистилляции Kjeldhal
- Включите дистиллятор Kjeldahl. Разрешить выполнение самотестов до тех пор, пока на экране не появится selection. Переключитесь в ручной режим, вставьте пустую трубку и закройте раздвижную дверь.
- Продувку титранта бюретки (0,02 Н НН 2SO4)(поднимите крышку), нажав на нее снизу и сверху несколько раз, и устраните пузырьки воздуха из труб, сжав трубку флакона H2SO4. Закройте капот.
- Продувка приемного раствора H3BO3x.
- Добавьте воду в 3 раза и переключитесь на активный пар (10 мин). Переключитесь на программу анализа Kjeldahl 1. Введите Бланко с помощью стрелок на уровне строки результата.
- Вставьте трубку. Начните с четырех пробелов и рассчитайте их средние значения. Введите значение в строке Бланко
ПРИМЕЧАНИЕ: После вставки трубки устройство автоматически и последовательно добавляет 30 мл H2O, 30 мл H3BO3и 40 мл 10 N NaOH. - Переключитесь на мл титранта в строке результата. Вставьте трубку и обратите внимание на количество используемого H2SO4.
ПРИМЕЧАНИЕ: Чтобы протестировать дистиллятор Kjeldahl, учтите, что 50 мг глицерина соответствуют 18,60% ± 5% % N. В конце каждого титрования устройство автоматически опорожняет и очищает трубку. - Вычисление процента N.

V s.a : Объем серной кислоты
T s.a : 0.02 N H2SO4
S: масса образца
5. Зольность в экстрагированном лигнине
- Высушите керамические тигли в течение 1 ч при 105 °C. Оставьте их остывать в адсорбаторе.
- Взвесьте тигель и запишите его номер. Добавьте приблизительно 1 г порошка образца. Поместите тигель в муфельную печь со следующей программой: 2-часовой рампой до 575 °C; плато 4 ч при 575 °C.
- Дайте духовке остыть до 100 °C. Снимите тигли, поместите их в адсорбатор и взвесьте.
6. Содержание углеводов
- Приготовление раствора боргидриданатрия (NaBH 4)/диметилсульфоксида (ДМСО)
- Поместите 2 г NaBH4 в объемную колбу объемом 100 мл и заполните до отметки ДМСО. Нагрейте до 100 °C в ванной Майора и перемешайте раствор до полного растворения.
- Приготовление раствора MIX
- Поместите по 20 мг ксилозы, арабинозы, римнозы, глюкозы, галактозы, маннозы и 2-дезоксиглюкозы в объемную колбу объемом 100 мл и заполните до отметки 100 мл деионизированной водой.
- Гидролиз образца
- Взвесите 50 мг образца лигнина в боросиликатной стеклянной трубке, добавьте 3 мл 1 МН2SO4и нагрейте смесь в течение 3 ч при 100 °С.
- Охладите образец, добавьте 1 мл 15 М гидроксида аммония (NH4OH) и проверьте рН, чтобы убедиться, что он нейтральный или щелочной. Добавьте ровно 1 мл внутреннего стандарта (2-дезоксиглюкозы) к каждому образцу.
ПРИМЕЧАНИЕ: 2-дезоксиглюкоза, добавленная в качестве внутреннего стандарта, позволяет количественно оценить количество каждой дозы, присутствующей в образце.
- Восстановление и ацетилирование моносахаридов в ацетат альдитола
- Возьмите 400 мкл раствора из шага 6.3.2 и поместите его в специальные пробирки. Возьмите 400 мкл контрольного раствора MIX и поместите его в специальные пробирки.
ПРИМЕЧАНИЕ: Использование решения MIX облегчает расчет коэффициентов отклика (RF) и моносахаридных процентных соотношений. - Добавить 2 мл раствора NaBH4/DMSO,приготовленного в разделе 6.1. Закройте трубку и высиживайте в течение 90 мин при 40 °C на водяной бане. Снимите трубку с водяной бани и добавьте 0,6 мл ледниковой уксусной кислоты.
ПРИМЕЧАНИЕ: Поскольку это экзотермическая реакция, появятся пузырьки и дым. - Добавьте приблизительно 0,4 мл 1-метилимидазола и приблизительно 4 мл уксусного ангидрида. Через 15 мин добавить 10 мл дистиллированной воды, охладить и добавить ~3 мл дихлорметана (CH2Cl2).
- По меньшей мере через 2 ч собирают ~1 мл нижней (органической) фазы и вводят его в газовый хроматограф, оснащенный капиллярной колонкой пламенно-ионизационного детектора HP1-метилсилоксан (30 м (длина) x 320 мкм (внутренний диаметр), 0,25 мкм (толщина пленки)). Анализируйте данные.
- Используйте следующую формулу для расчета коэффициента отклика (РЧ).
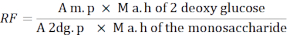
A м. п.: Среднее значение площади пика моносахарида в растворе MIX
M a. h из 2 - дезокси глюкозы: масса 2-дезоксиглюкозы после гидролиза
A 2дг. p: Среднее значение площади пика 2-дезоксиглюкозы в растворе MIX
M a. h моносахарида: масса моносахарида после гидролиза
ПРИМЕЧАНИЕ: Ангидрокоррекция составляет 0,8 для ромнозы, 0,88 для арабинозы и ксилозы и 0,9 для маннозы, глюкозы и галактозы. Масса после гидролиза = ангидрокоррекция х масса (г) моносахарида, используемого в растворе MIX. - Используйте следующую формулу для расчета массы моносахаридов.

АП. M: Область пика моносахаридов в анализируемом образце
M. IS: Добавлена масса внутреннего стандарта; здесь, C SI=1 мг/мл
AP.2: Пиковая область 2-дезоксиглюкозы в образце
RF: коэффициент отклика - Рассчитайте процентное содержание каждого моносахарида, используя следующую формулу.
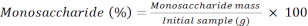
- Возьмите 400 мкл раствора из шага 6.3.2 и поместите его в специальные пробирки. Возьмите 400 мкл контрольного раствора MIX и поместите его в специальные пробирки.
7. Химические функции в экстрагированном лигнине (инфракрасный фурье-трансформированный)
- Для идентификации химических функциональных групп в экстрагированном лигнине используйте FT-IR-спектрометр, оснащенный модулем аттенуированного общего отражения (ATR). Откройте программное обеспечение для спектроскопии и настройте параметры: разрешение 4 см-1,время сканирования образца 32, время фонового сканирования 16, сохранение данных от 4000 до 400 см-1,коэффициент пропускания спектра результата.
- Не добавляйте образец; нажмите фоновый одноканальный. Теперь поместите 1 мг образца на кристалл и нажмите на образец одноканальным. Обработайте полученные спектры.
8. Молекулярная масса экстрагированного лигнина (гель-проникающая хроматография)
- Готовят раствор диметилформамида (ДМФ) с 0,5% хлоридом лития (LiCl). Возьмите 5 г LiCl в объемной колбе объемом 1 л, добавьте DMF до калибровочной линии и перемешайте содержимое до получения однородной жидкости.
- Растворить 3 мг образца лигнина в 3 мл ДМФ с 0,5% LiCl. Центрифугу в 10 мл центрифужной трубки и разделите растворимую фракцию во флакон.
- Растворить 3 мг полистирола стандарта 1 кДа, 2 кДа, 3 кДа, 10 кДа, 20 кДа и 30 кДа в растворе ДМФ с 0,5% LiCl. Центрифугу в стеклянных трубках боросиликатного по 10 мл и переложите растворимую фракцию во флакон.
- Подготовьте высокоэффективную жидкостную хроматографическо-ультрафиолетовую (УФ) систему.
- Откройте систему данных и проверьте УФ-детектор.
- Продувки системы дистиллированной водой. Установите плунжер в элюент (DMF с 0,5% LiCl). Откройте продувочный клапан и продувки линии со скоростью потока 1 мл/мин в течение 15 мин. Остановите поток и закройте продувочный клапан.
- Установите скорость потока на 1 мл/мин в течение 10 мин, чтобы очистить элюентный путь к детектору. Остановите скорость потока.
- Установите столбец, которому предшествует защитный столбец (см. Таблицу материалов). Включите нагреватель колонн при 45 °C, включите УФ-детектор и устанавливайте скорость потока постепенно, пока не будет достигнута скорость потока 0,6 мл / мин.
- Вводят по 30 мкл каждого образца в течение 40 мин на длине волны 270 нм. Обработайте полученные данные, и рассчитайте распределение масс с помощью калибровочной линии.
- Рассчитайте среднечислую молекулярную массу (Mn), среднюю молекулярную массу (Mw) и индекс полидисперсности (PDI).


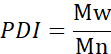
Mi: молекулярная масса цепи
Ni: количество цепей для этой молекулярной массы
9. Обработка данных и статистический анализ
- Выполняйте все аналитические эксперименты в трех количествах и выражайте результаты в % сухого вещества.
- Выполните односторонний дисперсионный анализ (ANOVA) и сравните средства, используя множественный сравнительный тест Туки.
- Выполните анализ главных компонентов (PCA).
Результаты
На фиг.2А-С показан выход лигнина при экстракции из шести видов сырья, показанный на фиг.1А-F,после комбинированной предварительной обработки микроволновой печиСОФ. Результаты показывают, что выход лигнина, полученный с ПОМОЩЬЮ DES1 (ChCl-щавелевая кислота)(Фиг.2А),был ниже, чем выходы, полученные с DES2 (ChCl-молочная кислота) и DES3 (ChCl-мочевина)(Фиг.2В,С). Кроме того, выходы лигнина из сосновых шишек (PC) и оливкового жмыха (OP) были выше на 32,31% и 26,04% для обработки DES1 и 48,72% и 43,76 для DES3, соответственно. Выход лигнина из листьев альфа (А) был значительно выше, чем выход всех других лигнинов, извлеченных с помощью DES2. Рисунок 3А-С показывает, что чистота лигнина превышала 70% для трех предварительных обработок биомасс, за исключением предварительной обработки DES3 листьев альфа (A), эгагропила (Ag) и миндальных оболочек (AS) при обработке DES3 (ChCl-мочевина), которая давала чистоту лигнина 65%. Самая высокая чистота лигнина (> 90%) получено при обработке DES1: листья альфа (А) 94%, скорлупа миндаля (АС) 93%, сосновые шишки (ПК) 90%, листья посидонии (PL) 92% и оливковый выжим (ОП) 91%.
Данные о чистоте и выходе лигнина были подвергнуты анализу главных компонентов (PCA) с учетом двух параметров (выход и чистота) и 18 обработок. Рисунок 4 показывает, что корреляционный круг объясняет 100% от общего изменения. Первый компонент, PCA1, объяснил 58,09%, а второй компонент, PCA2, объяснил 41,91% от общего изменения. Чистота лигнина положительно коррелировала с обработкой DES1 (Ox). Коэффициенты корреляции Пирсона (R) составляли альфа (A Ox) 0,32, оливковый жмых (OP Ox) 0,27, сосновые шишки (PC Ox) 0,2, листья посидонии (PL Ox) 0,35, миндальные раковины (AS Ox) 0,32 и aegagropile (Ag Ox) 0,05 соответственно. Однако обработка DES3 отрицательно коррелировала с выходом лигнина с R-значениями, которые колебались между −0,37 и −0,05. Таким образом, результаты PCA подтвердили, что лигнин, экстрагированный с помощью DES1, был самым чистым с самым низким выходом.
Лигнин характеризовался содержанием сахара, азота и золы (рисунок 5А-С). Общее содержание сахара определяли с помощью газовой хроматографии (ГК). Содержание углеводов в лигнине экстрагировалось с использованием DES3 (ChCl-мочевина) было самым высоким (6-15%). За этим последовал лигнин, экстрагированный с использованием DES2 (ChCl-молочная кислота), который имел содержание углеводов 3-12%. Однако самое низкое содержание углеводов (1%) сообщалось о лигнине, экстрагированном с использованием DES1 (ChCl-щавелевая кислота). Тип идентифицированных сахаров существенно различается(рисунок 6А-С); D-ксилоза и D-глюкоза были наиболее распространенными моносахаридами. Эти результаты показывают, что DES1 был чрезвычайно селективным в экстракции лигнина по сравнению с двумя другими DES, которые извлекли не только лигнин, но и углеводы. Другими словами, чистота лигнина была ниже после экстракции с помощью МОЛОЧНОЙ КИСЛОТЫ и МОЧЕВИНЫ.
Высокая селективность DES1 для фракционирования лигноцеллюлозной матрицы и извлечения чистого лигнина, вероятно, связана с высокой кислотностью его водородных связей (альфа = 1,3). Холин хлорид содержит ионы хлорида, которые нарушают внутримолекулярные взаимодействия водородных связей, а карбоксилатные группы в щавелевой кислоте способствуют растворении лигниновых полимеров. Аналогичным образом, содержание азота в лигнине, экстрагированном с использованием DES1, было ниже, чем содержание азота в лигнине, экстрагированном с использованием DES2 и DES3, достигая до 3%(рисунок 5A-C). Лигнин, извлеченный из листьев альфа, имел самое высокое содержание азота: 2,70, 3,84 и 3,40 для DES1, DES2 и DES3 соответственно. Эти результаты доказывают, что азотистые соединения экстрагировали и осаждали с лигнином. Кроме того, кальцинирование лигнина во всех образцах показало, что лигнин, экстрагированный с использованием DES2 и DES3, содержал более высокий неорганический компонент, чем лигнин, экстрагированный с использованием DES1.
Эти результаты показывают, что DES1 способствовал экстракции лигнина с высокой чистотой, но с низким содержанием азота, углеводов и золы. Другими словами, лигнин, экстрагированный с использованием DES1 (ChCl-щавелевая кислота), был чище, чем лигнин, экстрагированный с использованием DES2 (ChCl-молочная кислота) и DES3 (ChCl-мочевина), который обладает более низкой чистотой и высоким содержанием азота, углеводов и золы. В таблице 1 обобщено распределение молекулярной массы лигнина, проанализированное с помощью гель-проникающей хроматографии (GPC) и представленное среднечисленной молекулярной массой (Mn), средней массовой молекулярной массой (Mw) и индексом полидисперсности (PDI). Значения Mw варьировались от 48 123 до 147 233 г моль-1. Лигнин, экстрагированный DES2 из листьев альфа, миндальных оболочек и агагропила, имел более низкий PDI, чем лигнин, экстрагированный DES1, DES3 и щелочью, а также сырой лигнин. Напротив, лигнин, извлеченный DES2 из сосновых шишек, оливкового жмыха и листьев посидонии, показал более высокий PDI. Более низкая PDI лигнина, извлеченного из aegagropile, указывает на то, что его молекулярная масса более однородна, чем у лигнинов, извлеченных из других биомасс.
Химические функциональные группы, присутствующие в экстрагированном лигнине, исследовали с помощью FTIR-спектроскопии(рисунок 7A-F). Сильная широкая полоса между 3,441 и 3,198см-1 была отнесена к растягивающим колебаниям OH алкогольных и фенольных гидроксильных групп, участвующих в водородных связях. Сигналы в диапазоне волновых номеров 2,963-2,852см-1 были отнесены к алкильным C-H растягивающим колебаниям. Оливковый выжим, листья альфа и миндальные раковины показали более интенсивные полосы, чем другие биомассы. Полос от 2 800 до 1 800 см-1не наблюдалось. Лигнин, полученный методом обработки DES1 и DES2, имел восходящую полосу при 1,708см-1,что указывало на наличие неконъюгированных групп C=O. Однако этот сигнал отсутствовал в спектрах растворителей(рисунок 8В). Спектры молочной и щавелевой кислот характеризовались полосой в диапазоне 1,737-1,723см-1, что указывало на наличие неконъюгированных групп C=O, тогда как спектр мочевины характеризовался двумя сигналами в диапазоне волновых числа 1,660см-1 и 1,604см-1, приписываемыми амидным группам. Полосы в 1,606-1,618см-1 наблюдались в лигнине, экстрагированном обработкой DES1 и DES2, связанном с кольце-конъюгированным растяжением C = C.
Сигнал при 1,640см-1 в лигнине, извлеченном DES3, указывал на наличие вибрации растяжения C=O в сопряженных карбонильных группах лигнина. Сигнал на 1516см-1 возник из колебаний ароматических колец, присутствующих в лигнине, в то время как полоса в 1200 см-1 указывала на наличие эфирных групп. Полосам в диапазоне волнового числа 1,250-1,200см-1 было присвоено растяжение C-O неароматических спиртов. Полоса при 953см-1 была отнесена к метиловым заместителем. Результаты показывают, что спектры фракций DES-лигнина показали сигналы при 1,730-1,702см-1 и 1,643-1,635см-1,назначенные растягивающей вибрации неконъюгированных и сопряженных карбонильных групп соответственно. Однако эти диапазоны диапазонов отсутствовали в трех коммерческих лигнинах: сырых, обработанных содой и лигнинах, экстрагированных щелочью(рисунок 8А). Это наблюдение свидетельствует о том, что при его экстракции и солюбилизации некоторые функциональные группы лигнина были сопряжены с щавелевой и молочной кислотами.

Рисунок 1:Изучены средиземноморские биомассы. (A) Миндальные раковины, (B) Оливковые выжимки, (C) Конусные сосны, (D) Aegagropile (шарики Posidonia), (E) Листья Posidonia, (F) Листья альфа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Выход лигнина. (A)Холин хлорид + Щавелевая кислота (DES1),(B)Холин хлорид + Молочная кислота (DES2),(C)Холин хлорид + Мочевина (DES3). Значительные различия были определены с односторонним ANOVA и пост-специальным тестом Фишера (*P < 0,05; **P < 0,01; ***P < 0,001). Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; ns = незначимый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
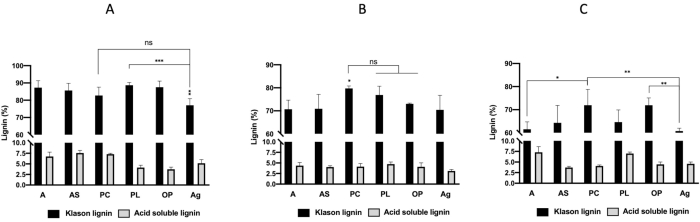
Рисунок 3:Лигнин (%). (A)Холин хлорид + Щавелевая кислота (DES1),(B)Холин хлорид + Молочная кислота (DES2),(C)Холин хлорид + Мочевина (DES3). Значительные различия были определены с односторонним ANOVA и пост-специальным тестом Фишера (*P < 0,05; **P < 0,01; ***P < 0,001). Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; ns = незначимый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4:Анализ основных компонентов выхода и чистоты лигнина, извлеченного из средиземноморских биомасс. Акцептор водородных связей (HBA) представляет собой холинхлорид (ChCl), а доноры водородной связи (HBD) - Ox = щавелевая кислота, Lac : молочная кислота и мочевина. PCA = анализ главных компонентов; A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5:Углеводы (%), азот (%) и зольность (%) в образцах лигнина. (A)Холин хлорид + Щавелевая кислота (DES1),(B)Холин хлорид + Молочная кислота (DES2),(C)Холин хлорид + Мочевина (DES3). Значительные различия были определены с односторонним ANOVA и пост-специальным тестом Фишера (*P < 0,05; **P < 0,01; ***P < 0,001). Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; ns = незначимый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6:Идентификация моносахаридов в образцах лигнина (%). (A)Холин хлорид + Щавелевая кислота (DES1),(B)Холин хлорид + Молочная кислота (DES2),(C)Холин хлорид + Мочевина (DES3). Значительные различия были определены с односторонним ANOVA и пост-специальным тестом Фишера (*P < 0,05; **P < 0,01; ***P < 0,001). Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; ns = незначимый. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 7:Инфракрасные спектры с преобразованием Фурье образцов лигнина. (A) Листья альфа, (B) Миндальные раковины, (C) Сосновые шишки, (D) Листья посидонии, (E) Оливковый жмых, (F) Aegagropile. Сокращения: DES1 = холинхлорид + щавелевая кислота, DES2 = холин хлорид + молочная кислота, DES3 = холинхлорид + мочевина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 8:Инфракрасные спектры с преобразованием Фурье. (A) Лигнин контролирует, (B) доноры водородных связей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| образец | лечение | Мн | Мвт | PDI |
| ля | мочевина | 47558 | 120141 | 2.5 |
| природный лак | 35241 | 73665 | 2.1 | |
| бык | 35793 | 84312 | 2.4 | |
| как | мочевина | 50181 | 105817 | 2.1 |
| природный лак | 60409 | 104915 | 1.7 | |
| бык | 83112 | 147233 | 1.8 | |
| ПК | мочевина | 34013 | 65181 | 1.9 |
| природный лак | 55513 | 145963 | 2.6 | |
| бык | 46409 | 102298 | 2.2 | |
| ПЛ | мочевина | 25696 | 50093 | 1.9 |
| природный лак | 45530 | 122900 | 2.7 | |
| бык | 28427 | 70726 | 2.5 | |
| ОП | мочевина | 29669 | 70424 | 2.4 |
| природный лак | 26735 | 66743 | 2.5 | |
| бык | 34161 | 75509 | 2.2 | |
| Аг | мочевина | 30184 | 48123 | 1.6 |
| природный лак | 33835 | 52123 | 1.5 | |
| бык | 30025 | 49808 | 1.7 | |
| контроль | Лигнин сырой | 23275.3 | 36496.5 | 1.6 |
| Лигнин, экстрагированный щелочью | 22792.6 | 43014.3 | 1.9 |
Таблица 1: Молекулярные массы лигнинов. Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; Mn = среднечислую молекулярную массу; Mw = усредненная по весу молекулярная масса; PDI = индекс полидисперсности; Ox = щавелевая кислота; Lac = молочная кислота.
Рисунок S1: Лигнин. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S2: Образцы после автоклава (30 мг лигнина + 1 мл 72% серной кислоты + 28 мл дистиллированной воды). Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S3: Гранулы лигнина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S4: Твердый остаток промыт четыре раза для восстановления максимального содержания лигнина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S5: Гель-проникающая хроматограмма контроля лигнина, сырых и щелочно-экстрагированных лигнинов. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S6: Гель-проникающих хроматограмм образцов лигнина. Сокращения: A = листья альфа, AS = миндальные раковины, PC = сосновые шишки, PL = листья посидонии, OP = оливковый выжим, Ag = Aegagropile; DES1 = холинхлорид + щавелевая кислота, DES2 = холинхлорид + молочная кислота, DES3 = холинхлорид + мочевина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Рисунок S7: Технологическая схема процесса глубокого эвтектического растворителя (DES)-микроволнового процесса экстракции лигнина. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Это исследование имело много целей; первым из которых было приготовление и использование недорогих зеленых растворителей с характеристиками как ионных жидкостей, так и органических растворителей. Вторая цель состояла в том, чтобы фракционировать биомассу и экстрагировать лигнин за один этап, не требуя предварительных этапов, таких как экстракция экстрагируемых веществ с использованием Soxhlet или гемицеллюлозы с использованием щелочных растворителей, основных или теплофизических методов. Третья цель состояла в том, чтобы восстановить лигнин путем простой фильтрации после обработки, без корректировки рН, а просто путем добавления дистиллированной воды. Результаты сверхбыстрой экстракции лигнина из шести различных источников с использованием микроволнового процесса на основе DES с использованием трех различных DES показывают, что выход экстракции может варьироваться в зависимости от биомассы и природы DES. Например, самый высокий выход извлечения лигнина среди всех трех DES был из оливкового жмыха. За этим последовали урожаи листьев альфа, сосновых шишек и миндальных раковин. Урожайность экстракта была ниже для листьев и шаров Posidonia oceanica.
Чистоту лигнина оценивали с использованием методов Класона, Кьельдаля (азота), углеводов (ГК) и золы. Как показано на фиг.3 и фиг.5А-С,чистота лигнина снижалась из-за совместного осаждения азотных, углеводных и зольных компонентов с лигнином. Условия экстракции лигнина с помощью DES1 обеспечили высокую чистоту, но низкий выход, что указывает на то, что для положительной корреляции между выходом и чистотой лигнина необходимы улучшения процесса. Выход лигнина может быть улучшен, если продолжительность обработки больше, мощность микроволновой печи увеличена с 800 Вт до 1200 Вт или уменьшено соотношение твердое вещество:растворитель (1:10). Данные о молекулярной массе лигнина дают представление о диссоциации или реполимеризации фрагментов лигнина после лечения. Увеличение Mw лигнина для биомасс наблюдалось после экстракции с использованием микроволновой ДЭС, как это видно, например, в случае листьев посидонии (Mw составляет 50093 для DES3 и 70726 для DES1), что свидетельствует о том, что деполимеризация происходила во время экстракции лигнина и сопровождалась быстрой реполимеризацией углеродно-углеродного интеръединичения под действием DES. Для этого требуется использование агента захвата, такого как формальдегид, для стабилизации развертывания.
При предварительной обработке DES диссоциация лигнина и конденсация являются двумя конкурирующими реакциями. PDI экстрагированных лигнинов ниже, чем у букового лигнина, экстрагированногоорганическими растворителями (этанол/вода/H2 SO4),о котором сообщается в литературе17. Это указывает на то, что обработка DES улучшает однородность молекулярной массы в лигнине по сравнению с обработкой органическими растворителями. Спектры FTIR указывают на то, что функциональные группы лигнина находятся под влиянием используемого растворителя DES. Спектры показывают сигналы при 1,730-1,702см-1, присвоенные растягивающей вибрации неконъюгированных карбонильных групп, тогда как пики при 1,643-1,635см-1 указывают на вибрацию растяжения сопряженных карбонильных групп. Эти результаты демонстрируют возможность извлечения лигнина с добавленной стоимостью высокой чистоты из средиземноморских биомасс (который в настоящее время недооценен и используется либо в качестве корма, либо в качестве почвенной поправки) и могут помочь определить оптимальный растворитель DES при обеспечении чистоты лигнина. Например, DES1 продемонстрировал чистейшую экстракцию лигнина, хотя и с более низким выходом, чем тот, который наблюдался с использованием двух других DES.
Предложенный способ может быть легко применен благодаря недорогой и зеленой ChCl-щавелевой кислоте глубокой эвтектической растворительной системы. Холин хлорид представляет собой органическую соль, а щавелевая кислота доступна в качестве натурального продукта растений, которые в изобилии отличаются низкой стоимостью. Этот метод (сверхбыстрый протокол, который в один этап обеспечивает фракционирование биомассы и извлечение лигнина высокой чистоты) применим к любому типу лигноцеллюлозной биомассы, которая имеет химический состав, аналогичный тому, который изучается здесь в лабораторных масштабах с использованием процесса микроволновой печи DES или в пилотном масштабе с использованием процесса DES-ультразвука или конвекционного нагрева.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов.
Благодарности
МК и ТБ благодарят Хайтама Айеба за статистический анализ и подготовку цифр, Валлонский регион (Европейское региональное развитие - VERDIR) и министра высшего образования и научных исследований (Тауфик Беттайеб) за финансирование.
Материалы
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Ссылки
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132(2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, Š, Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790(2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131(2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85(2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены