Method Article
Extração de Lignina ultrarrápida de resíduos lignocelúsicos incomuns do Mediterrâneo
Neste Artigo
Resumo
O pré-tratamento assistido por solventes eutéticos profundos é um processo verde, rápido e eficiente para fracionamento lignocelúsico e recuperação de lignina de alta pureza.
Resumo
O pré-tratamento ainda é o passo mais caro nos processos biorredistreiristas lignocelulósicos. Deve ser rentável minimizando os requisitos químicos, bem como o consumo de energia e calor e usando solventes favoráveis ao meio ambiente. Os solventes eutéticos profundos (DESs) são solventes-chave, verdes e de baixo custo em biorefinaries sustentáveis. São misturas transparentes caracterizadas por baixos pontos de congelamento resultantes de pelo menos um doador de ligação de hidrogênio e um aceitador de ligação de hidrogênio. Embora os DESs sejam solventes promissores, é necessário combiná-los com uma tecnologia de aquecimento econômico, como a irradiação de micro-ondas, para rentabilidade competitiva. A irradiação de micro-ondas é uma estratégia promissora para encurtar o tempo de aquecimento e aumentar o fracionamento porque pode atingir rapidamente a temperatura apropriada. O objetivo deste estudo foi desenvolver um método rápido de um passo para fracionamento de biomassa e extração de lignina utilizando um solvente de baixo custo e biodegradável.
Neste estudo, foi realizado um pré-tratamento de DES assistido por micro-ondas para 60 s a 800 W, utilizando três tipos de DESs. As misturas DES foram preparadas ácilmente a partir do cloreto de colina (CÍN) e três doadores de ligação de hidrogênio (HBDs): um ácido monocarboxílico (ácido láctico), um ácido dicarboxílico (ácido oxálico) e ureia. Este pré-tratamento foi utilizado para fração de biomassa e recuperação de lignina de resíduos marinhos (folhas de Posidonia e aegagropile), subprodutos agroalimentares (cascas de amêndoas e pomace de oliva), resíduos florestais (pincéis) e gramíneas lignocelulósica perenes(Stipa tenacisima). Foram realizadas análises adicionais para determinar o rendimento, pureza e distribuição de peso molecular da lignina recuperada. Além disso, o efeito dos DESs nos grupos químicos funcionais na lignina extraída foi determinado pela espectroscopia infravermelha de transformação de Fourier (FTIR). Os resultados indicam que a mistura de ácido CHI-oxálico proporciona a maior pureza da lignina e o menor rendimento. O presente estudo demonstra que o processo DES-microondas é uma tecnologia ultrarrápida, eficiente e econômica para fracionamento de biomassa lignocelúsica.
Introdução
Processos biorredistrais sustentáveis integram o processamento de biomassa, seu fracionamento em moléculas de interesse e sua conversão para produtos de valor agregado1. Na biorefinação de segunda geração, o pré-tratamento é considerado essencial para fracionar a biomassa em seus principais componentes2. Os métodos tradicionais de pré-tratamento utilizando estratégias químicas, físicas ou biológicas têm sido amplamente aplicados3. No entanto, esse pré-tratamento é considerado o passo mais caro na biorefinação e tem outras desvantagens, como tempo de processamento longo, alto consumo de calor e energia e impurezassolventes 4. Recentemente, o DESs, cujas propriedades são semelhantes às dos líquidos iônicos3,surgiram como solventes verdes devido a vantagens como biodegradabilidade, simpatia ambiental, facilidade de síntese e recuperação após o tratamento5.
DESs são misturas de pelo menos um HBD, como ácido láctico, ácido málico ou ácido oxálico, e um aceitador de ligação de hidrogênio (HBA) como betaine ou cloreto de colina (Cínamo)6. As interações HBA-HBD permitem um mecanismo catalítico que permite o decote de ligações químicas, causando fracionamento de biomassa e separação de lignina. Muitos pesquisadores relataram o pré-tratamento baseado no DES de matérias-primas lignocelulósicas, como o ChCl-gliceol na espiga do milho e stover7,8, ChCl-urea, e ácido ChCl-oxálico na palha de trigo9, ácido cítico em serragem de eucalipto 10, e ácido acético chcl11 e glicol de etileno chcl na madeira11. Para melhorar a eficiência do DES, o pré-tratamento deve ser combinado com o tratamento de micro-ondas para acelerar o fracionamento de biomassa5. Muitos pesquisadores relataram tal pré-tratamento combinado (DES e micro-ondas) de madeira8 e de milho stover, switchgrass e Miscanthus5, o que fornece uma nova visão sobre a capacidade de DESs para fracionamento lignocelúsico e extração de lignina em um passo fácil durante um curto período.
A lignina é uma macromolécula fenólica valorizada como matéria-prima para a produção de biopolímeros e apresenta uma alternativa para a produção de produtos químicos como monômeros aromáticos e oligômeros12. Além disso, a lignina possui atividades antioxidantes e de absorção ultravioleta13. Vários estudos relataram aplicações de lignina em produtos cosméticos14,15. Sua integração em produtos de protetor solar comercial melhorou o fator de proteção solar (FPS) do produto de SPF 15 a SPF 30 com a adição de apenas 2 wt % de lignina e até SPF 50 com a adição de 10 wt % lignina16. Este artigo descreve uma abordagem ultrarrápida para o decote lignina-carboidrato, auxiliada pelo pré-tratamento combinado DES-microondas da biomassa mediterrânea. Estas biomassa consistem em subprodutos agroalimentares, particularmente pomace de oliva e cascas de amêndoas. Outras biomassas investigadas foram as de origem marinha (folhas de Posidonia e aegagropile) e aquelas originárias de uma floresta (pinheiros e gramíneas silvestres). O foco deste estudo foi testar solventes verdes de baixo custo para avaliar os efeitos deste pré-tratamento combinado no fracionamento de matérias-primas, investigar sua influência na pureza e rendimento da lignina, e estudar seus efeitos sobre os pesos moleculares e grupos químicos funcionais na lignina extraída.
Protocolo
1. Preparação da biomassa
- Secagem de biomassa
- Coloque as folhas de Posidonia e as bolas de aegagropile(Posidonia oceânica),colhidas das praias do Mediterrâneo, em forno a 40 °C por 72 h.
- Coloque as cascas de amêndoas(Prunus dulcis),geradas a partir de indústrias alimentícias, e pomace de oliva(Olea europaea L.), obtidas de moinhos de azeite, em forno a 40 °C por 72 h.
- Coloque os pinheiros (Pinus halepensis), coletados de uma floresta, e as folhas alfa(Stipa tenacissima), coletadasda bacia do Mediterrâneo sul, em forno a 40 °C por 72 h.
NOTA: Se a biomassa contiver areia, deve ser enxaguada com água destilada antes de ser colocada no forno. A biomassa é mostrada na Figura 1A-F.
- Moagem de biomassa
- Coloque 20 g de cada biomassa em um cortador de martelo equipado com uma peneira de 1 mm. Colete o pó resultante em um béquer de 0,25 L e alimente-o a um cortador de martelo equipado com uma peneira de 0,5 mm. Colete o pó em um béquer de 0,25 L.
2. Extração de lignina ultrarrápida assistida por micro-ondas
- Preparação de solvente eutético profundo (DES)
- Prepare o DES1 (ácido oxalic) em uma razão molar de 1:1 misturando 174 g de ChCl com 126 g de dihidrato de ácido oxálico em um frasco de fundo redondo de 500 mL e derretendo-os em um banho a 70 °C por 4h até formar um líquido homogêneo e transparente.
- Prepare o DES2 (ácido cântico chcl) em uma razão molar de 1:1 misturando 174 g de ChCl com 90 g de ácido láctico em um frasco de fundo redondo de 500 mL e derretendo-os em um banho a 70 °C por 4h até formar um líquido homogêneo e transparente.
- Prepare o DES3 (ChCl-ure) em uma relação molar de 1:12 misturando 174 g de ChCl com 120 g de ureia em um frasco de fundo redondo de 500 mL e derretendo-os em um banho a 70 °C por 4h até formar um líquido homogêneo e transparente.
NOTA: Mexa essas misturas continuamente com uma barra de mexida a 500 rpm.
- Tratamento combinado microondas-DES
- Coloque 5 g da matéria-prima em um micro-ondas em um reator de politetrafluoroetileno fechado. Adicione 50 mL de DES e coloque uma barra de agitação na amostra. Feche o recipiente de micro-ondas com uma tampa apropriada e conecte a tampa de temperatura.
- Coloque o recipiente de micro-ondas na borda do toca-discos, garantindo que ele esteja constantemente agitado. Coloque a energia do micro-ondas em 800 W por 1 min. Usando luvas adequadas, tire o recipiente do micro-ondas e deixe a mistura esfriar. Repita este tratamento utilizando os três DESs para cada amostra de biomassa.
NOTA: Verifique e certifique-se de que a sonda de temperatura está corretamente colocada, e o recipiente de micro-ondas tem uma temperatura homogênea.
- Isolamento da Lignina
- Prepare uma solução antisolvente homogênea misturando etanol:água em uma relação 50:50 (v:v). Adicione 50 mL da solução antisolvente à matéria-prima tratada, coloque a mistura em um recipiente de centrifugação (250 mL) e centrífuga por 5 min a 3.000 × g.
- Após a centrifugação, filtre a supernascer (fração rica em lignina) usando um cadinho de filtro de vidro (porosidade 4, 10-16 μm, diâmetro 10 mm). Lave o resíduo de celulose restante coletado após a centrifugação com 25 mL da solução antisolvente.
- Centrifugar a 3.000 × g por 5 minutos após cada lavagem. Repita lava 4x, e colete e filtre as lavagens através do cadinho do filtro de vidro (porosidade N 4, 10-16 μm, diâmetro 10 mm).
- Adicione a fração filtrada rica em lignina do passo 2.3.2 às lavagens filtradas da etapa 2.3.3 em um frasco fundo redondo de 500 mL. Evaporar etanol usando um evaporador rotativo a 50 °C e 110 mbar.
- Adicione 150 mL de água deionizada ao licor concentrado (fração rica em lignina), e precipitar a lignina por centrifugação. Coletar lignina como uma pelota, e lavá-la com 25 mL de água destilada; repetir as lavagens 4x. Lyophilize a lignina ou seque-a em um forno a 40 °C.
NOTA: Se necessário, lave a lignina >4x para remover os sais dos solventes. - Use a seguinte fórmula para determinar o rendimento:

NOTA: A extração de lignina também foi realizada com dois outros DESs: cloreto de colina + cloreto de colina e cloreto de colina + ácido butírico a 1 min. No entanto, as quantidades de lignina recuperadas utilizando esses DESs foram extremamente pequenas (e irrecuperáveis) em comparação com os valores obtidos utilizando os outros três DESs.
3. Determinação de pureza da lignina extraída por Klason
- Preparação amostral para hidrólise de Klason
- Coloque o cadinho do filtro (porosidade 4, diâmetro 4,5 mm) em um forno de muffle a 550 °C por 4h (rampa de 2h, a partir de 25°C). Retire o cadinho quando o forno esfriar a 150 °C, coloque-o em um desiccador para esfriar e pese.
- Adicione aproximadamente 30 mg de lignina em um tubo de vidro borossilicato (veja a Tabela de Materiais),e observe o peso da amostra. Adicione 1 mL de ácido sulfúrico de 72% (H2SO4) à amostra, coloque a amostra em um banho de 30 °C por 60 minutos e misture a cada 10 minutos por vórtice.
- Retire a amostra, transfira para uma garrafa de vidro de 100 mL e adicione 28 mL de água destilada para diluir o ácido a uma concentração de 4%. Coloque a garrafa de vidro em uma autoclave a 121 °C por 60 min. Retire a garrafa de vidro e deixe esfriar.
- Análise da lignina ácido-insolúvel
- Filtre o hidrolise usando um cadinho sob vácuo. Colete todos os sólidos em uma garrafa de vidro contendo água deionizada. Enxágüe o cadinho com 50 mL de água deionizada.
- Seque o cadinho contendo os sólidos colocando-o em um forno a 105 °C por 16 h. Retire o cadinho do forno, coloque-o em um desiccador e deixe esfriar. Pesar a amostra.
- Coloque o cadinho em um forno de abafa a 550 °C para 4h (rampa de 2h). Remova-o e coloque em um desiccador. Pesar a amostra.
- Use a seguinte fórmula para calcular a porcentagem do resíduo ácido-insolúvel (AR):

WCSA: peso do cadinho + amostra depois de removê-los do forno
WC: peso do cadinho
WCSMF: peso do cadinho depois de removê-lo do forno de muffle
ODW: peso seco do forno da amostra
- Análise da lignina solúvel em ácido
- Meça a absorvância do filtrado obtido na etapa 3.2.1 com um espectrofotômetro a 205 nm usando cuvetas de quartzo. Use água destilada em branco.
- Use a seguinte fórmula para calcular a porcentagem do resíduo solúvel ácido (ASL):
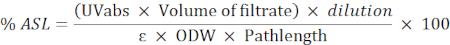
NOTA: A absorvância deve ser entre 0,2 e 0,7. Diluir a amostra, se necessário.
UVabs: absorção a 205 nm
Comprimento do caminho: caminho de luz da célula de medição (em cm)
ε: absorção de biomassa em um comprimento de onda específico
4. Teor de nitrogênio na lignina extraída
- Preparação da solução alcalina
- Em um frasco volumoso de 2,5 L, pese 1 kg de hidróxido de sódio (NaOH) e adicione água deionizada até a marca. Coloque uma barra magnética no frasco e mexa até que o NaOH esteja completamente dissolvido.
- Preparação de solução de ácido sulfúrico
- Pegue 0,1 N H2SO4 (veja a Tabela de Materiais) em um frasco volumoso de 5 L, adicione água deionizada até a marca de 5 L, coloque uma barra magnética e mexa até que o conteúdo se dissolva.
- Preparação de solução de recebimento
- Em um frasco volumoso de 5 L, dissolva 100 g de H3BO3 (ácido bórico) em água desionizada, e eleva o volume até a marca.
- Pesar 100 mg de verde bromocresol em um frasco volumoso de 100 mL, e adicionar metanol técnico até a marca.
- Pesar 100 mg de vermelho metil em um frasco volumoso de 100 mL e adicionar metanol técnico até a marca.
- Despeje a solução 5 L de H3BO3 da etapa 4.3.1, 100 mL de solução verde bromocresol a partir da etapa 4.3.2, 70 mL da solução vermelha metil da etapa 4.3.3, e 5 L de água desionizada em um recipiente. Agite bem a solução receptora por 30 minutos.
NOTA: A cor final da solução deve ser verde. Se a cor não for verde, adicione 50 mL de solução 1 N NaOH.
- Preparação da amostra
- Em um tubo de Kjeldahl, coloque 100 mg de lignina pesado em um papel sem nitrogênio, adicionar um comprimido de Kjeldhal (1,5 g sulfato de potássio (K2SO4) + 0,045 g de sulfato de cobre pentahidrate (CuSO4.5H2O) + 0,045 g de dióxido de titânio (TiO2)), e adicionar 7,2 mL de concentrado H2SO4.
NOTA: Utilize quatro tubos com apenas papel sem nitrogênio (sem as amostras) como espaços em branco.
- Em um tubo de Kjeldahl, coloque 100 mg de lignina pesado em um papel sem nitrogênio, adicionar um comprimido de Kjeldhal (1,5 g sulfato de potássio (K2SO4) + 0,045 g de sulfato de cobre pentahidrate (CuSO4.5H2O) + 0,045 g de dióxido de titânio (TiO2)), e adicionar 7,2 mL de concentrado H2SO4.
- Digestão amostral
- Ligue o termostato no digestor com 1h de antecedência a 360 °C.
- Coloque os tubos de amostra em um rack, coloque os quatro tubos em branco nos quatro cantos do rack e preencha os orifícios (se houver) do rack com tubos vazios.
- Coloque o rack no digestor pré-aquecido, cubra o sistema de sucção e abra a bomba de água.
NOTA: Tome cuidado para evitar vapores; aumentar o fluxo de água se a fumaça aparecer. - Depois de 2h, desligue o aquecimento, remova as amostras e coloque-as em um suporte metálico. Deixe o rack esfriar por aproximadamente 40 minutos com o sistema de sucção ligado.
- Procedimento de destilação de Kjeldhal
- Ligue o destilador Kjeldahl. Permita que os autotestes sejam executados até que a seleção apareça na tela. Mude para o modo Manual, insira um tubo vazio e feche a porta de correr.
- Purgue a burette titrant (0,02 N H2SO4) (levante a tampa) pressionando-a na parte inferior e superior várias vezes, e elimine as bolhas de ar dos tubos apertando o tubo da garrafa H2SO4. Feche o capô.
- Purgue a solução de recebimento H3BO3 3x.
- Adicione água 3x e mude para vapor ativo (10 min). Mude para o programa de análise Kjeldahl 1. Digite Blanco usando as setas no nível da linha Resultado.
- Insira o tubo. Comece com os quatro espaços em branco, e calcule suas médias. Digite o valor na linha Blanco.
NOTA: Após a inserção do tubo, o dispositivo adiciona automaticamente e sucessivamente 30 mL de H2O, 30 mL de H3BO3e 40 mL de 10 N NaOH. - Mude para mL de titulante na linha de resultado. Insira o tubo e observe a quantidade de H2SO4 utilizada.
NOTA: Para testar o destilador Kjeldahl, considere que 50 mg de glicerina correspondem a 18,60% ± 5% de % N. No final de cada titulação, o dispositivo esvazia e limpa automaticamente o tubo. - Calcule a porcentagem de N.

V s.a : Volume de ácido sulfúrico
T s.a : 0.02 N H2SO4
S: massa amostral
5. Conteúdo de cinzas em lignina extraída
- Seque os cadinhos de cerâmica por 1h a 105 °C. Deixe-os esfriar em um desiccator.
- Pesar um cadinho, e anotar seu número. Adicione aproximadamente 1 g do pó da amostra. Coloque o cadinho no forno de abafa com o seguinte programa: uma rampa de 2h até 575 °C; um platô de 4h a 575 °C.
- Deixe o forno esfriar a 100 °C. Remova os cadinhos, coloque-os no desiccador e pese-os.
6. Teor de carboidratos
- Preparação da solução de boroidride de sódio (NaBH4)/dimetilsulfoxida (DMSO)
- Coloque 2 g de NaBH4 em um frasco volumoso de 100 mL e preencha a marca com DMSO. Aqueça a 100 °C no banho de um prefeito, e mexa a solução até dissolver completamente.
- Preparação da solução MIX
- Coloque 20 mg cada de xilose, arabinose, rhamnose, glicose, galactose, manose e 2-desoxicosglucose em um frasco volumoso de 100 mL, e encha até a marca de 100 mL com água desocionalizada.
- Hidrólise da amostra
- Pesar uma amostra de 50 mg de lignina em um tubo de vidro borossilicato, adicionar 3 mL de 1 M H2SO4e aquecer a mistura por 3 h a 100 °C.
- Esfrie a amostra, adicione 1 mL de hidróxido de amônio de 15 M (NH4OH), e verifique o pH para garantir que ele seja neutro ou alcalino. Adicione exatamente 1 mL de padrão interno (2-desoxicos) a cada amostra.
NOTA: A 2-desoxicose adicionada como padrão interno permite quantificar a quantidade de cada dose presente na amostra.
- Redução e acetilação de monossacarídeos em acetato alditol
- Pegue 400 μL da solução a partir da etapa 6.3.2, e coloque-a em tubos especiais. Pegue 400 μL da solução MIX de controle e coloque-a em tubos especiais.
NOTA: O uso da solução MIX facilita o cálculo dos percentuais de fatores de resposta (RFs) e monossacarídeos. - Adicione 2 mL da solução NaBH4/DMSO preparada na seção 6.1. Feche o tubo e incubar por 90 min a 40 °C em um banho de água. Retire o tubo do banho de água e adicione 0,6 mL de ácido acético glacial.
NOTA: Como se trata de uma reação extermérmica, bolhas e fumaça aparecerão. - Adicione aproximadamente 0,4 mL de 1-metilimidazol e aproximadamente 4 mL de anidrido acético. Depois de 15 min, adicione 10 mL de água destilada, esfrie e adicione ~3 mL de diclorometano (CH2Cl2).
- Após pelo menos 2 h, colete ~1 mL da fase inferior (orgânica) e injete-o em um cromatógrafo gasoso equipado com uma coluna capilar do detector de ionização de chamas, HP1-metilsiloxano (30 m (comprimento) x 320 μm (diâmetro interno), 0,25 μm (espessura da película)). Analise os dados.
- Use a seguinte fórmula para calcular o fator de resposta (RF).
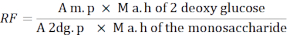
A m. p: Média da área do pico de monossacarídeo na solução MIX
M a. h de 2 - glicose desoxi: Massa de 2-desoxicosglucose após hidrólise
Um 2dg. p: Média da área do pico de 2 desoglucose na solução MIX
M a. h do monossacarídeo: Massa do monossacarídeo após hidrólise
NOTA: A correção de anhydro é de 0,8 para rhamnose, 0,88 para arabinose e xilose, e 0,9 para manejador, glicose e galactose. Massa após hidrólise = correção de anídro x massa (g) do monossacarídeo utilizado na solução MIX. - Use a seguinte fórmula para calcular a massa de monossacarídeo.

Ap. M: Área de pico de monossacarídeo na amostra analisada
M. IS: Massa de padrão interno adicionada; aqui, C SI=1 mg/mL
AP.2: Área de pico de 2-desoxicosglucose na amostra
RF: fator de resposta - Calcule a porcentagem de cada monossacarídeo usando a seguinte fórmula.
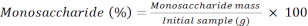
- Pegue 400 μL da solução a partir da etapa 6.3.2, e coloque-a em tubos especiais. Pegue 400 μL da solução MIX de controle e coloque-a em tubos especiais.
7. Funções químicas na lignina extraída (infravermelho transformado em Fourier)
- Para identificar os grupos funcionais químicos na lignina extraída, utilize um espectrômetro FT-IR equipado com um módulo atenuado de reflexão total (ATR). Abra o software de espectroscopia e ajuste os parâmetros: resolução 4 cm-1, tempo de varredura da amostra 32, tempo de varredura de fundo 16, salve dados de 4000 a 400 cm-1, transmissão de espectro de resultado.
- Não adicione nenhuma amostra; pressione fundo único canal. Agora coloque 1 mg da amostra no cristal, e pressione a amostra de um único canal. Processe o espectro obtido.
8. Peso molecular da lignina extraída (cromatografia de permeação de gel)
- Prepare uma solução de dimetilformamida (DMF) com cloreto de lítio de 0,5% (LiCl). Pegue 5 g de LiCl em um frasco volumoso de 1 L, adicione DMF até a linha de bitola e misture o conteúdo até que um líquido homogêneo seja obtido.
- Dissolva 3 mg da amostra de lignina em 3 mL de DMF com 0,5% de LiCl. Centrifugar em um tubo de centrífuga de 10 mL, e separar a fração solúvel em um frasco.
- Dissolva 3 mg de poliestireno padrão 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa e 30 kDa na solução de DMF com 0,5% de LiCl. Centrifugar em tubos de vidro borossilicato de 10 mL e transferir a fração solúvel para um frasco.
- Prepare um sistema de cromatografia líquida-ultravioleta líquida de alto desempenho (UV).
- Abra o sistema de dados e verifique o detector UV.
- Purgue o sistema com água destilada. Instale o êmbolo no eluent (DMF com 0,5% de LiCl). Abra a válvula de purga e purgue a linha com uma taxa de fluxo de 1 mL/min por 15 min. Pare o fluxo e feche a válvula de purga.
- Defina a vazão para 1 mL/min por 10 minutos para limpar a via eluente até o detector. Pare a vazão.
- Instale a coluna precedida por uma coluna de guarda (veja a Tabela de Materiais). Ligue o aquecedor da coluna a 45 °C, ligue o detector UV e defina a vazão gradualmente até que uma vazão de 0,6 mL/min seja atingida.
- Injete 30 μL de cada amostra por 40 minutos a um comprimento de onda de 270 nm. Processe os dados obtidos e calcule a distribuição em massa usando a linha de calibração.
- Calcular o número de peso molecular médio (Mn), peso molecular médio de peso médio (Mw) e índice de polidispersidade (IDP).


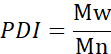
Mi: peso molecular de uma cadeia
Ni: número de cadeias para esse peso molecular
9. Tratamento de dados e análises estatísticas
- Realize todos os experimentos analíticos em triplicado e expresse os resultados como % de matéria seca.
- Realize uma análise unidirecional de variância (ANOVA) e compare os meios usando o teste de comparação múltipla de Tukey.
- Realize a análise dos componentes principais (PCA) .
Resultados
Figura 2A-C retratam o rendimento da lignina de extração das seis matérias-primas, mostrada na Figura 1A-F, após o pré-tratamento combinado microondas-DES. Os resultados mostram que o rendimento da lignina obtido com o DES1 (ácido TC-oxálico) (Figura 2A) foi inferior aos rendimentos obtidos com DES2 (ácido cótico) e DES3 (ChCl-ureia)(Figura 2B,C). Além disso, os rendimentos de lignina provenientes de pinheiros (PC) e pomace de oliva (OP) foram elevados em 32,31% e 26,04% para o tratamento DES1 e 48,72% e 43,76 para o DES3, respectivamente. O rendimento da lignina das folhas alfa (A) foi significativamente maior do que os rendimentos de todas as outras ligninas extraídas com DES2. Figura 3A-C mostram que a pureza da lignina excedeu 70% para os três pré-tratamentos da biomassa, com exceção do pré-tratamento DES3 de folhas alfa (A), aegagropile (Ag) e cascas de amêndoas (AS) no tratamento DES3 (ChCl-urea), que deu uma pureninidade lignlig de 65%. A maior pureza da lignina (> 90%) foram obtidas com o tratamento DES1: folhas alfa (A) 94%, cascas de amêndoas (AS) 93%, pinheiros (PC) 90%, folhas de Posidonia (PL) 92% e pomace de oliva (OP) 91%.
Os dados de pureza e rendimento da lignina foram submetidos à análise de componentes principais (PCA) considerando dois parâmetros (rendimento e pureza) e 18 tratamentos. A Figura 4 mostra que o círculo de correlação explicou 100% da variação total. O primeiro componente, PCA1, explicou 58,09%, e o segundo componente, PCA2, explicou 41,91% da variação total. A pureza da lignina foi positivamente correlacionada com o tratamento DES1 (Ox). Os coeficientes de correlação de Pearson (R) foram alfa (A Ox) 0,32, pomace de oliva (OP Ox) 0,27, pinecones (PC Ox) 0,2, folhas de Posidonia (PL Boi) 0,35, cascas de amêndoas (AS Ox) 0,32 e aegagropile (Ag Ox) 0,05, respectivamente. No entanto, o tratamento DES3 foi negativamente correlacionado com o rendimento da lignina com valores R que oscilaram entre -0,37 e -0,05. Assim, os resultados do PCA confirmaram que a lignina extraída com o DES1 foi a mais pura com o menor rendimento.
A lignina foi caracterizada por seu teor de açúcar, nitrogênio e cinzas(Figura 5A-C). O teor total de açúcar foi determinado pela cromatografia gasosa (GC). O teor de carboidratos na lignina foi extraído utilizando DES3 (ChCl-ureia) foi o mais alto (6-15%). Isso foi seguido pela lignina extraída utilizando DES2 (Ácido CÍSTICO-Acnótico), que apresentava teor de carboidratos de 3 a 12%. No entanto, o menor teor de carboidratos (1%) foi relatado para lignina extraída por dis1 (ácido CHI-oxálico). O tipo de açúcar identificado difere significativamente (Figura 6A-C); D-xilose e D-glicose foram os monossacarídeos mais abundantes. Esses resultados indicam que o DES1 foi extremamente seletivo na sua extração de lignina em comparação com os outros dois DESs, que extraíram não só a lignina, mas também os carboidratos. Em outras palavras, a pureza da lignina foi menor após a extração com o ácido láctico e a ureia DESs.
A alta seletividade do DES1 para fracionar a matriz lignocelulósica e extrair lignina pura é provavelmente devido à alta acidez de suas ligações de hidrogênio (alfa = 1,3). O cloreto de colina contém íons de cloreto que quebram as interações intramoleculares das ligações de hidrogênio, e os grupos de carboxilato em ácido oxálico contribuem para dissolver os polímeros de lignina. Da mesma forma, o teor de nitrogênio da lignina extraído utilizando DES1 foi inferior ao teor de nitrogênio da lignina extraído utilizando DES2 e DES3, atingindo até 3% (Figura 5A-C). A lignina extraída das folhas alfa apresentou o maior teor de nitrogênio: 2,70, 3,84 e 3,40 para DES1, DES2 e DES3, respectivamente. Estes resultados provam que os compostos nitrogenados foram extraídos e co-precipitados com lignina. Além disso, a calcina de lignina em todas as amostras indicou que a lignina extraída por DES2 e DES3 continha um componente inorgânico maior do que a lignina extraída por des1.
Esses resultados indicam que o DES1 promoveu a extração de lignina com alta pureza, mas com baixo teor de nitrogênio, carboidratos e cinzas. Em outras palavras, a lignina extraída usando DES1 (ácido ChCl-oxálico) foi mais pura do que a extraída usando DES2 (ácido cótico) e DES3 (ChCl-urea), que possui menor pureza e alto teor de nitrogênio, carboidratos e cinzas. A Tabela 1 resume a distribuição de massa molecular da lignina, analisada pela cromatografia de permeação de gel (GPC) e representada pelo peso molecular médio (Mn), peso molecular médio de peso médio (Mw) e índice de polidispersidade (PDI). Os valoresM w variaram de 48.123 a 147.233 g mol-1. A lignina extraída pelo DES2 a partir de folhas alfa, conchas de amêndoas e aegagropile tinha um PDI menor do que a lignina extraída por DES1, DES3 e alcalina, bem como a lignina crua. Em contraste, a lignina extraída pelo DES2 de pinheiros, pomace de oliva e folhas de Posidonia apresentaram PDI mais elevado. O PDI inferior da lignina extraído do aegagropile indica que seu peso molecular é mais homogêneo do que o das ligninas extraídas da outra biomassa.
Os grupos químicos funcionais presentes na lignina extraída foram investigados pela espectroscopia FTIR (Figura 7A-F). A faixa forte e larga entre 3.441 e 3.198 cm-1 foi atribuída às vibrações de alongamento de OH dos grupos hidroxil alcoólicas e fenólicos envolvidos na ligação de hidrogênio. Os sinais na faixa de número de ondas 2.963-2.852 cm-1 foram atribuídos a vibrações de alongamento alquilO C-H. Pomace de oliva, folhas alfa e cascas de amêndoas mostraram bandas mais intensas do que as outras biomassas. Não foram observadas bandas de 2.800 a 1.800 cm-1. A lignina obtida pelo tratamento DES1 e DES2, teve uma faixa crescente de 1.708 cm-1, o que indicou a presença de grupos C=O não julgados. No entanto, esse sinal estava ausente no espectro de solventes(Figura 8B). Espectros de ácido láctico e oxálico foram caracterizados por uma banda na faixa de 1.737-1.723 cm-1, que indicou a presença de grupos C=O não conjugados, enquanto o espectro de ureia foi caracterizado por dois sinais na faixa de número de ondas de 1.660 cm-1 e 1.604 cm-1 atribuídos a grupos amidos. As bandas de 1.606-1.618 cm-1 foram observadas em lignina extraída pelo tratamento DES1 e DES2, associada ao estiramento C=C conjugado por anéis.
O sinal de 1.640 cm-1 em lignina extraído pelo DES3 indicou a presença de vibração de alongamento de C=O em grupos carbonis conjugados de lignina. O sinal a 1516 cm-1 surgiu das vibrações dos anéis aromáticos presentes na lignina, enquanto a banda a 1200 cm-1 indicava a presença de grupos de éter. Faixas na faixa de número de ondas de 1.250-1.200 cm-1 foram atribuídas ao alongamento C-O de álcoois não diplomáticos. A banda a 953 cm-1 foi atribuída a substituintes de metila. Os resultados indicam que os espectros de frações de Lignina deS mostraram sinais em 1.730-1.702 cm-1 e 1.643-1.635 cm-1, atribuídos à vibração de alongamento de grupos carbonyl não julgados e conjugados, respectivamente. No entanto, essas faixas estavam ausentes em três ligninas comerciais: ligninas cruas, processadas por refrigerante e alcalinas(Figura 8A). Esta observação indica que durante sua extração e solubilização, alguns grupos funcionais de lignina foram conjugados com ácido oxálico e láctico.

Figura 1: Biomassa mediterrânea estudada. (A) Conchas de amêndoas, (B) Pomace de oliva, (C) Pinheiros de Cone, (D) Aegagropile (bolas de Posidonia), (E) folhas de Posidonia, (F) Folhas alfa. Clique aqui para ver uma versão maior desta figura.

Figura 2: Rendimento da lignina( A) Cloreto de colina + ácido oxálico (DES1), (B) Cloreto de colina + ácido láctico (DES2), (C) Cloreto de colina + Ureia (DES3). Diferenças significativas foram determinadas com o teste de ANOVA e Fisher pós-hoc (*P < 0,05; **P < 0,01; ***P < 0,001). Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; ns = não significativo. Clique aqui para ver uma versão maior desta figura.
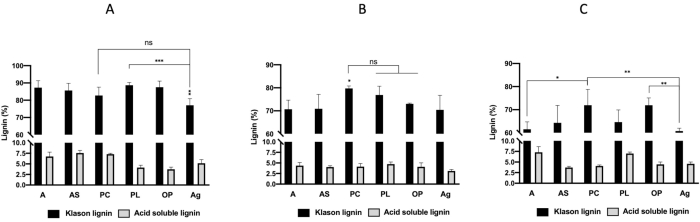
Figura 3: Lignina (%). (A) Cloreto de colina + ácido oxálico (DES1), (B) Cloreto de colina + ácido láctico (DES2), (C) Cloreto de colina + Ureia (DES3). Diferenças significativas foram determinadas com o teste pós-hoc de ANOVA e Fisher (*P < 0,05; **P < 0,01; ***P < 0,001). Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; ns = não significativo. Clique aqui para ver uma versão maior desta figura.

Figura 4: Principal análise componente do rendimento e pureza da lignina extraída da biomassa mediterrânea. O aceitador de ligação de hidrogênio (HBA) é o cloreto de colina (CÍCS) e os doadores de ligação de hidrogênio (HBD) são Ox = ácido oxálico, Lac : ácido láctico e ureia. PCA = análise de componentes principais; A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinecones, PL = folhas de Posidonia, OP = Pomace de oliva, Ag = Aegagropile. Clique aqui para ver uma versão maior desta figura.

Figura 5: Carboidratos (%), nitrogênio (%) e teor de cinzas (%) em amostras de lignina. (A) Cloreto de colina + ácido oxálico (DES1), (B) Cloreto de colina + ácido láctico (DES2), (C) Cloreto de colina + Ureia (DES3). Diferenças significativas foram determinadas com o teste de ANOVA e Fisher pós-hoc (*P < 0,05; **P < 0,01; ***P < 0,001). Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; ns = não significativo. Clique aqui para ver uma versão maior desta figura.

Figura 6: Identificação de monossacarídeos em amostras de lignina (%). (A) Cloreto de colina + ácido oxálico (DES1), (B) Cloreto de colina + ácido láctico (DES2), (C) Cloreto de colina + Ureia (DES3). Diferenças significativas foram determinadas com o teste de ANOVA e Fisher pós-hoc (*P < 0,05; **P < 0,01; ***P < 0,001). Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; ns = não significativo. Clique aqui para ver uma versão maior desta figura.

Figura 7: Espectro infravermelho de quatro transformações de amostras de lignina. (A) Folhas alfa, (B) Conchas de amêndoas,(C) Pinecones, (D) Folhas de Posidonia, (E) Pomace de Oliva, (F) Aegagropile. Abreviaturas: DES1 = Cloreto de colina + ácido oxálico, DES2 = Cloreto de colina + ácido láctico, DES3 = Cloreto de colina + Ureia. Clique aqui para ver uma versão maior desta figura.

Figura 8: Espectro infravermelho de quatro transformações. (A) Controles de ligação de hidrogênio,(B) doadores de ligações de hidrogênio. Clique aqui para ver uma versão maior desta figura.
| amostra | tratamento | Mn | Mw | Pdi |
| um | ureia | 47558 | 120141 | 2.5 |
| laca | 35241 | 73665 | 2.1 | |
| boi | 35793 | 84312 | 2.4 | |
| como | ureia | 50181 | 105817 | 2.1 |
| laca | 60409 | 104915 | 1.7 | |
| boi | 83112 | 147233 | 1.8 | |
| computador pessoal | ureia | 34013 | 65181 | 1.9 |
| laca | 55513 | 145963 | 2.6 | |
| boi | 46409 | 102298 | 2.2 | |
| Pl | ureia | 25696 | 50093 | 1.9 |
| laca | 45530 | 122900 | 2.7 | |
| boi | 28427 | 70726 | 2.5 | |
| Op | ureia | 29669 | 70424 | 2.4 |
| laca | 26735 | 66743 | 2.5 | |
| boi | 34161 | 75509 | 2.2 | |
| Ag | ureia | 30184 | 48123 | 1.6 |
| laca | 33835 | 52123 | 1.5 | |
| boi | 30025 | 49808 | 1.7 | |
| Controle | Lignina crua | 23275.3 | 36496.5 | 1.6 |
| Lignina extraída de alcalina | 22792.6 | 43014.3 | 1.9 |
Tabela 1: Pesos moleculares das ligninas. Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; Mn = peso molecular médio; Mw = peso molecular mediado por peso; PDI = índice de polidispersidade; Boi =ácido oxálico; Lac = ácido láctico.
Figura S1: Lignina. Clique aqui para baixar este Arquivo.
Figura S2: Amostras após autoclavar (30 mg de lignina + 1 mL de ácido sulfúrico de 72% + 28 mL de água destilada). Clique aqui para baixar este Arquivo.
Figura S3: Pelotas de lignina. Clique aqui para baixar este Arquivo.
Figura S4: Resíduo sólido lavado quatro vezes para recuperar o teor máximo de lignina. Clique aqui para baixar este Arquivo.
Figura S5: Cromatografias de permeação de gel de controles de lignina, ligninas cruas e extraídas de alcalina. Clique aqui para baixar este Arquivo.
Figura S6: Cromatogramas de permeação de gel de amostras de lignina. Abreviaturas: A = Folhas alfa, AS = Conchas de amêndoas, PC = Pinheiros, PL = Folhas de Posidonia, OP = Pomace de Oliva, Ag = Aegagropile; DES1 = Cloreto de colina + ácido oxálico, DES2 = Cloreto de colina + ácido láctico, DES3 = Cloreto de colina + Ureia. Clique aqui para baixar este Arquivo.
Figura S7: Fluxograma do processo de solvente eutético profundo (DES)-micro-ondas para extração de lignina. Clique aqui para baixar este Arquivo.
Discussão
Este estudo teve muitos objetivos; O primeiro deles foi preparar e usar solventes verdes de baixo custo com as características de líquidos iônicos e solventes orgânicos. O segundo objetivo foi fracionar a biomassa e extrair lignina em uma única etapa, sem exigir etapas preliminares como a extração de extraíveis utilizando Soxhlet ou hemicellulose utilizando solventes alcalinos, técnicas básicas ou termofísicas. O terceiro objetivo era recuperar a lignina por filtragem simples após o tratamento, sem ajuste de pH, mas simplesmente adicionando água destilada. Os resultados da extração ultrarrápida da lignina de seis fontes diferentes usando o processo baseado em DES assistido por micro-ondas usando três DESs diferentes indicam que o rendimento da extração pode variar dependendo da biomassa e natureza do DES. Por exemplo, o maior rendimento de extração de lignina entre os três DESs foi de pomace de oliva. Isso foi seguido pelos rendimentos de folhas alfa, pinheiros e cascas de amêndoas. Os rendimentos de extração foram menores para as folhas e bolas da Posidonia oceanica.
A pureza da lignina foi avaliada utilizando os métodos Klason, Kjeldahl (nitrogênio), carboidratos (GC) e cinzas. Como retratado na Figura 3 e Figura 5A-C, a pureza da lignina diminuiu devido à co-precipitação de componentes de nitrogênio, carboidratos e cinzas com lignina. As condições para a extração de lignina com o DES1 garantiram alta pureza, mas um baixo rendimento, indicando que melhorias no processo são necessárias para a correlação positiva entre o rendimento e a pureza da lignina. O rendimento da lignina pode ser melhorado se a duração do tratamento for maior, a potência do micro-ondas é aumentada de 800 W para 1200 W, ou a razão de solvente sólido (1:10) é reduzida. Os dados de peso molecular da Lignina fornecem uma visão sobre a dissociação ou recomerização de fragmentos de lignina após o tratamento. Observou-se aumento nos Mw de lignina para a biomassa após a extração utilizando microondas-DES, como é evidente, por exemplo, no caso das folhas de Posidonia (o MW é 50093 para DES3 e é 70726 para o DES1), o que demonstra que a despomerização ocorreu durante a extração de lignina e foi seguida por uma rápida repolimerização da interunidade carbono-carbono sob a ação do DES. Isso requer o uso de um agente de captura, como o formaldeído, para estabilizar a implantação.
No pré-tratamento do DES, dissociação de lignina e condensação são as duas reações concorrentes. O IDV das ligninas extraídas é inferior ao da faia lignina extraída por solventes orgânicos (etanol/água/H2SO4) relatado na literatura17. Isso indica que o tratamento do DES melhora a homogeneidade do peso molecular na lignina em comparação com o tratamento com solventes orgânicos. Os espectros FTIR indicam que os grupos funcionais de lignina são influenciados pelo solvente DES utilizado. Espectros mostram sinais em 1.730-1.702 cm-1 atribuídos à vibração de alongamento de grupos carbonyl não julgados, enquanto picos de 1.643-1.635 cm-1 indicam a vibração de alongamento de grupos carbonis conjugados. Esses resultados demonstram a possibilidade de extrair lignina de valor agregado de alta pureza da biomassa mediterrânea (que atualmente é desvalorizada e usada como alimento ou como emenda do solo) e podem ajudar a determinar o solvente de DES ideal, garantindo a pureza da lignina. Por exemplo, o DES1 demonstrou a extração mais pura de lignina, embora com um rendimento menor do que o observado usando os outros dois DESs.
O método proposto pode ser aplicado facilmente devido ao sistema de solvente eutectic profundo de ácido chcl-oxálico barato e verde. Cloreto de colina é um sal orgânico e o ácido oxálico está disponível como um produto natural das plantas, que são abundantes com baixo custo. Esta técnica (um protocolo ultrarrápido, que em uma etapa fornece fracionamento de biomassa e recuperação de lignina de alta pureza) é aplicável a qualquer tipo de biomassa lignocelulósica que tenha uma composição química semelhante à estudada aqui na escala laboratorial usando o processo microondas-DES ou na escala piloto usando o processo DES-ultrassom ou por aquecimento conveccional.
Divulgações
Os autores não relatam conflito de interesses.
Agradecimentos
MK e TB agradecem a Haitham Ayeb por análises estatísticas e preparação de figuras, Região valão (Desenvolvimento Regional Europeu-VERDIR) e Ministro da Educação Superior e Pesquisa Científica (Taoufik Bettaieb) pelo financiamento.
Materiais
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
Referências
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132(2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, Š, Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790(2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131(2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85(2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575(2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados