Method Article
특이한 지중해 리그놀룰로오스 잔류물에서 초고속 리닌 추출
요약
깊은 유텍 성 용매 기반, 마이크로 파 지원 전처리는 리그노 셀룰로오스 분획 및 고순도 리그닌 복구를위한 녹색, 빠르고 효율적인 공정입니다.
초록
전처리는 여전히 리그노셀룰로오스 바이오 정유 공정에서 가장 비싼 단계입니다. 화학 적 요구 사항뿐만 아니라 전력 및 열 소비를 최소화하고 환경 친화적 인 용매를 사용하여 비용 효율적인 만들어야합니다. 깊은 유텍 용매 (DESs)는 지속 가능한 바이오 정유 공장의 핵심, 녹색 및 저비용 용매입니다. 그들은 적어도 하나의 수소 결합 기증자와 하나의 수소 결합 수용자에서 발생하는 낮은 동결 점을 특징으로 투명 혼합물입니다. DES는 유망한 용매이지만 경쟁력있는 수익성을 위해 전자 레인지 조사와 같은 경제 난방 기술과 결합해야합니다. 전자 레인지 조사는 가열 시간을 단축하고 신속하게 적절한 온도를 달성 할 수 있기 때문에 분획을 높일 수있는 유망한 전략입니다. 이 연구의 목적은 저비용 및 생분해성 용매를 사용하여 바이오매스 분획 및 리그닌 추출을 위한 1단계, 신속한 방법을 개발하는 것이었습니다.
이 연구에서는, 전자레인지 지원 DES 전처리는 3종류의 DES를 사용하여 800W에서 60s를 위해 실시되었다. DES 혼합물은 콜린 염화물(ChCl)과 3개의 수소 결합 기증자(HBDs)에서 용이하게 제조되었습니다: 모노카복실산 (젖산), 디카복실산 (옥살산), 및 우레아. 이 전처리는 해양 잔류물(포지도니아 잎과 아에가그로필), 농식품 부산물(아몬드 껍질과 올리브 포마), 삼림 잔류물(파인콘), 다년생 리뇨셀룰로시풀(Stipa tenacissima)으로부터의 바이오매스 분획 및 리그닌 회수에 사용되었습니다. 추가 분석은 회수된 리그닌의 수율, 순도 및 분자량 분포를 결정하기 위해 수행되었다. 또한, 추출된 리그닌내화학작용군에 대한 DESS의 효과는 포리에-변환 적외선(FTIR) 분광법에 의해 결정되었다. 결과는 ChCl-oxalic 산 혼합물이 가장 높은 리그닌 순도와 가장 낮은 수율을 제공한다는 것을 나타냅니다. 본 연구는 DES-마이크로파 공정이 리그노셀룰로오스 바이오매스 분획을 위한 초고속, 효율적이며 비용 경쟁력 있는 기술임을 보여줍니다.
서문
지속 가능한 바이오 정유 공정은 바이오매스 처리, 그 분획을 관심 분자로 통합하고 부가가치 제품으로의 전환1을통합합니다. 2세대 바이오레핀에서 전처리는 바이오매스를 주요 구성 요소2로분수하는 데 필수적이라고 간주됩니다. 화학적, 물리적 또는 생물학적 전략을 활용한 전통적인 전처리 방법은 널리 적용되어왔다 3. 그러나, 이러한 전처리는 바이오리핀화에서 가장 비싼 단계로 간주되며, 긴 처리 시간, 높은 열 및 전력 소비, 용매 불순물4와같은 다른 단점이 있다. 최근에는 이온성 액체3과유사한 특성을 가진 DES는 생분해성, 환경 친화성, 합성용성 및 치료 후 회복과 같은 장점으로 인해 녹색 용매로 부상했다5.
DES는 유산산, 사과산 또는 옥살산과 같은 적어도 하나의 HBD의 혼합물이며, 베타인 또는 콜린 염화물(ChCl)6과같은 수소 결합 수용자(HBA)이다. HBA-HBD 상호 작용은 화학 결합의 분열을 허용하는 촉매 메커니즘을 가능하게하여 바이오 매스 분획 및 리그닌 분리를 유발합니다. 많은 연구자들은 옥수수의 cob과 stover7,8,ChCl-urea, 및 ChCl-oxalic acid에 ChCl-glycerol와 같은 리뇨셀룰로오스 사료원료의 DES 기반 전처리를 보고했습니다9, 유칼립투스 톱밥에 ChCl-젖산10,및 ChCl-acetic acid11및 ChCl-acetic acid 11 및 ChCl-acetic acid11. DES 효율을 향상시키기 위해 전처리는 마이크로파 처리와 결합하여 바이오매스 분획5를가속화해야 합니다. 많은 연구자들은 목재8과 옥수수 스토버, 스위치그래스 및 Miscanthus5의결합 된 전처리 (DES 및 전자 레인지)를보고했으며, 이는 짧은 기간 동안 한 번의 쉬운 단계에서 리그노 셀룰로오스 분획 및 리그닌 추출을위한 DES의 용량에 대한 새로운 통찰력을 제공합니다.
Lignin은 생체 중합체 생산을 위한 원료로 용맹화된 페놀 거대 분자이며 방향족 단량제 및올리고머(12)와같은 화학 물질의 생산에 대한 대안을 제시한다. 또한, 리그닌은 항산화 및 자외선 흡수활동(13)을가지고 있다. 여러 연구는 화장품에서 리그닌 응용 프로그램을보고14,15. 상용 자외선 차단제 제품에 대한 통합은 SPF 15에서 SPF 30까지 제품의 자외선 차단 인자(SPF)를 개선했으며, 10wt % lignin16을추가하여 2wt % 리그닌과 최대 SPF 50을 첨가했다. 이 논문은 지중해 바이오매스의 DES-마이크로파 전처리에 의해 지원되는 리그닌 탄수화물 분열에 대한 초고속 접근법을 설명합니다. 이러한 바이오매스는 농식품 부산물, 특히 올리브 포마와 아몬드 껍질로 구성되어 있습니다. 조사 된 다른 바이오 매스는 해양 기원 (포지도니아 잎과 aegagropile)과 숲 (소나무 콘과 야생 잔디)에서 유래한 생물의 생물입니다. 이 연구의 초점은 공급 원료 분분에 이 결합된 전처리의 효력을 평가하기 위하여 저비용 녹색 용매를 시험하고, 리그닌 순도와 수율에 미치는 영향을 조사하고, 추출된 리그닌에 있는 분자량 및 화학 기능군에 미치는 효력을 연구하기 위한 것이었습니다.
프로토콜
1. 바이오매스 준비
- 바이오매스 건조
- 지중해 해변에서 수확한 포지도니아 잎과 아에가그로필볼(Posidoniaoceanica)을72시간 동안 40°C의 오븐에 놓습니다.
- 식품 산업에서 생성된 아몬드껍질(Prunus dulcis)과올리브 포마메(Oleaeuropaea L.)를올리브 오일 공장에서 72시간 동안 40°C의 오븐에 놓습니다.
- 산림으로부터 채취한파인콘(피누스 할르펜시스)과지중해 남부 분지에서 채취한 알파잎(Stipa tenacissima)을72시간 동안 40°C의 오븐에 놓는다.
참고: 바이오매스가 모래가 들어 있는 경우 오븐에 놓이기 전에 증류수로 헹구어야 합니다. 바이오매스는 도1A-F로표시됩니다.
- 바이오매스 연삭
- 1mm 체가 장착된 해머 커터에 각 바이오매스 20g을 놓습니다. 결과 분말을 0.25 L 비커로 수집하고 0.5mm 체가 장착된 해머 커터에 공급합니다. 0.25 L 비커로 분말을 수집합니다.
2. 전자 레인지 지원, 초고속 리그닌 추출
- 깊은 유텍 용매 (DES) 준비
- DES1(ChCl-oxalic acid)을 1:1의 어금니비율로 1:1의 어금니비율로 1:1의 어금니비율로 1:1의 어금니비율로 1:1의 다름산으로 174g의 옥살산 이질126 g를 500mL 라운드-하부 플라스크에 섞어 70°C에서 4h의 배스로 녹여 균일하고 투명한 액체가 형성될 때까지 준비한다.
- DES2(ChCl-젖산)를 1:1의 어금니 비율로 500mL 의 둥근 바닥 플라스크에 90g의 젖산과 혼합하여 70°C에서 70°C에서 4시간 동안 용융하여 균질하고 투명한 액체가 형성될 때까지 준비한다.
- DES3(ChCl-urea)를 1:12의 어금니 비율로 1:12의 어금니비율로 500mL 원형 플라스크에 120g의 우레아와 혼합하여 70°C에서 70°C에서 4시간 동안 용융하여 균질하고 투명한 액체가 형성될 때까지 준비한다.
참고: 500rpm의 교반 바와 함께 이러한 혼합물을 지속적으로 저어줍니다.
- 결합 된 마이크로파 DES 처리
- 닫힌 폴리테트라플루오로로틸렌 반응기에서 공급원료 5g을 전자레인지에 넣습니다. DES 50mL를 추가하고 샘플에 교반 바를 배치합니다. 적절한 캡으로 전자레인지 용기를 닫고 온도 캡을 부착합니다.
- 전자 레인지 용기를 턴테이블 가장자리에 놓고 지속적으로 교반되도록합니다. 전자레인지 전원을 800W로 1분간 설정합니다. 적절한 장갑을 사용하여 전자 레인지에서 용기를 꺼내 서 혼합물을 식힙니다. 각 바이오매스 샘플에 대해 세 가지 DES를 사용하여 이 치료를 반복하십시오.
참고: 온도 프로브가 올바르게 배치되고 전자레인지 용기에 균일한 온도가 있는지 확인합니다.
- 리그닌 격리
- 에탄올:물을 50:50(v:v) 비율로 혼합하여 균일한 항솔매용액을 준비한다. 처리된 공급원료에 항솔매용액50mL을 추가하고, 혼합물을 원심분리 용기(250mL)에 넣고, 원심분리기는 3,000 ×g에서5분 동안 3,000ml로 배치한다.
- 원심분리 후 유리 필터 도가니(다공성 4, 10-16 μm, 직경 10mm)를 사용하여 상피(리그닌이 풍부한 분획)를 필터링합니다. 원심분리 후 수집된 잔류물을 25mL의 탈매용 용액으로 세척한다.
- 3,000 g의 원심분리기는 세척 후 5분 동안 ×. 4배 를 반복하고, 유리 필터 도가니(다공성 N4, 10-16 μm, 직경 10mm)를 통해 세차함을 수집하고 필터링합니다.
- 500mL 원형 하단 플라스크에서 2.3.3 단계에서 필터링된 세차재에 2.3.2 단계에서 필터링된 리그닌이 풍부한 분획을 추가합니다. 50°C 및 110mbar에서 회전 증발기로 에탄올을 증발시한다.
- 150mL의 탈이온화된 물을 농축 된 주류 (리그닌이 풍부한 분수)에 넣고 원심분리로 리그닌을 침전시합니다. 리닌을 펠릿으로 모으고 증류수 25mL로 세척하십시오. 4배 의 세차스를 반복합니다. 리뉴언을 리고이즈하거나 40°C의 오븐에서 건조시십시오.
참고: 필요한 경우 리닌 >4x를 세척하여 용매에서 염을 제거하십시오. - 다음 수식을 사용하여 수율을 결정합니다.

참고 : Lignin 추출은 또한 두 개의 다른 DESs와 함께 수행되었다 : 콜린 염화물 + 레스코르시놀 과 콜린 염화물 + 부티리 산 1 분에. 그러나, 이러한 DES를 사용하여 회수된 리그닌의 양은 다른 3개의 DES를 사용하여 얻은 양과 비교하여 매우 작고 복구할 수 없었다.
3. 클라슨에 의해 추출 된 리그닌의 순도 결정
- 클라슨 가수 분해에 대한 샘플 준비
- 필터 도가니(다공성 4, 직경 4.5mm)를 550°C의 머플 로에 4시간(2시간 경사로, 25°C)에 놓습니다. 오븐이 150°C로 냉각될 때 도가니를 제거하고 건조기에 넣고 식히고 계량합니다.
- 약 30 mg의 리그닌을 borosilicate 유리 튜브에 넣고(재료 표참조) 샘플의 무게를 기록합니다. 샘플에 72% 황산(H2SO4)의1mL을 추가하고, 샘플을 30°C 배스에 60분 동안 넣고, 10분마다 소용돌이에 섞는다.
- 샘플을 제거하고 100mL 유리 병에 옮기고 28mL의 증류수를 추가하여 산을 4%의 농도로 희석시 넣습니다. 유리병을 오토클레이브에 121°C에서 60분 간 놓습니다. 유리 병을 제거하고 식힙니다.
- 산성 용성 리그닌 분석
- 진공 상태에서 도가니를 사용하여 가수 분해를 필터링합니다. 탈이온된 물이 들어 있는 유리 병에 모든 고형물을 수집합니다. 50mL의 탈수로 도가니를 헹구는 다.
- 16h에 105°C의 오븐에 배치하여 고체를 함유한 도가니를 건조시다. 오븐에서 도가니를 제거하고 건조기에 넣고 식힙니다. 샘플의 무게를 측정합니다.
- 4시간(2시간 경사로)에 550°C의 머플 로에 도가니를 놓습니다. 그것을 제거하고 건조기에 배치합니다. 샘플의 무게를 측정합니다.
- 다음 수식을 사용하여 산 불용성 잔류물(AIR)의 백분율을 계산합니다.

WCSA : 오븐에서 제거 한 후 도가니 + 샘플의 무게
WC: 도가니의 무게
WCSMF : 머플 로에서 제거 한 후 도가니의 무게
ODW : 샘플의 오븐 건조 중량
- 산 수용성 리그닌 분석
- 쿼츠 큐벳을 사용하여 205 nm에서 분광계로 3.2.1 단계에서 얻은 여과물의 흡광도를 측정합니다. 증류수를 빈물로 사용하십시오.
- 다음 수식을 사용하여 산 수용성 잔류물(ASL)의 백분율을 계산합니다.
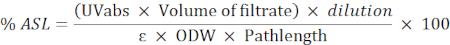
참고: 흡광도는 0.2에서 0.7 사이여야 합니다. 필요한 경우 샘플을 희석시.
UVabs: 205 nm의 흡광도
경로 길이: 측정 셀의 광 경로(cm)
ε: 특정 파장에서 바이오매스의 흡수성
4. 추출 된 리그닌의 질소 함량
- 알칼리 용액의 준비
- 2.5 L 체피플라스크에서 수산화나트륨(NaOH)의 무게 1kg을 계량하고 산화물을 마크까지 추가합니다. 플라스크에 마그네틱 바를 놓고 NaOH가 완전히 용해될 때까지 저어줍니다.
- 황산 용액 제제
- 5 L 볼륨 플라스크에서 0.1 N H2SO4 (재료의 표참조)를 가져 와서 5 L 마크까지 탈온 된 물을 추가하고 자기 막대를 놓고 내용물이 녹을 때까지 저어줍니다.
- 수신 솔루션 준비
- 5L 체피 플라스크에서, 100g의H3BO3(boric acid)를 탈온화된 물에 녹여, 부피를 마크에 끌어들인다.
- 무게 100 브로모 브레 솔 녹색의 mg 에 100 mL 볼륨 플라스크, 마크까지 기술 메탄올을 추가.
- 무게 100 메틸 레드의 mg에 100 mL 볼륨 플라스크, 마크까지 기술 메탄올을 추가.
- 4.3.3.3단계부터4.3.1, 브로모크레솔 그린 용액의 5L을 4.3.2, 70mL의 메틸 적색 용액으로부터 4.3.3.3, 용기에 5L의 분해물을 붓는다. 수신 솔루션을 30분 동안 잘 흔들어 줍니다.
참고: 솔루션의 최종 색상은 녹색이어야 합니다. 색상이 녹색이 아닌 경우 1 N NaOH 용액의 50mL를 추가합니다.
- 샘플 준비
- 켈달 튜브에서, 질소가 없는 종이에 100 mg의 리그닌을 넣고, Kjeldhal (1.5 g 칼륨 황산염 (K2SO4)+ 0.045 g 구리 황산 펜타수레이트 (CuSO4.5H2 O) + 0.045 g 이산화년제 (TiO2)를추가하고 7.2m의 Sod 농축물 2.2 l을 추가하십시오.
참고: 질소가 없는 종이(샘플 제외)만 있는 4개의 튜브를 공백으로 사용합니다.
- 켈달 튜브에서, 질소가 없는 종이에 100 mg의 리그닌을 넣고, Kjeldhal (1.5 g 칼륨 황산염 (K2SO4)+ 0.045 g 구리 황산 펜타수레이트 (CuSO4.5H2 O) + 0.045 g 이산화년제 (TiO2)를추가하고 7.2m의 Sod 농축물 2.2 l을 추가하십시오.
- 샘플 소화
- 360°C에서 소화기 1h의 온도 조절기를 사전에 켭분으로 전환합니다.
- 샘플 튜브를 랙에 놓고 4개의 빈 튜브를 랙의 네 모서리에 놓고 랙의 구멍(있는 경우)을 빈 튜브로 채웁니다.
- 랙을 예열된 소화기에 놓고 흡입 시스템을 덮고 물 펌프를 엽니다.
참고 : 연기를 피하기 위해주의; 연기가 나타나면 물의 흐름을 증가시다. - 2 시간 후, 가열을 끄고 샘플을 제거하고 금속 지지에 놓습니다. 흡입 시스템으로 약 40분 동안 랙을 식힙니다.
- 켈탈 증류 절차
- 켈달 증류소를 켭다. 선택 영역이 화면에 나타날 때까지 셀프 테스트를 실행할 수 있습니다. 수동 모드로 전환하고 빈 튜브를 삽입하고 슬라이딩 도어를 닫습니다.
- Titrant burette (0.02 N H2SO4)를제거하고 바닥과 상단을 여러 번 눌러 파이프에서 기포를 제거하고 H2SO4 병의 튜브를 압착하여 파이프에서 기포를 제거합니다. 후드를 닫습니다.
- H3BO3 수신 용액을 3배 제거합니다.
- 물을 3배 더 넣고 활성 증기(10분)로 전환합니다. Kjeldahl 1 분석 프로그램으로 전환합니다. 결과 선 수준에서 화살표를 사용하여 Blanco를 입력합니다.
- 튜브를 삽입합니다. 네 개의 공백으로 시작하여 평균을 계산합니다. 블랑코 선에서 값을 입력합니다.
참고: 튜브를 삽입한 후 장치는 H2O 30mL, H 3BO3의30mL, 10N NaOH의 40mL를 자동으로 그리고 연속적으로 추가합니다. - 결과 줄에서 titrant의 mL로 전환합니다. 튜브를 삽입하고 사용되는 H2SO4의 양을 기록합니다.
참고: Kjeldahl 증류소를 테스트하려면 50 mg의 글리세린이 18.60% ±% N%에 해당한다는 것을 고려하십시오. 각 적정의 끝에서 장치는 자동으로 비우고 튜브를 청소합니다. - N의 백분율을 계산합니다.

V s.a : 황산의 부피
T s.a : 0.02 N H2SO4
S: 샘플 질량
5. 추출 된 리그닌의 재 함량
- 105 °C에서 1 시간 동안 세라믹 도가니를 건조시십시오. 건조기에서 식히십시오.
- 도가니의 무게를 달고 그 숫자를 기록합니다. 샘플 파우더 약 1g을 추가합니다. 다음 프로그램과 함께 머플 로에 도가니를 놓습니다: 최대 575°C의 2h 램프; 575 °C에서 4 h의 고원.
- 오븐을 100°C로 식힙니다. 도가니를 제거하고, 건조기에 배치하고, 무게를 측정합니다.
6. 탄수화물 함량
- 보로하이드라이드 나트륨 제제(NaBH 4)/디메틸설프리산화물(DMSO) 용액
- NaBH4 2 g을 100mL 체피 플라스크에 놓고 DMSO로 마크를 채웁니다. 시장의 목욕탕에서 100 °C로 가열하고 용액이 완전히 녹을 때까지 저어줍니다.
- MIX 솔루션 준비
- 100mL 체피플라스크에 자일로오스, 아라비노스, 라노스, 포도당, 갈라콘토세, 만노, 2데옥시글루당을 각각 20mg을 놓고 100mL의 마크를 탈온화물로 채웁니다.
- 시료의 가수분해
- 보로실리케이트 유리 튜브에 리그닌 50 mg 샘플을 계량하고, 1 M H2SO4의3mL을 추가하고, 혼합물을 100°C에서 3시간 동안 가열합니다.
- 시료를 식히고, 15M 암모늄 수산화(NH4OH)의 1mL를 추가하고, pH를 확인하여 중성 또는 알칼리성인지 확인한다. 각 샘플에 정확히 1mL의 내부 표준(2-deoxyglucose)을 추가합니다.
참고: 내부 표준으로 첨가된 2-deoxyglucose는 시료에 존재하는 각 용량의 양을 정량화할 수 있게 합니다.
- 알디톨 아세테이트로 단당류의 감소 및 아세틸레이션
- 6.3.2 단계에서 용액의 400 μL을 가져 와서 특수 튜브에 놓습니다. 컨트롤 MIX 용액의 400 μL을 가져 와서 특수 튜브에 놓습니다.
참고: MIX 솔루션을 사용하면 응답 인자(RF) 및 단색차라이드 백분율의 계산이 용이합니다. - 섹션 6.1에 준비된 NaBH 4/DMSO 솔루션의 2mL를 추가합니다. 튜브를 닫고 수조에서 40 °C에서 90 분 동안 배양하십시오. 수조에서 튜브를 제거하고 빙하 아세트산 0.6mL를 추가합니다.
참고 : 이것은 외설적인 반응이기 때문에 거품과 연기가 나타납니다. - 약 0.4mL의 1-메틸리미다졸레와 약 4mL의 아세트 안수라이드를 추가합니다. 15분 후, 증류수 10mL를 넣고 시원하게 넣고 ~ 3mL의 디클로로메탄(CH2Cl2)을추가합니다.
- 적어도 2시간 후, 하부(유기) 위상의 ~1mL를 수집하고, 화염 이온화 검출기 모세관 기둥, HP1-메틸실록산(30m(길이) x 320 μm(내부 직경), 0.25 μm(필름 두께)을 장착한 가스 크로마토그래프에 주입한다. 데이터를 분석합니다.
- 다음 수식을 사용하여 응답 계수(RF)를 계산합니다.
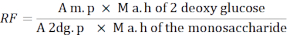
A m. p: MIX 솔루션의 단당류 피크 면적평균
M a. h 2 - 탈옥 포도당: 가수 분해 후 2-탈옥포도당의 질량
2dg. p: MIX 용액의 2-탈옥포도당 피크 영역의 평균
모노자카라이드의 M a. h: 가수 분해 후 단당카라이드질량
참고: 안하이드로 보정은 라노스의 경우 0.8, 아라비노스와 자일로스의 경우 0.88, 만노, 포도당 및 갈락토스의 경우 0.9입니다. 가수 분해 후 질량 = MIX 용액에 사용되는 단색차라이드의 안하이드로 보정 x 질량(g). - 다음 수식을 사용하여 단색 질량을 계산합니다.

AP. M: 분석된 샘플의 모노사카라이드 피크 영역
M. IS: 내부 표준의 질량 추가; 여기, C SI=1 mg/mL
AP.2: 시료의 2-데옥시글루코당의 피크 면적
RF: 응답 계수 - 다음 수식을 사용하여 각 단당구의 백분율을 계산합니다.
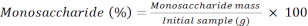
- 6.3.2 단계에서 용액의 400 μL을 가져 와서 특수 튜브에 놓습니다. 컨트롤 MIX 용액의 400 μL을 가져 와서 특수 튜브에 놓습니다.
7. 추출 된 리그닌의 화학 기능 (푸리에 변형 적외선)
- 추출된 리그닌에서 화학 작용군을 식별하려면 감쇠된 총 반사율(ATR) 모듈이 장착된 FT-IR 분광계를 사용합니다. 분광 소프트웨어를 열고 매개 변수를 조정 : 해상도 4cm-1,샘플 스캔 시간 32, 배경 스캔 시간 16, 4000에서 400cm-1,결과 스펙트럼 전송에서 데이터를 저장합니다.
- 샘플을 추가하지 마십시오. 배경 단일 채널을누릅니다. 이제 1 mg의 샘플을 크리스탈에 놓고 샘플 단일 채널을누릅니다. 획득된 스펙트럼을 처리합니다.
8. 추출 된 리그닌의 분자량 (젤 투과 크로마토그래피)
- 0.5% 리튬 염화물(LiCl)을 사용하여 디메틸포르마미드(DMF)의 용액을 준비한다. 1 L 체피 플라스크에서 LiCl 5 g을 가져 와서 DMF를 게이지 라인에 추가하고 균일 한 액체가 얻어질 때까지 내용을 혼합하십시오.
- 0.5% LiCl을 사용하여 DMF 3mL에 리그닌 샘플 3 mg을 용해하십시오. 10mL 원심분리기 튜브의 원심분리기와 용해성 분획을 유리병으로 분리합니다.
- 폴리스티렌 표준 1 kDa, 2 kDa, 3 kDa, 10 kDa, 20 kDa, 30 kDa의 3 mg을 DMF용액에 0.5% LiCl으로 녹입니다. 10mL 의 원심분리기는 유리 튜브를 보로실리케이트 유리 튜브로 옮기고 용해 분획을 유리병으로 옮킨다.
- 고성능 액체 크로마토그래피-자외선(UV) 시스템을 준비합니다.
- 데이터 시스템을 열고 UV 검출기를 확인합니다.
- 증류수로 시스템을 제거합니다. 용출물에 플런저를 설치합니다(0.5% LiCl이 있는 DMF). 퍼지 밸브를 열고 15분 동안 1mL/분의 유량으로 라인을 제거합니다. 흐름을 멈추고 퍼징 밸브를 닫습니다.
- 유량을 1mL/분으로 10분 동안 설정하여 검출기로 의 용출 경로를 청소합니다. 유량 중지합니다.
- 가드 열 앞에 있는 열을 설치합니다(재료 표참조). 45°C에서 컬럼 히터를 켜고 UV 검출기를 켜고 0.6mL/min의 유속도에 도달할 때까지 유량을 점진적으로 설정합니다.
- 270 nm의 파장에서 40 분 동안 각 샘플의 30 μL을 주입하십시오. 획득된 데이터를 처리하고 보정 라인을 사용하여 질량 분포를 계산합니다.
- 수 평균 분자량(Mn), 체중 평균 분자량(Mw), 및 다분산지수(PDI)를 계산합니다.


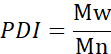
Mi: 체인의 분자량
Ni: 그 분자량에 대한 체인 수
9. 데이터 처리 및 통계 분석
- 삼중에서 모든 분석 실험을 수행하고 결과를 건조 물질의 %로 표현하십시오.
- 분산(ANOVA)에 대한 단방향 분석을 수행하고 Tukey의 다중 비교 테스트를 사용하여 수단을 비교합니다.
- 주 성분 분석(PCA)을 수행합니다.
결과
도 2A-C는 결합 된 마이크로파 DES 전처리 후 도 1A-F에도시 된 6 개의 공급 원료로부터 추출의 리그닌 수율을묘사한다. 그 결과 DES1(ChCl-oxalic acid)(도2A)로얻은 리닌 수율이 DES2(ChCl-젖산) 및 DES3(ChCl-urea)(도2B,C)로얻은 수율보다 낮았다는 것을 보여준다. 또한, 파인콘(PC)과 올리브 포마제(OP)의 리닌 수율은 DES1 치료제의 경우 각각 32.31%, 26.04%, DES3의 경우 48.72%, 43.76으로 높았다. 알파 잎(A)의 리닌 수율은 DES2로 추출된 다른 모든 리그닌의 수율보다 현저히 높았다. 도 3A-C는 DES3의 알파 잎(A), 아가그로필(Ag), 아몬드 껍질(AS)의 DES3 전처리를 제외한 바이오매스의 3가지 전처리에 대해 리그닌 순도가 70%를 초과하여 리그닌 순도를 65%를 준 것으로 나타났다. 가장 높은 리그닌 순도 (> 90%) DES1 치료제로 입수하였다: 알파 잎(A) 94%, 아몬드 껍질(AS) 93%, 파인콘(PC) 90%, 포시도니아 잎(PL) 92%, 올리브 포마메(OP) 91%.
리닌 순도 및 수율 데이터는 두 가지 파라미터(yield 및 순도) 및 18개의 처리를 고려하여 주요 성분 분석(PCA)을 실시하였다. 도 4는 상관관계원이 전체 변동의 100%를 설명한 것을 나타낸다. 첫 번째 구성 요소인 PCA1은 58.09%를 설명했으며 두 번째 구성 요소인 PCA2는 전체 변동의 41.91%를 설명했습니다. 리그닌 순도는 DES1 (Ox) 치료와 긍정적으로 상관관계가 있었다. 피어슨 상관계수(R)는 알파(A Ox) 0.32, 올리브 포마(OP Ox) 0.27, 파인콘(PC Ox) 0.2, 포지도니아 잎(PL Ox) 0.35, 아몬드 껍질(AS Ox) 0.32, 그리고 에가그로필(Ag Ox) 0.05이었다. 그러나 DES3 치료는 -0.37과 -0.05 사이에 진동하는 R 값과 리그닌 수율과 부정적인 상관 관계가 있었습니다. 따라서, PCA 결과는 DES1로 추출된 리그닌이 가장 낮은 수율을 가진 가장 순수한 것을 확인했습니다.
리그닌은 설탕, 질소 및 재 내용물(도5A-C)을특징으로 하였다. 총 당도는 가스 크로마토그래피(GC)에 의해 결정되었다. 리그닌의 탄수화물 함량은 DES3(ChCl-urea)를 사용하여 추출되었다(6-15%). 이어서 3-12%의 탄수화물 함량을 가진 DES2(ChCl-젖산)를 사용하여 추출한 리그닌이 뒤따랐다. 그러나, 가장 낮은 탄수화물 함량 (1%) DES1(ChCl-oxalic acid)을 사용하여 추출된 리그닌에 대해 보고되었다. 확인된 설탕의 종류는 현저하게달랐다(도6A-C); D-xylose와 D-포도당은 가장 풍부한 단당류였다. 이러한 결과는 DES1이 리그닌뿐만 아니라 탄수화물을 추출한 다른 두 DESS와 비교하여 리그닌 추출에서 매우 선택적이었다는 것을 나타냅니다. 즉, 리닌 순도는 젖산 및 우레아 DESs를 통해 추출 후 낮았다.
DES1의 높은 선택성은 리그노셀룰로오스 매트릭스를 분별하고 순수한 리그닌을 추출하는 것은 아마도 수소 결합의 높은 산도(알파 = 1.3)때문일 것이다. 콜린 염화물수소는 수소 결합의 분자 내 상호 작용을 깨는 염화물 이온을 포함하고, 옥살산의 카박스실레이트 그룹은 리그닌 폴리머를 용해시키는 데 기여한다. 유사하게, DES1을 사용하여 추출된 리그닌의 질소 함량은 DES2 및 DES3를 사용하여 추출된 리그닌의 질소 함량보다 낮았으며, 최대 3%(도5A-C)에도달하였다. 알파 잎에서 추출한 리닌은 DES1, DES2 및 DES3의 경우 각각 2.70, 3.84 및 3.40의 질소 함량이 가장 높았다. 이러한 결과는 질소 화합물이 추출되고 리그닌과 함께 침전되었다는 것을 증명합니다. 더욱이, 모든 시료에서 리그닌 칼시네이션은 DES2 및 DES3를 사용하여 추출된 리그닌이 DES1을 사용하여 추출한 리그닌보다 더 높은 무기 성분을 함유하고 있음을 나타냈다.
이러한 결과는 DES1이 높은 순도로 리그닌추출을 촉진했지만 질소, 탄수화물 및 재 함량이 낮다는 것을 나타낸다. 즉, DES1(ChCl-oxalic acid)을 사용하여 추출된 리닌은 더 낮은 순도와 높은 질소, 탄수화물 및 재 함량을 가진 DES2(ChCl-젖산) 및 DES3(ChCl-urea)를 사용하여 추출한 것보다 더 순수하였다. 표 1은 젤 투과 크로마토그래피(GPC)에 의해 분석되고 수평균 분자량(Mn), 체중 평균 분자량(Mw) 및 다분산지수(PDI)로 표현되는 리그닌의 분자 질량 분포를 요약하였다. Mw 값은 48,123에서 147,233 g mol-1사이다. 알파 잎, 아몬드 껍질 및 아에가그로필에서 DES2에 의해 추출된 리그닌은 DES1, DES3 및 알칼리뿐만 아니라 생 리그닌에 의해 추출된 리그닌보다 PDI가 낮았다. 대조적으로, 파인콘, 올리브 포마, 포지도니아 잎에서 DES2에 의해 추출된 리그닌은 더 높은 PDI를 보였다. 에가그로필에서 추출된 리그닌의 낮은 PDI는 분자량이 다른 바이오매스로부터 추출한 리그닌보다 더 균일하다는 것을 나타낸다.
추출된 리그닌에 존재하는 화학 작용기는 FTIR 분광법(도7A-F)에의해 조사되었다. 3,441cm에서 3,198cm-1 사이의 강력하고 넓은 밴드는 수소 결합에 관여하는 알코올 및 페놀 하이드록실 그룹의 OH 스트레칭 진동에 기인했다. 파수 범위 2,963-2,852cm-1의 신호는 알킬 C-H 스트레칭 진동에 할당되었다. 올리브 포마, 알파 잎, 아몬드 껍질은 다른 바이오 매스보다 더 강렬한 밴드를 보였다. 2,800 ~1,800cm-1에서어떤 밴드도 관찰되지 않았다. DES1 및 DES2 치료에 의해 얻은 리그닌은 1,708cm-1에서상승 밴드를 가지고 있었고, 이는 Conjugated C = O 그룹의 존재를 나타냈다. 그러나, 이러한 신호는 용매스펙트럼(도 8B)에없었다. 젖산 및 옥살산 스펙트럼은 1,737-1,723cm-1 범위에서 밴드가 특징지어졌으며, 이는 C=O 군의 존재를 나타내고, 우레아 스펙트럼은 1,660cm-1 및 1,604cm-1의 파수 범위에서 두 개의 신호가 특징이었다. 1,606-1,618cm-1의 밴드는 DES1 및 DES2 처리에 의해 추출된 리그닌에서 관찰되었으며, 이는 링-컨쥬게이트 C=C 스트레치와 연관되었다.
DES3에 의해 추출된 리그닌에서1,640cm-1의 신호는 리그닌의 컨쥬게이드 카보닐 그룹에서 C=O 스트레칭 진동의 존재를 나타냈다. 1516cm-1의 신호는 리그닌에 존재하는 방향족 고리의 진동에서 발생했으며, 1200cm-1의 밴드는 에테르 그룹의 존재를 나타냈습니다. 1,250-1,200cm-1의 파수 범위의 밴드는 비 방향족 알코올의 C-O 스트레칭에 할당되었다. 953cm-1의 밴드는 메틸 대체품에 배정되었다. 그 결과는 DES-lignin 분획 스펙트럼이 각각 1,730-1,702 cm-1 및 1,643-1,635 cm-1에서신호를 나타내었으며, 비응주및 컨쥬게이트 된 카보닐 그룹의 스트레칭 진동에 할당된 것을 나타낸다. 그러나, 이들 밴드 범위는 생, 소다 가공, 알칼리 추출 리그닌(그림8A)의세 가지 상업적 리그닌에 결석했다. 이 관측은 추출 및 용해화 중에 리닌의 일부 기능성 그룹이 옥탈및 젖산으로 접합되었다는 것을 나타냅니다.

도 1: 지중해 생물매스 연구. (A)아몬드 껍질,(B)올리브 포마,(C)콘 소나무,(D)아가그로필 (포지도니아 공),(E)포지도니아 잎,(F)알파 잎. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 리닌 수율. (A)콜린 염화물 + 옥탈산 (DES1),(B)콜린 염화 + 젖산 (DES2),(C)콜린 염화물 + 우레아 (DES3). 별방향 ANOVA 및 피셔의 사후 테스트(*P < 0.05; **P < 0.01; ***P < 0.001)으로 상당한 차이가 결정되었습니다. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; ns = 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
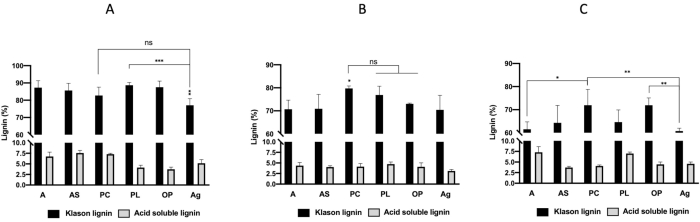
그림 3: 리닌 (%). (A)콜린 염화물 + 옥탈산 (DES1),(B)콜린 염화 + 젖산 (DES2),(C)콜린 염화물 + 우레아 (DES3). 별방향 ANOVA 및 피셔의 포스트 호크 테스트(*P < 0.05; **P < 0.01; ***P < 0.001)로 상당한 차이가 결정되었습니다. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; ns = 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 지중해 바이오매스로부터 추출한 리그닌의 수율 및 순도의 주요 성분 분석. 수소결합 수용제(HBA)는 콜린염화물(ChCl)과 수소결합 기증자(HBD)는 옥살산, 락: 젖산 및 우레아이다. PCA = 주 성분 분석; A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 탄수화물 (%), 질소 (%), 및 재 함량 (%) 리닌 샘플에서. (A)콜린 염화물 + 옥탈산 (DES1),(B)콜린 염화물 + 젖산 (DES2),(C)콜린 염화물 + 우레아 (DES3). 별방향 ANOVA 및 피셔의 사후 테스트(*P < 0.05; **P < 0.01; ***P < 0.001)으로 상당한 차이가 결정되었습니다. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; ns = 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 리그닌 샘플에서 단당류의 식별 (%). (A)콜린 염화물 + 옥탈산 (DES1),(B)콜린 염화물 + 젖산 (DES2),(C)콜린 염화물 + 우레아 (DES3). 별방향 ANOVA 및 피셔의 사후 테스트(*P < 0.05; **P < 0.01; ***P < 0.001)으로 상당한 차이가 결정되었습니다. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; ns = 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 리닌 샘플의 포리에-변형 적외선 스펙트럼. (A)알파 잎,(B)아몬드 껍질,(C)파인콘,(D)포지도니아 잎,(E)올리브 포마,(F)아가그로필. 약어: DES1 = 콜린 염화물 + 옥탈산, DES2 = 콜린 염화물 + 젖산, DES3 = 콜린 염화물 + 우레아. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: 포리에 변환 적외선 스펙트럼. (A)리닌 컨트롤,(B)수소 결합 기증자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 견본 | 치료 | 미네소타 | Mw | PDI |
| A | 요소 | 47558 | 120141 | 2.5 |
| 락 | 35241 | 73665 | 2.1 | |
| 황소 | 35793 | 84312 | 2.4 | |
| 만큼 | 요소 | 50181 | 105817 | 2.1 |
| 락 | 60409 | 104915 | 1.7 | |
| 황소 | 83112 | 147233 | 1.8 | |
| 개인용 컴퓨터 | 요소 | 34013 | 65181 | 1.9 |
| 락 | 55513 | 145963 | 2.6 | |
| 황소 | 46409 | 102298 | 2.2 | |
| PL | 요소 | 25696 | 50093 | 1.9 |
| 락 | 45530 | 122900 | 2.7 | |
| 황소 | 28427 | 70726 | 2.5 | |
| OP | 요소 | 29669 | 70424 | 2.4 |
| 락 | 26735 | 66743 | 2.5 | |
| 황소 | 34161 | 75509 | 2.2 | |
| Ag | 요소 | 30184 | 48123 | 1.6 |
| 락 | 33835 | 52123 | 1.5 | |
| 황소 | 30025 | 49808 | 1.7 | |
| 제어 | 원시 리그닌 | 23275.3 | 36496.5 | 1.6 |
| 알칼리 추출 리그닌 | 22792.6 | 43014.3 | 1.9 |
표 1: 리그닌의 분자 중량. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; Mn = 수 평균 분자량; Mw = 체중 평균 분자량; PDI = 다분산도 지수; 옥스 =옥탈산; 락 = 젖산.
그림 S1: 리그닌. 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S2: 자동 절제 된 후 샘플 (30 리그닌의 밀리 그램 + 72 % 황산 + 증류수 28 mL의 1 mL). 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S3: 리닌 펠릿. 이 파일을 다운로드하려면 여기를 클릭하십시오.
도 S4: 최대 리닌 함량을 복구하기 위해 4회 세척된 고체 잔류물. 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S5: 리그닌 컨트롤, 생 및 알칼리 추출 리그닌의 젤 투과 크로마토그램. 이 파일을 다운로드하려면 여기를 클릭하십시오.
그림 S6: 리그닌 샘플의 젤 투과 크로마토그램. 약어: A = 알파 잎, AS = 아몬드 껍질, PC = 파인콘, PL = 포지도니아 잎, OP = 올리브 포메이, Ag = 아가그로필; DES1 = 콜린 염화물 + 옥탈산, DES2 = 콜린 염화 + 젖산, DES3 = 콜린 염화물 + 우레아. 이 파일을 다운로드하려면 여기를 클릭하십시오.
도 S7: 리그닌 추출을 위한 깊은 유텍용매(DES)-마이크로파 공정의 플로우시트. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 연구는 많은 목표를 가지고 있었다; 첫 번째는 이온 액체와 유기 용매의 특성을 가진 저비용 녹색 용매를 준비하고 사용하는 것이었습니다. 두 번째 목적은 알칼리성 용매, 기본 또는 열물리학 기술을 사용하여 Soxhlet 또는 hemicellulose를 사용하여 추출물의 추출과 같은 예비 단계를 요구하지 않고, 단일 단계에서 바이오매스와 추출 리그닌을 분수하는 것이었습니다. 세 번째 목표는 pH의 조정없이, 처리 후 간단한 여과에 의해 리그닌을 복구하는 것이었지만 단순히 증류수를 첨가하여. 3개의 다른 DES를 사용하여 전자레인지 지원, DES 기반 공정을 사용하여 6개의 다른 소스로부터 리닌을 초고속 추출한 결과는 DES의 바이오매스 및 특성에 따라 추출 수율이 달라질 수 있음을 나타낸다. 예를 들어, 세 가지 DES 중 리그닌 추출의 가장 높은 수율은 올리브 포마제에서 나온 것이다. 그 다음에는 알파 잎, 파인콘, 아몬드 껍질의 수확량이 뒤따랐습니다. 추출 수율은 포지도니아 오세아니카의잎과 공에 대해 낮았다.
리그닌의 순도는 클라슨, Kjeldahl (질소), 탄수화물 (GC) 및 재 방법을 사용하여 평가되었다. 도 3 및 도 5A-C에묘사된 바와 같이, 리그닌의 순도는 리그닌을 함유한 질소, 탄수화물 및 재 성분의 공동 침전으로 인해 감소하였다. DES1을 통한 리그닌 추출 조건은 높은 순도를 보장하지만, 낮은 수율은 리그닌의 수율과 순도 사이의 긍정적 인 상관 관계에 공정 개선이 필요하다는 것을 나타냅니다. 리닌 수율은 처리의 지속 시간이 길면 향상될 수 있고, 전자레인지 전력이 800W에서 1200W로 증가하거나, 고체용매(1:10)의 비율이 감소된다. Lignin 분자량 데이터는 치료 후 리그닌 단편의 해리 또는 재중합에 대한 통찰력을 제공합니다. 바이오매스를 위한 리그닌의 Mw의 증가는 마이크로파-DES를 이용한 추출 후 관찰되었으며, 예를 들어, 포지도니아 잎의 경우(Mw는 DES3에 대해 50093이고 DES1에 대한 70726)의 경우, 이는 리젠의 추출 중에 분해가 발생하고 탄소 간 재화에 의해 뒤따랐다. 이렇게 하려면 포름알데히드와 같은 캡처 에이전트를 사용하여 배포를 안정화해야 합니다.
DES 전처리에서, 리그닌 해리 및 응축은 두 가지 경쟁 반응이다. 추출된 리그닌의 PDI는 유기 용매(에탄올/물/H 2 SO 4)에 의해 추출된 비치 리그닌보다 낮습니다(에탄올/물/H2SO4)은문헌(17)에보고된다. 이는 DES 처리가 유기 용매를 가진 처리에 비해 리그닌에 있는 분자량 균질성을 향상시킨다는 것을 나타냅니다. FTIR 스펙트럼은 리그닌 기능 그룹이 사용되는 DES 용매의 영향을 받는 것을 나타냅니다. 스펙트럼 은 1,730-1,702cm-1에서 신호를 표시하지 않은 탄산염 군의 스트레칭 진동에 할당된 반면, 1,643-1,635cm-1의 피크는 컨쥬게이트 카보닐 그룹의 스트레칭 진동을 나타냅니다. 이러한 결과는 지중해 바이오매스로부터 고순도의 부가가치 리그닌을 추출할 가능성을 보여 주며(현재 저평가되어 사료 또는 토양 수정으로 사용) 리그닌의 순도를 보장하면서 최적의 DES 용매를 결정하는 데 도움이 될 수 있다. 예를 들어, DES1은 다른 두 DES를 사용하여 관찰된 수율보다 낮은 수율을 가지고 있지만 리그닌의 가장 순수한 추출을 시연했다.
제안된 방법은 저렴하고 녹색 ChCl-옥살산 깊은 유텍성 용매 시스템으로 인해 쉽게 적용될 수 있다. 콜린 염화물은 유기 염및 옥살산은 낮은 비용으로 풍부한 식물의 천연 제품으로 사용할 수 있습니다. 이 기술(한 단계에서 바이오매스 분획 및 고순도 리그닌 회수를 제공하는 초고속 프로토콜)은 전자레인지-DES 공정을 이용하여 실험실 규모 또는 DES-초음파 공정을 이용하여 또는 대류 가열을 사용하여 파일럿 규모에서 연구한 것과 유사한 화학 성분을 가지고 있는 모든 유형의 리그노셀룰로증 바이오매스에 적용됩니다.
공개
저자는 이해 상충을 보고합니다.
감사의 말
MK와 TB는 통계 분석 및 그림 준비에 대한 하이탐 아이브 감사, 월룬 지역 (유럽 지역 개발 - VERDIR) 및 고등 교육 과학 연구 장관 (타우피크 베타아이에브) 자금 조달.
자료
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
참고문헌
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132(2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, Š, Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790(2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131(2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85(2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575(2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유