Method Article
超高速利格宁从不寻常的地中海木质细胞残留物中提取
摘要
深乳酸溶剂基,微波辅助预处理是一个绿色,快速,高效的过程,为木质细胞分馏和高纯度木质素回收。
摘要
预处理仍然是木质细胞学生物精炼过程中最昂贵的一步。它必须通过最大限度地减少化学需求、功率和热量消耗以及使用环保溶剂来实现成本效益。深乳酸盐溶剂 (DES) 是可持续生物定义中的关键、绿色和低成本溶剂。它们是透明混合物,其特点是至少由一个氢键供体和一个氢键接受者产生的低冰点。虽然 DES 是很有前途的溶剂,但有必要将其与经济加热技术(如微波辐照)相结合,以获得具有竞争力的盈利能力。微波辐照是缩短加热时间和提高分馏的一项很有前途的策略,因为它可以迅速达到适当的温度。本研究的目的是开发一种单步、快速的生物质分馏和木质素提取方法,使用低成本和可生物降解的溶剂。
在这项研究中,使用三种DES进行了60年代的微波辅助DES预处理,在800 W。DES混合物由胆碱氯化物(ChCl)和三个氢键捐赠者(HBDs)简单制备:单碳酸(乳酸)、二甲基糖酸(草酸)和尿素。这种预处理用于从海洋残留物(波西多尼亚叶和藻类)、农业食品副产品(杏仁壳和橄榄果)、森林残留物(松果)和常年木质细胞草(斯蒂帕特纳西西玛)中恢复生物质分馏和木质素。进一步分析以确定回收木质素的产量、纯度和分子重量分布。此外,DESs对提取木质素中的化学功能组的影响由富利埃转化红外(FTIR)光谱仪确定。结果表明,ChCl-草酸混合物具有最高的木质素纯度和最低的产量。本研究表明,DES微波工艺是一种超高速、高效且具有成本竞争力的木质细胞生物质分馏技术。
引言
可持续的生物精炼过程将生物质加工、其分馏成感兴趣的分子,并转化为增值产品1。在第二代生物修复中,预处理被认为是将生物质分成主要成分2的必要条件。利用化学、物理或生物策略的传统预处理方法已得到广泛应用。然而,这种预处理被认为是生物修复中最昂贵的一步,并具有其他缺点,如加工时间长,热和功耗高,溶剂杂质4。最近,DESs的特性与离子液体3相似,由于生物降解性、环保性、易合成性、治疗后恢复等优点,成为绿色溶剂。
DES 是至少一种 HBD 的混合物,如乳酸、粘液酸或草酸,以及氢键接受剂 (HBA) 的混合物,如贝坦或氯化胆 (ChCl)6。HBA-HBD 相互作用使催化机制能够使化学键裂开,导致生物质分裂和木质素分离。许多研究人员已经报告了基于DES的木质细胞素原料的预处理,如玉米棒上的ChCl-甘油和7号、8号、ChCl-尿素、 小麦稻草上的ChCl-草酸9,桉树锯末上的ChCl-乳酸10,木材上的ChCl-醋酸11和木上的ChCl-乙烯乙二醇。为了提高DES效率,预处理应与微波处理相结合,以加速生物质分馏5。许多研究人员报告了这种对8号木和玉米茎、开关草和米斯坎图斯5号的联合预处理(DES和微波),这为在短时间内对DES在木质细胞分馏和木质素提取方面的能力提供了新的见解。
木质素是一种酚类巨分子,作为生物聚合物生产的原料,是芳香单体和寡聚物等化学物质生产的替代品。此外,木质素具有抗氧化和紫外线吸收活动13。一些研究已经报告了木质素在化妆品中的应用14,15。其在商业防晒产品的集成改善了产品的防晒系数(SPF)从SPF 15到SPF 30,只增加了2 wt % 的木质素和高达SPF 50,增加了10瓦特%的木质素16。本文描述了一种超快的木质素 - 碳水化合物方法,辅之以地中海生物量的 DES - 微波预处理。这些生物量由农业食品副产品组成,特别是橄榄豆和杏仁壳。被调查的其他生物量是海洋原产物(波西多尼亚叶和海生物)和源自森林的生物量(松果和野生草)。本研究的重点是测试低成本的绿色溶剂,以评估这种联合预处理对原料分馏的影响,调查其对木质素纯度和产量的影响,并研究其对提取木质素中的分子量和化学功能组的影响。
研究方案
1. 生物质的制备
- 生物质干燥
- 将从地中海海滩收获的波西多尼亚叶子和大洋球(波西多尼亚海洋)放在40°C的烤箱中,72小时。
- 将来自食品工业的杏仁壳(普鲁努斯杜丽花)和从橄榄油厂获得的橄榄果壳(欧罗巴利亚 L.)放在 40 °C 的烤箱中,以 72 小时的速度放置。
- 将从森林中收集的松果(皮努斯哈莱彭西斯)和从地中海南部盆地收集的阿尔法叶(斯蒂帕特纳西西玛)放在40°C的烤箱中,以72小时的速度。
注:如果生物质含有沙子,在放入烤箱之前必须用蒸馏水冲洗。生物质显示在图1A-F中。
- 生物质研磨
- 将每个生物量的 20 克放在装有 1 毫米筛子的锤子切割机中。将产生的粉末收集到 0.25 升烧嘴中,并将其喂给装有 0.5 mm 筛子的锤子切割机。将粉末收集到 0.25 L 烧嘴中。
2. 微波辅助超高速木质素提取
- 深乳酸盐溶剂 (DES) 制备
- 将 174 克 ChCl 与 126 克草酸二水酸盐混合在 500 mL 的圆底烧瓶中,在 70 °C 的浴缸中熔化 4 小时,以 1:1 的摩尔比率准备 DES1(ChCl-草酸)。
- 将 174 克 ChCl 与 90 克乳酸混合在 500 mL 的圆底烧瓶中,在 70 °C 的浴缸中熔化 4 小时,以 1:1 的比例准备 DES2(ChCl-乳酸),直到形成均质透明的液体。
- 将 174 克 ChCl 与 120 克尿素混合在 500 mL 圆底烧瓶中,在 70 °C 的浴缸中熔化 4 小时,以 4 小时的速度将它们熔化。
注意:以 500 rpm 的搅拌棒连续搅拌这些混合物。
- 微波-DES 综合处理
- 将5克原料放在一个封闭的聚二氟乙烯反应堆的微波炉中。添加 50 mL 的 DES,并在样品中放置搅拌条。用适当的盖子关闭微波容器,并附加温度盖。
- 将微波容器放在转盘边缘,确保它不断激动。将微波功率设置为 800 W 1 分钟。使用合适的手套,将容器从微波炉中取出,让混合物冷却。使用每个生物质样本的三个 DES 重复此处理。
注意:检查并确保温度探头正确放置,微波容器具有均匀温度。
- 利格宁隔离
- 通过将乙醇:水混合在 50:50 (v:v) 的比例中,准备同质的防溶解液。将50mL的防溶剂加入处理过的原料中,将混合物放入离心容器(250 mL),离心机在3,000× 克时,5分钟。
- 离心后,使用玻璃滤芯(孔隙度 4,10-16 μm,直径 10 mm)过滤超自然(富含木质素的分数)。用25mL的防溶剂清洗离心后收集的剩余纤维素残留物。
- 每次洗涤后 5 分钟,离心机在 3,000 × g。 重复洗涤 4 倍,并通过玻璃滤芯收集和过滤洗涤物(孔隙度 N 4,10-16 μm,直径 10 mm)。
- 将过滤后的富含木质素的分数从步骤 2.3.2 添加到 500 mL 圆形底部烧瓶中的 2.3.3 步的过滤洗涤。使用旋转蒸发器在 50 °C 和 110 mbar 下蒸发乙醇。
- 在浓缩液(富含木质素的馏分)中加入150mL的去离子化水,并通过离心沉淀木质素。收集木质素作为颗粒,用25mL蒸馏水清洗:重复洗涤4倍。将木质素合二为一,或在 40 °C 的烤箱中干燥。
注意:如有必要,洗木质素>4x去除溶剂中的盐。 - 使用以下公式确定收益率:

注:在1分钟内还与另外两个DES一起进行木质素提取:胆碱氯化物+再醇和氯化胆+ 丁酸。然而,使用这些 DES 回收的木质素量与使用其他三个 DES 获得的量相比非常小(且无法恢复)。
3. 克拉森提取木质素的纯度测定
- 克拉森水解的样品准备
- 将滤芯(孔隙度 4,直径 4.5 mm)放在 550 °C 的消声炉中,4 小时(2 小时坡道,从 25°C 起)。当烤箱冷却到 150 °C 时,取出熔炉,将其放入干燥器中冷却并称重。
- 将大约 30 毫克的木质素加入博罗西酸玻璃管中(参见 材料表),并注意样品的重量。在样品中加入 1 mL 的 72% 硫酸 (H2SO4),将样品放在 30 °C 的浴缸中 60 分钟,然后通过漩涡每 10 分钟混合一次。
- 取出样品,将其转移到100毫升玻璃瓶中,并加入28毫升蒸馏水,将酸稀释到4%的浓度。将玻璃瓶放在高压灭菌室中,121°C 60分钟。取出玻璃瓶,让它冷却。
- 酸不溶性木质素分析
- 使用真空下的熔炉过滤水解盐。将所有固体收集在装有除离子水的玻璃瓶中。用50mL的除离子水冲洗熔炉。
- 将含有固体的熔炉在 105 °C 的烤箱中烘干 16 小时。从烤箱中取出熔炉,放入干燥器中,使其冷却。称量样品。
- 将熔炉放在 550 °C 的消声炉中,4 小时(2 小时坡道)。将其取出并放在干燥器中。称量样品。
- 使用以下公式计算酸不溶性残留物 (AIR) 的百分比:

WCSA:从烤箱中取出坩埚+样品后的重量
WC: 熔炉的重量
WCSMF:从消声炉中取出熔炉后熔炉的重量
ODW:样品的烤箱干燥重量
- 酸溶性木质素分析
- 使用石英立方块在 205 nm 的光谱光度计测量步骤 3.2.1 中获得的过滤的吸收度。将蒸馏水用作空白。
- 使用以下公式计算酸溶性残留量 (ASL) 的百分比:
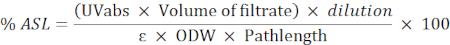
注意:吸收应在 0.2 和 0.7 之间。如有必要,稀释样品。
瑞银:吸收度在205纳米
路径长:测量单元的光路径(以厘米为内)
ε:特定波长的生物质吸收性
4. 提取木质素中的氮含量
- 碱溶液的制备
- 在2.5升的体积烧瓶中,重1公斤氢氧化钠(NaOH),并将除离子水加入标记。在烧瓶中放置一个磁条,搅拌至 NaOH 完全溶解。
- 硫酸溶液制备
- 在 5 升体积烧瓶中取 0.1 N H2SO4( 参见 材料表),将除离子水添加到 5 L 标记,放置磁条,搅拌至内容溶解。
- 接收解决方案的准备
- 在5升体积烧瓶中,溶解100克H3BO3( 玻酸)在阳离子水中,并将体积调高至标记。
- 在 100 mL 体积烧瓶中称重 100 毫克溴化物绿色,并将技术甲醇添加到标记中。
- 在 100 mL 体积烧瓶中称重 100 毫克甲基红,并将技术甲醇添加到标记中。
- 将步骤 4.3.1 的 5 升 H3BO3 溶液、步骤 4.3.2 的 100 mL 溴化物绿色溶液、步骤 4.3.3 的 70 mL 甲基红色溶液和 5 升除离子水倒入容器中。将接收解决方案摇动 30 分钟。
注:解决方案的最终颜色必须是绿色。如果颜色不是绿色,添加 50 mL 的 1 N NaOH 解决方案。
- 样品准备
- 在Kjeldahl管子中,将100毫克木质素放在无氮纸上, 加入一片 Kjeldhal (1.5 克硫酸钾 (K2SO4)+ 0.045 克硫酸铜五甲酸酯 (CuSO4.5H2O) + 0.045 克二氧化钛 (TiO2),并添加 7.2 mL 浓缩 H2SO4。
注:使用四个管子,只有无氮纸(没有样品)作为空白。
- 在Kjeldahl管子中,将100毫克木质素放在无氮纸上, 加入一片 Kjeldhal (1.5 克硫酸钾 (K2SO4)+ 0.045 克硫酸铜五甲酸酯 (CuSO4.5H2O) + 0.045 克二氧化钛 (TiO2),并添加 7.2 mL 浓缩 H2SO4。
- 样本消化
- 提前 1 小时在 360 °C 时打开沼气池上的恒温器。
- 将样品管放在架子上,将四个空白管放在机架的四个角落,并用空管填充机架的孔(如果有的话)。
- 将机架放在预热的沼气池中,盖住吸气系统,并打开水泵。
注意:注意避免烟雾:如果出现烟雾,则增加水流。 - 2小时后,关闭加热,取出样品,并将其放在金属支座上。打开吸气系统,让机架冷却约 40 分钟。
- 凯尔达尔蒸馏程序
- 打开基尔达尔蒸馏器。允许 自检 运行,直到 选择 出现在屏幕上。切换到 手动 模式,插入空管,并关闭滑动门。
- 通过在底部和顶部按几次,清除滴定毛刺 (0.02 N H2SO4) (抬起盖子),并通过挤压 H2SO4 瓶的管子消除管道中的气泡。关闭引擎盖。
- 清除H3BO3 接收解决方案3倍。
- 加入水3倍,并切换到活性蒸汽(10分钟)。切换到凯尔达尔1分析程序。使用结果线级别的箭头输入布兰科。
- 插入管子。从四个空白开始,并计算其平均值。输入 布兰科 线的价值。
注:插入管子后,设备自动并连续添加30毫升的H2O,30毫升的H3BO3和40毫升的10N NAOH。 - 在结果行中切换到滴定的 mL 。插入管子,并注意 H2SO4的使用量。
注意:要测试 Kjeldahl 蒸馏器,请考虑 50 毫克甘油对应于 18.60% ± 5% 的 N。每次滴定结束时,设备会自动清空并清洁管子。 - 计算 N 的百分比。

V.s.a : 硫酸体积
T s.a : 0.02 N H2SO4
S: 样本质量
5. 提取木质素中的灰烬含量
- 在 105 °C 时将陶瓷熔炉干燥 1 小时。 让他们在干燥器中冷却。
- 称一个熔炉,并注意其编号。加入大约1克的样品粉末。将熔炉与以下程序一起放在消声炉中:2 h 坡道高达 575 °C;575°C的4小时高原。
- 让烤箱冷却到100°C。 取出熔炉,放在干燥器中,并称重它们。
6. 碳水化合物含量
- 准备氢化钠 (纳布4) /二甲基硫化物 (DMSO) 溶液
- 将 2 克 NaBH4 放在 100 mL 体积烧瓶中,并用 DMSO 填充到标记中。在市长的浴缸中加热至 100 °C,搅拌溶液直到完全溶解。
- 混合解决方案的准备
- 将20毫克的木糖、阿拉比诺塞、黄麻、葡萄糖、甘露、曼诺和2-脱氧糖放在100mL体积烧瓶中,用去离子水填充至100mL的标记。
- 样品的水解
- 在玻色酸玻璃管中称重 50 毫克的木质素样本,加入 3 毫升 1 M H2SO4,并在 100 °C 时加热混合物 3 小时。
- 冷却样品,加入1mL的15M氢氧化铵(NH4OH),并检查pH值,以确保它是中性或碱性。在每个样品中添加完全 1 mL 的内部标准(2 脱氧糖)。
注:作为内部标准添加的 2 脱氧糖使量化样品中每个剂量的数量成为可能。
- 将单糖减为醋酸乙酸醇
- 从步骤 6.3.2 中取出 400 μL 的溶液,并将其放置在特殊管中。服用 400 μL 的控制 MIX 解决方案,并将其放置在特殊管中。
注意:使用 MIX 解决方案有助于计算响应因子 (RFs) 和单糖百分比。 - 添加第6.1节中准备的NaBH 4/DMSO解决方案的2mL。关闭管子,在水浴中以40°C孵育90分钟。从水浴中取出管子,加入0.6mL的冰川醋酸。
注意:由于这是一种外热反应,气泡和烟雾会出现。 - 加入约0.4毫升的1甲基苯丙酮和约4mL的醋酸氢化物。15分钟后,加入10mL蒸馏水,冷却,并加入~3mL的二氯甲烷(CH2Cl2)。
- 至少 2 小时后,收集下(有机)相的约 1 mL,并将其注入装有火焰电传检测器毛细细线柱 HP1-甲基西洛烷(30 米(长度) x 320 μm(内部直径)、0.25 μm(薄膜厚度)的气相色谱仪中。分析数据。
- 使用以下公式计算响应因子 (RF)。
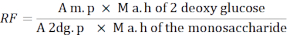
下午:MIX 解决方案中单糖峰值的平均面积
M. h 的 2 - 脱氧葡萄糖: 水解后 2 脱氧糖的质量
A 2 分。p: MIX 解决方案中 2 脱氧糖峰值的平均面积
单糖的 M a. h: 水解后单糖的质量
注:安氢校正为 0.8 为 rhamnose,0.88 为阿拉比诺酶和木糖,0.9 为曼诺斯、葡萄糖和卡拉索。水解后的质量=混合溶液中使用的单糖的氢校正x质量(g)。 - 使用以下公式计算单糖质量。

美联社。M: 分析样本中的单糖峰值区域
M. IS: 添加了大量内部标准:在这里,C SI=1毫克/千升
AP.2:样品中2-脱氧糖的峰值区域
RF:响应因子 - 使用以下公式计算每个单糖的百分比。
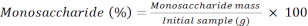
- 从步骤 6.3.2 中取出 400 μL 的溶液,并将其放置在特殊管中。服用 400 μL 的控制 MIX 解决方案,并将其放置在特殊管中。
7. 提取木质素中的化学功能(四化转化红外线)
- 要识别提取木质素中的化学功能组,请使用配备衰减总反射 (ATR) 模块的 FT-IR 光谱仪。打开光谱软件,并调整参数:分辨率4厘米-1,样本扫描时间32,背景扫描时间16,保存数据从4000到400厘米-1,结果光谱传输。
- 不要添加任何示例:新闻 背景单通道。现在将1毫克的样品放在晶体上,并按 样品单通道。处理获得的光谱。
8. 提取木质素的分子重量(凝胶渗透色谱)
- 用 0.5% 氯化锂 (LiCl) 制备二甲基甲酰胺 (DMF) 溶液。在 1 升体积烧瓶中加入 5 克 LiCl,将 DMF 添加到仪表线中,并将内容混合,直到获得同质液体。
- 在 DMF 的 3 mL 中溶解 3 毫克木质素样本,溶解 0.5% LiCl。离心机在10mL离心管中,将可溶性分数分离成小瓶。
- 溶解3毫克聚苯乙烯标准1 kDa,2 kDa,3 kDa,10 kDa,20 kDa和30千达在DMF的解决方案与0.5%LiCl。在10毫升的薄氧玻璃管中分流,并将可溶性分数转移到小瓶中。
- 准备高性能液相色谱-紫外线(UV)系统。
- 打开数据系统,检查紫外线探测器。
- 用蒸馏水净化系统。在椭流器中安装柱塞(DMF 与 0.5% LiCl)。打开净化阀,以 1 mL/min 的流速清除线路 15 分钟。停止流动并关闭清除阀。
- 将流速设置为 1 mL/min 10 分钟,以清洁通往探测器的通道。停止流速。
- 安装柱,前面有一个护栏(参见 材料表)。在 45 °C 时打开柱加热器,打开紫外线探测器,并逐渐设置流速,直到达到 0.6 mL/min 的流速。
- 以270 nm的波长注入每个样品的30μL40分钟。处理获得的数据,并使用校准线计算质量分布。
- 计算平均分子量 (Mn)、体重平均分子量 (Mw) 和多散率指数 (PDI)。


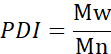
米:链条的分子量
Ni: 分子量的链条数量
9. 数据处理和统计分析
- 在三脚架中执行所有分析实验,并将结果表示为干物质的百分比。
- 对方差 (ANOVA) 进行单向分析,并使用 Tukey 的多重比较测试比较方法。
- 执行主要组件分析 (PCA)。
结果
图2A-C描绘了在混合微波-DES预处理后从图1A-F中显示的六种原料中提取的木质素产量。结果表明,DES1(ChCl-草酸)(图2A)获得的木质素产量低于DES2(氯化物酸)和DES3(ChCl-尿素)(图2B,C)获得的产量。此外,松果(PC)和橄榄波玛斯(OP)的木质素产量分别高于DES1治疗的32.31%和26.04%,DES3的木质素产量分别为48.72%和43.76%。阿尔法叶(A)的木质素产量明显高于用DES2提取的所有其他木质素的产量。图3A-C显示,在生物质的三种预处理中,木质素纯度超过70%,除了DES3在DES3(ChCl-尿素)处理中预处理阿尔法叶(A)、藻类(Ag)和杏仁壳(AS),其木质素纯度为65%。最高的木质素纯度(>90%)获得与DES1治疗:藻叶(A)94%,杏仁壳(AS)93%,松果(PC)90%,波西多尼亚叶(PL)92%,橄榄波玛斯(OP)91%。
通过考虑两个参数(产量和纯度)和18种处理方法,对木质素纯度和产量数据进行了主要成分分析( PCA)。 图4 显示相关性圆解释了总变异的100%。第一个组件 PCA1 解释了 58.09%,第二个组件 PCA2 解释了总变异的 41.91%。木质素纯度与DES1(牛)治疗呈正相关。皮尔逊相关系数 (R) 分别为阿尔法 (A Ox) 0.32、橄榄痘 (OP Ox) 0.27、松果 (PC Ox) 0.2、波西多尼亚叶 (PL Ox) 0.35、杏仁壳 (AS Ox) 0.32 和艾加罗皮 (Ag Ox) 0.05。然而,DES3治疗与木质素产量呈负相关,R值在0.37−至0.05−之间振荡。因此,PCA结果证实,用DES1提取的木质素是最纯净的,产量最低。
木质素的特点是其糖,氮和灰含量(图5A-C)。总含糖量由气相色谱 (GC) 确定。使用DES3(ChCl-尿素)提取的木质素中的碳水化合物含量最高(6-15%)。其次是使用DES2(ChCl-乳酸)提取的木质素,其碳水化合物含量为3-12%。然而,碳水化合物含量最低 (1%)据报道,使用DES1(ChCl-草酸)提取的木质素。已识别的糖的种类差异很大(图6A-C):D-木糖和D葡萄糖是最丰富的单糖。这些结果表明,DES1在提取木质素时与其他两个DES相比具有极高的选择性,这两种DES不仅提取了木质素,还提取了碳水化合物。换句话说,用乳酸和尿素DES提取后,木质素的纯度较低。
DES1将木质细胞基质和提取纯木质素分割的高选择性可能是因为它的氢键(阿尔法 =1.3)的高酸度。氯化物含有氯化物离子,这些离子会破坏氢键的内在相互作用,而草酸中的碳水化合物组有助于溶解木质聚合物。同样,使用DES1提取的木质素的氮含量低于使用DES2和DES3提取的木质素的氮含量,最高可达3%(图5A-C)。从阿尔法叶中提取的木质素的氮含量最高:DES1、DES2和DES3分别为2.70、3.84和3.40。这些结果证明,氮化合物被提取并与木质素共同沉淀。此外,所有样品中的木质素钙化表明,使用DES2和DES3提取的木质素比使用DES1提取的木质素含有更高的无机成分。
结果表明,DES1促进了高纯度、低氮、碳水化合物和低灰含量的木质素的提取。换句话说,使用DES1(ChCl-草酸)提取的木质素比使用DES2(ChCl-乳酸)和DES3(ChCl-尿素)提取的褐金更纯净,后者具有较低的纯度和高氮、碳水化合物和灰烬含量。 表1 总结了木质素的分子质量分布,通过凝胶渗透色谱 (GPC) 分析,以平均分子量 (Mn)、体重平均分子量 (Mw) 和多散分指数 (PDI) 为代表。Mw 值范围从 48,123 到 147,233 g 熔醇-1。DES2从阿尔法叶、杏仁壳和藻类中提取的木质素的PDI低于DES1、DES3和碱提取的木质素以及生木质素。相比之下,DES2从松果、橄榄果和波西多尼亚叶中提取的木质素的PDI较高。从高分子中提取的木质素PDI较低,表明其分子量比从其他生物量中提取的木质素更均匀。
提取木质素中的化学功能组由FTIR光谱仪(图7A-F)调查。3,441 至 3,198 厘米-1之间的强宽波段归因于参与氢粘接的酒精和酚类羟基群的 OH 拉伸振动。波数范围内的信号范围为 2,963-2,852 厘米-1被分配到烷基 C-H 拉伸振动。橄榄花、阿尔法叶和杏仁壳表现出比其他生物量更强烈的带状。没有观察到2,800至1,800厘米-1的波段。DES1 和 DES2 治疗获得的木质素的上升带为 1,708 厘米-1,这表明存在未受损害的 C+O 组。然而,这个信号在溶剂光谱(图8B)中不存在。乳酸和草酸光谱的特点是带在1,737-1,723厘米-1范围内,这表明存在未受征服的C+O组,而尿素光谱的特点是两个信号在波数范围1,660厘米-1和1,604厘米-1归因于阿米德组。DES1 和 DES2 处理提取的木质素中观察到1,606-1,618 厘米 -1的带状物,与环状 C=C 拉伸相关。
DES3提取的木质素在1,640厘米-1的信号表明,在木质素的结合碳基群中存在C+O拉伸振动。1516 cm-1的信号来自木质素中芳香环的振动,而1200cm-1的波段表示乙醚组的存在。波数范围为1,250-1,200厘米-1的波段被分配到非芳香酒精的C-O伸展。953 厘米-1 的带子被分配到甲基替代物中。结果表明,DES-lignin分数光谱显示信号分别为1,730-1,702厘米-1和1,643-1,635厘米-1,分别分配给未结合和共振碳基组的拉伸振动。然而,这些带范围在三个商业木质素中不存在:生木、苏打水加工和碱提取木质素(图8A)。这一观察表明,在提取和溶解过程中,一些功能组的木质素与草酸和乳酸结合。

图1:地中海生物质研究。 (A) 杏仁壳, (B) 橄榄松, (C) 锥松, (D) 艾加罗皮勒 (波西多尼亚球), [E) 波西多尼亚叶, (F) 阿尔法叶. 请单击此处查看此图的较大版本。

图2:木质素产量。 (A) 氯化胆碱 + 氧化酸 (DES1), (B) 胆碱氯化物 + 乳酸 (DES2), (C) 胆碱氯化物 + 尿素 (DES3).通过单向 ANOVA 和费舍尔的临时测试 (*P < 0.05; **P < 0.01; ***P < 0.001) 确定了显著差异。缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:ns=不显著。 请单击此处查看此图的较大版本。
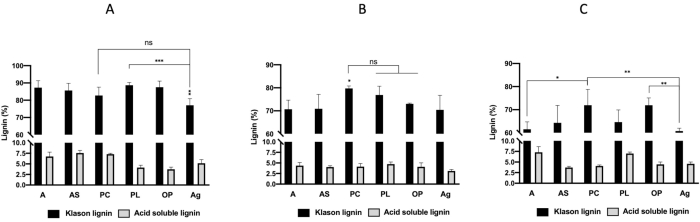
图3: 木质素 (%)( A) 氯化胆碱 + 氧化酸 (DES1),(B)胆碱氯化物 + 乳酸 (DES2),(C) 胆碱氯化物 + 尿素 (DES3)。通过单向 ANOVA 和费舍尔的临时测试(*P < 0.05;**P < 0.01;***P < 0.001)确定了显著差异。缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:ns=不显著。 请单击此处查看此图的较大版本。

图4:从地中海生物质中提取的木质素的产量和纯度的主要成分分析。 氢债券接受者 (HBA) 是胆碱氯化物 (ChCl), 氢键捐赠者 (HBD) 是牛 = 草酸, 乳酸和尿素。PCA=主要组件分析:A= 阿尔法叶, AS = 杏仁壳, PC = 松果, Pl = 波西多尼亚叶, Op = 橄榄花, Ag = 艾加罗皮勒。 请单击此处查看此图的较大版本。

图5:碳水化合物 (%)、 氮 (%)和灰含量 (%)在木质素样品中。 (A) 氯化胆碱 + 氧化酸 (DES1)、 (B) 胆碱氯化物 + 乳酸 (DES2)、 (C) 胆碱氯化物 + 尿素 (DES3)。通过单向 ANOVA 和费舍尔的临时测试 (*P < 0.05; **P < 0.01; ***P < 0.001) 确定了显著差异。缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:ns=不显著。 请单击此处查看此图的较大版本。

图6:木质素样品中单糖的鉴定(%)。(A) 氯化胆碱 + 氧化酸 (DES1)、 (B) 胆碱氯化物 + 乳酸 (DES2)、 (C) 胆碱氯化物 + 尿素 (DES3)。通过单向 ANOVA 和费舍尔的临时测试 (*P < 0.05; **P < 0.01; ***P < 0.001) 确定了显著差异。缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:ns=不显著。 请单击此处查看此图的较大版本。

图7:木质素样品的四变红外光谱。 (A) 阿尔法叶, [B) 杏仁壳 , [C) 松果, [D[ 波西多尼亚叶 , [E) 橄榄花 , (F) 艾加罗皮。缩写: DES1 = 氯胆碱 + 氧化酸, DES2 = 胆碱氯化物 + 乳酸, DES3 = 胆碱氯化物 + 尿素。 请单击此处查看此图的较大版本。

图8:四变红外光谱。(A)木质素控制,(B)氢键捐赠者。请单击此处查看此图的较大版本。
| 样本 | 治疗 | 锰 | 兆瓦 | PDI |
| 一 | 尿素 | 47558 | 120141 | 2.5 |
| 紫胶 | 35241 | 73665 | 2.1 | |
| 牛 | 35793 | 84312 | 2.4 | |
| 如 | 尿素 | 50181 | 105817 | 2.1 |
| 紫胶 | 60409 | 104915 | 1.7 | |
| 牛 | 83112 | 147233 | 1.8 | |
| 个人电脑 | 尿素 | 34013 | 65181 | 1.9 |
| 紫胶 | 55513 | 145963 | 2.6 | |
| 牛 | 46409 | 102298 | 2.2 | |
| PL | 尿素 | 25696 | 50093 | 1.9 |
| 紫胶 | 45530 | 122900 | 2.7 | |
| 牛 | 28427 | 70726 | 2.5 | |
| 操作 | 尿素 | 29669 | 70424 | 2.4 |
| 紫胶 | 26735 | 66743 | 2.5 | |
| 牛 | 34161 | 75509 | 2.2 | |
| 银 | 尿素 | 30184 | 48123 | 1.6 |
| 紫胶 | 33835 | 52123 | 1.5 | |
| 牛 | 30025 | 49808 | 1.7 | |
| 控制 | 生木质素 | 23275.3 | 36496.5 | 1.6 |
| 碱提取木质素 | 22792.6 | 43014.3 | 1.9 |
表1:木质素的分子量。 缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:Mn = 平均分子量:Mw = 体重平均分子重量;PDI = 多散度指数;牛 =草酸;乳酸=乳酸。
图S1:木质素。 请单击此处下载此文件。
图S2:自采后的样品(30毫克木质素+1毫克72%硫酸+28毫升蒸馏水)。 请单击此处下载此文件。
图S3:木质颗粒。 请单击此处下载此文件。
图S4:固体残留物洗了四次,以恢复最大的木质素含量。 请单击此处下载此文件。
图S5:凝胶渗透铬图的木质素控制,生和碱提取的木质素。 请单击此处下载此文件。
图S6:木质素样品的凝胶渗透色谱图。 缩写:A=阿尔法叶,AS=杏仁壳,PC=松果,PL=波西多尼亚叶,OP=橄榄果,Ag=艾加罗皮勒:DES1=氯化胆+氧化物,DES2=胆碱氯化物+乳酸,DES3=胆碱氯化物+尿素。请单击此处下载此文件。
图S7:深乳酸溶剂(DES)-木质素提取微波过程的流单。 请单击此处下载此文件。
讨论
这项研究有许多目标:首先是准备和使用具有离子液体和有机溶剂特性的低成本绿色溶剂。第二个目标是将生物量分成一步,提取木质素,而不需要初步步骤,例如使用碱性溶剂、基本或热物理技术使用 Soxhlet 或半纤维素提取可提取物。第三个目标是在治疗后通过简单的过滤来恢复木质素,无需调整pH度,而只需加入蒸馏水即可。使用微波辅助的基于 DES 的工艺从六种不同来源超高速提取木质素的结果表明,提取产量可能因 DES 的生物量和性质而异。例如,所有三种DES中木质素提取的最高产量来自橄榄波玛斯。其次是藻叶、松果和杏仁壳的产量。 波西多尼亚海洋的叶子和球的提取产量较低。
使用克拉森、凯尔达尔(氮)、碳水化合物(GC)和灰烬方法评估木质素的纯度。如图3和图5A-C所述,由于氮、碳水化合物和灰成分与木质素的共降水,木质素的纯度下降。与DES1的木质素提取条件确保了高纯度,但产量低,表明过程改进对于木质素的产量和纯度之间的正相关性是必要的。如果治疗时间较长,微波功率从800 W增加到1200W,或固体:溶剂(1:10)的比例降低,木质素产量可以提高。木质素分子量数据提供了治疗后木质素片段分离或再聚合的见解。使用微波-DES提取后,观察到生物量的木质素Mw增加, 例如,在Posidonia叶的情况下(Mw是DES3的50093,DES1是70726),这表明去聚合发生在木质素提取过程中,随后在DES的行动下迅速重新合并碳-碳互联。这需要使用捕获剂(如甲醛)来稳定部署。
在DES预处理中,木质素分离和凝结是两种相互竞争的反应。提取的木质素的PDI低于17号文献中报道的有机溶剂(乙醇/水/H2SO4)提取的山毛虫木质素。这表明,与有机溶剂治疗相比,DES治疗提高了木质素的分子量均匀性。FTIR 光谱表明,木质素功能组受使用 DES 溶剂的影响。Spectra 显示的信号为 1,730-1,702 厘米-1,分配给未受伤害的碳基组的拉伸振动,而峰值为 1,643-1,635 厘米-1表示共聚碳基组的拉伸振动。这些结果表明,有可能从地中海生物质中提取高纯度的高纯度高附加值木质素(目前被低估,用作饲料或土壤修正),并有助于确定最佳的DES溶剂,同时确保木质素的纯度。例如,DES1 展示了木质素最纯净的提取,尽管其产量低于使用其他两个 DES 观察到的产量。
由于成本低廉且绿色的ChCl-草酸深乳酸溶剂系统,建议的方法很容易应用。氯化胆是一种有机盐,草酸是植物的天然产品,成本低廉。该技术(一种超快协议,一步提供生物质分馏和高纯度木质素回收)适用于任何类型的木质细胞生物量,其化学成分与实验室规模上使用微波-DES工艺或使用DES超声波过程或对流加热在试验尺度上研究的化学成分相似。
披露声明
作者报告没有利益冲突。
致谢
MK 和 TB 感谢海瑟姆 ·阿耶布的统计分析和数字准备,瓦隆地区(欧洲区域发展-VERDIR)和高等教育和科学研究部长(陶菲克·贝塔伊布)提供资金。
材料
| Name | Company | Catalog Number | Comments |
| HPLC Gel Permeation Chromatography | Agilent 1200 series | ||
| 1 methylimadazole | Acros organics | ||
| 2-deoxy-D-glucose (internal standard) | Sigma Aldrich (St. Louis, USA) | ||
| Acetic acid | Sigma Aldrich (St. Louis, USA) | ||
| Acetic anhydride | Sigma Aldrich (St. Louis, USA) | ||
| Adjustables pipettors | |||
| Alkali | alkali-extracted lignin | ||
| Arabinose (99%) | Sigma Aldrich (St. Louis, USA) | ||
| Autoclave | CERTO CLAV (Model CV-22-VAC-Pro) | ||
| Water Bath at 70 °C | |||
| Boric acid | Sigma Aldrich (St. Louis, USA) | ||
| Bromocresol | Sigma Aldrich (St. Louis, USA) | ||
| Catalyst | CTQ (coded A22) (1.5 g K2SO4 + 0.045 g CuSO4.5 H2O + 0.045 g TiO2) | Merck | |
| Centrifugation container | |||
| Centrifuge | BECKMAN COULTER | Avanti J-E centrifuge | |
| Ceramic crucibles | |||
| Choline chloride 99% | Acros organics | ||
| Column | Agilent PLGel Mixed C (alpha 3,000 (4.6 × 250 mm, 5 µm) preceded by a guard column (TSK gel alpha guard column 4.6 mm × 50 mm, 5 µm) | ||
| Column | HP1-methylsisoxane (30 m, 0.32 mm, 0.25 mm) | ||
| Crucible porosity N°4 ( Filtering crucible) | Shott Duran Germany | boro 3.3 | |
| Deonized water | |||
| Dessicator | |||
| Dimethylformamide | VWR BDH Chemicals | ||
| Dimethylsulfoxide | Acros organics | ||
| Erlenmeyer flask | |||
| Ethanol | Merck (Darmstadtt, Germany) | ||
| Filtering crucibles, procelain | |||
| Filtration flasks | |||
| Fourrier Transformed Inra- Red | Vertex 70 Bruker apparatus equipped with an attenuated total reflectance (ATR) module. Spectra were recorded in the 4,000–400 cm−1 range with 32 scans at a resolution of 4.0 cm−1 | ||
| Galactose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Gaz Chromatography | Agilent (7890 series) | ||
| Glass bottle 100 mL | |||
| Glass tubes ( borosilicate) with teflon caps 10 mL | |||
| Glucose (98% | Sigma Aldrich (St. Louis, USA) | ||
| Golves | |||
| Graduated cylinder 50 mL /100 mL | |||
| H2SO4 Titrisol (0.1 N) | Merck (Darmstadtt, Germany) | ||
| H2SO4 (95-98%) | Sigma Aldrich (St. Louis, USA) | BUCHI R-114) | |
| Hummer cutter equiped with 1 mm and 0.5 mm sieve | Mill Ttecator (Sweden) | Cyclotec 1093 | |
| Indulin | Raw lignin control | ||
| Kjeldahl distiller | Kjeltec 2300 (Foss) | ||
| Kjeldahl tube | FOSS | ||
| Kjeldhal rack | |||
| Kjeldhal digester | Kjeltec 2300 (Foss) | ||
| Kjeldhal suction system | |||
| Lab Chem station Software | GC data analysis | ||
| Lactic acid | Merck (Darmstadtt, Germany) | ||
| Lithium chloride LiCl | Sigma Aldrich (St. Louis, USA) | ||
| Mannose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Methyl red | |||
| Microwave | START SYNTH MILESTONE Microwave laboratory system | ||
| Microwave temperature probe | |||
| Microwave container | |||
| Muffle Furnace | |||
| NaOH | Merck (Darmstadtt, Germany) | ||
| Nitrogen free- paper | |||
| Opus | spectroscopy software | ||
| Oven | GmbH Memmert SNB100 | Memmert SNB100 | |
| Oxalic acid | VWR BDH Chemicals | ||
| P 1000 | Soda-processed lignin | ||
| pH paper | |||
| precision balance | |||
| Infrared spectroscopy | |||
| Quatz cuvette | |||
| Rhamnose (98%) | Sigma Aldrich (St. Louis, USA) | ||
| Rotary vacuum evaporator | Bucher | ||
| Round-bottom flask 500 mL | |||
| sodium borohydride NaBH4 | |||
| Schott bottle | glass bottle | ||
| Sovirel tubes | sovirel | Borosilicate glass tubes | |
| Spatule | |||
| Special tube | |||
| Spectophotometer | UV-1800 Shimadzu | ||
| Sterilization indicator tape | |||
| Stir bar in teflon | |||
| Stirring plate | |||
| Syringes | |||
| Sodium borohydride | Sigma Aldrich (St. Louis, USA) | ||
| Titrisol | Merck | Merck 109984 | 0.1 N H2SO4 |
| Urea | VWR BDH Chemicals | ||
| Vials | |||
| VolumetriC flask 2.5 L /5 L | Bucher | ||
| Vortex | |||
| Xylose (98%) | Sigma Aldrich (St. Louis, USA) |
参考文献
- Kammoun, M., et al. Hydrothermal dehydration of monosaccharides promoted by seawater fundamentals on the catalytic role of inorganic salts. Frontiers in Chemistry. 7, 132(2019).
- Kammoun, M., Ayeb, H., Bettaieb, T., Richel, A. Chemical characterisation and technical assessment of agri-food residues, marine matrices, and wild grasses in the South Mediterranean area: A considerable inflow for biorefineries. Waste Management. 118, 247-257 (2020).
- Zhang, C. W., Xia, S. Q., Ma, P. Facile pretreatment of lignocellulosic biomass using deep eutectic solvents. Bioresource Technology. 219, 1-5 (2016).
- Mora-Pale, M., Meli, L., Doherty, T. V., Linhardt, R. J., Dordick, J. S. Room temperature ionic liquids as emerging solvents for the pretreatment of lignocellulosic biomass. Biotechnology and Bioengineering. 108 (6), 1229-1245 (2011).
- Chen, Z., Wan, C. Ultrafast fractionation of lignocellulosic biomass by microwave-assisted deep eutectic solvent pretreatment. Bioresource Technologie. 250, 532-537 (2018).
- Francisco, M., Van Den Bruinhorst, A., Kroon, M. C. New natural and renewable low transition temperature mixtures ( LTTMs ): screening as solvents for lignocellulosic biomass processing. Green Chemistry. 14 (8), 2153-2157 (2012).
- Liu, Y. C., et al. Efficient cleavage of lignin - carbohydrate complexes and ultrafast extraction of lignin oligomers from wood biomass by microwave-assisted treatment with deep eutectic solvent. Chem sus chem. 10, 1692-1700 (2017).
- Xu, G. C., Ding, J. C., Han, R. Z., Dong, J. J., Ni, Y. Enhancing cellulose accessibility of corn stover by deep eutectic solvent pretreatment for butanol fermentation. Bioresource Technologie. 203, 364-369 (2016).
- Jablonský, M., Andrea, Š, Kamenská, L., Vrška, M., Šima, J. Deep eutectic solvents fractionation of wheat straw deep eutectic solvents fractionation of wheat straw. Bioresources. 10 (4), 8039-8047 (2015).
- Shen, X. J., et al. Facile fractionation of lignocelluloses by biomass-derived deep eutectic solvent (DES) pretreatment for cellulose enzymatic hydrolysis and lignin valorization. Green Chemistry. 21, 275-283 (2019).
- Alvarez-Vasco, C., et al. Unique low-molecular-weight lignin with high purity extracted from wood by deep eutectic solvents (DES): a source of lignin for valorization. Green Chemistry. 18, 5133-5141 (2016).
- Banu, J. R., et al. A review on biopolymer production via lignin valorization. Bioresource Technologie. 290, 121790(2019).
- Gordobil, O., Olaizola, P., Banales, J. M., Labidi, J. Lignins from agroindustrial by-products as natural ingredients for cosmetics chemical structure and in vitro sunscreen and cytotoxic activities. Molecules. 25 (5), 1131(2020).
- Lee, C. S., Thu Tran, T. M., Weon Choi, J., Won, K. Lignin for white natural sunscreens. International Journal of Biological Macromolecules. 122, 549-554 (2019).
- Widsten, P. Lignin-based sunscreens-state-of-the-art, prospects and challenges. Cosmetics. 7, 85(2020).
- Qian, Y., Qiu, X., Zhu, S. Lignin: a nature-inspired sun blocker for broad-spectrum sunscreens. Royal Society of Chemistry. 17, 320-324 (2015).
- Zijlstra, D. S., et al. Extraction of lignin with high β-O-4 content by mild ethanol extraction and its effect on the depolymerization yield. Journal of Visualized Experiments. (143), e58575(2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。