Method Article
Успешная визуализация кальция In vivo с миниатюрным микроскопом Head-Mount в миндале свободно ведя себя мышью
В этой статье
Резюме
Микроэндоскопическая визуализация кальция In vivo является бесценным инструментом, позволяющим в режиме реального времени контролировать нейронную активность у свободно ведя себя животных. Однако применение этого метода к миндалинам было трудно. Этот протокол призван обеспечить полезное руководство для успешного ориентации клеток миндалины с миниатюрным микроскопом у мышей.
Аннотация
In vivo в режиме реального времени мониторинга нейронной деятельности в свободно движущихся животных является одним из ключевых подходов к увязки нейронной активности с поведением. Для этого разработана и успешно применена технология визуализации in vivo, которая обнаруживает переходный кальций в нейронах с использованием генетически закодированных показателей кальция (GECIs), миниатюрный флуоресцентный микроскоп и градиентный рефракционный индекс (GRIN) объектив1,2,3,4,5,6. Этот метод визуализации является особенно мощным, поскольку он позволяет хронической одновременной визуализации генетически определенных популяций клеток в течение длительного периода до нескольких недель. Хотя это полезно, этот метод визуализации не был легко применен к структурам мозга, которые находят глубоко в головном мозге, таких как миндалина, существенная структура мозга для эмоциональной обработки и ассоциативнойпамяти страха 7. Есть несколько факторов, которые делают его трудно применить технику визуализации миндалины. Например, артефакты движения обычно встречаются чаще во время визуализации, проводимой в более глубоких областях мозга, потому что микроскоп, имплантированный глубоко в мозг, относительно нестабилен. Другая проблема заключается в том, что боковой желудочек расположен близко к имплантированному объективу GRIN, и его движение во время дыхания может вызвать крайне нерегулярные артефакты движения, которые не могут быть легко исправлены, что затрудняет формирование стабильного изображения. Кроме того, поскольку клетки миндалины, как правило, тихие в состоянии покоя или анестезии, трудно найти и сфокусировать целевые клетки, выражаюющие GECI в миндалинах во время процедуры основания для более поздней визуализации. Этот протокол обеспечивает полезное руководство о том, как эффективно целевых клеток, выражаюющих GECI в миндалинах с головой монтажа миниатюрный микроскоп для успешного in vivo кальция изображения в такой глубокой области мозга. Отмечается, что данный протокол основан на конкретной системе (например, Inscopix), но не ограничивается ею.
Введение
Кальций является вездесущим второй посланник, играя решающую роль почти в каждой клеточнойфункции 8. В нейронах, потенциал действия стрельбы и синаптических входных вызвать быстрое изменение внутриклеточного свободного "Ca2"9,10. Таким образом, отслеживание преходящих кальция дает возможность контролировать активность нейронов. GECIs являются мощными инструментами, которые позволяют для мониторинга«Ca 2»в определенных популяциях клеток ивнутриклеточных отсеков 11,12. Среди многих различных типов белка на основе кальция индикатор, GCaMP, Ca2 "зонд на основе одной молекулы GFP13, является наиболее оптимизированным и, таким образом, широко используется GECI. Благодаря нескольким инженерным раундам, ряд вариантов GCaMP былразработан 12,14,15,16. Мы используем один из недавно разработанных GCaMPs, GCaMP7b, в этом протоколе16. Датчики GCaMP в значительной степени способствовали изучению функций нейронных цепей в ряде модельныхорганизмов, таких как визуализация переходных элементов Ca 2 во время развития17, виво изображения в определенном корковомслое 18, измерение динамики цепи вдвигательной задаче обучения 19 и визуализации активности клеточного ансамбля,связанные с ассоциативной памятью страхав гиппокампе и миндалинах 20,21.
Оптическая визуализация GECIs имеет ряд преимуществ22. Генетическое кодирование позволяет ГЕКИ быть четко выражены в течение длительного периода времени в определенном подмножестве клеток, которые определяются генетическим профилем или конкретными моделями анатомических связей. Оптическая визуализация позволяет in vivo хронический одновременный мониторинг сотен и тысяч нейронов у живых животных. Несколько оптических систем визуализации были разработаны для in vivo изображения и анализа GECIs в головном мозге свободно ведет себя мышей с головой монтаж миниатюрныхфлуоресцентных микроскопов 21,23,24,25. Несмотря на метод оптической визуализации in vivo, основанный на GECIs, объектив GRIN и миниатюрный микроскоп, установленный на голове, является мощным инструментом для изучения связи между активностью нейронной цепи и поведением, применение этой технологии к миндалинам было трудно из-за нескольких технических проблем, связанных с таргетингом объектива GRIN на клетки, выражаюющие ГЕКИ в миндалинах, не вызывая эффектных артефактов, которые серьезно снижают качество изображения и находят клетки, выражают Этот протокол призван обеспечить полезное руководство для хирургических процедур вложения базовой пластины и имплантации объектива GRIN, которые являются важнейшими шагами для успешного виво оптической визуализации кальция в миндалинах. Хотя этот протокол нацелен на миндалины, большинство процедур, описанных здесь, как правило, применимы к другим более глубоким областям мозга. Хотя этот протокол основан на определенной системе (например, Inscopix), та же цель может быть легко достигнута с другими альтернативными системами.
протокол
Все процедуры были одобрены Комитетом по этике животных в Корейском передовом институте науки и техники. Все эксперименты проводились в соответствии с руководящим принципом Комитета по уходу и использованию животных.
ПРИМЕЧАНИЕ: Этот протокол состоит из шести основных этапов: операция по инъекциям вируса, операция по имплантации объектива GRIN, проверка имплантации объектива GRIN, вложение базовой пластины, оптическая запись сигнала GCaMP во время теста на поведение и обработка данных(рисунок 1A). За исключением хирургии, используется коммерческий пакет программного обеспечения (Inscopix).
1. Стереотаксисная хирургия - инъекция вируса AAV
ПРИМЕЧАНИЕ: Штамм мыши, используемый в этой хирургической процедуре C57BL6/J. Тело животного покрыто стерильной драпировкой во время операции, а все этапы в протоколе выполняются в стерильных перчатках. Несколько операций, как правило, не выполняются в тот же день. Однако, если несколько мышей должны иметь такую же хирургию в такой же день, то используйте отдельный комплект autoclaved хирургических инструментов для каждой мыши и 70% этанола для того чтобы дезинфицировать хирургические аппаратуры между мышами. Чтобы держать мышь теплой во время хирургической процедуры, мышь покрыта заказным хирургическим одеялом после стремления к стереотаксиам.
- Дезинфицировать все необходимые хирургические инструменты с 70% этанола, и подготовить шприц Гамильтона и стеклянную пипетку. Заполните стеклянную пипету дистиллированной водой.
ПРИМЕЧАНИЕ: Все хирургические инструменты, используемые в протоколе, автоматически используются. Поскольку линзы GRIN и винты черепа не могут быть автоматически использованы для стерилизации, 70% этанола используется в качестве дезинфицирующего средства для предотвращения воспаления. Хотя это и не опробовано, могут использоваться и другие формы стерилизации, например, газ или химическая стерилизация. - Обезболивать мышь пентобарбиталом (83мг/кг -1 массы тела) путем внутриперитонеальной инъекции. После того, как мышь теряет сознание, побрить мех на черепе.
- Очистите кожу над черепом с 70% этанола и исправить мышь к стереотаксисной раме. Аккуратно удалите кожу и протрите поверхность черепа раствором перекиси водорода 35% с помощью аппликатора из хлопка. Нанесите смазку глаз мазь для предотвращения высыхания роговицы во время операции.
ПРИМЕЧАНИЕ: Хотя обычно нет никаких проблем с использованием 70% этанола только для асептического приготовления кожи, рекомендуется использовать 3 чередующихся раундов дезинфицирующих средств, таких как иодофоры или хлоргексидин раствор, и 70% этанола. Более высокая концентрация перекиси водорода используется в этом протоколе, чтобы убедиться, что соединительная ткань на черепе мыши удаляется как можно более полностью, что имеет решающее значение для уменьшения движения артефакта во время более поздних изображений, потому что соединительная ткань на черепе мешает твердое присоединение основания к черепу. Следует отметить, что 35% перекиси водорода намного выше, чем то, что обычно используется (3%). - Зафиксировать штифт с помощью стереотаксийного держателя зонда. Выровнять высоту брегмы и лямбды с булавкой.
- Найдите конкретное местоположение на черепе мыши для краниотомии.
ПРИМЕЧАНИЕ: Координаты боковой миндалины (LA) для инъекций вируса (AP, ML, DV) --1,6 мм, -3,5 мм, -4,3 мм) от брегмы в этом протоколе (AP; Передний-задний, ML; Медиа-боковой, DV; Dorsal-Ventral, каждая аббревиатура указывает на относительное axial расстояние от брегмы)26. Координаты должны быть оптимизированы для каждого экспериментального состояния. - Просверлите поверхность черепа(рисунок 1B). Вымойте фракции черепа фосфатным буферным солевым раствором (PBS). Удалите оставшийся слой с помощью типсов или иглы 27 G.
- При бурении черепа старайтесь не трогать последний слой дуры, чтобы избежать повреждения поверхности ткани мозга. Поврежденная поверхность мозга вызывает воспаление вокруг объектива, что вызывает серьезные артефакты движения и высокую аутофторесценцию во время записи. Размер краниотомии составляет 1,6 мм. Скорость бурения составляет 18 000 об/мин, а размер бита - 0,6 мм.
- Для снижения объектива GRIN от поверхности мозговой ткани пробуреного участка до места целевой миндалины вычислите расстояние, названное "Значение А", вычитая разницу DV между брегмой и открытой поверхностью мозга из координат DV имплантации объектива, которая устанавливается на основе брегмы (4,2 мм в данном случае, рисунок 1C).
- Загрузите 3 мл минерального масла и 0,7 МЛ раствора вируса AAV в стеклянной пипетки.
ПРИМЕЧАНИЕ: Минеральное масло помогает отделить раствор вируса и воду. 0,7 Л является оптимизированным объемом для инъекций вируса Лос-Анджелеса, который может полностью покрыть Лос-Анджелес. - Снимите штифт со стереотаксийного держателя зонда и закрепите к нему стеклянную пипетку.
- Найдите стеклянную пипетут в месте инъекции, упомянутом в шаге 1.5. Вставьте стеклянную пипетку в ткани мозга после кровотечения полностью остановлена.
- Доставка вируса через стеклянную пипетку с помощью инъекционного насоса.
ПРИМЕЧАНИЕ: Рейтер вируса должен быть выше 1 х 1013 вг/мл, чтобы получить достаточное количество GCaMP экспресс-клеток. Скорость впрыска составляет 0,1 мкл/мин и рассеивается в течение 10 мин. Если есть кровотечение, мыть поверхность мозга с PBS. Держите поверхность мозга мокрой в этом шаге. - После окончания инъекции, удалить стеклянную пипетку медленно.
2. Стереотаксисная хирургия - имплантация объектива GRIN
ПРИМЕЧАНИЕ: GRIN линзы имплантата хирургии является наиболее важным шагом в этом протоколе. Так как последовательная медленная скорость движения объектива GRIN имеет решающее значение для успешной имплантации объектива GRIN, моторизованная рука хирургии может быть полезна. Моторизованная хирургия руки стереотаксис манипулятор, который контролируется компьютерным программным обеспечением. Хотя моторизованная рука используется в этом протоколе, другие способы также могут быть использованы до тех пор, как объектив движется последовательно и медленно во время имплантации. Подробная информация об устройстве находится в таблице материалов.
- Просверлите череп, чтобы имплантировать два винта черепа. Вымойте все фракции черепа с ПОМОЩЬЮ PBS.
ПРИМЕЧАНИЕ: Чтобы уменьшить движение артефактов в более поздних оптических изображений, по крайней мере два винта не требуется. Два винта черепа и положение имплантата объектива GRIN образуют равносторонний треугольник(рисунок 1B). Размер краниотомии должен плотно соответствовать диаметру винта. Если есть кровотечение, мыть кровоточащей поверхности с PBS. Скорость бурения составляет 18 000 об/мин, а размер бита - 0,6 мм. - Дезинфицировать винты с 70% этанола для предотвращения воспаления. Имплантировать винты как можно глубже.
ПРИМЕЧАНИЕ: Винты должны быть плотно закреплены без дополнительной адгезии, такой как цемент. - Установите моторизованную руку хирургии на стереотаксисную раму. Подключите необходимое оборудование к ноутбуку, на котором установлено контролируемое программноеобеспечение (Таблица материалов).
- Перед тем, как опускать объектив GRIN, приготовьтесь сделать игольчатую дорожку с иглой 26 G.
ПРИМЕЧАНИЕ: Игла трек является своего рода руководство трек, который помогает имплантации относительно толстый объектив GRIN в глубоких областях мозга, таких как миндалина, не вызывая серьезного искажения структуры мозга вдоль пути инъекции. Этот направляющий трек называется иглой трек, потому что это сделано путем снижения и подъема процедуры относительно тонкой иглы 26 G. - Прикрепите держатель канюли, чтобы ударить по игле на стереотаксисной раме.
- Захвати 26 G иглы с держателем канюлы и вычислить координаты места вставки иглы.
ПРИМЕЧАНИЕ: В этом протоколе координаты места вставки иглы находятся на 50 мкм боковой от места инъекции вируса (AP, ML, DV) --1,6 мм, -3,55 мм, -3,7 мм). - Доступ к программному обеспечению для управления и полная подготовка к манипулированию положением иглы.
- Запустите программное обеспечение для управления и выберите кнопку «Пуск нового проекта», чтобы начать сеанс управления.
ПРИМЕЧАНИЕ: В сеансе управления есть несколько пустых коробок и кнопок меню. Пустые ящики являются входным пространством для координат. После ввода координат в пустых коробках моторизованная стереотаксисная рука движется, нажав кнопку Go To. Кнопка Go To изменяется в кнопку STOP, когда стереотаксисная рука движется. Среди нескольких кнопок меню в этом протоколе требуется только кнопка «Инструмент». - Нажмите кнопку инструмент. Калибруйте программное обеспечение управления, нажав кнопку «Калибруйте» меню кадра. Калибровка — это процесс, с помощью которого фактическое положение манипулятора устанавливается в качестве значений в программном обеспечении Stereodrive.
- Запустите программное обеспечение для управления и выберите кнопку «Пуск нового проекта», чтобы начать сеанс управления.
- Найдите кончик иглы на открытой поверхности мозга на поверхности черепа с помощью стереотаксиального манипулятора.
ПРИМЕЧАНИЕ: Скорость иглы устанавливается с помощью меню скорости Microdrive в меню инструмента. Скорость по умолчанию 3,0 мм/с. Тем не менее, на этом этапе рекомендуется скорость 0,5 мм/с. Движение иглы контролируется клавишами стрелки. - Добавьте 2-3 капли PBS, чтобы сохранить поверхность мозга влажной. Заполните пустой ящик на экране компьютера с соответствующими координатами DV La. Если поверхность мозга сухая, это препятствует проникновению иглы в ткани мозга.
- Нижняя игла 26 G, нажав кнопку Go To. Он автоматически останавливается, когда игла достигает целевого сайта, установленная координатами DV. Скорость иглы составляет 100 мкм/мин. Если есть кровотечение, остановить иглу, нажав кнопку STOP и мыть поверхность мозга с PBS. Держите поверхность мозга мокрой в этом шаге. После того, как кровотечение остановлено, начните снижаться снова.
- После того, как игла полностью перестанет двигаться, введите 45,00 мм в пустой ящик на экране компьютера.
ПРИМЕЧАНИЕ: 45.00 мм является значением координат DV, что делает иглу вернуться в первое положение. - Поднимите иглу, нажав кнопку Go To. Скорость движения иглы составляет 100-200 мкм/мин.
- После иглы перестает двигаться, удалить PBS на поверхности мозга. Удалите держатель иглы и канюлы из стереотаксисной рамы. Экспериментатор может вручную остановить иглу, нажав кнопку STOP, когда это необходимо.
- Оборудуй стереотаксис с держатель объектива. Установите объектив GRIN на держатель объектива.
ПРИМЕЧАНИЕ: Объектив GRIN, оптимизированный для таргетинга на Лос-Анджелес (0,6 мм в диаметре, 7,3 мм в длину) используется в этом протоколе. Если держатель объектива не подготовлен, альтернативный способ заключается в использовании бульдог клип сцепление объектив GRIN. - Дезинфицировать объектив 70% этанола и прикрепить стереотаксис стержень к стереотаксисным рамам.
- Найдите кончик объектива GRIN в назначенном месте на поверхности черепа (тот же метод, описанный в шаге 2.8).
ПРИМЕЧАНИЕ: Координаты объектива GRIN (AP, ML, DV) - (-1,6 мм, -3,55 мм, -4,2 мм)(рисунок 1С). Объектив не должен касаться черепа, чтобы избежать повреждений на его кончике. - Рассчитайте координаты DV, вычитая абсолютное значение "Value A" из координат DV имплантации объектива, описанных в шаге 2.16.
- Падение 2-3 капли PBS на поверхности мозга. Введите 1000 мкм для опускания и 300 мкм для поднятия объектива в пустой коробке на экране компьютера.
- Повторите снижение (1000 мкм вниз) и повышение (300 мкм вверх) объектива GRIN, пока он не достигнет целевого сайта. Эта процедура вверх и вниз используется, чтобы помочь освободить давление, генерируемое внутри ткани мозга из-за процедуры снижения хрусталика, что в противном случае может привести к искажению структур мозга вдоль пути имплантации.
ПРИМЕЧАНИЕ: Скорость движения объектива GRIN составляет 100 мкм/мин. Даже если есть кровотечение, не прекращать движение объектива GRIN и мыть поверхность мозга с PBS. Держите поверхность мозга мокрой в этом шаге. Если поверхность мозга сухая, ткань мозга прилипает к поверхности объектива GRIN и вызывает искажение структуры мозга. - Если объектив GRIN достигает целевого сайта, удалите PBS и осторожно нанесите смолы зубного цемента вокруг объектива GRIN, винты, и их боковины (Рисунок 1D).
ПРИМЕЧАНИЕ: Применение цемента смолы по всему черепу может уменьшить движение артефактов. Напротив, если смоляной цемент случайно покрывает мышцы, прикрепленные к черепу, это увеличивает движение артефактов. - После смолы зубного цемента затвердевает, разобрать объектив GRIN из держателя объектива и применить акриловый цемент по всему черепу(рисунок 1D).
- Чтобы прикрепить головную пластину, разобрать держатель объектива из стереотаксиса стержня и прикрепить головную пластину на кончике стержня с помощью лент. Подтвердите, является ли головная пластина горизонтальной.
ПРИМЕЧАНИЕ: Наклонная головная пластина вызывает наклонный вид. Головная пластина необходима для фиксации головы мыши в мобильной домашней клетке системы (в разделе крепления базовой пластины). Если экспериментатор не использует систему, пропустите этот шаг (шаг 2.22) и следующий шаг 2.23. - Медленно опустите стержень, пока головная пластина не обнаружит в верхней части манжеты объектива. Опустите головную пластину на 1000 мкм больше. Переместите головную пластину для имплантированного объектива GRIN, чтобы найти на правом краю внутреннего кольца headplate.
ПРИМЕЧАНИЕ: Головная пластина должна быть расположена ниже, чем имплантированная поверхность объектива GRIN; в противном случае, микроэндоскоп не может подойти достаточно близко к имплантированному объективу GRIN для регулировки фокусной плоскости из-за акрилового цемента. - Нанесите акриловый цемент, чтобы прикрепить головную пластину к слоям цемента(рисунок 1D).
- Прикрепите парафиновую пленку на имплантированную поверхность объектива GRIN, чтобы защитить поверхность объектива от пыли. Затем нанесите съемную эпоксидную связь на парафиновую пленку, чтобы парафиновая пленка оставалась на поверхности объектива.
- В брюшной полости мыши вводят карпрофен, анальгезику (0,5 мг/мл в PBS) и дексаметазон, противовоспалительный препарат (0,02 мг/мл в PBS).
ПРИМЕЧАНИЕ: Доза препарата зависит от массы тела: карпрофен (5 мгкг -1 массы тела) и дексаметазон (0,2 мгкг -1 массы тела). Карпрофен и Дексаметазон вводят после операции и один раз в день в течение 7 дней после операции. - Смешайте 0,3 мг/мл амоксициллина, антибиотика, в воде домашней клетки для введения препарата в течение 1 недели.
- Верните мышь в домашнюю клетку и позвольте 5-8 недель для восстановления и передачи вируса.
ПРИМЕЧАНИЕ: Мышь восстанавливается в предварительно разогретой клетке на электрическом одеяле, пока мышь не проснется от анестезии.
3. Проверка имплантации объектива GRIN
ПРИМЕЧАНИЕ: Проверка имплантации объектива GRIN дает информацию о том, является ли имплантированный объектив GRIN нацелен на экспресс-клетки GCaMP. Основываясь на этой информации, экспериментатор экономит свое время от трудоемких процессов, таких как тест на поведение и обработка данных, исключая животных с неугомитной имплантацией объектива GRIN. Во время процедуры проверки ячейки с выражением GCaMP должны быть сфокусированы в поле зрения записи. Мобильная домашняя клетка используется на этом этапе. Мобильная домашняя клетка представляет ею специализированный круглый аппарат, который позволяет мыши, закрепленные на голове, свободно перемещать ноги во время проверки имплантации объектива GRIN и крепления базовой пластины. Воздушный стол в этом аппарате, на котором расположены ноги головы фиксированных мышей позволяет такое свободное движение ног, хотя голова фиксируется. Клетки в боковом ядре миндалины, как правило, тихо в состоянии покоя или анестезии, поэтому сигналы флуоресценции GCaMP редко обнаруживаются в этих условиях, что делает его очень трудным, иногда невозможным, чтобы найти клетки, выражаюющие GCaMP во время проверки имплантации линзы GRIN и базовой пластины вложения. Тем не менее, движение ног часто производит сигналы флуоресценции GCaMP в клетках бокового ядра миндалины и тем самым может помочь найти микроскоп. Таким образом, мобильная домашняя клетка используется в этом протоколе.
- Соберите стереотаксис манипулятор для мобильной системы домашней клетки.
- Обезболивать мышь 1,5% изофлюранного газа. После того, как мышь полностью без сознания, поместите мышь на головной планку мобильной системы домашней клетки.
- Найдите углеродную клетку под мышью. Закройте углеродную клетку и включите воздушный поток, чтобы заставить клетку свободно двигаться без трения. Подождите несколько минут, пока мышь не станет активной.
ПРИМЕЧАНИЕ: Скорость воздушного потока должна быть оптимизирована для каждого экспериментального состояния (здесь, 100 л/мин). - Удалите парафиновую пленку и эпоксидную связь на поверхности имплантированного объектива GRIN и протрите поверхность объектива 70% этанола с помощью бумаги объектива.
- Подготовь программное обеспечение для сбора данных (ДАЗ) (например, Inscopix). Установите условия визуализации.
ПРИМЕЧАНИЕ: Программное обеспечение ДАЗ используется для управления микроскопом (светодиодная мощность, фокус объектива ит.д.)и хранением данных.- Включите коробку ДАЗ и подключите к ней микроскоп. Затем подключите его к ноутбуку либо непосредственно с помощью кабеля, либо через беспроводной интернет.
ПРИМЕЧАНИЕ: Программное обеспечение ДАЗ устанавливается в дополнительном оборудовании под названием ДАК (например, Inscopix). Подключив коробку ДАЗ к ноутбуку, программное обеспечение ДАК становится доступным на ноутбуке. - Доступ к программному обеспечению ДАЗ через интернет-браузер (Firefox рекомендуется).
- Установите все необходимые детали (Дата, идентификатор мыши ит.д. . )в определенной сессии. Затем нажмите Сохранить и продолжить. После сохранения доступ к сеансу Run.
- В Run Session , установитьусловия изображения, такие как время экспозиции, получить, электронный фокус, и экспозиция-LED власти.
ПРИМЕЧАНИЕ: Прибыль и воздействие светодиодной мощности меняются в зависимости от лабораторных условий. Рекомендуемое значение для электрического фокусировки составляет 500, а время экспозиции - 50 мс. Существует никаких ограничений для изменения светодиодной мощности и усиления. Тем не менее, более высокая интенсивность света может вызвать больше отбеливания. Время экспозиции записи определяет частоту кадров видеозаписи. Более высокие частоты кадров снизят интенсивность сигнала. Частота кадров должна быть оптимизирована для GECIs, используемых для визуализации.
- Включите коробку ДАЗ и подключите к ней микроскоп. Затем подключите его к ноутбуку либо непосредственно с помощью кабеля, либо через беспроводной интернет.
- Чтобы удержать микроскоп на стереотаксисном манипуляторе, приложите стереотаксисный стержень с микроскопом к стереотаксисному манипулятору.
ПРИМЕЧАНИЕ: Захват является небольшой аксессуар, который может быть прикреплен к стереотаксисного аппарата провести микроскоп тела для размещения его на целевое расположение мозга. - Захвати микроскоп с микроскопом захвата. Включите светодиодный свет, подключенный к микроскопу, и выровняйтесь с микроскопом вертикально. Опустите микроскоп при наблюдении изображения до тех пор, пока поверхность имплантированного объектива GRIN не появит.
- Выравнивание центра имплантированного объектива GRIN с центром представления.
ПРИМЕЧАНИЕ: Проверка имплантации объектива GRIN может быть проведена на этом этапе (упомянутый в разделе результатов, рисунок 2B, рисунок 2D, рисунок 2F). - Захват изображения имплантированной поверхности объектива GRIN (Нажмите кнопку Prt Sc на клавиатуре). Изображение имплантированной поверхности объектива GRIN требуется для деэлектрации не нейрональных компонентов во время более поздней обработки данных (шаг 6.8).
- Найти соответствующее положение микроскопа. Медленно поднимите объектив микроскопа при наблюдении изображения для поиска клеток с выражением GCaMP7b.
ПРИМЕЧАНИЕ: Это может быть необходимо, чтобы настроить выгоду от приобретения изображения или экспозиции светодиодной мощности. Проверка имплантации объектива GRIN может быть проведена на этом этапе (упомянутый в разделе результат, рисунок 2A, рисунок 2C, рисунок 2E).
4. Базовое вложение
ПРИМЕЧАНИЕ: Шаг крепления базовой пластины следует за проверкой имплантации объектива GRIN. Базовая плита является платформой для установки микроскопа на голову мышей. Как упоминалось в предыдущем разделе, мобильная домашняя клетка используется в этом протоколе.
- После проверки имплантации объектива GRIN, разобрать миниатюрный микроскоп из микроскопа захвата.
- Прикрепите основание к микроскопу. Затяните винт с помощью шестиугольного ключа для стабильного крепления базовой пластины к микроскопу.
- Захвати микроскоп с микроскопом захвата. Включите светодиодный свет, подключенный к микроскопу, и выровняйтесь с микроскопом вертикально. Опустите микроскоп до тех пор, пока не будет замечена поверхность имплантированного объектива GRIN. Выравнивание центра имплантированного объектива GRIN с центром представления.
- Найти соответствующее положение микроскопа. Медленно поднимите объектив объектива микроскопа до нахождения фокусной плоскости, которая дает лучшие изображения клеток с выражением GCaMP7b(рисунок 2A).
ПРИМЕЧАНИЕ: Это может быть необходимо, чтобы настроить выгоду от приобретения изображения или экспозиции светодиодной мощности во время этого шага. - Нанесите акриловый цемент, чтобы быстро прикрепить основание к головной пластине(рисунок 2G). Создайте боковины с акриловым цементом между базовой пластиной и головной пластиной.
ПРИМЕЧАНИЕ: Акриловый цемент сжимается, когда он затвердевает. По этой причине не удалять микроскоп до тех пор, пока цемент полностью не затвердеет (этот шаг занимает не менее 30 мин). Цементирование должно быть сделано очень тщательно, чтобы избежать нежелательного цементирования микроскопа и его объективной линзы с акриловым цементом. - После акрилового цемента полностью затвердевает, ослабить винт и поднять корпус микроскопа медленно.
- Если есть зазор на боковине, передело дополнительное цементирование для защиты имплантированного объектива GRIN от пыли.
- Обложка базовой пластины для защиты имплантированных объектив GRIN от пыли и затянуть винт базовой пластины.
- Отпустите головную пластину из головной планки. Верните мышь в домашнюю клетку до будущих оптических изображений.
5. Оптическая запись сигнала GCaMP во время теста поведения
ПРИМЕЧАНИЕ: Процедура записи сигнала GCaMP во время поведения может быть очень разной в зависимости от систем, используемых для оптической визуализации, экспериментального проектирования и лабораторной среды. Поэтому в данном разделе это описано простым способом.
- Проведем несколько дней обработки перед тестом поведения.
- Подготовь двигатель поведения (например, камеру кондиционирования страха, программное обеспечение для поведения и инструмент Coulbourn) и портативный компьютер.
- Подключите микроскоп к коробке ДАЗ и включите коробку ДАЗ.
- Подключите коробку ДАЗ к ноутбуку через беспроводное подключение к Интернету.
- Запустите программное обеспечение ДАК (браузер Firefox рекомендуется) на ноутбуке. Нажмите кнопку менеджера файлов и проверьте оставшуюся емкость коробки ДАК для сохранения записанных данных.
ПРИМЕЧАНИЕ: Размер данных составляет около 80 ГБ за 30 минут записи. - Введите необходимую информацию (Дата, идентификатор мыши ит.д.)в определенный сеанс и введите сеанс Run.
- Аккуратно возьмите мышь и снимите крышку основания на голове. Размещение микроскопа на базовой платформе.
- Затяните базовый винт и поместите животное с головой монтажа микроэндоскопа в камеру поведения.
ПРИМЕЧАНИЕ: Мышь пытается бежать на этом шаге, если обработка не достаточно. - Подключите доску NI к порту TRIG в коробке ДАЗ с помощью кабеля BNC. Ni board получает сигналы TTL от программного обеспечения для поведения (например, FreezeFrame) и координирует процедуру одновременной записи сигнала GCaMP и поведения животных.
- Отрегулируйте фокусную плоскость.
ПРИМЕЧАНИЕ: Фокусная плоскость определяется расстоянием между объективным объективом микроскопа и объективом GRIN, имплантированным в мозг. Чтобы настроить фокусную плоскость, объективное положение объектива манипулируется при наблюдении за изображениями. Расстояние между этими двумя линзами, которое показывает четкую морфологию клеток и кровеносных сосудов, устанавливается в качестве координационного центра для визуализации. В этом протоколе программное обеспечение ДАЗ используется для управления движением объектива цели во время корректировки. - Установите оптимизированное время экспозиции, прибыль, светодиодную мощность в сеансе Run.
ПРИМЕЧАНИЕ: Как правило, 50 мс используется для экспозиции времени. Прибыль и светодиодная мощность устанавливаются на основе гистограмм изображений. Гистограммы указывают на распределение интенсивности флуоресценции пикселей. Основываясь на визуальном осмотре, правый край гистограммы должен иметь значение от 40% до 60% в случае GCaMP7b. Он изменяется в зависимости от GECIs, используемых для визуализации. - Измените опцию записи на запись Triggered. Нажмите Запись и начать поведение.
ПРИМЕЧАНИЕ: Опция срабатываемой записи обеспечивает сопоставимую временную шкалу сеанса записи и сеанса поведения. При получении сигнала TTL включается красный свет над портом TRIG. - После окончания теста на поведение отсоедините микроскоп и прикрепите крышку базовой панели.
- Верните мышь в домашнюю клетку. Затем выберите менеджер файла и экспортные данные из коробки ДАЗ.
- После теста на поведение пожертвуй мышью для посмертной гистологической проверки.
6. Обработка данных
ПРИМЕЧАНИЕ: Процедура обработки данных сильно отличается в зависимости от программного обеспечения для обработки данных и GECIs, используемых для эксперимента изображения. Поэтому в данном разделе это описано простым способом. В этом протоколе используется коммерческое программное обеспечение для обработки данных (см. таблицу материалов). Кроме того, другие программы с открытым исходным кодом, упомянутые в разделе обсуждения, также могут быть использованы без проблем. Переменные, используемые в этом протоколе, перечислены в таблице 1.
- Импорт файла видеозаписи (1280 пикселей х 800 пикселей) из коробки ДАЗ в настольный компьютер для обработки данных. Запуск программного обеспечения для обработки данных.
ПРИМЕЧАНИЕ: Программное обеспечение для обработки данных отличается от программного обеспечения ДАЗ на предыдущих этапах. В программном обеспечении для обработки данных есть 6 этапов: отбор проб, обрезка, пространственный фильтр, коррекция движения, расчет F/F, обнаружение событий, которые необходимы для извлечения одноклеточных переходных данных кальция из записанного видео. - Downsample и обрезать видео.
ПРИМЕЧАНИЕ: Для повышения скорости обработки данных необходимы даунсамплинг и обрезка. Обрезать область, за исключением области интереса, где сигнал GCaMP наблюдается. - Применить пространственный фильтр. После применения пространственного фильтра создайте проекционные изображения среднего интенсивности.
ПРИМЕЧАНИЕ: Пространственный фильтр различает каждый пиксель в записанном видео-изображении и обеспечивает высокое контрастное изображение. Существует два типа фильтра для отреза, фильтра с низким и высоким вырезом. Более высокое значение фильтров с низким вырезом увеличивает контраст изображения, но при этом общий серый шум также увеличивается. Более низкое значение фильтра с высоким вырезом делает изображение размытым. - Применить коррекцию движения. Используйте изображение проекции среднего интенсивности в качестве эталонного изображения для коррекции движения.
- Примените коррекцию движения снова, используя изображение первого кадра в качестве эталонного изображения.
ПРИМЕЧАНИЕ: Два шага коррекции движения значительно уменьшают артефакт движения. - Примените расчет F/F для визуализации пикселей, которые показывают изменение яркости.
ПРИМЕЧАНИЕ: Изменение яркости пикселей вызвано изменением интенсивности флуоресценции GCaMP, и это указывает на переходный кальций. - Примените алгоритм PCA/ICA для визуализации переходной кривой кальция каждой клетки.
ПРИМЕЧАНИЕ: PCA/ICA является алгоритмом сортировки группы данных в набор данных одного компонента. Переменные должны быть оптимизированы для каждого лабораторного состояния. В этом протоколе все переменные по умолчанию, за исключением временного веса ICA (0,4 используется в этом протоколе)27. - Deselect вручную невнонные компоненты среди выявленных компонентов на основе критериев, описанных в следующей записке.
ПРИМЕЧАНИЕ: Для этой цели используются два основных критерия. Во-первых, сигнал GCaMP, исходящий от нейрона, выглядит как четкая сферическая форма. Таким образом, в качестве нейрона выбирается только сигнал с четкой сферической формой. Во-вторых, учитывая диаметр клеточного тела миндалины пирамидальной клетки, как известно, примерно 20мкм 28,29,30, только сигнал примерно совпадает с этим размером выбран в качестве нейрона. Для определения размера сигнала GCaMP фактический размер одного пикселя рассчитывается на основе захваченного изображения поверхности объектива (шаг 3.9) и рассчитывается максимальная ширина односферной формы. Например, в этом протоколе диаметр имплантированного объектива GRIN составляет 600 мкм. Таким образом, если диаметр объектива составляет 800 пикселей, то фактический размер одного пикселя составляет 1,5 мкм (20 мкм составляет около 7 пикселей). - Применить функцию обнаружения событий, чтобы обнаружить значительное увеличение кальция переходных (событие кальция).
ПРИМЕЧАНИЕ: На этом этапе требуется переменная, называемая самым маленьким временем распада событий. В этом протоколе 1.18s используется в качестве оптимизированной переменной для GCaMP7b. Среднее время распада половины (t1/20,82s) рассчитывается на основе кривой F/F во время спонтанной активности клеток. Так как GCaMP следует экспоненциальный распад, .
.
Результаты
Проверка имплантации объектива GRIN
Прежде чем хронически прикрепить основание к мозгу путем цементирования, имплантация объектива GRIN должна быть проверена. У животных с успешной имплантацией хрусталика, как GCaMP экспресс-клеток и кровеносных сосудов были четко замечены в фокусном диапазоне плоскости определяется расстояние между объективным объективом микроскопа и имплантированных объектива GRIN (Рисунок 2А и В). В отличие от этого, у животных с внецелевой имплантации, четкое изображение GCaMP экспресс-клеток не наблюдалось в пределах диапазона фокусной плоскости (либо вне фокуса или вне зрения). В случае вне фокуса, хорошо сфокусированные кровеносные сосуды могут наблюдаться, но только размытые изображения для клеток в пределах диапазона фокуснойплоскости (рисунок 2C и D). В случае вне зрения, кровеносные сосуды не наблюдались в большинстве случаев и не флуоресценции сигнал был обнаружен в пределах диапазона фокусной плоскости(рисунок 2E). Более того, в отличие от других случаев, имплантированный объектив GRIN показал яркий край(рисунок 2F). Базовая пластина крепления проводится только на проверенных животных с на целевой имплантации объектива GRIN.
Запись сигналов GCaMP в нейроне Лос-Анджелеса в ответ на слуховые стимулы
В этом протоколе, 4 экземпляра псевдорандомизированного тона (2,8 кГц, 200 мс продолжительность, 25 импульсов) были представлены мыши, и сигналы GCaMP были оптически записаны в клетках Лос-Анджелеса мышей с микроэндоскопом, монтирует голову. Мыши, введенные с AAV1-Syn-GCaMP7b-WPRE в одностороннем боковой миндалины были использованы для изображения. У животных с успешной имплантацией объектива GRIN, вирус, выражаюющий клетки и кровеносные сосуды, были четко замечены в пределах диапазона фокуснойплоскости (рисунок 3A). В состоянии поведения, примерно 50-150 клеток обычно отображаются значительные изменения флуоресценции в поле зрения в Лос-Анджелесе даже без тона, как показано на изображении F/ F, вероятно, спонтанно активных клеток (Рисунок 3B). При представлении тона лишь несколько ячеек отображали тонально-специфическое изменение сигнала GCaMP, определяемое анализом изображения F/F (6 ячеек на рисунке 3C и рисунке 3D). Такие же процедуры проводились на мышах, введенных с помощью AAV2/1-CAMKI-GFP в качестве контроля. Хотя GFP экспресс-клетки были обнаружены в диапазоне фокусной плоскости, ни одна клетка не отображается значительное изменение флуоресценции с или без тона, как это определено анализ изображения F / F(рисунок 3E и рисунок 3F).
Для гистологической проверки экспрессии GCaMP и ориентации объектива GRIN, корональных секций посмертного мозга рассматриваются под флуоресцентным микроскопом(рисунок 4A и рисунок 4B). DaPI окрашивание используется для подтверждения нетронутых клеток и никаких признаков повреждения тканей из-за воспаления тканей мозга вокруг объектива GRIN(рисунок 4C).
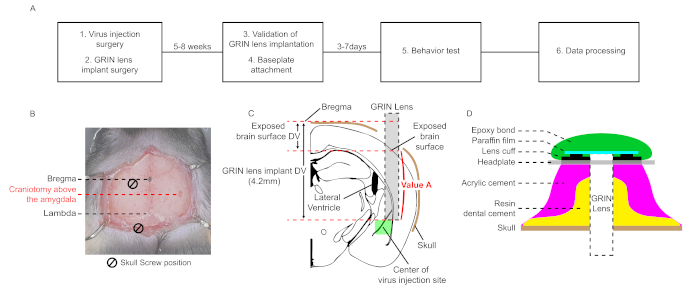
Рисунок 1: Схематический рабочий процесс и диаграммы для стереотаксической хирургии для микроэндоскопической визуализации кальция in vivo в Лос-Анджелесе (A) Схематический рабочий процесс микроэндоскопической визуализации кальция in vivo в Лос-Анджелесе. (B) Микроскопическая картина, показывающая двумерные координаты мест краниотомии для инъекции вируса и хирургии имплантата объектива GRIN. Два винта черепа и объектив образуют равносторонний треугольник. c) диаграмма относительного положения между местом инъекции вируса и имплантированным объективом ГРИН и схематичное объяснение расчета "Значение А". (D) поперечное сечение цементного слоя от поверхности черепа до головной панели на заключительных этапах операции. Смола зубного цемента должна покрывать стенку винтов и имплантированный объектив GRIN. Акриловый цемент наносится на смолы зубного цемента. На цементный слой крепится головная панель. Парафиновая пленка покрывает имплантированную поверхность объектива GRIN и защищает ее от пыли. Съемная эпоксидная связь предотвращает отсоединение парафиновой пленки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Проверка имплантации объектива GRIN и конфигурации слоев цемента после крепления базовой пластины. (A) Репрезентативное эндоскопическое изображение снимка от животных с успешной имплантацией объектива GRIN. Четко наблюдаются как экспресс-клетки GCaMP, так и кровеносные сосуды. (B) Снимок изображения имплантированной поверхности объектива GRIN от животных с успешной имплантацией объектива GRIN. (C) Репрезентативное эндоскопическое снимок изображения животных с внефокусной имплантацией объектива GRIN. (D) Снимок имплантированной поверхности объектива GRIN от животных с внефокусной имплантацией объектива GRIN. В случае вне фокуса, кровеносные сосуды иногда четко наблюдаются, но только размытые изображения для клеток в фокусном диапазоне плоскости. (E) репрезентативное эндоскопическое снимок изображения животных с вне вида имплантации объектива GRIN. В случае вне зрения, кровеносные сосуды не наблюдаются в большинстве случаев и нет сигнала флуоресценции обнаруживается в пределах диапазона фокусного самолета. (F) Снимок изображения имплантированной поверхности объектива GRIN от животных с вне вида имплантации объектива GRIN. В отличие от других случаев, яркий край наблюдается в этом случае. (G) Конфигурация слоев цемента для крепления базовой пластины. Базовая плита и нагрудная плита прикрепляются акриловым цементом. Между базовой плитой и объективом GRIN должно быть незаполненное акриловым цементом. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
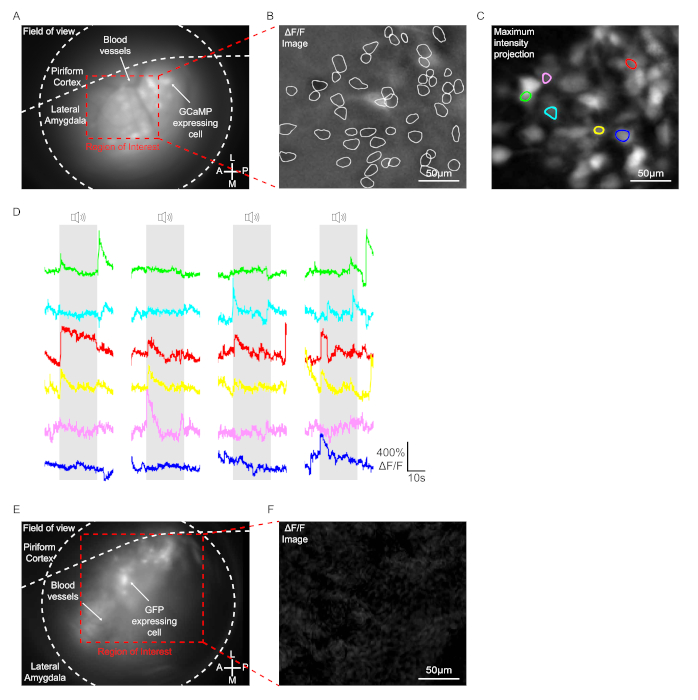
Рисунок 3: Запись сигналов GCaMP в нейронах Лос-Анджелеса. (от А до К) Данные, полученные с помощью мыши, вводимой с помощью AAV1-Syn-GCaMP7b-WPRE. (A) репрезентативное эндоскопическое изображение моментального снимка во время теста поведения. GCaMP7b экспресс-клетки и кровеносные сосуды были четко замечены в пределах диапазона фокусного самолета. (B) Репрезентативное изображение снимка, показывающеесигнал F/F. Белая линия указывает на клетки, которые показали значительное изменение флуоресценции в области интереса во время теста поведения. Шкала бар 50 мкм. (C) Максимальная интенсивность проекции изображения. Всего 6 ячеек показали тон-специфическое изменение сигнала GCaMP. Шкала бар No 50 мкм. (D) Представитель F/ F следы тон отзывчивых клеток. Каждый цвет соответствует каждой отдельной ячейке с одинаковым цветом в панели (C). (E и F) Данные, полученные с помощью мыши, вводимой с помощью AAV2/1-CaMKII-GFP. (E) репрезентативное эндоскопическое снимок изображения во время теста поведения. GFP экспресс-клетки были четко обнаружены в пределах диапазона фокусного самолета. (F) репрезентативное изображение снимка, показывающеесигнал F/F. Шкала бар 50 м. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Гистологическая проверка положения объектива GRIN и выражения GCaMP7b. (A) репрезентативное изображение корональной секции, показывающее выражение GCaMP7b в Лос-Анджелесе. Масштабная планка 200 мкм. (B) Увеличенное изображение. Шкала бар No 50 мкм. (C) Флуоресценция микроскопическое изображение, показывающее DAPI окрашивания сигнала. Масштабная планка 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть более широкую версию этой цифры.
| Фактор | Значение |
| Пространственный коэффициент отбора проб | 2 |
| Временный коэффициент отбора проб | 2 |
| Пространственный фильтр: Высокий вырез | 0.5 |
| Пространственный фильтр: Низкий вырез | 0.005 |
| Коррекция движения: Высокое сокращение | 0.016 |
| Коррекция движения: Низкая вырезка | 0.004 |
| Коррекция движения: Maxtranslation | 20 |
| Справочная рамка КФ/Ф | Средняя рамка |
| PCA/ICA: blockSize | 1000 |
| PCA/ICA: конвергенцияТресхолд | 1x10'-5 |
| PCA/ICA: icaTemporalWeight | 0.4 |
| PCA/ICA: numICs | 120 |
| PCA/ICA: numPCs | 150 |
| PCA/ICA: unmixType | Временных |
| Обнаружение событий: Распад Констант | 1.18 |
| Обнаружение событий: Порог | 4 |
Таблица 1: Список переменных для обработки данных
Обсуждение
Умелые методы хирургии имеют важное значение для достижения успешного виво оптической визуализации кальция с головой монтажа миниатюрной микроскопии в более глубоких областях мозга, таких как миндалина, как мы описали здесь. Поэтому, хотя этот протокол является ориентиром для оптимизации хирургических процессов базового крепления и имплантации объектива GRIN, для критических шагов могут потребоваться дополнительные процессы оптимизации. Как уже упоминалось в разделе протокола, координаты миндалины в хирургии, скорость воздушного потока в этапе крепления базовой пластины, настройки приобретения изображения (частота кадров, светодиодная мощность ит.д.)в записи кальция и переменных (ICA временный вес, время распада событий ит.д. .) в обработке данных должны быть оптимизированы.
Шаг крепления базовой панели может быть изменен. Головная пластина необходима, потому что она помогает исправить голову бодрствующими мышами во время крепления базовой пластины, проводимой в мобильной домашней клетке. Однако, если передвижная домашняя клетка не подготовлена в лаборатории, то система газофлюранной газовой анестезии является альтернативным вариантом. Для этого альтернативного способа концентрация изофлюранового газа может иметь решающее значение. Мы заметили, что сигнал GCaMP редко обнаруживается в миндалинах мышей под 1,5% изофлюрана. Напротив, сигнал GCaMP обнаруживается при состоянии изофлюрана 0,8%, и мыши остаются в почти бодрствующим состоянии, но без существенного движения головы в этом состоянии. Таким образом, это условие обезболивации позволяет проводить базовое крепление без использования дополнительных устройств, таких как головная пластина и передвижная домашняя клетка.
Нестабильное вложение винта черепа, цемента, основания и микроскопа может вызвать движение артефактов, которые могут быть исправлены с помощью алгоритма коррекции движения программного обеспечения. Движение бокового желудочка, как полагают, вызывает нерегулярный тип артефактов движения, которые не могут быть легко исправлены с помощью доступного в настоящее время программного обеспечения коррекции движения. Такие нерегулярные артефакты движения минимальны в большинстве поверхностных областей мозга, таких как гиппокамп и кора. Тем не менее, он часто обнаруживается во время оптической визуализации в миндалинах. Чтобы преодолеть эту проблему, этот протокол предлагает имплантировать объектив GRIN в 50 мкм от вирусного места инъекции на боковуюсторону (рисунок 1C), что значительно улучшает процесс получения изображения за счет уменьшения потенциальных артефактов движения, происходящих из бокового желудочка. Несмотря на то, что мы установили 50 мкм по отношению к месту вирусной инъекции, целевая координата имплантации хрусталика также может быть установлена относительно бокового желудочка. В этом протоколе, мы рассуждали, что это более важно, чтобы точно целевой вирусный сайт выражения для успешной работы изображений. Таким образом, мы использовали вирусную инъекцию координаты в качестве ссылки, чтобы установить целевую координату имплантации объектива. Благодаря неоднократным испытаниям, мы создали оптимальное состояние, которое позволило объективу GRIN эффективно таргетинга вирусного экспрессионного сайта, избегая при этом артефактов движения, вызванных движением бокового желудочка. В конце концов, метод, который может эффективно и точно исправить любые артефакты движения будет иметь большую помощь для доступа к оптической визуализации в более глубокие области мозга в будущем.
Несмотря на то, что оптическая визуализация кальция in vivo с помощью миниатюрного микроскопа с помощью миниатюрного микроскопа является мощным инструментом и оптимизирована, во многих аспектах все еще есть возможности для совершенствования. Этот протокол облегчит исследования, которые направлены на изучение в режиме реального времени нейронной активности в миндалинах свободно ведут себя животных.
Раскрытие информации
Автору нечего раскрывать
Благодарности
Эта работа была поддержана грантами Научно-технологического фонда Samsung (Проект номер SSTF-BA1801-10).
Материалы
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
Ссылки
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637(2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128(2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены