Method Article
ناجحة في التصوير الكلسيوم الجسم الحي مع المجهر Miniaturized الرأس جبل في Amygdala من الماوس تتصرف بحرية
In This Article
Summary
في التصوير المجهري للكالسيوم في الجسم الحي هو أداة لا تقدر بثمن التي تمكن من رصد الوقت الحقيقي للأنشطة العصبية في التصرف بحرية الحيوانات. ومع ذلك، تطبيق هذه التقنية على اللوزة كان من الصعب. يهدف هذا البروتوكول إلى توفير دليل مفيد لاستهداف خلايا اللوزة بنجاح باستخدام مجهر مصغر في الفئران.
Abstract
في مراقبة في الوقت الحقيقي في الجسم الحي للأنشطة العصبية في الحيوانات تتحرك بحرية هي واحدة من الأساليب الرئيسية لربط نشاط الخلايا العصبية إلى السلوك. لهذا الغرض، تم تطوير تقنية التصوير في الجسم الحي التي تكشف عن عابري الكالسيوم في الخلايا العصبية باستخدام مؤشرات الكالسيوم المشفرة وراثيا (GECIs)، مجهر الفلورانس المصغرة، وعدسة معامل الانكسار التدرج (GRIN) وتطبيقها بنجاح على العديد من هياكل الدماغ1،2،3،4،5،6. هذه تقنية التصوير قوية بشكل خاص لأنها تمكن التصوير المتزامن المزمن لفئات الخلايا المحددة جينياً لفترة طويلة تصل إلى عدة أسابيع. على الرغم من أن مفيدة، هذه التقنية التصوير لم يتم تطبيقها بسهولة على هياكل الدماغ التي تحدد في عمق الدماغ مثل اللوزة، بنية الدماغ الأساسية للمعالجة العاطفية وذاكرة الخوف النقابي7. هناك عدة عوامل تجعل من الصعب تطبيق تقنية التصوير على اللوزة. على سبيل المثال، تحدث القطع الأثرية للحركة عادة بشكل أكثر تكرارًا أثناء التصوير الذي يتم إجراؤه في مناطق الدماغ الأعمق لأن مجهرًا على شكل رأس مزروع في عمق الدماغ غير مستقر نسبيًا. مشكلة أخرى هي أن البطين الجانبي يتم وضعه بالقرب من عدسة GRIN المزروعة وحركته أثناء التنفس قد يسبب التحف الحركة غير منتظمة للغاية التي لا يمكن تصحيحها بسهولة، مما يجعل من الصعب تشكيل عرض التصوير مستقرة. وعلاوة على ذلك، لأن الخلايا في اللوزة عادة ما تكون هادئة في حالة الراحة أو التخدير، فمن الصعب العثور على الخلايا المستهدفة والتركيز التي تعبر عن GECI في اللوزة أثناء إجراء الطلاء الأساسي للتصوير في وقت لاحق. يوفر هذا البروتوكول إرشادات مفيدة لكيفية استهداف الخلايا بفعالية التعبير عن GECI في اللوزة مع مجهر مصغر على جبل الرأس للنجاح في تصوير الكالسيوم في مثل هذه المنطقة الأعمق في الدماغ. ويلاحظ أن هذا البروتوكول يستند إلى نظام معين (على سبيل المثال، إنسكوبيكس) ولكنه لا يقتصر عليه.
Introduction
الكالسيوم هو رسول الثانية في كل مكان، ولعب دورا حاسما في وظائف كل خلية تقريبا8. في الخلايا العصبية, إطلاق العمل المحتملة والمدخلات متشابك يسبب التغير السريع من الحر داخل الخلية [كاليفورنيا2+]9,10. لذلك، تتبع عابري الكالسيوم يوفر فرصة لمراقبة نشاط الخلايا العصبية. GECIs هي أدوات قوية تسمح بالرصد [Ca2+]في مجموعات الخلايا المحددة والمقصورات داخلالخلوية 11،12. من بين العديد من أنواع مختلفة من البروتين القائم على مؤشر الكالسيوم، GCaMP، Ca2 + مسبار على أساس جزيء GFPواحد 13، هو الأكثر الأمثل، وبالتالي تستخدم على نطاق واسع GECI. من خلال جولات متعددة من الهندسة ، تم تطوير عدد من المتغيرات من GCaMP12،14،15،16. نحن نستخدم واحدة من GCaMPs التي تم تطويرها مؤخرا ، GCaMP7b ، في هذا البروتوكول16. وقد ساهمت أجهزة الاستشعار GCaMP بشكل كبير في دراسة وظائف الدوائر العصبية في عدد من الكائنات الحية النموذجية مثل تصوير Ca2 + العابرين خلال التنمية17، في التصوير في الجسم الحي في طبقة القشريةالمحددة 18، وقياس ديناميات الدوائر في تعلم المهام الحركية19 والتصوير من نشاط الفرقة الخلية ذات الصلة مع ذاكرة الخوف النقابي في قرن آمون وamgdala20،21.
التصوير البصري من GECIs له العديد من المزايا22. الترميز الجيني تمكن GECIs من التعبير عنها بشكل ثابت لفترة طويلة الأجل من الزمن في مجموعة فرعية محددة من الخلايا التي يتم تعريفها من خلال الملامح الوراثية أو أنماط محددة من الاتصال التشريحي. التصوير البصري تمكن في الرصد المتزامن المزمن في الجسم الحي من المئات إلى الآلاف من الخلايا العصبية في الحيوانات الحية. وقد تم تطوير عدد قليل من أنظمة التصوير البصري لفي التصوير في الجسم الحي وتحليل GECIs داخل الدماغ من الفئران تتصرف بحرية مع رئيس جبل المجاهر الفلورية المصغرة21,23,24,25. على الرغم من تقنية التصوير البصري في الجسم الحي على أساس GECIs ، عدسة GRIN ، والمجهر المصغر على الرأس كونه أداة قوية لدراسة الصلة بين نشاط الدائرة العصبية والسلوك ، فإن تطبيق هذه التقنية على اللوزة كان صعبًا بسبب العديد من المشكلات التقنية المتعلقة باستهداف عدسة GRIN للخلايا التي تعبر عن GECIs في اللوزة دون التسبب في القطع الأثرية المتحركة التي تقلل بشدة من جودة اكتساب الصور وإيجاد خلايا تعبر عن GECIs. يهدف هذا البروتوكول إلى توفير دليل مفيد للإجراءات الجراحية لمرفق اللوح الأساسي وغرينس عدسة التي هي خطوات حاسمة لنجاح في التصوير بالكالسيوم في الجسم الحي في اللوزة. على الرغم من أن هذا البروتوكول يستهدف اللوزة، فإن معظم الإجراءات الموصوفة هنا تنطبق عادة على مناطق الدماغ الأعمق الأخرى. وعلى الرغم من أن هذا البروتوكول يستند إلى نظام معين (مثل إنسكوبيكس)، فإن الغرض نفسه قد يتحقق بسهولة مع نظم بديلة أخرى.
Protocol
وقد وافقت لجنة أخلاقيات الحيوان في المعهد الكوري المتقدم للعلوم والتكنولوجيا على جميع الإجراءات. وقد أجريت جميع التجارب وفقاً للمبدأ التوجيهي للجنة المؤسسية لرعاية الحيوانات واستخدامها.
ملاحظة: يتكون هذا البروتوكول من ست خطوات رئيسية: جراحة حقن الفيروس، جراحة زرع العدسة GRIN، التحقق من زرع عدسة GRIN، مرفق القاعد، التسجيل البصري لإشارة GCaMP أثناء اختبار السلوك، ومعالجة البيانات(الشكل 1A). باستثناء الجراحة، يتم استخدام حزمة البرامج التجارية (Inscopix).
1. جراحة تكسينية - حقن فيروس AAV
ملاحظة: سلالة الماوس المستخدمة في هذا الإجراء الجراحي هو C57BL6/J. يتم تغطية جسم الحيوان مع ستائر معقمة أثناء الجراحة ويتم تنفيذ جميع الخطوات في البروتوكول مع ارتداء قفازات معقمة. لا يتم إجراء عمليات جراحية متعددة عادة في نفس اليوم. ومع ذلك، إذا كان الفئران متعددة لديها لإجراء نفس الجراحة في نفس اليوم، واستخدام مجموعة منفصلة من الأدوات الجراحية autoclaved لكل فأر والإيثانول 70٪ لتطهير الأدوات الجراحية بين الفئران. للحفاظ على الماوس دافئًا أثناء العملية الجراحية ، يتم تغطية الماوس بطانية جراحية مصنوعة خصيصًا بعد تثبيتها على الإطار المُجسم.
- تطهير جميع الأدوات الجراحية المطلوبة مع الإيثانول 70٪ ، وإعداد حقنة هاملتون وماصة زجاجية. املأ الماصات الزجاجية بالماء المقطر.
ملاحظة: جميع الأدوات الجراحية المستخدمة في البروتوكول هي autoclaved. لأن عدسة GRIN ومسامير الجمجمة لا يمكن أن تكون autoclaved للتعقيم، ويستخدم 70 ٪ الإيثانول كمطهر لمنع الالتهاب. على الرغم من عدم محاولة، يمكن استخدام أشكال أخرى من التعقيم مثل الغاز أو التعقيم الكيميائي. - تخدير الماوس باستخدام pentobarbital (83 ملغ•كغ -1 من وزن الجسم) عن طريق الحقن داخل الصفاق. بعد أن يصبح الماوس فاقدا للوعي، حلق الفراء على الجمجمة.
- تنظيف الجلد فوق الجمجمة مع الإيثانول 70٪ وإصلاح الماوس إلى إطار stereotaxic. إزالة بعناية الجلد ومسح سطح الجمجمة مع محلول بيروكسيد الهيدروجين 35٪ باستخدام قضيب طرف القطن. تطبيق مرهم العين زيوت التشحيم لمنع تجفيف القرنية أثناء الجراحة.
ملاحظة: على الرغم من أنه عادة لا توجد مشكلة مع استخدام 70٪ الإيثانول فقط لإعداد الجلد العقيم، فمن المستحسن استخدام 3 جولات بالتناوب من المطهرات مثل الفودفورات أو محلول الكلورهيكسيدين، و 70٪ الإيثانول. يتم استخدام تركيز أعلى من بيروكسيد الهيدروجين في هذا البروتوكول للتأكد من أن يتم إزالة الأنسجة الضامة على جمجمة الماوس تماما قدر الإمكان، وهو أمر بالغ الأهمية للحد من الحركة خلال التصوير في وقت لاحق لأن النسيج الضام على الجمجمة يتداخل مع مرفق ثابت من اللوح الأساسي إلى الجمجمة. وتجدر الإشارة إلى أن 35٪ بيروكسيد الهيدروجين هو أعلى بكثير مما يستخدم عادة (3 ٪). - إصلاح دبوس مع حامل مسبار ستيريو. محاذاة ارتفاع البريغما و لامدا مع دبوس.
- العثور على موقع محدد على جمجمة الماوس لاستئصال القحف.
ملاحظة: إحداثيات الزميجال الجانبي (LA) لحقن الفيروس هي (AP, ML, DV) = (-1.6 مم, -3.5 مم, -4.3 مم) من bregma في هذا البروتوكول (AP; الأمامي- الخلفي, ML; ميديال-الجانبي، DV؛ دورسال-فينترال، كل اختصار يشير إلى مسافة محورية نسبية من البريغمة)26. يجب أن تكون الأمثل الإحداثيات لكل حالة تجريبية. - حفر سطح الجمجمة (الشكل 1B). غسل كسور الجمجمة مع الفوسفات المالحة المخزنة (PBS). قم بإزالة الطبقة المتبقية باستخدام ملقط أو إبرة 27 G.
- عند حفر الجمجمة، حاول عدم لمس طبقة دورا الماضي لتجنب تلف سطح أنسجة الدماغ. سطح الدماغ التالف يسبب التهاب حول العدسة، مما يؤدي إلى التحف الحركة الشديدة وارتفاع autofluorescence أثناء التسجيل. حجم استئصال القحف هو 1.6 ملم. سرعة الحفر هي 18000 دورة في الدقيقة ، وحجم بت هو 0.6 ملم.
- لخفض عدسة GRIN من سطح أنسجة الدماغ للموقع المحفور إلى موقع اللوزة الهدف ، حساب المسافة المسماة "القيمة A" عن طريق طرح الفرق بين DV bregma وسطح الدماغ المكشوف من إحداثيات DV من زرع العدسة ، والذي يتم تعيينه على أساس البريغما (4.2 مم في هذه الحالة ، الشكل 1C).
- تحميل 3 ميكرولتر من الزيوت المعدنية و0.7 ميكرولتر من حل فيروس AAV في الماصات الزجاجية.
ملاحظة: الزيت المعدني يساعد على فصل حل الفيروسات والمياه. 0.7 μL هو حجم الأمثل لحقن فيروس لوس انجليس التي يمكن أن تغطي تماما لوس انجليس. - إزالة دبوس من حامل مسبار stereotaxic وإصلاح ماصة الزجاج لذلك.
- حدد موقع ماصة الزجاج في موقع الحقن المذكورة في الخطوة 1.5. أدخل الماصات الزجاجية في أنسجة الدماغ بعد توقف النزيف تمامًا.
- تسليم الفيروس من خلال ماصة زجاجية باستخدام مضخة حقن.
ملاحظة: يجب أن يكون titer من الفيروس أعلى من 1 ×10 13 vg/mL للحصول على عدد كاف من الخلايا التعبير GCaMP. سرعة الحقن هي 0.1 ميكرولتر/دقيقة ومنتشرة لمدة 10 دقائق. إذا كان هناك نزيف، وغسل سطح الدماغ مع برنامج تلفزيوني. الحفاظ على سطح الدماغ الرطب في هذه الخطوة. - بعد الانتهاء من الحقن، وإزالة ماصة الزجاج ببطء.
2. جراحة تكسية - زرع عدسة GRIN
ملاحظة: جراحة زرع العدسة GRIN هي الخطوة الأكثر أهمية في هذا البروتوكول. نظرًا لأن السرعة البطيئة الثابتة لحركة عدسة GRIN أمر بالغ الأهمية لزراعة عدسة GRIN الناجحة ، يمكن أن يكون ذراع الجراحة الآلية مفيدًا. ذراع الجراحة الآلية هو مناور ستيريو اكسوسيك التي يتم التحكم بها من قبل برامج الكمبيوتر. على الرغم من أن الذراع الآلية تستخدم في هذا البروتوكول، يمكن أيضا استخدام طرق أخرى طالما تتحرك العدسة باستمرار وببطء أثناء عملية الزرع. معلومات مفصلة عن الجهاز في جدول المواد.
- حفر الجمجمة لزرع اثنين من مسامير الجمجمة. غسل جميع كسور الجمجمة مع برنامج تلفزيوني.
ملاحظة: لتقليل الحركة في التصوير البصري لاحق، مطلوب اثنين على الأقل من البراغي. المسماران الجمجمة ووضع عدسة زرع نموذج مثلث متساوي الأضلاع(الشكل 1B). حجم استئصال القحف يجب أن يتناسب بإحكام مع قطر المسمار. إذا كان هناك نزيف، وغسل سطح النزيف مع برنامج تلفزيوني. سرعة الحفر هي 18000 دورة في الدقيقة ، وحجم بت هو 0.6 ملم. - تطهير مسامير مع 70٪ الإيثانول لمنع الالتهاب. زرع مسامير عميقة قدر الإمكان.
ملاحظة: يجب أن تكون المسامير ثابتة بإحكام دون الالتصاق إضافية مثل الأسمنت. - قم بتركيب ذراع جراحة آلية على الإطار المجسم. قم بتوصيل الأجهزة المطلوبة بالكمبيوتر المحمول الذي يتم فيه تثبيت برنامج التحكم(جدول المواد).
- قبل خفض عدسة GRIN، استعد لعمل مسار إبرة بإبرة 26 جم.
ملاحظة: المسار إبرة هو نوع من المسار دليل أن يساعد على زرع عدسة GRIN سميكة نسبيا في مناطق الدماغ العميق مثل اللوزة دون التسبب في تشويه شديد لهيكل الدماغ على طول مسار الحقن. ويسمى هذا المسار دليل مسار إبرة لأنه مصنوع من قبل إجراء خفض ورفع من إبرة رقيقة نسبيا 26 G. - إرفاق حامل كانولا لعقد بشكل ثابت الإبرة على الإطار ستيريو.
- قبضة إبرة 26 G مع حامل قنية وحساب إحداثيات موقع إدخال إبرة.
ملاحظة: في هذا البروتوكول، إحداثيات موقع إدخال إبرة هي 50 ميكرومتر جانبية من موقع حقن الفيروس (AP، ML، DV) = (-1.6 مم، -3.55 مم، -3.7 مم). - الوصول إلى برامج التحكم والإعداد الكامل للتلاعب موقف إبرة.
- تشغيل برنامج التحكم وحدد الزر بدء مشروع جديد لبدء التحكم في جلسة العمل.
ملاحظة: في جلسة التحكم، هناك عدة مربعات فارغة و أزرار القائمة. المربعات الفارغة هي مساحة إدخال للإحداثيات. بعد إدخال الإحداثيات في المربعات الفارغة، يتحرك ذراع stereotaxic بمحركات بالنقر على زر الانتقال إلى. يتغير زر "الانتقال إلى" إلى زر STOP عندما يتحرك الذراع المجسم. من بين عدة أزرار القائمة، مطلوب فقط زر الأداة في هذا البروتوكول. - انقر فوق الزر Tool . معايرة برنامج التحكم بالنقر فوق الزر معايرة قائمة الإطار. المعايرة هي العملية التي يتم من خلالها تعيين الموضع الفعلي للمتلاعب كقيم على برنامج Stereodrive.
- تشغيل برنامج التحكم وحدد الزر بدء مشروع جديد لبدء التحكم في جلسة العمل.
- حدد موقع إبرة الإبرة على سطح الدماغ المكشوف على سطح الجمجمة باستخدام المتلاعب المُجسم.
ملاحظة: يتم تعيين سرعة الإبرة باستخدام قائمة سرعة Microdrive في القائمة Tool. السرعة الافتراضية هي 3.0 مم/s. ومع ذلك، يوصى بسرعة 0.5 مم/الثانية في هذه الخطوة. يتم التحكم في حركة الإبرة بواسطة مفاتيح الأسهم. - إضافة 2-3 قطرات من برنامج تلفزيوني للحفاظ على سطح الدماغ الرطب. املأ المربع الفارغ على شاشة الكمبيوتر بإحداثيات DV المناسبة لـ LA. إذا كان سطح الدماغ جافًا ، فإنه يعوق اختراق الإبرة في أنسجة الدماغ.
- خفض إبرة 26 G بالنقر على زر الانتقال إلى. ويتوقف تلقائيا عندما تصل الإبرة إلى الموقع المستهدف الذي تم تعيينه بواسطة إحداثيات DV. سرعة الإبرة هي 100 ميكرومتر/ دقيقة. إذا كان هناك نزيف، ووقف الإبرة عن طريق النقر على زر وقف وغسل سطح الدماغ مع برنامج تلفزيوني. الحفاظ على سطح الدماغ الرطب في هذه الخطوة. بعد توقف النزيف، ابدأ في خفض مرة أخرى.
- بعد إبرة توقف تماما عن التحرك، أدخل 45.00 مم في مربع فارغ على شاشة الكمبيوتر.
ملاحظة: 45.00 مم قيمة تنسيق DV الذي يجعل إبرة العودة إلى موضع البداية. - رفع الإبرة عن طريق النقر على زر الانتقال إلى. سرعة حركة الإبرة هي 100-200 ميكرومتر/دقيقة.
- بعد أن تتوقف الإبرة عن الحركة، قم بإزالة برنامج تلفزيوني على سطح الدماغ. إلغاء الإبرة وحامل كانولا من الإطار stereotaxic. يمكن للمجرب إيقاف الإبرة يدويًا بالنقر على زر STOP عند الضرورة.
- تجهيز قضيب stereotaxic مع حامل العدسة. قم بتثبيت عدسة GRIN على حامل العدسة.
ملاحظة: يتم استخدام عدسة GRIN المحسنة لاستهداف LA (قطرها 0.6 مم، وطولها 7.3 مم) في هذا البروتوكول. إذا لم يتم إعداد حامل العدسة ، وهناك طريقة بديلة هي استخدام مقطع بلدغ لقبضة عدسة GRIN. - تطهير العدسة مع الإيثانول 70٪ وإرفاق قضيب stereotaxic إلى إطارات stereotaxic.
- حدد موقع طرف عدسة GRIN في الموقع المعين على سطح الجمجمة (نفس الطريقة الموضحة في الخطوة 2.8).
ملاحظة: إن الإحداثي لعدسة GRIN هو (AP، ML، DV) = (-1.6 مم، -3.55 مم، -4.2 مم)(الشكل 1C). يجب أن العدسة لا تلمس الجمجمة لتجنب الضرر على طرفها. - احسب إحداثيات DV عن طريق طرح القيمة المطلقة لـ "القيمة A" من إحداثيات DV لغرس العدسة الموضحة في الخطوة 2.16.
- إسقاط 2-3 قطرات من برنامج تلفزيوني على سطح الدماغ. أدخل 1000 ميكرومتر لخفض و 300 ميكرومتر لرفع العدسة في مربع فارغ على شاشة الكمبيوتر.
- كرر خفض (1000 μm إلى أسفل) ورفع (300 ميكرومتر إلى أعلى) من عدسة GRIN حتى تصل إلى الموقع المستهدف. ويستخدم هذا الإجراء صعودا وهبوطا للمساعدة في الإفراج عن الضغط المتولدة داخل أنسجة الدماغ بسبب انخفاض إجراءات العدسة التي يمكن أن تسبب خلاف ذلك تشويه هياكل الدماغ على طول مسار الزرع.
ملاحظة: سرعة حركة العدسة GRIN هي 100 ميكرومتر/دقيقة. حتى لو كان هناك نزيف، لا تتوقف عن تحريك عدسة GRIN وغسل سطح الدماغ مع برنامج تلفزيوني. الحفاظ على سطح الدماغ الرطب في هذه الخطوة. إذا كان سطح الدماغ جافًا ، فإن أنسجة الدماغ تلتصق بسطح عدسة GRIN وتسبب تشويهًا لبنية الدماغ. - إذا كانت عدسة GRIN تصل إلى الموقع المستهدف، وإزالة برنامج تلفزيوني وتطبيق بعناية الاسمنت الأسنان الراتنج حول عدسة GRIN، ومسامير، والجدران الجانبية الخاصة بهم(الشكل 1D).
ملاحظة: قد يؤدي تطبيق أسمنت الراتنج في جميع أنحاء الجمجمة إلى تقليل التحف المتحركة. على العكس من ذلك، إذا كان الاسمنت الراتنج يغطي بطريق الخطأ العضلات تعلق على الجمجمة، فإنه يزيد من التحف الحركة. - بعد الراتنج الأسمنت الأسنان تصلب، تفكيك عدسة GRIN من حامل العدسة وتطبيق الاسمنت الاكريليك في جميع أنحاء الجمجمة (الشكل 1D).
- لإرفاق لوحة الرأس، تفكيك حامل العدسة من قضيب stereotaxic وإرفاق لوحة الرأس على طرف القضيب باستخدام الأشرطة. تأكد من ما إذا كانت لوحة الرأس أفقية.
ملاحظة: يؤدي لوحة الرأس المائلة إلى عرض مائل. مطلوب لوحة الرأس لتحديد رأس الماوس في نظام قفص المنزل المحمول (في قسم مرفق اللوح الأساسي). إذا لم يستخدم المجرب النظام، تخطي هذه الخطوة (الخطوة 2.22) والخطوة التالية 2.23. - خفض قضيب ببطء حتى لوحة الرأس يقع في الجزء العلوي من الكفة العدسة. خفض لوحة الرأس 1000 μm أكثر. حرك لوحة الرأس لعدسة الـ GRIN المزروعة لتحديد موقعها على الحافة اليمنى للحلقة الداخلية للصفح.
ملاحظة: يجب وضع لوحة الرأس أقل من سطح العدسة GRIN المزروعة؛ خلاف ذلك ، لا يمكن أن تقترب من المنظار الدقيق ما يكفي من العدسة GRIN مزروعة لضبط الطائرة التنسيقية بسبب الاسمنت الاكريل. - تطبيق الاسمنت الاكريليك لإرفاق لوحة الرأس إلى طبقات الاسمنت (الشكل 1D).
- قم بتوصيل فيلم البارافين على سطح العدسة GRIN المزروع لحماية سطح العدسة من الغبار. ثم تطبيق السندات الايبوكسي القابلة للإزالة على فيلم البارافين للحفاظ على فيلم البارافين تبقى على سطح العدسة.
- حقن Carprofen, مسكن (0.5 ملغ / مل في برنامج تلفزيوني), و ديكساميثازون, دواء مضاد للالتهابات (0.02 ملغ / مل في برنامج تلفزيوني) حل, في تجويف البريتونية من الماوس.
ملاحظة: تعتمد جرعة الدواء على وزن الجسم: كاربون (5 ملغ•كجم -1 من وزن الجسم) و ديكساميثازون (0.2 ملغ •كجم-1 من وزن الجسم). يتم إعطاء كل من Carprofen و Dexamethasone بعد الجراحة ومرة واحدة في اليوم لمدة 7 أيام بعد الجراحة. - مزيج 0.3 ملغ / مل أموكسيسيلين, مضاد حيوي, في الماء قفص المنزل لإدارة الدواء لمدة 1 أسبوع.
- العودة الماوس إلى قفص المنزل والسماح 5-8 أسابيع للانتعاش وtransduction الفيروس.
ملاحظة: يتم استرداد الماوس في قفص قبل warmed على بطانية كهربائية حتى يستيقظ الماوس من التخدير.
3. التحقق من زرع عدسة GRIN
ملاحظة: إن التحقق من زرع عدسة GRIN يوفر معلومات حول ما إذا كانت عدسة GRIN المزروعة على الهدف لخلايا GCaMP المعبرة. وبناء على هذه المعلومات، يوفر المجرب وقته من العمليات التي تستغرق وقتا طويلا مثل اختبار السلوك ومعالجة البيانات عن طريق استبعاد الحيوانات التي استنفد غرس عدسة GRIN غير المستهدفة. أثناء إجراء التحقق من الصحة، يجب أن تركز الخلايا مع تعبير GCaMP في حقل التسجيل للعرض. يتم استخدام قفص المنزل المحمول في هذه الخطوة. القفص المنزلي المتنقل هو جهاز دائري متخصص يسمح للفئران الثابتة الرأس بتحريك أرجلها بحرية أثناء التحقق من زرع عدسة GRIN ومرفقات اللوح الأساسي. ويمكن من الطاولة الجسر الجوي في هذا الجهاز الذي يتم وضع الساقين من الفئران الثابتة الرأس مثل هذه الحركة الحرة للساقين على الرغم من أن يتم إصلاح الرأس. الخلايا في النواة الجانبي من اللوزة عادة ما تكون هادئة في حالة يستريح أو تخدير حتى يتم الكشف عن إشارات الفلورية GCaMP نادرا ما يتم الكشف في هذه الظروف، مما يجعل من الصعب جدا، وأحيانا من المستحيل، للعثور على الخلايا التي تعبر عن GCaMP أثناء التحقق من صحة زرع عدسة GRIN ومرفقات الأساسي. ومع ذلك ، فإن حركة الساقين غالبا ما تنتج إشارات الفلورية GCaMP في خلايا النواة الجانبي من اللوزة وبالتالي يمكن أن تساعد على تحديد موقع المجهر. وهكذا، يتم استخدام القفص المنزلي المتنقل في هذا البروتوكول.
- تجميع المتلاعب stereotaxic لنظام قفص المنزل المحمول.
- تخدير الماوس مع 1.5٪ غاز ايزوفلوران. بعد الماوس هو فاقد الوعي تماما، ووضع الماوس على شريط الرأس من نظام قفص المنزل المحمول.
- حدد موقع قفص الكربون تحت الماوس. أغلقي قفص الكربون و قمي بتشغيل تدفق الهواء لجعل القفص يتحرك بحرية دون احتكاك. انتظر بضع دقائق حتى يصبح الماوس نشطاً.
ملاحظة: يجب تحسين سرعة تدفق الهواء لكل حالة تجريبية (هنا، 100 لتر/دقيقة). - إزالة فيلم البارافين والسندات الايبوكسي على سطح العدسة GRIN مزروعة ومسح سطح العدسة مع 70٪ الإيثانول باستخدام ورق العدسة.
- إعداد برنامج الحصول على البيانات (DAQ) (مثل Inscopix). تعيين ظروف التصوير.
ملاحظة: يتم استخدام برنامج DAQ للتحكم في المجهر (طاقة LED ، تركيز العدسة ،إلخ)وتخزين البيانات.- قم بتشغيل المربع DAQ ثم قم بتوصيل المجهر به. ثم، توصيله إلى كمبيوتر محمول إما مباشرة باستخدام كابل أو عبر الإنترنت اللاسلكية.
ملاحظة: يتم تثبيت برنامج DAQ في الأجهزة الإضافية تسمى DAQ مربع (على سبيل المثال، Inscopix). عن طريق توصيل المربع DAQ إلى الكمبيوتر المحمول، يصبح برنامج DAQ يمكن الوصول إليها في كمبيوتر محمول. - الوصول إلى برنامج DAQ من خلال متصفح الإنترنت (فايرفوكس مستحسن).
- تعيين كافة التفاصيل الضرورية (التاريخ، معرف الماوس،الخ)في جلسة محددة. ثم انقر فوق حفظ ومتابعة. بعد الحفظ، قم بالوصول إلى جلسة عمل تشغيل.
- في جلسة التشغيل، قم بتعيين ظروف التصوير مثل وقت التعرض، والحصول على التركيز الإلكتروني، وقوة التعرض LED.
ملاحظة: يمكن تغيير طاقة الاكتساب والتعرض الضوئي للـ LED اعتمادًا على ظروف المختبر. القيمة الموصى بها للتركيز الكهربائي هو 500 ووقت التعرض هو 50 مللي ثانية. لا يوجد أي قيود على تغيير قوة LED والمكاسب. ومع ذلك، يمكن أن تسبب كثافة أعلى من الضوء المزيد من التبييض. وقت التعرض للتسجيل يحدد معدل الإطار لتسجيل الفيديو. سوف يقلل ارتفاع معدلات الإطار من كثافة الإشارة. يجب تحسين معدلات الإطارات لـ GECIs المستخدمة في التصوير.
- قم بتشغيل المربع DAQ ثم قم بتوصيل المجهر به. ثم، توصيله إلى كمبيوتر محمول إما مباشرة باستخدام كابل أو عبر الإنترنت اللاسلكية.
- لعقد المجهر على المتلاعب stereotaxic، إرفاق قضيب stereotaxic مع القابض المجهر إلى المتلاعب stereotaxic.
ملاحظة: القابض هو ملحق صغير التي يمكن إرفاقها بجهاز stereotaxic لعقد الجسم المجهر لوضعها في موقع الدماغ الهدف. - قبضة المجهر مع القابض المجهر. قم بتشغيل ضوء LED المتصل بالمجهر ومحاذاة المجهر عموديًا. خفض المجهر أثناء مراقبة الصورة حتى يظهر سطح عدسة GRIN المزروعة.
- محاذاة مركز عدسة الـ GRIN المزروعة مع مركز المنظر.
ملاحظة: يمكن إجراء التحقق من زرع عدسة GRIN في هذه الخطوة (المذكورة في قسم النتائج، الشكل 2B، الشكل 2D، الشكل 2F). - التقط صورة لسطح العدسة GRIN المزروعة (انقر فوق زر Prt Sc على لوحة المفاتيح). مطلوب صورة لسطح عدسة GRIN المزروعة لإلغاء تحديد المكونات غير العصبية أثناء معالجة البيانات لاحقًا (الخطوة 6.8).
- أوجد الموضع المناسب للمجهر. رفع ببطء عدسة الهدف من المجهر أثناء مراقبة الصورة للبحث عن الخلايا مع GCaMP7b التعبير.
ملاحظة: قد يكون من الضروري ضبط كسب الحصول على الصورة أو قوة الـ LED التي تعرضها. التحقق من زرع عدسة GRIN يمكن إجراؤه في هذه الخطوة (المذكورة في قسم النتائج، الشكل 2A، الشكل 2C، الشكل 2E).
4. مرفق لوحة أساسية
ملاحظة: تتبع خطوة المرفق في اللوحة الأساسية التحقق من صحة زرع عدسة GRIN. اللوح الأساسي هو منصة لتركيب المجهر على رأس الفئران. كما ذكر في القسم السابق، يتم استخدام قفص المنزل المحمول في هذا البروتوكول.
- بعد التحقق من زرع عدسة GRIN، تفكيك مجهر مصغر من القابض المجهر.
- إرفاق لوحة أساسية إلى المجهر. تشديد المسمار باستخدام ست عشرية مفتاح لتعلق مستقرة من اللوح الأساسي إلى المجهر.
- قبضة المجهر مع القابض المجهر. قم بتشغيل ضوء LED المتصل بالمجهر ومحاذاة المجهر عموديًا. خفض المجهر حتى يتم ملاحظة سطح عدسة GRIN المزروعة. محاذاة مركز عدسة الـ GRIN المزروعة مع مركز المنظر.
- أوجد الموضع المناسب للمجهر. رفع ببطء عدسة الهدف من المجهر حتى العثور على الطائرة البؤرية التي تعطي أفضل الصور من الخلايا مع GCaMP7b التعبير (الشكل 2A).
ملاحظة: قد يكون من الضروري ضبط كسب الحصول على الصور أو القدرة على التعرض للضوء أثناء هذه الخطوة. - تطبيق الاسمنت الاكريليك لإرفاق بثبات لوحة أساسية إلى لوحة الرأس (الشكل 2G). بناء الجدران الجانبية مع الاسمنت الاكريليك بين لوحة أساسية ولوحة الرأس.
ملاحظة: ينكمش أسمنت الأكريليك عندما يصلب. لهذا السبب، لا تقم بإزالة المجهر حتى يصلب الأسمنت تمامًا (تستغرق هذه الخطوة 30 دقيقة على الأقل). وينبغي أن يتم الاسمنت بعناية فائقة لتجنب الاسمنت غير المرغوب فيها من المجهر وعدسة هدفها مع الاسمنت الاكريليك. - بعد الاسمنت الاكريليك تصلب تماما، وتخفيف المسمار ورفع الجسم المجهر ببطء.
- إذا كان هناك فجوة على الجدار الجانبي، إعادة ترسيخ إضافية لحماية عدسة GRIN المزروعة من الغبار.
- غطي اللوح الأساسي لحماية عدسة الـ GRIN المزروعة من الغبار وإحكام المسمار في اللوح الأساسي.
- حرر لوحة الرأس من شريط الرأس. عودة الماوس إلى قفص المنزل حتى التصوير البصري في المستقبل.
5. التسجيل البصري لإشارة GCaMP أثناء اختبار السلوك
ملاحظة: يمكن أن يكون إجراء تسجيل إشارة GCaMP أثناء السلوك مختلفًا جدًا اعتمادًا على الأنظمة المستخدمة في التصوير البصري والتصميم التجريبي والبيئة المختبرية. ولذلك، فإنه هو وصفها بطريقة بسيطة في هذا القسم.
- إجراء عدة أيام من التعامل قبل اختبار السلوك.
- إعداد جهاز السلوك (على سبيل المثال، غرفة تكييف الخوف، وبرامج السلوك، وآلة كولبورن) والكمبيوتر المحمول.
- قم بتوصيل المجهر في المربع DAQ وتشغيل المربع DAQ.
- قم بتوصيل المربع DAQ بالكمبيوتر المحمول عبر اتصال إنترنت لاسلكي.
- بدء تشغيل برنامج DAQ (مستحسن متصفح فايرفوكس) على الكمبيوتر المحمول. انقر فوق زر إدارة الملفات ثم تحقق من سعة التخزين المتبقية من المربع DAQ لحفظ البيانات المسجلة.
ملاحظة: حجم البيانات هو 80 غيغابايت تقريباً لتسجيل 30 دقيقة. - أدخل المعلومات الضرورية (التاريخ، معرف الماوس،الخ.) في جلسة العمل المعرفة وأدخل في جلسة تشغيل.
- الاستيلاء بلطف على الماوس وإزالة غطاء القاعات على رأسه. وضع المجهر على منصة القاعده
- تشديد المسمار الأساسي ووضع الحيوان مع المنظار متناهي الصغر على الرأس جبل في غرفة السلوك.
ملاحظة: يحاول الماوس الهروب في هذه الخطوة إذا معالجة غير كافية. - قم بتوصيل لوحة NI بمنفذ TRIG في المربع DAQ باستخدام كبل BNC. يتلقى NI الإشارات TTL من برنامج السلوك (على سبيل المثال، FreezeFrame) وينسق إجراءات التسجيل المتزامن للإشارة GCaMP وسلوك الحيوان.
- ضبط المستوى البؤري.
ملاحظة: يتم تحديد الطائرة البؤرية عن طريق المسافة بين العدسة الموضوعية للمجهر وعدسة GRIN المزروعة في الدماغ. لضبط المستوى البؤري، يتم التلاعب في موضع العدسة الهدف أثناء مراقبة الصور. يتم تعيين المسافة بين هذين العدسات التي تظهر مورفولوجيا واضحة من الخلايا والأوعية الدموية كقطة محورية للتصوير. في هذا البروتوكول، يتم استخدام برنامج DAQ للتحكم في حركة العدسة الهدف أثناء الضبط. - تعيين وقت التعرض الأمثل، وكسب، والطاقة LED في دورة تشغيل.
ملاحظة: عموما، يتم استخدام 50 مللي ثانية لوقت التعرض. يتم تعيين اكتساب و LED السلطة على أساس الرسوم البيانية الصورة. تشير الرسوم البيانية إلى توزيع شدة الفلورس للبكسل. استناداً إلى الفحص البصري، يجب أن تكون الحافة اليمنى من الرسم البياني قيمة بين 40٪ و 60٪ في حالة GCaMP7b. يتغير هذا النظام بناءً على GECIs المستخدم في التصوير. - تغيير خيار التسجيل إلى تسجيل مشغّل. انقر فوق تسجيل وبدء السلوك.
ملاحظة: يوفر خيار تسجيل triggered جدول زمني متطابقة جلسة عمل التسجيل و جلسة السلوك. إذا تم تلقي إشارة TTL، يتم تشغيل ضوء أحمر فوق منفذ TRIG. - بعد الانتهاء من اختبار السلوك، قم بفصل المجهر وارفق غطاء اللوحة الأساسية.
- العودة الماوس إلى قفص المنزل. ثم حدد إدارة الملفات وتصدير البيانات من المربع DAQ.
- بعد اختبار السلوك، اضحي بالماوس للتحقق من صحة الانتمائية بعد الوفاة.
6- معالجة البيانات
ملاحظة: يختلف إجراء معالجة البيانات اختلافاً كبيراً تبعاً لبرنامج معالجة البيانات و GECIs المستخدم في تجربة التصوير. ولذلك، فإنه هو وصفها بطريقة بسيطة في هذا القسم. يستخدم هذا البروتوكول برامج معالجة البيانات التجارية (انظر جدول المواد). بدلا من ذلك، يمكن أيضا أن غيرها من البرامج المفتوحة المصدر المذكورة في قسم المناقشة يمكن استخدامها مع أي مشكلة. يتم سرد المتغيرات المستخدمة في هذا البروتوكول في الجدول 1.
- استيراد ملف بيانات الفيديو تسجيل (1280 بكسل × 800 بكسل) من المربع DAQ إلى كمبيوتر سطح المكتب لمعالجة البيانات. بدء تشغيل برنامج معالجة البيانات.
ملاحظة: برنامج معالجة البيانات يختلف عن برنامج DAQ في الخطوات السابقة. في برامج معالجة البيانات ، هناك 6 خطوات: أخذ عينات أسفل ، الاقتصاص ، تصفية مكانية ، تصحيح الحركة ، حساب ΔF / F ، الكشف عن الحدث والتي تعد ضرورية لاستخراج بيانات عابرة أحادية الخلية الكالسيوم من الفيديو المسجل. - خفض حجم والمحاصيل الفيديو.
ملاحظة: إن الاختزال والحصد ضروريان لزيادة سرعة معالجة البيانات. المحاصيل المنطقة باستثناء المنطقة ذات الأهمية حيث لوحظ إشارة GCaMP. - تطبيق عامل تصفية مكاني. بعد تطبيق مرشح مكاني، قم بإنشاء صورة إسقاط شدة متوسطة.
ملاحظة: يميز المرشح المكاني كل بكسل في صورة الفيديو المسجلة ويوفر صورة عالية التباين. هناك نوعان من تصفية قطع، وانخفاض وارتفاع تصفية قطع. أعلى قيمة منخفضة خفض قبالة مرشحات يزيد من التباين من الصورة ولكن في نفس الضوضاء الرمادية العامة أيضا يزيد. القيمة الأقل من ارتفاع خفض قبالة مرشح يجعل الصورة تصبح طمس. - تطبيق تصحيح الحركة. استخدم صورة الإسقاط شدة الوسط كصورة مرجعية لتصحيح الحركة.
- تطبيق تصحيح الحركة مرة أخرى باستخدام صورة الإطار الأول كصورة مرجعية.
ملاحظة: خطوتان من تصحيح الحركة تقلل بشكل كبير من الحركة. - تطبيق حساب ΔF/F لتصور بكسل التي تظهر تغييرا في السطوع.
ملاحظة: يحدث تغير السطوع في البيكسلات بسبب تغير شدة الفلور من GCaMP، ويشير إلى عابرات الكالسيوم. - تطبيق الخوارزمية PCA / ICA لتصور منحنى عابر الكالسيوم من كل خلية.
ملاحظة: PCA/ICA هو خوارزمية لفرز مجموعة من البيانات في مجموعة من بيانات مكون واحد. وينبغي أن تكون المتغيرات الأمثل لكل حالة مختبرية. في هذا البروتوكول، كافة المتغيرات افتراضية باستثناء ICA الوزن الزمني (0.4 يستخدم في هذا البروتوكول)27. - قم بإلغاء تحديد المكونات غير العصبية يدويًا بين المكونات المحددة استنادًا إلى المعايير الموضحة في الملاحظة التالية.
ملاحظة: يتم استخدام معيارين رئيسيين لهذا الغرض. أولاً، إشارة GCaMP نشأت من خلية عصبية تبدو وكأنها شكل كروي واضح. وهكذا، يتم تحديد إشارة فقط مع شكل كروي واضح كخليون. ثانيا، نظرا لقطر الخلية الجسم من الخلايا الهرمية amygdala ومن المعروف أن ما يقرب من 20 μm28،29،30، فقط إشارة يطابق تقريبا مع هذا الحجم يتم اختيار الخلايا العصبية. لتحديد حجم إشارة GCaMP، يتم حساب الحجم الفعلي لبكسل واحد استناداً إلى الصورة الملتقطة لسطح العدسة (الخطوة 3.9) ويتم حساب العرض الأقصى لشكل كروي مفرد. على سبيل المثال، في هذا البروتوكول، قطر عدسة GRIN المزروعة هو 600 ميكرومتر. لذلك، إذا كان قطر العدسة 800 بكسل، فإن الحجم الفعلي للبكسل الواحد هو 1.5 ميكرومتر (20 ميكرومتر حوالي 7 بكسل). - تطبيق وظيفة الكشف عن الحدث للكشف عن زيادة كبيرة من الكالسيوم عابر (حدث الكالسيوم).
ملاحظة: في هذه الخطوة، مطلوب متغير يسمى الحدث أصغر وقت الضم (τ). في هذا البروتوكول، يتم استخدام 1.18s كمتغير محسن لـ GCaMP7b. ويحسب متوسط نصف الوقت (t1/2= 0.82s) على أساس منحنى ΔF / F أثناء النشاط التلقائي للخلايا. منذ GCaMP يتبع الاضمحلال الأسي، τ = .
.
النتائج
التحقق من زرع عدسة GRIN
قبل ربط مزمنة اللوح الأساسي إلى الدماغ عن طريق ترسيخ, زرع عدسة GRIN يحتاج إلى التحقق من صحتها. في الحيوانات مع زرع عدسة ناجحة، لوحظ بوضوح كل GCaMP التعبير عن الخلايا والأوعية الدموية داخل نطاق الطائرة المحورية التي تحددها المسافة بين عدسة الهدف من المجهر وعدسة GRIN المزروعة (الشكل 2A و B). وعلى النقيض من ذلك، في الحيوانات التي بها غرس خارج الهدف، لم تُلاحظ صورة واضحة لخلايا التعبير عن GCaMP داخل نطاق الطائرة البؤري (إما خارج التركيز أو خارج الرؤية). في حالة عدم التركيز ، يمكن ملاحظة الأوعية الدموية ذات التركيز الجيد ولكن فقط صور ضبابية للخلايا داخل نطاق الطائرة البؤري(الشكل 2ج و D). في حالة عدم الرؤية، لم يتم ملاحظة الأوعية الدموية في معظم الحالات ولم يتم الكشف عن إشارة الفلوريسنس داخل نطاق الطائرة البؤري(الشكل 2E). وعلاوة على ذلك، على عكس الحالات الأخرى، أظهرت عدسة GRIN المزروعة حافة مشرقة (الشكل 2F). يتم إجراء مرفق اللوح الأساسي فقط على الحيوانات التي تم التحقق من صحتها مع زرع عدسة GRIN المستهدفة.
تسجيل إشارات GCaMP في الخلايا العصبية لوس انجليس ردا على المحفزات السمعية
في هذا البروتوكول، تم عرض 4 حالات من النبرة الزائفة (2.8 كيلوهرتز، 200 مللي ثانية، 25 نبضة) على الماوس، وسجلت إشارات GCaMP بصريا في خلايا لوس انجليس من الفئران مع المنظار المجهري على جبل الرأس. واستخدمت الفئران حقن مع AAV1-Syn-GCaMP7b-WPRE في اللوزة الجانبي الأحادية للتصوير. في الحيوانات مع زرع عدسة GRIN ناجحة، لوحظ بوضوح الخلايا التي تعبر عن الفيروس والأوعية الدموية داخل نطاق الطائرة البؤري(الشكل 3A). في حالة السلوك، ما يقرب من 50-150 عادة ما تعرض الخلايا تغيير fluorescence كبيرة في مجال الرؤية في لوس انجليس حتى من دون لهجة كما هو مبين في صورة ΔF / F، من المرجح عفويا خلايا نشطة (الشكل 3B). عند عرض نغمة، عرض عدد قليل من الخلايا فقط تغيير نغمة محددة من إشارة GCaMP كما يحددها تحليل صورة ΔF / F (6 خلايا في الشكل 3C والشكل 3D). وأجريت نفس الإجراءات على الفئران حقن مع AAV2/1-CaMKIIα-GFP كتحكم. على الرغم من أن GFP التعبير عن الخلايا تم الكشف عنها داخل نطاق الطائرة البؤري، أي خلايا عرض تغيير fluorescence كبيرة مع أو بدون لهجة كما يحددها تحليل صورة ΔF / F(الشكل 3E والشكل 3F).
للتحقق النسيجي من تعبير GCaMP واستهداف عدسة GRIN، يتم فحص أقسام الإكلال من الدماغ بعد الوفاة تحت المجهر المفلور(الشكل 4A والشكل 4B). يستخدم تلطيخ DAPI لتأكيد الخلايا السليمة ولا توجد علامة على تلف الأنسجة بسبب التهاب أنسجة الدماغ حول عدسة GRIN (الشكل 4C).
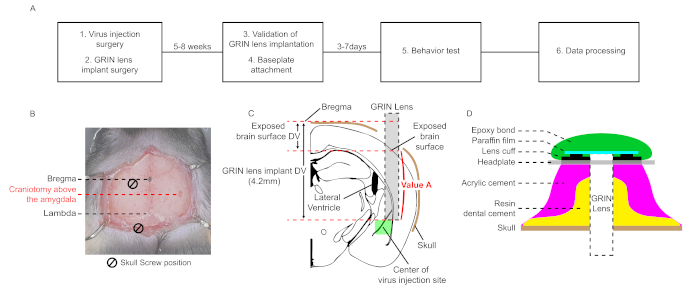
الشكل 1: سير العمل التخطيطي والرسوم البيانية لجراحة مجسمة لفي التصوير المجهري للكالسيوم في لوس انجليس (أ) سير عمل تخطيطي في التصوير المجهري للكالسيوم في لوس انجليس. (ب) صورة مجهرية تُظهر إحداثيات ثنائية الأبعاد لمواقع استئصال القحف لحقن الفيروس وجراحة زرع عدسة "غرين". مسامير الجمجمة اثنين والعدسة تشكل مثلث متساوي الأضلاع. (ج) رسم بياني للموضع النسبي بين موقع حقن الفيروس وعدسة "غرين" المزروعة، وشرح تخطيطي لحساب "القيمة ألف". (د) مقطع عرضي لطبقة الأسمنت من سطح الجمجمة إلى اللوح الرأسي في الخطوات النهائية للجراحة. وينبغي أن الاسمنت الراتنج الأسنان تغطي جدار المسامير وعدسة GRIN مزروعة. يتم تطبيق الاسمنت الاكريليك على الاسمنت الراتنج الأسنان. يتم إرفاق اللوح الرأسي على طبقة الأسمنت. يغطي فيلم البارافين سطح عدسة GRIN المزروعة ويحميه من الغبار. السندات الايبوكسي القابلة للإزالة يمنع فصل من فيلم البارافين. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التحقق من زرع عدسة GRIN وتكوين طبقات الأسمنت بعد مرفق اللوح الأساسي. (أ) صورة لقطة بالمنظار من الحيوانات مع زرع عدسة GRIN ناجحة. كل من GCaMP التعبير عن الخلايا والأوعية الدموية لوحظت بوضوح. (ب) صورة سريعة لسطح عدسة GRIN المزروعة من الحيوانات مع زرع عدسة GRIN ناجحة. (ج) صورة لقطة بالمنظار من الحيوانات مع زرع عدسة GRIN خارج التركيز. (د) صورة لقطة لسطح عدسة GRIN المزروعة من الحيوانات مع زرع عدسة GRIN خارج التركيز. في حالة عدم التركيز، تتم ملاحظة الأوعية الدموية في بعض الأحيان بوضوح ولكن الصور غير واضحة فقط للخلايا داخل نطاق الطائرة البؤري. (هـ) صورة لقطة بالمنظار من الحيوانات مع زرع عدسة GRIN خارجة عن العرض. في حالة عدم الرؤية، لا يتم ملاحظة الأوعية الدموية في معظم الحالات ولا يتم الكشف عن أي إشارة مفلورة داخل نطاق الطائرة البؤري. (و) صورة سريعة لسطح عدسة GRIN المزروعة من الحيوانات مع زرع عدسة GRIN خارج نطاق العرض. على عكس الحالات الأخرى ، يتم ملاحظة الحافة الساطعة في هذه الحالة. (ز) تكوين طبقات الأسمنت لمرفقات اللوح الأساسي. يتم إرفاق اللوح الأساسي واللوحة الرأسية بواسطة أسمنت الأكريليك. يجب أن يكون هناك مساحة شاغرة مع الاسمنت الاكريليك بين قاع القاعدة وعدسة GRIN. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
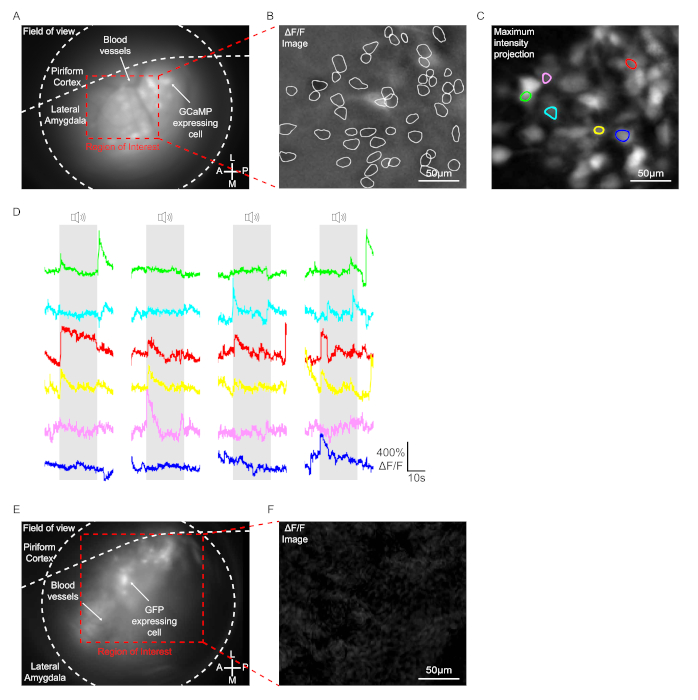
الشكل 3: تسجيل إشارات GCaMP في الخلايا العصبية LA. (من ألف إلى جيم) البيانات التي تم الحصول عليها من ماوس تم حقنها بـ AAV1-Syn-GCaMP7b-WPRE. (أ) صورة لقطة بالمنظار التمثيلي أثناء اختبار السلوك. ولوحظ بوضوح GCaMP7b الخلايا المعبرة والأوعية الدموية داخل نطاق الطائرة المحورية. (ب) صورة لقطة تمثيلية تُظهر إشارة ΔF/F. يشير الخط الأبيض إلى الخلايا التي تعرض تغييرًا كبيرًا في الفلوريس في المنطقة التي تهم أثناء اختبار السلوك. شريط مقياس = 50 ميكرومتر. (C) أقصى كثافة الإسقاط الصورة. مجموع 6 خلايا عرض تغيير لهجة محددة من إشارة GCaMP. شريط مقياس = 50 μm. (د) ممثل ΔF / F آثار لهجة استجابة الخلايا. كل لون يتوافق مع كل خلية فردية بنفس اللون في اللوحة (C). (هاء و واو) البيانات التي تم الحصول عليها من فأر حقن مع AAV2/1-CaMKIIα-GFP. (هـ) صورة لقطة بالمنظار التمثيلي أثناء اختبار السلوك. تم الكشف بوضوح عن الخلايا المعبرة عن GFP داخل نطاق المستوى البؤري. (و) صورة لقطة تمثيلية تُظهر إشارة ΔF/F. شريط مقياس = 50μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: التحقق النسيجي من موضع عدسة GRIN والتعبير GCaMP7b. (أ) صورة تمثيلية لقسم الإكليل تُظهر تعبير GCaMP7b في لوس أنجلوس. شريط مقياس = 200μm. (ب) صورة المكبرة. شريط مقياس = 50 ميكرومتر. (ج) صورة مجهرية الفلوريسين تظهر DAPI تلطيخ إشارة. شريط مقياس = 200 μm. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| عامل | قيمه |
| عامل أخذ العينات الهازل المكاني | 2 |
| عامل أخذ العينات النازل الزمني | 2 |
| مرشح المكاني: ارتفاع قطع | 0.5 |
| مرشح المكاني: انخفاض قطع | 0.005 |
| تصحيح الحركة: ارتفاع قطع | 0.016 |
| تصحيح الحركة: انخفاض قطع | 0.004 |
| تصحيح الحركة: ماكس ترانسليشن | 20 |
| الإطار المرجعي ΔF/F | الإطار المتوسط |
| PCA/ICA: كتلة حجم | 1000 |
| PCA/ICA: التقارباله | 1x10^-5 |
| PCA/ICA: icaTemporalWeight | 0.4 |
| PCA/ICA: numICs | 120 |
| PCA/ICA: numPCs | 150 |
| PCA/ICA: إلغاء اِيَسَب | الزمنيه |
| اكتشاف الحدث: ثابت الاضمحلال | 1.18 |
| اكتشاف الحدث: عتبة | 4 |
الجدول 1: قائمة المتغيرات لمعالجة البيانات
Discussion
تقنيات الجراحة ماهرا ضرورية لتحقيق النجاح في التصوير بالكالسيوم البصرية vivo مع المجهر مصغرة الرأس جبل في مناطق الدماغ أعمق مثل اللوزة كما وصفنا هنا. لذلك، على الرغم من أن هذا البروتوكول يوفر إرشادات للعمليات الجراحية المحسنة لمرفقات اللوح الأساسي وغرينس عدسة زرع، قد تكون عمليات التحسين الإضافية ضرورية للخطوات الهامة. كما هو مذكور في قسم البروتوكول، إحداثيات اللوزة في الجراحة، وسرعة تدفق الهواء في خطوة المرفقات الأساسية، وإعدادات الحصول على الصور (معدل الإطار، وقوة LED،وماإلى ذلك) في تسجيل الكالسيوم والمتغيرات (الوزن الزمني ICA، أصغر وقت للانحلال،إلخ)في معالجة البيانات تحتاج إلى تحسين.
يمكن تعديل خطوة المرفقات الأساسية. لوحة الرأس ضروري لأنه يساعد على إصلاح رأس الفئران مستيقظا خلال مرفق لوحة الأساس التي أجريت في قفص المنزل المحمول. ومع ذلك، إذا لم يتم إعداد القفص المنزلي المتنقل في المختبر، فإن نظام التخدير بغاز الأيزوفلوران هو خيار بديل. لهذه الطريقة البديلة، قد يكون تركيز غاز الأيزوفلوران حاسماً. لاحظنا أن GCaMP نادرا ما يتم الكشف عن إشارة في اللوزة من الفئران تحت 1.5٪ ايزوفلوران. على العكس من ذلك، يتم الكشف عن إشارة GCaMP تحت شرط isoflurane 0.8٪ والفئران البقاء في حالة مستيقظا تقريبا ولكن من دون حركة رئيس كبيرة في هذه الحالة. وبالتالي فإن حالة التخدير هذه تسمح بإجراء مرفق اللوح الأساسي دون استخدام أجهزة إضافية مثل لوحة الرأس والأقفاص المنزلية المتنقلة.
يمكن أن يسبب المرفق غير المستقر من المسمار الجمجمة والاسمنت، والقاعدة، والمجهر التحف الحركة التي يمكن تصحيحها باستخدام خوارزمية برنامج تصحيح الحركة. ويعتقد أن حركة البطين الجانبي تسبب نوع غير منتظم من التحف الحركة التي لا يمكن تصحيحها بسهولة مع برامج تصحيح الحركة المتاحة حاليا. مثل هذه التحف الحركة غير النظامية هي الحد الأدنى في معظم المناطق السطحية في الدماغ مثل قرن آمون والقشرة. ومع ذلك، فإنه يتم الكشف عنها في كثير من الأحيان أثناء التصوير البصري في اللوزة. للتغلب على هذه المشكلة، يقترح هذا البروتوكول زرع عدسة GRIN 50 ميكرومتر بعيدا عن موقع الحقن الفيروسي إلى الجانب الجانبي(الشكل 1C)،مما يحسن إلى حد كبير عملية الحصول على الصور عن طريق الحد من التحف الحركة المحتملة التي نشأت من البطين الجانبي. على الرغم من أننا وضعنا 50 ميكرومترًا بالنسبة لموقع الحقن الفيروسي، فإن التنسيق المستهدف لزرع العدسة قد يتم تعيينه أيضًا بالنسبة للبطين الجانبي. في هذا البروتوكول، ونحن معللة أنه من الأكثر أهمية لاستهداف بدقة موقع التعبير الفيروسية لأداء ناجح للتصوير. وهكذا، استخدمنا إحداثي حقن فيروسية كمرجع لتحديد الإحداثي المستهدف لزرع العدسة. من خلال التجارب المتكررة ، أنشأنا حالة مثالية سمحت لعدسة GRIN باستهداف موقع التعبير الفيروسي بكفاءة مع تجنب التحف المتحركة الناجمة عن حركة البطينين الجانبي. في نهاية المطاف ، فإن الطريقة التي يمكن أن تصحح بكفاءة ودقة أي حركة التحف تكون عونا كبيرا للوصول إلى التصوير البصري إلى مناطق أعمق في الدماغ في المستقبل.
على الرغم من أن التصوير في في vivo الكالسيوم البصري مع المجهر مصغرة رئيس جبل هو أداة قوية وتم تحسينها، لا يزال هناك مجال للتحسين في العديد من الجوانب. هذا البروتوكول سوف يسهل الدراسات التي تهدف إلى التحقيق في النشاط العصبي في الوقت الحقيقي في اللوزة من الحيوانات تتصرف بحرية.
Disclosures
صاحب البلاغ ليس لديه ما يكشفه
Acknowledgements
وقد تم دعم هذا العمل من خلال منح من مؤسسة سامسونج للعلوم والتكنولوجيا (مشروع رقم SSTF-BA1801-10).
Materials
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
References
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637(2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128(2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved