Method Article
Erfolgreiche In-vivo-Calcium-Bildgebung mit einem kopfmontierten Miniaturmikroskop in der Amygdala der frei verhaltenden Maus
In diesem Artikel
Zusammenfassung
In vivo mikroendoskopische Kalzium-Bildgebung ist ein unschätzbares Werkzeug, das Echtzeit-Überwachung von neuronalen Aktivitäten bei frei verhaltenden Tieren ermöglicht. Jedoch, Anwendung dieser Technik auf die Amygdala war schwierig. Dieses Protokoll soll eine nützliche Leitlinie für die erfolgreiche Ausrichtung auf Amygdala-Zellen mit einem miniaturisierten Mikroskop bei Mäusen bieten.
Zusammenfassung
In vivo Echtzeit-Überwachung von neuronalen Aktivitäten bei frei beweglichen Tieren ist einer der wichtigsten Ansätze, um neuronale Aktivität mit Verhalten zu verknüpfen. Zu diesem Zweck wurde eine in vivo-Bildgebungstechnik entwickelt, die Kalziumtransienten in Neuronen mithilfe genetisch kodierter Calciumindikatoren (GECIs), eines miniaturisierten Fluoreszenzmikroskops und einer Gradienten-Refraktiven-Index-Linse (GRIN) erkennt und erfolgreich auf viele Gehirnstrukturen1,2,3,4,5,6angewendet. Diese bildgebende Technik ist besonders leistungsfähig, da sie eine chronische simultane Bildgebung genetisch definierter Zellpopulationen über einen längeren Zeitraum bis zu mehreren Wochen ermöglicht. Obwohl nützlich, diese bildgebende Technik wurde nicht leicht auf Gehirnstrukturen angewendet, die tief im Gehirn wie Amygdala, eine wesentliche Gehirnstruktur für emotionale Verarbeitung und assoziative Angst Gedächtnis7lokalisieren. Es gibt mehrere Faktoren, die es schwierig machen, die bildgebende Technik auf die Amygdala anzuwenden. Zum Beispiel treten Bewegungsartefakte in der Regel häufiger während der Bildgebung in den tieferen Hirnregionen auf, weil ein tief in das Gehirn implantiertes Kopf-Mount-Mikroskop relativ instabil ist. Ein weiteres Problem ist, dass der seitliche Ventrikel in der Nähe der implantierten GRIN-Linse positioniert ist und seine Bewegung während der Atmung zu hochunregelmäßigen Bewegungsartefakten führen kann, die nicht leicht korrigiert werden können, was es schwierig macht, eine stabile bildgebende Ansicht zu bilden. Da die Zellen in der Amygdala in der Regel in einem ruhenden oder anästhesierten Zustand ruhig sind, ist es schwierig, die Zielzellen, die GECI in der Amygdala exzieren, während des Baseplating-Verfahrens für eine spätere Bildgebung zu finden und zu fokussieren. Dieses Protokoll bietet eine hilfreiche Anleitung, wie zellen, die GECI in der Amygdala exemiten, effizient mit einem miniaturisierten Mikroskop mit Kopfmontage für eine erfolgreiche In-vivo-Calcium-Bildgebung in einer so tieferen Hirnregion gezielt werden können. Es wird darauf hingewiesen, dass dieses Protokoll auf einem bestimmten System (z. B. Inscopix) basiert, aber nicht darauf beschränkt ist.
Einleitung
Kalzium ist ein allgegenwärtiger zweiter Botenstoff, der eine entscheidende Rolle in fast allen Zellfunktionen spielt8. In Neuronen führen Aktionspotentialabschuss und synaptische Sendeleistung zu einer schnellen Veränderung der intrazellulären freien [Ca2+]9,10. Daher bietet die Verfolgung von Kalziumtransienten die Möglichkeit, die neuronale Aktivität zu überwachen. GECIs sind leistungsstarke Werkzeuge, die die Überwachung [Ca2+] in definierten Zellpopulationen und intrazellulären Kompartimenten11,12ermöglichen. Unter vielen verschiedenen Arten von proteinbasiertem Kalziumindikator ist GCaMP, eine Ca2+-Sonde, die auf einem einzigen GFP-Molekül13basiert, die am meisten optimierte und daher am weitesten verbreitete GECI. Durch mehrere Runden des Engineerings wurde eine Reihe von Varianten von GCaMP entwickelt12,14,15,16. Wir verwenden einen der kürzlich entwickelten GCaMPs, GCaMP7b, in diesem Protokoll16. GCaMP-Sensoren haben wesentlich zur Untersuchung der Funktionen des neuronalen Schaltkreises in einer Reihe von Modellorganismen beigetragen, wie z. B. der Abbildung von Ca2+ Transienten während der Entwicklung17, in vivo Bildgebung in einer spezifischen kortikalen Schicht18, Messung der Schaltungsdynamik im Motoraufgabenlernen19 und Bildgebung der Zellensembleaktivität im Zusammenhang mit assoziativem Angstgedächtnis im Hippocampus und Amygdala20,21.
Optische Bildgebung von GECIs hat mehrere Vorteile22. Die genetische Codierung ermöglicht es, GECIs für einen längeren Zeitraum stabil in einer bestimmten Teilmenge von Zellen zu exprimieren, die durch genetisches Profil oder spezifische Muster anatomischer Konnektivität definiert sind. Optische Bildgebung ermöglicht in vivo chronische simultane Überwachung von Hunderten bis Tausenden von Neuronen bei lebenden Tieren. Einige optische Bildgebungssysteme wurden für die In-vivo-Bildgebung und Analyse von GECIs im Gehirn frei verhaltender Mäuse mit miniaturisierten Fluoreszenzmikroskopen21,23,24,25entwickelt. Obwohl die optische Bildgebungstechnik in vivo, die auf GECIs, GRIN-Objektiv und einem Head-Mount-Miniaturmikroskop basiert, ein leistungsfähiges Werkzeug ist, um den Zusammenhang zwischen neuronaler Schaltkreisaktivität und Verhalten zu untersuchen, war die Anwendung dieser Technologie auf die Amygdala aufgrund mehrerer technischer Probleme im Zusammenhang mit der Ausrichtung der GRIN-Linse auf Zellen, die GECIs in der Amygdala exzieren, ohne Bewegungsartefakte zu verursachen, die die Qualität der Bildaufnahme stark reduzieren und Zellen finden, die GECIs exdrücken. Dieses Protokoll soll eine hilfreiche Richtlinie für chirurgische Verfahren der Baseplate-Anhaftung und GRIN-Linsenimplantation bieten, die entscheidende Schritte für eine erfolgreiche optische Kalzium-Bildgebung in vivo in der Amygdala sind. Obwohl dieses Protokoll auf die Amygdala abzielt, sind die meisten hier beschriebenen Verfahren allgemein auf andere tiefere Hirnregionen anwendbar. Obwohl dieses Protokoll auf einem bestimmten System (z. B. Inscopix) basiert, kann derselbe Zweck leicht mit anderen alternativen Systemen erreicht werden.
Protokoll
Alle Verfahren wurden von der Animal Ethics Committee am Korea Advanced Institute of Science and Technology genehmigt. Alle Experimente wurden in Übereinstimmung mit der Leitlinie des Institutionellen Ausschusses für Tierpflege und -nutzung durchgeführt.
HINWEIS: Dieses Protokoll besteht aus sechs Hauptschritten: Virusinjektionschirurgie, GRIN-Linsenimplantatchirurgie, Validierung der GRIN-Linsenimplantation, Baseplattenbefestigung, optische Aufzeichnung des GCaMP-Signals während eines Verhaltenstests und Datenverarbeitung (Abbildung 1A). Außer bei der Chirurgie wird das kommerzielle Softwarepaket (Inscopix) verwendet.
1. Stereotaxie Chirurgie – AAV Virus Injektion
HINWEIS: Der bei diesem chirurgischen Eingriff verwendete Mausstamm ist C57BL6/J. Der Körper des Tieres ist während der Operation mit einem sterilen Drap bedeckt und alle Schritte im Protokoll werden mit sterilen Handschuhen durchgeführt. Mehrere Operationen werden in der Regel nicht am selben Tag durchgeführt. Wenn jedoch mehrere Mäuse am selben Tag dieselbe Operation durchführen müssen, verwenden Sie einen separaten Satz autoklavierter chirurgischer Werkzeuge für jede Maus und 70 % Ethanol, um die chirurgischen Instrumente zwischen Mäusen zu desinfizieren. Um die Maus während des chirurgischen Eingriffs warm zu halten, wird die Maus mit einer maßgeschneiderten chirurgischen Decke bedeckt, nachdem sie am stereotaxic Rahmen befestigt wurde.
- Desinfizieren Sie alle erforderlichen chirurgischen Werkzeuge mit 70% Ethanol und bereiten Sie eine Hamilton-Spritze und eine Glaspipette vor. Füllen Sie die Glaspipette mit destilliertem Wasser.
HINWEIS: Alle im Protokoll verwendeten chirurgischen Werkzeuge sind autoklaviert. Da die GRIN-Linse und die Schädelschrauben nicht zur Sterilisation autoklaviert werden können, werden 70 % Ethanol als Desinfektionsmittel zur Vorbeugung von Entzündungen eingesetzt. Obwohl nicht versucht, können andere Formen der Sterilisation verwendet werden, z. B. Gas oder chemische Sterilisation. - Anästhetisieren Sie die Maus mit Pentobarbital (83mg-kg -1 Körpergewicht) durch intraperitoneale Injektion. Nachdem die Maus bewusstlos wird, rasieren Sie das Fell auf dem Schädel.
- Reinigen Sie die Haut über dem Schädel mit 70% Ethanol und fixieren Sie die Maus am stereotaxic Rahmen. Entfernen Sie vorsichtig die Haut und wischen Sie die Schädeloberfläche mit einer 35% Wasserstoffperoxidlösung mit einem Baumwollspitzen-Applikator ab. Schmiermittel Augensalbe auftragen, um eine Hornhauttrocknung während der Operation zu verhindern.
HINWEIS: Obwohl es in der Regel kein Problem mit der Verwendung von 70% Ethanol nur für die aseptische Hautzubereitung gibt, wird empfohlen, 3 abwechselnde Runden des Desinfektionsmittels zu verwenden, z. B. Iodophoren oder Chlorhexidinlösung und 70% Ethanol. In diesem Protokoll wird eine höhere Konzentration von Wasserstoffperoxid verwendet, um sicherzustellen, dass das Bindegewebe am Mausschädel so vollständig wie möglich entfernt wird, was für die Reduzierung des Bewegungsartefakts während der späteren Bildgebung von entscheidender Bedeutung ist, da das Bindegewebe am Schädel eine feste Befestigung der Grundplatte am Schädel stört. Es sei darauf hingewiesen, dass 35 % Wasserstoffperoxid viel höher ist als das, was normalerweise verwendet wird (3 %). - Fixieren Sie den Stift mit einem stereotaxic-Sondenhalter. Richten Sie die Höhe des Bregma und Deslambda mit dem Stift aus.
- Finden Sie die spezifische Position auf dem Mausschädel für die Kraniotomie.
ANMERKUNG: Die Koordinaten der lateralen Amygdala (LA) zur Virusinjektion sind (AP, ML, DV) = (-1,6 mm, -3,5 mm, -4,3 mm) aus Bregma in diesem Protokoll (AP; Vorder-Posterior, ML; Medial-Lateral, DV; Dorsal-Ventral, jede Abkürzung gibt einen relativen axialen Abstand vom Bregma an)26. Die Koordinaten sollten für jede Versuchsbedingung optimiert werden. - Bohren Sie die Schädeloberfläche (Abbildung 1B). Schädelfraktionen mit Phosphatgepufferter Saline (PBS) waschen. Entfernen Sie die verbleibende Schicht mit Zangen oder einer 27 G Nadel.
- Versuchen Sie beim Bohren des Schädels, die letzte Dura-Schicht nicht zu berühren, um Schäden an der Hirngewebeoberfläche zu vermeiden. Eine beschädigte Gehirnoberfläche verursacht Entzündungen um die Linse, die schwere Bewegungsartefakte und hohe Autofluoreszenz während der Aufnahme induziert. Die Größe der Kraniotomie beträgt 1,6 mm. Die Bohrgeschwindigkeit beträgt 18.000 Rpm, und die Bitgröße beträgt 0,6 mm.
- Um die GRIN-Linse von der Hirngewebeoberfläche der gebohrten Stelle zur Ziel-Amygdala-Stelle zu senken, berechnen Sie den als "Wert A" bezeichneten Abstand, indem Sie die DV-Differenz zwischen dem Bregmäen und der exponierten Hirnoberfläche von der DV-Koordinate der Linsenimplantation subtrahieren, die auf der Grundlage des Bregmädes (in diesem Fall 4,2 mm, Abbildung 1C)eingestellt wird.
- Laden Sie 3 l Mineralöl und 0,7 l der AAV-Viruslösung in die Glaspipette.
HINWEIS: Mineralöl hilft, Viruslösung und Wasser zu trennen. 0,7 l ist ein optimiertes Volumen für die LA-Virusinjektion, das die LA vollständig abdecken kann. - Entfernen Sie den Stift aus dem stereotaxic-Sondenhalter und fixieren Sie die Glaspipette daran.
- Suchen Sie die Glaspipette an der in Schritt 1.5 genannten Injektionsstelle. Legen Sie die Glaspipette in das Hirngewebe ein, nachdem die Blutung vollständig gestoppt wurde.
- Liefern Sie das Virus durch eine Glaspipette mit einer Injektionspumpe.
HINWEIS: Der Titer des Virus sollte mehr als 1 x 1013 vg/ml sein, um eine ausreichende Anzahl von GCaMP-exezierenden Zellen zu erhalten. Die Einspritzgeschwindigkeit beträgt 0,1 l/min und ist 10 min diffus. Wenn blutungen, waschen Sie die Gehirnoberfläche mit PBS. Halten Sie die Gehirnoberfläche in diesem Schritt nass. - Nach der Injektion die Glaspipette langsam entfernen.
2. Stereotaxie Chirurgie – GRIN-Linsenimplantation
HINWEIS: DIE CHIRURGIE des GRIN-Linsenimplantats ist der wichtigste Schritt in diesem Protokoll. Da eine gleichbleibend langsame Geschwindigkeit der GRIN-Linsenbewegung für eine erfolgreiche GRIN-Linsenimplantation entscheidend ist, kann ein motorisierter Operationsarm nützlich sein. Der motorisierte Operationsarm ist ein stereotaxic Manipulator, der von Computersoftware gesteuert wird. Obwohl der motorisierte Arm in diesem Protokoll verwendet wird, können auch andere Wege verwendet werden, solange sich die Linse während der Implantation konstant und langsam bewegt. Ausführliche Informationen über das Gerät finden Sie in der Tabelle der Materialien.
- Bohren Sie den Schädel, um zwei Schädelschrauben zu implantieren. Waschen Sie alle Schädelfraktionen mit PBS.
HINWEIS: Um die Bewegungsartefakte in späteren optischen Bildgebungen zu reduzieren, sind mindestens zwei Schrauben erforderlich. Die beiden Schädelschrauben und die Position des GRIN-Linsenimplantats bilden ein gleichseitiges Dreieck (Abbildung 1B). Die Größe der Kraniotomie sollte eng mit dem Durchmesser der Schraube passen. Wenn Blutungen auftreten, waschen Sie die Blutoberfläche mit PBS. Die Bohrgeschwindigkeit beträgt 18.000 Rpm, und die Bitgröße beträgt 0,6 mm. - Desinfizieren Sie die Schrauben mit 70% Ethanol, um Entzündungen zu verhindern. Implantieren Sie die Schrauben so tief wie möglich.
HINWEIS: Schrauben sollten ohne zusätzliche Haftung wie Zement fest befestigt werden. - Installieren Sie einen motorisierten Operationsarm auf dem stereotaxic Rahmen. Schließen Sie die erforderliche Hardware an den Laptop-Computer an, auf dem die Steuerungssoftware installiert ist (Tabelle der Materialien).
- Bevor Sie die GRIN-Linse senken, bereiten Sie sich darauf vor, eine Nadelspur mit einer 26 G Nadel zu machen.
HINWEIS: Die Nadelspur ist eine Art Führungsweg, der hilft, die relativ dicke GRIN-Linse in tiefe Hirnregionen wie Amygdala zu implantieren, ohne eine schwere Verzerrung der Gehirnstruktur entlang des Injektionswegs zu verursachen. Diese Führungsschiene wird als Nadelspur bezeichnet, da sie durch ein Absenken und Erheben von relativ dünner 26 G Nadel hergestellt wird. - Befestigen Sie den Kanülenhalter, um die Nadel stabil auf dem stereotaxic Rahmen zu halten.
- Greifen Sie die 26 G Nadel mit dem Kanülenhalter und berechnen Sie die Koordinaten der Nadeleinsteckstelle.
HINWEIS: In diesem Protokoll sind die Koordinaten der Nadeleinsteckstelle 50 m seitlich von der Virusinjektionsstelle (AP, ML, DV) = (-1,6 mm, -3,55 mm, -3,7 mm). - Greifen Sie auf die Steuerungssoftware zu und bereiten Sie sich auf die Manipulation der Nadelposition vor.
- Führen Sie die steuernde Software aus, und wählen Sie die Schaltfläche Neues Projekt starten aus, um die Sitzung zu steuern.
HINWEIS: In der Steuerungssitzung gibt es mehrere leere Felder und Menütasten. Die leeren Felder sind Eingabebereich für Koordinaten. Nachdem Sie Koordinaten in die leeren Felder eingegeben haben, bewegt sich der motorisierte stereotaxic Arm, indem Er auf die Schaltfläche Gehe zu klickt. Die Schaltfläche "Gehe zu" wechselt in eine STOP-Taste, wenn sich der stereotaxic-Arm bewegt. Unter mehreren Menüschaltflächen ist in diesem Protokoll nur die Schaltfläche "Tool" erforderlich. - Klicken Sie auf die Schaltfläche Werkzeug. Kalibrieren Sie die Steuerungssoftware, indem Sie auf die Schaltfläche "Rahmenmenü kalibrieren" klicken. Kalibrierung ist der Prozess, bei dem die tatsächliche Position des Manipulators als Werte auf der Stereodrive-Software festgelegt wird.
- Führen Sie die steuernde Software aus, und wählen Sie die Schaltfläche Neues Projekt starten aus, um die Sitzung zu steuern.
- Finden Sie die Spitze der Nadel an der exponierten Gehirnoberfläche auf der Schädeloberfläche mit stereotaxic Manipulator.
HINWEIS: Die Geschwindigkeit der Nadel wird über das Microdrive-Geschwindigkeitsmenü im Menü Werkzeug eingestellt. Die Standarddrehzahl beträgt 3,0 mm/s. In diesem Schritt wird jedoch eine Geschwindigkeit von 0,5 mm/s empfohlen. Die Bewegung der Nadel wird durch die Pfeiltasten gesteuert. - Fügen Sie 2-3 Tropfen PBS hinzu, um die Gehirnoberfläche nass zu halten. Füllen Sie das leere Feld auf dem Computerbildschirm mit den entsprechenden DV-Koordinaten der LA aus. Wenn die Gehirnoberfläche trocken ist, behindert es das Eindringen der Nadel in das Gehirngewebe.
- Senken Sie die 26 G-Nadel, indem Sie auf die Schaltfläche Gehe zu klicken. Es stoppt automatisch, wenn die Nadel die Zielstelle erreicht, die von DV-Koordinaten festgelegt wurde. Die Geschwindigkeit der Nadel beträgt 100 m/min. Wenn es Blutungen gibt, stoppen Sie die Nadel, indem Sie auf die STOP-Taste klicken und die Gehirnoberfläche mit PBS waschen. Halten Sie die Gehirnoberfläche in diesem Schritt nass. Nachdem die Blutung gestoppt wurde, beginnen Sie wieder zu senken.
- Nachdem sich die Nadel vollständig nicht mehr bewegt, geben Sie 45,00 mm in das leere Feld auf dem Computerbildschirm ein.
HINWEIS: 45.00 mm ist ein Wert der DV-Koordinate, der die Nadel in die Startposition zurückbringt. - Heben Sie die Nadel, indem Sie auf die Schaltfläche Gehe zu klicken. Die Geschwindigkeit der Nadelbewegung beträgt 100-200 m/min.
- Nachdem sich die Nadel nicht mehr bewegt, entfernen Sie die PBS auf der Gehirnoberfläche. Deinstallieren Sie die Nadel und kanülenhalter aus dem stereotaxic Rahmen. Der Experimentator kann die Nadel manuell anhalten, indem er bei Bedarf auf die STOP-Taste klickt.
- Rüsten Sie die stereotaxic Stange mit dem Linsenhalter aus. Installieren Sie die GRIN-Linse am Linsenhalter.
HINWEIS: In diesem Protokoll wird das für die Ausrichtung auf die LA (0,6 mm Durchmesser, 7,3 mm Länge) optimierte GRIN-Objektiv verwendet. Wenn der Linsenhalter nicht vorbereitet ist, ist eine alternative Möglichkeit, einen Bulldog-Clip zu verwenden, um die GRIN-Linse zu greifen. - Desinfizieren Sie die Linse mit 70% Ethanol und befestigen Sie die stereotaxic Stange an den stereotaxic Rahmen.
- Suchen Sie die Spitze der GRIN-Linse an der vorgesehenen Stelle auf der Schädeloberfläche (gleiche methode, die in Schritt 2.8 beschrieben wird).
HINWEIS: Die Koordinate der GRIN-Linse ist (AP, ML, DV) = (-1,6 mm, -3,55 mm, -4,2 mm) (Abbildung 1C). Die Linse sollte den Schädel nicht berühren, um Schäden an der Spitze zu vermeiden. - Berechnen Sie die DV-Koordinate, indem Sie den absoluten Wert von "Wert A" von der im Schritt 2.16 beschriebenen DV-Koordinate der Linsenimplantation subtrahieren.
- Tropfen Sie 2-3 Tropfen PBS auf die Gehirnoberfläche. Geben Sie 1000 m zum Senken und 300 m für das Anheben der Linse in das leere Feld auf dem Computerbildschirm ein.
- Wiederholen Sie das Absenken (1000 m nach unten) und das Anheben (300 m nach oben) der GRIN-Linse, bis es die Zielstelle erreicht. Dieses Auf und Ab Verfahren wird verwendet, um den Druck im Gehirngewebe durch die Senkung Verfahren der Linse erzeugt zu lösen, die sonst Verzerrungen der Gehirnstrukturen entlang des Implantationspfades verursachen kann.
HINWEIS: Die Geschwindigkeit der GRIN-Linsenbewegung beträgt 100 m/min. Auch wenn es Blutungen gibt, hören Sie nicht auf, die GRIN-Linse zu bewegen und waschen Sie die Gehirnoberfläche mit PBS. Halten Sie die Gehirnoberfläche in diesem Schritt nass. Wenn die Gehirnoberfläche trocken ist, klebt das Gehirngewebe an der GRIN-Linsenoberfläche und verursacht verzerrungen der Gehirnstruktur. - Wenn die GRIN-Linse die Zielstelle erreicht, entfernen Sie PBS und tragen Sie den Harz-Zahnzement vorsichtig um die GRIN-Linse, die Schrauben und ihre Seitenwand auf (Abbildung 1D).
HINWEIS: Das Auftragen des Harzzements über den gesamten Schädel kann Bewegungsartefakte reduzieren. Im Gegenteil, wenn der Harzzement versehentlich die muskeln bedeckt, die am Schädel befestigt sind, erhöht er die Bewegungsartefakte. - Nachdem der Harz Zahnzement aushärtet, zerlegen Sie die GRIN-Linse aus dem Linsenhalter und wenden Sie Acrylzement über den schädelischen auf (Abbildung 1D).
- Um die Kopfplatte zu befestigen, zerlegen Sie den Linsenhalter von der stereotaxic Stange und befestigen Sie die Kopfplatte an der Spitze der Stange mit Bändern. Bestätigen Sie, ob die Kopfplatte horizontal ist.
HINWEIS: Eine geneigte Kopfplatte verursacht eine geneigte Ansicht. Zur Befestigung des Mauskopfes im Mobilheimkäfigsystem (im Grundplatten-Befestigungsbereich) ist eine Kopfplatte erforderlich. Wenn der Experimentator das System nicht verwendet, überspringen Sie diesen Schritt (Schritt 2.22) und den folgenden Schritt 2.23. - Senken Sie die Stange langsam, bis sich die Kopfplatte an der Oberseite der Linsenmanschette befindet. Senken Sie die Kopfplatte 1000 m mehr. Bewegen Sie die Kopfplatte für die implantierte GRIN-Linse, um sie am rechten Rand des Innenrings der Kopfplatte zu lokalisieren.
HINWEIS: Die Kopfplatte sollte niedriger als die implantierte GRIN-Linsenoberfläche positioniert werden; Andernfalls kann sich das Mikroendoskop nicht nah genug an die implantierte GRIN-Linse nähern, um die Brennebene aufgrund des Acrylzements anzupassen. - Acrylzement auftragen, um die Kopfplatte an den Zementschichten zu befestigen (Abbildung 1D).
- Befestigen Sie Paraffinfolie auf der implantierten GRIN-Linsenoberfläche, um die Linsenoberfläche vor Staub zu schützen. Tragen Sie dann abnehmbare Epoxid-Bindung auf den Paraffinfilm auf, um Paraffinfolie auf der Linsenoberfläche zu verbleiben.
- Injizieren Sie Carprofen, ein Schmerzmittel (0,5 mg/ml in PBS), und Dexamethason, ein entzündungshemmendes Medikament (0,02 mg/ml in PBS) Injizieren, in die Peritonealhöhle der Maus.
HINWEIS: Die Dosis des Arzneimittels ist abhängig vom Körpergewicht: Carprofen (5mg-kg -1 Körpergewicht) und Dexamethason (0,2mg-kg -1 des Körpergewichts). Sowohl Carprofen als auch Dexamethason werden nach der Operation verabreicht und einmal täglich für 7 Tage nach der Operation. - Mischen Sie 0,3 mg/ml Amoxicillin, ein Antibiotikum, in Hauskäfigwasser, um das Medikament für 1 Woche zu verabreichen.
- Bringen Sie die Maus in den heimischen Käfig zurück und lassen Sie 5-8 Wochen für die Genesung und Virustransduktion.
HINWEIS: Die Maus wird in einem vorgewärmten Käfig auf einer elektrischen Decke wiederhergestellt, bis die Maus aus dem Anästhetikum erwacht.
3. Validierung der GRIN-Linsenimplantation
HINWEIS: Die Validierung der GRIN-Linsenimplantation liefert Informationen darüber, ob die implantierte GRIN-Linse auf GCaMP-exzessierende Zellen ausgerichtet ist. Basierend auf diesen Informationen spart der Experimentator Zeit vor zeitaufwändigen Prozessen wie dem Verhaltenstest und der Datenverarbeitung, indem er Tiere mit einer zielgerichteten GRIN-Linsenimplantation ausschließt. Während des Validierungsvorgangs sollten Zellen mit GCaMP-Ausdruck im Aufzeichnungsfeld fokussiert werden. In diesem Schritt wird ein Wohnmobilkäfig verwendet. Ein Mobile Home Käfig ist ein spezieller rundgeformter Apparat, der es kopffixierten Mäusen ermöglicht, ihre Beine während der Validierung der GRIN-Linsenimplantation und Der Grundplattenbefestigung frei zu bewegen. Ein Lufthebetisch in diesem Gerät, auf dem die Beine der Kopf fixierten Mäuse platziert sind, ermöglicht eine solche freie Bewegung der Beine, obwohl der Kopf fixiert ist. Die Zellen im lateralen Kern der Amygdala sind in der Regel ruhig in einem ruhenden oder anästhesierten Zustand, so dass GCaMP-Fluoreszenzsignale unter diesen Bedingungen selten nachgewiesen werden, was es sehr schwierig, manchmal unmöglich macht, Zellen zu finden, die GCaMP während der Validierung der GRIN-Linsenimplantation und Grundplattenbefestigung exdrücken. Die Bewegung der Beine erzeugt jedoch oft GCaMP-Fluoreszenzsignale in den Zellen des lateralen Kerns von Amygdala und kann dadurch helfen, das Mikroskop zu lokalisieren. Somit wird in diesem Protokoll der Mobilheimkäfig verwendet.
- Montieren Sie den stereotaxic Manipulator an das Mobile Home Käfigsystem.
- Anästhesisieren Sie die Maus mit 1,5% Isoflurangas. Nachdem die Maus völlig bewusstlos ist, legen Sie die Maus auf die Kopfstange des Mobilheim-Käfigsystems.
- Suchen Sie den Kohlenstoffkäfig unter der Maus. Schließen Sie den Kohlenstoffkäfig und schalten Sie den Luftstrom ein, damit sich der Käfig ohne Reibung frei bewegt. Warten Sie einige Minuten, bis die Maus aktiv wird.
HINWEIS: Die Geschwindigkeit des Luftstroms sollte für jeden Versuchszustand optimiert werden (hier 100 l/min). - Entfernen Sie Paraffinfolie und Epoxidbindung auf der Oberfläche der implantierten GRIN-Linse und wischen Sie die Linsenoberfläche mit 70% Ethanol mit Linsenpapier ab.
- Bereiten Sie die Datenerfassungssoftware (DAQ) (z. B. Inscopix) vor. Stellen Sie die Bildbedingungen ein.
HINWEIS: Die DAQ-Software wird zur Steuerung des Mikroskops (LED-Leistung, Linsenfokus,etc.) und Datenspeicherung verwendet.- Schalten Sie die Datenerfassungsbox ein und schließen Sie ein Mikroskop daran an. Verbinden Sie es dann direkt über ein Kabel oder über drahtloses Internet mit einem Laptopcomputer.
HINWEIS: Die Datenerfassungssoftware ist in der zusätzlichen Hardware namens DAQ Box (z. B. Inscopix) installiert. Durch den Anschluss der Datenerfassungsbox an den Laptopcomputer wird die Datenerfassungssoftware auf einem Laptopcomputer zugänglich. - Greifen Sie über einen Internetbrowser auf die Datenerfassungssoftware zu (Firefox wird empfohlen).
- Legen Sie alle erforderlichen Details (Datum, Maus-IDusw.) in der definierten Sitzungfest. Klicken Sie dann auf Speichern und Fortfahren. Greifen Sie nach dem Speichern auf die Ausführungssitzungzu.
- Legen Sie in der Ausführungssitzungdie Bildbedingungen wie Belichtungszeit, Verstärkung, elektronischer Fokus und Belichtungs-LED-Leistung fest.
HINWEIS: Verstärkung und Belichtungs-LED-Leistung sind je nach Laborbedingungen änderbar. Der empfohlene Wert für den elektrischen Fokus ist 500 und die Belichtungszeit beträgt 50 ms. Es gibt keine Einschränkung für den Wechsel von LED-Leistung und Gewinn. Eine höhere Lichtintensität kann jedoch zu mehr Bleichen führen. Die Belichtungszeit der Aufnahme bestimmt eine Bildrate der Videoaufzeichnung. Höhere Bildraten reduzieren die Signalintensität. Die Bildraten sollten für die für die Bildgebung verwendeten GECIs optimiert werden.
- Schalten Sie die Datenerfassungsbox ein und schließen Sie ein Mikroskop daran an. Verbinden Sie es dann direkt über ein Kabel oder über drahtloses Internet mit einem Laptopcomputer.
- Um das Mikroskop auf einem stereotaxic Manipulator zu halten, befestigen Sie die stereotaxic Stange mit MikroskopGreifer an stereotaxic Manipulator.
HINWEIS: Der Greifer ist ein kleines Zubehör, das an dem stereotaxic-Gerät befestigt werden kann, um einen Mikroskopkörper zu halten, um ihn an der Ziel-Gehirnposition zu platzieren. - Greifen Sie das Mikroskop mit dem Mikroskopgreifer. Schalten Sie das mit dem Mikroskop verbundene LED-Licht ein und richten Sie das Mikroskop vertikal aus. Senken Sie das Mikroskop, während Sie das Bild beobachten, bis die Oberfläche der implantierten GRIN-Linse angezeigt wird.
- Richten Sie die Mitte der implantierten GRIN-Linse mit der Mitte der Ansicht aus.
ANMERKUNG: Die Validierung der GRIN-Linsenimplantation kann in diesem Schritt durchgeführt werden (im Ergebnisabschnitt, Abbildung 2B, Abbildung 2D, Abbildung 2F). - Bild der implantierten GRIN-Objektivoberfläche aufnehmen (Klicken Sie auf der Tastatur auf Prt Sc-Taste). Das Bild der implantierten GRIN-Linsenoberfläche wird für die Deauswahl nicht-neuronaler Komponenten während der späteren Datenverarbeitung benötigt (Schritt 6.8).
- Finden Sie die entsprechende Position des Mikroskops. Heben Sie langsam die Objektivlinse des Mikroskops an, während Sie das Bild beobachten, um nach Zellen mit GCaMP7b-Expression zu suchen.
HINWEIS: Es kann notwendig sein, die Verstärkung der Bildaufnahme oder die Belichtungs-LED-Leistung einzustellen. Die Validierung der GRIN-Linsenimplantation kann in diesem Schritt durchgeführt werden (erwähnt im Ergebnisabschnitt, Abbildung 2A, Abbildung 2C, Abbildung 2E).
4. Grundplattenbefestigung
HINWEIS: Der Baseplate-Befestigungsschritt folgt der Validierung der GRIN-Linsenimplantation. Die Grundplatte ist eine Plattform für die Montage des Mikroskops an den Kopf von Mäusen. Wie im vorherigen Abschnitt erwähnt, wird in diesem Protokoll ein Wohnmobilkäfig verwendet.
- Nach der Validierung der GRIN-Linsenimplantation wird ein Miniaturmikroskop aus dem Mikroskopgreifer demontiert.
- Befestigen Sie die Grundplatte am Mikroskop. Ziehen Sie die Schraube mit Hex-Taste für eine stabile Befestigung der Grundplatte am Mikroskop fest.
- Greifen Sie das Mikroskop mit dem Mikroskopgreifer. Schalten Sie das mit dem Mikroskop verbundene LED-Licht ein und richten Sie das Mikroskop vertikal aus. Senken Sie das Mikroskop, bis die Oberfläche der implantierten GRIN-Linse beobachtet wird. Richten Sie die Mitte der implantierten GRIN-Linse mit der Mitte der Ansicht aus.
- Finden Sie die entsprechende Position des Mikroskops. Heben Sie die Objektivlinse des Mikroskops langsam an, bis sie eine Brennebene findet, die die besten Bilder von Zellen mit GCaMP7b-Expression liefert (Abbildung 2A).
HINWEIS: Es kann erforderlich sein, die Verstärkung der Bildaufnahme oder Belichtungs-LED-Leistung während dieses Schritts einzustellen. - Acrylzement auftragen, um die Grundplatte stabil an der Kopfplatte zu befestigen (Abbildung 2G). Bauen Sie die Seitenwände mit Acrylzement zwischen Grundplatte und Kopfplatte auf.
HINWEIS: Acrylzement schrumpft, wenn er aushärtet. Aus diesem Grund entfernen Sie das Mikroskop erst, wenn der Zement vollständig aushärtet (dieser Schritt dauert mindestens 30 min). Das Zementieren sollte sehr sorgfältig durchgeführt werden, um eine unerwünschte Zementierung des Mikroskops und seiner Objektivlinse mit Acrylzement zu vermeiden. - Nachdem Acrylzement vollständig aushärtet, lösen Sie die Schraube und heben Sie den Mikroskopkörper langsam an.
- Wenn sich eine Lücke an der Seitenwand befindet, wiederholen Sie die zusätzliche Zementierung, um die implantierte GRIN-Linse vor Staub zu schützen.
- Bedecken Sie die Grundplatte, um die implantierte GRIN-Linse vor Staub zu schützen, und ziehen Sie die Schraube der Grundplatte fest.
- Lassen Sie die Kopfplatte von der Kopfstange. Zurück zur Heimischen Käfig bis zukünftige optische Bildgebung.
5. Optische Aufzeichnung des GCaMP-Signals während eines Verhaltenstests
HINWEIS: Das Verfahren der GCaMP-Signalaufzeichnung während des Verhaltens kann sehr unterschiedlich sein, abhängig von den Systemen, die für die optische Bildgebung, das experimentelle Design und die Laborumgebung verwendet werden. Daher wird es in diesem Abschnitt auf einfache Weise beschrieben.
- Führen Sie mehrere Tage der Handhabung vor dem Verhaltenstest durch.
- Bereiten Sie den Verhaltensapparat (z. B. Angstkonditionierungskammer, Verhaltenssoftware und das Coulbourn-Instrument) und den Laptop-Computer vor.
- Stecken Sie das Mikroskop in die Datenerfassungsbox und schalten Sie die Datenerfassungsbox ein.
- Verbinden Sie die Datenerfassungsbox über eine drahtlose Internetverbindung mit dem Laptop-
- Starten Sie die Datenerfassungssoftware (Firefox-Browser wird empfohlen) auf dem Laptop-Computer. Klicken Sie auf die Schaltfläche Datei-Manager, und überprüfen Sie die verbleibende Speicherkapazität des Felds Datenerfassung, um aufgezeichnete Daten zu speichern.
HINWEIS: Die Datengröße beträgt ca. 80 GB für 30 min Aufnahme. - Geben Sie die erforderlichen Informationen (Datum, Maus-IDusw.) in die Definierte Sitzung ein und nehmen Sie in die Run-Sitzungein.
- Greifen Sie vorsichtig die Maus und entfernen Sie die Grundplattenabdeckung auf dem Kopf. Platzieren des Mikroskops auf der Basisplattenplattform.
- Ziehen Sie die Grundplatte Schraube und legen Sie das Tier mit einem Kopf-Mount-Mikroendoskop in die Verhaltenskammer.
HINWEIS: Die Maus versucht, in diesem Schritt zu entkommen, wenn die Handhabung nicht ausreicht. - Schließen Sie die NI-Platine über ein BNC-Kabel an den TRIG-Anschluss der DaQ-Box an. NI-Board empfängt TTL-Signale von Verhaltenssoftware (z. B. FreezeFrame) und koordiniert die gleichzeitige Aufzeichnung des GCaMP-Signals und des Verhaltens von Tieren.
- Passen Sie die Fokusebene an.
HINWEIS: Die Brennebene wird durch den Abstand zwischen der Objektivlinse des Mikroskops und der im Gehirn implantierten GRIN-Linse bestimmt. Um die Fokusebene anzupassen, wird die objektive Linsenposition während der Beobachtung von Bildern manipuliert. Der Abstand zwischen diesen beiden Linsen, der eine klare Morphologie von Zellen und Blutgefäßen zeigt, wird als Fokale für die Bildgebung festgelegt. In diesem Protokoll wird die DAQ-Software verwendet, um die Bewegung der Objektivlinse während der Einstellung zu steuern. - Stellen Sie die optimierte Belichtungszeit, Verstärkung, LED-Leistung in Run-Sitzung.
HINWEIS: Im Allgemeinen werden 50 ms für die Belichtungszeit verwendet. Gain- und LED-Leistung werden basierend auf Bildhistogrammen eingestellt. Histogramme geben die Verteilung der Fluoreszenzintensität der Pixel an. Basierend auf der Sichtprüfung sollte der rechte Rand des Histogramms bei GCaMP7b einen Wert zwischen 40% und 60% haben. Es ändert sich in Abhängigkeit von den GECIs für die Bildgebung verwendet. - Ändern Sie die Aufnahmeoption in Triggered recording. Klicken Sie auf Aufzeichnen, und starten Sie das Verhalten.
HINWEIS: Die Option "Ausgelöste Aufzeichnung" stellt eine übereinstimmende Zeitachse der Aufzeichnungssitzung und der Verhaltenssitzung bereit. Wenn das TTL-Signal empfangen wird, schaltet sich ein rotes Licht über dem TRIG-Port ein. - Nach Abschluss des Verhaltenstests das Mikroskop lösen und die Grundplattenabdeckung befestigen.
- Bringen Sie die Maus in den heimischen Käfig zurück. Wählen Sie dann Datei-Manager aus, und exportieren Sie Daten aus dem DaQ-Feld.
- Opfern Sie nach dem Verhaltenstest die Maus für die postmortale histologische Überprüfung.
6. Datenverarbeitung
HINWEIS: Die Datenverarbeitung ist je nach Datenverarbeitungssoftware und DEN für das Bildgebungsexperiment verwendeten GECIs sehr unterschiedlich. Daher wird es in diesem Abschnitt auf einfache Weise beschrieben. Dieses Protokoll verwendet kommerzielle Datenverarbeitungssoftware (siehe Tabelle der Materialien). Alternativ kann auch andere Open-Source-Software, die im Diskussionsbereich erwähnt wird, problemlos verwendet werden. Die in diesem Protokoll verwendeten Variablen sind in Tabelle 1aufgeführt.
- Importieren Sie die Aufzeichnungsvideodatendatei (1280 Pixel x 800 Pixel) aus der Datenerfassungsbox in den Desktop-Computer für die Datenverarbeitung. Starten Sie die Datenverarbeitungssoftware.
HINWEIS: Datenverarbeitungssoftware unterscheidet sich von der Datenerfassungssoftware in früheren Schritten. In der Datenverarbeitungssoftware gibt es 6 Schritte: Down-Sampling, Zuschneiden, Räumlicher Filter, Bewegungskorrektur, F/F-Berechnung, Ereigniserkennung, die für die Extraktion von einzelzelligen Kalziumtransientendaten aus aufgezeichneten Videos notwendig sind. - Downsample und schneiden Sie das Video.
HINWEIS: Downsampling und Zuschneiden sind notwendig, um die Datenverarbeitungsgeschwindigkeit zu erhöhen. Schneiden Sie das Gebiet mit Ausnahme der Region, in der das GCaMP-Signal beobachtet wird. - Wenden Sie den räumlichen Filter an. Erstellen Sie nach dem Anwenden des räumlichen Filters ein mittleres Intensitätsprojektionsbild.
HINWEIS: Der räumliche Filter unterscheidet jedes Pixel in aufgezeichneten Videobildern und liefert ein Bild mit hohem Kontrast. Es gibt zwei Arten von Trennfiltern, niedrigem und hohem Cut-off-Filter. Der höhere Wert von Low Cut-off-Filtern erhöht den Kontrast des Bildes, erhöht aber gleichzeitig das gesamte Graurauschen. Der niedrigere Wert des Hochabschaltfilters lässt das Bild unscharf werden. - Wenden Sie die Bewegungskorrektur an. Verwenden Sie das mittlere Intensitätsprojektionsbild als Referenzbild für die Bewegungskorrektur.
- Wenden Sie die Bewegungskorrektur erneut mithilfe des Bildes des ersten Frames als Referenzbild an.
HINWEIS: Zwei Schritte der Bewegungskorrektur verringern das Bewegungsartefakt erheblich. - Wenden Sie die Berechnung von F/F an, um Pixel zu visualisieren, die eine Änderung der Helligkeit anzeigen.
HINWEIS: Die Helligkeitsänderung von Pixeln wird durch fluoreszenzintensive Änderung von GCaMP verursacht und zeigt Kalziumtransienten an. - Wenden Sie den PCA/ICA-Algorithmus an, um die transiente Kalziumkurve jeder Zelle zu visualisieren.
HINWEIS: PCA/ICA ist ein Algorithmus zum Sortieren einer Gruppe von Daten in einen Satz von Einzelkomponentendaten. Die Variablen sollten für jeden Laborzustand optimiert werden. In diesem Protokoll sind alle Variablen standardmäßig mit Ausnahme der ZEITLICHen Gewichtung von ICA (0.4 wird in diesem Protokoll verwendet)27. - Deaktivieren Sie manuell nicht-neuronale Komponenten unter den identifizierten Komponenten basierend auf den in der folgenden Anmerkung beschriebenen Kriterien.
HINWEIS: Zu diesem Zweck werden zwei Hauptkriterien verwendet. Erstens sieht das GCaMP-Signal, das von einem Neuron stammt, wie eine klare kugelförmige Form aus. Somit wird nur das Signal mit einer klaren kugelförmigen Form als Neuron ausgewählt. Zweitens ist angesichts des Durchmessers des Zellkörpers der Amygdala-Pyramidenzelle bekannt, dass sie etwa 20 m28,29,30beträgt, nur das Signal, das ungefähr zu dieser Größe passt, als Neuron ausgewählt wird. Um die Größe des GCaMP-Signals zu bestimmen, wird die tatsächliche Größe eines einzelnen Pixels basierend auf dem aufgenommenen Bild der Linsenoberfläche (Schritt 3.9) und der maximalen Breite einer einzelnen kugelförmigen Form berechnet. In diesem Protokoll beträgt der Durchmesser der implantierten GRIN-Linse beispielsweise 600 m. Wenn der Durchmesser der Linse also 800 Pixel beträgt, beträgt die tatsächliche Größe des einzelnen Pixels 1,5 m (20 m sind etwa 7 Pixel). - Wenden Sie die Ereigniserkennungsfunktion an, um eine signifikante Zunahme des Kalziumtransienten (Calciumereignis) zu erkennen.
HINWEIS: In diesem Schritt wird die Variable , die als kleinste Zerfallszeit des Ereignisses bezeichnet wird, benötigt. In diesem Protokoll wird 1.18s als optimierte Variable für GCaMP7b verwendet. Die durchschnittliche Halbzerfallszeit (t1/2=0,82s) wird basierend auf der Kurve f/F während der spontanen Aktivität von Zellen berechnet. Da GCaMP exponentiellen Zerfall folgt, ist es .
.
Ergebnisse
Validierung der GRIN-Linsenimplantation
Bevor die Grundplatte chronisch durch Zementieren am Gehirn befestigt wird, muss die GRIN-Linsenimplantation validiert werden. Bei Tieren mit erfolgreicher Linsenimplantation wurden sowohl GCaMP-Extierzellen als auch Blutgefäße innerhalb eines Fokalebenenbereichs deutlich beobachtet, der durch den Abstand zwischen objektiver Linse des Mikroskops und implantierter GRIN-Linse bestimmt wurde (Abbildung 2Aund B). Im Gegensatz dazu wurde bei Tieren mit außerhalb des Ziels der Implantation kein klares Bild von GCaMP-exezierenden Zellen innerhalb des Fokusebenenbereichs (entweder außerhalb des Fokus oder außerhalb der Sicht) beobachtet. Bei a-fokussierten, gut fokussierten Blutgefäßen konnten jedoch nur verschwommene Bilder für Zellen innerhalb des Fokusebenenbereichs beobachtet werden (Abbildung 2Cund D). Bei Außersichtigen wurden in den meisten Fällen keine Blutgefäße beobachtet, und es wurde kein Fluoreszenzsignal innerhalb des Fokusebenenbereichs nachgewiesen (Abbildung 2E). Darüber hinaus zeigte die implantierte GRIN-Linse im Gegensatz zu anderen Fällen einen hellen Rand (Abbildung 2F). Die Grundplattenbefestigung wird nur an validierten Tieren mit auf Ziel-GRIN-Linsenimplantation durchgeführt.
Aufzeichnung von GCaMP-Signalen im LA-Neuron als Reaktion auf auditive Reize
In diesem Protokoll wurden 4 Instanzen pseudorandomisierten Tons (2,8 kHz, 200 ms Dauer, 25 Impulse) einer Maus präsentiert, und GCaMP-Signale wurden optisch in den LA-Zellen von Mäusen mit Kopf-Mount-Mikroendoskop aufgezeichnet. Für die Bildgebung wurden Mäuse verwendet, die mit AAV1-Syn-GCaMP7b-WPRE in der einseitigen lateralen Amygdala injiziert wurden. Bei Tieren mit erfolgreicher GRIN-Linsenimplantation wurden virusextierende Zellen und Blutgefäße im Fokusebenenbereich deutlich beobachtet (Abbildung 3A). In der Verhaltensbedingung zeigten etwa 50-150 Zellen in der Regel eine signifikante Fluoreszenzänderung im Sichtfeld in der LA auch ohne Ton, wie in dem Bild f/F dargestellt, wahrscheinlich spontan aktive Zellen(Abbildung 3B). Bei der Tondarstellung zeigten nur wenige Zellen eine tonspezifische Änderung des GCaMP-Signals an, wie durch die Bildanalyse von F/F bestimmt (6 Zellen in Abbildung 3C und Abbildung 3D). Die gleichen Verfahren wurden an Mäusen durchgeführt, die mit AAV2/1-CaMKII-GFP als Kontrolle injiziert wurden. Obwohl GFP-exzessizierende Zellen innerhalb des Fokusebenenbereichs nachgewiesen wurden, zeigten keine Zellen eine signifikante Fluoreszenzänderung mit oder ohne Ton, wie sie durch die Bildanalyse f/F bestimmt wurde (Abbildung 3E und Abbildung 3F).
Zur histologischen Verifikation der GCaMP-Expression und Targeting der GRIN-Linse werden koronale Abschnitte des postmortalen Gehirns unter dem Fluoreszenzmikroskop untersucht (Abbildung 4A und Abbildung 4B). DAPI Färbung wird verwendet, um intakte Zellen zu bestätigen und keine Anzeichen von Gewebeschäden aufgrund einer Entzündung des Gehirngewebes um die GRIN-Linse (Abbildung 4C).
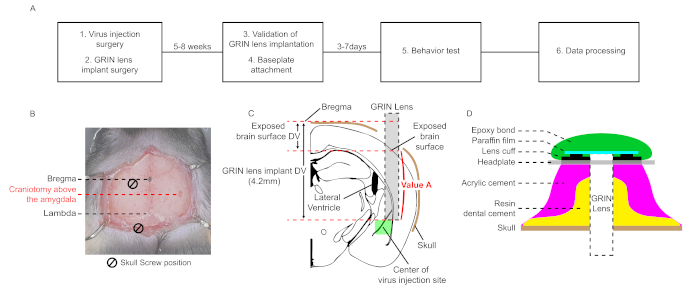
Abbildung 1: Schematische Arbeitsabläufe und Diagramme für die stereotaxicische Chirurgie für die mikroendoskopische Kalziumbildgebung in vivo in der LA. (A) Ein schematischer Workflow der in vivo mikroskopischen Calcium-Bildgebung in der LA. (B) Ein mikroskopisches Bild, das zweidimensionale Koordinaten von Craniotomie-Standorten für die Virusinjektion und die GRIN-Linsenimplantatchirurgie zeigt. Zwei Schädelschrauben und die Linse bilden ein gleichseitiges Dreieck. (C) Ein Diagramm für die relative Position zwischen der Virusinjektionsstelle und der implantierten GRIN-Linse und eine schematische Erklärung für die Berechnung von "Wert A". (D) Querschnitt der Zementschicht von der Schädeloberfläche bis zur Kopfplatte in den letzten Schritten der Operation. Harz-Zahnzement sollte die Wand der Schrauben und die implantierte GRIN-Linse abdecken. Acrylzement wird auf den Harz-Zahnzement aufgetragen. Kopfplatte wird auf der Zementschicht befestigt. Paraffinfolie bedeckt die implantierte GRIN-Linsenoberfläche und schützt sie vor Staub. Abnehmbare Epoxid-Bindung verhindert das Lösen von Paraffinfolie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Validierung der GRIN-Linsenimplantation und Konfiguration von Zementschichten nach Grundplattenbefestigung. (A) Ein repräsentatives endoskopisches Schnappschussbild von Tieren mit erfolgreicher GRIN-Linsenimplantation. Sowohl GCaMP-exemittende Zellen als auch Blutgefäße werden deutlich beobachtet. (B) Schnappschussbild der implantierten GRIN-Linsenoberfläche von Tieren mit erfolgreicher GRIN-Linsenimplantation. (C) Ein repräsentatives endoskopisches Schnappschussbild von Tieren mit unkonzentrierter GRIN-Linsenimplantation. (D) Schnappschussbild der implantierten GRIN-Linsenoberfläche von Tieren mit unfokussierter GRIN-Linsenimplantation. Bei a-focus werden Blutgefäße manchmal deutlich beobachtet, aber nur verschwommene Bilder für Zellen innerhalb des Fokusebenenbereichs. (E) Ein repräsentatives endoskopisches Schnappschussbild von Tieren mit ungesehener GRIN-Linsenimplantation. Bei Außersichtigkeit werden Blutgefäße in den meisten Fällen nicht beobachtet und es wird kein Fluoreszenzsignal innerhalb des Fokusebenenbereichs nachgewiesen. (F) Ein Schnappschussbild der implantierten GRIN-Linsenoberfläche von Tieren mit unsichtbarer GRIN-Linsenimplantation. Im Gegensatz zu anderen Fällen wird in diesem Fall die helle Kante beobachtet. (G) Die Konfiguration von Zementschichten zur Grundplattenbefestigung. Grundplatte und Kopfplatte werden mit Acrylzement befestigt. Zwischen Der Grundplatte und der GRIN-Linse sollte ein mit Acrylzement gefüllter Platz vorhanden sein. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
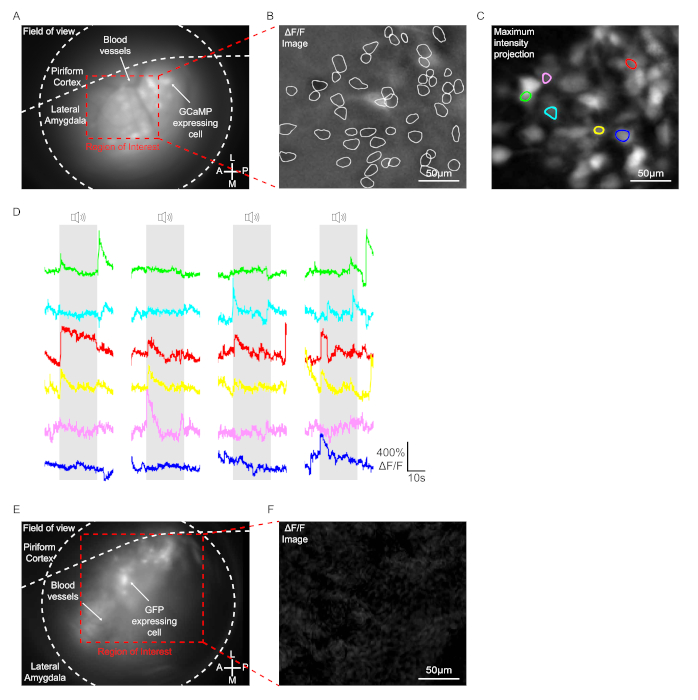
Abbildung 3: Aufzeichnung von GCaMP-Signalen in den LA-Neuronen. (A bis C) Daten aus einer mit AAV1-Syn-GCaMP7b-WPRE injizierten Maus. (A) Ein repräsentatives endoskopisches Schnappschussbild während eines Verhaltenstests. GCaMP7b exemittierende Zellen und Blutgefäße wurden im Fokusebenenbereich deutlich beobachtet. (B) Ein repräsentatives Schnappschussbild, das das Signal F/Fzeigt. Weiße Linie zeigt Zellen an, die während des Verhaltenstests eine signifikante Fluoreszenzänderung im Interessenbereich zeigten. Skala bar = 50 m. (C) Maximale Intensität Projektionsbild. Insgesamt 6 Zellen zeigten eine tonspezifische Änderung des GCaMP-Signals an. Skala bar = 50 m. (D) Vertreter -F/F Spuren von Ton reaktionsfähigen Zellen. Jede Farbe entspricht jeder einzelnen Zelle mit der gleichen Farbe im Panel (C). (E und F) Daten aus einer Maus, die mit AAV2/1-CaMKII-GFP injiziertwurde. (E) Ein repräsentatives endoskopisches Schnappschussbild während eines Verhaltenstests. GFP-exemittende Zellen wurden im Fokusebenenbereich eindeutig nachgewiesen. (F) Ein repräsentatives Schnappschussbild mit dem Signal "F/F". Maßstabsleiste = 50 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Histologische Verifikation der GRIN-Linsenposition und des GCaMP7b-Ausdrucks. (A) Ein repräsentatives koronales Schnittbild, das den GCaMP7b-Ausdruck in der LA zeigt. Skala bar = 200 m. (B) Vergrößertes Bild. Skala bar = 50 m. (C) Fluoreszenz mikroskopisches Bild mit DAPI-Färbungssignal. Maßstabsleiste = 200 m. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Faktor | Wert |
| Räumlicher Down-Sampling-Faktor | 2 |
| Zeitlicher Down-Sampling-Faktor | 2 |
| Raumfilter: Hoher Cut-off | 0.5 |
| Räumlicher Filter: Niedriger Cut-off | 0.005 |
| Bewegungskorrektur: Hohe Abschaltung | 0.016 |
| Bewegungskorrektur: Niedriger Cut-off | 0.004 |
| Bewegungskorrektur: Maxtranslation | 20 |
| •F/F-Referenzrahmen | Mittlerer Rahmen |
| PCA/ICA: blockSize | 1000 |
| PCA/ICA: KonvergenzSchwellenwert | 1x10-5 |
| PCA/ICA: icaTemporalWeight | 0.4 |
| PCA/ICA: numICs | 120 |
| PCA/ICA: numPCs | 150 |
| PCA/ICA: unmixType | Zeitlichen |
| Ereigniserkennung: Zerfallskonstante | 1.18 |
| Ereigniserkennung: Schwellenwert | 4 |
Tabelle 1: Liste der Variablen für die Datenverarbeitung
Diskussion
Geschickte Operationstechniken sind unerlässlich, um eine erfolgreiche optische Kalzium-Bildgebung in vivo mit Kopf-Mount-Miniaturmikroskopie in tieferen Hirnregionen wie der Amygdala zu erreichen, wie wir sie hier beschrieben haben. Obwohl dieses Protokoll eine Richtlinie für optimierte chirurgische Prozesse der Grundplattenbefestigung und der GRIN-Linsenimplantation bietet, können zusätzliche Optimierungsprozesse für kritische Schritte erforderlich sein. Wie im Protokollabschnitt erwähnt, müssen Amygdala-Koordinaten in der Chirurgie, Luftstromgeschwindigkeit im Baseplate-Befestigungsschritt, Bildaufnahmeeinstellungen (Bildaufnahmerate, LED-Leistung,etc.)in der Kalziumaufzeichnung und Variablen (ICA-Zeitgewicht, Ereignis kleinste Zerfallszeit,etc. )in der Datenverarbeitung optimiert werden.
Der Befestigungsschritt der Grundplatte kann geändert werden. Die Kopfplatte ist notwendig, weil sie hilft, den Kopf von wachen Mäusen während der Grundplattenbefestigung im Mobilheimkäfig zu fixieren. Wird der Mobilheimkäfig jedoch nicht im Labor hergestellt, ist das Isofluran-Gasanästhesiesystem eine alternative Option. Für diesen alternativen Weg kann die Konzentration von Isoflurangas kritisch sein. Wir beobachteten, dass GCaMP-Signal selten in der Amygdala von Mäusen unter 1,5% Isofluran nachgewiesen wird. Im Gegenteil, das GCaMP-Signal wird unter einem 0,8% Isofluran-Zustand nachgewiesen und Mäuse bleiben in einem fast wachen Zustand, aber ohne wesentliche Kopfbewegung in diesem Zustand. Diese Anästhesisierungsbedingung ermöglicht somit die Führung der Grundplattenbefestigung ohne zusätzliche Geräte wie Kopfplatte und Wohnmobilkäfig.
Instabile Befestigung der Schädelschraube, Zement, Grundplatte und Mikroskop kann Bewegungsartefakte verursachen, die mit Hilfe des Bewegungskorrektur-Softwarealgorithmus korrigiert werden können. Die Bewegung des seitlichen Ventrikels wird angenommen, dass eine unregelmäßige Art von Bewegungsartefakten verursacht, die nicht leicht mit derzeit verfügbaren Bewegungskorrektur-Software korrigiert werden können. Solche unregelmäßigen Bewegungsartefakte sind in den meisten oberflächlichen Hirnregionen wie dem Hippocampus und dem Kortex minimal. Es wird jedoch häufig während der optischen Bildgebung in der Amygdala erkannt. Um dieses Problem zu überwinden, schlägt dieses Protokoll vor, die GRIN-Linse 50 m von der viralen Injektionsstelle auf die seitliche Seite zu implantieren (Abbildung 1C), was den Bildaufnahmeprozess erheblich verbessert, indem die potenziellen Bewegungsartefakte aus dem seitlichen Ventrikel reduziert werden. Obwohl wir 50 m relativ zur viralen Injektionsstelle festlegen, kann die Zielkoordinate für die Linsenimplantation auch relativ zum lateralen Ventrikel eingestellt werden. In diesem Protokoll haben wir argumentiert, dass es wichtiger ist, die virale Ausdrucksstelle für eine erfolgreiche Performance der Bildgebung genau zu zielen. Daher haben wir eine virale Injektionskoordinate als Referenz verwendet, um die Zielkoordinate der Linsenimplantation festzulegen. Durch wiederholte Versuche haben wir eine optimale Bedingung etabliert, die es der GRIN-Linse ermöglichte, die virale Ausdrucksstelle effizient auszurichten und Bewegungsartefakte zu vermeiden, die durch seitliche Ventrikelbewegungen verursacht wurden. Schließlich wäre die Methode, die alle Bewegungsartefakte effizient und genau korrigieren kann, eine große Hilfe für den Zugriff auf optische Bildgebung in tieferen Hirnregionen in der Zukunft.
Obwohl die in vivo optische Kalzium-Bildgebung mit Kopf-Mount-Miniaturmikroskop ein leistungsfähiges Werkzeug ist und optimiert wurde, gibt es in vielerlei Hinsicht noch Raum für Verbesserungen. Dieses Protokoll wird Studien erleichtern, die darauf abzielen, die neuronale Aktivität in Echtzeit in der Amygdala frei verhaltender Tiere zu untersuchen.
Offenlegungen
Der Autor hat nichts zu verraten
Danksagungen
Diese Arbeit wurde durch Stipendien der Samsung Science and Technology Foundation (Projektnummer SSTF-BA1801-10) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
Referenzen
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637(2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128(2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten