Method Article
Imaging di calcio in vivo di successo con un microscopio miniaturizzato head-mount nell'amigdala del topo che si comporta liberamente
In questo articolo
Riepilogo
L'imaging microendoscopico in vivo del calcio è uno strumento inestimabile che consente il monitoraggio in tempo reale delle attività neuronali negli animali che si comportano liberamente. Tuttavia, l'applicazione di questa tecnica all'amigdala è stata difficile. Questo protocollo mira a fornire una linea guida utile per indirizzare con successo le cellule di amigdala con un microscopio miniaturizzato nei topi.
Abstract
Il monitoraggio in tempo reale in vivo delle attività neuronali negli animali che si muovono liberamente è uno degli approcci chiave per collegare l'attività neuronale al comportamento. A tal fine, è stata sviluppata e applicata con successo a molte strutture cerebrali1,2,3,4,5,6una tecnica di imaging in vivo che rileva i transitori di calcio nei neuroni utilizzando indicatori di calcio geneticamente codificati (GECI), un microscopio a fluorescenza miniaturizzata e una lente indice di rifrazione gradiente (GRIN). Questa tecnica di imaging è particolarmente potente perché consente l'imaging simultaneo cronico di popolazioni cellulari geneticamente definite per un periodo di lungo periodo fino a diverse settimane. Sebbene utile, questa tecnica di imaging non è stata facilmente applicata alle strutture cerebrali che si trovano in profondità nel cervello come l'amigdala, una struttura cerebrale essenziale per l'elaborazione emotiva e la memoria della pauraassociativa 7. Ci sono diversi fattori che rendono difficile l'applicazione della tecnica di imaging all'amigdala. Ad esempio, gli artefatti del movimento di solito si verificano più frequentemente durante l'imaging condotto nelle regioni cerebrali più profonde perché un microscopio a testa impiantato in profondità nel cervello è relativamente instabile. Un altro problema è che il ventricolo laterale è posizionato vicino alla lente GRIN impiantata e il suo movimento durante la respirazione può causare artefatti di movimento altamente irregolari che non possono essere facilmente corretti, il che rende difficile formare una vista di imaging stabile. Inoltre, poiché le cellule nell'amigdala sono solitamente silenziose in uno stato di riposo o anestetizzato, è difficile trovare e mettere a fuoco le cellule bersaglio che esprimono GECI nell'amigdala durante la procedura di base per l'imaging successivo. Questo protocollo fornisce una linea guida utile su come indirizzare in modo efficiente le cellule che esprimono GECI nell'amigdala con microscopio miniaturizzato a testa per un'imaging di calcio in vivo di successo in una regione cerebrale così profonda. Si noti che questo protocollo si basa su un particolare sistema (ad esempio, Inscopix) ma non limitato ad esso.
Introduzione
Il calcio è un secondo messaggero onnipresente, che gioca un ruolo cruciale in quasi tutte le funzioni cellulari8. Nei neuroni, il potenziale d'azione di cottura e l'input sinaptico causano un rapido cambiamento del libero intracellulare [Ca2+]9,10. Pertanto, tracciare i transitori di calcio offre l'opportunità di monitorare l'attività neuronale. I GECI sono potenti strumenti che consentono il monitoraggio [Ca2+] in popolazioni cellulari definite e compartimenti intracellulari11,12. Tra molti tipi diversi di indicatore di calcio a base proteica, GCaMP, una sonda Ca2+ basata su una singola molecola GFP13, è il GECI più ottimizzato e quindi ampiamente utilizzato. Attraverso più cicli di ingegneria, è stato sviluppato un certo numero di varianti di GCaMP12,14,15,16. Usiamo uno dei GCAMP sviluppati di recente, GCaMP7b, in questo protocollo16. I sensori GCaMP hanno notevolmente contribuito allo studio delle funzioni del circuito neurale in una serie di organismi modello come l'imaging dei transitori Ca2+ durante losviluppo 17,l'imaging in vivo in uno specifico strato corticale18,la misurazione della dinamica del circuito nell'apprendimento delle attività motorie19 e l'imaging dell'attività dell'insieme cellulare correlata alla memoria della paura associativa nell'ippocampo e nell'amigdala20,21.
L'imaging ottico dei GECI presenta diversivantaggi 22. La codifica genetica consente ai GECI di essere espressi stabilmente per un periodo di tempo a lungo termine in un sottoinsieme specifico di cellule definite dal profilo genetico o da modelli specifici di connettività anatomica. L'imaging ottico consente il monitoraggio cronico simultaneo in vivo di centinaia o migliaia di neuroni negli animali vivi. Sono stati sviluppati alcuni sistemi di imaging ottico per l'imaging in vivo e l'analisi di GECI all'interno del cervello di topi che si comportano liberamente con microscopi miniaturizzati a fluorescenzaa testa 21,23,24,25. Nonostante la tecnica di imaging ottico in vivo basata su GECI, lente GRIN e un microscopio in miniatura a testa sia un potente strumento per studiare il legame tra attività e comportamento del circuito neurale, l'applicazione di questa tecnologia all'amigdala è stata difficile a causa di diversi problemi tecnici legati al targeting dell'obiettivo GRIN alle cellule che esprimono GECI nell'amigdala senza causare artefatti di movimento che riducono gravemente la qualità dell'acquisizione di immagini e trovano cellule che esprimono GECI. Questo protocollo mira a fornire una linea guida utile per le procedure chirurgiche di attacco della piastra di base e impianto dell'obiettivo GRIN che sono passaggi critici per l'imaging ottico di calcio in vivo di successo nell'amigdala. Sebbene questo protocollo si rivolge all'amigdala, la maggior parte delle procedure descritte qui sono comunemente applicabili ad altre regioni cerebrali più profonde. Sebbene questo protocollo sia basato su un particolare sistema (ad esempio, Inscopix), lo stesso scopo può essere facilmente raggiunto con altri sistemi alternativi.
Protocollo
Tutte le procedure sono state approvate dal Comitato etico animale del Korea Advanced Institute of Science and Technology. Tutti gli esperimenti sono stati eseguiti secondo le linee guida del Comitato istituzionale per la cura e l'uso degli animali.
NOTA: Questo protocollo consiste in sei passaggi principali: chirurgia dell'iniezione di virus, chirurgia implantare dell'obiettivo GRIN, convalida dell'impianto dell'obiettivo GRIN, attacco della base, registrazione ottica del segnale GCaMP durante un test di comportamento ed elaborazione dei dati (Figura 1A). Ad eccezione della chirurgia, viene utilizzato il pacchetto software commerciale (Inscopix).
1. Chirurgia stereotassica - Iniezione di virus AAV
NOTA: Il ceppo del topo utilizzato in questa procedura chirurgica è C57BL6/J. Il corpo dell'animale è coperto da un drappo sterile durante l'intervento chirurgico e tutti i passaggi del protocollo vengono eseguiti indossando guanti sterili. Gli interventi chirurgici multipli di solito non vengono eseguiti nello stesso giorno. Tuttavia, se più topi devono fare lo stesso intervento chirurgico nello stesso giorno, utilizzare un set separato di strumenti chirurgici autoclavati per ogni topo e il 70% di etanolo per disinfettare gli strumenti chirurgici tra topi. Per mantenere caldo il mouse durante la procedura chirurgica, il mouse è coperto da una coperta chirurgica su misura dopo essere stato fissato al telaio stereotassico.
- Disinfettare tutti gli strumenti chirurgici necessari con il 70% di etanolo e preparare una siringa Hamilton e una pipetta di vetro. Riempire la pipetta di vetro con acqua distillata.
NOTA: Tutti gli strumenti chirurgici utilizzati nel protocollo sono autoclavati. Poiché l'obiettivo GRIN e le viti cranico non possono essere autoclavati per la sterilizzazione, il 70 % di etanolo viene utilizzato come disinfettante per prevenire l'infiammazione. Anche se non provato, possono essere utilizzate altre forme di sterilizzazione, ad esempio gas o sterilizzazione chimica. - Anestetizzare il topo con pentobarbital (83 mg-kg-1 di peso corporeo) per iniezione intraperitoneale. Dopo che il topo diventa incosciente, radere la pelliccia sul cranio.
- Pulire la pelle sopra il cranio con il 70% di etanolo e fissare il mouse al telaio stereotassico. Rimuovere con cura la pelle e pulire la superficie del cranio con una soluzione di perossido di idrogeno al 35% utilizzando un applicatore a punta di cotone. Applicare unguento per gli occhi lubrificante per evitare l'essiccazione corneale durante l'intervento chirurgico.
NOTA: Sebbene di solito non ci siano problemi con l'uso del 70% di etanolo solo per la preparazione aseptica della pelle, si consiglia di utilizzare 3 cicli alternati di disinfettante, ad esempio iodofori o soluzione di clorexidina e 70% di etanolo. Una maggiore concentrazione di perossido di idrogeno viene utilizzata in questo protocollo per assicurarsi che il tessuto connettivo sul cranio del topo venga rimosso il più completamente possibile, il che è fondamentale per ridurre l'artefatto del movimento durante l'imaging successivo perché il tessuto connettivo sul cranio interferisce con un solido attacco della base al cranio. Va notato che il 35% di perossido di idrogeno è molto più alto di quello normalmente utilizzato (3 %). - Fissare il perno con un supporto per sonde stereotassiche. Allineare l'altezza del bregma e della lambda con il perno.
- Trova la posizione specifica sul cranio del topo per la craniotomia.
NOTA: Le coordinate dell'amigdala laterale (LA) per iniezione di virus sono (AP, ML, DV) = (-1,6 mm, -3,5 mm, -4,3 mm) da bregma in questo protocollo (AP; Anteriore-Posteriore, ML; Mediale-Laterale, DV; Dorsale-Ventrale, ogni abbreviazione indica la distanza assiale relativa dal bregma)26. Le coordinate devono essere ottimizzate per ogni condizione sperimentale. - Perforare la superficie del cranio( Figura 1B). Lavare le frazioni cranica con soluzione salina tamponata con fosfato (PBS). Rimuovere lo strato rimanente utilizzando pini o un ago da 27 G.
- Quando si fora il cranio, cercare di non toccare l'ultimo strato dura per evitare danni alla superficie del tessuto cerebrale. Una superficie cerebrale danneggiata provoca infiammazione intorno all'obiettivo, che induce gravi artefatti del movimento e alta autofluorescenza durante la registrazione. La dimensione della craniotomia è di 1,6 mm. La velocità del trapano è di 18.000 giri/min e la dimensione del bit è di 0,6 mm.
- Per abbassare l'obiettivo GRIN dalla superficie del tessuto cerebrale del sito forato al sito di amigdala bersaglio, calcolare la distanza denominata "Valore A" sottraendo la differenza DV tra il bregma e la superficie cerebrale esposta dalla coordinata DV dell'impianto dell'obiettivo, impostata in base al bregma (4,2 mm in questo caso, Figura 1C).
- Caricare 3 μL di olio minerale e 0,7 μL della soluzione del virus AAV nella pipetta di vetro.
NOTA: L'olio minerale aiuta a separare la soluzione virale dall'acqua. 0,7 μL è un volume ottimizzato per l'iniezione di virus LA in grado di coprire completamente l'A LOS. - Rimuovere il perno dal supporto della sonda stereotassica e fissarlo.
- Individuare la pipetta di vetro nel sito di iniezione menzionato al passaggio 1.5. Inserire la pipetta di vetro nel tessuto cerebrale dopo che il sanguinamento è stato completamente interrotto.
- Consegnare il virus attraverso una pipetta di vetro utilizzando una pompa di iniezione.
NOTA: Il titolo del virus deve essere superiore a 1 x 1013 vg/mL per ottenere un numero sufficiente di cellule che esprimono GCaMP. La velocità di iniezione è di 0,1 μL/min e diffusa per 10 min. Se c'è sanguinamento, lavare la superficie cerebrale con PBS. Mantieni la superficie cerebrale bagnata in questo passaggio. - Dopo aver terminato l'iniezione, rimuovere lentamente la pipetta di vetro.
2. Chirurgia stereotassica - Impianto dell'obiettivo GRIN
NOTA: la chirurgia implantare dell'obiettivo GRIN è il passaggio più critico di questo protocollo. Poiché una velocità lenta costante del movimento dell'obiettivo GRIN è fondamentale per il successo dell'impianto dell'obiettivo GRIN, può essere utile un braccio chirurgico motorizzato. Il braccio di chirurgia motorizzato è un manipolatore stereotassico controllato da software per computer. Sebbene il braccio motorizzato sia utilizzato in questo protocollo, altri modi possono anche essere utilizzati finché l'obiettivo si muove in modo coerente e lento durante l'impianto. Informazioni dettagliate sul dispositivo sono disponibili nella tabella dei materiali.
- Perforare il cranio per impiantare due viti cranica. Lavare tutte le frazioni del cranio con PBS.
NOTA: Per ridurre gli artefatti di movimento nell'imaging ottico successivo, sono necessarie almeno due viti. Le due viti del cranio e la posizione dell'impianto dell'obiettivo GRIN formano un triangolo equilatero( Figura 1B). La dimensione della craniotomia dovrebbe adattarsi strettamente al diametro della vite. Se c'è sanguinamento, lavare la superficie sanguinante con PBS. La velocità del trapano è di 18.000 giri/min e la dimensione del bit è di 0,6 mm. - Disinfettare le viti con il 70% di etanolo per prevenire l'infiammazione. Impiantare le viti il più in profondità possibile.
NOTA: Le viti devono essere fissate saldamente senza ulteriore adesione come il cemento. - Installare un braccio chirurgico motorizzato sul telaio stereotassico. Collegare l'hardware richiesto al computer portatile in cui è installato il software di controllo (Table of Materials).
- Prima di abbassare l'obiettivo GRIN, prepararsi a fare una traccia dell'ago con un ago da 26 G.
NOTA: La pista dell'ago è una sorta di pista guida che aiuta a impiantare l'obiettivo GRIN relativamente spessa in regioni cerebrali profonde come l'amigdala senza causare una grave distorsione della struttura cerebrale lungo il percorso di iniezione. Questa pista guida è chiamata pista dell'ago perché è fatta da una procedura di abbassamento ed elevazione di ago 26 G relativamente sottile. - Attaccare il supporto della cannula per tenere stabilmente l'ago sul telaio stereotassico.
- Afferrare l'ago da 26 G con il supporto per cannula e calcolare le coordinate del sito di inserimento dell'ago.
NOTA: In questo protocollo, le coordinate del sito di inserimento dell'ago sono 50 μm lateralmente dal sito di iniezione del virus (AP, ML, DV) = (-1,6 mm, -3,55 mm, -3,7 mm). - Accedi al software di controllo e completa preparazione per manipolare la posizione dell'ago.
- Eseguire il software di controllo e selezionare il pulsante Avvia nuovo progetto per iniziare a controllare la sessione.
NOTA: nella sessione di controllo, ci sono diverse caselle vuote e pulsanti di menu. Le caselle vuote sono spazio di input per le coordinate. Dopo aver immesso le coordinate nelle caselle vuote, il braccio stereotassico motorizzato si muove facendo clic sul pulsante Vai a. Il pulsante Vai a si trasforma in un tasto STOP quando il braccio stereotassico si muove. Tra diversi pulsanti di menu, in questo protocollo è richiesto solo il pulsante Strumento. - Fare clic sul pulsante Strumento. Calibrare il software di controllo facendo clic sul pulsante calibra il menu del fotogramma. La calibrazione è il processo mediante il quale la posizione effettiva del manipolatore viene impostata come valori sul software Stereodrive.
- Eseguire il software di controllo e selezionare il pulsante Avvia nuovo progetto per iniziare a controllare la sessione.
- Individuare la punta dell'ago sulla superficie del cervello esposta sulla superficie del cranio utilizzando un manipolatore stereotassico.
NOTA: la velocità dell'ago viene impostata utilizzando il menu Velocità Microdrive del menu Utensile. La velocità predefinita è di 3,0 mm/s. Tuttavia, in questo passaggio si consiglia una velocità di 0,5 mm/s. Il movimento dell'ago è controllato dai tasti di direzione. - Aggiungere 2-3 gocce di PBS per mantenere bagnata la superficie cerebrale. Compilare la casella vuota sullo schermo del computer con le coordinate DV appropriate dell'A LOS Angeles. Se la superficie cerebrale è asciutta, ostacola la penetrazione dell'ago nel tessuto cerebrale.
- Abbassare l'ago da 26 G facendo clic sul pulsante Vai a. Si arresta automaticamente quando l'ago raggiunge il sito di destinazione impostato dalle coordinate DV. La velocità dell'ago è di 100 μm/min. Se c'è sanguinamento, fermare l'ago facendo clic sul pulsante STOP e lavare la superficie cerebrale con PBS. Mantieni la superficie cerebrale bagnata in questo passaggio. Dopo che il sanguinamento è stato interrotto, ricominciare ad abbassarsi.
- Dopo che l'ago smette completamente di muoversi, inserire 45,00 mm nella scatola bianca sullo schermo del computer.
NOTA: 45,00 mm è un valore della coordinata DV che fa tornare l'ago nella posizione iniziale. - Elevare l'ago facendo clic sul pulsante Vai a. La velocità del movimento dell'ago è di 100-200 μm/min.
- Dopo che l'ago smette di muoversi, rimuovere il PBS sulla superficie cerebrale. Disinstallare l'ago e il supporto per cannula dal telaio stereotassico. Lo sperimentatore può arrestare manualmente l'ago facendo clic sul tasto STOP quando necessario.
- Equipaggia l'asta stereotassica con il supporto dell'obiettivo. Installare l'obiettivo GRIN sul supporto dell'obiettivo.
NOTA: L'obiettivo GRIN ottimizzato per il targeting del LA (0,6 mm di diametro, 7,3 mm di lunghezza) viene utilizzato in questo protocollo. Se il supporto dell'obiettivo non è preparato, un modo alternativo è utilizzare una clip bulldog per afferrare l'obiettivo GRIN. - Disinfettare l'obiettivo con il 70% di etanolo e attaccare l'asta stereotassica ai telai stereotassici.
- Individuare la punta dell'obiettivo GRIN nel sito designato sulla superficie del cranio (stesso metodo descritto al passaggio 2.8).
NOTA: La coordinata dell'obiettivo GRIN è (AP, ML, DV) = (-1,6 mm, -3,55 mm, -4,2 mm) (Figura 1C). L'obiettivo non deve toccare il cranio per evitare danni sulla punta. - Calcolare la coordinata DV sottraendo il valore assoluto di "Valore A" dalla coordinata DV dell'impianto dell'obiettivo descritto nel passaggio 2.16.
- Rilascia 2-3 gocce di PBS sulla superficie cerebrale. Immettere 1000 μm per l'abbassamento e 300 μm per sollevare l'obiettivo nella scatola bianca sullo schermo del computer.
- Ripetere l'abbassamento (1000 μm verso il basso) e l'innalzamento (300 μm verso l'alto) dell'obiettivo GRIN fino a raggiungere il sito di destinazione. Questa procedura su e giù viene utilizzata per aiutare a rilasciare la pressione generata all'interno del tessuto cerebrale a causa della procedura di abbassamento della lente che altrimenti può causare distorsioni delle strutture cerebrali lungo il percorso di impianto.
NOTA: La velocità del movimento dell'obiettivo GRIN è di 100 μm/min. Anche se c'è sanguinamento, non smettere di spostare l'obiettivo GRIN e lavare la superficie cerebrale con PBS. Mantieni la superficie cerebrale bagnata in questo passaggio. Se la superficie cerebrale è asciutta, il tessuto cerebrale si attacca alla superficie dell'obiettivo GRIN e provoca distorsioni della struttura cerebrale. - Se l'obiettivo GRIN raggiunge il sito di destinazione, rimuovere PBS e applicare con cura il cemento dentale in resina attorno all'obiettivo GRIN, alle viti e alla parete laterale (Figura 1D).
NOTA: L'applicazione del cemento resina su tutto il cranio può ridurre gli artefatti del movimento. Al contrario, se il cemento resina copre accidentalmente i muscoli attaccati al cranio, aumenta gli artefatti del movimento. - Dopo che il cemento dentale in resina si indurisce, smontare l'obiettivo GRIN dal supporto dell'obiettivo e applicare cemento acrilico su tutto il cranio(Figura 1D).
- Per fissare la piastra della testa, smontare il supporto dell'obiettivo dall'asta stereotassica e attaccare la piastra della testa sulla punta dell'asta utilizzando i nastri. Verificare se la piastra della testa è orizzontale.
NOTA: Una piastra della testa inclinata provoca una vista inclinata. È necessaria una piastra di testa per fissare la testa del mouse nel sistema di gabbia domestica mobile (nella sezione di attacco della piastra di base). Se lo sperimentatore non utilizza il sistema, ignorare questo passaggio (passaggio 2.22) e il passaggio 2.23 seguente. - Abbassare lentamente l'asta fino a quando la piastra della testa non si trova nella parte superiore del polsino dell'obiettivo. Abbassare la piastra della testa di 1000 μm in più. Spostare la piastra della testa per l'obiettivo GRIN impiantato per individuare sul bordo destro dell'anello interno della piastra frontale.
NOTA: La piastra della testa deve essere posizionata più in basso rispetto alla superficie dell'obiettivo GRIN impiantata; in caso contrario, il microscopio non può avvicinarsi abbastanza vicino all'obiettivo GRIN impiantato per regolare il piano focale a causa del cemento acrilico. - Applicare il cemento acrilico per attaccare la piastra della testa agli strati di cemento (Figura 1D).
- Attaccare la pellicola di paraffina sulla superficie dell'obiettivo GRIN impiantata per proteggere la superficie dell'obiettivo dalla polvere. Quindi applicare il legame epossidico rimovibile sul film di paraffina per mantenere la pellicola di paraffina rimanere sulla superficie dell'obiettivo.
- Iniettare Carprofen, un analgesico (0,5 mg/mL in PBS) e Dexametasone, un farmaco antinfiammatorio (0,02 mg/mL in PBS) soluzione, nella cavità peritoneale del topo.
NOTA: La dose del farmaco dipende dal peso corporeo: Carprofene (5 mg-kg-1 del peso corporeo) e Desametasone (0,2 mg-kg-1 del peso corporeo). Sia il Carprofene che il Desametasone vengono somministrati dopo l'intervento chirurgico e una volta al giorno per 7 giorni dopo l'intervento chirurgico. - Mescolare 0,3 mg /mL amoxicillina, un antibiotico, nell'acqua della gabbia domestica per somministrare il farmaco per 1 settimana.
- Riportare il topo nella gabbia di casa e consentire 5-8 settimane per il recupero e la trasduzione del virus.
NOTA: Il topo viene recuperato in una gabbia pre-riscaldata su una coperta elettrica fino a quando il mouse non si sveglia dall'anestetico.
3. Convalida dell'impianto dell'obiettivo GRIN
NOTA: La convalida dell'impianto dell'obiettivo GRIN fornisce informazioni sul fatto che l'obiettivo GRIN impiantato sia sul bersaglio delle cellule che esprimono GCaMP. Sulla base di queste informazioni, lo sperimentatore risparmia tempo da processi dispendiosi in termini di tempo come il test del comportamento e l'elaborazione dei dati escludendo gli animali con impianto di lenti GRIN non mirato. Durante la procedura di convalida, le celle con espressione GCaMP devono essere concentrate nel campo visivo di registrazione. In questo passaggio viene utilizzata una gabbia domestica mobile. Una gabbia domestica mobile è un apparato specializzato a forma rotonda che consente ai topi fissi della testa di muovere liberamente le gambe durante la convalida dell'impianto dell'obiettivo GRIN e dell'attacco della piastra di base. Un tavolo di sollevamento aereo in questo apparecchio su cui sono posizionate le gambe dei topi fissi della testa consente tale libera circolazione delle gambe anche se la testa è fissata. Le cellule nel nucleo laterale dell'amigdala sono solitamente silenziose in uno stato di riposo o anestetizzato, quindi i segnali di fluorescenza GCaMP vengono raramente rilevati in queste condizioni, il che rende molto difficile, a volte impossibile, trovare cellule che esprimono GCaMP durante la convalida dell'impianto dell'obiettivo GRIN e dell'attacco della piastra di base. Tuttavia, il movimento delle gambe spesso produce segnali di fluorescenza GCaMP nelle cellule del nucleo laterale dell'amigdala e quindi può aiutare a localizzare il microscopio. Pertanto, la gabbia domestica mobile viene utilizzata in questo protocollo.
- Assemblare il manipolatore stereotassico sul sistema di gabbie per la casa mobile.
- Anestetizzare il topo con l'1,5% di gas isoflurane. Dopo che il mouse è completamente privo di sensi, posiziona il mouse sulla barra della testa del sistema di gabbie per la casa mobile.
- Individuare la gabbia di carbonio sotto il mouse. Chiudere la gabbia di carbonio e accendere il flusso d'aria per far muovere liberamente la gabbia senza attrito. Attendere alcuni minuti prima che il mouse diventi attivo.
NOTA: La velocità del flusso d'aria deve essere ottimizzata per ogni condizione sperimentale (qui, 100 L / min). - Rimuovere la pellicola di paraffina e il legame epossidico sulla superficie dell'obiettivo GRIN impiantato e pulire la superficie dell'obiettivo con il 70% di etanolo utilizzando carta lente.
- Preparare il software di acquisizione dati (DAQ) (ad esempio, Inscopix). Impostare le condizioni di imaging.
NOTA: il software DAQ viene utilizzato per controllare il microscopio (alimentazione a LED, messa a fuoco dell'obiettivo,ecc.)e l'archiviazione dei dati.- Accendere la casella DAQ e collegarti un microscopio. Quindi, collegalo a un computer portatile utilizzando direttamente un cavo o tramite Internet wireless.
NOTA: Il software DAQ è installato nell'hardware aggiuntivo chiamato DAQ box (ad esempio, Inscopix). Collegando la casella DAQ al computer portatile, il software DAQ diventa accessibile in un computer portatile. - Accedere al software DAQ tramite un browser Internet (si consiglia Firefox).
- Impostare tutti i dettagli necessari (Data, ID mouse ecosì via) nella sessione definita. Quindi fare clic su Salva e continua. Dopo il salvataggio, accedere alla sessione Esegui.
- Nella sessione di esecuzioneimpostare le condizioni di imaging quali tempo di esposizione, guadagno, messa a fuoco elettronica e potenza del LED di esposizione.
NOTA: Il guadagno e la potenza del LED di esposizione sono modificabili a seconda delle condizioni di laboratorio. Il valore consigliato per la messa a fuoco elettrica è 500 e il tempo di esposizione è di 50 ms. Non ci sono restrizioni per cambiare la potenza e il guadagno dei LED. Tuttavia, una maggiore intensità della luce può causare più sbiancamento. Il tempo di esposizione della registrazione determina una frequenza fotogrammi della registrazione video. Una frequenza fotogrammi più elevata ridurrà l'intensità del segnale. Le frequenza dei fotogrammi devono essere ottimizzate per i GECI utilizzati per l'imaging.
- Accendere la casella DAQ e collegarti un microscopio. Quindi, collegalo a un computer portatile utilizzando direttamente un cavo o tramite Internet wireless.
- Per tenere il microscopio su un manipolatore stereotassico, attaccare l'asta stereotassica con pinza al microscopio al manipolatore stereotassico.
NOTA: La pinza è un piccolo accessorio che può essere collegato all'apparato stereotassico per contenere un corpo al microscopio per posizionarlo nella posizione del cervello bersaglio. - Afferra il microscopio con la pinza al microscopio. Accendere la luce LED collegata al microscopio e allineare il microscopio verticalmente. Abbassare il microscopio osservando l'immagine fino a quando non viene visualizzata la superficie dell'obiettivo GRIN impiantato.
- Allineare il centro dell'obiettivo GRIN impiantato con il centro della vista.
NOTA: La convalida dell'impianto dell'obiettivo GRIN può essere effettuata in questa fase (menzionata nella sezione dei risultati, Figura 2B, Figura 2D, Figura 2F). - Acquisire l'immagine della superficie dell'obiettivo GRIN impiantata (fare clic sul pulsante Prt Sc sulla tastiera). L'immagine della superficie dell'obiettivo GRIN impiantata è necessaria per deselezionare i componenti non neuronali durante l'elaborazione successiva dei dati (fase 6.8).
- Trova la posizione appropriata del microscopio. Eleva lentamente l'obiettivo del microscopio osservando l'immagine per cercare cellule con espressione GCaMP7b.
NOTA: Potrebbe essere necessario regolare il guadagno dell'acquisizione dell'immagine o la potenza del LED di esposizione. La convalida dell'impianto dell'obiettivo GRIN può essere effettuata in questa fase (menzionata nella sezione dei risultati, Figura 2A, Figura 2C, Figura 2E).
4. Attacco della piastra di base
NOTA: La fase di attacco della piastra di base segue la convalida dell'impianto dell'obiettivo GRIN. La base è una piattaforma per il montaggio del microscopio sulla testa dei topi. Come accennato nella sezione precedente, in questo protocollo viene utilizzata una gabbia mobile per la casa.
- Dopo aver convalidato l'impianto dell'obiettivo GRIN, smontare un microscopio in miniatura dalla pinza del microscopio.
- Attaccare la base al microscopio. Stringere la vite utilizzando l'esagono per un fissaggio stabile della piastra di base al microscopio.
- Afferra il microscopio con la pinza al microscopio. Accendere la luce LED collegata al microscopio e allineare il microscopio verticalmente. Abbassare il microscopio fino a quando non viene osservata la superficie dell'obiettivo GRIN impiantato. Allineare il centro dell'obiettivo GRIN impiantato con il centro della vista.
- Trova la posizione appropriata del microscopio. Elevare lentamente l'obiettivo del microscopio fino a trovare un piano focale che dia le migliori immagini di cellule con espressione GCaMP7b (Figura 2A).
NOTA: Potrebbe essere necessario regolare il guadagno di acquisizione dell'immagine o di esposizione-LED durante questa fase. - Applicare il cemento acrilico per attaccare stabilmente la piastra di base alla piastra della testa (Figura 2G). Costruisci le pareti laterali con cemento acrilico tra la piastra di base e la piastra della testa.
NOTA: Il cemento acrilico si restringe quando si indurisce. Per questo motivo, non rimuovere il microscopio fino a quando il cemento non si indurisce completamente (questo passaggio richiede almeno 30 minuti). La cementazione dovrebbe essere eseguita con molta attenzione per evitare cementifici indesiderati del microscopio e della sua lente oggettiva con cemento acrilico. - Dopo che il cemento acrilico si indurisce completamente, allentare la vite ed elevare lentamente il corpo del microscopio.
- Se c'è uno spazio sulla parete laterale, ripetere la cementazione aggiuntiva per proteggere l'obiettivo GRIN impiantato dalla polvere.
- Coprire la piastra di base per proteggere l'obiettivo GRIN impiantato dalla polvere e stringere la vite della piastra di base.
- Rilasciare la piastra della testa dalla barra della testa. Riportare il mouse in gabbia fino alla futura imaging ottico.
5. Registrazione ottica del segnale GCaMP durante un test di comportamento
NOTA: La procedura di registrazione del segnale GCaMP durante il comportamento può essere molto diversa a seconda dei sistemi utilizzati per l'imaging ottico, la progettazione sperimentale e l'ambiente di laboratorio. Pertanto, è descritto in modo semplice in questa sezione.
- Condurre diversi giorni di gestione prima del test di comportamento.
- Preparare l'apparato comportamentale (ad esempio, camera di condizionamento della paura, software di comportamento e lo strumento Coulbourn) e computer portatile.
- Collegare il microscopio alla casella DAQ e attivare la casella DAQ.
- Collegare la casella DAQ al computer portatile tramite connessione Internet wireless.
- Avviare il software DAQ (si consiglia il browser Firefox) sul computer portatile. Fare clic sul pulsante Gestione file e selezionare la capacità di archiviazione rimanente della casella DAQ per salvare i dati registrati.
NOTA: la dimensione dei dati è di circa 80 GB per la registrazione di 30 minuti. - Immettere le informazioni necessarie (Data, ID mouse ecosì via) nella sessione Definita e immettere la sessione Esegui.
- Afferrare delicatamente il mouse e rimuovere il coperchio della piastra di base sulla testa. Posizionamento del microscopio sulla piattaforma della base.
- Stringere la vite della base e posizionare l'animale con un microscopio a testa nella camera di comportamento.
NOTA: il mouse tenta di fuggire in questo passaggio se la gestione non è sufficiente. - Collegare la scheda NI alla porta TRIG della scatola DAQ utilizzando un cavo BNC. La scheda NI riceve segnali TTL dal software di comportamento (ad esempio FreezeFrame) e coordina la procedura di registrazione simultanea del segnale GCaMP e del comportamento dell'animale.
- Regolare il piano focale.
NOTA: Il piano focale è determinato dalla distanza tra la lente oggettiva del microscopio e l'obiettivo GRIN impiantato nel cervello. Per regolare il piano focale, la posizione dell'obiettivo dell'obiettivo viene manipolata osservando le immagini. La distanza tra queste due lenti che mostra una chiara morfologia delle cellule e dei vasi sanguigni è impostata come piano focale per l'imaging. In questo protocollo, il software DAQ viene utilizzato per controllare il movimento dell'obiettivo durante la regolazione. - Impostare il tempo di esposizione ottimizzato, il guadagno, l'alimentazione a LED nella sessione di corsa.
NOTA: Generalmente, 50 ms viene utilizzato per il tempo di esposizione. Guadagno e alimentazione a LED sono impostati in base agli istogrammi dell'immagine. Gli istogrammi indicano la distribuzione dell'intensità di fluorescenza dei pixel. In base all'ispezione visiva, il bordo destro dell'istogramma dovrebbe avere un valore compreso tra il 40% e il 60% nel caso di GCaMP7b. Cambia a seconda dei GECI utilizzati per l'imaging. - Modificare l'opzione di registrazione in Registrazione attivata. Fare clic su Registra e avviare il comportamento.
NOTA: l'opzione di registrazione attivata fornisce una sequenza temporale abbinata della sessione di registrazione e della sessione di comportamento. Se viene ricevuto il segnale TTL, si accende una luce rossa sopra la porta TRIG. - Dopo aver terminato il test di comportamento, staccare il microscopio e attaccare il coperchio della piastra di base.
- Riportare il topo nella gabbia di casa. Selezionare Quindi Gestione file ed esportare i dati dalla casella DAQ.
- Dopo il test comportamentale, sacrificare il mouse per la verifica istologica post mortem.
6. Trattamento dei dati
NOTA: La procedura di elaborazione dei dati è molto diversa a seconda del software di elaborazione dei dati e dei GECI utilizzati per l'esperimento di imaging. Pertanto, è descritto in modo semplice in questa sezione. Questo protocollo utilizza software di elaborazione dati commerciali (vedere Table of Materials). In alternativa, anche altri software open source menzionati nella sezione discussione possono essere utilizzati senza problemi. Le variabili utilizzate in questo protocollo sono elencate nella tabella 1.
- Importare il file di dati video di registrazione (1280 pixel x 800 pixel) dalla casella DAQ nel computer desktop per l'elaborazione dei dati. Avviare il software di elaborazione dati.
NOTA: il software di elaborazione dei dati è diverso dal software DAQ nei passaggi precedenti. Nel software di elaborazione dei dati, ci sono 6 passaggi: down-sampling, ritaglio, filtro spaziale, correzione del movimento, calcolo ΔF / F, rilevamento di eventi che sono necessari per estrarre dati transitori di calcio a singola cellula dal video registrato. - Decampionare e ritagliare il video.
NOTA: il downsampling e il ritaglio sono necessari per aumentare la velocità di elaborazione dei dati. Ritagliare l'area ad eccezione della regione di interesse in cui viene osservato il segnale GCaMP. - Applicare il filtro spaziale. Dopo aver applicato il filtro spaziale, creare un'immagine di proiezione di intensità media.
NOTA: il filtro spaziale distingue ogni pixel nell'immagine video registrata e fornisce un'immagine a contrasto elevato. Esistono due tipi di filtro di cut-off, filtro di cut-off basso e alto. Il valore più elevato dei filtri di cut-off bassi aumenta il contrasto dell'immagine, ma allo stesso tempo aumenta anche il rumore grigio complessivo. Il valore inferiore del filtro di taglio alto fa sì che l'immagine diventi sfocata. - Applicare la correzione del movimento. Utilizzate l'immagine di proiezione dell'intensità media come immagine di riferimento per la correzione del movimento.
- Applicare nuovamente la correzione del movimento utilizzando l'immagine del primo fotogramma come immagine di riferimento.
NOTA: due passaggi di correzione del movimento riducono significativamente l'artefatto del movimento. - Applicare il calcolo ΔF/F per visualizzare i pixel che mostrano una modifica della luminosità.
NOTA: Il cambiamento di luminosità dei pixel è causato dal cambiamento di intensità della fluorescenza di GCaMP e indica transitori di calcio. - Applicare l'algoritmo PCA/ICA per visualizzare la curva transitoria del calcio di ogni cellula.
NOTA: PCA/ICA è un algoritmo per ordinare un gruppo di dati in un insieme di dati a singolo componente. Le variabili devono essere ottimizzate per ogni condizione di laboratorio. In questo protocollo, tutte le variabili sono predefinite ad eccezione del peso temporale ICA (0.4 viene utilizzato in questo protocollo)27. - Deselezionare manualmente i componenti non neuronali tra i componenti identificati in base ai criteri descritti nella nota seguente.
NOTA: A tal fine vengono utilizzati due criteri principali. In primo luogo, il segnale GCaMP originato da un neurone sembra una chiara forma sferica. Pertanto, solo il segnale con una chiara forma sferica viene selezionato come neurone. In secondo luogo, dato il diametro del corpo cellulare della cellula piramidale di amigdala è noto per essere di circa 20 μm28,29,30, solo il segnale corrisponde approssimativamente a questa dimensione è selezionato come neurone. Per determinare la dimensione del segnale GCaMP, la dimensione effettiva di un singolo pixel viene calcolata in base all'immagine acquisita della superficie dell'obiettivo (passaggio 3.9) e viene calcolata la larghezza massima di una singola forma sferica. Ad esempio, in questo protocollo, il diametro dell'obiettivo GRIN impiantato è di 600 μm. Pertanto, se il diametro dell'obiettivo è di 800 pixel, la dimensione effettiva del singolo pixel è di 1,5 μm (20 μm è di circa 7 pixel). - Applicare la funzione di rilevamento eventi per rilevare un aumento significativo del transitore di calcio (evento calcio).
NOTA: In questo passaggio, è richiesta la variabile chiamata evento più piccolo tempo di decadimento (τ). In questo protocollo, 1.18s viene utilizzato come variabile ottimizzata per GCaMP7b. Il tempo medio di semidiredimento (t1/2=0,82s) è calcolato in base alla curva ΔF/F durante l'attività spontanea delle cellule. Poiché GCaMP segue il decadimento esponenziale, τ = .
.
Risultati
Convalida dell'impianto dell'obiettivo GRIN
Prima di attaccare cronicamente la base al cervello cementando, l'impianto dell'obiettivo GRIN deve essere convalidato. Negli animali con impianto di lenti di successo, sia GCaMP che esprimono cellule e vasi sanguigni sono stati chiaramente osservati all'interno di un intervallo piana focale determinato dalla distanza tra lente oggettiva del microscopio e lente GRIN impiantata (Figura 2A e B). Al contrario, negli animali con impianto fuori bersaglio, non è stata osservata un'immagine chiara delle cellule che esprimono GCaMP all'interno dell'intervallo del piano focale (fuori fuoco o fuori dalla vista). Nel caso di vasi sanguigni fuori fuoco e ben focalizzati, ma solo immagini sfocate per le cellule all'interno dell'intervallo del piano focale (Figura 2C e D). Nel caso di fuori vista, nella maggior parte dei casi non sono stati osservati vasi sanguigni e non è stato rilevato alcun segnale di fluorescenza entro l'intervallo del piano focale (Figura 2E). Inoltre, a differenza di altri casi, l'obiettivo GRIN impiantato ha mostrato un bordo luminoso (Figura 2F). L'attacco della base viene condotto solo su animali convalidati con impianto di lenti GRIN sul bersaglio.
Registrazione dei segnali GCaMP nel neurone LA in risposta agli stimoli uditivi
In questo protocollo, 4 casi di tono pseudorandomizzato (2,8 kHz, durata 200 ms, 25 impulsi) sono stati presentati a un mouse, e i segnali GCaMP sono stati registrati otticamente nelle cellule LA dei topi con microscopio a testa. I topi iniettati con AAV1-Syn-GCaMP7b-WPRE nell'amigdala laterale unilaterale sono stati utilizzati per l'imaging. Negli animali con impianto di lenti GRIN riuscito, le cellule che esprimono virus e i vasi sanguigni sono stati chiaramente osservati all'interno dell'intervallo del piano focale(Figura 3A). Nella condizione di comportamento, circa 50-150 cellule di solito mostrano un significativo cambiamento di fluorescenza nel campo visivo nel LA anche senza tono come mostrato nell'immagine ΔF / F, probabilmente cellule spontaneamente attive (Figura 3B). Al momento della presentazione del tono, solo poche celle hanno mostrato un cambiamento specifico del tono del segnale GCaMP determinato dall'analisi dell'immagine ΔF/F (6 celle nella Figura 3C e nella Figura 3D). Le stesse procedure sono state condotte su topi iniettati con AAV2/1-CaMKIIα-GFP come controllo. Sebbene le cellule che esprimono GFP siano state rilevate all'interno dell'intervallo del piano focale, nessuna voce ha mostrato un significativo cambiamento di fluorescenza con o senza tono, come determinato dall'analisi dell'immagine ΔF/F (Figura 3E e Figura 3F).
Per la verifica istologica dell'espressione GCaMP e il targeting della lente GRIN, le sezioni coronali del cervello postmortem vengono esaminate al microscopio a fluorescenza(Figura 4A e Figura 4B). La colorazione DAPI viene utilizzata per confermare le cellule intatte e nessun segno di danno tissutale dovuto all'infiammazione del tessuto cerebrale intorno all'obiettivo GRIN (Figura 4C).
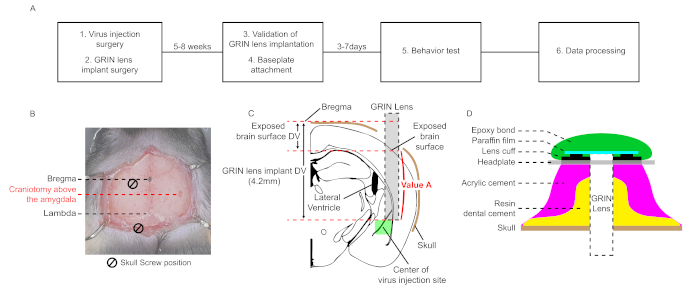
Figura 1: Flusso di lavoro schematico e diagrammi per la chirurgia stereotassica per l'imaging microendoscopico in vivo di calcio nel Los Angeles. (A) Un flusso di lavoro schematico di imaging microendoscopico in vivo di calcio nel Los Angeles. (B) Un quadro microscopico che mostra le coordinate bidimensionali dei siti di craniotomia per l'iniezione di virus e la chirurgia dell'impianto dell'obiettivo GRIN. Due viti cranica e la lente formano un triangolo equilatero. (C) Un diagramma per la posizione relativa tra il sito di iniezione del virus e l'obiettivo GRIN impiantato e una spiegazione schematica per il calcolo del "Valore A". (D) Sezione trasversale dello strato di cemento dalla superficie del cranio alla piastra frontale nelle fasi finali dell'intervento chirurgico. Il cemento dentale in resina deve coprire la parete delle viti e l'obiettivo GRIN impiantato. Il cemento acrilico viene applicato sul cemento dentale in resina. La piastra frontale è attaccata allo strato di cemento. La pellicola di paraffina copre la superficie dell'obiettivo GRIN impiantata e la protegge dalla polvere. Il legame epossidico rimovibile impedisce il distacco della pellicola di paraffina. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Convalida dell'impianto dell'obiettivo GRIN e configurazione degli strati di cemento dopo l'attacco della piastra di base. (A) Un'immagine istantanea endoscopica rappresentativa di animali con impianto di lenti GRIN riuscito. Sia il GCaMP che esprime cellule che vasi sanguigni sono chiaramente osservati. (B) Immagine istantanea della superficie dell'obiettivo GRIN impiantata da animali con impianto di obiettivo GRIN riuscito. (C) Un'immagine istantanea endoscopica rappresentativa di animali con impianto di lenti GRIN fuori fuoco. (D) Immagine istantanea della superficie dell'obiettivo GRIN impiantata dagli animali con impianto dell'obiettivo GRIN fuori fuoco. Nel caso di fuori fuoco, i vasi sanguigni sono talvolta chiaramente osservati, ma solo immagini sfocate per le cellule all'interno del range del piano focale. (E) Un'immagine istantanea endoscopica rappresentativa di animali con impianto di lenti GRIN fuori dalla vista. Nel caso di fuori vista, i vasi sanguigni non sono osservati nella maggior parte dei casi e non viene rilevato alcun segnale di fluorescenza all'interno dell'intervallo del piano focale. (F) Un'immagine istantanea della superficie dell'obiettivo GRIN impiantata da animali con impianto dell'obiettivo GRIN fuori dalla vista. A differenza di altri casi, il bordo luminoso si osserva in questo caso. (G) La configurazione degli strati di cemento per l'attacco della piastra di base. La piastra di base e la piastra frontale sono attaccate da cemento acrilico. Dovrebbe esserci uno spazio vuoto di cemento acrilico tra la piastra di base e l'obiettivo GRIN. Clicca qui per visualizzare una versione più grande di questa figura.
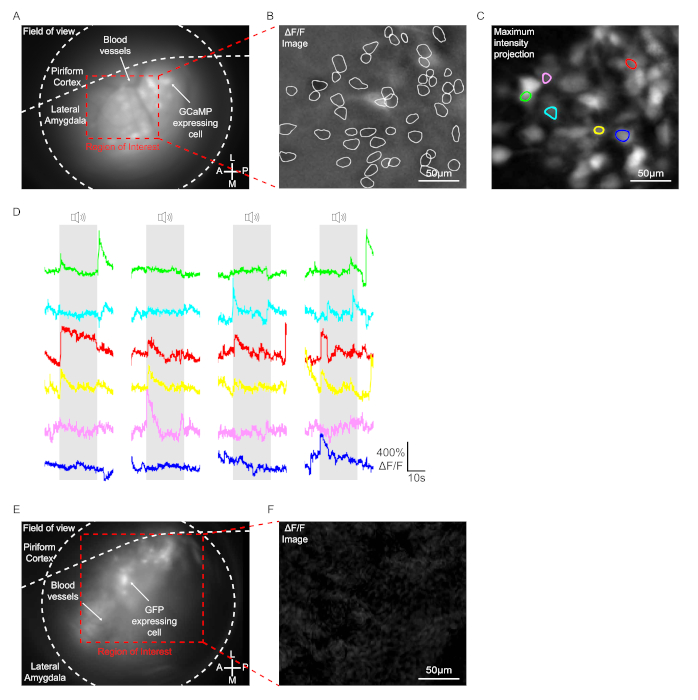
Figura 3: Registrazione dei segnali GCaMP nei neuroni la. (Da A a C) Dati ottenuti da un mouse iniettato con AAV1-Syn-GCaMP7b-WPRE. (A) Un'immagine istantanea endoscopica rappresentativa durante un test di comportamento. GCaMP7b che esprime cellule e vasi sanguigni sono stati chiaramente osservati all'interno dell'intervallo del piano focale. (B) Un'immagine istantanea rappresentativa che mostra il segnale ΔF/F. La linea bianca indica le celle che hanno mostrato un significativo cambiamento di fluorescenza nella regione di interesse durante il test di comportamento. Barra di scala = 50 μm. (C) Immagine di proiezione di intensità massima. In totale 6 celle hanno mostrato un cambiamento specifico del tono del segnale GCaMP. Barra di scala = 50 μm. (D) Tracce rappresentative ΔF/F di cellule reattive al tono. Ogni colore corrisponde a ogni singola cella con lo stesso colore nel pannello (C). (E e F) Dati ottenuti da un mouse iniettato con AAV2/1-CaMKIIα-GFP. (E) Un'immagine istantanea endoscopica rappresentativa durante un test di comportamento. Le cellule che esprimono la GFP sono state chiaramente rilevate all'interno dell'intervallo del piano focale. (F) Un'immagine istantanea rappresentativa che mostra il segnale ΔF/F. Barra di scala = 50μm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Verifica istologica della posizione dell'obiettivo GRIN e dell'espressione GCaMP7b. (A) Immagine rappresentativa della sezione coronale che mostra l'espressione GCaMP7b nel file LA. Barra di scala = 200μm. (B) Immagine ingrandita. Barra di scala = 50 μm. (C) Immagine microscopica a fluorescenza che mostra il segnale di colorazione DAPI. Barra di scala = 200 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
| Fattore | Valore |
| Fattore di campionamento spaziale verso il basso | 2 |
| Fattore di campionamento temporale verso il basso | 2 |
| Filtro spaziale: taglio elevato | 0.5 |
| Filtro spaziale: taglio basso | 0.005 |
| Correzione del movimento: taglio elevato | 0.016 |
| Correzione del movimento: taglio basso | 0.004 |
| Correzione del movimento: Maxtranslation | 20 |
| Frame di riferimento ΔF/F | Cornice media |
| PCA/ICA: blockSize | 1000 |
| PCA/ICA: convergenzaThreshold | 1x10^-5 |
| PCA/ICA: icaTemporalWeight | 0.4 |
| PCA/ICA: numIC | 120 |
| PCA/ICA: numPC | 150 |
| PCA/ICA: unmixType | Temporale |
| Rilevamento eventi: costante di decadimento | 1.18 |
| Rilevamento eventi: soglia | 4 |
Tabella 1: Elenco delle variabili per l'elaborazione dei dati
Discussione
Le abili tecniche chirurgiche sono essenziali per ottenere un'imaging ottico di calcio in vivo di successo con microscopia miniaturica a testa in regioni cerebrali più profonde come l'amigdala come abbiamo descritto qui. Pertanto, sebbene questo protocollo fornisca una linea guida per processi chirurgici ottimizzati di attacco della piastra di base e impianto dell'obiettivo GRIN, potrebbero essere necessari ulteriori processi di ottimizzazione per i passaggi critici. Come accennato nella sezione del protocollo, le coordinate dell'amigdala in chirurgia, la velocità del flusso d'aria nella fase di attacco della piastra di base, le impostazioni di acquisizione delle immagini (frequenza fotogrammi, potenza LED,ecc.)nella registrazione del calcio e le variabili (peso temporale ICA, tempo di decadimento più piccolo dell'evento,ecc.)nell'elaborazione dei dati devono essere ottimizzate.
Il passo di attacco della piastra di base può essere modificato. La piastra della testa è necessaria perché aiuta a fissare la testa dei topi svegli durante l'attacco della piastra di base condotto nella gabbia domestica mobile. Tuttavia, se la gabbia domestica mobile non è preparata in laboratorio, il sistema di anestesia del gas isoflurane è un'opzione alternativa. In questo modo alternativo, la concentrazione di gas isoflurane può essere critica. Abbiamo osservato che il segnale GCaMP viene raramente rilevato nell'amigdala dei topi sotto l'1,5% di isoflurane. Al contrario, il segnale GCaMP viene rilevato in una condizione di isoflurane dello 0,8% e i topi rimangono in uno stato quasi sveglio ma senza un sostanziale movimento della testa in questa condizione. Questa condizione di anestesia consente quindi di condurre l'attacco della piastra di base senza utilizzare dispositivi aggiuntivi come piastra frontale e gabbia domestica mobile.
L'attacco instabile della vite cranica, del cemento, della base e del microscopio può causare artefatti di movimento che possono essere corretti utilizzando l'algoritmo del software di correzione del movimento. Si pensa che il movimento del ventricolo laterale causi un tipo irregolare di artefatti di movimento che non possono essere facilmente corretti con il software di correzione del movimento attualmente disponibile. Tali artefatti di movimento irregolare sono minimi nella maggior parte delle regioni cerebrali superficiali come l'ippocampo e la corteccia. Tuttavia, viene spesso rilevato durante l'imaging ottico nell'amigdala. Per superare questo problema, questo protocollo suggerisce di impiantare l'obiettivo GRIN a 50 μm dal sito di iniezione virale al lato laterale (Figura 1C), che migliora notevolmente il processo di acquisizione dell'immagine riducendo i potenziali artefatti di movimento originati dal ventricolo laterale. Sebbene abbiamo impostato 50 μm rispetto al sito di iniezione virale, la coordinata target per l'impianto delle lenti può anche essere impostata rispetto al ventricolo laterale. In questo protocollo, abbiamo ragionato che è più fondamentale indirizzare con precisione il sito di esprimezione virale per prestazioni di successo dell'imaging. Pertanto, abbiamo usato una coordinata di iniezione virale come riferimento per impostare la coordinata target dell'impianto dell'obiettivo. Attraverso prove ripetute, abbiamo stabilito una condizione ottimale che ha permesso all'obiettivo GRIN di indirizzare in modo efficiente il sito di espressione virale evitando artefatti di movimento causati dal movimento laterale del ventricolo. Alla fine, il metodo in grado di correggere in modo efficiente e accurato qualsiasi artefatto di movimento sarebbe di grande aiuto per accedere all'imaging ottico in regioni cerebrali più profonde in futuro.
Sebbene l'imaging ottico in vivo di calcio con microscopio miniaturico a testa sia uno strumento potente ed è stato ottimizzato, c'è ancora spazio per miglioramenti in molti aspetti. Questo protocollo faciliterà gli studi che mirano a indagare l'attività neurale in tempo reale nell'amigdala degli animali che si comportano liberamente.
Divulgazioni
L'autore non ha nulla da rivelare
Riconoscimenti
Questo lavoro è stato supportato da sovvenzioni della Samsung Science and Technology Foundation (Project Number SSTF-BA1801-10).
Materiali
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
Riferimenti
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637(2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128(2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon