Method Article
Imágenes de calcio in vivo exitosas con un microscopio miniaturizado head-mount en la amígdala del ratón que se comporta libremente
En este artículo
Resumen
La imagen de calcio microendoscópica in vivo es una herramienta invaluable que permite el monitoreo en tiempo real de las actividades neuronales en animales que se comportan libremente. Sin embargo, aplicar esta técnica a la amígdala ha sido difícil. Este protocolo tiene como objetivo proporcionar una guía útil para atacar con éxito las células de amígdala con un microscopio miniaturizado en ratones.
Resumen
El monitoreo in vivo en tiempo real de las actividades neuronales en animales en movimiento libre es uno de los enfoques clave para vincular la actividad neuronal con el comportamiento. Para ello, se ha desarrollado y aplicado con éxito a muchas estructuras cerebrales1,2,3,4,5,6una técnica de imágenes in vivo que detecta transitorios de calcio en las neuronas utilizando indicadores de calcio codificados genéticamente (GECIs), un microscopio de fluorescencia miniaturizado y una lente de índice refractivo degradado (GRIN). Esta técnica de imágenes es particularmente potente porque permite la toma de imágenes simultáneas crónicas de poblaciones celulares genéticamente definidas durante un período a largo plazo hasta varias semanas. Aunque útil, esta técnica de imagen no se ha aplicado fácilmente a las estructuras cerebrales que se encuentran en lo profundo del cerebro como la amígdala, una estructura cerebral esencial para el procesamiento emocional y la memoria del miedo asociativo7. Hay varios factores que dificultan la aplicación de la técnica de imagen a la amígdala. Por ejemplo, los artefactos de movimiento generalmente ocurren con más frecuencia durante las imágenes realizadas en las regiones cerebrales más profundas porque un microscopio de montaje en la cabeza implantado en las profundidades del cerebro es relativamente inestable. Otro problema es que el ventrículo lateral se coloca cerca de la lente GRIN implantada y su movimiento durante la respiración puede causar artefactos de movimiento altamente irregulares que no se pueden corregir fácilmente, lo que dificulta la formación de una vista de imagen estable. Además, debido a que las células de la amígdala suelen estar silenciosas en un estado de reposo o anestesiado, es difícil encontrar y enfocar las células objetivo que expresan GECI en la amígdala durante el procedimiento de placa base para obtener imágenes posteriores. Este protocolo proporciona una guía útil sobre cómo dirigirse eficientemente a las células que expresan GECI en la amígdala con microscopio miniaturizado de montaje en la cabeza para obtener imágenes de calcio in vivo exitosas en una región cerebral más profunda. Se observa que este protocolo se basa en un sistema particular (por ejemplo, Inscopix) pero no se limita a él.
Introducción
El calcio es un segundo mensajero omnipresente, jugando un papel crucial en casi todas las funciones celulares8. En las neuronas, el disparo potencial de acción y la entrada sináptica causan un cambio rápido de libre intracelular [Ca2+]9,10. Por lo tanto, el seguimiento de los transitorios de calcio proporciona una oportunidad para monitorear la actividad neuronal. Los GECIs son potentes herramientas que permiten monitorear [Ca2+] en poblaciones celulares definidas y compartimentos intracelulares11,12. Entre muchos tipos diferentes de indicadores de calcio a base de proteínas, GCaMP, una sonda Ca2+ basada en una sola molécula GFP13,es la GECI más optimizada y por lo tanto ampliamente utilizada. A través de múltiples rondas de ingeniería, se han desarrollado una serie de variantes de GCaMP12,14,15,16. Utilizamos uno de los GCaMPs recientemente desarrollados, GCaMP7b, en este protocolo16. Los sensores GCaMP han contribuido en gran medida al estudio de las funciones de circuito neural en una serie de organismos modelo como la toma de imágenes de los transitorios Ca2+ durante el desarrollo17,la imagen in vivo en una capa cortical específica18,la medición de la dinámica de circuito en el aprendizaje de tareas motoras19 y la imagen de la actividad del conjunto celular relacionada con la memoria de miedo asociativa en el hipocampo y la amígdala20,21.
La imagen óptica de los GECIs tiene varias ventajas22. La codificación genética permite que los GECIs se expresen de forma estable durante un período de tiempo a largo plazo en un subconjunto específico de células definidas por perfil genético o patrones específicos de conectividad anatómica. Las imágenes ópticas permiten un monitoreo simultáneo crónico in vivo de cientos a miles de neuronas en animales vivos. Se han desarrollado algunos sistemas ópticos de imágenes para imágenes in vivo y análisis de GECIs dentro del cerebro de ratones que se comportan libremente con microscopios de fluorescencia miniaturizados de montaje en la cabeza21,23,24,25. A pesar de que la técnica de imagen óptica in vivo basada en GECIs, la lente GRIN y un microscopio en miniatura de montaje en la cabeza son una poderosa herramienta para estudiar el vínculo entre la actividad y el comportamiento de los circuitos neuronales, aplicar esta tecnología a la amígdala ha sido difícil debido a varios problemas técnicos relacionados con la orientación de la lente GRIN a las células que expresan GECIs en la amígdala sin causar artefactos de movimiento que reducen severamente la calidad de la adquisición de imágenes y la búsqueda de células que expresan GECIs. Este protocolo tiene como objetivo proporcionar una guía útil para los procedimientos quirúrgicos de fijación de placa base e implantación de lentes GRIN que son pasos críticos para obtener imágenes ópticas de calcio in vivo exitosas en la amígdala. Aunque este protocolo se dirige a la amígdala, la mayoría de los procedimientos descritos aquí son comúnmente aplicables a otras regiones cerebrales más profundas. Aunque este protocolo se basa en un sistema en particular (por ejemplo, Inscopix), el mismo propósito puede lograrse fácilmente con otros sistemas alternativos.
Protocolo
Todos los procedimientos fueron aprobados por el Comité de Ética Animal del Instituto Avanzado de Ciencia y Tecnología de Corea. Todos los experimentos se realizaron de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales.
NOTA: Este protocolo consta de seis pasos principales: cirugía de inyección de virus, cirugía de implante de lente GRIN, validación de implantación de lente GRIN, accesorio de placa base, grabación óptica de señal GCaMP durante una prueba de comportamiento y procesamiento de datos(Figura 1A). A excepción de la cirugía, se utiliza el paquete de software comercial (Inscopix).
1. Cirugía estereotáxica – Inyección del virus AAV
NOTA: La tensión del ratón utilizada en este procedimiento quirúrgico es C57BL6/J. El cuerpo del animal está cubierto con una cortina estéril durante la cirugía y todos los pasos en el protocolo se realizan con guantes estériles. Por lo general, varias cirugías no se realizan en el mismo día. Sin embargo, si varios ratones tienen que someterse a la misma cirugía en el mismo día, utilice un conjunto separado de herramientas quirúrgicas autoclavadas para cada ratón y un 70% de etanol para desinfectar los instrumentos quirúrgicos entre ratones. Para mantener el ratón caliente durante el procedimiento quirúrgico, el ratón está cubierto con una manta quirúrgica hecha a medida después de fijarse al marco estereotáxico.
- Desinfectar todas las herramientas quirúrgicas necesarias con un 70% de etanol, y preparar una jeringa Hamilton y una pipeta de vidrio. Llene la pipeta de vidrio con agua destilada.
NOTA: Todas las herramientas quirúrgicas utilizadas en el protocolo están autoclavadas. Debido a que la lente GRIN y los tornillos del cráneo no se pueden autoclavar para la esterilización, el 70 % de etanol se utiliza como desinfectante para prevenir la inflamación. Aunque no se ha probado, se pueden utilizar otras formas de esterilización, por ejemplo, gas o esterilización química. - Anestesiar el ratón con pentobarbital (83 mg∙kg-1 de peso corporal) por inyección intraperitoneal. Después de que el ratón queda inconsciente, afeita el pelaje en el cráneo.
- Limpie la piel por encima del cráneo con un 70% de etanol y fije el ratón al marco estereotáxico. Retire cuidadosamente la piel y limpie la superficie del cráneo con una solución de peróxido de hidrógeno al 35% utilizando un aplicador de punta de algodón. Aplique ungüento ocular lubricante para prevenir el secado corneal durante la cirugía.
NOTA: Aunque por lo general no hay ningún problema con el uso de 70% etanol sólo para la preparación aséptica de la piel, se recomienda utilizar 3 rondas alternas de desinfectante, por ejemplo, iodoforos o solución de clorhexidina, y 70% etanol. Mayor concentración de peróxido de hidrógeno se utiliza en este protocolo para asegurarse de que el tejido conectivo en el cráneo del ratón se elimina lo más completamente posible, lo que es crítico para reducir el artefacto de movimiento durante las imágenes posteriores porque el tejido conectivo en el cráneo interfiere con un firme apego de la placa base al cráneo. Cabe señalar que 35% peróxido de hidrógeno es mucho más alto que lo que se utiliza normalmente (3 %). - Fije el pasador con un soporte de sonda estereotáxica. Alinee la altura del bregma y lambda con el pasador.
- Encuentre la ubicación específica en el cráneo del ratón para la craneotomía.
NOTA: Las coordenadas de la amígdala lateral (LA) para la inyección de virus son (AP, ML, DV) = (-1,6 mm, -3,5 mm, -4,3 mm) de bregma en este protocolo (AP; Anterior-Posterior, ML; Medial-Lateral, DV; Dorsal-Ventral, cada abreviatura indica una distancia axial relativa del bregma)26. Las coordenadas deben optimizarse para cada condición experimental. - Perfore la superficie del cráneo (Figura 1B). Lave las fracciones del cráneo con solución salina tamponada de fosfato (PBS). Retire la capa restante usando fórceps o una aguja de 27 G.
- Al perforar el cráneo, trate de no tocar la última capa dura para evitar daños en la superficie del tejido cerebral. Una superficie cerebral dañada causa inflamación alrededor de la lente, lo que induce artefactos de movimiento severo y alta autofluorescencia durante la grabación. El tamaño de la craneotomía es de 1,6 mm. La velocidad de perforación es de 18.000 rpm y el tamaño del bit es de 0,6 mm.
- Para bajar la lente GRIN de la superficie del tejido cerebral del sitio perforado al sitio de amígdala objetivo, calcule la distancia denominada como "Valor A" restando la diferencia dv entre el bregma y la superficie cerebral expuesta de la coordenada DV de la implantación de la lente, que se establece en función del bregma (4,2 mm en este caso, Figura 1C).
- Cargue 3 μL de aceite mineral y 0,7 μL de la solución del virus AAV en la pipeta de vidrio.
NOTA: El aceite mineral ayuda a separar la solución antivirus y el agua. 0.7 μL es un volumen optimizado para la inyección del virus de Los Ángeles que puede cubrir completamente los LA. - Retire el pasador del soporte de sonda estereotáxica y fije la pipeta de vidrio en él.
- Localice la pipeta de vidrio en el lugar de inyección mencionado en el paso 1.5. Inserte la pipeta de vidrio en el tejido cerebral después de que el sangrado se detenga por completo.
- Entregue el virus a través de una pipeta de vidrio utilizando una bomba de inyección.
NOTA: El valor del virus debe superior a 1 x 1013 vg/mL para obtener un número suficiente de células de expresión GCaMP. La velocidad de inyección es de 0,1 μL/min y difusa durante 10 min. Si hay sangrado, lave la superficie cerebral con PBS. Mantenga la superficie cerebral húmeda en este paso. - Después de terminar la inyección, retire la pipeta de vidrio lentamente.
2. Cirugía estereotáxica – Implantación de lente GRIN
NOTA: La cirugía del implante de lente GRIN es el paso más crítico en este protocolo. Dado que una velocidad lenta constante del movimiento de la lente GRIN es fundamental para la implantación exitosa de la lente GRIN, un brazo de cirugía motorizado puede ser útil. El brazo de cirugía motorizada es un manipulador estereotáxico que es controlado por software informático. Aunque el brazo motorizado se utiliza en este protocolo, también se pueden utilizar otras formas siempre y cuando la lente se mueva consistente y lentamente durante la implantación. La información detallada sobre el dispositivo se encuentra en la Tabla de materiales.
- Perfore el cráneo para implantar dos tornillos de cráneo. Lave todas las fracciones del cráneo con PBS.
NOTA: Para reducir los artefactos de movimiento en imágenes ópticas posteriores, se requieren al menos dos tornillos. Los dos tornillos de cráneo y la posición del implante de lente GRIN forman un triángulo equilátero(Figura 1B). El tamaño de la craneotomía debe ajustarse firmemente con el diámetro del tornillo. Si hay sangrado, lave la superficie sangrante con PBS. La velocidad de perforación es de 18.000 rpm y el tamaño del bit es de 0,6 mm. - Desinfectar los tornillos con un 70% de etanol para prevenir la inflamación. Implante los tornillos lo más profundo posible.
NOTA: Los tornillos deben fijarse firmemente sin adhesión adicional, como el cemento. - Instale un brazo de cirugía motorizado en el marco estereotáxico. Conecte el hardware necesario al ordenador portátil en el que está instalado el software de control (Tabla de materiales).
- Antes de bajar la lente GRIN, prepárese para hacer una pista de aguja con una aguja de 26 G.
NOTA: La pista de la aguja es una especie de pista guía que ayuda a implantar la lente GRIN relativamente gruesa en regiones cerebrales profundas como la amígdala sin causar una distorsión grave de la estructura cerebral a lo largo de la trayectoria de inyección. Esta pista guía se llama una pista de aguja porque está hecha por un procedimiento de bajado y elevación de aguja relativamente delgada de 26 G. - Coloque el soporte de la cánula para sujetar firmemente la aguja en el marco estereotáxico.
- Sujete la aguja de 26 G con el soporte de cánula y calcule las coordenadas del sitio de inserción de la aguja.
NOTA: En este protocolo, las coordenadas del sitio de inserción de agujas son 50 μm laterales del sitio de inyección del virus (AP, ML, DV) = (-1,6 mm, -3,55 mm, -3,7 mm). - Acceda al software de control y preparación completa para manipular la posición de la aguja.
- Ejecute el software de control y seleccione el botón Iniciar nuevo proyecto para iniciar la sesión de control.
NOTA: En la sesión de control, hay varios cuadros en blanco y botones de menú. Los cuadros en blanco son espacio de entrada para coordenadas. Después de introducir coordenadas en los cuadros en blanco, el brazo estereotáxico motorizado se mueve haciendo clic en el botón Ir a. El botón Ir a cambia a un botón STOP cuando el brazo estereotáxico se mueve. Entre varios botones de menú, solo se requiere el botón Herramienta en este protocolo. - Haga clic en el botón Herramienta. Calibrar el software de control haciendo clic en calibrar el botón de menú marco. La calibración es el proceso mediante el cual la posición real del manipulador se establece como valores en el software Stereodrive.
- Ejecute el software de control y seleccione el botón Iniciar nuevo proyecto para iniciar la sesión de control.
- Localice la punta de la aguja en la superficie cerebral expuesta en la superficie del cráneo utilizando manipulador estereotáxico.
NOTA: La velocidad de la aguja se establece utilizando el menú de velocidad de Microdrive en el menú Herramienta. La velocidad predeterminada es de 3,0 mm/s. Sin embargo, se recomienda una velocidad de 0,5 mm/s en este paso. El movimiento de la aguja está controlado por las teclas de flecha. - Añadir 2-3 gotas de PBS para mantener la superficie del cerebro húmeda. Rellene el cuadro en blanco de la pantalla del ordenador con las coordenadas DV adecuadas de Los Ángeles. Si la superficie cerebral está seca, dificulta la penetración de la aguja en el tejido cerebral.
- Baje la aguja de 26 G haciendo clic en el botón Ir a. Se detiene automáticamente cuando la aguja llega al sitio objetivo establecido por coordenadas DV. La velocidad de la aguja es de 100 μm/min. Si hay sangrado, detenga la aguja haciendo clic en el botón STOP y lave la superficie del cerebro con PBS. Mantenga la superficie cerebral húmeda en este paso. Después de que se detenga el sangrado, comience a bajar de nuevo.
- Después de que la aguja deje de moverse por completo, introduzca 45,00 mm en la caja en blanco de la pantalla del ordenador.
NOTA: 45.00 mm es un valor de coordenada DV que hace que la aguja vuelva a la posición inicial. - Eleve la aguja haciendo clic en el botón Ir a. La velocidad del movimiento de la aguja es de 100-200 μm/min.
- Después de que la aguja deje de moverse, retire el PBS en la superficie cerebral. Desinstale la aguja y el soporte de cánula del marco estereotáxico. El experimentador puede detener manualmente la aguja haciendo clic en el botón STOP cuando sea necesario.
- Equipe la varilla estereotáxica con el soporte de la lente. Instale la lente GRIN en el soporte de la lente.
NOTA: La lente GRIN optimizada para dirigirse a la LA (0,6 mm de diámetro, 7,3 mm de longitud) se utiliza en este protocolo. Si el soporte de la lente no está preparado, una forma alternativa es utilizar un clip bulldog para agarrar la lente GRIN. - Desinfecte la lente con un 70% de etanol y conecte la varilla estereotáxica a los marcos estereotáxicos.
- Localice la punta de la lente GRIN en el sitio designado en la superficie del cráneo (mismo método descrito en el paso 2.8).
NOTA: La coordenada de la lente GRIN es (AP, ML, DV) = (-1,6 mm, -3,55 mm, -4,2 mm) (Figura 1C). La lente no debe tocar el cráneo para evitar daños en su punta. - Calcule la coordenada DV restando el valor absoluto de "Valor A" de la coordenada DV de la implantación de la lente descrita en el paso 2.16.
- Suelta 2-3 gotas de PBS en la superficie del cerebro. Introduzca 1000 μm para bajar y 300 μm para elevar la lente en el cuadro en blanco de la pantalla del ordenador.
- Repita la reducción (1000 μm hacia abajo) y el aumento (300 μm hacia arriba) de la lente GRIN hasta que llegue al sitio objetivo. Este procedimiento de arriba a abajo se utiliza para ayudar a liberar la presión generada dentro del tejido cerebral debido al procedimiento de reducción de la lente que de otro modo puede causar distorsión de las estructuras cerebrales a lo largo de la trayectoria de implantación.
NOTA: La velocidad del movimiento de la lente GRIN es de 100 μm/min. Incluso si hay sangrado, no deje de mover la lente GRIN y lave la superficie del cerebro con PBS. Mantenga la superficie cerebral húmeda en este paso. Si la superficie cerebral está seca, el tejido cerebral se adhiere a la superficie de la lente GRIN y causa distorsión de la estructura cerebral. - Si la lente GRIN llega al sitio objetivo, retire PBS y aplique cuidadosamente el cemento dental de resina alrededor de la lente GRIN, los tornillos y su pared lateral(Figura 1D).
NOTA: Aplicar el cemento de resina por todo el cráneo puede reducir los artefactos de movimiento. Por el contrario, si el cemento de resina cubre accidentalmente los músculos unidos al cráneo, aumenta los artefactos de movimiento. - Después de que el cemento dental de resina se endurezca, desmonte la lente GRIN del soporte de la lente y aplique cemento acrílico por todo el cráneo(Figura 1D).
- Para fijar la placa de la cabeza, desmonte el soporte de la lente de la varilla estereotáxica y coloque la placa de la cabeza en la punta de la varilla mediante cintas. Confirme si la placa frontal es horizontal.
NOTA: Una placa inclinada de la cabeza causa una vista inclinada. Se requiere una placa para fijar el cabezal del ratón en el sistema de jaulas de la casa móvil (en la sección de fijación de la placa base). Si el experimentador no utiliza el sistema, omita este paso (paso 2.22) y el paso 2.23 siguiente. - Baje lentamente la varilla hasta que la placa de la cabeza se localice en la parte superior del manguito de la lente. Baje la placa de la cabeza 1000 μm más. Mueva la placa de la cabeza para la lente GRIN implantada para localizarla en el borde derecho del anillo interno de la placa frontal.
NOTA: La placa de la cabeza debe colocarse más baja que la superficie de la lente GRIN implantada; de lo contrario, el microendoscopio no puede acercarse lo suficientemente cerca de la lente GRIN implantada para ajustar el plano focal debido al cemento acril. - Aplique cemento acrílico para fijar la placa de la cabeza a las capas de cemento (Figura 1D).
- Coloque la película de parafina en la superficie de lente GRIN implantada para proteger la superficie de la lente del polvo. A continuación, aplique un enlace epoxi extraíble en la película de parafina para mantener la película de parafina permanece en la superficie de la lente.
- Inyectar carprofeno, una solución analgésico (0,5 mg/ml en PBS), y Dexametasona, un fármaco antiinflamatorio (0,02 mg/ml en PBS), en la cavidad peritoneal del ratón.
NOTA: La dosis de la droga depende del peso corporal: Carprofeno (5 mg∙kg-1 de peso corporal) y Dexametasona (0,2 mg∙kg-1 de peso corporal). Tanto el carprofeno como la dexametasona se administran después de la cirugía y una vez al día durante 7 días después de la cirugía. - Mezclar 0,3 mg/ml de amoxicilina, un antibiótico, en agua de jaula casera para administrar el medicamento durante 1 semana.
- Devolver el ratón a la jaula de casa y permitir 5-8 semanas para la recuperación y la transducción del virus.
NOTA: El ratón se recupera en una jaula pre-calentada en una manta eléctrica hasta que el ratón se despierta del anestésico.
3. Validación de la implantación de la lente GRIN
NOTA: La validación de la implantación de la lente GRIN proporciona información sobre si la lente GRIN implantada está en el objetivo de las células que expresan GCaMP. Basándose en esta información, el experimentador ahorra tiempo de procesos que consumen mucho tiempo, como la prueba de comportamiento y el procesamiento de datos, excluyendo animales con implantación de lentes GRIN fuera de objetivo. Durante el procedimiento de validación, las celdas con expresión GCaMP deben centrarse en el campo de grabación de la vista. En este paso se utiliza una jaula para casas móviles. Una jaula para el hogar móvil es un aparato especializado en forma redonda que permite a los ratones fijados en la cabeza mover libremente sus piernas durante la validación de la implantación de la lente GRIN y el accesorio de placa base. Una mesa de elevación de aire en este aparato en el que se colocan las patas de los ratones fijos de la cabeza permite tal libre movimiento de las piernas, aunque la cabeza está fija. Las células en el núcleo lateral de la amígdala suelen estar silenciosas en estado de reposo o anestesia, por lo que las señales de fluorescencia GCaMP rara vez se detectan en estas condiciones, lo que hace muy difícil, a veces imposible, encontrar células que expresen GCaMP durante la validación de la implantación de la lente GRIN y el accesorio de la placa base. Sin embargo, el movimiento de las piernas a menudo produce señales de fluorescencia GCaMP en las células del núcleo lateral de la amígdala y por lo tanto puede ayudar a localizar el microscopio. Por lo tanto, la jaula de la casa móvil se utiliza en este protocolo.
- Monte el manipulador estereotáxico en el sistema de jaulas para el hogar móvil.
- Anestesia el ratón con un 1,5% de gas isoflurano. Después de que el ratón esté completamente inconsciente, coloque el ratón en la barra de la cabeza del sistema de jaulas de la casa móvil.
- Localice la jaula de carbono debajo del ratón. Cierre la jaula de carbono y encienda el flujo de aire para hacer que la jaula se mueva libremente sin fricción. Espere unos minutos hasta que el ratón se active.
NOTA: La velocidad del flujo de aire debe optimizarse para cada condición experimental (aquí, 100 L/min). - Retire la película de parafina y la unión epoxi en la superficie de la lente GRIN implantada y limpie la superficie de la lente con un 70% de etanol usando papel de lente.
- Prepare el software de adquisición de datos (DAQ) (por ejemplo, Inscopix). Establezca las condiciones de diagnóstico por imágenes.
NOTA: El software DAQ se utiliza para controlar el microscopio (potencia LED, enfoque de la lente,etc.)y el almacenamiento de datos.- Encienda la caja DAQ y conecte un microscopio a ella. A continuación, conéctelo a un ordenador portátil, ya sea directamente utilizando un cable o a través de Internet inalámbrico.
NOTA: El software DAQ está instalado en el hardware adicional llamado daq box (por ejemplo, Inscopix). Al conectar el cuadro DAQ al ordenador portátil, el software DAQ se vuelve accesible en un ordenador portátil. - Acceda al software DAQ a través de un navegador de Internet (se recomienda Firefox).
- Establezca todos los detalles necesarios (Fecha, ID del ratón,etc.)en la sesión definida. A continuación, haga clic en Guardar y continuar. Después de guardar, acceda a la sesión Ejecutar.
- En la sesión de ejecución,establezca las condiciones de imagen, como el tiempo de exposición, la ganancia, el enfoque electrónico y la potencia de exposición-LED.
NOTA: La ganancia y la potencia del LED de exposición son modificables dependiendo de las condiciones de laboratorio. El valor recomendado para el enfoque eléctrico es de 500 y el tiempo de exposición es de 50 ms. No hay ninguna restricción para cambiar la potencia y la ganancia del LED. Sin embargo, una mayor intensidad de la luz puede causar más blanqueamiento. El tiempo de exposición de la grabación determina una velocidad de fotogramas de grabación de vídeo. Las velocidades de fotogramas más altas reducirán la intensidad de la señal. Las velocidades de fotogramas deben optimizarse para los GECIs utilizados para la toma de imágenes.
- Encienda la caja DAQ y conecte un microscopio a ella. A continuación, conéctelo a un ordenador portátil, ya sea directamente utilizando un cable o a través de Internet inalámbrico.
- Para sostener el microscopio en un manipulador estereotáxico, conecte la varilla estereotáxica con la pinza del microscopio al manipulador estereotáxico.
NOTA: La pinza es un pequeño accesorio que se puede unir al aparato estereotáxico para sostener un cuerpo de microscopio para colocarlo en la ubicación del cerebro objetivo. - Sujete el microscopio con la pinza del microscopio. Encienda la luz LED conectada al microscopio y alinee el microscopio verticalmente. Baje el microscopio mientras observa la imagen hasta que aparezca la superficie de la lente GRIN implantada.
- Alinee el centro de la lente GRIN implantada con el centro de la vista.
NOTA: La validación de la implantación de la lente GRIN se puede llevar a cabo en este paso (mencionado en la sección de resultados, Figura 2B, Figura 2D, Figura 2F). - Capturar imagen de la superficie de la lente GRIN implantada (haga clic en el botón Prt Sc en el teclado). La imagen de la superficie implantada de la lente GRIN es necesaria para anular la selección de componentes no neuronales durante el procesamiento posterior de datos (paso 6.8).
- Encuentre la posición adecuada del microscopio. Eleva lentamente la lente objetivo del microscopio mientras observas la imagen para buscar células con expresión GCaMP7b.
NOTA: Puede ser necesario ajustar la ganancia de la adquisición de la imagen o la potencia de exposición-LED. La validación de la implantación de la lente GRIN se puede llevar a cabo en este paso (mencionado en la sección de resultados, Figura 2A, Figura 2C, Figura 2E).
4. Accesorio de placa base
NOTA: El paso de fijación de la placa base sigue la validación de la implantación de la lente GRIN. La placa base es una plataforma para montar el microscopio en la cabeza de los ratones. Como se mencionó en la sección anterior, una jaula de casa móvil se utiliza en este protocolo.
- Después de validar la implantación de la lente GRIN, desmonte un microscopio en miniatura de la pinza del microscopio.
- Conecte la placa base al microscopio. Apriete el tornillo con llave hexagonal para una fijación estable de la placa base al microscopio.
- Sujete el microscopio con la pinza del microscopio. Encienda la luz LED conectada al microscopio y alinee el microscopio verticalmente. Baje el microscopio hasta que se observe la superficie de la lente GRIN implantada. Alinee el centro de la lente GRIN implantada con el centro de la vista.
- Encuentre la posición adecuada del microscopio. Elevar lentamente la lente objetivo del microscopio hasta encontrar un plano focal que dé las mejores imágenes de las células con expresión GCaMP7b (Figura 2A).
NOTA: Puede ser necesario ajustar la ganancia de adquisición de imagen o potencia de exposición-LED durante este paso. - Aplique cemento acrílico para fijar de forma estable la placa base a la placa de la cabeza (Figura 2G). Construir las paredes laterales con cemento acrílico entre la placa base y la placa de la cabeza.
NOTA: El cemento acrílico se encoge cuando se endurece. Por esta razón, no retire el microscopio hasta que el cemento se endurezca por completo (este paso toma al menos 30 min). La cementación debe hacerse con mucho cuidado para evitar la cementación no deseada del microscopio y su lente objetivo con cemento acrílico. - Después de que el cemento acrílico se endurezca por completo, afloje el tornillo y eleve el cuerpo del microscopio lentamente.
- Si hay un hueco en la pared lateral, vuelva a hacer cementación adicional para proteger la lente GRIN implantada del polvo.
- Cubra la placa base para proteger la lente GRIN implantada del polvo y apriete el tornillo de la placa base.
- Suelte la placa de la cabeza de la barra de la cabeza. Devuelva el ratón a la jaula de casa hasta futuras imágenes ópticas.
5. Grabación óptica de la señal GCaMP durante una prueba de comportamiento
NOTA: El procedimiento de grabación de señal GCaMP durante el comportamiento puede ser muy diferente dependiendo de los sistemas utilizados para la toma de imágenes ópticas, el diseño experimental y el entorno de laboratorio. Por lo tanto, se describe de una manera sencilla en esta sección.
- Realice varios días de manejo antes de la prueba de comportamiento.
- Prepare el aparato de comportamiento (por ejemplo, cámara de acondicionamiento de miedo, software de comportamiento y el instrumento Coulbourn) y computadora portátil.
- Conecte el microscopio a la caja DAQ y encienda la caja DAQ.
- Conecte la caja DAQ al ordenador portátil a través de conexión inalámbrica a Internet.
- Inicie el software DAQ (se recomienda el navegador Firefox) en el ordenador portátil. Haga clic en el botón Administrador de archivos y compruebe la capacidad de almacenamiento restante del cuadro DAQ para guardar los datos grabados.
NOTA: El tamaño de los datos es de aproximadamente 80 GB para una grabación de 30 minutos. - Introduzca la información necesaria (Fecha, ID del ratón,etc.)en la sesión definida e introduzca la sesión ejecutar.
- Sujete suavemente el ratón y retire la cubierta de la placa base en su cabeza. Colocación del microscopio en la plataforma de la placa base.
- Apriete el tornillo de la placa base y coloque al animal con un microendoscopio de montaje en la cabeza en la cámara de comportamiento.
NOTA: El ratón intenta escapar en este paso si el manejo no es suficiente. - Conecte la placa NI al puerto TRIG de la caja DAQ mediante un cable BNC. La placa NI recibe señales TTL del software de comportamiento (por ejemplo, FreezeFrame) y coordina el procedimiento de grabación simultánea de la señal GCaMP y el comportamiento del animal.
- Ajuste el plano focal.
NOTA: El plano focal está determinado por la distancia entre la lente objetiva del microscopio y la lente GRIN implantada en el cerebro. Para ajustar el plano focal, la posición objetivo de la lente se manipula mientras se observan las imágenes. La distancia entre esas dos lentes que muestra una morfología clara de las células y los vasos sanguíneos se establece como el plano focal para la toma de imágenes. En este protocolo, el software DAQ se utiliza para controlar el movimiento de la lente objetiva durante el ajuste. - Establezca el tiempo de exposición optimizado, ganancia, potencia LED en la sesión de ejecución.
NOTA: Generalmente, se utilizan 50 ms para el tiempo de exposición. La ganancia y la potencia LED se establecen en función de los histogramas de imagen. Los histogramas indican la distribución de la intensidad de fluorescencia de los píxeles. Basado en la inspección visual, el borde derecho del histograma debe tener un valor entre 40% y 60% en el caso de GCaMP7b. Cambia en función de los GECIs utilizados para la toma de imágenes. - Cambiar la opción de grabación a Grabación activada. Haga clic en Grabar e inicie el comportamiento.
NOTA: La opción de grabación activada proporciona una línea de tiempo coincidente de la sesión de grabación y la sesión de comportamiento. Si se recibe la señal TTL, se enciende una luz roja por encima del puerto TRIG. - Después de terminar la prueba de comportamiento, desasociar el microscopio y fijar la cubierta de la placa base.
- Devuelve el ratón a la jaula de casa. A continuación, seleccione Administrador de archivos y exporte datos desde el cuadro DAQ.
- Después de la prueba de comportamiento, sacrifique al ratón para la verificación histológica postmortem.
6. Procesamiento de datos
NOTA: El procedimiento de procesamiento de datos es muy diferente dependiendo del software de procesamiento de datos y de los GECIs utilizados para el experimento de imágenes. Por lo tanto, se describe de una manera sencilla en esta sección. Este protocolo utiliza software de procesamiento de datos comerciales (consulte Tabla de materiales). Alternativamente, otro software de código abierto mencionado en la sección de discusión también se puede utilizar sin ningún problema. Las variables utilizadas en este protocolo se enumeran en la Tabla 1.
- Importe el archivo de datos de vídeo de grabación (1280 píxeles x 800 píxeles) desde el cuadro DAQ al equipo de escritorio para el procesamiento de datos. Inicie el software de procesamiento de datos.
NOTA: El software de procesamiento de datos es diferente del software DAQ en pasos anteriores. En el software de procesamiento de datos, hay 6 pasos: muestreo descendente, recorte, filtro espacial, corrección de movimiento, cálculo ΔF/F, detección de eventos que son necesarios para extraer datos transitorios de calcio de una sola célula del vídeo grabado. - Reduce la superficie y recorta el vídeo.
NOTA: El muestreo descendente y el recorte son necesarios para aumentar la velocidad de procesamiento de datos. Recorte el área excepto la región de interés donde se observa la señal GCaMP. - Aplique el filtro espacial. Después de aplicar el filtro espacial, cree una imagen de proyección de intensidad media.
NOTA: El filtro espacial distingue cada píxel de la imagen de vídeo grabada y proporciona una imagen de alto contraste. Hay dos tipos de filtro de corte, filtro de corte bajo y alto. El mayor valor de los filtros de corte bajo aumenta el contraste de la imagen, pero al mismo tiempo el ruido gris general también aumenta. El menor valor del filtro de corte alto hace que la imagen se desenfoque. - Aplique la corrección de movimiento. Utilice la imagen de proyección de intensidad media como imagen de referencia para la corrección de movimiento.
- Aplique la corrección de movimiento de nuevo utilizando la imagen del primer fotograma como imagen de referencia.
NOTA: Dos pasos de corrección de movimiento disminuyen significativamente el artefacto de movimiento. - Aplique el cálculo ΔF/F para visualizar píxeles que muestren un cambio en el brillo.
NOTA: El cambio de brillo de los píxeles es causado por el cambio de intensidad de fluorescencia de GCaMP, e indica transitorios de calcio. - Aplique el algoritmo PCA/ICA para visualizar la curva transitoria de calcio de cada célula.
NOTA: PCA/ICA es un algoritmo para ordenar un grupo de datos en un conjunto de datos de un solo componente. Las variables deben optimizarse para cada condición de laboratorio. En este protocolo, todas las variables son predeterminadas excepto el peso temporal ICA (0,4 se utiliza en este protocolo)27. - Anule la selección manual de componentes no neuronales entre los componentes identificados en función de los criterios descritos en la siguiente nota.
NOTA: Para ello se utilizan dos criterios principales. En primer lugar, la señal GCaMP originada a partir de una neurona parece una forma esférica clara. Por lo tanto, sólo la señal con una forma esférica clara se selecciona como una neurona. En segundo lugar, dado el diámetro del cuerpo celular de la célula piramidal de amígdala se sabe que es aproximadamente 20 μm28,29,30, sólo la señal aproximadamente coincide con este tamaño se selecciona como una neurona. Para determinar el tamaño de la señal GCaMP, el tamaño real de un solo píxel se calcula en función de la imagen capturada de la superficie de la lente (paso 3.9) y se calcula el ancho máximo de una sola forma esférica. Por ejemplo, en este protocolo, el diámetro de la lente GRIN implantada es de 600 μm. Por lo tanto, si el diámetro de la lente es de 800 píxeles, el tamaño real del píxel único es de 1,5 μm (20 μm es de aproximadamente 7 píxeles). - Aplique la función de detección de eventos para detectar un aumento significativo del calcio transitorio (evento de calcio).
NOTA: En este paso, se requiere la variable denominada tiempo de decaimiento más pequeño (τ). En este protocolo, 1.18s se utiliza como una variable optimizada para GCaMP7b. El tiempo medio promedio de decaimiento (t1/2=0,82s) se calcula sobre la base de la curva ΔF/F durante la actividad espontánea de las células. Puesto que GCaMP sigue la decadencia exponencial, τ = .
.
Resultados
Validación de la implantación de lentes GRIN
Antes de conectar crónicamente la placa base al cerebro mediante la cementación, la implantación de la lente GRIN debe ser validada. En animales con implantación exitosa de lentes, tanto las células que expresan GCaMP como los vasos sanguíneos se observaron claramente dentro de un rango de plano focal determinado por la distancia entre la lente objetiva del microscopio y la lente GRIN implantada(Figura 2A y B). Por el contrario, en animales con implantación fuera del objetivo, no se observó una imagen clara de células que expresan GCaMP dentro del rango del plano focal (ya sea fuera de foco o fuera de la vista). En el caso de los vasos sanguíneos fuera de foco, se podían observar vasos sanguíneos bien enfocados, pero sólo imágenes borrosas para las células dentro del rango del plano focal(Figura 2C y D). En el caso de fuera de la vista, los vasos sanguíneos no se observaron en la mayoría de los casos y no se detectó ninguna señal de fluorescencia dentro del rango del plano focal (Figura 2E). Además, a diferencia de otros casos, la lente GRIN implantada mostró un borde brillante(Figura 2F). El accesorio de placa base se lleva a cabo sólo en animales validados con implantación de lente GRIN objetivo.
Grabación de señales GCaMP en la neurona de Los Ángeles en respuesta a estímulos auditivos
En este protocolo, se presentaron 4 casos de tono pseudorandomizado (2,8 kHz, 200 ms de duración, 25 pulsos) a un ratón, y las señales GCaMP se registraron ópticamente en las células de Los Ángeles de ratones con microendoscopio de montaje en la cabeza. Los ratones inyectados con AAV1-Syn-GCaMP7b-WPRE en la amígdala lateral unilateral fueron utilizados para la toma de imágenes. En animales con implantación exitosa de lentes GRIN, las células que expresan el virus y los vasos sanguíneos se observaron claramente dentro del rango del plano focal(Figura 3A). En la condición de comportamiento, aproximadamente 50-150 células generalmente mostraron un cambio significativo de fluorescencia en el campo de visión en los La Ángeles incluso sin tono como se muestra en la imagen ΔF/F, probablemente células espontáneamente activas (Figura 3B). Tras la presentación del tono, sólo unas pocas células mostraron un cambio específico del tono de la señal GCaMP según lo determinado por el análisis de imágenes ΔF/F (6 celdas en la Figura 3C y la Figura 3D). Los mismos procedimientos se llevaron a cabo en ratones inyectados con AAV2/1-CaMKIIα-GFP como control. Aunque las células de expresión GFP se detectaron dentro del rango del plano focal, ninguna celda mostró un cambio significativo de fluorescencia con o sin tono determinado por el análisis de imágenes ΔF/F(Figura 3E y Figura 3F).
Para la verificación histológica de la expresión GCaMP y la orientación de la lente GRIN, las secciones coronales del cerebro postmortem se examinan bajo el microscopio de fluorescencia(Figura 4A y Figura 4B). La tinción DAPI se utiliza para confirmar las células intactas y ningún signo de daño tisular debido a la inflamación del tejido cerebral alrededor de la lente GRIN(Figura 4C).
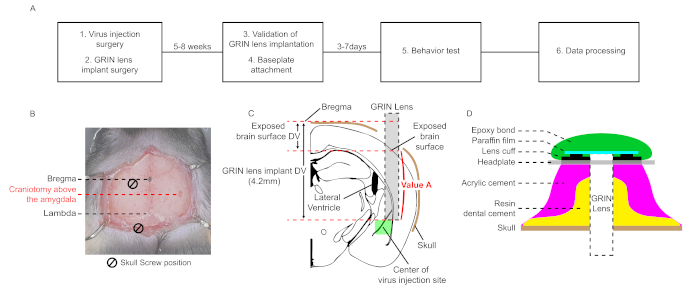
Figura 1: Flujo de trabajo esquemático y diagramas para cirugía estereotáxica para imágenes de calcio microendoscópicas in vivo en Los Ángeles. (A) Un flujo de trabajo esquemático de imágenes de calcio microendoscópicas in vivo en Los Ángeles. (B) Una imagen microscópica que muestra coordenadas bidimensionales de los sitios de craneotomía para la inyección del virus y la cirugía del implante de lente GRIN. Dos tornillos de cráneo y la lente forman un triángulo equilátero. (C) Un diagrama para la posición relativa entre el sitio de inyección de virus y la lente GRIN implantada, y una explicación esquemática para calcular el "Valor A". (D) Sección transversal de la capa de cemento desde la superficie del cráneo hasta la placa de la cabeza en los últimos pasos de la cirugía. El cemento dental de resina debe cubrir la pared de los tornillos y la lente GRIN implantada. El cemento acrílico se aplica en el cemento dental de resina. La placa frontal se fija en la capa de cemento. La película de parafina cubre la superficie implantada de la lente GRIN y la protege del polvo. La unión epoxi extraíble evita el desprendimiento de la película de parafina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Validación de la implantación de la lente GRIN y configuración de capas de cemento después del accesorio de la placa base. (A) Una imagen instantánea endoscópica representativa de animales con implantación exitosa de lentes GRIN. Tanto las células que expresan GCaMP como los vasos sanguíneos se observan claramente. (B) Imagen instantánea de la superficie de lente GRIN implantada de animales con implantación exitosa de lente GRIN. (C) Una imagen instantánea endoscópica representativa de animales con implantación de lente GRIN fuera de enfoque. (D) Imagen instantánea de la superficie implantada de la lente GRIN de animales con implantación de lente GRIN fuera de foco. En el caso de fuera de enfoque, los vasos sanguíneos a veces se observan claramente, pero sólo imágenes borrosas para las células dentro del rango del plano focal. (E) Una imagen instantánea endoscópica representativa de animales con implantación de lente GRIN fuera de la vista. En el caso de fuera de la vista, los vasos sanguíneos no se observan en la mayoría de los casos y no se detecta ninguna señal de fluorescencia dentro del rango del plano focal. (F) Una imagen instantánea de la superficie de lente GRIN implantada de animales con implantación de lente GRIN fuera de la vista. A diferencia de otros casos, el borde brillante se observa en este caso. (G) La configuración de capas de cemento para fijación de placa base. La placa base y la placa frontal están unidas por cemento acrílico. Debe haber un espacio sin llenar con cemento acrílico entre la placa base y la lente GRIN. Haga clic aquí para ver una versión más grande de esta figura.
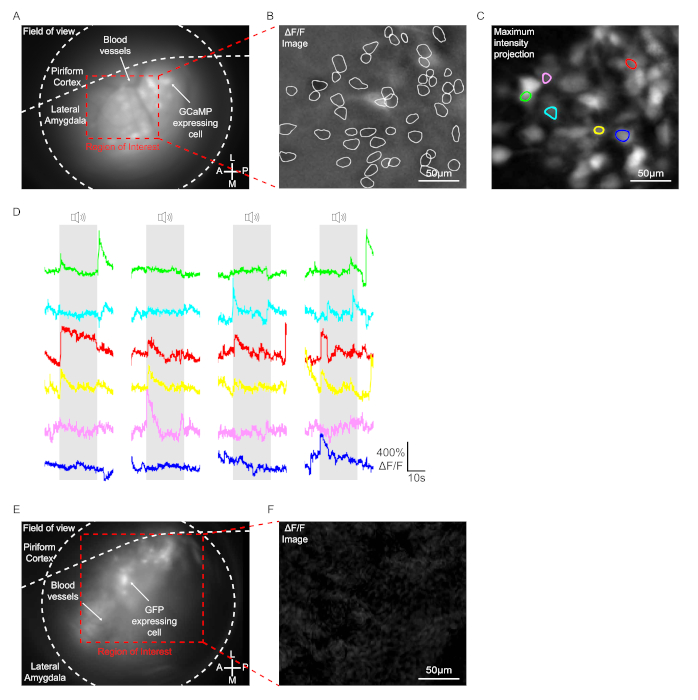
Figura 3: Grabación de señales GCaMP en las neuronas de Los Ángeles. (De la A a la C) Datos obtenidos de un ratón inyectado con AAV1-Syn-GCaMP7b-WPRE. (A) Una imagen de instantánea endoscópica representativa durante una prueba de comportamiento. GCaMP7b expresando células y vasos sanguíneos se observaron claramente dentro del rango del plano focal. (B) Una imagen de instantánea representativa que muestra la señal F/F de Δ. La línea blanca indica las células que mostraron un cambio significativo de fluorescencia en la región de interés durante la prueba de comportamiento. Barra de escala = 50 μm. (C) Imagen de proyección de intensidad máxima. Total 6 células mostraron un cambio específico del tono de la señal GCaMP. Barra de escala = 50 μm. (D) Trazas representativas de F/F Δde células sensibles al tono. Cada color corresponde a cada celda individual con el mismo color en el panel (C). (E y F) Datos obtenidos de un ratón inyectado con AAV2/1-CaMKIIα-GFP. (E) Una imagen de instantánea endoscópica representativa durante una prueba de comportamiento. Las células de expresión GFP se detectaron claramente dentro del rango del plano focal. (F) Una imagen de instantánea representativa que muestra la señal F/F de Δ. Barra de escala = 50μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Verificación histológica de la posición de la lente GRIN y la expresión GCaMP7b. (A) Una imagen de sección coronal representativa que muestra la expresión GCaMP7b en Los Ángeles. Barra de escala = imagen ampliada de 200μm. (B). Barra de escala = imagen microscópica de fluorescencia de 50 μm. (C) que muestra la señal de tinción DAPI. Barra de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Factor | Valor |
| Factor de muestreo de descenso espacial | 2 |
| Factor de muestreo descendente temporal | 2 |
| Filtro espacial: Corte alto | 0.5 |
| Filtro espacial: Corte bajo | 0.005 |
| Corrección de movimiento: Corte alto | 0.016 |
| Corrección de movimiento: Corte bajo | 0.004 |
| Corrección de movimiento: Maxtranslation | 20 |
| Marco de referencia ΔF/F | Marco medio |
| PCA/ICA: blockSize | 1000 |
| PCA/ICA: convergenciaThreshold | 1x10^-5 |
| PCA/ICA: icaTemporalWeight | 0.4 |
| PCA/ICA: numIC | 120 |
| PCA/ICA: numPC | 150 |
| PCA/ICA: unmixType | Temporal |
| Detección de eventos: Constante de decaimiento | 1.18 |
| Detección de eventos: Umbral | 4 |
Tabla 1: Lista de variables para el procesamiento de datos
Discusión
Las técnicas de cirugía hábiles son esenciales para lograr imágenes ópticas de calcio in vivo exitosas con microscopía en miniatura de montaje en la cabeza en regiones cerebrales más profundas como la amígdala como la describimos aquí. Por lo tanto, aunque este protocolo proporciona una guía para procesos quirúrgicos optimizados de fijación de placa base e implantación de lentes GRIN, es posible que sean necesarios procesos de optimización adicionales para pasos críticos. Como se menciona en la sección de protocolo, las coordenadas de amígdala en cirugía, la velocidad de flujo de aire en el paso de fijación de placa base, la configuración de adquisición de imágenes (velocidad de fotogramas, potencia LED,etc.)en la grabación de calcio y variables (peso temporal ICA, tiempo de decaimiento más pequeño del evento,etc.)en el procesamiento de datos deben optimizarse.
El paso de fijación de la placa base se puede modificar. La placa de la cabeza es necesaria porque ayuda a fijar la cabeza de los ratones despiertos durante el accesorio de la placa base realizado en la jaula móvil del hogar. Sin embargo, si la jaula móvil no está preparada en el laboratorio, el sistema de anestesia de gas isoflurano es una opción alternativa. Para esta forma alternativa, la concentración de gas isoflurano puede ser crítica. Observamos que la señal GCaMP rara vez se detecta en la amígdala de ratones con menos del 1,5% de isoflurano. Por el contrario, la señal GCaMP se detecta bajo una condición isoflurano del 0,8% y los ratones permanecen en un estado casi despierto pero sin un movimiento sustancial de la cabeza en esta condición. Esta condición de anestesia permite así realizar el accesorio de placa base sin utilizar dispositivos adicionales como la placa de la cabeza y la jaula móvil del hogar.
La fijación inestable del tornillo del cráneo, el cemento, la placa base y el microscopio puede causar artefactos de movimiento que se pueden corregir mediante el algoritmo de software de corrección de movimiento. Se cree que el movimiento del ventrículo lateral causa un tipo irregular de artefactos de movimiento que no se pueden corregir fácilmente con el software de corrección de movimiento disponible actualmente. Tales artefactos de movimiento irregular son mínimos en la mayoría de las regiones cerebrales superficiales como el hipocampo y la corteza. Sin embargo, se detecta con frecuencia durante las imágenes ópticas en la amígdala. Para superar este problema, este protocolo sugiere implantar la lente GRIN a 50 μm de distancia del lugar de inyección viral al lado lateral(Figura 1C),lo que mejora en gran medida el proceso de adquisición de imágenes al reducir los artefactos de movimiento potenciales originados a partir del ventrículo lateral. Aunque establecemos 50 μm en relación con el sitio de inyección viral, la coordenada objetivo para la implantación de lentes también se puede ajustar en relación con el ventrículo lateral. En este protocolo, razonamos que es más crítico dirigirse con precisión al sitio de expresión viral para el rendimiento exitoso de las imágenes. Por lo tanto, utilizamos una coordenada de inyección viral como referencia para establecer la coordenada objetivo de la implantación de la lente. A través de ensayos repetidos, establecimos una condición óptima que permitía a la lente GRIN dirigirse eficientemente al sitio de expresión viral evitando artefactos de movimiento causados por el movimiento del ventrículo lateral. Eventualmente, el método que puede corregir de manera eficiente y precisa cualquier artefacto de movimiento sería de gran ayuda para acceder a imágenes ópticas a regiones cerebrales más profundas en el futuro.
Aunque la imagen óptica in vivo de calcio con microscopio miniatura de montaje en la cabeza es una herramienta poderosa y ha sido optimizada, todavía hay margen de mejora en muchos aspectos. Este protocolo facilitará estudios que tienen como objetivo investigar la actividad neuronal en tiempo real en la amígdala de animales que se comportan libremente.
Divulgaciones
El autor no tiene nada que revelar
Agradecimientos
Este trabajo fue apoyado por subvenciones de Samsung Science and Technology Foundation (Número de proyecto SSTF-BA1801-10).
Materiales
| Name | Company | Catalog Number | Comments |
| 26G needle | BD | 302002 | Surgery |
| AAV1-Syn-GCaMP7b-WPRE | Addgene | 104493-AAV1 | Surgery |
| AAV2/1-CaMKiiα-GFP | custom made | Surgery | |
| Acrylic-Dental cement (Ortho-jet Acrylic Pink) | Lang | 1334-pink | Surgery & Baseplate Attachment |
| Air flow manipulator | Neurotar | NTR000253-04 | Baseplate Attachment |
| Amoxicillin | SIGMA | A8523-5G | Surgery |
| Baseplate | INSCOPIX | 1050-002192 | Baseplate Attachment |
| Baseplate cover | INSCOPIX | 1050-002193 | Baseplate Attachment |
| Behavioral apparatus (chamber) | Coulbourn Instrument | Testcage | Behavior test |
| Behavioral apparatus (software) | Coulbourn Instrument | Freeze Frame | Behavior test |
| Carbon cage | Neurotar | 180mm x 70mm | Baseplate Attachment |
| Carprofen | SIGMA | PHR1452-1G | Surgery |
| Data processing software | INSCOPIX | INSCOPIX Data Processing Software | Baseplate Attachment & Behavior test |
| Dexamethasone | SIGMA | D1756-500MG | Surgery |
| Drill | Seyang | marathon-4 | Surgery |
| Drill bur | ELA | US1/2, Shank104 | Surgery |
| Glass needle | WPI | PG10165-4 | Surgery |
| GRIN lens (INSCOPIX Proview Lens Probe) | INSCOPIX | 1050-002208 | Surgery |
| Hamilton Syringe | Hamilton | 84875 | Surgery |
| Head plate | Neurotar | Model 5 | Surgery |
| Hex-key | INSCOPIX | 1050-004195 | Baseplate Attachment |
| Laptop computer | Samsung | NT950XBV | Surgery & Baseplate Attachment |
| Lens holder, Stereotaxic rod (INSCOPIX proview implant kit) | INSCOPIX | 1050-004223 | Surgery |
| Microscope gripper | INSCOPIX | 1050-002199 | Baseplate Attachment |
| Microscope, DAQ software, hardware | INSCOPIX | nVista 3.0 | Baseplate Attachment & Behavior test |
| Mobile homecage | Neurotar | MHC V5 | Baseplate Attachment |
| Moterized arm | Neurostar | Customized | Surgery |
| Moterized arm software | Neurostar | Customized | Surgery |
| NI board | National instrument | Behavior test | |
| Removable epoxy bond | WPI | Kwik-Cast | Surgery |
| Resin cement (Super-bond) | Sun medical | Super bond C&B | Surgery |
| Skull screw | Stoelting | 51457 | Surgery |
| Stereotaxic electrode holder | ASI | EH-600 | Surgery |
| Stereotaxic frame | Stoelting | 51600 | Surgery |
| Stereotaxic manipulator | Stoelting | 51600 | Baseplate Attachment |
Referencias
- Gonzalez, W. G., Zhang, H., Harutyunyan, A., Lois, C. Persistence of neuronal representations through time and damage in the hippocampus. Science. 365 (6455), 821-825 (2019).
- Ghandour, K., et al. Orchestrated ensemble activities constitute a hippocampal memory engram. Nature Communications. 10 (1), 2637(2019).
- Grundemann, J., et al. Amygdala ensembles encode behavioral states. Science. 364 (6437), (2019).
- Krabbe, S., et al. Adaptive disinhibitory gating by VIP interneurons permits associative learning. Nature Neuroscience. 22 (11), 1834-1843 (2019).
- Betley, J. N., et al. Neurons for hunger and thirst transmit a negative-valence teaching signal. Nature. 521 (7551), 180-185 (2015).
- Jennings, J. H., et al. Visualizing hypothalamic network dynamics for appetitive and consummatory behaviors. Cell. 160 (3), 516-527 (2015).
- LeDoux, J. E. Emotion circuits in the brain. Annual Review of Neuroscience. 23, 155-184 (2000).
- Burgoyne, R. D. Neuronal calcium sensor proteins: generating diversity in neuronal Ca2+ signalling. Nature Reviews Neuroscience. 8 (3), 182-193 (2007).
- Miyakawa, H., et al. Synaptically activated increases in Ca2+ concentration in hippocampal CA1 pyramidal cells are primarily due to voltage-gated Ca2+ channels. Neuron. 9 (6), 1163-1173 (1992).
- Denk, W., Yuste, R., Svoboda, K., Tank, D. W. Imaging calcium dynamics in dendritic spines. Current Opinion in Neurobiology. 6 (3), 372-378 (1996).
- Mank, M., et al. A genetically encoded calcium indicator for chronic in vivo two-photon imaging. Nature Methods. 5 (9), 805-811 (2008).
- Akerboom, J., et al. Genetically encoded calcium indicators for multi-color neural activity imaging and combination with optogenetics. Frontiers in Molecular Neuroscience. 6, 2(2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Dana, H., et al. High-performance calcium sensors for imaging activity in neuronal populations and microcompartments. Nature Methods. 16 (7), 649-657 (2019).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Mittmann, W., et al. Two-photon calcium imaging of evoked activity from L5 somatosensory neurons in vivo. Nature Neuroscience. 14 (8), 1089-1093 (2011).
- Huber, D., et al. Multiple dynamic representations in the motor cortex during sensorimotor learning. Nature. 484 (7395), 473-478 (2012).
- Grewe, B. F., et al. Neural ensemble dynamics underlying a long-term associative memory. Nature. 543 (7647), 670-675 (2017).
- Cai, D. J., et al. A shared neural ensemble links distinct contextual memories encoded close in time. Nature. 534 (7605), 115-118 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Zhang, L., et al. Miniscope GRIN Lens System for Calcium Imaging of Neuronal Activity from Deep Brain Structures in Behaving Animals. Current Protocols in Neuroscience. 86 (1), 56(2019).
- Jacob, A. D., et al. A Compact Head-Mounted Endoscope for In vivo Calcium Imaging in Freely Behaving Mice. Current Protocols in Neuroscience. 84 (1), 51(2018).
- Ghosh, K. K., et al. Miniaturized integration of a fluorescence microscope. Nature Methods. 8 (10), 871-878 (2011).
- Xiong, B., et al. Precise Cerebral Vascular Atlas in Stereotaxic Coordinates of Whole Mouse Brain. Frontiers in Neuroanatomy. 11, 128(2017).
- Mukamel, E. A., Nimmerjahn, A., Schnitzer, M. J. Automated analysis of cellular signals from large-scale calcium imaging data. Neuron. 63 (6), 747-760 (2009).
- Millhouse, O. E., DeOlmos, J. Neuronal configurations in lateral and basolateral amygdala. Neuroscience. 10 (4), 1269-1300 (1983).
- McDonald, A. J. Neuronal organization of the lateral and basolateral amygdaloid nuclei in the rat. Journal of Comparative Neurology. 222 (4), 589-606 (1984).
- McDonald, A. J. Neurons of the lateral and basolateral amygdaloid nuclei: a Golgi study in the rat. Journal of Comparative Neurology. 212 (3), 293-312 (1982).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados