Method Article
Функциональный анализ инфильтрирующих опухоль миелоидных клеток методами проточной цитометрии и адоптивного переноса
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол обеспечивает надежные методы диссоциации солидных опухолей и выделения миелоидных клеток в мышиных моделях внутрикожных или подкожных опухолей. Проточная цитометрия позволяет фенотипически охарактеризовать гетерогенные миелоидные популяции в микроокружении опухоли, а сортировка продемонстрирует их функциональность в контексте адоптивного переноса.
Аннотация
Инфильтрирующий опухоль миелоидный клеточный компартмент представляет собой гетерогенную популяцию широко иммуносупрессивных клеток, которые были использованы опухолью для поддержки ее роста. Их накопление в опухолевой и вторичной лимфоидной ткани приводит к подавлению противоопухолевых иммунных реакций и, таким образом, является мишенью для терапевтического вмешательства. Поскольку известно, что местная цитокиновая среда может диктовать функциональное программирование инфильтрирующих опухоль миелоидных клеток, были разработаны стратегии манипулирования микроокружением опухоли (ТМЭ) для выражения цитокинового ландшафта, более благоприятного для активности противоопухолевых миелоидных клеток. Для оценки индуцированных терапией изменений в инфильтрирующих опухоль миелоидных клетках в данной статье будет описана процедура диссоциации внутрикожной/подкожной опухолевой ткани у мышей с солидными опухолями в рамках подготовки к восстановлению лейкоцитов. Будут предложены стратегии проточного цитометрического анализа, позволяющие идентифицировать гетерогенные миелоидные популяции в изолированных лейкоцитах и охарактеризовать уникальные миелоидные фенотипы. Наконец, в данной статье будут описаны средства очистки жизнеспособных миелоидных клеток для функциональных анализов и определения их терапевтической ценности в контексте адоптивного переноса.
Введение
Опухолевое микроокружение (ТМЭ) состоит из быстро пролиферирующих опухолевых клеток и окружающего его гетерогенного компартмента стромальных клеток. Поскольку растущие опухоли часто плохо васкуляризированы, ТМЭ является периферическим участком, уникально характеризующимся гипоксией, недостатком питательных веществ и ацидозом1. Чтобы выжить в этом ландшафте, реакции опухоли на стресс и метаболическое перепрограммирование приводят к секреции растворимых факторов, которые способствуют ремоделированию тканей и ангиогенезу, а также к селективному набору иммунных клеток. Поскольку миелоидные клетки являются одним из наиболее распространенных типов гемопоэтических клеток в ТМЭ, растет интерес к изучению роли инфильтрирующих опухоль миелоидных клеток в ТМЭ.
Миелоидные клетки представляют собой гетерогенную и пластичную группу клеток врожденного иммунитета, включая моноциты, макрофаги, дендритные клетки и гранулоциты. Несмотря на то, что они играют важную роль в тканевом гомеостазе и регуляции адаптивного иммунного ответа, их функция может быть поляризующей в зависимости от состава сигналов активации в локальноммикроокружении. Опухоли используют свойства миелоидных клеток за счет секреции растворимых факторов в ТМЭ. Эти альтернативные сигналы могут отклонять миелопоэз в сторону незрелой дифференцировки и искажать функцию существующих миелоидных клеток, инфильтрирующих опухоль3. Действительно, миелоидные клетки в ТМЭ часто способствуют прогрессированию рака и могут подавлять противоопухолевые иммунные реакции, что приводит к неблагоприятным последствиям для терапии рака.
Несмотря на то, что было показано, что терапевтические стратегии, способствующие истощению иммуносупрессивных миелоидных клеток, задерживают рост опухоли4, отсутствие специфичности мишени ставит под угрозу удаление иммуностимулирующих миелоидных клеток, которые, в свою очередь, помогают в разрешении рака. Эти воспалительные миелоидные клетки могут оказывать глубокое противоопухолевое действие, включая прямое уничтожение опухолевых клеток и активацию цитотоксических CD8+ Т-клеток5. С другой стороны, стратегии нормализации состава и функции миелоидных клеток в ТМЭ показали терапевтический успех6; Однако биологические механизмы, лежащие в основе их перевоспитания в сторону противоопухолевого фенотипа, до сих пор до конца не изучены. В конечном счете, всесторонняя характеристика опухолевых миелоидных клеток необходима для дальнейшего совершенствования терапии рака.
К сожалению, воспроизводимая дезагрегирование опухолей для выделения миелоидных клеток является сложной задачей. Миелоидные клетки опухолевого происхождения чувствительны к манипуляциям ex vivo по сравнению с другими субпопуляциями лейкоцитов, а агрессивность процессинга опухоли может привести к расщеплению ферментативного эпитопа и снижению жизнеспособности восстановленных клеток7. Целью данного метода является обеспечение надежного средства диссоциации опухоли для сохранения целостности поверхностных маркеров для анализа и жизнеспособности клеток для функционального исследования. По сравнению с протоколами выделения инфильтрирующих опухоль лейкоцитов (TIL), которые отдают предпочтение более жестким ферментативным смесям для усиления воспроизводимого высвобождения различных клеточных субпопуляций, этот метод отдает предпочтение более консервативному ферментативному расщеплению для максимального восстановления миелоидных клеток. Также предусмотрены высокоуровневые стратегии многоцветного гейтирования для идентификации субпопуляций миелоидных клеток опухолевых опухолей мышей для дальнейшей характеристики и/или сортировки.
протокол
ПРИМЕЧАНИЕ: Все исследования на животных соответствовали рекомендациям Канадского совета по уходу за животными и были одобрены Советом по этике исследований животных Университета Макмастера.
1. Забор и диссоциация опухоли
- Инокулируйте мышей C57BL/6 в возрасте 6-8 недель внутрикожно/подкожно 2 × 105 клеток меланомы B16, как описано Nguyen et al.8 Дайте опухолям расти в течение 7 дней до забора.
- Усыпьте мышь при вывихе шейки матки, следя за тем, чтобы при этом не нарушить опухоль. Перед сбором урожая опрыскайте мышь 70% этанолом.
- С помощью скальпеля и ножниц хирургическим путем удалите внутрикожную/подкожную опухоль из окружающих тканей (включая прикрепленные лимфоузлы, дренирующие опухоль) и поместите опухоли в предварительно взвешенную микропробирку. Держите на льду.
ПРИМЕЧАНИЕ: Проводите забор опухолей в шкафу биобезопасности для животных. Используйте коническую трубку объемом 15 мл для больших опухолей. - Взвесьте опухоли и добавьте 500 мкл среды RPMI-1640 с 10% фетальной бычьей сывороткой (FBS) в каждую пробирку, разрезая опухоли ножницами внутри пробирки или в 6-луночной пластине.
ПРИМЕЧАНИЕ: Кусочки опухоли должны быть достаточно маленькими, чтобы их можно было перемешать с помощью электрической пипетки после добавления среды для пищеварения. - Смесь для диссоциации готовят путем растворения коллагеназы IV типа в 0,5 мг/мл и ДНКазы в дозе 0,2 мг/мл в среде RPMI-1640 с 10% FBS и 5 мМ хлорида кальция.
ПРИМЕЧАНИЕ: Смесь для диссоциации должна быть приготовлена свежей для максимизации активности коллагеназы. - Перенесите измельченную опухолевую суспензию в коническую пробирку объемом 15 мл и добавьте 10 мл диссоциационной смеси на 0,25 мг опухоли. Поместите трубку в орбитальный шейкер с регулируемой температурой на 30 минут при температуре 37 °C с перемешиванием 200 об/мин. Нейтрализовать активность коллагеназы путем добавления двух объемов холодной среды RPMI-1640 с 10% FBS и 2 мМ этилендиамина тетрауксусной кислоты (ЭДТА), и поставить в холодильник на 10 мин при 4 °C.
- Кратковременно переведите суспензию и пипетируйте ее пипеткой в ситечко 40 мкм на конической пробирке объемом 50 мл. С помощью поршня шприца и нейтрализующей среды удалите остаточную опухолевую ткань и промойте ее через ситечко. Центрифугируйте суспензию в течение 5 мин (500 × г, 4 °C), выбросьте надосадочную жидкость и повторно суспендируйте гранулу в фосфатно-солевом буфере (PBS) с 2% FBS и 1 мМ ЭДТА.
2. Обогащение TIL и проточное цитометрическое окрашивание (FACS)
- Для обогащения TILs для характеризации миелоидных клеток используйте набор для магнитного разделения клеток, предназначенный для биотин-положительного отбора с биотинилированными антителами CD45.2 в соответствии с инструкциями производителя (см. Таблицу материалов).
- Ресуспендируйте клетки в 200 мкл буфера FACS (PBS с 0,5% w/v бычьего сывороточного альбумина (BSA)) и перенесите их в 96-луночный U-образный планшет.
ПРИМЕЧАНИЕ: Не превышайте концентрацию окрашивания 1 × 108 клеток/мл. Отрегулируйте объем и разделите образцы на несколько лунок, чтобы компенсировать большое количество ячеек. - Центрифугируйте планшет в течение 5 минут (500 × г, 4 °C) и выбросьте надосадочную жидкость. Добавьте 50 мкл раствора Fc-блока (1:200 разведение очищенного антимышиного CD16/CD32 крысы [см. Таблицу материалов) в буфере FACS, конечная концентрация 2,5 мкг/мл) и ресуспендируйте клетки с помощью пипетирования. Выдерживать в течение 10 минут при температуре 4 °C.
- Добавьте 50 мкл буфера FACS, содержащего в 2 раза больше поверхностно-окрашивающего антитела (разведение CD45.2, NK1.1, CD11c, F4/80, CD8a, Ly6C, CD11b, CD4, Ly6G) и корректируемое окрашивание жизнеспособности (FVS, разведение 1:500), и перемешайте клетки с помощью пипетирования. Выдерживать в течение 20 минут при температуре 4 °C.
ПРИМЕЧАНИЕ: Накройте пластину алюминиевой фольгой, чтобы свести к минимуму воздействие света. Антитела следует титровать перед началом эксперимента для эмпирического определения оптимального разведения. - Промойте ячейки дважды, добавив 200 мкл буфера FACS в каждую лунку, центрифугируя суспензию (5 мин, 500 × г, 4 °C) и выбросив надосадочную жидкость.
- Добавьте 100 мкл раствора для фиксации/пермеабилизации (см. Таблицу материалов) в каждую лунку, перемешайте клетки с помощью пипетирования и инкубируйте в течение 20 мин при 4 °C.
- Добавьте 100 мкл 1x пермеабилизационного буфера (см. Таблицу материалов) в каждую лунку, центрифугируйте планшет в течение 5 мин (500 × г, 4 °C) и выбросьте надосадочную жидкость.
- Промойте ячейки, добавив 200 мкл 1x пермеабилизационного буфера в каждую лунку, центрифугируя суспензию (5 мин, 500 × г, 4 °C) и выбросив надосадочную жидкость.
Примечание: Эксперимент можно приостановить на ночь после ресуспендирования клеток в буфере для пермеабилизации. Хранить образец при температуре 4 °C в защищенном от света месте. Возобновите работу после краткого перемешивания ячеек перед центрифугированием. - Добавьте 100 мкл пермеабилизационного буфера, содержащего 1-кратную концентрацию внутриклеточного окрашивающего антитела (1:100 разведение синтазы оксида азота 2 (NOS2), аргиназы 1 (Arg1)), и перемешайте клетки с помощью пипетирования. Выдерживать в течение 20 минут при температуре 4 °C.
ПРИМЕЧАНИЕ: Накройте пластину алюминиевой фольгой, чтобы свести к минимуму воздействие света. Антитела следует титровать перед началом эксперимента для эмпирического определения оптимального разведения. - Добавьте 100 мкл 1x пермеабилизационного буфера в каждую лунку, центрифугируйте планшет в течение 5 минут (500 × г, 4 °C) и выбросьте надосадочную жидкость.
- Промойте клетки, добавив 200 мкл 1x пермеабилизационного буфера в каждую лунку, центрифугируя суспензию (5 мин, 500 × г, 4 °C) и выбросив надосадочную жидкость.
- Ресуспендируйте элементы в 300 мкл буфера FACS. Перед проведением анализа проточной цитометрии процедите образец через полистирольную пробирку с круглым дном объемом 5 мл и крышкой фильтра 40 мкм.
3. Сортировка опухолевых миелоидных клеток для функциональных исследований
- После определения желаемых популяций миелоидных клеток с помощью анализа проточной цитометрии предварительно обогащают объемные миелоидные клетки для сортировки с помощью набора для магнитного разделения клеток, предназначенного для CD11b- или CD11c-положительного отбора в соответствии с инструкциями производителя (см. Таблицу материалов).
- Используя поверхностные окрашивающие антитела, специфичные для желаемых субпопуляций миелоидных клеток (разведение CD11b, Ly6C, Ly6G в соотношении 1:100), окрашивают предварительно обогащенные клетки, как описано на этапах 2.2-2.5.
ПРИМЕЧАНИЕ: Включите фиксируемое окрашивание на жизнеспособность, чтобы обеспечить сортировку живых миелоидных клеток. Не превышайте концентрацию окрашивания 1 × 108 клеток/мл. Отрегулируйте объем и разделите образцы на несколько лунок, чтобы компенсировать большое количество ячеек. - Ресуспендируйте клетки в холодном сортировочном буфере (PBS с 1% w/v BSA, 25 мМ 4-(2-гидроксиэтил)-1-пиперазитансульфоновой кислоты (HEPES) и 1 мМ ЭДТА). Отфильтруйте образец через полипропиленовую пробирку с круглым дном объемом 5 мл и крышкой фильтра 40 мкм. Держите клетки на льду, а трубку накройте алюминиевой фольгой.
ПРИМЕЧАНИЕ: Отрегулируйте концентрацию ячеек/объема в соответствии с желаемой спецификацией прибора для сортировки. - Подготовьте пробирку для сбора проб с улавливающей средой (полипропиленовая пробирка объемом 5 мл с круглым дном, содержащая PBS с 50% FBS).
ПРИМЕЧАНИЕ: Пробирки с покрытием объемом 5 мл захватывают среду в течение ночи перед сортировкой. Выбросьте все, кроме 1-2 мл улавливающей среды, на следующий день перед проведением пробы. - Измените настройки прибора сортировщика, чтобы снизить давление образца и предотвратить возмущения при образовании капель. Установите наконечник сопла 130 μм и используйте настройку 10 фунтов на квадратный дюйм. Прогоните пробу с низкой скоростью потока с периодическим перемешиванием образца со скоростью 100 об/мин, следя за тем, чтобы осаждение капель находилось в центре пробирки. После сортировки держите образец на льду.
- Инкубируйте образец в течение 10 минут при 4 °C. Центрифугируйте пробирку в течение 5 минут (500 × г, 4 °C), выбросьте надосадочную жидкость и повторно суспендируйте гранулу в желаемой среде для функциональных анализов или адоптивного переноса.
4. Адоптивный перенос очищенных миелоидных клеток опухоли
- Внутрикожно инокулировать мышей C57BL/6 в возрасте 6-8 недель 1 ×10 6 опухолевых клеток меланомы B16, ресуспендированных в 30 мкл PBS.
ПРИМЕЧАНИЕ: Прививайте мышей заранее, чтобы рост опухоли не превышал 100мм3 к моменту адоптивного переноса. - Ресуспендирование отсортированных опухолевых миелоидных клеток в PBS с 25 мМ HEPES и 1 мМ ЭДТА в концентрации 2 × 106 клеток/мл. Отфильтруйте образец через полистирольную пробирку объемом 5 мл с круглым дном и крышкой фильтра 40 мкм. Держите на льду.
- Индуцировать и поддерживать мышей под наркозом 3% изофлурана. Наносите офтальмологическую мазь для предотвращения сухости/травмирования глаз.
- Загрузите в шприц 31 г 50 мкл клеточной суспензии. Удалите пузырьки воздуха, осторожно взмахнув шприцем. Очистите место инъекции с помощью спиртового тампона.
- С помощью стерильных щипцов приподнимают кожу у основания опухоли. Введите иглу в подкожное пространство под небольшим углом вверх, чтобы войти в опухоль снизу кожи. С помощью щипцов сожмите кожу вокруг иглы и медленно выдавите объем шприца. Продолжайте зажимать кожу щипцами, медленно извлекая иглу, и используйте ватный тампон, чтобы убрать потенциальную утечку.
ПРИМЕЧАНИЕ: При желании приступайте к любым дополнительным терапевтическим процедурам. - Дайте мышам восстановиться после анестезии.
Результаты
Результаты показывают, что этот метод дает высокий выход миелоидных клеток из солидных опухолей мышей. Сохранение целостности рецептора и жизнеспособности клеток способствует надежному функциональному анализу желаемых миелоидных субпопуляций. Эти улучшения в выделении миелоидных клеток позволили различить изменяющуюся функцию внутриопухолевых миелоидных клеток при нормализации ТМЭ с ингибитором гистондеацетилазы I класса (HDACi), MS-275, во время адоптивной Т-клеточной терапии. Протоколы выделения TIL обычно не предпринимают шагов для максимизации выхода миелоидных клеток9. В результате, ферментативное разложение, как правило, слишком жесткое и приводит к потере жизнеспособности образца. При обработке опухолей меланомы B16 лечили коллагеназой I типа I в течение 1 ч (часто используемое условие) перед положительным обогащением CD45.2+ клеток путем магнитной селекции, морфология (прямая зона рассеяния (FSC-A) в сравнении с боковой областью рассеяния (SSC-A)) и субгейтирование миелоидных клеток (CD11b против CD11c) указывали на то, что выход миелоидных клеток (CD11b+ или CD11c+) и немиелоидных клеток (CD11b-CD11c-) был чрезвычайно низким (рис. 1). Для снижения потенциально избыточной специфической активности коллагеназы продолжительность переваривания опухоли была уменьшена до 30 мин. Несмотря на небольшое улучшение в восстановлении миелоидных клеток, общий выход все еще был низким, и не было улучшения в восстановлении немиелоидных клеток.
Поскольку изменение партии может привести к появлению протеаз со специфической активностью, достаточно высокой, чтобы вызвать чрезмерную гибель клеток, отдельная партия коллагеназы типа I была запрошена у другого коммерческого поставщика для сравнения. Интересно, что общий выход миелоидных и немиелоидных клеток был намного выше, с небольшим увеличением количества миелоидных клеток при добавлении FBS. Несмотря на то, что FBS был добавлен для стабилизации миелоидных клеток к повреждению, вызванному коллагеназой, это подняло вопрос о том, нейтрализует ли FBS также триптическую активность препарата коллагеназы I типа, которая может нарушать восстановление клеток. Поскольку препараты коллагеназы I типа обладают коллагеназой, казеиназой, клострипаином и триптической активностью10, для уменьшения воздействия протеазы пытались расщеплять с использованием коллагеназы IV типа, которая обладает более высокой специфичной для коллагеназы активностью и более низкой триптической активностью. Это состояние приводило к большему увеличению выхода миелоидных клеток, а добавление FBS приводило к наибольшему выходу. Интересно, что коллагеназа I и IV типа, с FBS или без него, заметно не изменяла общий выход немиелоидных клеток.
С помощью этих оптимизированных условий ферментативного расщепления лейкоциты были выделены из опухолей меланомы B16 у мышей, а проточная цитометрия была использована для фенотипирования различных популяций миелоидных клеток в TME на основе их экспрессии поверхностных маркеров. Опухоли собирали и обрабатывали, а лейкоциты выделяли с помощью набора магнитной селекции CD45.2. Затем клетки окрашивали с помощью тщательно разработанной панели маркеров клеточной поверхности (рис. 2). Описанная здесь стратегия гейтирования начинается с морфологической оценки клеток с использованием FSC-A в сравнении с SSC-A. Это позволяет исключить клеточный мусор на основании их небольшого размера. Для выбора одиночных ячеек и исключения дублетов использовались FSC-H в сравнении с FSC-W. Затем общее количество живых лейкоцитов было скобировано на основе CD45.2 и окрашивания на жизнеспособность. Лимфоциты были исключены на основе окрашивания NK1.1, CD4 и CD8; обратите внимание, что у мышей с BALB/c можно использовать Asialo-GM1 и/или DX5 для исключения естественных киллеров (NK-клеток), поскольку NK1.1 не экспрессируется на NK-клетках, полученных из BALB/c. Затем CD11b был нанесен на график против CD11c для идентификации опухолеассоциированных дендритных клеток (TADC) / обычных дендритных клеток (cDCs).
Клетки, отрицательные на CD11c, представляют собой объемные миелоидные клетки, которые могут быть дополнительно разделены на основе окрашивания Ly6C и Ly6G. Клетки, экспрессирующие промежуточные уровни Ly6C и высокие уровни Ly6G, представляют собой нейтрофилы. Эта популяция имеет тот же фенотип, что и гранулоцитарные миелоидные супрессорные клетки (G-MDSC). CD11b+ клетки, которые имеют отрицательную окраску на Ly6G, но положительную на Ly6C, могут быть разделены на Ly6Chi, Ly6Cint и Ly6Clo. Клетки Ly6Cint/hi экспрессируют более низкие уровни F4/80 и представляют собой воспалительные моноциты. Тем не менее,Hi-клетки Ly6C также имеют тот же фенотип, что и моноцитарные миелоидные супрессорные клетки (M-MDSC). Наконец, клетки Ly6Cint экспрессируют высокие уровни F4/80 и обычно связаны с опухолеассоциированными макрофагами (TAM). Несмотря на то, что эта характеристика может не полностью идентифицировать интересующие подмножества миелоидных клеток, она обеспечивает полезную стратегию гейтирования для сортировки популяций миелоидных клеток в пределах TME для дальнейшего функционального или геномного анализа. В контексте иммунотерапии адоптивная Т-клеточная терапия, включающая эпигенетические модифицирующие препараты, такие как ингибитор гистондеацетилазы класса I (HDACi) MS-275, может воздействовать на TME, способствуя устойчивой регрессии опухоли, в то время как ее отсутствие приводит к рецидиву опухоли8.
Несмотря на то, что микроматричный анализ объемной опухолевой РНК предполагает роль инфильтрирующих опухоль миелоидных клеток, эта фенотипическая характеристика не указывает на значительные изменения поверхностных маркеров вовремя лечения MS-275. Интересно, что функциональные маркеры, присутствующие на панели окрашивания проточной цитометрии, идентифицировали определенное субпопуляцию миелоидных клеток (CD11b+ Ly6Chi Ly6G-), дифференциально продуцирующие синтазу оксида азота 2 (NOS2) и аргиназу 1 (Arg1), которые являются неявными показаниями поляризационного или дивергентного функционального программирования (рис. 3A). Сортируя CD11b+ Ly6Chi Ly6G-клетки дифференцированно обработанных мышей-носителей опухолей, можно провести более обширные функциональные исследования, чтобы понять их роль. С помощью мечения карбоксифлуоресцеином сукцинимидиловым эфиром (CFSE) для мониторинга пролиферации лимфоцитов11 было обнаружено, что отсортированные миелоидные клетки, полученные от наивных и вакцинированных мышей, подавляли пролиферацию Т-клеток in vitro, в то время как клетки, полученные от вакцинированных + мышей, получавших MS-275, имели сниженную иммуносупрессивную функцию (рис. 3B). Адоптивный перенос этих клеток показал, что они обладают противоопухолевыми способностями и способствуют устойчивой регрессии опухолей во время вакцинации и увеличению выживаемости мышей (рис. 3C).

Рисунок 1: Репрезентативные данные, показывающие эффективность различных условий диссоциации. У мышей C57BL/6 (n=3 в группе) необработанные внутрикожные опухоли B16F10-gp33 были обработаны и диссоциированы в различных ферментативных условиях перед отбором CD45.2. Выше показаны стратегии гейтирования проточной цитометрии, используемые для демонстрации различий в выходе клеток (FSC-A в сравнении с FSC-A в сравнении с проточным цитометрией. SSC-A) иллюстрирует выход инфильтрирующих опухоль лейкоцитов неявно путем различения размера и гранулярности клеток. (CD11b в сравнении с CD11c) позволяет количественно определить миелоидные (CD11b+ или CD11c+) или немиелоидные (CD11b-CD11c-) клетки. Погрешность определяется стандартной погрешностью среднего значения. Сокращения: CD = кластер дифференцировки; SSC-A = боковая зона рассеяния; FSC-A = область прямого рассеяния; FBS = фетальная бычья сыворотка. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
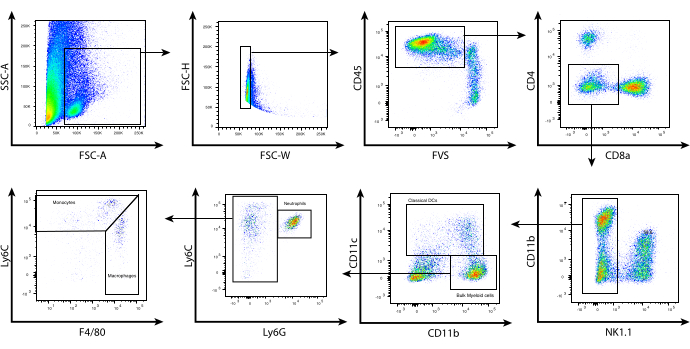
Рисунок 2: Репрезентативный анализ проточной цитометрии инфильтрирующих опухоль миелоидных клеток. После обработки опухоли и отбора CD45.2 обогащенные клетки окрашивали поверхностью, как описано в протоколе. Выше показана стратегия гейтирования, используемая для исключения лимфоцитов и идентификации отдельных подмножеств миелоидных клеток в микроокружении опухоли. Мусор (SSC-A в сравнении с FSC-A) и дублеты (FSC-H в сравнении с FSC-W), а CD45.2+ живые клетки определяли с помощью корректируемого окрашивания жизнеспособности FVS510 (CD45.2 в сравнении с FSC-W). FVS). CD4+, CD8+, NK1.1+ клетки были закрыты. CD11bhi/lo CD11c+ клетки представляют собой cDC. Затем CD11b+ CD11c- были субгированы на основе экспрессии Ly6C и Ly6G. Были идентифицированы три популяции: (i) Ly6Cint Ly6G+ (нейтрофилы/G-MDSCs), (ii) Ly6Chi Ly6G- F4/80lo/int (моноциты/M-MDSCs), (iii) Ly6Clo/int Ly6G- F4/80hi (макрофаги/TAMs). Сокращения: CD = кластер дифференцировки; SSC-A = боковая зона рассеяния; FSC-A = область прямого рассеяния; FSC-H = высота разброса вперед; FSC-W = ширина разброса вперед; FVS = фиксируемая краска для жизнеспособности; cDCs = обычные дендритные клетки; Ly = антиген лимфоцитов; G-MDSCs = гранулоцитарные миелоидные супрессорные клетки; M-MDSCs = моноцитарные миелоидные супрессорные клетки; TAMs = опухолеассоциированные макрофаги. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Функциональный анализ очищенных миелоидных клеток, инфильтрирующих опухоль. У мышей C57BL/6 (n=3-5 в группе) внутрикожные опухоли B16F10-gp33 либо не вакцинировались, либо получали адоптивную Т-клеточную терапию в присутствии или в отсутствие ингибитора HDAC, MS-275. Через пять дней после лечения опухоли были обработаны и положительно обогащены CD11b+ клетками. Клетки окрашивали поверхностью для субгейта на желаемом субпопуляции миелоидных клеток, инфильтрирующем опухоль (CD11b+ Ly6Chi Ly6G-). (A) Эти клетки дополнительно окрашивали внутриклеточно на наличие маркеров, которые могут определить полярность функциональной активации, и данные представлены в виде частоты CD11b+ Ly6Chi Ly6G-клеток, которые продуцируют NOS2 или Arg1. В качестве альтернативы, окрашенные поверхность миелоидные клетки, обогащенные CD11b+, сортировали для получения чистой популяции Ly6Chi Ly6G-клеток. (B) Эти очищенные клетки были пептидно-импульсными и кокультивировались с мечеными CFSE, наивными TCR-трансгенными Т-клетками в различных соотношениях. Разведение CFSE, определяемое с помощью проточной цитометрии, отображается в виде репрезентативной гистограммы и количественно измеряется индексом клеточного деления (1:1). (C) Отдельно очищенные CD11b+ Ly6Chi Ly6G-клетки, полученные от вакцинированных + обработанных MS-275 мышей-носителей опухолей, были адопциально перенесены в новых мышей с опухолями (n=5) в сочетании с вакцинацией и регрессией опухоли, а также отслеживались кривые выживаемости. Погрешность определяется стандартной погрешностью среднего значения. p=0,0004, * p=0,0479, **** p<0,0001. Эта цифра была изменена по Nguyen et al. 8. Сокращения: CD = кластер дифференцировки; HDAC = ингибитор гистондеацетилазы; NOS2 = синтаза оксида азота 2; Arg1 = аргиназа 1 ; CFSE = карбоксифлуоресцеин сукцинимидиловый эфир; TCR = Т-клеточный рецептор; Ly = антиген лимфоцитов; NS= не существенно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Несмотря на то, что инфильтрирующие опухоль миелоидные клетки существуют в различных состояниях активации и дифференцировки в опухоли, было выявлено несколько подгрупп, включая опухолеассоциированные ДК (TADC), опухолеассоциированные нейтрофилы (TAN), миелоидные супрессорные клетки (MDSC) и опухолеассоциированные макрофаги (TAMs)12. К сожалению, перекрывающаяся экспрессия маркеров клеточной поверхности, используемых для идентификации этих субпопуляций миелоидных клеток, в настоящее время затрудняет фенотипическую дифференциацию опухолевых миелоидных клеток от других миелоидных клеток13. Аналогичным образом, индуцированные терапией фенотипические изменения в инфильтрирующих опухоль миелоидных клетках могут быть нелегко наблюдаемы с существующими панелями окрашивания миелоидных антител. В совокупности недостаточность уникальных поверхностных маркеров усложняет понимание биологии миелоидных клеток. Чтобы выделить естественные, вызванные опухолью и находящиеся под влиянием терапии миелоидные клетки, необходимо провести оценку субпопуляций миелоидных клеток в соответствии с их функцией в дополнение к их фенотипическим характеристикам.
Описанные здесь методы забора и диссоциации опухолевой ткани позволяют выделить миелоидные клетки с сохранением жизнеспособности и целостности поверхностных маркеров. Поскольку инфильтрирующие опухоль миелоидные клетки чувствительны к манипуляциям ex vivo 7, акцент в протоколе сделан на менее агрессивную механическую и ферментативную диссоциацию. Однако, в зависимости от типа опухолевой ткани, различные образцы требуют по-разному агрессивного лечения для получения одноклеточной суспензии. Для более богатых коллагеном моделей опухолей (например, фибросаркомы CMS5) в дополнение к ножницам можно использовать поршень шприца для более полной механической дезагрегации опухолевой ткани перед ферментативным лечением. И наоборот, менее богатые коллагеном модели опухолей (например, меланома B16) не обязательно требуют ферментативного лечения. Как показано в этих результатах, тип препарата коллагеназы и партия, из которой он был получен, могут существенно влиять на разнообразие и активность протеаз, воздействию которых подвергаются клетки во время ферментативной диссоциации.
В то время как немиелоидные лейкоциты (т.е. лимфоциты), по-видимому, не так чувствительны, эти данные свидетельствуют о том, что миелоидные клетки, в частности, могут быть очень восприимчивы к чрезмерному воздействию протеазы (рис. 1), что приводит к повреждению мембранных белков и снижению жизнеспособности. В результате, рекомендуется использование коллагеназы IV типа по сравнению с коллагеназой I типа из-за ее повышенной протеолитической активности, специфичной для коллагеназы, и включения FBS в смесь для пищеварения для нейтрализации остаточной триптической активности. Кроме того, использование очищенных продуктов коллагеназы, в отличие от сырых препаратов из коммерческих источников, может повысить воспроизводимость клеточного восстановления. После того, как разложение завершено, добавление ЭДТА и инкубация при 4 °C являются обязательными для хелатирования ионов Ca2+ и снижения температуры, необходимой для активности коллагеназы14.
Для характеристики инфильтрата миелоидных клеток в гетерогенной популяции TIL были предложены стратегии высокоуровневого гейтинга (рис. 2). Панель полихроматической проточной цитометрии должна быть спроектирована таким образом, чтобы 1) были исключены мертвые и немиелоидные клетки, 2) можно было идентифицировать субпопуляции миелоидных клеток и 3) можно было неявно наблюдать измененную функциональность в группах образцов (рис. 3). В зависимости от количества подмножеств миелоидных клеток, представляющих интерес, и глубины функциональной характеристики, эти критерии могут не полностью умещаться в пределах одной окрашивающей панели. Чтобы освободить каналы для панели, маркеры могут быть стратегически объединены в один канал дампа. Хотя этот метод позволяет проводить многомерный анализ инфильтрирующих опухоль миелоидных клеток, он все еще ограничен относительно низким пределом параметров. Более современные технологии с использованием ионов репортеров тяжелых металлов, такие как массовая цитометрия, позволяют регистрировать до 40 независимых параметров в пределах одной панели, что позволит лучше изучить клеточное и функциональное разнообразие миелоидных клеток в TME15.
Тем не менее, стоимость контрольно-измерительных приборов ограничивает повсеместное их использование. Проточная цитометрия более доступна и позволяет получить надежные данные для определения характеристик, хотя смешивание и сопоставление маркеров на нескольких панелях требует валидации панели в качестве чрезвычайно важного шага перед экспериментом. После идентификации инфильтрирующих опухоль миелоидных подгрупп, представляющих интерес,несколько исследователей описывают методы сортировки этих клеток для функциональных анализов и исследований. Отсортированные клетки могут быть надежно проанализированы на предмет их способности подавлять Т-клетки in vitro , а также их противоопухолевой способности in vivo после их адоптивного переноса в мышиные модели рецидива опухоли (Рисунок 3). В целом, значимость описанных методов заключается в том, что, по сравнению с другими протоколами выделения TIL, условия забора опухоли, диссоциации, обогащения клеток и сортировки клеток были подобраны таким образом, чтобы воспроизводимо получить высокий выход миелоидного клеточного компартмента по сравнению со всеми другими лейкоцитами и без ущерба для их функции.
Раскрытие информации
Конфликт интересов не декларируется.
Благодарности
Эта работа была поддержана Институтом исследований рака Онтарио за счет финансирования, предоставленного правительством Онтарио, а также Канадскими институтами исследований в области здравоохранения (FRN 123516 и FRN 152954), Канадским онкологическим обществом (грант 705143) и Научно-исследовательским институтом Терри Фокса (TFRI-1073).
Материалы
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
Ссылки
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611 (2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677 (2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977 (2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863 (2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685 (2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259 (2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713 (2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены