Method Article
유세포분석법(flow cytometry) 및 채택 전달(Adoptive Transfer)을 통한 종양 침투 골수성 세포의 기능 분석
요약
이 프로토콜은 쥐 피내 또는 피하 종양 모델에서 고형 종양 해리 및 골수성 세포 분리에 대한 신뢰할 수 있는 방법을 제공합니다. 유세포 분석은 종양 미세환경 내에서 이질적인 골수성 집단의 표현형 특성화를 가능하게 하며, 분류는 채택 전달의 맥락에서 그 기능을 입증할 것입니다.
초록
종양 침투 골수성 세포 구획(tumor-infiltating myeloid cell compartment)은 종양이 성장을 지원하기 위해 악용된 광범위한 면역 억제 세포의 이질적인 집단을 나타냅니다. 종양과 2차 림프 조직에 축적되면 항종양 면역 반응이 억제되어 치료 개입의 대상이 됩니다. 국소 사이토카인 환경이 종양 침투 골수성 세포의 기능적 프로그래밍을 지시할 수 있는 것으로 알려져 있기 때문에 항종양 골수성 세포 활성에 더 도움이 되는 사이토카인 지형을 표현하기 위해 종양 미세환경(TME)을 조작하는 전략이 고안되었습니다. 종양 침투 골수성 세포에서 치료로 유도된 변화를 평가하기 위해 이 논문은 백혈구 회복을 준비하기 위해 고형 종양 보유 마우스에서 피내/피하 종양 조직을 해리하는 절차를 간략하게 설명합니다. 유세포 분석을 위한 전략은 분리된 백혈구 내에서 이질적인 골수성 집단을 식별하고 고유한 골수성 표현형의 특성을 규명할 수 있도록 제공됩니다. 마지막으로, 이 논문은 기능적 분석을 위해 생존 가능한 골수성 세포를 정제하고 입양 이식의 맥락에서 치료 가치를 결정하는 방법을 설명합니다.
서문
종양 미세환경(TME)은 빠르게 증식하는 종양 세포와 주변의 이질적인 기질 세포 구획으로 구성됩니다. 성장하는 종양은 혈관화가 잘 이루어지지 않는 경우가 많기 때문에 TME는 저산소증, 영양 결핍 및 산증을 특징으로 하는 독특한 말초 부위입니다1. 이러한 환경에서 살아남기 위해 종양 스트레스 반응과 대사 재프로그래밍은 조직 리모델링과 혈관 신생을 촉진하는 용해성 인자의 분비와 면역 세포의 선택적 동원을 초래합니다2. 골수성 세포는 TME에서 가장 풍부한 유형의 조혈 세포 중 하나이기 때문에 TME에서 종양 침투 골수성 세포의 역할을 조사하는 데 대한 관심이 높아지고 있습니다.
골수성 세포는 단핵구(monocyte), 대식세포(macrophage), 수지상 세포(dendritic cell) 및 과립구(granulocyte)를 포함하는 선천성 면역 세포의 이질적이고 가소적인 그룹입니다. 이들은 조직 항상성과 적응 면역 반응 조절에 중요한 역할을 하지만, 국소 미세환경3 내에서 활성화 신호의 구성에 따라 그 기능이 분극화될 수 있습니다. 종양은 TME 내에서 용해성 인자의 분비를 통해 골수성 세포의 특성을 이용합니다. 이러한 대체 신호는 골수형성을 미성숙한 분화로 전환시키고 기존 종양 침투 골수성 세포의 기능을 왜곡시킬 수 있습니다3. 실제로, TME 내의 골수성 세포는 종종 암 진행을 촉진하고 항종양 면역 반응을 억제하여 암 치료에 악영향을 미칠 수 있습니다.
면역억제 골수성 세포의 고갈을 촉진하는 치료 전략이 종양 성장을 지연시키는 것으로 나타났지만4, 표적 특이성이 부족하면 면역자극성 골수성 세포를 제거할 위험이 있으며, 이는 반대로 암 해결에 도움이 됩니다. 이러한 염증성 골수성 세포는 종양세포의 직접적인 사멸 및 세포독성 CD8+ T세포의 활성화를 포함한 심오한 항종양 효과를 발휘할 수 있다5. 대안적으로, TME에서 골수성 세포의 구성과 기능을 정상화하는 전략은 치료적 성공을 보여주었다6; 그러나 항종양 표현형에 대한 재교육의 기초가 되는 생물학적 메커니즘은 아직 완전히 이해되지 않았습니다. 궁극적으로, 종양 골수성 세포의 포괄적인 특성화는 암 치료의 추가적인 개선을 위해 필요합니다.
불행히도, 골수성 세포 분리를 위한 종양의 재현 가능한 분리는 어렵습니다. 종양 유래 골수성 세포는 다른 백혈구 하위 집합에 비해 체외 조작에 민감하며, 종양 처리의 공격성으로 인해 효소 항원결정기 절단과 회복된 세포의 생존력 감소가 발생할 수 있습니다7. 이 방법의 목적은 분석을 위한 표면 마커 무결성과 기능 연구를 위한 세포 활력을 보존하기 위해 신뢰할 수 있는 종양 해리 수단을 제공하는 것입니다. 다양한 세포 subset의 재현 가능한 방출을 향상시키기 위해 더 가혹한 효소 혼합물을 선호하는 종양 침투 백혈구(TIL) 분리 프로토콜과 비교하여, 이 방법은 골수성 세포 회복을 극대화하기 위해 보다 보수적인 효소 분해를 선호합니다. 또한 추가 특성화 및/또는 분류를 위해 쥐 종양 골수성 세포 하위 집합을 식별하기 위해 높은 수준의 다중 색상 흐름 게이팅 전략이 제공됩니다.
프로토콜
참고: 모든 동물 연구는 캐나다 동물 관리 위원회(Canadian Council on Animal Care) 지침을 준수했으며 McMaster University의 동물 연구 윤리 위원회(Animal Research Ethics Board)의 승인을 받았습니다.
1. 종양 수확 및 해리
- 6-8주 된 암컷 C57BL/6 마우스에게 Nguyen 등이 설명한 대로 2 × 105 B16 흑색종 세포를 피내/피하로 접종합니다 .8 수확하기 전에 7일 동안 종양이 자라도록 합니다.
- 경추 탈구로 마우스를 안락사시키면서 그렇게 할 때 종양을 방해하지 않도록 합니다. 수확하기 전에 마우스에 70% 에탄올을 뿌립니다.
- 메스와 가위를 사용하여 주변 조직(부착된 종양 배출 림프절 포함)에서 피내/피하 종양을 외과적으로 제거하고 종양을 미리 계량된 마이크로퓨지 튜브에 넣습니다. 얼음 위에 보관하십시오.
참고: 동물용 생물 안전 캐비닛에서 종양 적출을 수행합니다. 큰 종양의 경우 15mL 원뿔형 튜브를 사용하십시오. - 종양의 무게를 측정하고 10% 소 태아 혈청(FBS)이 포함된 RPMI-1640 배지 500μL를 각 튜브에 첨가하고 가위를 사용하여 종양을 튜브 내부 또는 6웰 플레이트에 있는 작은 조각으로 자릅니다.
알림: 종양 조각은 소화 매체가 추가되면 전기 피펫터로 혼합할 수 있을 만큼 충분히 작아야 합니다. - 10% FBS 및 5mM 염화칼슘이 포함된 RPMI-1640 배지에서 콜라겐분해효소 IV형을 0.5mg/mL로, DNase를 0.2mg/mL로 용해시켜 해리 혼합물을 준비합니다.
참고: 해리 혼합물은 콜라겐분해효소 활성을 최대화하기 위해 신선하게 준비해야 합니다. - 다진 종양 현탁액을 15mL 코니컬 튜브로 옮기고 종양 0.25mg당 10mL의 해리 혼합물을 추가합니다. 튜브를 온도 조절이 가능한 오비탈 셰이커에 30분 동안 37rpm 교반으로 200분 동안 놓습니다. 10% FBS와 2mM 에틸렌디아민 테트라아세트산(EDTA)이 함유된 저온 RPMI-1640 배지 2개를 첨가하여 콜라겐분해효소 활성을 중화하고 4°C에서 10분 동안 냉장 보관합니다.
- 현탁액을 짧게 와류로 만들고 피펫으로 50mL 원뿔형 튜브의 40μm 스트레이너에 넣습니다. 주사기 플런저와 중화 매체를 사용하여 잔류 종양 조직을 분해하고 여과기를 통해 세척합니다. 현탁액을 5분(500× g, 4°C) 동안 원심분리하고, 상층액을 버리고, 펠릿을 2% FBS 및 1mM EDTA로 인산염 완충 식염수(PBS)에 재현탁합니다.
2. TIL 농축 및 유세포 분석 염색(FACS)
- 골수성 세포 특성 분석을 위해 TIL을 농축하려면 제조업체의 지침에 따라 비오틴화된 CD45.2 항체를 사용하여 비오틴 양성 선택을 위해 설계된 자기 세포 분리 키트를 사용하십시오( 재료 표 참조).
- 200μL의 FACS 완충액(0.5% w/v 소 혈청 알부민(BSA)이 포함된 PBS)에 세포를 재현탁하고 96웰 U-바닥 플레이트로 옮깁니다.
참고: 염색 농도 1 × 108 cells/mL를 초과하지 마십시오. 부피를 조정하고 샘플을 여러 웰로 분할하여 높은 세포 수를 보상합니다. - 플레이트를 5분(500× g, 4°C) 동안 원심분리하고 상층액을 버립니다. FACS 완충액에 50μL의 Fc 블록 용액(정제된 쥐 안티 마우스 CD16/CD32의 1:200 희석[ 재료 표 참조)을 추가하고 최종 농도 2.5μg/mL)를 피펫팅으로 세포를 재현탁합니다. 4 °C에서 10분 동안 배양합니다.
- 2배 농도의 표면 염색 항체(CD45.2, NK1.1, CD11c, F4/80, CD8a, Ly6C, CD11b, CD4, Ly6G의 1:50 희석) 및 고정성 생존도 염색(FVS, 1:500 희석)을 포함하는 50μL의 FACS 완충액을 추가하고 피펫팅으로 세포를 혼합합니다. 4 °C에서 20분 동안 배양합니다.
알림: 빛 노출을 최소화하기 위해 알루미늄 호일로 플레이트를 덮으십시오. 최적의 희석을 경험적으로 결정하기 위해 실험 전에 항체를 적정해야 합니다. - 각 웰에 200μL의 FACS 완충액을 추가하고 현탁액을 원심분리(5분, 500× g, 4°C)한 다음 상등액을 폐기하여 세포를 두 번 세척합니다.
- 각 웰에 100μL의 고정/투과화 용액( 재료 표 참조)을 추가하고, 피펫팅으로 세포를 혼합하고, 4°C에서 20분 동안 배양합니다.
- 각 웰에 100μL의 1x 투과화 완충액( 재료 표 참조)을 추가하고 플레이트를 5분(500 × g, 4°C) 동안 원심분리한 다음 상등액을 버립니다.
- 각 웰에 200μL의 1x 투과 완충액을 첨가하고 현탁액을 원심분리(5분, 500× g, 4°C)한 다음 상등액을 폐기하여 세포를 세척합니다.
참고: 실험은 투과화 완충액에 세포를 재현탁한 후 밤새 일시 중지할 수 있습니다. 샘플을 4°C에서 보관하고 빛으로부터 보호하십시오. 원심분리 전에 세포를 잠시 혼합한 후 다시 시작합니다. - 1배 농도의 세포 내 염색 항체(산화질소 합성효소 2(NOS2), 아르기나아제 1(Arg1)의 1:100 희석)을 포함하는 투과화 완충액 100μL를 추가하고 피펫팅으로 세포를 혼합합니다. 4 °C에서 20분 동안 배양합니다.
알림: 빛 노출을 최소화하기 위해 알루미늄 호일로 플레이트를 덮으십시오. 최적의 희석을 경험적으로 결정하기 위해 실험 전에 항체를 적정해야 합니다. - 각 웰에 100μL의 1x 투과 완충액을 추가하고 플레이트를 5분(500× g, 4°C) 동안 원심분리한 다음 상층액을 버립니다.
- 각 웰에 200μL의 1x 투과화 완충액을 첨가하고 현탁액을 원심분리(5분, 500× g, 4°C)한 후 상등액을 폐기하여 세포를 세척합니다.
- 300μL의 FACS 완충액에 세포를 재현탁합니다. 유세포 분석을 수행하기 전에 40μm 스트레이너 캡이 있는 5mL 둥근 바닥 폴리스티렌 튜브를 통해 샘플을 여과합니다.
3. 기능적 연구를 위한 종양 골수성 세포 분류
- 유세포 분석으로 원하는 골수성 세포 집단을 식별한 후, 제조업체의 지침에 따라 CD11b 또는 CD11c 양성 선택을 위해 설계된 자기 세포 분리 키트로 분류를 위해 벌크 골수성 세포를 사전 농축합니다( 재료 표 참조).
- 원하는 골수성 세포 subset(CD11b, Ly6C, Ly6G의 1:100 희석)에 특이적인 표면 염색 항체를 사용하여 2.2-2.5단계에 설명된 대로 사전 농축된 세포를 염색합니다.
참고: 살아있는 골수성 세포의 분류를 보장하기 위해 고정 가능한 생존도 염색을 포함합니다. 염색 농도 1 × 108 cells/mL를 초과하지 마십시오. 부피를 조정하고 샘플을 여러 웰로 분할하여 높은 세포 수를 보상합니다. - 세포를 저온 분류 완충액(1% w/v BSA, 25mM 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid(HEPES) 및 1mM EDTA가 있는 PBS)에 재현탁합니다. 40μm 스트레이너 캡이 있는 5mL 둥근 바닥 폴리프로필렌 튜브를 통해 샘플을 여과합니다. 세포를 얼음 위에 보관하고 알루미늄 호일로 튜브를 덮습니다.
알림: 세포/부피의 농도를 정렬을 위해 원하는 기기 사양으로 조정합니다. - 포집 매체(FBS가 50%인 PBS가 포함된 5mL 둥근 바닥 폴리프로필렌 튜브)가 있는 샘플 수집 튜브를 준비합니다.
참고: 분류하기 전에 밤새 5mL 포획 배지로 튜브를 코팅합니다. 샘플을 실행하기 전에 다음 날 1-2mL의 포획 배지를 제외한 모든 포획 배지를 폐기하십시오. - 분류기 기기 설정을 수정하여 시료 압력을 낮추고 액적 형성의 섭동을 방지합니다. 130μm 노즐 팁을 장착하고 10psi 설정을 활용합니다. 100rpm에서 주기적인 시료 교반으로 낮은 유속으로 시료를 실행하여 액적의 침전이 튜브 중앙에 있는지 확인합니다. 분류 후에는 샘플을 얼음 위에 보관하십시오.
- 샘플을 4°C에서 10분 동안 배양합니다. 튜브를 5분(500 × g, 4 °C) 동안 원심분리하고, 상층액을 버리고, 기능 분석 또는 채택 이식을 위해 원하는 배지에 펠릿을 다시 현탁시킵니다.
4. 정제된 종양 골수성 세포의 입양 이식
- 6-8주 된 암컷 C57BL/6 마우스에 1 × 106 B16 흑색종 종양 세포를 30μL의 PBS에 재현탁액으로 접종합니다.
참고: 입양 이식 시점까지 종양 성장이 100mm3를 초과하지 않도록 마우스에 미리 접종합니다. - 분류된 PBS의 종양 골수성 세포를 2 × 106 cells/mL의 농도로 25 mM HEPES 및 1 mM EDTA로 재현탁합니다. 40μm 스트레이너 캡이 있는 5mL 둥근 바닥 폴리스티렌 튜브를 통해 샘플을 여과합니다. 얼음 위에 보관하십시오.
- 3% 이소플루란으로 마취 상태에서 마우스를 유도하고 유지합니다. 안구 건조/부상을 방지하기 위해 안과 연고를 바르십시오.
- 31G 주사기에 50μL의 세포 현탁액을 로드합니다. 주사기를 부드럽게 튕겨 기포를 제거합니다. 알코올 면봉을 사용하여 주사 부위를 청소합니다.
- 멸균 집게를 사용하여 종양 기저부의 피부를 들어 올립니다. 바늘을 약간 위쪽 각도로 피하 공간에 삽입하여 피부 아래에서 종양으로 들어갑니다. 집게를 사용하여 바늘 주위의 피부를 꼬집고 주사기를 천천히 분배합니다. 바늘을 천천히 제거하면서 집게로 피부를 계속 꼬집고 면봉을 사용하여 누출 가능성을 청소합니다.
참고: 원하는 경우 추가 치료 치료를 진행하십시오. - 쥐가 마취에서 회복될 때까지 기다립니다.
결과
결과는 이 방법이 고형 쥐 종양에서 골수성 세포를 많이 생성한다는 것을 보여줍니다. 수용체 무결성 및 세포 생존력의 보존은 원하는 골수성 부분 집합의 신뢰할 수 있는 기능 분석을 용이하게 합니다. 골수성 세포 분리에 대한 이러한 개선은 양자 T 세포 요법 중 클래스 I 히스톤 탈아세틸화효소 억제제(HDACi), MS-275로 TME가 정상화될 때 종양내 골수성 세포의 기능 변화를 식별할 수 있게 해주었습니다. TIL 분리 프로토콜은 일반적으로 골수성 세포 수율을 최대화하기 위한 단계를 수행하지 않습니다9. 그 결과, 효소 분해는 일반적으로 너무 가혹하여 시료 생존력을 떨어뜨립니다. B16 흑색종 종양을 자기 선택에 의해 CD45.2+ 세포에 대해 양성 농축하기 전에 1시간 동안 콜라겐분해효소 I형으로 치료한 경우, 형태학(전방 산란 영역(FSC-A) 대 측면 산란 영역(SSC-A)) 및 골수성 세포 subgating(CD11b 대 CD11c)은 골수성 세포(CD11b+ 또는 CD11c+) 및 비골수성 세포(CD11b- -, CD11c-)의 수율이 매우 낮음을 나타냈습니다(그림 1). 콜라겐분해효소의 잠재적으로 과도한 특이적 활성을 줄이기 위해, 종양 소화 시간을 30분으로 줄였습니다. 골수성 세포 회복은 약간 개선되었지만, 전체 수율은 여전히 낮았고 비골수성 세포 회복은 개선되지 않았습니다.
로트 변이는 과도한 세포 사멸을 유발할 수 있을 만큼 충분히 높은 특정 활성을 가진 프로테아제를 도입할 수 있기 때문에 비교를 위해 다른 상용 공급업체에 별도의 콜라겐분해효소 유형 I을 요청했습니다. 흥미롭게도, 골수성 세포와 비골수성 세포의 전체 수율은 훨씬 더 높았으며, FBS가 추가됨에 따라 골수성 세포 수가 약간 증가했습니다. 골수성 세포를 콜라겐분해효소 유도 손상으로 안정화시키기 위해 FBS가 첨가되었지만, 이는 FBS가 세포 회복을 손상시킬 수 있는 콜라겐분해효소 유형 I 제제의 트립틱 활성도 중화하고 있는지에 대한 의문을 제기했습니다. 콜라겐분해효소 I형 제제는 콜라겐분해효소, 카제인분해효소, 클로스트라인효소 및 트립틱 활성10을 가지므로, 프로테아제 노출을 줄이기 위해 콜라겐분해효소 특이적 활성이 높고 트립틱 활성이 낮은 콜라겐분해효소 IV형을 사용하여 소화를 시도하였다. 이 조건은 골수성 세포 수율을 더 크게 증가시키는 결과를 낳았으며, FBS를 추가하면 가장 높은 수율을 얻을 수 있었습니다. 흥미롭게도, FBS가 있든 없든 콜라겐분해효소 I형 및 IV형은 비골수성 세포의 전체 수율을 현저하게 변화시키지 않았습니다.
이러한 최적화된 효소 분해 조건을 통해 쥐 B16 흑색종 종양에서 백혈구를 분리하고, 유세포 분석을 사용하여 표면 마커의 발현을 기반으로 TME 내의 다양한 골수성 세포 집단을 표현형화했습니다. 종양을 수확 및 처리하고 CD45.2 자기 선택 키트를 사용하여 백혈구를 분리했습니다. 그런 다음 신중하게 설계된 세포 표면 마커 패널을 사용하여 세포를 염색했습니다(그림 2). 여기에 설명된 게이팅 전략은 FSC-A 대 SSC-A를 사용하여 세포의 형태학적 평가로 시작합니다. 이를 통해 작은 크기를 기준으로 세포 파편을 제외할 수 있습니다. FSC-H 대 FSC-W를 사용하여 단일 세포를 선택하고 이중선을 제외했습니다. 그런 다음 CD45.2 및 생존력 염색에 따라 총 살아있는 백혈구를 게이팅했습니다. 림프구는 NK1.1, CD4 및 CD8 염색에 따라 제외되었습니다. BALB/c 마우스에서 NK1.1은 BALB/c 유래 NK 세포에서 발현되지 않으므로 Asialo-GM1 및/또는 DX5를 사용하여 자연살해(NK) 세포를 배제할 수 있습니다. 그런 다음 CD11b를 CD11c에 대해 플롯하여 종양 관련 수지상 세포(TADC)/기존 수지상 세포(cDC)를 식별했습니다.
CD11c에 대해 음성인 세포는 벌크 골수성 세포를 나타내며, 이는 Ly6C 및 Ly6G 염색을 기반으로 추가로 분리될 수 있습니다. 중간 수준의 Ly6C와 높은 수준의 Ly6G를 발현하는 세포는 호중구를 나타냅니다. 이 집단은 과립구 골수성 유래 억제 세포(G-MDSC)와 동일한 표현형을 공유합니다. Ly6G에 대해 음성으로 염색되지만 Ly6C에 대해 양성인 CD11b+ 세포는 Ly6Chi, Ly6Cint 및 Ly6Clo로 나눌 수 있습니다. Ly6Cint/hi 세포는 낮은 수준의 F4/80을 발현하며 염증성 단핵구를 나타냅니다. 그러나 Ly6Chi 세포는 단핵구 골수성 억제 세포(M-MDSC)와도 동일한 표현형을 공유합니다. 마지막으로, Ly6Cint cell은 높은 수준의 F4/80을 발현하며 일반적으로 종양 관련 대식세포(TAM)와 관련이 있습니다. 이러한 특성 분석은 관심 있는 골수성 세포 하위 집합을 완전히 식별하지 못할 수 있지만, 추가 기능 또는 게놈 분석을 위해 TME 내에서 골수성 세포 집단을 분류하는 데 유용한 게이팅 전략을 제공합니다. 면역요법의 맥락에서, I급 히스톤 탈아세틸화효소 억제제(Class I histone deacetylase inhibitor, HDACi) MS-275와 같은 후성유전학적 변형 약물을 통합한 양자 T세포 요법은 TME에 영향을 미쳐 지속적인 종양 퇴행을 촉진할 수 있으며, 종양 퇴행이 없으면 종양 재발을 초래할 수 있다8.
벌크 종양 RNA의 마이크로어레이 분석은 종양 침투 골수성 세포의 역할을 시사하지만, 이러한 표현형 특성화는 MS-275 치료 중 주요 표면 마커 변화를 나타내지 않았습니다8. 흥미롭게도, 유세포 분석 염색 패널에 존재하는 기능적 마커는 편광 또는 발산 함수 프로그래밍의 암시적 판독값인 산화질소 합성효소 2(NOS2) 및 아르기나아제 1(Arg1)을 차등적으로 생성하는 특정 골수성 세포 하위 집합(CD11b+ Ly6C, hi Ly6G-)을 식별했습니다(그림 3A). 차등 처리된 종양 보유 마우스에서 CD11b+ Ly6Chi Ly6G- 세포를 분류함으로써 이들의 역할을 이해하기 위해 보다 광범위한 기능 연구를 수행할 수 있습니다. 림프구 증식을 모니터링하기 위해 카르복시플루오레세인 숙시니미딜 에스테르(CFSE) 라벨링을 사용하여11, 백신 접종을 받은 마우스 및 백신 접종을 받은 마우스에서 유래한 분류된 골수성 세포는 체외에서 T 세포 증식을 억제하는 것으로 밝혀졌으며, 백신 접종 + MS-275 투여된 마우스에서 유래한 세포는 면역억제 기능이 감소한 것으로 나타났습니다(그림 3B). 이 세포의 채택 이식은 대신 항종양 능력을 가지고 있으며 백신 접종 중 종양의 지속적인 퇴행을 촉진하고 마우스 생존을 연장하는 것으로 나타났습니다(그림 3C).

그림 1: 다양한 해리 조건의 효과를 보여주는 대표적인 데이터. C57BL/6 마우스(그룹당 n=3)에서 치료되지 않은 피내 B16F10-gp33 종양을 CD45.2 선택 전에 다양한 효소 조건에서 처리 및 해리했습니다. 위에 표시된 것은 세포 수율 차이를 입증하는 데 사용되는 유세포 분석 게이팅 전략입니다(FSC-A 대 SSC-A)는 세포 크기/입도 구별에 의해 암묵적으로 종양 침투 백혈구 수율을 보여줍니다. (CD11b vs. CD11c) 세포는 골수성(CD11b+ 또는 CD11c+) 또는 비골수성(CD11b- CD11c-) 세포를 정량화할 수 있습니다. 오류는 평균의 표준 오차로 정의됩니다. 약어: CD = cluster of differentiation; SSC-A = 측면 산란 영역; FSC-A = 전방 산란 영역; FBS =소 태아 혈청. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
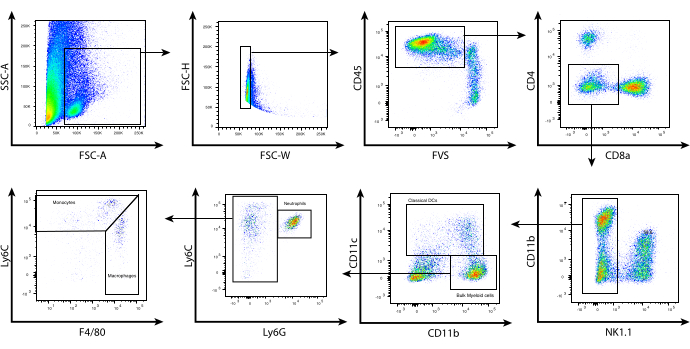
그림 2: 종양 침투 골수성 세포의 대표적인 유세포 분석 종양 처리 및 CD45.2 선별 후, 농축된 세포는 프로토콜에 기술된 대로 표면 염색되었습니다. 위에 표시된 것은 림프구를 배제하고 종양 미세환경 내에서 골수성 세포의 개별 부분 집합을 식별하는 데 사용되는 게이팅 전략입니다. 파편(SSC-A vs. FSC-A) 및 이중항(FSC-H vs. FSC-W)은 제외하고, 고정성 생존도 염색 FVS510(CD45.2 vs. FVS)입니다. CD4+, CD8+, NK1.1+ 세포를 게이트아웃했습니다. CD11bhi/lo CD11c+ 셀은 cDC를 나타냅니다. 그런 다음 CD11b+ CD11c-를 Ly6C 및 Ly6G 발현에 기초하여 subgation했습니다. (i) Ly6Cint Ly6G+ (호중구/G-MDSC), (ii) Ly6Chi Ly6G- F4/80lo/int (단핵구/M-MDSC), (iii) Ly6Clo/int Ly6G- F4/80hi (대식세포/TAM)의 3개 집단이 확인되었습니다. 약어: CD = cluster of differentiation; SSC-A = 측면 산란 영역; FSC-A = 전방 산란 영역; FSC-H = 전방 산란 높이; FSC-W = 전방 산란 폭; FVS = 고정성 생존도 염색; cDCs = 기존 수지상 세포; Ly = 림프구 항원; G-MDSCs = 과립구 골수성 유래 억제 세포; M-MDSCs = 단핵 골수성 유래 억제 세포; TAMs= 종양 관련 대식세포. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 정제된 종양 침윤 골수성 세포의 기능 분석. C57BL/6 마우스(그룹당 n=3-5)에서 피내 B16F10-gp33 종양은 백신을 접종하지 않았거나 HDAC 억제제인 MS-275의 유무에 관계없이 양자 T 세포 요법을 투여했습니다. 치료 5일 후, 종양을 처리하고 CD11b+ 세포에 대해 양성 농축을 했습니다. 세포를 원하는 종양 침윤 골수성 세포 하위 집합(CD11b+ , Ly6C, hi , Ly6G-)에 subgate하기 위해 표면 염색했습니다. (A) 이러한 세포는 기능적 활성화의 극성을 설명할 수 있는 마커를 위해 세포 내에서 추가로 염색되었으며, 데이터는 NOS2 또는 Arg1을 생성하는 CD11b+ Ly6Chi Ly6G- 세포의 빈도로 표시됩니다. 대안적으로, 표면 염색된 CD11b+-농축 골수성 세포를 분류하여 순수한 Ly6Chi Ly6G- 세포 집단을 얻었다. (B) 이러한 정제된 세포를 펩타이드 펄스화하고 CFSE 표지된 나이브 TCR-형질전환 T 세포와 다양한 비율로 공동 배양했습니다. 유세포 분석에 의해 결정된 CFSE 희석은 대표 히스토그램으로 표시되며 세포 분열 지수(1:1)로 정량화됩니다. (C) 백신을 접종한 + MS-275 처리된 종양 보유 마우스에서 유래한 별도로 정제된 CD11b+ Ly6Chi Ly6G- 세포를 백신 접종 및 종양 퇴행과 함께 새로운 종양 보유 마우스(n=5)로 채택하여 이식하고 생존 곡선을 모니터링했습니다. 오류는 평균의 표준 오차로 정의됩니다. p=0.0004, * p=0.0479, **** p<0.0001. 이 수치는 Nguyen et al.에서 수정되었습니다. 8. 약어: CD = cluster of differentiation; HDAC = 히스톤 탈아세틸화효소 억제제; NOS2 = 산화질소 합성효소 2; Arg1 = 아르기나아제 1 ; CFSE = 카르복시플루오레세인 숙시니미딜 에스테르; TCR = T 세포 수용체; Ly = 림프구 항원; NS= 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
종양 침윤 골수성 세포는 종양 내에서 다양한 활성화 및 분화 상태로 존재하지만, 종양 관련 DC(TADC), 종양 관련 호중구(TAN), 골수성 유래 억제 세포(MDSC) 및 종양 관련 대식세포(TAM)를 포함한 여러 하위 집합이 확인되었습니다12. 불행히도, 이러한 골수성 세포 하위 집합을 식별하는 데 사용되는 세포 표면 마커의 중첩 발현으로 인해 현재 종양 골수성 세포를 다른 골수성 세포와 표현형으로 구별하는 것이 어렵습니다13. 마찬가지로, 종양 침투 골수성 세포에서 치료로 유도된 표현형 변화는 기존 골수성 항체 염색 패널에서는 쉽게 관찰되지 않을 수 있습니다. 종합하면, 고유한 표면 마커의 부족은 골수성 세포 생물학에 대한 이해를 복잡하게 만듭니다. 자연적, 종양 주도 및 치료의 영향을 받는 골수성 세포를 설명하기 위해서는 골수성 세포 하위 집합의 평가가 표현형 특성과 더불어 기능에 따라 수행되어야 합니다.
종양 조직을 수확하고 해리하기 위해 본원에 기술된 방법은 보존된 생존율 및 표면 마커 무결성을 가진 골수성 세포의 분리를 가능하게 합니다. 종양 침투 골수성 세포는 체외 조작7에 민감하기 때문에 프로토콜의 강조점은 덜 공격적인 기계적 및 효소적 해리입니다. 그러나 종양 조직 유형에 따라 다른 샘플은 단일 세포 현탁액을 생성하기 위해 다양하고 공격적인 처리가 필요합니다. 콜라겐이 더 풍부한 종양 모델(즉, CMS5 섬유육종)의 경우, 효소 치료 전에 종양 조직을 보다 기계적으로 분해하기 위해 가위와 함께 주사기 플런저를 사용할 수 있습니다. 반대로, 콜라겐이 적은 종양 모델(즉, B16 흑색종)이 반드시 효소 치료가 필요한 것은 아닙니다. 이러한 결과에서 입증된 바와 같이, 콜라겐분해효소 제제의 유형과 콜라겐분해효소가 파생된 로트는 효소 해리 중에 세포가 노출되는 프로테아제의 다양성과 효능에 상당한 영향을 미칠 수 있습니다.
비골수성 백혈구(즉, 림프구)는 민감하지 않은 것으로 보이지만, 이러한 데이터는 특히 골수성 세포가 과도한 단백질 분해 효소 노출에 매우 취약할 수 있으며(그림 1) 멤브레인 단백질이 손상되고 생존력이 감소할 수 있음을 시사합니다. 결과적으로, 콜라겐 분해 효소 유형 I보다 콜라겐 분해 효소 유형 IV를 사용하는 것은 콜라겐 분해 효소 특이적 단백질 분해 활성이 증가하고 잔류 트립틱 활성을 중화하기 위해 FBS를 소화 혼합물에 통합하기 위해 권장됩니다. 또한, 상업적인 공급원의 미정제 제제와 달리 정제된 콜라겐분해효소 생성물을 사용하면 세포 회수의 재현성을 높일 수 있습니다. 분해가 완료되면 Ca2+ 이온을 킬레이트화하고 콜라겐분해효소 활성에 필요한 온도를 낮추기 위해 EDTA를 추가하고 4°C에서 배양해야 합니다14.
이질적인 TIL 집단 내에 침투하는 골수성 세포를 특성화하기 위해 높은 수준의 게이팅 전략이 제공되었습니다(그림 2). 다색 유세포 분석 패널은 1) 사체 및 비골수성 세포를 배제하고, 2) 골수성 세포 부분 집합을 식별하고, 3) 변경된 기능을 샘플 그룹에서 암시적으로 관찰할 수 있는 방식으로 설계되어야 합니다(그림 3). 관심 있는 골수성 세포 subset의 수와 기능적 특성화의 깊이에 따라 이러한 기준이 하나의 염색 패널에 완전히 수용되지 않을 수 있습니다. 패널의 채널을 확보하기 위해 마커를 전략적으로 단일 덤프 채널로 풀링할 수 있습니다. 이 방법을 사용하면 종양 침윤 골수성 세포를 고차원적으로 분석할 수 있지만 여전히 상대적으로 낮은 매개변수 한계로 인해 제약을 받습니다. 질량 세포 분석과 같은 중금속 리포터 이온을 사용하는 최신 기술은 단일 패널 내에서 최대 40개의 독립적인 매개변수를 가능하게 하여 TME15 내 골수성 세포의 세포 및 기능적 다양성을 더 잘 연구할 수 있습니다.
그러나 계측 비용은 사용의 편재성을 제한합니다. 유세포 분석은 접근성이 더 높고 신뢰할 수 있는 특성화 데이터를 생성하지만, 여러 패널에 걸쳐 마커를 혼합 및 일치시키기 위해 실험 전에 매우 중요한 단계로서 패널 검증이 필요합니다. 종양 침윤 골수성 관심 부분 집합이 확인되면 여러 연구자15가 기능적 분석 및 연구를 위해 이러한 세포를 분류하는 기술을 설명합니다. 분류된 세포는 종양 재발의 마우스 모델로 채택한 후 in vitro 에서 T 세포 억제 능력과 in vivo 에서 항종양 능력을 안정적으로 분석할 수 있습니다(그림 3). 전반적으로, 설명된 방법의 중요성은 다른 TIL 분리 프로토콜과 비교하여 종양 수확, 해리, 세포 농축 및 세포 분류 조건이 다른 모든 백혈구보다 골수성 세포 구획의 높은 수율을 재현성 있게 획득하고 그 기능을 손상시키지 않도록 조정되었다는 것입니다.
공개
선언된 이해 상충이 없습니다.
감사의 말
이 연구는 온타리오 주 정부, 캐나다 보건 연구소(FRN 123516 및 FRN 152954), 캐나다 암 학회(보조금 705143) 및 테리 폭스 연구소(TFRI-1073)의 자금 지원을 통해 온타리오 암 연구소(Ontario Institute for Cancer Research)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
참고문헌
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611 (2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677 (2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977 (2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863 (2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685 (2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259 (2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713 (2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유