Method Article
Análise funcional de células mieloides infiltrantes de tumor por citometria de fluxo e transferência adotiva
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo fornece métodos confiáveis de dissociação de tumores sólidos e isolamento de células mieloides em modelos de tumores intradérmicos ou subcutâneos murinos. A citometria de fluxo permite a caracterização fenotípica de populações mieloides heterogêneas dentro do microambiente tumoral e a classificação demonstrará sua funcionalidade no contexto da transferência adotiva.
Resumo
O compartimento de células mielóides infiltrantes do tumor representa uma população heterogênea de células amplamente imunossupressoras que foram exploradas pelo tumor para apoiar seu crescimento. Seu acúmulo no tumor e no tecido linfóide secundário leva à supressão das respostas imunes antitumorais e, portanto, é alvo de intervenção terapêutica. Como se sabe que o meio local de citocinas pode ditar a programação funcional das células mieloides infiltrantes de tumores, estratégias foram elaboradas para manipular o microambiente tumoral (TME) para expressar um cenário de citocinas mais propício à atividade das células mieloides antitumorais. Para avaliar as alterações induzidas pela terapia em células mieloides infiltrantes de tumor, este artigo descreverá o procedimento para dissociar o tecido tumoral intradérmico/subcutâneo de camundongos portadores de tumor sólido em preparação para a recuperação de leucócitos. Estratégias para análise de citometria de fluxo serão fornecidas para permitir a identificação de populações mieloides heterogêneas dentro de leucócitos isolados e a caracterização de fenótipos mieloides únicos. Por fim, este artigo descreverá um meio de purificar células mieloides viáveis para ensaios funcionais e determinar seu valor terapêutico no contexto da transferência adotiva.
Introdução
O microambiente tumoral (TME) é composto por células neoplásicas de rápida proliferação e um compartimento de células estromais heterogêneas circundantes. Como os tumores em crescimento são frequentemente pouco vascularizados, o TME é um local periférico caracterizado exclusivamente por hipóxia, privação de nutrientes e acidose1. Para sobreviver nesse cenário, as respostas ao estresse tumoral e a reprogramação metabólica resultam na secreção de fatores solúveis que promovem a remodelação tecidual e a angiogênese, bem como o recrutamento seletivo de células imunes2. Como as células mieloides são um dos tipos mais abundantes de células hematopoiéticas no TME, há um interesse crescente em examinar o papel das células mieloides infiltrantes de tumor no TME.
As células mieloides são um grupo heterogêneo e plástico de células imunes inatas, incluindo monócitos, macrófagos, células dendríticas e granulócitos. Embora tenham papéis críticos na homeostase tecidual e na regulação da resposta imune adaptativa, sua função pode ser polarizadora dependendo da composição dos sinais de ativação dentro do microambiente local3. Os tumores aproveitam as características das células mieloides por meio da secreção de fatores solúveis dentro do TME. Esses sinais alternativos podem desviar a mielopoiese para a diferenciação imatura e distorcer a função das células mieloides infiltrantes de tumor existentes3. De fato, as células mieloides dentro do TME geralmente promovem a progressão do câncer e podem suprimir as respostas imunes antitumorais, levando a efeitos adversos na terapia do câncer.
Embora as estratégias terapêuticas que promovem a depleção de células mieloides imunossupressoras tenham demonstrado retardar o crescimento tumoral4, a falta de especificidade do alvo corre o risco de remoção de células mieloides imunoestimuladoras, que, por outro lado, auxiliam na resolução do câncer. Essas células mieloides inflamatórias podem exercer efeitos antitumorais profundos, incluindo morte direta de células tumorais e ativação de células T CD8+ citotóxicas5. Alternativamente, estratégias que normalizam a composição e a função das células mieloides no TME têm mostrado sucesso terapêutico6; no entanto, os mecanismos biológicos subjacentes à sua reeducação em direção a um fenótipo antitumoral ainda não foram totalmente compreendidos. Em última análise, uma caracterização abrangente das células mieloides tumorais é necessária para melhorar ainda mais a terapia do câncer.
Infelizmente, a desagregação reprodutível de tumores para isolamento de células mieloides é um desafio. As células mieloides derivadas de tumores são sensíveis à manipulação ex vivo em comparação com outros subconjuntos de leucócitos, e a agressividade do processamento do tumor pode levar à clivagem enzimática do epítopo e à redução da viabilidade das células recuperadas7. O objetivo deste método é fornecer um meio confiável de dissociação tumoral para preservar a integridade do marcador de superfície para análise e a vitalidade celular para estudo funcional. Em comparação com os protocolos de isolamento de leucócitos infiltrantes de tumor (TIL) que favorecem misturas enzimáticas mais severas para aumentar a liberação reprodutível de vários subconjuntos celulares, esse método favorece uma digestão enzimática mais conservadora para maximizar a recuperação das células mieloides. Estratégias de gating de fluxo multicolorido de alto nível também são fornecidas para identificar subconjuntos de células mieloides de tumores murinos para posterior caracterização e/ou classificação.
Protocolo
NOTA: Todos os estudos em animais cumpriram as diretrizes do Conselho Canadense de Cuidados com Animais e foram aprovados pelo Conselho de Ética em Pesquisa Animal da Universidade McMaster.
1. Colheita e dissociação do tumor
- Inocular camundongos C57BL/6 fêmeas de 6 a 8 semanas de idade por via intradérmica/subcutânea com 2 × 105 células de melanoma B16, conforme descrito por Nguyen et al.8 Permitir que os tumores cresçam por 7 dias antes da colheita.
- Eutanasiar o camundongo por luxação cervical, certificando-se de não interromper o tumor ao fazê-lo. Pulverize o camundongo com etanol a 70% antes da colheita.
- Usando um bisturi e uma tesoura, remova cirurgicamente o tumor intradérmico/subcutâneo do tecido circundante (incluindo os linfonodos de drenagem do tumor anexados) e coloque os tumores em um tubo de microcentrífuga pré-pesado. Mantenha no gelo.
NOTA: Realize a colheita do tumor em um gabinete de biossegurança para uso animal. Use um tubo cônico de 15 mL para tumores maiores. - Pese os tumores e adicione 500 μL de meio RPMI-1640 com 10% de soro fetal bovino (FBS) a cada tubo, usando uma tesoura para cortar os tumores em pequenos pedaços dentro do tubo ou em uma placa de 6 poços.
NOTA: Os pedaços do tumor devem ser pequenos o suficiente para serem misturados por um pipetador elétrico uma vez que o meio de digestão tenha sido adicionado. - Prepare a mistura de dissociação dissolvendo colagenase tipo IV a 0,5 mg / mL e DNase a 0,2 mg / mL em meio RPMI-1640 com 10% de FBS e 5 mM de cloreto de cálcio.
NOTA: A mistura de dissociação deve ser preparada fresca para maximizar a atividade da colagenase. - Transfira a suspensão do tumor picado para um tubo cônico de 15 mL e adicione 10 mL de mistura de dissociação por 0,25 mg de tumor. Coloque o tubo em um agitador orbital com temperatura controlada por 30 min a 37 °C com agitação de 200 rpm. Neutralize a atividade da colagenase adicionando dois volumes de meio RPMI-1640 frio com 10% de FBS e 2 mM de ácido etilenodiamina tetracético (EDTA) e leve à geladeira por 10 min a 4 ° C.
- Um breve vórtice e pipeta a suspensão em um filtro de 40 μm em um tubo cônico de 50 mL. Use um êmbolo de seringa e um meio neutralizante para desagregar o tecido tumoral residual e lave-o através do filtro. Centrifugue a suspensão por 5 min (500 × g, 4 ° C), descarte o sobrenadante e ressuspenda o pellet em solução salina tamponada com fosfato (PBS) com 2% de FBS e 1 mM de EDTA.
2. Enriquecimento TIL e coloração por citometria de fluxo (FACS)
- Para enriquecer os TILs para caracterização de células mieloides, use um kit de separação de células magnéticas projetado para seleção positiva de biotina com anticorpos CD45.2 biotinilados de acordo com as instruções do fabricante (consulte a Tabela de Materiais).
- Ressuspenda as células em 200 μL de tampão FACS (PBS com albumina de soro bovino (BSA) a 0,5% p/v) e transfira-as para uma placa de fundo em U de 96 poços.
NOTA: Não exceda uma concentração de coloração de 1 × 108 células/mL. Ajuste o volume e divida as amostras em vários poços para compensar o alto número de células. - Centrifugar a placa durante 5 min (500 × g, 4 °C) e rejeitar o sobrenadante. Adicione 50 μL de solução em bloco Fc (diluição 1:200 de CD16 / CD32 purificado de rato anti-camundongo [consulte a Tabela de Materiais) em tampão FACS, concentração final de 2,5 μg / mL) e ressuspenda as células por pipetagem. Incubar durante 10 min a 4 °C.
- Adicione 50 μL de tampão FACS contendo concentração 2x de anticorpo de coloração superficial (diluição 1:50 de CD45.2, NK1.1, CD11c, F4/80, CD8a, Ly6C, CD11b, CD4, Ly6G) e coloração de viabilidade fixável (FVS, diluição 1:500) e misture as células por pipetagem. Incubar durante 20 min a 4 °C.
NOTA: Cubra a placa com papel alumínio para minimizar a exposição à luz. Os anticorpos devem ser titulados antes do experimento para determinar empiricamente a diluição ideal. - Lave as células duas vezes adicionando 200 μL de tampão FACS a cada poço, centrifugando a suspensão (5 min, 500 × g, 4 ° C) e descartando o sobrenadante.
- Adicione 100 μL de solução de fixação/permeabilização (consulte a Tabela de Materiais) a cada poço, misture as células pipetagem e incube por 20 min a 4 °C.
- Adicione 100 μL de tampão de permeabilização 1x (consulte a Tabela de Materiais) a cada poço, centrifugue a placa por 5 min (500 × g, 4 ° C) e descarte o sobrenadante.
- Lave as células adicionando 200 μL de tampão de permeabilização 1x a cada poço, centrifugando a suspensão (5 min, 500 × g, 4 ° C) e descartando o sobrenadante.
NOTA: O experimento pode ser pausado durante a noite após ressuspender as células no tampão de permeabilização. Armazenar a amostra a 4 °C e protegida da luz. Retomar após misturar brevemente as células antes de centrifugar. - Adicione 100 μL de tampão de permeabilização contendo 1x concentração de anticorpo de coloração intracelular (diluição 1:100 de óxido nítrico sintase 2 (NOS2), arginase 1 (Arg1)) e misture as células por pipetagem. Incubar durante 20 min a 4 °C.
NOTA: Cubra a placa com papel alumínio para minimizar a exposição à luz. Os anticorpos devem ser titulados antes do experimento para determinar empiricamente a diluição ideal. - Adicione 100 μL de tampão de permeabilização 1x a cada poço, centrifugue a placa por 5 min (500 × g, 4 ° C) e descarte o sobrenadante.
- Lave as células adicionando 200 μL de tampão de permeabilização 1x a cada poço, centrifugando a suspensão (5 min, 500 × g, 4 ° C) e descartando o sobrenadante.
- Ressuspenda as células em 300 μL de tampão FACS. Filtre a amostra através de um tubo de poliestireno de fundo redondo de 5 mL com tampa de filtro de 40 μm antes de realizar a análise de citometria de fluxo.
3. Classificação de células mielóides tumorais para estudos funcionais
- Depois de identificar as populações de células mieloides desejadas por análise de citometria de fluxo, pré-enriqueça as células mieloides em massa para classificação com um kit de separação de células magnéticas projetado para seleção positiva para CD11b ou CD11c de acordo com as instruções do fabricante (consulte a Tabela de Materiais).
- Usando anticorpos de coloração de superfície específicos para os subconjuntos de células mielóides desejados (diluição 1:100 de CD11b, Ly6C, Ly6G), core as células pré-enriquecidas conforme descrito nas etapas 2.2-2.5.
NOTA: Inclua corante de viabilidade corrigível para garantir a classificação de células mieloides vivas. Não exceda uma concentração de coloração de 1 × 108 células / mL. Ajuste o volume e divida as amostras em vários poços para compensar o alto número de células. - Ressuspenda as células em tampão de triagem a frio (PBS com 1% p / v BSA, ácido 4-(2-hidroxietil) -1-piperazineetanossulfônico 25 mM (HEPES) e EDTA 1 mM). Filtre a amostra através de um tubo de polipropileno de fundo redondo de 5 mL com uma tampa de filtro de 40 μm. Mantenha as células no gelo e cubra o tubo com papel alumínio.
NOTA: Ajuste a concentração de células/volume para a especificação do instrumento desejada para classificação. - Prepare um tubo de coleta de amostra com meio de captura (tubo de polipropileno de fundo redondo de 5 mL contendo PBS com 50% de FBS).
NOTA: Revestir os tubos com 5 mL de meio de captura durante a noite antes da classificação. Descarte todos, exceto 1-2 mL do meio de captura no dia seguinte antes de executar a amostra. - Modifique as configurações do instrumento classificador para diminuir a pressão da amostra e evitar perturbações na formação de gotículas. Equipe a ponta do bico de 130 μm e utilize a configuração de 10 psi. Execute a amostra em uma baixa taxa de fluxo com agitação periódica da amostra a 100 rpm, garantindo que a deposição de gotículas esteja no centro do tubo. Após a classificação, mantenha a amostra no gelo.
- Incubar a amostra durante 10 minutos a 4 °C. Centrifugue o tubo por 5 min (500 × g, 4 ° C), descarte o sobrenadante e ressuspenda o pellet no meio desejado para ensaios funcionais ou transferência adotiva.
4. Transferência adotiva de células mielóides tumorais purificadas
- Inocule camundongos C57BL / 6 fêmeas de 6-8 semanas de idade por via intradérmica com 1 ×10 6 células tumorais de melanoma B16 ressuspensas em 30 μL de PBS.
NOTA: Inocule os camundongos com antecedência, de modo que o crescimento do tumor não exceda 100 mm3 no momento da transferência adotiva. - Ressuspenda as células mielóides tumorais classificadas em PBS com 25 mM HEPES e 1 mM EDTA a uma concentração de 2 × 106 células / mL. Filtrar a amostra através de um tubo de poliestireno de fundo redondo de 5 ml com uma tampa de filtro de 40 μm. Mantenha no gelo.
- Induza e mantenha camundongos sob anestesia com isoflurano a 3%. Aplique pomada oftálmica para prevenir secura/lesão ocular.
- Coloque uma seringa de 31 G com 50 μL de suspensão celular. Desaloje as bolhas de ar sacudindo suavemente a seringa. Limpe o local da injeção com um toalhete embebido em álcool.
- Usando uma pinça estéril, levante a pele na base do tumor. Insira a agulha no espaço subcutâneo em um ligeiro ângulo para cima para entrar no tumor por baixo da pele. Use a pinça para apertar a pele ao redor da agulha e dispense lentamente o volume da seringa. Continue a beliscar a pele com a pinça enquanto remove a agulha lentamente e use um cotonete para limpar possíveis vazamentos.
NOTA: Prossiga com quaisquer tratamentos terapêuticos adicionais, se desejar. - Permita que os ratos se recuperem da anestesia.
Resultados
Os resultados demonstram que este método produz um alto rendimento de células mieloides de tumores murinos sólidos. A preservação da integridade do receptor e da viabilidade celular facilita a análise funcional confiável dos subconjuntos mieloides desejados. Essas melhorias no isolamento de células mieloides permitiram o discernimento da mudança de função das células mieloides intratumorais após a normalização do TME com o inibidor de histona desacetilase classe I (HDACi), MS-275, durante a terapia adotiva com células T. Os protocolos de isolamento TIL normalmente não tomam as medidas para maximizar o rendimento das células mieloides9. Como resultado, a digestão enzimática é tipicamente muito dura e leva à perda da viabilidade da amostra. Quando os tumores de melanoma B16 processados foram tratados com colagenase tipo I por 1 h (uma condição comumente usada) antes de enriquecer positivamente para células CD45.2+ por seleção magnética, a morfologia (área de dispersão direta (FSC-A) vs. área de dispersão lateral (SSC-A)) e subgating de células mieloides (CD11b vs. CD11c) indicaram que o rendimento de células mieloides (CD11b+ ou CD11c+) e células não mieloides (CD11b- CD11c-) foi extremamente baixo (Figura 1). Para reduzir a atividade específica potencialmente excessiva da colagenase, a duração da digestão do tumor foi reduzida para 30 min. Embora tenha havido uma ligeira melhora na recuperação de células mieloides, o rendimento geral ainda foi baixo e não houve melhora na recuperação de células não mieloides.
Como a variação do lote pode introduzir proteases com atividade específica alta o suficiente para causar morte celular excessiva, um lote separado de colagenase tipo I foi solicitado a um fornecedor comercial diferente para comparação. Curiosamente, o rendimento geral de células mieloides e não mieloides foi muito maior, com um ligeiro aumento no número de células mieloides após a adição de FBS. Embora o FBS tenha sido adicionado para estabilizar as células mieloides ao dano induzido pela colagenase, isso levantou a questão de saber se o FBS também estava neutralizando a atividade tríptica da preparação de colagenase tipo I, o que poderia estar prejudicando a recuperação celular. Como as preparações de colagenase tipo I têm atividades de colagenase, caseinase, clostripaína e tríptica10, para reduzir a exposição à protease, a digestão foi tentada usando colagenase tipo IV, que tem maior atividade específica da colagenase e menor atividade tríptica. Essa condição resultou em um maior aumento no rendimento de células mieloides, com a adição de FBS resultando no maior rendimento. Curiosamente, a colagenase tipo I e tipo IV, com ou sem FBS, não alterou acentuadamente o rendimento geral de células não mieloides.
Com essas condições de digestão enzimática otimizadas, os leucócitos foram isolados de tumores de melanoma murino B16 e a citometria de fluxo foi usada para fenotipar as diferentes populações de células mieloides dentro do TME com base em sua expressão de marcadores de superfície. Os tumores foram colhidos e processados e os leucócitos isolados usando um kit de seleção magnética CD45.2. As células foram então coradas usando um painel cuidadosamente projetado de marcadores de superfície celular (Figura 2). A estratégia de gating descrita aqui começa com uma avaliação morfológica das células usando FSC-A vs. SSC-A. Isso permite a exclusão de detritos celulares com base em seu pequeno tamanho. FSC-H vs. FSC-W foi usado para selecionar células únicas e excluir os dupletos. O total de leucócitos vivos foi então bloqueado com base em CD45.2 e coloração de viabilidade. Os linfócitos foram excluídos com base nas colorações NK1.1, CD4 e CD8; observe que em camundongos BALB/c, Asialo-GM1 e/ou DX5 podem ser usados para excluir células natural killer (NK), pois NK1.1 não é expresso em células NK derivadas de BALB/c. O CD11b foi então plotado contra o CD11c para identificar células dendríticas associadas a tumores (TADCs)/células dendríticas convencionais (cDCs).
As células negativas para CD11c representam as células mieloides em massa, que podem ser separadas com base na coloração Ly6C e Ly6G. As células que expressam níveis intermediários de Ly6C e altos níveis de Ly6G representam os neutrófilos. Essa população compartilha o mesmo fenótipo das células supressoras derivadas de mielóides granulocíticos (G-MDSCs). As células CD11b+ que coram negativo para Ly6G, mas positivo para Ly6C podem ser divididas em Ly6Chi, Ly6Cint e Ly6Clo. As célulasLy6C int/hi expressam níveis mais baixos de F4/80 e representam monócitos inflamatórios. No entanto, as células Ly6Chi também compartilham o mesmo fenótipo com as células supressoras derivadas de mielóides monocíticos (M-MDSCs). Finalmente, as célulasLy6C int expressam altos níveis de F4/80 e geralmente estão associadas a macrófagos associados a tumores (TAMs). Embora essa caracterização possa não identificar totalmente os subconjuntos de células mieloides de interesse, ela fornece uma estratégia útil para classificar as populações de células mieloides dentro do TME para análises funcionais ou genômicas adicionais. No contexto da imunoterapia, a terapia adotiva com células T incorporando drogas modificadoras epigenéticas, como o inibidor de histona desacetilase classe I (HDACi) MS-275, pode afetar o TME para promover regressão tumoral sustentada, enquanto sua ausência resulta em recidivatumoral 8.
Embora a análise de microarray do RNA tumoral em massa sugira um papel para as células mieloides infiltrantes de tumor, essa caracterização fenotípica não indicou grandes alterações nos marcadores de superfície durante o tratamento com MS-2758. Curiosamente, os marcadores funcionais presentes no painel de coloração por citometria de fluxo identificaram um certo subconjunto de células mieloides (CD11b + Ly6Chi Ly6G-) produzindo diferencialmente óxido nítrico sintase 2 (NOS2) e arginase 1 (Arg1), que são leituras implícitas de programação funcional polarizadora ou divergente ( Figura 3A ). Ao classificar as células CD11b + Ly6Chi Ly6G- de camundongos portadores de tumor tratados diferencialmente, estudos funcionais mais extensos podem ser realizados para entender seu papel. Usando a marcação de éster succinimidílico de carboxifluoresceína (CFSE) para monitorar a proliferação de linfócitos11, descobriu-se que células mielóides selecionadas derivadas de camundongos virgens e vacinados suprimem a proliferação de células T in vitro, enquanto células derivadas de camundongos vacinados + tratados com MS-275 reduziram a função imunossupressora ( Figura 3B ). A transferência adotiva dessas células revelou que elas possuíam capacidade antitumoral e promoviam regressão sustentada de tumores durante a vacinação e sobrevida prolongada de camundongos (Figura 3C).

Figura 1: Dados representativos mostrando a eficácia de diferentes condições de dissociação. Em camundongos C57BL/6 (n=3 por grupo), tumores intradérmicos B16F10-gp33 não tratados foram processados e dissociados sob várias condições enzimáticas antes da seleção de CD45.2. Acima estão mostradas as estratégias de cogating de citometria de fluxo usadas para demonstrar as diferenças de rendimento celular (FSC-A vs. SSC-A) ilustra o rendimento de leucócitos infiltrantes de tumor implicitamente pela discriminação de tamanho/granularidade celular. (CD11b vs. CD11c) permite a quantificação de células mieloides (CD11b+ ou CD11c+) ou não mieloides (CD11b-CD11c-). O erro é definido pelo erro padrão da média. Abreviaturas: CD = cluster de diferenciação; SSC-A = área de dispersão lateral; FSC-A = área de dispersão direta; FBS = soro fetal bovino. Clique aqui para ver uma versão maior desta figura.
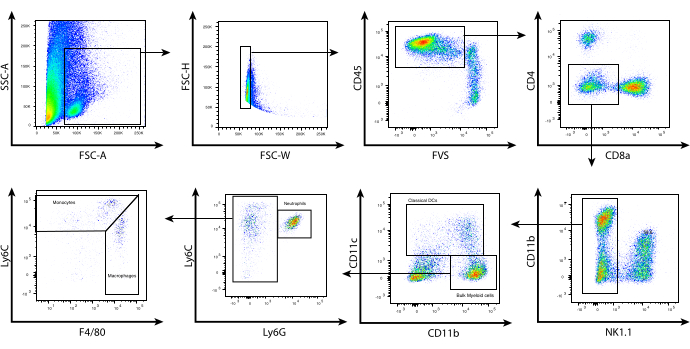
Figura 2: Análise de citometria de fluxo representativa de células mieloides infiltrantes de tumor. Após o processamento do tumor e a seleção de CD45.2, as células enriquecidas foram coradas superficialmente conforme descrito no protocolo. Mostrada acima é a estratégia de gating usada para excluir os linfócitos e identificar os subconjuntos individuais de células mieloides dentro do microambiente tumoral. Detritos (SSC-A vs. FSC-A) e dupletos (FSC-H vs. FSC-W) foram excluídos, e as células vivas CD45.2+ foram determinadas usando a coloração de viabilidade fixável FVS510 (CD45.2 vs. FVS). As células CD4+, CD8+, NK1.1+ foram fechadas. As células CD11bhi/lo CD11c+ representam cDCs. CD11b + CD11c- foram então subalternizados com base na expressão de Ly6C e Ly6G. Três populações foram identificadas: (i) Ly6Cint Ly6G+ (neutrófilos/G-MDSCs), (ii) Ly6Chi Ly6G- F4/80lo/int (monócitos/M-MDSCs), (iii) Ly6Clo/int Ly6G- F4/80hi (macrófagos/TAMs). Abreviaturas: CD = cluster de diferenciação; SSC-A = área de dispersão lateral; FSC-A = área de dispersão direta; FSC-H = altura de dispersão para frente; FSC-W = largura de dispersão direta; FVS = mancha de viabilidade corrigível; cDCs = células dendríticas convencionais; Ly = antígeno linfocitário; G-MDSCs = células supressoras derivadas de mielóides granulocíticos; M-MDSCs = células supressoras monocíticas derivadas de mieloides; TAMs = macrófagos associados a tumores. Clique aqui para ver uma versão maior desta figura.

Figura 3: Análises funcionais de células mieloides purificadas infiltrantes de tumores. Em camundongos C57BL/6 (n=3-5 por grupo), os tumores intradérmicos B16F10-gp33 não foram vacinados ou receberam terapia adotiva com células T na presença ou ausência do inibidor de HDAC, MS-275. Cinco dias após o tratamento, os tumores foram processados e enriquecidos positivamente para células CD11b+. As células foram coradas na superfície para subgate no subconjunto de células mielóides infiltrantes de tumor desejado (CD11b + Ly6Chi Ly6G-). (A) Essas células foram posteriormente coradas intracelularmente para marcadores que podem delinear a polaridade da ativação funcional, e os dados são apresentados como a frequência de células CD11b + Ly6Chi Ly6G- que produzem NOS2 ou Arg1. Alternativamente, as células mieloides enriquecidas com CD11b + coradas na superfície foram classificadas para obter uma população pura de células Ly6Chi Ly6G-. (B) Essas células purificadas foram pulsadas por peptídeos e cocultivadas com células T transgênicas TCR virgens marcadas com CFSE em proporções variadas. A diluição do CFSE, determinada por citometria de fluxo, é mostrada como um histograma representativo e quantificada pelo índice de divisão celular (1:1). (C) Células CD11b + Ly6Chi Ly6G- purificadas separadamente derivadas de camundongos portadores de tumor vacinados + tratados com MS-275 foram transferidas adotivamente para novos camundongos portadores de tumor (n = 5) em conjunto com vacinação e regressão tumoral, e as curvas de sobrevivência foram monitoradas. O erro é definido pelo erro padrão da média. p=0,0004, * p=0,0479, **** p<0,0001. Esta figura foi modificada de Nguyen et al. 8. Abreviaturas: CD = cluster de diferenciação; HDAC = inibidor da histona desacetilase; NOS2 = óxido nítrico sintase 2; Arg1 = arginase 1; CFSE = éster succinimidílico de carboxifluoresceína; TCR = receptor de células T; Ly = antígeno linfocitário; NS= não significativo. Clique aqui para ver uma versão maior desta figura.
Discussão
Embora as células mieloides infiltrantes de tumor existam em estados variados de ativação e diferenciação dentro do tumor, vários subconjuntos foram identificados, incluindo DCs associadas a tumores (TADCs), neutrófilos associados a tumores (TANs), células supressoras derivadas de mielóides (MDSCs) e macrófagos associados a tumores (TAMs) 12 . Infelizmente, a expressão sobreposta de marcadores de superfície celular usados para identificar esses subconjuntos de células mieloides torna atualmente desafiador diferenciar fenotipicamente as células mieloides tumorais de outras células mieloides13. Da mesma forma, as alterações fenotípicas induzidas pela terapia nas células mieloides infiltrantes de tumor podem não ser facilmente observadas com os painéis de coloração de anticorpos mieloides existentes. Em conjunto, a insuficiência de marcadores de superfície únicos complica a compreensão da biologia celular mieloide. Para delinear células mieloides naturais, tumorais e influenciadas pela terapia, a avaliação dos subconjuntos de células mieloides deve ser feita de acordo com sua função, além de suas características fenotípicas.
Os métodos aqui descritos para colher e dissociar o tecido tumoral permitem o isolamento de células mieloides com viabilidade preservada e integridade do marcador de superfície. Como as células mieloides infiltrantes de tumor são sensíveis à manipulação ex vivo 7, a ênfase do protocolo está na dissociação mecânica e enzimática menos agressiva. No entanto, dependendo do tipo de tecido tumoral, diferentes amostras requerem tratamento agressivo variável para gerar uma suspensão unicelular. Para modelos de tumor mais ricos em colágeno (ou seja, fibrossarcoma CMS5), um êmbolo de seringa pode ser usado além de uma tesoura para desagregar mecanicamente o tecido tumoral de forma mais completa antes do tratamento enzimático. Por outro lado, modelos de tumor menos ricos em colágeno (ou seja, melanoma B16) não requerem necessariamente tratamento enzimático. Conforme demonstrado nesses resultados, o tipo de preparação de colagenase e o lote do qual ela foi derivada podem influenciar significativamente a variedade e a potência das proteases às quais as células são expostas durante a dissociação enzimática.
Embora os leucócitos não mieloides (ou seja, linfócitos) não pareçam ser tão sensíveis, esses dados sugerem que as células mieloides, em particular, podem ser muito suscetíveis à exposição excessiva à protease (Figura 1), resultando em danos às proteínas da membrana e diminuição da viabilidade. Como resultado, o uso de colagenase tipo IV sobre colagenase tipo I é recomendado por sua atividade proteolítica específica da colagenase aumentada e pela incorporação de FBS na mistura de digestão para neutralizar a atividade tríptica residual. Além disso, a utilização de produtos de colagenase purificados, em oposição a preparações brutas de fontes comerciais, pode aumentar a reprodutibilidade da recuperação celular. Uma vez concluída a digestão, a adição de EDTA e a incubação a 4 °C são obrigatórias para quelar os íons Ca2+ e reduzir a temperatura necessária para a atividade da colagenase14.
Para caracterizar o infiltrado de células mieloides em uma população TIL heterogênea, estratégias de gating de alto nível foram fornecidas (Figura 2). O painel de citometria de fluxo policromático deve ser projetado de forma que 1) as células mortas e não mieloides sejam excluídas, 2) os subconjuntos de células mieloides possam ser identificados e 3) a funcionalidade alterada possa ser observada implicitamente em todos os grupos de amostras (Figura 3). Dependendo do número de subconjuntos de células mieloides de interesse e da profundidade da caracterização funcional, esses critérios podem não ser totalmente acomodados em um painel de coloração. Para liberar canais para o painel, os marcadores podem ser estrategicamente agrupados em um único canal de despejo. Embora esse método permita a análise de alta dimensão de células mieloides infiltrantes de tumores, ele ainda é limitado por um limite de parâmetro relativamente baixo. Tecnologias mais recentes que usam íons repórteres de metais pesados, como a citometria de massa, permitem até 40 parâmetros independentes em um único painel, o que permitirá um melhor estudo da diversidade celular e funcional das células mieloides dentro do TME15.
No entanto, o custo da instrumentação limita a onipresença de seu uso. A citometria de fluxo é mais acessível e produz dados de caracterização confiáveis, embora a mistura e a correspondência de marcadores em vários painéis exijam a validação do painel como uma etapa extremamente importante antes do experimento. Após a identificação de subconjuntos mieloides infiltrantes de tumor de interesse, vários pesquisadores15 descrevem técnicas para classificar essas células para ensaios e estudos funcionais. As células classificadas podem ser analisadas de forma confiável quanto à sua capacidade supressora de células T in vitro , bem como sua capacidade antitumoral in vivo após a transferência adotiva para modelos de camundongos de recidiva tumoral (Figura 3). No geral, a importância dos métodos descritos é que, em comparação com outros protocolos de isolamento TIL, as condições de colheita do tumor, dissociação, enriquecimento celular e classificação celular foram adaptadas para adquirir reprodutivelmente um alto rendimento do compartimento de células mielóides sobre todos os outros leucócitos e sem comprometer sua função.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi apoiado pelo Instituto de Pesquisa do Câncer de Ontário por meio de financiamento fornecido pelo Governo de Ontário, bem como pelos Institutos Canadenses de Pesquisa em Saúde (FRN 123516 e FRN 152954), pela Sociedade Canadense do Câncer (concessão 705143) e pelo Instituto de Pesquisa Terry Fox (TFRI-1073).
Materiais
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
Referências
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611(2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677(2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977(2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863(2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685(2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259(2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713(2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados