Method Article
Análisis funcional de células mieloides infiltrantes de tumores mediante citometría de flujo y transferencia adoptiva
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo proporciona métodos fiables de disociación de tumores sólidos y aislamiento de células mieloides en modelos tumorales intradérmicos o subcutáneos murinos. La citometría de flujo permite la caracterización fenotípica de poblaciones mieloides heterogéneas dentro del microambiente tumoral y la clasificación demostrará su funcionalidad en el contexto de la transferencia adoptiva.
Resumen
El compartimento de células mieloides infiltrantes del tumor representa una población heterogénea de células inmunosupresoras amplias que han sido explotadas por el tumor para apoyar su crecimiento. Su acumulación en el tejido tumoral y linfoide secundario conduce a la supresión de las respuestas inmunitarias antitumorales y, por lo tanto, es un objetivo para la intervención terapéutica. Como se sabe que el entorno local de citocinas puede dictar la programación funcional de las células mieloides infiltrantes de tumores, se han ideado estrategias para manipular el microambiente tumoral (TME) para expresar un paisaje de citocinas más propicio para la actividad de las células mieloides antitumorales. Para evaluar los cambios inducidos por la terapia en las células mieloides infiltrantes de tumores, este artículo describirá el procedimiento para disociar el tejido tumoral intradérmico/subcutáneo de ratones portadores de tumores sólidos en preparación para la recuperación de leucocitos. Se proporcionarán estrategias para el análisis de citometría de flujo que permitan la identificación de poblaciones mieloides heterogéneas dentro de leucocitos aislados y la caracterización de fenotipos mieloides únicos. Por último, en este artículo se describirá un medio para purificar células mieloides viables para ensayos funcionales y determinar su valor terapéutico en el contexto de la transferencia adoptiva.
Introducción
El microambiente tumoral (TME) está compuesto por células neoplásicas que proliferan rápidamente y un compartimento heterogéneo de células estromales circundantes. Dado que los tumores en crecimiento suelen estar mal vascularizados, la EMT es un sitio periférico caracterizado únicamente por hipoxia, privación de nutrientes y acidosis1. Para sobrevivir en este panorama, las respuestas al estrés tumoral y la reprogramación metabólica dan como resultado la secreción de factores solubles que promueven la remodelación tisular y la angiogénesis, así como el reclutamiento selectivo de células inmunitarias2. Dado que las células mieloides son uno de los tipos más abundantes de células hematopoyéticas en la TME, existe un creciente interés en examinar el papel de las células mieloides infiltrantes de tumores en la TME.
Las células mieloides son un grupo heterogéneo y plástico de células inmunitarias innatas que incluyen monocitos, macrófagos, células dendríticas y granulocitos. Aunque tienen un papel crítico en la homeostasis de los tejidos y en la regulación de la respuesta inmunitaria adaptativa, su función puede ser polarizante en función de la composición de las señales de activación dentro del microambiente local3. Los tumores se benefician de las características de las células mieloides a través de la secreción de factores solubles dentro de la TME. Estas señales alternativas pueden desviar la mielopoyesis hacia la diferenciación inmadura y sesgar la función de las células mieloides infiltrantes de tumores existentes3. De hecho, las células mieloides dentro de la TME a menudo promueven la progresión del cáncer y pueden suprimir las respuestas inmunitarias antitumorales, lo que provoca efectos adversos en la terapia contra el cáncer.
Aunque se ha demostrado que las estrategias terapéuticas que promueven el agotamiento de las células mieloides inmunosupresoras retrasan el crecimientotumoral 4, la falta de especificidad de la diana pone en riesgo la eliminación de las células mieloides inmunoestimuladoras, que, por el contrario, ayudan a la resolución del cáncer. Estas células mieloides inflamatorias pueden ejercer profundos efectos antitumorales, incluida la destrucción directa de células tumorales y la activación de células T CD8+ citotóxicas5. Por otra parte, las estrategias que normalizan la composición y función de las células mieloides en el TME han mostrado éxito terapéutico6; Sin embargo, los mecanismos biológicos que subyacen a su reeducación hacia un fenotipo antitumoral aún no se han comprendido completamente. En última instancia, es necesaria una caracterización completa de las células mieloides tumorales para mejorar aún más el tratamiento del cáncer.
Desafortunadamente, la desagregación reproducible de tumores para el aislamiento de células mieloides es un desafío. Las células mieloides derivadas de tumores son sensibles a la manipulación ex vivo en comparación con otros subconjuntos de leucocitos, y la agresividad del procesamiento tumoral puede conducir a la escisión enzimática del epítopo y a una reducción de la viabilidad de las células recuperadas7. El propósito de este método es proporcionar un medio confiable de disociación tumoral para preservar la integridad del marcador de superficie para el análisis y la vitalidad celular para el estudio funcional. En comparación con los protocolos de aislamiento de leucocitos infiltrantes tumorales (TIL) que favorecen mezclas enzimáticas más duras para mejorar la liberación reproducible de varios subconjuntos celulares, este método favorece una digestión enzimática más conservadora para maximizar la recuperación de las células mieloides. También se proporcionan estrategias de compuerta de flujo multicolor de alto nivel para identificar subconjuntos de células mieloides tumorales murinas para su posterior caracterización y/o clasificación.
Protocolo
NOTA: Todos los estudios en animales cumplieron con las pautas del Consejo Canadiense de Cuidado Animal y fueron aprobados por la Junta de Ética de Investigación Animal de la Universidad McMaster.
1. Recolección y disociación tumoral
- Inocular a ratones hembra C57BL/6 de 6-8 semanas de edad por vía intradérmica/subcutánea con 2 células de melanoma × 105 B16 según lo descrito por Nguyen et al.8 Permita que los tumores crezcan durante 7 días antes de la recolección.
- Eutanasia al ratón por dislocación cervical mientras se asegura de no interrumpir el tumor al hacerlo. Rocíe el ratón con etanol al 70% antes de cosechar.
- Con un bisturí y unas tijeras, extirpe quirúrgicamente el tumor intradérmico/subcutáneo del tejido circundante (incluidos los ganglios linfáticos adheridos que drenan el tumor) y coloque los tumores en un tubo de microfuga previamente pesado. Mantener en hielo.
NOTA: Realice la recolección de tumores en un gabinete de bioseguridad para uso animal. Use un tubo cónico de 15 ml para tumores más grandes. - Pesar los tumores y agregar 500 μL de medio RPMI-1640 con 10% de suero fetal bovino (FBS) a cada tubo, usando tijeras para cortar los tumores en pedazos pequeños dentro del tubo o en una placa de 6 pocillos.
NOTA: Las piezas tumorales deben ser lo suficientemente pequeñas como para ser mezcladas por una pipeta eléctrica una vez que se haya agregado el medio de digestión. - Prepare la mezcla de disociación disolviendo colagenasa tipo IV a 0,5 mg/mL y DNasa a 0,2 mg/mL en medio RPMI-1640 con 10% de FBS y 5 mM de cloruro de calcio.
NOTA: La mezcla de disociación debe prepararse fresca para maximizar la actividad de la colagenasa. - Transfiera la suspensión tumoral picada a un tubo cónico de 15 mL y agregue 10 mL de mezcla de disociación por 0,25 mg de tumor. Coloque el tubo en un agitador orbital con control de temperatura durante 30 min a 37 °C con agitación de 200 rpm. Neutralizar la actividad de la colagenasa añadiendo dos volúmenes de medio frío RPMI-1640 con 10% de FBS y 2 mM de ácido etilendiaminérgico tetraacético (EDTA), y refrigerar durante 10 min a 4 °C.
- Realice un vórtice breve y pipetee la suspensión en un filtro de 40 μm en un tubo cónico de 50 mL. Use un émbolo de jeringa y un medio neutralizante para disgregar el tejido tumoral residual y lávelo a través del colador. Centrifugar la suspensión durante 5 min (500 × g, 4 °C), desechar el sobrenadante y volver a suspender el pellet en solución salina tamponada con fosfato (PBS) con 2% de FBS y 1 mM de EDTA.
2. Enriquecimiento de TIL y tinción por citometría de flujo (FACS)
- Para enriquecer los TIL para la caracterización de células mieloides, utilice un kit de separación de células magnéticas diseñado para la selección de biotina positiva con anticuerpos CD45.2 biotinilados de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales).
- Vuelva a suspender las células en 200 μL de tampón FACS (PBS con albúmina sérica bovina (BSA) al 0,5% p/v) y transfiéralas a una placa de fondo en U de 96 pocillos.
NOTA: No exceda una concentración de tinción de 1 × 108 células/mL. Ajuste el volumen y divida las muestras en varios pocillos para compensar el alto número de celdas. - Centrifugar la placa durante 5 min (500 × g, 4 °C) y desechar el sobrenadante. Añadir 50 μL de solución en bloque de Fc (dilución 1:200 de CD16/CD32 anti-ratón de rata purificado [ver la Tabla de Materiales] en tampón FACS, concentración final de 2,5 μg/mL), y resuspender las células mediante pipeteo. Incubar durante 10 min a 4 °C.
- Añadir 50 μL de tampón FACS que contiene una concentración 2x de anticuerpo que teñe la superficie (dilución 1:50 de CD45.2, NK1.1, CD11c, F4/80, CD8a, Ly6C, CD11b, CD4, Ly6G) y tinción de viabilidad fijable (FVS, dilución 1:500), y mezclar las células mediante pipeteo. Incubar durante 20 min a 4 °C.
NOTA: Cubra la placa con papel de aluminio para minimizar la exposición a la luz. Los anticuerpos deben valorarse antes del experimento para determinar empíricamente la dilución óptima. - Lave las células dos veces añadiendo 200 μL de tampón FACS a cada pocillo, centrifugando la suspensión (5 min, 500 × g, 4 °C) y desechando el sobrenadante.
- Añadir 100 μL de solución de fijación/permeabilización (ver la Tabla de Materiales) a cada pocillo, mezclar las células por pipeteo e incubar durante 20 min a 4 °C.
- Añada 100 μL de tampón de permeabilización 1x (consulte la Tabla de materiales) a cada pocillo, centrifugue la placa durante 5 min (500 × g, 4 °C) y deseche el sobrenadante.
- Lave las células añadiendo 200 μL de tampón de permeabilización 1x a cada pocillo, centrifugando la suspensión (5 min, 500 × g, 4 °C) y desechando el sobrenadante.
NOTA: El experimento se puede pausar durante la noche después de volver a suspender las células en el tampón de permeabilización. Almacene la muestra a 4 °C y protéjala de la luz. Reanude después de mezclar brevemente las células antes de centrifugar. - Añadir 100 μL de tampón de permeabilización que contenga 1x concentración de anticuerpo de tinción intracelular (dilución 1:100 de óxido nítrico sintasa 2 (NOS2), arginasa 1 (Arg1)), y mezclar las células mediante pipeteo. Incubar durante 20 min a 4 °C.
NOTA: Cubra la placa con papel de aluminio para minimizar la exposición a la luz. Los anticuerpos deben valorarse antes del experimento para determinar empíricamente la dilución óptima. - Añada 100 μL de tampón de permeabilización 1x a cada pocillo, centrifugue la placa durante 5 min (500 × g, 4 °C) y deseche el sobrenadante.
- Lavar las células añadiendo 200 μL de tampón de permeabilización 1x a cada pocillo, centrifugando la suspensión (5 min, 500 × g, 4 °C) y desechando el sobrenadante.
- Vuelva a suspender las células en 300 μL de tampón FACS. Filtre la muestra a través de un tubo de poliestireno de fondo redondo de 5 mL con tapón de filtro de 40 μm antes de realizar el análisis de citometría de flujo.
3. Clasificación de células mieloides tumorales para estudios funcionales
- Después de identificar las poblaciones de células mieloides deseadas mediante un análisis de citometría de flujo, enriquezca previamente las células mieloides a granel para clasificarlas con un kit de separación de células magnéticas diseñado para la selección de CD11b o CD11c positivo de acuerdo con las instrucciones del fabricante (consulte la Tabla de materiales).
- Utilizando anticuerpos de tinción de superficie específicos para los subconjuntos de células mieloides deseados (dilución 1:100 de CD11b, Ly6C, Ly6G), tiñe las células preenriquecidas como se describe en los pasos 2.2-2.5.
NOTA: Incluya una tinción de viabilidad fijable para garantizar la clasificación de las células mieloides vivas. No exceda una concentración de tinción de 1 × 108 células/mL. Ajuste el volumen y divida las muestras en varios pocillos para compensar el alto número de celdas. - Vuelva a suspender las células en un tampón de clasificación en frío (PBS con 1% p/v de BSA, 25 mM de ácido 4-(2-hidroxietil)-1-piperazinenetanosulfónico (HEPES) y 1 mM de EDTA). Filtre la muestra a través de un tubo de polipropileno de fondo redondo de 5 mL con un tapón colador de 40 μm. Mantenga las celdas en hielo y cubra el tubo con papel de aluminio.
NOTA: Ajuste la concentración de células/volumen a la especificación deseada del instrumento para la clasificación. - Prepare un tubo de recolección de muestras con medio de captura (tubo de polipropileno de fondo redondo de 5 mL que contiene PBS con 50% de FBS).
NOTA: Cubra los tubos con medio de captura de 5 mL durante la noche antes de clasificarlos. Deseche todo menos 1-2 mL del medio de captura al día siguiente antes de analizar la muestra. - Modifique la configuración del instrumento clasificador para disminuir la presión de la muestra y evitar perturbaciones en la formación de gotas. Equipe la punta de la boquilla de 130 μm y utilice la configuración de 10 psi. Ejecute la muestra a un caudal bajo con agitación periódica de la muestra a 100 rpm, asegurándose de que la deposición de gotas esté en el centro del tubo. Después de la clasificación, mantenga la muestra en hielo.
- Incubar la muestra durante 10 min a 4 °C. Centrifugar el tubo durante 5 min (500 × g, 4 °C), desechar el sobrenadante y volver a suspender el pellet en el medio deseado para ensayos funcionales o transferencia adoptiva.
4. Transferencia adoptiva de células mieloides tumorales purificadas
- Inocular por vía intradérmica a ratones C57BL/6 hembras de 6 a 8 semanas de edad con 1 × 106 células tumorales de melanoma B16 resuspendidas en 30 μL de PBS.
NOTA: Inocular a los ratones con anticipación de manera que el crecimiento del tumor no exceda los 100mm3 en el momento de la transferencia adoptiva. - Vuelva a suspender las células mieloides tumorales clasificadas en PBS con 25 mM de HEPES y 1 mM de EDTA a una concentración de 2 × 106 células/mL. Filtre la muestra a través de un tubo de poliestireno de fondo redondo de 5 mL con un tapón colador de 40 μm. Mantener en hielo.
- Inducir y mantener ratones bajo anestesia con isoflurano al 3%. Aplique ungüento oftálmico para prevenir la sequedad/lesión ocular.
- Cargue una jeringa de 31 G con 50 μL de suspensión celular. Desaloje las burbujas de aire moviendo suavemente la jeringa. Limpie el lugar de la inyección con un hisopo con alcohol.
- Con pinzas estériles, levante la piel en la base del tumor. Inserte la aguja en el espacio subcutáneo en un ligero ángulo hacia arriba para ingresar al tumor desde debajo de la piel. Use las pinzas para pellizcar la piel que rodea la aguja y dispense lentamente el volumen de la jeringa. Continúe pellizcando la piel con las pinzas mientras retira la aguja lentamente, y use un hisopo de algodón para limpiar las posibles fugas.
NOTA: Proceda con cualquier tratamiento terapéutico adicional si lo desea. - Permita que los ratones se recuperen de la anestesia.
Resultados
Los resultados demuestran que este método produce un alto rendimiento de células mieloides procedentes de tumores murinos sólidos. La preservación de la integridad del receptor y la viabilidad celular facilita el análisis funcional fiable de los subconjuntos mieloides deseados. Estas mejoras en el aislamiento de células mieloides permitieron el discernimiento de la función cambiante de las células mieloides intratumorales tras la normalización de la TME con el inhibidor de la histona desacetilasa de clase I (HDACi), MS-275, durante la terapia adoptiva de células T. Por lo general, los protocolos de aislamiento de TIL no toman las medidas necesarias para maximizar el rendimiento de las células mieloides9. Como resultado, la digestión enzimática suele ser demasiado dura y conduce a una pérdida de viabilidad de la muestra. Cuando los tumores de melanoma B16 se trataron con colagenasa tipo I durante 1 h (una afección de uso común) antes de enriquecer positivamente para las células CD45.2+ mediante selección magnética, la morfología (área de dispersión directa (FSC-A) frente a área de dispersión lateral (SSC-A)) y la subgación de células mieloides (CD11b frente a CD11c) indicaron que el rendimiento de las células mieloides (CD11b+ o CD11c+) y las células no mieloides (CD11b-CD11c-) fue extremadamente bajo (Figura 1). Para reducir la actividad específica potencialmente excesiva de la colagenasa, la duración de la digestión tumoral se redujo a 30 min. Si bien hubo una ligera mejora en la recuperación de las células mieloides, el rendimiento general siguió siendo bajo y no hubo ninguna mejora en la recuperación de las células no mieloides.
Debido a que la variación del lote puede introducir proteasas con una actividad específica lo suficientemente alta como para causar una muerte celular excesiva, se solicitó un lote separado de colagenasa tipo I a un proveedor comercial diferente para comparar. Curiosamente, el rendimiento general de células mieloides y no mieloides fue mucho mayor, con un ligero aumento en el número de células mieloides tras la adición de FBS. Aunque se añadió FBS para estabilizar las células mieloides al daño inducido por la colagenasa, esto planteó la cuestión de si el FBS también estaba neutralizando la actividad tríptica de la preparación de colagenasa tipo I, lo que podría estar perjudicando la recuperación celular. Dado que las preparaciones de colagenasa tipo I tienen colagenasa, caseinasa, clostripaina y actividades trípticas10, para reducir la exposición a la proteasa, se intentó la digestión utilizando colagenasa tipo IV, que tiene mayor actividad específica de colagenasa y menor actividad tríptica. Esta condición resultó en un mayor aumento en el rendimiento de las células mieloides, y la adición de FBS resultó en el rendimiento más alto. Curiosamente, la colagenasa tipo I y tipo IV, con o sin FBS, no cambió notablemente el rendimiento general de las células no mieloides.
Con estas condiciones de digestión enzimática optimizadas, se aislaron leucocitos de tumores murinos de melanoma B16 y se utilizó citometría de flujo para fenotipar las diferentes poblaciones de células mieloides dentro del TME en función de su expresión de marcadores de superficie. Los tumores se recolectaron y procesaron y los leucocitos se aislaron mediante un kit de selección magnética CD45.2. A continuación, las células se tiñeron utilizando un panel cuidadosamente diseñado de marcadores de superficie celular (Figura 2). La estrategia de compuerta descrita aquí comienza con una evaluación morfológica de las células utilizando FSC-A frente a SSC-A . Esto permite excluir los desechos celulares en función de su pequeño tamaño. Se utilizó FSC-H vs. FSC-W para seleccionar celdas individuales y excluir los dobletes. A continuación, se controlaron los leucocitos vivos totales con base en CD45.2 y la tinción de viabilidad. Los linfocitos se excluyeron según la tinción de NK1.1, CD4 y CD8; Tenga en cuenta que en ratones BALB/c, Asialo-GM1 y/o DX5 se pueden usar para excluir las células asesinas naturales (NK), ya que NK1.1 no se expresa en las células NK derivadas de BALB/c. A continuación, se trazó CD11b contra CD11c para identificar las células dendríticas asociadas a tumores (TADC)/células dendríticas convencionales (cDC).
Las células negativas para CD11c representan las células mieloides a granel, que se pueden separar aún más en función de la tinción con Ly6C y Ly6G. Las células que expresan niveles intermedios de Ly6C y niveles altos de Ly6G representan a los neutrófilos. Esta población comparte el mismo fenotipo que las células supresoras derivadas de mieloides granulocíticos (G-MDSC). Las células CD11b+ que dan negativo para Ly6G, pero positivo para Ly6C, se pueden dividir en Ly6Chi, Ly6Cint y Ly6Clo. Las célulasLy6C int/hi expresan niveles más bajos de F4/80 y representan monocitos inflamatorios. Sin embargo, las célulashi Ly6C también comparten el mismo fenotipo que las células supresoras derivadas de mieloides monocíticos (M-MDSC). Por último, las célulasint Ly6C expresan altos niveles de F4/80 y suelen estar asociadas a macrófagos asociados a tumores (TAM). Si bien es posible que esta caracterización no identifique completamente los subconjuntos de células mieloides de interés, proporciona una estrategia de compuerta útil para clasificar las poblaciones de células mieloides dentro del TME para análisis funcionales o genómicos adicionales. En el contexto de la inmunoterapia, la terapia adoptiva de células T que incorpora fármacos modificadores epigenéticos, como el inhibidor de la histona desacetilasa de clase I (HDACi) MS-275, puede afectar a la TME para promover la regresión tumoral sostenida, mientras que su ausencia da lugar a una recaída tumoral8.
Aunque el análisis de microarrays de ARN tumoral a granel sugiere un papel para las células mieloides infiltrantes del tumor, esta caracterización fenotípica no indicó cambios importantes en los marcadores de superficie durante el tratamiento con MS-2758. Curiosamente, los marcadores funcionales presentes en el panel de tinción de citometría de flujo identificaron un cierto subconjunto de células mieloides (CD11b+ Ly6Chi Ly6G-) que producen diferencialmente óxido nítrico sintasa 2 (NOS2) y arginasa 1 (Arg1), que son lecturas implícitas de programación funcional polarizada o divergente (Figura 3A). Al separar las células CD11b+ Ly6Chi Ly6G- de ratones portadores de tumores tratados diferencialmente, se podrían realizar estudios funcionales más extensos para comprender su papel. Utilizando el marcaje del éster de carboxifluoresceína succinimidilo (CFSE) para monitorizar la proliferación de linfocitos11, se descubrió que las células mieloides clasificadas derivadas de ratones naïve y vacunados suprimían la proliferación de células T in vitro, mientras que las células derivadas de ratones vacunados + tratados con MS-275 tenían una función inmunosupresora reducida (Figura 3B). La transferencia adoptiva de estas células reveló que, en cambio, poseían capacidad antitumoral y promovían la regresión sostenida de los tumores durante la vacunación y prolongaban la supervivencia de los ratones (Figura 3C).

Figura 1: Datos representativos que muestran la efectividad de diferentes condiciones de disociación. En ratones C57BL/6 (n = 3 por grupo), los tumores intradérmicos B16F10-gp33 no tratados se procesaron y disociaron en diversas condiciones enzimáticas antes de la selección de CD45.2. Arriba se muestran las estrategias de activación por citometría de flujo utilizadas para demostrar las diferencias de rendimiento celular (FSC-A vs. SSC-A) ilustra el rendimiento de los leucocitos infiltrantes tumorales implícitamente mediante la discriminación entre el tamaño de la célula y la granularidad. (CD11b vs. CD11c) permite la cuantificación de células mieloides (CD11b+ o CD11c+) o no mieloides (CD11b-CD11c-). El error se define por el error estándar de la media. Abreviaturas: CD = grupo de diferenciación; SSC-A = área de dispersión lateral; FSC-A = área de dispersión hacia adelante; FBS = suero fetal bovino. Haga clic aquí para ver una versión más grande de esta figura.
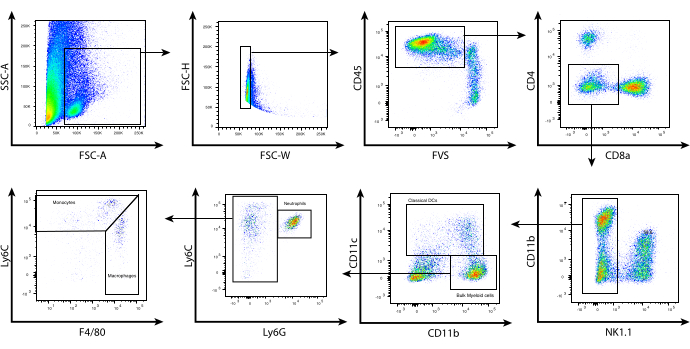
Figura 2: Análisis representativo de citometría de flujo de células mieloides infiltrantes de tumores. Tras el procesamiento tumoral y la selección de CD45.2, las células enriquecidas se tiñeron en la superficie como se describe en el protocolo. Arriba se muestra la estrategia de compuerta utilizada para excluir los linfocitos e identificar los subconjuntos individuales de células mieloides dentro del microambiente tumoral. Escombros (SSC-A vs. FSC-A) y dobletes (FSC-H vs. FSC-W), y se determinaron las células vivas CD45.2+ mediante la tinción de viabilidad fijable FVS510 (CD45.2 vs. FVS). Las células CD4+, CD8+, NK1.1+ fueron compuertas. Las células CD11bhi/lo CD11c+ representan cDC. A continuación, CD11b+ CD11c- se subgaron en función de la expresión de Ly6C y Ly6G. Se identificaron tres poblaciones: (i) Ly6Cint Ly6G+ (neutrófilos/G-MDSC), (ii) Ly6Chi Ly6G- F4/80lo/int (monocitos/M-MDSCCs), (iii) Ly6Clo/int Ly6G- F4/80hi (macrófagos/TAMs). Abreviaturas: CD = grupo de diferenciación; SSC-A = área de dispersión lateral; FSC-A = área de dispersión hacia adelante; FSC-H = altura de dispersión hacia adelante; FSC-W = anchura de dispersión hacia adelante; FVS = mancha de viabilidad fijable; cDCs = células dendríticas convencionales; Ly = antígeno linfocitario; G-MDSCs = células supresoras derivadas de mieloides granulocíticos; M-MDSCs = células supresoras monocíticas derivadas de mieloides; TAMs= macrófagos asociados a tumores. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Análisis funcional de células mieloides tumorales purificadas. En los ratones C57BL/6 (n = 3-5 por grupo), los tumores intradérmicos B16F10-gp33 no estaban vacunados o se les administró terapia adoptiva de células T en presencia o ausencia del inhibidor de HDAC, MS-275. Cinco días después del tratamiento, los tumores fueron procesados y enriquecidos positivamente para células CD11b+. Las células se tiñeron en la superficie para subcompuerta en el subconjunto deseado de células mieloides infiltrantes del tumor (CD11b+, Ly6C, hi, Ly6G-). (A) Estas células se tiñeron intracelularmente en busca de marcadores que puedan delinear la polaridad de la activación funcional, y los datos se presentan como la frecuencia de células CD11b+ Ly6Chi Ly6G- que producen NOS2 o Arg1. Alternativamente, las células mieloides enriquecidas con CD11b+ teñidas en superficie se clasificaron para obtener una población pura de células Ly6Chi Ly6G-. (B) Estas células purificadas fueron pulsadas por péptidos y cocultivadas con células T transgénicas TCR vírgenes marcadas con CFSE en proporciones variables. La dilución de CFSE, determinada por citometría de flujo, se muestra como un histograma representativo y se cuantifica mediante el índice de división celular (1:1). (C) Las células CD11b+ Ly6Chi Ly6G- purificadas por separado, derivadas de ratones portadores de tumores vacunados + tratados con MS-275, se transfirieron adoptivamente a nuevos ratones portadores de tumores (n = 5) junto con la vacunación y la regresión tumoral, y se monitorizaron las curvas de supervivencia. El error se define por el error estándar de la media. p=0,0004, * p=0,0479, **** p<0,0001. Esta cifra ha sido modificada de Nguyen et al. 8. Abreviaturas: CD = grupo de diferenciación; HDAC = inhibidor de la histona desacetilasa; NOS2 = óxido nítrico sintasa 2; Arg1 = arginasa 1 ; CFSE = éster de carboxifluoresceína succinimidilo; TCR = receptor de células T; Ly = antígeno linfocitario; NS= no significativo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aunque las células mieloides infiltrantes de tumores existen en diferentes estados de activación y diferenciación dentro del tumor, se han identificado varios subconjuntos, entre los que se incluyen las CD asociadas al tumor (TADC), los neutrófilos asociados al tumor (TAN), las células supresoras derivadas de mieloides (MDSC) y los macrófagos asociados al tumor (TAM)12. Desafortunadamente, la expresión superpuesta de los marcadores de la superficie celular utilizados para identificar estos subconjuntos de células mieloides hace que actualmente sea un desafío diferenciar fenotípicamente las células mieloides tumorales de otras células mieloides13. De manera similar, es posible que los cambios fenotípicos inducidos por el tratamiento en las células mieloides infiltrantes del tumor no se observen fácilmente con los paneles de tinción de anticuerpos mieloides existentes. En conjunto, la insuficiencia de marcadores de superficie únicos complica la comprensión de la biología de las células mieloides. Para delinear las células mieloides naturales, impulsadas por tumores e influenciadas por la terapia, la evaluación de los subconjuntos de células mieloides debe realizarse de acuerdo con su función, además de sus características fenotípicas.
Los métodos descritos en este documento para recolectar y disociar tejido tumoral permiten el aislamiento de células mieloides con viabilidad preservada e integridad de marcadores de superficie. Dado que las células mieloides infiltrantes del tumor son sensibles a la manipulación ex vivo 7, el énfasis del protocolo está en la disociación mecánica y enzimática menos agresiva. Sin embargo, dependiendo del tipo de tejido tumoral, las diferentes muestras requieren un tratamiento agresivo variable para generar una suspensión unicelular. Para modelos tumorales más ricos en colágeno (es decir, fibrosarcoma CMS5), se podría usar un émbolo de jeringa además de unas tijeras para desagregar el tejido tumoral de manera más mecánica antes del tratamiento enzimático. Por el contrario, los modelos tumorales menos ricos en colágeno (es decir, el melanoma B16) no requieren necesariamente tratamiento enzimático. Como se demuestra en estos resultados, el tipo de preparación de colagenasa y el lote del que se deriva pueden influir significativamente en la variedad y potencia de las proteasas a las que están expuestas las células durante la disociación enzimática.
Si bien los leucocitos no mieloides (es decir, los linfocitos) no parecen ser tan sensibles, estos datos sugieren que las células mieloides, en particular, pueden ser muy susceptibles a la exposición excesiva a la proteasa (Figura 1), lo que resulta en daño a las proteínas de la membrana y disminución de la viabilidad. Como resultado, se recomienda el uso de colagenasa tipo IV sobre colagenasa tipo I por su mayor actividad proteolítica específica de colagenasa y la incorporación de FBS en la mezcla de digestión para neutralizar la actividad tríptica residual. Además, el uso de productos de colagenasa purificados, en lugar de preparaciones crudas de fuentes comerciales, puede aumentar la reproducibilidad de la recuperación celular. Una vez finalizada la digestión, la adición de EDTA y la incubación a 4 °C es obligatoria para quelar los iones Ca2+ y reducir la temperatura necesaria para la actividad de la colagenasa14.
Para caracterizar el infiltrado de células mieloides dentro de una población heterogénea de TIL, se han proporcionado estrategias de compuerta de alto nivel (Figura 2). El panel de citometría de flujo policromática debe diseñarse de tal manera que 1) se excluyan las células muertas y no mieloides, 2) se puedan identificar subconjuntos de células mieloides y 3) se pueda observar implícitamente una funcionalidad alterada en grupos de muestras (Figura 3). Dependiendo del número de subconjuntos de células mieloides de interés y de la profundidad de la caracterización funcional, es posible que estos criterios no se adapten completamente dentro de un panel de tinción. Para liberar canales para el panel, los marcadores podrían agruparse estratégicamente en un solo canal de volcado. Aunque este método permite el análisis de alta dimensión de las células mieloides infiltrantes de tumores, todavía está limitado por un límite de parámetros relativamente bajo. Las tecnologías más recientes que utilizan iones reporteros de metales pesados, como la citometría de masas, permiten hasta 40 parámetros independientes dentro de un solo panel, lo que permitirá un mejor estudio de la diversidad celular y funcional de las células mieloides dentro del TME15.
Sin embargo, el costo de la instrumentación limita la ubicuidad de su uso. La citometría de flujo es más accesible y produce datos de caracterización fiables, aunque la mezcla y la coincidencia de marcadores en múltiples paneles requiere la validación del panel como un paso extremadamente importante antes del experimento. Tras la identificación de subconjuntos de mieloides infiltrantes tumorales de interés, varios investigadores15 describen técnicas para clasificar estas células para ensayos y estudios funcionales. Las células clasificadas pueden analizarse de forma fiable para determinar su capacidad supresora de células T in vitro , así como su capacidad antitumoral in vivo después de transferirlas adoptivamente a modelos de ratón de recaída tumoral (Figura 3). En general, la importancia de los métodos descritos es que, en comparación con otros protocolos de aislamiento de TIL, las condiciones de recolección tumoral, disociación, enriquecimiento celular y clasificación celular se adaptaron para adquirir de manera reproducible un alto rendimiento del compartimento de células mieloides sobre todos los demás leucocitos y sin comprometer su función.
Divulgaciones
No se han declarado conflictos de interés.
Agradecimientos
Este trabajo fue apoyado por el Instituto de Ontario para la Investigación del Cáncer a través de fondos proporcionados por el Gobierno de Ontario, así como por los Institutos Canadienses de Investigación en Salud (FRN 123516 y FRN 152954), la Sociedad Canadiense del Cáncer (subvención 705143) y el Instituto de Investigación Terry Fox (TFRI-1073).
Materiales
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
Referencias
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611 (2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677 (2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977 (2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863 (2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685 (2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259 (2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713 (2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados