Method Article
ניתוח פונקציונלי של תאים מיאלואידים חודרים לגידול על ידי ציטומטריית זרימה והעברה מאמצת
* These authors contributed equally
In This Article
Summary
פרוטוקול זה מספק שיטות אמינות לדיסוציאציה של גידול מוצק ובידוד תאים מיאלואידים במודלים של גידולים תוך-עוריים או תת עוריים של עכברים. זרימה ציטומטרית מאפשרת אפיון פנוטיפי של אוכלוסיות מיאלואידיות הטרוגניות בתוך המיקרו-סביבה של הגידול ומיון ידגים את הפונקציונליות שלהן בהקשר של העברה מאמצת.
Abstract
תא התאים המיאלואידים החודר לגידול מייצג אוכלוסייה הטרוגנית של תאים מדכאי חיסון נרחבים שנוצלו על ידי הגידול כדי לתמוך בצמיחתו. הצטברותם בגידול וברקמת לימפה משנית מובילה לדיכוי תגובות חיסוניות אנטי-גידוליות ולכן מהווה יעד להתערבות טיפולית. מכיוון שידוע שסביבת הציטוקינים המקומית יכולה להכתיב את התכנות התפקודי של תאים מיאלואידים חודרים לגידול, תוכננו אסטרטגיות למניפולציה של המיקרו-סביבה של הגידול (TME) כדי לבטא נוף ציטוקינים התורם יותר לפעילות תאים מיאלואידים אנטי-גידוליים. כדי להעריך שינויים הנגרמים על ידי טיפול בתאים מיאלואידים חודרים לגידול, מאמר זה יתאר את ההליך לניתוק רקמת גידול תוך-עורית/תת עורית מעכברים מוצקים נושאי גידול כהכנה להתאוששות לויקוציטים. יינתנו אסטרטגיות לניתוח זרימה ציטומטרי כדי לאפשר זיהוי של אוכלוסיות מיאלואידיות הטרוגניות בתוך לויקוציטים מבודדים ואפיון של פנוטיפים מיאלואידים ייחודיים. לבסוף, מאמר זה יתאר אמצעי לטיהור תאים מיאלואידים ברי קיימא לבדיקות תפקודיות וקביעת ערכם הטיפולי בהקשר של העברה לאימוץ.
Introduction
המיקרו-סביבה של הגידול (TME) מורכבת מתאים ניאופלסטיים המתרבים במהירות ותא תאי סטרומה הטרוגני מסביב. מכיוון שגידולים גדלים הם לרוב בעלי כלי דם גרועים, ה-TME הוא אתר היקפי המאופיין באופן ייחודי בהיפוקסיה, מחסור בחומרים מזינים וחמצת1. כדי לשרוד בנוף זה, תגובות עקה של גידול ותכנות מחדש מטבולי מביאות להפרשת גורמים מסיסים המקדמים עיצוב מחדש של רקמות ואנגיוגנזה, כמו גם גיוס סלקטיבי של תאי חיסון2. מכיוון שתאים מיאלואידים הם אחד הסוגים הנפוצים ביותר של תאים המטופויאטיים ב-TME, יש עניין גובר בבחינת תפקידם של תאים מיאלואידים חודרים לגידול ב-TME.
תאים מיאלואידים הם קבוצה הטרוגנית ופלסטית של תאי חיסון מולדים כולל מונוציטים, מקרופאגים, תאים דנדריטיים וגרנולוציטים. למרות שיש להם תפקידים קריטיים בהומאוסטזיס של רקמות ובוויסות תגובה חיסונית אדפטיבית, תפקודם יכול להיות מקטב בהתאם להרכב אותות ההפעלה בתוך המיקרו-סביבה המקומית3. גידולים מנצלים את מאפייני התאים המיאלואידים באמצעות הפרשת גורמים מסיסים בתוך ה-TME. אותות חלופיים אלה יכולים להסיט מיאלופואזיס לעבר התמיינות לא בשלה ולהטות את תפקודם של תאים מיאלואידים חודרים לגידול3. ואכן, תאים מיאלואידים בתוך TME מקדמים לעתים קרובות את התקדמות הסרטן ויכולים לדכא תגובות חיסוניות אנטי-גידוליות, מה שמוביל להשפעות שליליות על הטיפול בסרטן.
למרות שהוכח כי אסטרטגיות טיפוליות המקדמות את דלדול התאים המיאלואידים המדכאים את מערכת החיסון מעכבות את צמיחת הגידול4, היעדר ספציפיות המטרה מסכן את הסרת התאים המיאלואידים החיסוניים, אשר בניגוד לכך, מסייעים ברזולוציה של סרטן. תאים מיאלואידים דלקתיים אלה יכולים להפעיל השפעות אנטי-גידוליות עמוקות כולל הרג ישיר של תאי גידול והפעלה של תאי CD8+ T ציטוטוקסיים5. לחלופין, אסטרטגיות המנרמלות את ההרכב והתפקוד של תאים מיאלואידים ב-TME הראו הצלחה טיפולית6; עם זאת, המנגנונים הביולוגיים העומדים בבסיס החינוך מחדש שלהם לפנוטיפ אנטי-גידולי עדיין לא הובנו במלואם. בסופו של דבר, אפיון מקיף של תאים מיאלואידים של הגידול נחוץ לשיפור נוסף של הטיפול בסרטן.
למרבה הצער, פירוק ניתן לשחזור של גידולים לבידוד תאים מיאלואידים הוא מאתגר. תאים מיאלואידים שמקורם בגידול רגישים למניפולציה ex vivo בהשוואה לתת-קבוצות לויקוציטים אחרות, והאגרסיביות של עיבוד הגידול עלולה להוביל למחשוף אפיטופ אנזימטי ולהפחתת הכדאיות של תאים משוחזרים7. מטרת שיטה זו היא לספק אמצעי אמין לדיסוציאציה של גידול כדי לשמר את שלמות סמני פני השטח לניתוח וחיוניות תאית למחקר פונקציונלי. בהשוואה לפרוטוקולי בידוד לויקוציטים חודרים לגידול (TIL) המעדיפים תערובות אנזימטיות קשות יותר כדי לשפר את השחרור הניתן לשחזור של תת-קבוצות תאיות שונות, שיטה זו מעדיפה עיכול אנזימטי שמרני יותר כדי למקסם את התאוששות התאים המיאלואידים. אסטרטגיות שער זרימה מרובות צבעים ברמה גבוהה ניתנות גם לזיהוי תת-קבוצות של תאים מיאלואידים של גידול עכברים לצורך אפיון ו/או מיון נוסף.
Protocol
הערה: כל המחקרים בבעלי חיים עמדו בהנחיות המועצה הקנדית לטיפול בבעלי חיים ואושרו על ידי מועצת האתיקה למחקר בבעלי חיים של אוניברסיטת מקמאסטר.
1. קצירת גידולים ודיסוציאציה
- לחסן עכברים בני 6-8 שבועות, נקבה, C57BL/6 תוך עורית/תת עורית עם 2 × 105 תאי מלנומה B16 כפי שתואר על ידי Nguyen et al.8 אפשר לגידולים לצמוח במשך 7 ימים לפני הקטיף.
- המתת חסד של העכבר על ידי פריקת צוואר הרחם תוך הקפדה לא לשבש את הגידול בעת ביצוע פעולה זו. רססו את העכבר ב-70% אתנול לפני הקטיף.
- בעזרת אזמל ומספריים, הסר בניתוח את הגידול התוך-עורי/תת עורי מהרקמה שמסביב (כולל בלוטות לימפה מחוברות המנקזות את הגידול), והנח את הגידולים בצינור מיקרופוגה שקול מראש. המשיכו על הקרח.
הערה: בצע את קציר הגידול בארון בטיחות ביולוגית לשימוש בעלי חיים. השתמש בצינור חרוטי של 15 מ"ל לגידולים גדולים יותר. - שקלו את הגידולים, והוסיפו 500 מיקרוליטר של מדיום RPMI-1640 עם 10% סרום בקר עוברי (FBS) לכל צינור, בעזרת מספריים כדי לחתוך את הגידולים לחתיכות קטנות בתוך הצינור או בצלחת של 6 בארות.
הערה: חלקי הגידול צריכים להיות קטנים מספיק כדי לערבב אותם על ידי פיפטור חשמלי לאחר הוספת מדיום העיכול. - הכן את תערובת הדיסוציאציה על ידי המסת קולגנאז מסוג IV ב-0.5 מ"ג/מ"ל ו-DNase ב-0.2 מ"ג/מ"ל במדיום RPMI-1640 עם 10% FBS ו-5 מ"מ סידן כלורי.
הערה: יש להכין תערובת דיסוציאציה טרייה כדי למקסם את פעילות הקולגנאז. - העבירו את תרחיף הגידול הטחון לצינור חרוטי של 15 מ"ל, והוסיפו 10 מ"ל תערובת דיסוציאציה לכל 0.25 מ"ג גידול. הנח את הצינור בשייקר מסלולי מבוקר טמפרטורה למשך 30 דקות ב-37 מעלות צלזיוס עם תסיסה של 200 סל"ד. נטרלו את פעילות הקולגנאז על ידי הוספת שני נפחים של מדיום RPMI-1640 קר עם 10% FBS ו-2 מ"מ חומצה אתילנדיאמין טטראצטית (EDTA), ומקררים למשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס.
- מערבולת קצרה ופיפטה את המתלה למסננת של 40 מיקרומטר על צינור חרוטי של 50 מ"ל. השתמש בבוכנת מזרק ובמדיה מנטרלת כדי לפרק את רקמת הגידול הנותרת, ולשטוף אותה דרך המסננת. צנטריפוגה את התרחיף למשך 5 דקות (500 × גרם, 4 מעלות צלזיוס), השליכו את הסופרנטנט והשעו מחדש את הגלולה בתמיסת מלח חוצצת פוספט (PBS) עם 2% FBS ו-1 מ"מ EDTA.
2. העשרת TIL וצביעה ציטומטרית בזרימה (FACS)
- כדי להעשיר TIL לאפיון תאים מיאלואידים, השתמש בערכת הפרדת תאים מגנטיים המיועדת לבחירה חיובית לביוטין עם נוגדנים CD45.2 ביוטיניליים בהתאם להוראות היצרן (ראה טבלת החומרים).
- השעו מחדש את התאים ב-200 מיקרוליטר של מאגר FACS (PBS עם 0.5% w/v אלבומין בסרום בקר (BSA)), והעבירו אותם לצלחת תחתונה U של 96 בארות.
הערה: אין לחרוג מריכוז צביעה של 1 × 108 תאים/מ"ל. התאם את עוצמת הקול ופצל דגימות למספר בארות כדי לפצות על מספרי תאים גבוהים. - צנטריפוגה את הצלחת למשך 5 דקות (500 × גרם, 4 מעלות צלזיוס), והשליכו את הסופרנטנט. הוסף 50 מיקרוליטר של תמיסת בלוק Fc (דילול של 1:200 של CD16/CD32 נגד עכבר חולדה מטוהרת [ראה טבלת החומרים) במאגר FACS, ריכוז סופי של 2.5 מיקרוגרם/מ"ל), והשהה מחדש את התאים על ידי פיפטינג. יש לדגור במשך 10 דקות בחום של 4 מעלות צלזיוס.
- הוסף 50 מיקרוליטר של מאגר FACS המכיל ריכוז פי 2 של נוגדן מכתים על פני השטח (דילול 1:50 של CD45.2, NK1.1, CD11c, F4/80, CD8a, Ly6C, CD11b, CD4, Ly6G) וכתם כדאיות הניתן לתיקון (FVS, דילול 1:500), וערבב את התאים על ידי פיפטינג. יש לדגור למשך 20 דקות בחום של 4 מעלות צלזיוס.
הערה: מכסים את הצלחת בנייר אלומיניום כדי למזער את החשיפה לאור. יש לטטר נוגדנים לפני הניסוי כדי לקבוע באופן אמפירי את הדילול האופטימלי. - שטפו את התאים פעמיים על ידי הוספת 200 מיקרוליטר של מאגר FACS לכל באר, צנטריפוגה של התרחיף (5 דקות, 500 × גרם, 4 מעלות צלזיוס), והשלכת הסופרנטנט.
- הוסף 100 מיקרוליטר של תמיסת קיבוע/חדירות (ראה טבלת החומרים) לכל באר, ערבב את התאים על ידי פיפטינג ודגר במשך 20 דקות ב-4 מעלות צלזיוס.
- הוסף 100 מיקרוליטר של מאגר חדירות 1x (ראה טבלת החומרים) לכל באר, צנטריפוגה את הצלחת למשך 5 דקות (500 × גרם, 4 מעלות צלזיוס), והשליך את הסופרנטנט.
- שטפו את התאים על ידי הוספת 200 מיקרוליטר של מאגר חדירות 1x לכל באר, צנטריפוגה של התרחיף (5 דקות, 500 × גרם, 4 מעלות צלזיוס), והשלכת הסופרנטנט.
הערה: ניתן להשהות את הניסוי למשך הלילה לאחר השעיית התאים במאגר חדירה. אחסן את הדגימה ב-4 מעלות צלזיוס ומוגן מפני אור. המשך לאחר ערבוב קצר של התאים לפני הצנטריפוגה. - הוסף 100 מיקרוליטר של מאגר חדירות המכיל ריכוז פי 1 של נוגדן צביעה תוך תאי (דילול 1:100 של תחמוצת החנקן סינתאז 2 (NOS2), ארגינאז 1 (Arg1)), וערבב את התאים על ידי פיפטינג. יש לדגור למשך 20 דקות בחום של 4 מעלות צלזיוס.
הערה: מכסים את הצלחת בנייר אלומיניום כדי למזער את החשיפה לאור. יש לטטר נוגדנים לפני הניסוי כדי לקבוע באופן אמפירי את הדילול האופטימלי. - הוסף 100 מיקרוליטר של מאגר חדירות 1x לכל באר, צנטריפוגה את הצלחת למשך 5 דקות (500 × גרם, 4 מעלות צלזיוס), והשליך את הסופרנטנט.
- שטפו את התאים על ידי הוספת 200 מיקרוליטר של מאגר חדירות 1x לכל באר, צנטריפוגה של התרחיף (5 דקות, 500 × גרם, 4 מעלות צלזיוס), והשלכת הסופרנטנט.
- השעו מחדש את התאים ב-300 מיקרוליטר של מאגר FACS. סנן את הדגימה דרך צינור פוליסטירן תחתון עגול של 5 מ"ל עם מכסה מסננת של 40 מיקרומטר לפני ביצוע ניתוח ציטומטריית זרימה.
3. מיון תאים מיאלואידים של גידול למחקרים פונקציונליים
- לאחר זיהוי אוכלוסיות התאים המיאלואידים הרצויות על ידי ניתוח זרימה ציטומטרית, יש להעשיר מראש תאים מיאלואידים בתפזורת למיון עם ערכת הפרדת תאים מגנטיים המיועדת לבחירה חיובית CD11b או CD11c בהתאם להוראות היצרן (ראה טבלת החומרים).
- באמצעות נוגדנים לצביעה על פני השטח הספציפיים לתת-קבוצות התאים המיאלואידיים הרצויים (דילול 1:100 של CD11b, Ly6C, Ly6G), צובעים את התאים המועשרים מראש כמתואר בשלבים 2.2-2.5.
הערה: כלול כתם כדאיות הניתן לתיקון כדי להבטיח מיון של תאים מיאלואידים חיים. אין לחרוג מריכוז צביעה של 1 × 108 תאים/מ"ל. התאם את עוצמת הקול ופצל את הדגימות למספר בארות כדי לפצות על מספרי תאים גבוהים. - השעו מחדש את התאים במאגר מיון קר (PBS עם 1% w/v BSA, 25 מ"מ 4-(2-הידרוקסיאתיל)-1-פיפרזינאתיל-חומצה סולפונית (HEPES) ו-1 מ"מ EDTA). מסננים את הדגימה דרך צינור פוליפרופילן תחתון עגול בנפח 5 מ"ל עם מכסה מסננת של 40 מיקרומטר. שמור את התאים על קרח, וכסה את הצינור בנייר אלומיניום.
הערה: התאם את ריכוז התאים/נפח למפרט המכשיר הרצוי למיון. - הכן צינור איסוף דגימות עם מדיום לכידה (צינור פוליפרופילן תחתון עגול 5 מ"ל המכיל PBS עם 50% FBS).
הערה: מצפים צינורות עם 5 מ"ל לכידת מדיום למשך הלילה לפני המיון. השלך את כל אמצעי הלכידה מלבד 1-2 מ"ל למחרת לפני הפעלת הדגימה. - שנה את הגדרות מכשיר המיון כדי להפחית את לחץ הדגימה ולמנוע הפרעות בהיווצרות טיפות. צייד את קצה הזרבובית של 130 מיקרומטר, והשתמש בהגדרה של 10 psi. הפעל את הדגימה בקצב זרימה נמוך עם תסיסה תקופתית של דגימה ב-100 סל"ד, וודא שתצהיר הטיפות נמצא במרכז הצינור. לאחר המיון, שמור את הדגימה על קרח.
- דגרו את הדגימה למשך 10 דקות בטמפרטורה של 4 מעלות צלזיוס. צנטריפוגה של הצינור למשך 5 דקות (500 × גרם, 4 מעלות צלזיוס), השליכו את הסופרנטנט והשעו מחדש את הגלולה במדיום הרצוי לבדיקות פונקציונליות או העברה לאימוץ.
4. העברה מאמצת של תאים מיאלואידים מטוהרים של גידול
- לחסן עכברים בני 6-8 שבועות, נקבה, C57BL/6 תוך עורית עם 1 × 106 תאי גידול מלנומה B16 מושעים ב-30 מיקרוליטר של PBS.
הערה: יש לחסן עכברים מראש כך שגידול הגידול לא יעלה על 100 מ"מ3 בזמן ההעברה לאימוץ. - השעו מחדש את התאים המיאלואידים של הגידול הממוינים ב-PBS עם 25 מ"מ HEPES ו-1 מ"מ EDTA בריכוז של 2 ×-106 תאים/מ"ל. מסננים את הדגימה דרך צינור פוליסטירן תחתון עגול של 5 מ"ל עם מכסה מסננת של 40 מיקרומטר. המשיכו על הקרח.
- לגרום ולשמור על עכברים בהרדמה עם 3% איזופלורן. יש למרוח משחה עיניים למניעת יובש/פציעה בעין.
- טען מזרק 31 גרם עם 50 מיקרוליטר של מתלה תאים. עקור בועות אוויר על ידי לחיצה עדינה על המזרק. נקה את מקום ההזרקה באמצעות ספוגית אלכוהול.
- בעזרת מלקחיים סטריליים יש להרים את העור בבסיס הגידול. הכנס את המחט לחלל התת עורי בזווית קלה כלפי מעלה כדי להיכנס לגידול מתחת לעור. השתמש במלקחיים כדי לצבוט את העור המקיף את המחט, והוציא לאט את נפח המזרק. המשך לצבוט את העור עם המלקחיים תוך הסרת המחט לאט, והשתמש בצמר גפן כדי לנקות דליפה פוטנציאלית.
הערה: המשך עם כל טיפול טיפולי נוסף אם תרצה. - אפשרו לעכברים להתאושש מההרדמה.
תוצאות
התוצאות מדגימות כי שיטה זו מייצרת תפוקה גבוהה של תאים מיאלואידים מגידולי עכברים מוצקים. שימור שלמות הקולטן והכדאיות התאית מאפשר ניתוח פונקציונלי אמין של תת-הקבוצות המיאלואידיות הרצויות. שיפורים אלה בבידוד התאים המיאלואידיים אפשרו להבחין בתפקוד המשתנה של תאים מיאלואידים תוך-גידוליים עם נורמליזציה של ה-TME עם מעכב היסטון דאצטילאז מסוג I (HDACi), MS-275, במהלך טיפול בתאי T מאמצים. פרוטוקולי בידוד TIL בדרך כלל אינם נוקטים בצעדים כדי למקסם את תפוקת התאים המיאלואידיים9. כתוצאה מכך, עיכול אנזימטי הוא בדרך כלל קשה מדי ומוביל לאובדן כדאיות הדגימה. כאשר גידולי מלנומה B16 מעובדים טופלו בקולגנאז מסוג I למשך שעה אחת (מצב נפוץ) לפני העשרה חיובית לתאי CD45.2+ על ידי ברירה מגנטית, המורפולוגיה (אזור פיזור קדימה (FSC-A) לעומת אזור פיזור צד (SSC-A)) ותאי מיאלואיד (CD11b לעומת CD11c) הצביעו על כך שהתפוקה של תאים מיאלואידים (CD11b+ או CD11c+) ותאים לא מיאלואידים (CD11b-CD11c-) הייתה נמוכה ביותר (איור 1). כדי להפחית את הפעילות הספציפית הפוטנציאלית המוגזמת של קולגנאז, משך עיכול הגידול ירד ל-30 דקות. אמנם חל שיפור קל בהתאוששות התאים המיאלואידים, אך התשואה הכוללת עדיין הייתה נמוכה ולא היה שיפור בהתאוששות התאים שאינם מיאלואידים.
מכיוון ששונות אצווה עלולה להכניס פרוטאזות עם פעילות ספציפית גבוהה מספיק כדי לגרום למוות מוגזם של תאים, מנה נפרדת של קולגנאז מסוג I התבקשה מספק מסחרי אחר להשוואה. מעניין שהתפוקה הכוללת של תאים מיאלואידים ולא מיאלואידים הייתה גבוהה בהרבה, עם שיפור קל במספר התאים המיאלואידים עם הוספת FBS. למרות ש-FBS נוסף כדי לייצב את התאים המיאלואידים לנזק הנגרם על ידי קולגנאז, זה העלה את השאלה האם FBS מנטרל גם את הפעילות הטריפטית של תכשיר קולגנאז מסוג I, מה שעלול לפגוע בהתאוששות התאים. מכיוון שלתכשירים מסוג קולגנאז מסוג I יש קולגנאז, קזנאז, קלוסטריפאין ופעילות טריפטית10, כדי להפחית את החשיפה לפרוטאז, העיכול נעשה באמצעות קולגנאז מסוג IV, שיש לו פעילות ספציפית גבוהה יותר לקולגנאז ופעילות טריפטית נמוכה יותר. מצב זה הביא לעלייה גדולה יותר בתפוקת התאים המיאלואידים, כאשר תוספת FBS הביאה לתשואה הגבוהה ביותר. מעניין שקולגנאז מסוג I וסוג IV, עם או בלי FBS, לא שינו באופן ניכר את התפוקה הכוללת של תאים שאינם מיאלואידים.
עם תנאי עיכול אנזימטיים אופטימליים אלה, בודדו לויקוציטים מגידולי מלנומה B16 של עכברים, ונעשה שימוש בזרימה ציטומטרית כדי לפנוטיפ של אוכלוסיות התאים המיאלואידים השונות בתוך ה-TME על סמך ביטוי סמני פני השטח שלהם. הגידולים נאספו ועובדו והלויקוציטים בודדו באמצעות ערכת בחירה מגנטית CD45.2. לאחר מכן התאים נצבעו באמצעות פאנל שתוכנן בקפידה של סמני פני התא (איור 2). אסטרטגיית השער המתוארת כאן מתחילה בהערכה מורפולוגית של התאים באמצעות FSC-A לעומת SSC-A. זה מאפשר אי הכללה של פסולת סלולרית על סמך גודלם הקטן. FSC-H לעומת FSC-W שימש לבחירת תאים בודדים ולהוצאת הכפילים. סך כל הלויקוציטים החיים גודרו לאחר מכן על סמך CD45.2 וצביעה כדאיות. לימפוציטים לא נכללו על סמך צביעת NK1.1, CD4 ו-CD8; שימו לב כי בעכברי BALB/c, ניתן להשתמש ב-Asialo-GM1 ו/או DX5 כדי להוציא תאי הרג טבעיים (NK) מכיוון ש-NK1.1 אינו מתבטא בתאי NK שמקורם ב-BALB/c. לאחר מכן CD11b תוכנן כנגד CD11c כדי לזהות תאים דנדריטיים הקשורים לגידול (TADCs)/תאים דנדריטיים קונבנציונליים (cDCs).
תאים שליליים ל-CD11c מייצגים את התאים המיאלואידים בתפזורת, אותם ניתן להפריד עוד יותר על סמך צביעת Ly6C ו-Ly6G. תאים המבטאים רמות ביניים של Ly6C ורמות גבוהות של Ly6G מייצגים את הנויטרופילים. אוכלוסייה זו חולקת את אותו פנוטיפ כמו התאים המדכאים שמקורם במיאלואיד גרנולוציטי (G-MDSCs). ניתן לחלק תאי CD11b+ שצובעים שלילי עבור Ly6G, אך חיוביים עבור Ly6C ניתן לחלק ל-Ly6Chi, Ly6Cint ו-Ly6Clo. תאי Ly6Cint/hi מבטאים רמות נמוכות יותר של F4/80 ומייצגים מונוציטים דלקתיים. עם זאת, תאיHi Ly6C חולקים גם את אותו פנוטיפ עם תאים מדכאים שמקורם במיאלואיד מונוציטי (M-MDSCs). לבסוף, תאיLy6C int מבטאים רמות גבוהות של F4/80 ובדרך כלל קשורים למקרופאגים הקשורים לגידול (TAMs). בעוד שאפיון זה עשוי שלא לזהות באופן מלא את תת-הקבוצות של התאים המיאלואידים המעניינים, הוא מספק אסטרטגיית שער שימושית למיון אוכלוסיות תאים מיאלואידים בתוך ה-TME לצורך ניתוחים פונקציונליים או גנומיים נוספים. בהקשר של אימונותרפיה, טיפול מאמץ בתאי T המשלב תרופות משנות אפיגנטיות, כגון מעכב היסטון דאצטילאז מסוג I (HDACi) MS-275, יכול להשפיע על ה-TME כדי לקדם רגרסיה מתמשכת של הגידול, בעוד שהיעדרו גורם להישנות הגידול8.
למרות שניתוח מיקרו-מערך של RNA גידול בתפזורת מצביע על תפקיד לתאים מיאלואידים חודרים לגידול, אפיון פנוטיפי זה לא הצביע על שינויים משמעותיים בסמני פני השטח במהלך הטיפול ב-MS-2758. מעניין לציין שסמנים פונקציונליים הקיימים בפאנל צביעת ציטומטריית הזרימה זיהו תת-קבוצה מסוימת של תאים מיאלואידים (CD11b+ Ly6Chi Ly6G-) המייצרים באופן דיפרנציאלי תחמוצת החנקן סינתאז 2 (NOS2) וארגינאז 1 (Arg1), שהם קריאות מרומזות של תכנות פונקציונלי מקוטב או מתפצל (איור 3A). על ידי מיון תאי CD11b+ Ly6Chi Ly6G- מעכברים נושאי גידול שטופלו באופן דיפרנציאלי, ניתן לבצע מחקרים פונקציונליים נרחבים יותר כדי להבין את תפקידם. באמצעות תיוג carboxyfluorescein succinimidyl ester (CFSE) לניטור התפשטות הלימפוציטים11, תאים מיאלואידים ממוינים שמקורם בעכברים נאיביים ומחוסנים נמצאו כמדכאים את התפשטות תאי T במבחנה, בעוד שתאים שמקורם בעכברים מחוסנים + שטופלו ב-MS-275 הפחיתו את תפקוד דיכוי החיסון (איור 3B). העברה מאמצת של תאים אלה גילתה כי במקום זאת יש להם יכולת אנטי-גידולית וקידמו רגרסיה מתמשכת של גידולים במהלך החיסון והישרדות ממושכת של עכברים (איור 3C).

איור 1: נתונים מייצגים המראים את היעילות של מצבי דיסוציאציה משתנים. בעכברי C57BL/6 (n=3 לקבוצה), גידולי B16F10-gp33 תוך-עוריים שלא טופלו עובדו ופורקו בתנאים אנזימטיים שונים לפני בחירת CD45.2. מוצגות לעיל אסטרטגיות שער ציטומטריית זרימה המשמשות להדגמת הבדלי תשואה תאיים (FSC-A לעומת . SSC-A) מדגים את תפוקת הלויקוציטים החודרים לגידול באופן מרומז על ידי אפליית גודל התא/גרעיניות. (CD11b לעומת CD11c) מאפשר כימות של תאים מיאלואידים (CD11b+ או CD11c+) או לא מיאלואידים (CD11b-CD11c-). שגיאה מוגדרת על ידי שגיאה סטנדרטית של הממוצע. קיצורים: CD = אשכול התמיינות; SSC-A = אזור פיזור צדדי; FSC-A = אזור פיזור קדימה; FBS = סרום בקר עוברי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
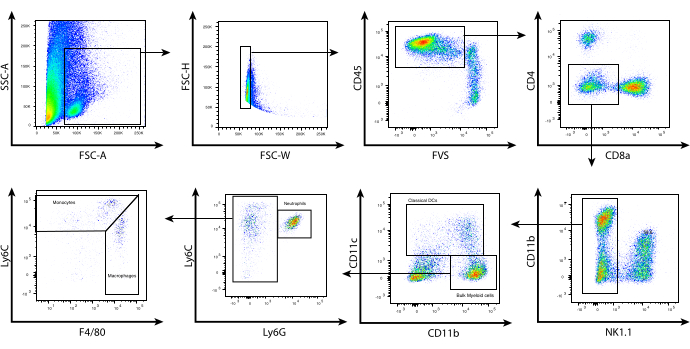
איור 2: ניתוח ציטומטריית זרימה מייצגת של תאים מיאלואידים חודרים לגידול. לאחר עיבוד הגידול ובחירת CD45.2, תאים מועשרים הוכתמו על פני השטח כמתואר בפרוטוקול. מוצגת לעיל אסטרטגיית השער המשמשת להוצאת הלימפוציטים וזיהוי תת-הקבוצות הבודדות של תאים מיאלואידים בתוך מיקרו-סביבת הגידול. פסולת (SSC-A לעומת FSC-A) וכפילים (FSC-H לעומת FSC-W) לא נכללו, ותאים חיים CD45.2+ נקבעו באמצעות כתם הכדאיות הניתן לתיקון FVS510 (CD45.2 לעומת FSC-W. FVS). תאי CD4+, CD8+, NK1.1+ היו מגודרים. תאי CD11bhi/lo CD11c+ מייצגים cDCs. CD11b+ CD11c- לאחר מכן הועברו על סמך ביטוי Ly6C ו-Ly6G. זוהו שלוש אוכלוסיות: (i) Ly6Cint Ly6G+ (נויטרופילים/G-MDSCs), (ii) Ly6Chi Ly6G- F4/80lo/int (מונוציטים/M-MDSCs), (iii) Ly6Clo/int Ly6G- F4/80hi (מקרופאגים/TAMs). קיצורים: CD = אשכול התמיינות; SSC-A = אזור פיזור צדדי; FSC-A = אזור פיזור קדימה; FSC-H = גובה פיזור קדימה; FSC-W = רוחב פיזור קדימה; FVS = כתם כדאיות הניתן לתיקון; cDCs = תאים דנדריטיים קונבנציונליים; Ly = אנטיגן לימפוציטים; G-MDSCs = תאים מדכאים שמקורם במיאלואיד גרנולוציטי; M-MDSCs = תאים מדכאים שמקורם במיאלואיד מונוציטי; TAMs = מקרופאגים הקשורים לגידול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: ניתוחים פונקציונליים של תאים מיאלואידים מטוהרים החודרים לגידול. בעכברי C57BL/6 (n=3-5 לקבוצה), גידולי B16F10-gp33 תוך-עוריים לא חוסנו או ניתנו לטיפול בתאי T מאמצים בנוכחות או בהיעדר מעכב HDAC, MS-275. חמישה ימים לאחר הטיפול, הגידולים עובדו והועשרו באופן חיובי לתאי CD11b+. התאים היו מוכתמים על פני השטח כדי לתת-קבוצה של תאים מיאלואידים חודרים לגידול הרצוי (CD11b+ Ly6Chi Ly6G-). (A) תאים אלה נצבעו עוד יותר תוך תאית עבור סמנים שיכולים לתאר את הקוטביות של הפעלה תפקודית, והנתונים מוצגים כתדירות של תאי CD11b+ Ly6Chi Ly6G- המייצרים NOS2 או Arg1. לחלופין, התאים המיאלואידים המוכתמים על פני השטח מועשרים ב-CD11b+ מוינו לקבלת אוכלוסיית תאי Ly6Chi Ly6G טהורה. (B) התאים המטוהרים האלה עברו פעימת פפטיד ותרבית משותפת עם תאי T טרנסגניים נאיביים שמסומנים ב-CFSE ביחסים משתנים. דילול CFSE, כפי שנקבע על ידי ציטומטריית זרימה, מוצג כהיסטוגרמה מייצגת ומכומת על ידי אינדקס חלוקה תאית (1:1). (C) תאי CD11b+ Ly6Chi Ly6G מטוהרים בנפרד שמקורם בעכברים נושאי גידול מחוסנים + MS-275 שטופלו הועברו באופן מאומץ לעכברים נושאי גידול חדשים (n=5) בשילוב עם חיסון ורגרסיה של הגידול, ועקומות ההישרדות נוטרו. שגיאה מוגדרת על ידי שגיאת התקן של הממוצע. p=0.0004, * p=0.0479, **** p<0.0001. נתון זה שונה מ-Nguyen et al. 8. קיצורים: CD = אשכול התמיינות; HDAC = מעכב היסטון דאצטילאז; NOS2 = תחמוצת החנקן סינתאז 2; Arg1 = ארגינאז 1 ; CFSE = carboxyfluorescein succinimidyl ester; TCR = קולטן תאי T; Ly = אנטיגן לימפוציטים; NS= לא משמעותי. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
למרות שתאים מיאלואידים חודרים לגידול קיימים במצבי הפעלה והתמיינות משתנים בתוך הגידול, זוהו מספר תת-קבוצות כולל DCs הקשורים לגידול (TADCs), נויטרופילים הקשורים לגידול (TANs), תאים מדכאים שמקורם במיאלואיד (MDSCs) ומקרופאגים הקשורים לגידול (TAMs)12. למרבה הצער, הביטוי החופף של סמני פני התא המשמשים לזיהוי תת-קבוצות תאים מיאלואידיים אלה הופך את זה לאתגר כיום להבדיל פנוטיפית בין תאים מיאלואידים של גידול לתאים מיאלואידים אחרים13. באופן דומה, שינויים פנוטיפיים הנגרמים על ידי טיפול בתאים מיאלואידים חודרים לגידול עשויים שלא להבחין בקלות עם לוחות צביעת נוגדנים מיאלואידים קיימים. יחד, היעדר סמני שטח ייחודיים מסבך את ההבנה של הביולוגיה של התא המיאלואידי. כדי לתאר תאים מיאלואידים טבעיים, מונעי גידול ומושפעים מטיפול, הערכת תת-קבוצות של תאים מיאלואידים חייבת להיעשות בהתאם לתפקודם בנוסף למאפיינים הפנוטיפיים שלהם.
השיטות המתוארות כאן לקצירת רקמת הגידול ולניתוק מאפשרות בידוד של תאים מיאלואידים עם כדאיות נשמרת ושלמות סמן פני השטח. מכיוון שתאים מיאלואידים חודרים לגידול רגישים למניפולציה ex vivo 7, הדגש של הפרוטוקול הוא על דיסוציאציה מכנית ואנזימטית פחות אגרסיבית. עם זאת, בהתאם לסוג רקמת הגידול, דגימות שונות דורשות טיפול אגרסיבי משתנה כדי ליצור תרחיף של תא בודד. עבור מודלים גידוליים עשירים יותר בקולגן (כלומר, פיברוסרקומה CMS5), ניתן להשתמש בבוכנת מזרק בנוסף למספריים כדי לפרק באופן מכני יותר את רקמת הגידול לפני הטיפול האנזימטי. לעומת זאת, מודלים של גידולים פחות עשירים בקולגן (כלומר, מלנומה B16) אינם דורשים בהכרח טיפול אנזימטי. כפי שהודגם בתוצאות אלה, סוג הכנת הקולגנאז והכמות שממנה הוא הופק יכולים להשפיע באופן משמעותי על המגוון והעוצמה של פרוטאזות שהתאים נחשפים אליהם במהלך דיסוציאציה אנזימטית.
בעוד שלויקוציטים שאינם מיאלואידים (כלומר, לימפוציטים) אינם נראים רגישים כל כך, נתונים אלה מצביעים על כך שתאים מיאלואידים, במיוחד, עשויים להיות רגישים מאוד לחשיפה מוגזמת לפרוטאז (איור 1), וכתוצאה מכך נזק לחלבוני הממברנה וירידה בכדאיות. כתוצאה מכך, מומלץ להשתמש בקולגנאז מסוג IV על פני קולגנאז מסוג I בשל הפעילות הפרוטאוליטית המוגברת הספציפית לקולגנאז ושילוב FBS בתערובת העיכול כדי לנטרל פעילות טריפטית שיורית. יתר על כן, שימוש במוצרי קולגנאז מטוהרים, בניגוד לתכשירים גולמיים ממקורות מסחריים, יכול להגביר את יכולת השחזור של התאוששות התאים. לאחר השלמת העיכול, תוספת של EDTA ודגירה ב-4 מעלות צלזיוס היא חובה כדי לקלוט את יוני Ca2+ ולהפחית את הטמפרטורה הדרושה לפעילות קולגנאז14.
כדי לאפיין חדירת תאים מיאלואידים בתוך אוכלוסיית TIL הטרוגנית, סופקו אסטרטגיות שער ברמה גבוהה (איור 2). יש לתכנן את פאנל ציטומטריית הזרימה הפוליכרומטית בצורה כזו ש-1) תאים מתים ולא מיאלואידים אינם נכללים, 2) ניתן לזהות תת-קבוצות של תאים מיאלואידים, ו-3) ניתן לצפות בפונקציונליות שהשתנתה באופן מרומז על פני קבוצות דגימות (איור 3). בהתאם למספר תת-הקבוצות של התאים המיאלואידים המעניינים ועומק האפיון התפקודי, ייתכן שקריטריונים אלה לא יתאימו במלואם בתוך לוח צביעה אחד. כדי לפנות ערוצים לפאנל, ניתן היה לאגד סמנים אסטרטגית לערוץ השלכה יחיד. למרות ששיטה זו מאפשרת ניתוח ממדי גבוה של תאים מיאלואידים חודרים לגידול, היא עדיין מוגבלת על ידי מגבלת פרמטרים נמוכה יחסית. טכנולוגיות עדכניות יותר המשתמשות ביונים מדווחים של מתכות כבדות, כגון ציטומטריית מסה, מאפשרות עד 40 פרמטרים בלתי תלויים בתוך פאנל יחיד, מה שיאפשר מחקר טוב יותר של המגוון התאי והתפקודי של תאים מיאלואידים בתוך TME15.
עם זאת, עלות המכשור מגבילה את השימוש בו בכל מקום. ציטומטריית זרימה נגישה יותר ומייצרת נתוני אפיון אמינים, אם כי ערבוב והתאמה של סמנים על פני מספר פאנלים מחייב אימות פאנל כשלב חשוב ביותר לפני הניסוי. עם זיהוי תת-קבוצות מיאלואידיות חודרות לגידול מעניינות, מספר חוקרים15 מתארים טכניקות למיון תאים אלה לבדיקות ומחקרים פונקציונליים. ניתן לנתח תאים ממוינים באופן מהימן עבור יכולת דיכוי תאי ה-T שלהם במבחנה , כמו גם יכולתם האנטי-גידולית in vivo לאחר העברתם לאימוץ למודלים עכבריים של הישנות הגידול (איור 3). בסך הכל, המשמעות של השיטות המתוארות היא שבהשוואה לפרוטוקולי בידוד TIL אחרים, התנאים של קצירת גידול, דיסוציאציה, העשרת תאים ומיון תאים הותאמו להשגת תפוקה גבוהה של תא התאים המיאלואידים על פני כל הלויקוציטים האחרים ומבלי לפגוע בתפקודם.
Disclosures
לא הוכרז על ניגוד עניינים.
Acknowledgements
עבודה זו נתמכה על ידי מכון אונטריו לחקר הסרטן באמצעות מימון שסופק על ידי ממשלת אונטריו, כמו גם המכונים הקנדיים לחקר הבריאות (FRN 123516 ו-FRN 152954), האגודה הקנדית לסרטן (מענק 705143) ומכון המחקר טרי פוקס (TFRI-1073).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
References
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611 (2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677 (2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977 (2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863 (2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685 (2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259 (2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713 (2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved