Method Article
التحليل الوظيفي للخلايا النخاعية المتسللة للورم عن طريق قياس التدفق الخلوي والنقل بالتبني
* These authors contributed equally
In This Article
Summary
يوفر هذا البروتوكول طرقا موثوقة لتفكك الورم الصلب وعزل الخلايا النخاعية في نماذج الأورام داخل الأدمة أو تحت الجلد في الفئران. يسمح قياس التدفق الخلوي بالتوصيف الظاهري للمجموعات النخاعية غير المتجانسة داخل البيئة المكروية للورم وسيظهر الفرز وظائفها في سياق النقل بالتبني.
Abstract
تمثل حجرة الخلايا النخاعية المتسللة للورم مجموعة غير متجانسة من الخلايا المثبطة للمناعة على نطاق واسع والتي استغلها الورم لدعم نموه. يؤدي تراكمها في الورم والأنسجة اللمفاوية الثانوية إلى قمع الاستجابات المناعية المضادة للأورام ، وبالتالي فهي هدف للتدخل العلاجي. كما هو معروف أن بيئة السيتوكين المحلية يمكن أن تملي البرمجة الوظيفية للخلايا النخاعية المتسللة للورم ، فقد تم وضع استراتيجيات لمعالجة البيئة المكروية للورم (TME) للتعبير عن مشهد السيتوكين الأكثر ملاءمة لنشاط الخلايا النخاعية المضادة للأورام. لتقييم التغيرات التي يسببها العلاج في الخلايا النخاعية المتسللة للورم ، ستحدد هذه الورقة إجراء فصل أنسجة الورم داخل الأدمة / تحت الجلد من الفئران الحاملة للورم الصلبة استعدادا للتعافي من الكريات البيض. سيتم توفير استراتيجيات لتحليل قياس التدفق الخلوي لتمكين تحديد مجموعات النخاع غير المتجانسة داخل الكريات البيض المعزولة وتوصيف الأنماط الظاهرية النخاعية الفريدة. أخيرا ، ستصف هذه الورقة وسيلة لتنقية الخلايا النخاعية القابلة للحياة للمقايسات الوظيفية وتحديد قيمتها العلاجية في سياق النقل بالتبني.
Introduction
تتكون البيئة المكروية للورم (TME) من خلايا ورمية سريعة التكاثر وحجرة الخلايا اللحمية غير المتجانسة المحيطة. نظرا لأن الأورام النامية غالبا ما تكون ضعيفة الأوعية الدموية ، فإن TME هو موقع محيطي يتميز بشكل فريد بنقص الأكسجة والحرمان من المغذيات والحماض1. للبقاء على قيد الحياة في هذا المشهد ، تؤدي استجابات إجهاد الورم وإعادة البرمجة الأيضية إلى إفراز العوامل القابلة للذوبان التي تعزز إعادة تشكيل الأنسجة وتكوين الأوعية الدموية بالإضافة إلى التجنيد الانتقائي للخلايا المناعية2. نظرا لأن الخلايا النخاعية هي واحدة من أكثر أنواع الخلايا المكونة للدم وفرة في TME ، فهناك اهتمام متزايد بفحص دور الخلايا النخاعية المتسللة للورم في TME.
الخلايا النخاعية هي مجموعة غير متجانسة وبلاستيكية من الخلايا المناعية الفطرية بما في ذلك الخلايا الوحيدة والضامة والخلايا المتغصنة والخلايا الحبيبية. على الرغم من أن لها أدوارا حاسمة في توازن الأنسجة وتنظيم الاستجابة المناعية التكيفية ، إلا أن وظيفتها يمكن أن تكون مستقطبة اعتمادا على تكوين إشارات التنشيط داخل البيئة المكروية المحلية3. تستفيد الأورام من خصائص الخلايا النخاعية من خلال إفراز العوامل القابلة للذوبان داخل TME. يمكن لهذه الإشارات البديلة أن تحول تكون النخاع نحو التمايز غير الناضج وتحرف وظيفة الخلايا النخاعية الموجودة في الورم3. في الواقع ، غالبا ما تعزز الخلايا النخاعية داخل TME تطور السرطان ويمكن أن تثبط الاستجابات المناعية المضادة للأورام ، مما يؤدي إلى آثار ضارة على علاج السرطان.
على الرغم من أن الاستراتيجيات العلاجية التي تعزز استنفاد الخلايا النخاعية المثبطة للمناعة قد ثبت أنها تؤخر نموالورم 4 ، إلا أن الافتقار إلى الخصوصية المستهدفة يخاطر بإزالة الخلايا النخاعية المحفزة للمناعة ، والتي على النقيض من ذلك ، تساعد في حل السرطان. يمكن أن يكون لهذه الخلايا النخاعية الالتهابية تأثيرات مضادة للأورام عميقة بما في ذلك القتل المباشر للخلايا السرطانية وتنشيط الخلايا التائية CD8 + السامةللخلايا 5. بدلا من ذلك ، أظهرت استراتيجيات تطبيع تكوين ووظيفة الخلايا النخاعية في TME نجاحا علاجيا6. ومع ذلك ، فإن الآليات البيولوجية الكامنة وراء إعادة تثقيفها نحو النمط الظاهري المضاد للأورام لم يتم فهمها بشكل كامل بعد. في النهاية ، يعد التوصيف الشامل للخلايا النخاعية السرطانية ضروريا لمزيد من التحسين في علاج السرطان.
لسوء الحظ ، فإن التفكيك القابل للتكرار للأورام لعزل الخلايا النخاعية يمثل تحديا. الخلايا النخاعية المشتقة من الورم حساسة للتلاعب خارج الجسم الحي مقارنة بالمجموعات الفرعية الأخرى من الكريات البيض ، ويمكن أن تؤدي عدوانية معالجة الورم إلى انقسام الحاتمة الأنزيمية وتقليل قابلية الخلايا المستردةللحياة 7. الغرض من هذه الطريقة هو توفير وسيلة موثوقة لتفكك الورم للحفاظ على سلامة علامة السطح للتحليل والحيوية الخلوية للدراسة الوظيفية. بالمقارنة مع بروتوكولات عزل الكريات البيض المتسللة للورم (TIL) التي تفضل الخلطات الأنزيمية الأكثر قسوة لتعزيز الإطلاق القابل للتكرار لمجموعات فرعية خلوية مختلفة ، فإن هذه الطريقة تفضل الهضم الأنزيمي الأكثر تحفظا لزيادة استعادة الخلايا النخاعية إلى أقصى حد. يتم أيضا توفير استراتيجيات بوابات تدفق متعددة الألوان عالية المستوى لتحديد مجموعات فرعية من الخلايا النخاعية لورم الفئران لمزيد من التوصيف و / أو الفرز.
Protocol
ملاحظة: امتثلت جميع الدراسات التي أجريت على مع إرشادات المجلس الكندي لرعاية وتمت الموافقة عليها من قبل مجلس أخلاقيات أبحاث بجامعة ماكماستر.
1. حصاد الورم والتفكك
- تلقيح الفئران C57BL / 6 البالغة من العمر 6-8 أسابيع داخل الجلد / تحت الجلد مع 2 × 105 خلايا الورم الميلانيني B16 كما هو موضح من قبل Nguyen et al.8 السماح للأورام بالنمو لمدة 7 أيام قبل الحصاد.
- قتل الفأر عن طريق خلع عنق الرحم مع التأكد من عدم تعطيل الورم عند القيام بذلك. رش الماوس ب 70٪ من الإيثانول قبل الحصاد.
- باستخدام مشرط ومقص ، قم بإزالة الورم داخل الأدمة / تحت الجلد جراحيا من الأنسجة المحيطة (بما في ذلك الغدد الليمفاوية المتصلقة بتصريف الورم) ، ووضع الأورام في أنبوب ميكرو فوج موزن مسبقا. ابق على الجليد.
ملاحظة: قم بإجراء حصاد الورم في خزانة السلامة البيولوجية للاستخدام الحيواني. استخدم أنبوبا مخروطيا سعة 15 مل للأورام الكبيرة. - قم بوزن الأورام ، وأضف 500 ميكرولتر من وسط RPMI-1640 مع مصل بقري الجنين بنسبة 10٪ (FBS) إلى كل أنبوب ، باستخدام المقص لتقطيع الأورام إلى قطع صغيرة داخل الأنبوب أو في صفيحة من 6 آبار.
ملاحظة: يجب أن تكون قطع الورم صغيرة بما يكفي لخلطها بواسطة ماصة كهربائية بمجرد إضافة وسط الهضم. - تحضير مزيج التفكك عن طريق إذابة الكولاجيناز من النوع الرابع عند 0.5 مجم / مل و DNase عند 0.2 مجم / مل في وسط RPMI-1640 مع 10٪ FBS و 5 ملي كلوريد الكالسيوم.
ملاحظة: يجب تحضير مزيج التفكك طازجا لزيادة نشاط الكولاجيناز. - انقل معلق الورم المفروم إلى أنبوب مخروطي سعة 15 مل ، وأضف 10 مل من مزيج التفكك لكل 0.25 مجم من الورم. ضع الأنبوب في شاكر مداري يتم التحكم في درجة حرارته لمدة 30 دقيقة عند 37 درجة مئوية مع تحريك 200 دورة في الدقيقة. قم بتحييد نشاط الكولاجيناز عن طريق إضافة مجلدين من وسط RPMI-1640 البارد مع 10٪ FBS و 2 ملي مولار من حمض رباعي الأسيتيك إيثيلين ديامين (EDTA) ، ثم ضعه في الثلاجة لمدة 10 دقائق عند 4 درجات مئوية.
- قم بتدوير التعليق لفترة وجيزة وقم بتقطيعه إلى مصفاة 40 ميكرومتر على أنبوب مخروطي سعة 50 مل. استخدم مكبس حقنة ووسائط معادلة لتفكيك أنسجة الورم المتبقية وغسلها من خلال المصفاة. قم بالطرد المركزي للتعليق لمدة 5 دقائق (500 × جم ، 4 درجات مئوية) ، وتخلص من المادة الطافية ، وأعد تعليق الحبيبات في محلول ملحي مخزن بالفوسفات (PBS) مع 2٪ FBS و 1 ملي مولار EDTA.
2. التخصيب TIL وتلوين التدفق الخلوي (FACS)
- لإثراء TILs لتوصيف الخلايا النخاعية ، استخدم مجموعة فصل الخلايا المغناطيسية المصممة للاختيار الإيجابي للبيوتين مع الأجسام المضادة CD45.2 البيوتينيل وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- أعد تعليق الخلايا في 200 ميكرولتر من المخزن المؤقت FACS (PBS مع 0.5٪ وزن / حجم ألبومين مصل البقر (BSA)) ، وانقلها إلى صفيحة قاع U مكونة من 96 بئرا.
ملاحظة: لا تتجاوز تركيز التلوين 1 × 108 خلايا / مل. اضبط الحجم ، وقسم العينات إلى آبار متعددة للتعويض عن أعداد الخلايا العالية. - قم بالطرد المركزي للوحة لمدة 5 دقائق (500 × جم ، 4 درجات مئوية) ، وتخلص من المادة الطافية. أضف 50 ميكرولتر من محلول كتلة Fc (تخفيف 1: 200 من الفئران المنقى المضاد للفأر CD16 / CD32 [انظر جدول المواد) في المخزن المؤقت FACS ، التركيز النهائي 2.5 ميكروغرام / مل) ، وأعد تعليق الخلايا عن طريق سحب العينات. احتضن لمدة 10 دقائق عند 4 درجات مئوية.
- أضف 50 ميكرولتر من المخزن المؤقت FACS الذي يحتوي على تركيز 2x من الجسم المضاد الملطخ السطحي (تخفيف 1:50 من CD45.2 ، NK1.1 ، CD11c ، F4 / 80 ، CD8a ، Ly6C ، CD11b ، CD4 ، Ly6G) وبقعة قابلة للبقاء قابلة للإصلاح (FVS ، تخفيف 1: 500) ، واخلط الخلايا عن طريق سحب العينات. احتضن لمدة 20 دقيقة عند 4 درجات مئوية.
ملاحظة: قم بتغطية اللوحة بورق الألمنيوم لتقليل التعرض للضوء. يجب معايرة الأجسام المضادة قبل التجربة لتحديد التخفيف الأمثل تجريبيا. - اغسل الخلايا مرتين عن طريق إضافة 200 ميكرولتر من المخزن المؤقت FACS إلى كل بئر ، والطرد المركزي للتعليق (5 دقائق ، 500 × جم ، 4 درجات مئوية) ، والتخلص من المادة الطافية.
- أضف 100 ميكرولتر من محلول التثبيت/النفاذية (انظر جدول المواد) إلى كل بئر، واخلط الخلايا عن طريق سحب العينات، واحتضنه لمدة 20 دقيقة عند 4 درجات مئوية.
- أضف 100 ميكرولتر من 1x المخزن المؤقت للنفاذية (انظر جدول المواد) إلى كل بئر ، وقم بالطرد المركزي للوحة لمدة 5 دقائق (500 × جم ، 4 درجات مئوية) ، وتخلص من المادة الطافية.
- اغسل الخلايا عن طريق إضافة 200 ميكرولتر من 1x المخزن المؤقت للنفاذية إلى كل بئر ، والطرد المركزي للتعليق (5 دقائق ، 500 × جم ، 4 درجات مئوية) ، والتخلص من المادة الطافية.
ملاحظة: يمكن إيقاف التجربة مؤقتا طوال الليل بعد إعادة تعليق الخلايا في المخزن المؤقت للنفاذية. قم بتخزين العينة في درجة حرارة 4 درجات مئوية ومحمية من الضوء. استأنف بعد خلط الخلايا لفترة وجيزة قبل الطرد المركزي. - أضف 100 ميكرولتر من المخزن المؤقت للنفاذية الذي يحتوي على تركيز 1x من الجسم المضاد للتلوين داخل الخلايا (1: 100 تخفيف من سينسيز أكسيد النيتريك 2 (NOS2) ، أرجيناز 1 (Arg1)) ، واخلط الخلايا عن طريق سحب العينات. احتضن لمدة 20 دقيقة عند 4 درجات مئوية.
ملاحظة: قم بتغطية اللوحة بورق الألمنيوم لتقليل التعرض للضوء. يجب معايرة الأجسام المضادة قبل التجربة لتحديد التخفيف الأمثل تجريبيا. - أضف 100 ميكرولتر من 1x المخزن المؤقت للنفاذية إلى كل بئر ، وقم بالطرد المركزي للوحة لمدة 5 دقائق (500 × جم ، 4 درجات مئوية) ، وتخلص من المادة الطافية.
- اغسل الخلايا بإضافة 200 ميكرولتر من 1x المخزن المؤقت للنفاذية إلى كل بئر ، والطرد المركزي للتعليق (5 دقائق ، 500 × جم ، 4 درجات مئوية) ، والتخلص من المادة الطافية.
- أعد تعليق الخلايا في 300 ميكرولتر من المخزن المؤقت FACS. قم بتصفية العينة من خلال أنبوب بوليسترين دائري القاع سعة 5 مل مع غطاء مصفاة 40 ميكرومتر قبل إجراء تحليل قياس التدفق الخلوي.
3. فرز الخلايا النخاعية الورمية للدراسات الوظيفية
- بعد تحديد مجموعات الخلايا النخاعية المطلوبة عن طريق تحليل قياس التدفق الخلوي ، قم بتخصيب الخلايا النخاعية السائبة مسبقا للفرز باستخدام مجموعة فصل الخلايا المغناطيسية المصممة للاختيار الإيجابي CD11b أو CD11c وفقا لتعليمات الشركة المصنعة (انظر جدول المواد).
- باستخدام الأجسام المضادة الملطخة السطحية الخاصة بالمجموعات الفرعية للخلايا النخاعية المرغوبة (تخفيف 1: 100 من CD11b و Ly6C و Ly6G) ، قم بتلطيخ الخلايا المخصبة مسبقا كما هو موضح في الخطوات 2.2-2.5.
ملاحظة: قم بتضمين بقعة قابلة للبقاء قابلة للإصلاح لضمان فرز الخلايا النخاعية الحية. لا تتجاوز تركيز التلوين 1 × 108 خلايا / مل. اضبط الحجم ، وقسم العينات إلى آبار متعددة للتعويض عن أعداد الخلايا العالية. - أعد تعليق الخلايا في مخزن مؤقت للفرز على البارد (PBS مع 1٪ وزن / حجم BSA ، 25 ملي مولار 4- (2-هيدروكسي إيثيل) -1-بيبرازين إيثان سلفونيك حمض (HEPES) ، و 1 ملي مولار EDTA). قم بتصفية العينة من خلال أنبوب بولي بروبيلين دائري القاع سعة 5 مل بغطاء مصفاة 40 ميكرومتر. احتفظ بالخلايا على الجليد ، وقم بتغطية الأنبوب بورق الألمنيوم.
ملاحظة: اضبط تركيز الخلايا/الحجم وفقا لمواصفات الجهاز المطلوبة للفرز. - قم بإعداد أنبوب جمع العينات مع وسيط التقاط (5 مل أنبوب بولي بروبلين دائري القاع يحتوي على PBS مع 50٪ FBS).
ملاحظة: تلتقط الأنابيب المعطفية بسعة 5 مل متوسطا طوال الليل قبل الفرز. تخلص من كل وسيط الالتقاط باستثناء 1-2 مل في اليوم التالي قبل تشغيل العينة. - قم بتعديل إعدادات أداة الفرز لتقليل ضغط العينة ومنع الاضطرابات في تكوين القطرات. جهز طرف الفوهة 130 ميكرومتر ، واستخدم إعداد 10 رطل لكل بوصة مربعة. قم بتشغيل العينة بمعدل تدفق منخفض مع تحريك دوري للعينة عند 100 دورة في الدقيقة ، مع التأكد من أن ترسب القطرات في وسط الأنبوب. بعد الفرز ، احتفظ بالعينة على الجليد.
- احتضان العينة لمدة 10 دقائق عند 4 درجات مئوية. قم بالطرد المركزي للأنبوب لمدة 5 دقائق (500 × جم ، 4 درجات مئوية) ، وتخلص من المادة الطافية ، وأعد تعليق الحبيبات في الوسط المطلوب للمقايسات الوظيفية أو النقل بالتبني.
4. النقل بالتبني للخلايا النخاعية السرطانية المنقاة
- تلقيح الفئران C57BL / 6 البالغة من العمر 6-8 أسابيع داخل الجلد مع 1 × 106 خلايا ورم ميلانيني B16 معلقة في 30 ميكرولتر من PBS.
ملاحظة: قم بتلقيح الفئران مسبقا بحيث لا يتجاوز نمو الورم 100 مم3 بحلول وقت النقل بالتبني. - أعد تعليق الخلايا النخاعية السرطانية المصنفة في PBS مع 25 ملي مولار HEPES و 1 ملي EDTA بتركيز 2 × 106 خلايا / مل. قم بتصفية العينة من خلال أنبوب بوليسترين دائري القاع سعة 5 مل بغطاء مصفاة 40 ميكرومتر. ابق على الجليد.
- تحفيز الفئران والحفاظ عليها تحت التخدير بنسبة 3٪ أيزوفلوران. ضع مرهم العين لمنع جفاف العين / إصابتها.
- قم بتحميل حقنة 31 جم مع 50 ميكرولتر من تعليق الخلية. قم بإخراج فقاعات الهواء عن طريق النقر برفق على المحقنة. نظف موقع الحقن باستخدام مسحة كحولية.
- باستخدام ملقط معقم ، ارفع الجلد عند قاعدة الورم. أدخل الإبرة في الفراغ تحت الجلد بزاوية تصاعدية طفيفة لدخول الورم من أسفل الجلد. استخدم الملقط لقرص الجلد المحيط بالإبرة ، وقم بتوزيع حجم المحقنة ببطء. استمر في الضغط على الجلد بالملقط أثناء إزالة الإبرة ببطء ، واستخدم قطعة قطن لتنظيف التسرب المحتمل.
ملاحظة: تابع أي علاجات علاجية إضافية إذا رغبت في ذلك. - اسمح للفئران بالتعافي من التخدير.
النتائج
توضح النتائج أن هذه الطريقة تنتج إنتاجية عالية من الخلايا النخاعية من أورام الفئران الصلبة. يسهل الحفاظ على سلامة المستقبلات وقابلية الخلوية التحليل الوظيفي الموثوق به للمجموعات الفرعية النخاعية المرغوبة. سمحت هذه التحسينات لعزل الخلايا النخاعية بتمييز الوظيفة المتغيرة للخلايا النخاعية داخل الورم عند تطبيع TME باستخدام مثبط هيستون ديستيلاز من الفئة الأولى (HDACi) ، MS-275 ، أثناء العلاج بالخلايا التائية بالتبني. عادة لا تتخذ بروتوكولات عزل TIL الخطوات لتعظيم إنتاجية الخلايا النخاعية9. نتيجة لذلك ، عادة ما يكون الهضم الأنزيمي قاسيا للغاية ويؤدي إلى فقدان صلاحية العينة. عندما تمت معالجة أورام الورم الميلانيني B16 بالنوع الأول من الكولاجيناز لمدة ساعة واحدة (حالة شائعة الاستخدام) قبل التخصيب الإيجابي لخلايا CD45.2 + عن طريق الانتقاء المغناطيسي ، أشار التشكل (منطقة التشتت الأمامية (FSC-A) مقابل منطقة التشتت الجانبية (SSC-A)) والخلايا النخاعية الفرعية (CD11b مقابل CD11c) إلى أن إنتاجية الخلايا النخاعية (CD11b + أو CD11c +) والخلايا غير النخاعية (CD11b- CD11c-) كانت منخفضة للغاية (الشكل 1). لتقليل النشاط المحدد المفرط المحتمل للكولاجيناز ، تم تقليل مدة هضم الورم إلى 30 دقيقة. بينما كان هناك تحسن طفيف في استعادة الخلايا النخاعية ، كان العائد الإجمالي لا يزال منخفضا ولم يكن هناك تحسن في استعادة الخلايا غير النخاعي.
نظرا لأن اختلاف الكمية قد يؤدي إلى ظهور البروتياز بنشاط محدد مرتفع بما يكفي للتسبب في موت الخلايا المفرط ، فقد تم طلب الكثير من نوع الكولاجيناز الأول من مورد تجاري مختلف للمقارنة. ومن المثير للاهتمام أن العائد الإجمالي للخلايا النخاعية وغير النخاعية كان أعلى بكثير ، مع تحسن طفيف في عدد الخلايا النخاعية عند إضافة FBS. على الرغم من إضافة FBS لتثبيت الخلايا النخاعية للتلف الناجم عن الكولاجيناز ، إلا أن هذا أثار التساؤل حول ما إذا كانت FBS تحيد أيضا النشاط التريبتسي لمستحضر الكولاجيناز من النوع الأول ، والذي قد يضعف استعادة الخلايا. نظرا لأن مستحضرات الكولاجيناز من النوع الأول تحتوي على أنشطة كولاجيناز وكازيناز وكلوستربين وتريبتيك10 ، لتقليل التعرض للبروتياز ، فقد تمت محاولة الهضم باستخدام الكولاجيناز من النوع الرابع ، والذي يحتوي على نشاط أعلى خاص بالكولاجيناز ونشاط تربتيك أقل. أدت هذه الحالة إلى زيادة أكبر في إنتاجية الخلايا النخاعية ، مع إضافة FBS مما أدى إلى أعلى عائد. ومن المثير للاهتمام أن النوع الأول من الكولاجيناز والنوع الرابع ، مع أو بدون FBS ، لم يغيرا بشكل ملحوظ العائد الإجمالي للخلايا غير النخاعي.
مع ظروف الهضم الأنزيمية المحسنة هذه ، تم عزل الكريات البيض من أورام الورم الميلانيني B16 في الفئران ، وتم استخدام قياس التدفق الخلوي للتنميط الظاهري لمجموعات الخلايا النخاعية المختلفة داخل TME بناء على تعبيرها عن علامات السطح. تم حصاد الأورام ومعالجتها وعزل الكريات البيض باستخدام مجموعة الاختيار المغناطيسي CD45.2. ثم تم تلطيخ الخلايا باستخدام لوحة مصممة بعناية من علامات سطح الخلية (الشكل 2). تبدأ استراتيجية البوابات الموضحة هنا بتقييم مورفولوجي للخلايا باستخدام FSC-A مقابل SSC-A. هذا يسمح باستبعاد الحطام الخلوي بناء على صغر حجمه. تم استخدام FSC-H مقابل FSC-W لتحديد الخلايا المفردة واستبعاد الزوجيات. ثم تم بوابات إجمالي الكريات البيض الحية بناء على CD45.2 وتلوين البقاء. تم استبعاد الخلايا الليمفاوية بناء على تلطيخ NK1.1 و CD4 و CD8. لاحظ أنه في الفئران BALB / c ، يمكن استخدام Asialo-GM1 و / أو DX5 لاستبعاد الخلايا القاتلة الطبيعية (NK) حيث لا يتم التعبير عن NK1.1 في خلايا NK المشتقة من BALB / c. ثم تم رسم CD11b ضد CD11c لتحديد الخلايا المتغصنة المرتبطة بالورم (TADCs) / الخلايا المتغصنة التقليدية (cDCs).
تمثل الخلايا السالبة ل CD11c الخلايا النخاعية السائبة ، والتي يمكن فصلها بشكل أكبر بناء على تلطيخ Ly6C و Ly6G. تمثل الخلايا التي تعبر عن مستويات متوسطة من Ly6C والمستويات العالية من Ly6G العدلات. تشترك هذه المجموعة في نفس النمط الظاهري للخلايا المثبطة المشتقة من الخلايا النخاعية الحبيبية (G-MDSCs). يمكن تقسيم خلايا CD11b + التي تكون سلبية ل Ly6G ، ولكنها إيجابية ل Ly6C إلى Ly6Chi وLy6C int و Ly6Clo. تعبر خلايا Ly6Cint / hi عن مستويات أقل من F4 / 80 وتمثل الخلايا الوحيدة الالتهابية. ومع ذلك ، تشترك خلاياLy6C hi أيضا في نفس النمط الظاهري مع الخلايا المثبطة المشتقة من النخاع أحادي الخلية (M-MDSCs). أخيرا ، تعبر الخلاياالداخلية Ly6C عن مستويات عالية من F4 / 80 وعادة ما ترتبط بالضامة المرتبطة بالورم (TAMs). في حين أن هذا التوصيف قد لا يحدد بشكل كامل المجموعات الفرعية للخلايا النخاعية ذات الأهمية ، إلا أنه يوفر استراتيجية بوابة مفيدة لفرز مجموعات الخلايا النخاعية داخل TME لمزيد من التحليلات الوظيفية أو الجينومية. في سياق العلاج المناعي ، يمكن أن يؤثر العلاج بالخلايا التائية بالتبني الذي يتضمن أدوية معدلة للجينة ، مثل مثبط هيستون ديستيلاز من الفئة الأولى (HDACi) MS-275 ، على TME لتعزيز انحدار الورم المستمر ، بينما يؤدي غيابه إلى انتكاسة الورم8.
على الرغم من أن تحليل المصفوفات الدقيقة للحمض النووي الريبي للورم السائب يشير إلى دور الخلايا النخاعية المتسللة للورم ، إلا أن هذا التوصيف الظاهري لم يشير إلى تغييرات كبيرة في علامات السطح أثناء علاج MS-2758. ومن المثير للاهتمام ، أن العلامات الوظيفية الموجودة في لوحة تلطيخ قياس التدفق الخلوي حددت مجموعة فرعية معينة من الخلايا النخاعية (CD11b + Ly6Chi Ly6G-) تنتج بشكل تفاضلي سينسيز أكسيد النيتريك 2 (NOS2) و arginase 1 (Arg1) ، وهي قراءات ضمنية للبرمجة الوظيفية المستقطبة أو المتباينة (الشكل 3 أ). من خلال فرز خلايا CD11b + Ly6Chi Ly6G- من الفئران الحاملة للورم المعالجة تفاضليا ، يمكن إجراء دراسات وظيفية أكثر شمولا لفهم دورها. باستخدام ملصقات الكربوكسي فلوريسين إستر السكسينيميديل (CFSE) لمراقبة تكاثر الخلايا الليمفاوية11 ، تم العثور على الخلايا النخاعية المصنفة المشتقة من الفئران الساذجة والملقحة لتثبيط تكاثر الخلايا التائية في المختبر ، في حين أن الخلايا المشتقة من الفئران الملقحة + المعالجة ب MS-275 قد قللت من الوظيفة المثبطة للمناعة (الشكل 3 ب). كشف النقل بالتبني لهذه الخلايا أنها تمتلك بدلا من ذلك قدرة مضادة للأورام وعززت الانحدار المستمر للأورام أثناء التطعيم وبقاء الفئران على قيد الحياة لفترات طويلة (الشكل 3 ج).

الشكل 1: البيانات التمثيلية التي توضح فعالية ظروف التفكك المختلفة. في الفئران C57BL / 6 (ن = 3 لكل مجموعة) ، تمت معالجة أورام B16F10-gp33 داخل الأدمة غير المعالجة وفصلها في ظل ظروف إنزيمية مختلفة قبل اختيار CD45.2. كما هو موضح أعلاه استراتيجيات بوابات قياس التدفق الخلوي المستخدمة لإثبات اختلافات الإنتاجية الخلوية (FSC-A مقابل. SSC-A) يوضح محصول الكريات البيض المتسللة للورم ضمنيا من خلال تمييز حجم الخلية / الحبيبات. (CD11b مقابل CD11c) يسمح بالقياس الكمي للخلايا النخاعية (CD11b + أو CD11c +) أو غير النخاعية (CD11b- CD11c-). يتم تعريف الخطأ من خلال الخطأ المعياري للمتوسط. الاختصارات: CD = مجموعة التمايز. SSC-A = منطقة الانتثار الجانبية؛ FSC-A = منطقة الانتثار الأمامية ؛ FBS = مصل الأبقار الجنينية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
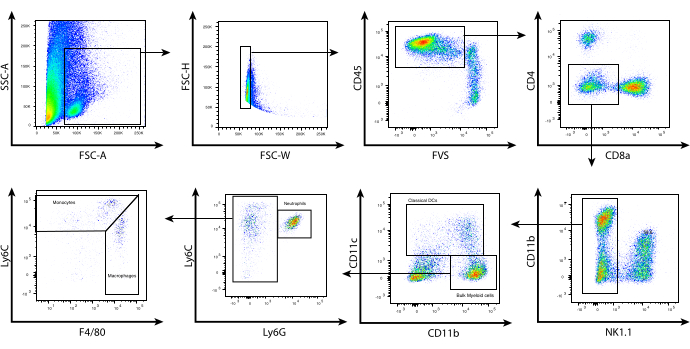
الشكل 2: تحليل قياس التدفق الخلوي التمثيلي للخلايا النخاعية المتسللة للورم. بعد معالجة الورم واختيار CD45.2 ، تم تلطيخ الخلايا المخصبة على السطح كما هو موضح في البروتوكول. كما هو موضح أعلاه هو استراتيجية البوابات المستخدمة لاستبعاد الخلايا الليمفاوية وتحديد المجموعات الفرعية الفردية للخلايا النخاعية داخل البيئة المكروية للورم. الحطام (SSC-A مقابل FSC-A) والمزدوجات (FSC-H مقابل FSC-W) ، وتم تحديد الخلايا الحية CD45.2 + باستخدام بقعة البقاء القابلة للإصلاح FVS510 (CD45.2 vs. FVS). تم إخراج خلايا CD4 + و CD8 + و NK1.1+ . تمثل خلايا CD11bhi / lo CD11c + cDCs. CD11b + CD11c- تم إخضاعها بعد ذلك بناء على تعبير Ly6C و Ly6G. تم تحديد ثلاثة مجموعات سكانية: (أنا) Ly6Cint Ly6G + (العدلات / G-MDSCs) ، (ii) Ly6Chi Ly6G- F4 / 80lo / int (الخلايا الوحيدة / M-MDSCs) ، (ثالثا) Ly6Clo / int Ly6G- F4 / 80hi (الضامة / TAMs). الاختصارات: CD = مجموعة التمايز. SSC-A = منطقة الانتثار الجانبية؛ FSC-A = منطقة الانتثار الأمامية ؛ FSC-H = ارتفاع الانتثار الأمامي ؛ FSC-W = عرض مبعثر إلى الأمام ؛ FVS = بقعة قابلة للإصلاح ؛ cDCs = الخلايا المتغصنة التقليدية. Ly = مستضد الخلايا الليمفاوية. G-MDSCs = الخلايا المثبطة المشتقة من الخلايا النخاعية المحببة ؛ M-MDSCs = الخلايا المثبطة المشتقة من النخاع أحادي الخلية ؛ TAM = الضامة المرتبطة بالورم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التحليلات الوظيفية للخلايا النخاعية المنقاة التي تتسلل إلى الورم. في الفئران C57BL / 6 (ن = 3-5 لكل مجموعة) ، كانت أورام B16F10-gp33 داخل الأدمة إما غير محصنة أو تعطى علاجا بالخلايا التائية بالتبني في وجود أو عدم وجود مثبط HDAC ، MS-275. بعد خمسة أيام من العلاج ، تمت معالجة الأورام وإثرائها بشكل إيجابي لخلايا CD11b +. تم تلطيخ الخلايا على السطح لفرعي على المجموعة الفرعية للخلايا النخاعية المرغوبة التي تتسلل إلى الورم (CD11b + Ly6Chi Ly6G-). (أ) تم تلطيخ هذه الخلايا بشكل أكبر داخل الخلايا للحصول على علامات يمكنها تحديد قطبية التنشيط الوظيفي ، ويتم تقديم البيانات على أنها تردد خلايا CD11b + Ly6Chi Ly6G- التي تنتج NOS2 أو Arg1. بدلا من ذلك ، تم فرز الخلايا النخاعية المخصبة ب CD11b + الملطخة بالسطح للحصول على مجموعة خلايا Ly6Chi Ly6G- نقية. (ب) كانت هذه الخلايا المنقاة نابضة بالببتيد وزراعتها مع الخلايا التائية المعدلة وراثيا TCR الساذجة المسماة CFSE بنسب متفاوتة. يظهر تخفيف CFSE ، كما هو محدد بواسطة قياس التدفق الخلوي ، كرسم بياني تمثيلي ويتم تحديده كميا بواسطة مؤشر الانقسام الخلوي (1: 1). (ج) تم نقل خلايا CD11b + Ly6Cعالية Ly6G المنقاة بشكل منفصل المشتقة من الفئران الحاملة للورم الملقحة + المعالجة ب MS-275 بالتبني إلى فئران جديدة حاملة للورم (ن = 5) بالتزامن مع التطعيم وانحدار الورم ، وتمت مراقبة منحنيات البقاء على قيد الحياة. يتم تعريف الخطأ من خلال الخطأ المعياري للمتوسط. ع = 0.0004 ، * ص = 0.0479 ، **** ص <0.0001. تم تعديل هذا الرقم من Nguyen et al. 8. الاختصارات: CD = مجموعة التمايز. HDAC = مثبط هيستون ديستيلاز. NOS2 = سينسيز أكسيد النيتريك 2 ؛ Arg1 = أرجيناز 1 ; CFSE = كربوكسي فلوريسين إستر السكسينيديل. TCR = مستقبلات الخلايا التائية. Ly = مستضد الخلايا الليمفاوية. NS= غير مهم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
على الرغم من وجود الخلايا النخاعية المتسللة للورم في حالات تنشيط وتمايز متفاوتة داخل الورم ، فقد تم تحديد العديد من المجموعات الفرعية بما في ذلك DCs المرتبطة بالورم (TADCs) ، والعدلات المرتبطة بالورم (TANs) ، والخلايا المثبطة المشتقة من النخاع (MDSCs) ، والضامة المرتبطة بالورم (TAMs) 12. لسوء الحظ ، فإن التعبير المتداخل لعلامات سطح الخلية المستخدمة لتحديد هذه المجموعات الفرعية للخلايا النخاعية يجعل من الصعب حاليا التمييز بين الخلايا النخاعية السرطانية الظاهريا والخلايا النخاعية الأخرى13. وبالمثل ، قد لا يمكن ملاحظة التغيرات المظهرية الناجمة عن العلاج في الخلايا النخاعية المتسللة للورم بسهولة باستخدام ألواح تلطيخ الأجسام المضادة النخاعية الموجودة. مجتمعة ، فإن عدم كفاية علامات السطح الفريدة يعقد فهم بيولوجيا الخلايا النخاعية. لتحديد الخلايا النخاعية الطبيعية التي يحركها الورم والمتأثرة بالعلاج ، يجب أن يتم تقييم المجموعات الفرعية للخلايا النخاعية وفقا لوظيفتها بالإضافة إلى خصائصها المظهرية.
تسمح الطرق الموضحة هنا لحصاد أنسجة الورم وفصلها بعزل الخلايا النخاعية مع الحفاظ على الجدوى وسلامة علامة السطح. نظرا لأن الخلايا النخاعية المتسللة للورم حساسة للتلاعب خارج الجسم الحي 7 ، فإن تركيز البروتوكول ينصب على التفكك الميكانيكي والأنزيمي الأقل عدوانية. ومع ذلك ، اعتمادا على نوع الأنسجة السرطانية ، تتطلب العينات المختلفة علاجا عدوانيا متغيرا لتوليد معلق أحادي الخلية. لمزيد من نماذج الأورام الغنية بالكولاجين (مثل الساركوما الليفية CMS5) ، يمكن استخدام مكبس حقنة بالإضافة إلى المقص لتقسيم أنسجة الورم ميكانيكيا بشكل كامل قبل العلاج الأنزيمي. على العكس من ذلك ، فإن نماذج الأورام الأقل ثراء بالكولاجين (أي الورم الميلانيني B16) لا تتطلب بالضرورة علاجا إنزيميا. كما هو موضح في هذه النتائج ، يمكن أن يؤثر نوع تحضير الكولاجيناز والكمية التي اشتق منها بشكل كبير على تنوع وفاعلية البروتياز التي تتعرض لها الخلايا أثناء التفكك الأنزيمي.
في حين أن الكريات البيض غير النخاعية (أي الخلايا الليمفاوية) لا تبدو حساسة ، فإن هذه البيانات تشير إلى أن الخلايا النخاعية ، على وجه الخصوص ، قد تكون شديدة التعرض للتعرض المفرط للبروتياز (الشكل 1) ، مما يؤدي إلى تلف بروتينات الغشاء وانخفاض الجدوى. نتيجة لذلك ، يوصى باستخدام الكولاجيناز من النوع الرابع على النوع الأول من الكولاجيناز لزيادة نشاطه المحلل للبروتين الخاص بالكولاجيناز ودمج FBS في مزيج الهضم لتحييد النشاط التريبتسي المتبقي. علاوة على ذلك ، فإن استخدام منتجات الكولاجيناز النقية ، على عكس المستحضرات الخام من المصادر التجارية ، يمكن أن يزيد من قابلية استنساخ الاستعادة الخلوية. بمجرد اكتمال الهضم ، فإن إضافة EDTA والحضانة عند 4 درجات مئوية أمر إلزامي لاستخلاص أيونات Ca2+ وتقليل درجة الحرارة اللازمة لنشاط الكولاجيناز14.
لتوصيف تسلل الخلايا النخاعية داخل مجموعة TIL غير المتجانسة ، تم توفير استراتيجيات بوابات عالية المستوى (الشكل 2). يجب تصميم لوحة قياس التدفق الخلوي متعدد الألوان بطريقة 1) يتم استبعاد الخلايا الميتة وغير النخاعية ، 2) يمكن تحديد مجموعات فرعية للخلايا النخاعية ، و 3) يمكن ملاحظة الوظائف المتغيرة ضمنيا عبر مجموعات العينات (الشكل 3). اعتمادا على عدد المجموعات الفرعية للخلايا النخاعية ذات الأهمية وعمق التوصيف الوظيفي ، قد لا يتم استيعاب هذه المعايير بالكامل داخل لوحة تلطيخ واحدة. لتحرير القنوات لللوحة ، يمكن تجميع العلامات بشكل استراتيجي في قناة تفريغ واحدة. على الرغم من أن هذه الطريقة تسمح بتحليل عالي الأبعاد للخلايا النخاعية المتسللة إلى الورم ، إلا أنها لا تزال مقيدة بحد معلمة منخفض نسبيا. تتيح التقنيات الحديثة التي تستخدم أيونات مراسل المعادن الثقيلة ، مثل قياس الكتلة الخلوية ، ما يصل إلى 40 معلمة مستقلة داخل لوحة واحدة ، مما سيسمح بدراسة أفضل للتنوع الخلوي والوظيفي للخلايا النخاعية داخل TME15.
ومع ذلك ، فإن تكلفة الأجهزة تحد من انتشار استخدامها في كل مكان. يمكن الوصول إلى قياس التدفق الخلوي بشكل أكبر وينتج بيانات توصيف موثوقة ، على الرغم من أن خلط ومطابقة العلامات عبر لوحات متعددة يتطلب التحقق من صحة اللوحة كخطوة مهمة للغاية قبل التجربة. عند تحديد المجموعات الفرعية النخاعية المتسللة للورم ذات الأهمية ، يصف العديد من الباحثين15 تقنيات لفرز هذه الخلايا للفحوصات والدراسات الوظيفية. يمكن تحليل الخلايا التي تم فرزها بشكل موثوق لقدرتها على قمع الخلايا التائية في المختبر بالإضافة إلى قدرتها على مقاومة الأورام في الجسم الحي بعد نقلها بالتبني إلى نماذج فئران لانتكاس الورم (الشكل 3). بشكل عام ، تكمن أهمية الطرق الموصوفة في أنه ، بالمقارنة مع بروتوكولات عزل TIL الأخرى ، تم تصميم ظروف حصاد الورم ، والتفكك ، وإثراء الخلايا ، وفرز الخلايا من أجل الحصول على عائد مرتفع من حجرة الخلايا النخاعية بشكل متكرر على جميع الكريات البيض الأخرى ودون المساس بوظيفتها.
Disclosures
لم يتم الإعلان عن أي تضارب في المصالح.
Acknowledgements
تم دعم هذا العمل من قبل معهد أونتاريو لأبحاث السرطان من خلال التمويل المقدم من حكومة أونتاريو ، وكذلك المعاهد الكندية للبحوث الصحية (FRN 123516 و FRN 152954) ، وجمعية السرطان الكندية (منحة 705143) ، ومعهد تيري فوكس للأبحاث (TFRI-1073).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 700 Mouse Anti-Mouse CD45.2 | BD Biosciences | 560693 | 1:100 |
| APC-Cy7 Mouse Anti-Mouse NK-1.1 | BD Biosciences | 560618 | 1:100 |
| Biotin Mouse Anti-Mouse CD45.2 | BD Biosciences | 553771 | |
| BV421 Hamster Anti-Mouse CD11c | BD Biosciences | 562782 | 1:100 |
| BV650 Rat Anti-Mouse F4/80 | BD Biosciences | 743282 | 1:100 |
| BV711 Rat Anti-Mouse CD8a | BD Biosciences | 563046 | 1:100 |
| Collagenase, Type IV, powder | Gibco | 17104019 | |
| DNase I | Roche | 10104159001 | |
| EasySep Mouse CD11b Positive Selection Kit II | Stemcell technologies | 18970 | |
| EasySep Mouse CD11c Positive Selection Kit II | Stemcell technologies | 18780 | |
| EasySep Release Mouse Biotin Positive Selection Kit | Stemcell technologies | 17655 | |
| FITC Rat Anti-Mouse Ly-6C | BD Biosciences | 553104 | 1:100 |
| Fixable Viability Stain 510 | BD Biosciences | 564406 | 1:1000 |
| Fixation/Permeabilization Solution Kit (BD Cytofix/Cytoperm) | BD Biosciences | 554714 | |
| PE Rat Anti-CD11b | BD Biosciences | 557397 | 1:100 |
| PE-Cy7 Rat Anti-Mouse CD4 | BD Biosciences | 552775 | 1:100 |
| PerCP-Cy5.5 Rat Anti-Mouse Ly-6G | BD Biosciences | 560602 | 1:100 |
| Perm/Wash (BD Perm/Wash) | BD Biosciences | 554723 | |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | |
| iNOS Monoclonal Antibody (CXNFT), APC | Thermo Fisher | 17-5920-82 | 1:100 |
| Human/Mouse Arginase 1/ARG1 Fluorescein-conjugated Antibody | R&D Systems | IC5868F | 1:100 |
References
- Paardekooper, L. M., Vos, W., vanden Bogaart, G. Oxygen in the tumor microenvironment: effects on dendritic cell function. Oncotarget. 10 (8), 883-896 (2019).
- Schouppe, E., De Baetselier, P., Van Ginderachter, J. A., Sarukhan, A. Instruction of myeloid cells by the tumor microenvironment: Open questions on the dynamics and plasticity of different tumor-associated myeloid cell populations. Oncoimmunology. 1 (7), 1135-1145 (2012).
- Jahchan, N. S., et al. Tuning the tumor myeloid microenvironment to fight cancer. Frontiers in Immunology. 10, 1611(2019).
- Srivastava, M. K., et al. Myeloid suppressor cell depletion augments antitumor activity in lung cancer. PLoS One. 7 (7), 40677(2012).
- Awad, R. M., De Vlaeminck, Y., Maebe, J., Goyvaerts, C., Breckpot, K. Turn back the TIMe: targeting tumor infiltrating myeloid cells to revert cancer progression. Frontiers in Immunology. 9, 1977(2018).
- Strauss, L., et al. Targeted deletion of PD-1 in myeloid cells induces antitumor immunity. Science Immunology. 5 (43), 1863(2020).
- Cassetta, L., et al. Deciphering myeloid-derived suppressor cells: isolation and markers in humans, mice and non-human primates. Cancer Immunology, Immunotherapy. 68 (4), 687-697 (2019).
- Nguyen, A., et al. HDACi delivery reprograms tumor-infiltrating myeloid cells to eliminate antigen-loss variants. Cell Reports. 24 (3), 642-654 (2018).
- Newton, J. M., Hanoteau, A., Sikora, A. G. Enrichment and characterization of the tumor immune and non-immune microenvironments in established subcutaneous murine tumors. Journal of Visual Experiments: JoVE. (136), e57685(2018).
- Engfeldt, P., Arner, P., Ostman, J. Nature of the inhibitory effect of collagenase on phosphodiesterase activity. Journal of Lipid Research. 26 (8), 977-981 (1985).
- Quah, B. J., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. Journal of Visual Experiments: JoVE. (44), e2259(2010).
- Schupp, J., et al. Targeting myeloid cells in the tumor sustaining microenvironment. Cellular Immunology. 343, 103713(2019).
- Gabrilovich, D. I., Ostrand-Rosenberg, S., Bronte, V. Coordinated regulation of myeloid cells by tumours. Nature Reviews Immunology. 12 (4), 253-268 (2012).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Roussel, M., et al. Mass cytometry deep phenotyping of human mononuclear phagocytes and myeloid-derived suppressor cells from human blood and bone marrow. Journal of Leukocyte Biology. 102 (2), 437-447 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.