Method Article
Биолюминесценция в режиме реального времени Визуализация динамики сигнализации во время Нейрогенеза Murine
В этой статье
Резюме
Нейронные стволовые/клетки-прародители демонстрируют различную экспрессионную динамику сигнальных компонентов Notch, которые приводят к различным исходам клеточных событий. Такое динамическое выражение может быть выявлено путем мониторинга в реальном времени, а не статического анализа, с использованием высокочувствительной биолюминесценционной системы визуализации, которая позволяет визуализировать быстрые изменения в экспрессии генов.
Аннотация
Сигнализация notch регулирует обслуживание нервных клеток ствола/прародителя взаимодействиями клетки-клетки. Компоненты сигнализации Notch демонстрируют динамическое выражение. Эффектор сигнала Hes1 и Notch ligand Delta-like1 (Dll1) выражены в колебательной манере в нервных стволовых/прагениторных клетках. Поскольку период колебательной экспрессии этих генов очень короткий (2 ч), трудно контролировать их циклическое выражение. Для изучения таких быстрых изменений в экспрессии гена или динамике белка требуется быстрая реакция репортеров. Из-за его быстрой кинетики созревания и высокой чувствительности, биолюминесценция репортер luciferase подходит для мониторинга быстрых изменений экспрессии генов в живых клетках. Мы использовали дестабилизированный репортер люциферазы для мониторинга активности промоутера и luciferase-слитый репортер для визуализации динамики белка с разрешением одной клетки. Эти биолюминесценции репортеры показывают быстрый оборот и генерировать очень слабые сигналы; поэтому мы разработали высокочувствительную систему визуализации биолюминесценции для обнаружения таких слабых сигналов. Эти методы позволяют нам контролировать различные динамики экспрессии генов в живых клетках и тканях, которые являются важной информацией, чтобы помочь понять фактические клеточные состояния.
Введение
Мозг млекопитающих состоит из большого количества различных типов нейронов и глиальных клеток. Все клетки генерируются из нервных стволовых / прародителей клеток (NPCs), которые сначала размножаются, чтобы расширить их число, затем начинают дифференцироваться в нейроны, и, наконец, привести к глиальных клеток1,2,3,4,5. После того, как клетки дифференцированы в нейроны, они не могут размножаться или увеличивать их число, и, следовательно, поддержание NpCs до более поздних стадиях имеет важное значение. Прочка сигнализации через ячейки взаимодействия играет важную роль в поддержании NPCs6,7. Выемка лиганды взаимодействуют с мембранным белком, Notch, на поверхности соседних клеток и активирует белок Notch. После активации происходит протеоз белка Notch, тем самым высвобождая внутриклеточное достояние Notch (NICD) из клеточной мембраны в ядро8,9,10. В ядре NICD связывается с областями промотора Hes1 и Hes5 (Hes1/5) и активирует экспрессию этих генов. Hes1/5 подавляют экспрессию проневрюкгенных генов Ascl1 и Neurogenin1 (Neurog1/2)11,12,13,14. Поскольку проневральные гены вызывают дифференциацию нейронов, Hes1/5 играет важную роль в поддержании NPC. Кроме того, поскольку проневрюновые гены могут активировать экспрессию Нотх лиганда Дельта-like1 (Dll1), Hes1/5 также подавляет экспрессию Dll1. Таким образом, выражение Dll1 приводит к тому, что соседние клетки являются отрицательными для Dll1 через Сигнализацию Notch. Таким образом, клетки ингибируют соседние клетки от следующих их же судьбы, явление, известное как боковое ингибирование8. В развивающемся мозге боковое ингибирование играет роль в генерации различных типов клеток.
Визуализация в режиме реального времени на уровне одной клетки показывает динамические выражения компонентов сигнализации Notch вNPC 15,16,17. Прочка сигнализации активизирует выражение Hes1, но Hes1 белка связывается с собственным промоутером и подавляет свое собственное выражение. Кроме того, Hes1 является чрезвычайно нестабильным белком, который деградирует убиквитин-протеасомы пути; поэтому, репрессии своего собственного промоутера только недолго, а затем транскрипция начинается снова. Таким образом, выражение Hes1 колеблется как на транскрипции, так и на переводном уровне в цикле182 ч. Колеблящее выражение Hes1, в свою очередь, индуцирует колебальное выражение нюшенных генов, таких как Ascl1, Neurog2, и Dll1, через периодические репрессии15,16,17,19. В то время как проневральные гены могут вызвать дифференциацию нейронов, их колебательная экспрессия недостаточна для дифференциации нейронов; а их устойчивое выражение имеет важное значение для дифференциации нейронов. Колеблющее выражение проневральных генов важно для поддержания NPC, а не для индуцирования дифференциации нейронов14,15,16. Выражение Dll1 колеблется как на транскрипции, так и на переводном уровне при различных морфогенезах, таких как нейрогенез и сомитогенез. Динамическое выражение Dll1 важно для нормального морфогенеза и устойчивое выражение Dll1 вызывает дефекты в нейрогенезе и сомитогенезе17. Эти выводы демонстрируют важную функцию, которую динамика экспрессии генов и кинетики белка оказывают на регуляцию различных событий развития (т.е. различная динамика экспрессии производит различные выходы в клеточном поведении).
Для анализа динамики сигнализации Notch статического анализа тканей и клеток недостаточно, так как они постоянно меняются. В режиме реального времени изображение одиночных клеток является мощным инструментом для выявления динамики экспрессии генов. Динамическое выражение сигнальных молекул Notch подвергается быстрым циклическим реакциям в период 2-3 ч. Это быстрое периодическое выражение представляет две трудные проблемы для мониторинга в реальном времени: (1) выражение молекул подавляется до низких уровней, и (2) быстрый оборот требует быстрого реагирования репортеров. Чтобы преодолеть эти проблемы, мы ранее разработали метод визуализации биолюминесценции в режиме реального времени20. Поскольку биолюминесценция репортер имеет более высокую чувствительность и короче время созревания, чем флуоресцентные репортеры, эта стратегия позволяет нам контролировать быструю динамику в живых клетках. Используя визуализацию в реальном времени, мы обнаружили, что больше генов обладают динамическим экспрессией, чем мы думали ранее. Кроме того, увеличилось количество сообщений, показывающих экспрессию и белковую динамику в живых клетках и значение этой динамики в различных биологических событиях, что свидетельствует о фундаментальной роли динамики в экспрессиях генов21,22.
В этом отчете мы описываем способ визуализации выражения Notch ligand Dll1 в NPC как в разобщенных культурах, так и в корковых срезанных культурах. Для мониторинга динамики транскрипции Dll1 на уровне одной клетки, мы создали разъединенные культуры NPCs, полученные из эмбрионального теленефалиона трансгенных мышей, несущих pDll1-Ub-Fluc репортер, Dll1 промоутер-управляемый дестабилизированной люциферазы репортер. Для мониторинга динамики белка Dll1 in vivo мы ввели репортера о слиянии Dll1-Fluc в NPC в коре головного мозга и визуализировали экспрессию репортера в NPC в корковых срезанных культурах. Изображения в режиме реального времени позволили нам запечатлеть различные особенности экспрессии генов и белковую динамику в живых клетках с высоким временным разрешением.
протокол
Все процедуры, включая предметы животного, были одобрены Институциональным комитетом по уходу за животными и использованию в Институте пограничной жизни и медицинских наук Киотского университета.
1. Биолюминесценция репортеров
ПРИМЕЧАНИЕ: Лучифераза репортер подходит для измерения быстрой динамики промоутер деятельности путем сплавляя сигнал деградации. Кроме того, репортер luciferase fusion позволяет контролировать динамику белка в одной клетке. Оба типа репортеров доступны для монослойной культуры (культура диссоциации) и тканевой культуры (культура среза).
- Репортер для мониторинга Dll1 промоутер деятельности17
ПРИМЕЧАНИЕ: Для мониторинга быстрых изменений в экспрессии генов, быстрой реакции и нестабильной репортер имеет важное значение. Светлячок люциферазы (Fluc) показывает быстрое созревание по сравнению с флуоресценцией репортеров. Поскольку убиквитин сливается luciferase репортер (Ub-Fluc) показывает быструю деградацию и быстрой оборота, это очень полезно для мониторинга динамического экспрессии генов в живых клетках20.- Используйте Dll1 промоутер инициативе дестабилизированных luciferase репортер, вездесущий luciferase (pDll1-Ub-Fluc, Рисунок 1Верхняя панель), чтобы контролировать быстрые изменения в выражении Dll1 на транскрипционном уровне17.
- Создайте трансгенную линию мыши, несущую pDll1-Ub-Fluc для стабильного выражения этого репортера.
- Репортер для мониторинга динамики белка Dll117.
- Для генерации стук-в мышах, вставьте luciferase кДНК в 3 " термини dll1 кодирования области так, что Dll1-люцифераза синтез белка выражается (Dll1-Fluc репортер, Рисунок 1A, нижняя панель)17.
- Мониторинг экспрессии динамики Dll1 на уровнях белка путем измерения активности люциферазы.
- Для мониторинга динамики белка Dll1 на уровне тканей, введите репортера Dll1-Fluc в NPCs в эмбриональной теленефалии при электропорации матки.
2. Биолюминесценция системы визуализации
- Постройте биолюминесценцию живой визуализации системы с помощью перевернутого микроскопа, установленного с высокой чувствительностью, водяным охлаждением CCD камеры. Для того, чтобы уменьшить шум и получить высокую чувствительность, охладите камеру охлажденной водой, предоставляемой циркулятором воды при оптимизированной температуре -90 градусов по Цельсию.
- Для визуализации живых клеток/тканей установите инкубационную систему, контролируя температуру и смешанный газ, на стадию микроскопа.
- Для визуализации выражения дестабилизированной люциферазы репортер, используйте высокий численный угол (NA: 1.30) 40x масло погружения объективной линзы. Рабочая дистанция этого объектива составляет 0,2 мм, она доступна не только для монослойной клеточной культуры, но и для культуры срезов.
- Для двойного мониторинга люциферазы и флуоресцеина репортер выражение, установить светодиодное освещение устройства на световой путь микроскопа.
- Управление замедленной визуализацией с помощью программного обеспечения, связанного с микроскопом (например, многомерная программа приобретения программного обеспечения MetaMorph).
- Подготовьте всю систему в темной комнате, потому что сигнал дестабилизированного репортера люциферазы очень слабый, и, чтобы избежать посторонних света предотвратить приобретение.
3. Нейронная ствол/клетка-прародитель (NPC) разъединяет культуры
- Подготовка культурных носителей, посуды и реагентов для культуры диссоциации NPC
- Подготовка N2/B27 средств массовой информации для культивирования нервных стволовых / прародителей клеток с окончательной концентрацией 1x N2, 1x B27, 1 мМ N-ацетилцистеин, 10 нг /мЛ bFGF и 50 U/mL пенициллин / Streptomycin в DMEM/ F12 сми.
- Подготовьте папинское решение для диссоциации, содержащее 7 U/mL папаин, 0.006% DNase и 1 мМ N-ацетилцистеин в средствах массовой информации ЭБСС.
- Приготовьте 100 мМ раствора люциферина натрия для визуализации люциферин. Разбавить раствор люциферина N2/B27 до конечной концентрации 1 мМ.
ПРИМЕЧАНИЕ: Люциферин показывает автофлюорезцеин себя. В случае люциферазы-флуоресценции двойной визуализации, особенно EGFP, снижение концентрации люциферина до 0,5 мм лучше. - Пальто 35-мм стеклянной донной посуды (стеклянный диаметр 27 мм) с 40 мкг/мл поли-L-лизин (PLL) раствор омрачаемого раствора для 1 ч при комнатной температуре. После инкубации промыть тарелки 3x с PBS и дайте ему высохнуть.
- Рассечение эмбрионов и диссоциация НСПК
- После эвтаназии беременной pDll1-Ub-luc трансгенной мыши (эмбриональный день 12.5 (E12.5)) со стороны CO2 удушья и вывихшей шейки матки, прорезать живот и вынуть матку.
ПРИМЕЧАНИЕ: Исследователи должны следовать правилам и руководящим принципам комитета по исследованию животных своего учреждения. Если используются обезболивающие или обезболивающие препараты, используйте их правильно. - Перенесите матку в 10 см Петри блюдо, содержащее 25 мл ледяной PBS. Выняйте эмбрионы из матки в ледяной PBS, используя микро ножницы и тонкие щипцы.
- Отрежьте голову каждого эмбриона ножницами и перенесите ее на 10 см посуды Петри, содержащей ледяные DMEM/F12. Удалите эпидермис и хрящ, окружающие мозг и перенесите мозг на 35 мм чашку Петри, содержащую ледяной 3 мл n2/B27 носителей.
- Отрежьте правую и левую теленцефалон от диенцефалона(рисунок 1Ba-f, C,D). Удалите оболей, покрывающие поверхность теленефалиона с помощью тонких щипцы(рисунок 1Би). Используя мелкие щипцы снова, вынуть дорсо-боковой части коры из теленефалии(Рисунок 1Bg,h,j-l E).
- Перенесите ткани в новые трубки мощностью 1,5 мл с помощью пипетки P1000 и удалите любую дополнительную среду с помощью пипетки P200. Добавьте 0,1 мл папинского раствора на ткани мозга (пара коры головного мозга). После 15 минут инкубации при 24 градусах Цельсия, аккуратно пипетки образцы 10 раз с P1000 пипетка. Инкубировать образцы снова в течение 15 мин при 24 градусах Цельсия.
- Аккуратно пипетка образцы 10 раз с P1000 пипетка. Центрифуг образцы в течение 3 мин при 400 х г и комнатной температуры (RT). Отбросьте супернатант.
- Добавьте 1 мл средств dMEM/F12 в пеллету. Аккуратно пипетка 10 раз с пипеткой P1000. Центрифуг образцы в течение 3 мин при 400 х г и RT. Отбросьте супернатант. Повторите это по крайней мере еще 2 раза.
- К грануле добавьте 0,5 мл n2/B27 носителей, содержащих 1 мМ люциферин, и хорошо перемешайте. Семя клетки (1 х 106 клеток) к PLL покрытием стеклянной нижней блюдо. Культура клеток в инкубаторе CO2 в течение 1 ч. Как только клетки прилипают к блюду, добавьте 2 мл n2/B27 носителей, содержащих 1 мМ люциферин.
- После эвтаназии беременной pDll1-Ub-luc трансгенной мыши (эмбриональный день 12.5 (E12.5)) со стороны CO2 удушья и вывихшей шейки матки, прорезать живот и вынуть матку.
- Визуализация экспрессии лучиферазы репортера в культуре диссоциации NPC
- Запустите люминесцентную систему живой визуализации перед выполнением вскрытия. Для культуры NPC установите температуру инкубатора на уровне 37 градусов по Цельсию и установите установку газовой смеси 20% O2,5% CO2.
- Положите масло погружения к объективному объективу. Поместите образец блюда на сцену микроскопа. Просматривайте поле вручную и выбирайте наилучшее положение и фокус интересуемых ячеек. Нажмите в прямом эфире, чтобы приобрести тестовое изображение.
- Запустите замедленное приобретение с помощью 2-мерных (люминесценция и яркое поле) приобретений за 24 ч с помощью многомерной программы приобретения. Выберите многомерную программу приобретения и установите настройку приобретения следующим образом (шаг 3.3.6).
- Для приобретения люминесценции используйте следующие настройки камеры: низкая скорость передачи (50 кГц), 2 х 2х 4 х 4 биннинга, 10 мин/5 мин времени экспозиции. Для получения яркого поля используйте следующие настройки: промежуточная скорость передачи (1 МГц), 1 х 1 биннинг и 100 мс время экспозиции.
4. При электропорации матки
ПРИМЕЧАНИЕ: Это выполняется для введения Dll1-Fluc репортера в нейронных клеток-прародителей.
- Подготовка инструментов и реагентов для электропорации
- Подготовка микрокапилляров для инъекции ДНК в желудочек эмбриональной теленефалии. Растянуть траву капилляра с теплом и вырезать и полировать кончик его с полировкой машины.
- Приготовьте смесь ДНК с краситель (например, Трипан синий). Концентрация каждой ДНК составляет 1 мкг/Л в PBS и добавить красителя до конечной концентрации 10%.
ПРИМЕЧАНИЕ: Используйте смесь ДНК для визуализации динамики белка Dll1 следующим образом: Dll1-Fluc (Репортер белка Dll1, Рисунок 2E верхний)и pEF-EGFP (EF промоутер приводом EGFP экспрессии вектор, Рисунок 2Eниже), мониторинг расположения и морфологии трансинфицированных клеток. - Приготовьте два типа анестезии: 3,88 мг/мл пентобарбитала и 0,12% ксилазина, в стерильных 1x PBS.
- Используйте стерильные инструменты и хирургические перчатки во время операции.
- При электропорации матки
- Анестезия во время беременности МЦР мыши (E12.5) путем интраперитонеального введения анестезии с 500 л 3,88 мг/мл пентобарбитала и 500 л 0,12% ксилазина.
ПРИМЕЧАНИЕ: Исследователи должны следовать регулированию экспериментов на животных. Если нужно использовать анестезию или обезболивающие препараты, используйте их должным образом. - Клип волосы и дезинфицировать кожу с хирургическим скраб.
- Проверьте отсутствие ответа щепотку. После того, как педали рефлекс не наблюдается, сделать 2-3 см прорезать живот вдоль средней линии. Положите марли вокруг расчлененных частей и мокрые марли с теплой PBS не высушить разрез. Вынизить правый рог матки осторожно с кольцеобразными щиптом и подсчитайте количество эмбрионов.
- Вводят 1-2 л смешанной ДНК в желудочек теленефалии эмбрионов мягко с микрокапиллярной.
ПРИМЕЧАНИЕ: Когда инъекция успешно, можно увидеть синий цвет красителя над поверхностью матки. - Влажный матки и электрода, прежде чем обеспечить напряжение импульсов, а затем держать голову эмбриона мягко. Установите положительно заряженный электрод в сторону полушария, в который была введена ДНК. Убедитесь, что состояние пульса электропорации составляет 30-50 В на 50 мс, интервал импульсов составляет 1 с (50 мс заряда и 950 мс без заряда). Предоставьте 5 импульсов одному эмбриону и проверьте, что пузырьки генерируются из отрицательно заряженного электрода.
ПРИМЕЧАНИЕ: Убедитесь, что направление электрода: ДНК включена в клетки на стороне положительного электрода. Во время этой процедуры не двигайте положение электрода. - Повторите шаги 4.2.3-4.4.4 для других эмбрионов и верните рог матки в брюшную полость. Проведите ту же процедуру с эмбрионами в левом роге матки.
- После того, как отодвинет левую сторону, шов разреза шелковым швом (4-0) с иглой (17 мм). Перед закрытием разреза полностью, положить теплый PBS в брюшной полости
ПРИМЕЧАНИЕ: Интервал между швами составляет около 2 мм. - После окончания операции поместите мышь на грелку для восстановления после анестезии. Дом мыши по отдельности.
ПРИМЕЧАНИЕ: Исследователи должны следовать своим местным институтом регулирования экспериментов на животных. Если нужно использовать обезболивающие препараты, используйте их должным образом.
- Анестезия во время беременности МЦР мыши (E12.5) путем интраперитонеального введения анестезии с 500 л 3,88 мг/мл пентобарбитала и 500 л 0,12% ксилазина.
5. Подготовка срезовых культур развивающейся коры головного мозга и визуализация экспрессии лучаферазы репортера в корковых ломтиках
- Подготовка культурных носителей и реагентов для срезаных культур коры головного мозга
- Приготовьте обогащенные носители для культивирования корковых ломтиков, содержащих 5% сыворотки крупного рогатого скота плода и 5% сыворотки лошади в n2/B27 media.
- Пузырь 100% O2 газа через DMEM / F12 средств массовой информации для вскрытия и изготовления корковых ломтиков.
ПРИМЕЧАНИЕ: Для безопасного использования кислородного газа храните баллон O2 в цилиндровом шкафу и следите за концентрацией кислорода в воздухе по счетчику концентрации кислорода. - Разбавить 100 мМ люциферина натрия раствор в обогащенных носителях до конечной концентрации 1 мМ.
ПРИМЕЧАНИЕ: Люциферин показывает автофлюорезцеин себя. В случае люциферазы-флуоресценции двойной визуализации, особенно EGFP, более низкая концентрация люциферина (0,5 мм) лучше. - Установите мультигазовый инкубатор на уровне 37 градусов по Цельсию на 40% O2 и 5% CO2.
- Рассечение эмбрионов и обследование экспрессии флуоресцентного репортера
- После эвтаназии беременной мыши, к которой репортеры (Е13.5) вводятся внутриутробно-электропорации (шаг 4.2), прорезать живот и вынуть матку.
ПРИМЕЧАНИЕ: Исследователи должны следовать регулированию экспериментов на животных. При использовании анестезии или обезболивающих препаратов, использовать их должным образом. - Перенесите матку в 10 см петри блюдо, содержащее PBS. Вынизвините эмбрионы из матки в PBS, используя микро ножницы и тонкие щипцы. Отрежьте голову каждого эмбриона и перенесите на 10 см чашку Петри, содержащую DMEM/F12 media, пузырись с 100% O2 газом. Удалите эпидермис и хрящ, окружающий мозг, в dMEM/F12 media.
- Положите мозг на крышку чашки Петри с кольцеобразными щипками и установите крышку на стадии стереоскопического микроскопа флуоресценции. Проверьте область коры головного мозга, выражающую флуоресцентный белок под возбуждающим светом(рисунок 2A,B).
- Передача мозга на силиконовую резиновую разделочную доску, наполненную 30 мл медиа-медиа DMEM/F12, пузырилась 100% газом O2. Удалите олени, покрывающие поверхность теленефалиона, тонкими щипцыми.
- Вырежьте границу между медиальной и боковой частью тонально-телецефалии и разделите на два полушария с помощью микрохирургического ножа или тонких щипцев. Используя микрохирургический нож, вырезать кору, как полосы и сделать корковых ломтиков(Рисунок 2C,D). Пипетка ломтиками со средой с помощью пипетки и передать их в обогащенные носители в 35 мм блюдо.
- Положите ломтики на культуре вставки в стеклянные блюда нижней с обогащенными средствами массовой информации. Исправьте направление ломтиков с помощью тонких щипков. Навяжьте вырезанную поверхность срезов на поверхность культуры вставки. Удалите дополнительные носители пипеткой. Инкубировать ломтики в мульти-газового инкубатора, установленные на 40% O2 и 5% CO2 при 37 градусах по Цельсию в течение 30 мин.
- Добавьте 300 юл обогащенных носителей, содержащих 1 мМ люциферина, в вставить в стеклянную нижнюю тарелку.
- После эвтаназии беременной мыши, к которой репортеры (Е13.5) вводятся внутриутробно-электропорации (шаг 4.2), прорезать живот и вынуть матку.
- Визуализация экспрессии лучиферазы репортера в срезанных культурах
- Запустите люминесцентную систему живой визуализации перед началом вскрытия. Используйте следующее состояние корковых срезовых культур: 40% O2,5% CO2 и 37 градусов по Цельсию.
- Положите масло погружения в 40-x объектив объективной. Положите образец блюда на стадию микроскопа. Приобретите тестовое изображение флуоресцентного и установите положение и плоскость фокуса в интересуемый регион под освещением возбуждания света.
- Запустите замедленное приобретение 3-диаменталальным (люминесценция, флуоресценция и яркое поле) приобретения для 24 ч(рисунок 2F-H). Для приобретения люминесценции используйте следующие настройки камеры: низкая скорость передачи (50 кГц), 2x2/4x4 binning, 10 мин/5 мин времени экспозиции. Для получения флуоресценции и яркого изображения поля используйте следующие настройки: промежуточная скорость передачи (1 МГц), 1x1 binning и 100 мс время экспозиции.
6. Обработка и анализ изображений
- Подключите каждое изображение и сделайте образы стека. Нажмите Импорт Изображения Последовательность из меню файла (Файл (файл) Импорт (импорт) Image Sequence) и выбрать папку, где приобретенные изображения сохраняются. Поместите несколько слов, содержащихся в названии файла, в столбец File name contains.
- Чтобы удалить шум космических лучей на изображениях биолюминесценции, нанесите плагин SpikeNoise Filter ImageJ/Fiji. Откройте изображения стека и нажмите фильтр SpikeNoise.
- Примените плагин Временного фильтра Savitzky Golay, чтобы получить четкую динамику экспрессии репортера. Откройте стек изображения и нажмите Savitzky Golay Временный фильтр.
- Чтобы измерить интенсивность выражения репортера, нанесите плагин Axis Profile Plus к каждой отдельной ячейке. Выберите ячейки и установите ROIs, область интереса, и нажмите кнопку «Профиль оси плюс».
Результаты
Выражения генов Hes1/7 exhibit 2 h цикл колебаний в различных линиях клетки и во время somitogenesis. Кроме того, период колебаний очень короткий, и их мРНК и белки крайне нестабильны с периодом полураспада около 20 мин. При использовании репортера медленной реакции мы не можем проследить такую быструю динамику, а при использовании стабильного репортера он постепенно накапливается, пока экспрессия гена колеблется. Таким образом, репортер должен быть быстро деградировали, чтобы контролировать быструю текучесть таких циклически выраженных генов. Чтобы преодолеть эти проблемы, мы использовали luciferase репортера для мониторинга динамического выражения осцилляторов. Поскольку биолюминесценция репортер имеет короткое время созревания и высокую чувствительность, это позволяет нам контролировать быструю динамику ультрадианских осцилляторов. Как флуоресцентный репортер, лучифераза репортер может контролировать динамику экспрессии белка, будучи слиты с геном кодирования последовательности (Рисунок 1A, Рисунок 2E и Рисунок 3D). Продукты гена, слитые люциферазы, обладают таким же экспрессией, текучестью и транслокацией кинетики в клетках, как и эндогенные белки. Кроме того, для мониторинга активности промоутера колеблющийся ген Dll1, мы использовали вездесущий люциферазы, дестабилизированные luciferase репортера (Рисунок 1И Рисунок 3А)23, чей период полураспада составляет около 10 мин20. Используя различные типы лучериферазы репортеров, мы создали трансгенных мышей или постучал в мышей, чтобы получить стабильную экспрессию репортера в NPCs во время нейрогенеза17. Для визуализации экспрессии репортера на уровне одной клетки в культуре тканей предпочтительнее разрозненные введения репортера. Таким образом, мы использовали преходящую преображение гена репортера в NPC через внутриутробное электропорацию(рисунок 2F-H). Система luciferase репортер был использован в области циркадных ритмов для мониторинга динамических выражений часов генов в течение длительного периода (например, 1 неделю), предполагая, что люциферин (D-люциферин), субстрат светлячок фермента люциферазы, является очень стабильным и не имеет токсичности для живых клеток24,25. Мы обычно используем люциферин в концентрациях 1 мМ в средствах массовой информации, что достаточно для ночной визуализации живых клеток. Кроме того, система визуализации на основе микроскопа позволяет нам приобретать многомерные изображения, яркие полевые изображения, флуоресценции и изображения хемилюминесценции(рисунок 2F-H и рисунок 3E).
Используя эти условия, мы визуализировали выражения различных ультрадианных часов, в том числе Hes1, Ascl1, Neurog2 и Dll1 (Рисунки 2 и Рисунок 3). Результаты представительства показаны на рисунке 3. Репортер Dll1 промоутер деятельности выставлены колеблющиеся выражения в NPCs, полученных от теленефалиона Dll1-Ub-Fluc репортер ам.мышей. Дестабилизированный репортер люциферазы(рисунок 3A) указал резкое вверх и вниз регулирование выражения промоутер деятельности(рисунок 3B, C). В этом случае, один нейронных клеток-прародителей отображается примерно 2,5 ч цикл колебаний с различными амплитудами в течение 13 ч(Рисунок 3C). Быстрый ответ luciferase репортер позволяет нам захватить динамику передачи Notch сигнализации между двумя живыми клетками(Рисунок 3D-F и дополнительный фильм S1). Мы подготовили два типа ДНК-смесей: (1) Репортер-промоутер Hes1 (pHes1-Ub-luc) и вектор экспрессии EGFP, и (2) белковый репортер Dll1 (Dll1-Luc) и вектор выражения mCherry и трансфицировали их в NPCs отдельно. Затем мы собрали два типа клеток и совместно культивировали для измерения выражения репортеров в живых клетках. Результаты представительи показаны на рисунке 3E,F. Соседние положительные клетки EGFP, несущие Hes1 репортера и mCherry положительные клетки, выражающие Dll1 белковый репортер связался друг с другом во время наблюдения. Hes1 репортер выражение в зеленой камере, казалось, начать около 60 минут после контакта двух клеток(Рисунок 3E,F). Это говорит о том, что задержка времени передачи сигнала Notch между соседними ячейками составляла около 1 ч. Кроме того, во время передачи сигнала экспрессия белка Dll1 показала динамическую транслокацию в красной клетке(рисунок 3E).

Рисунок 1: Рассечение эмбрионального мозга мыши. (A) Структура luciferase репортеров, Dll1 промоутер репортер и Dll1 белка репортер. (B) Процедура вскрытия. ()Боковой вид эмбриона мыши. (б)Отрежьте голову вместе с пунктирной линией. (c)Удалите эпидермис и хрящ из разрыва между теленцефалоном и средним мозгом. (d)Отрежьте окружающие ткани вдоль средней линии между правым и левым полушариями. (e) Удалите ткань из центрального перерыва в обе стороны. (f) Теленцефалон и средний мозг после удаления окружающих тканей. (g)Разделите теленцефалон (тел), средний мозг (середина) и обонятельную лампу (OB). (h) Поперечный сечение теленцефалона, показанный пунктирной линией в(g). (i)Удалите оболейцы, окружающие поверхность теленцефалона. (j)Разделите теленцефалон на две части: медиальную и боковую часть. (k)Отрежьте границу коры головного мозга и ганглияического возвышения (GE). (l) Дорсо-боковая часть коры используется для культуры диссоциации. (C) Мозг в эмбриональный день 14 (E14), состоящий из левых(а)и справа(b)полушарий теленефалии и среднего мозга(c). (D) Теленцефалические полушария отделены от среднего мозга. (E) Одно расчлененое полушарие теленцефалона: вентролатеральная часть теленефалии, включая ганглионные ценности(d),дорсолатеральная часть теленцефалона, используемая для диссоцированных культур и срезовых культур(e),медиальная часть теленецефалии(f)и менгинга, покрывающая поверхность мозга (g). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
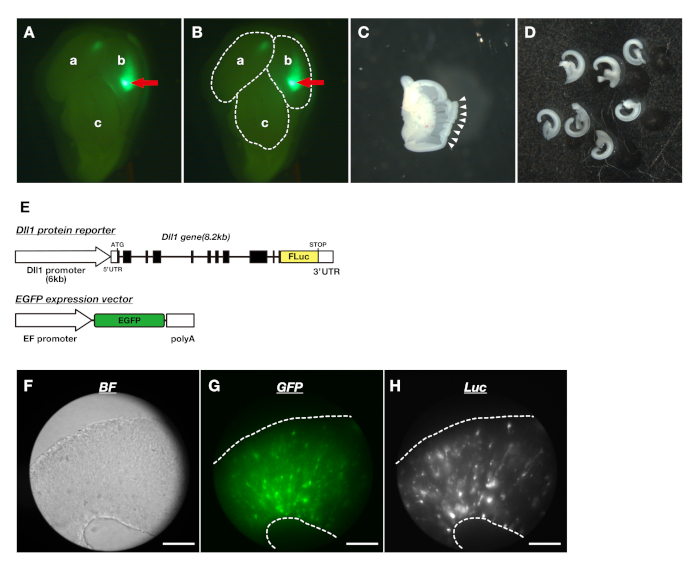
Рисунок 2: Изготовление корковых ломтиков эмбриональной теленефалии и визуализация динамики белка Dll1 в корковых срезанных культурах. (A) Проверка экспрессии EGFP с помощью стереоскопического микроскопического микроскопа флуоресценции. Красная стрелка показывает область коры головного мозга, выражающую EGFP. Левое полушарие(a),правое полушарие(b)и средний мозг(c). (B) Пунктирные линии указывают на очертания областей мозга, показанных в (A). (C) Расчлененный коры дорсолатеральной теленефалии. Белые наконечники стрел указывают на края разреза. (D) Кортикальные ломтики дорсо-боковой теленефалии. (E) Генные структуры репортеров для визуализации динамики белка Dll1 в NPCs. Репортер протеина Dll1, Dll1-Fluc (верхний) был введен в NPC с вектором выражения EGFP (нижний) для того чтобы контролировать морфологию и переселение клеток в корковых ломтиках. (F-H) Трехмерные изображения яркого поля (F), выражение GFP (G), и биолюминесценции (H) в корковом ломтике. Биолюминесценция визуализации системы позволило проследить выражения люциферазы и флуоресценции репортера одновременно. Шкала баров: 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
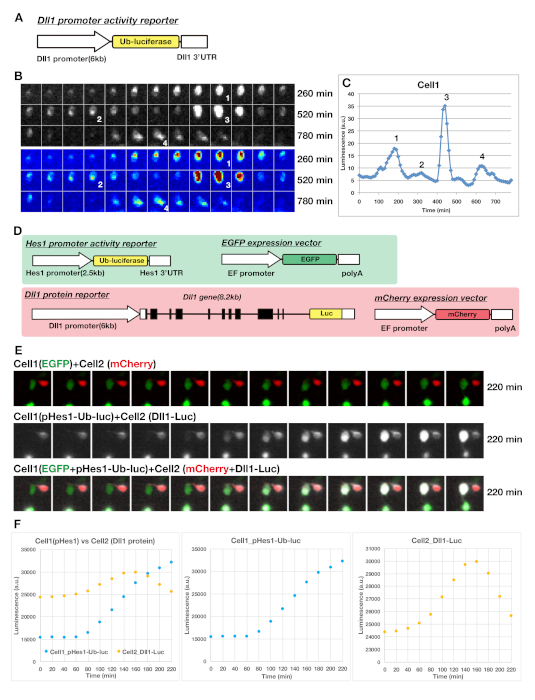
Рисунок 3: Репрезентативные данные для визуализации и анализа динамической экспрессии гена Dll1 в культуре NPC. (A) Репортер построить для визуализации Dll1 выражение на транскрипционном уровне, используя дестабилизированные luciferase репортер (Уб-люцифераза, убикитинат люцифераза). (B) Визуализация выражения Dll1 в одном NPC с биолюминесценции репортера. Цифры в панели показывают пиковые точки колеблющихся выражений Dll1, соответствующих числам в панели C. (C) График времени курса биолюминесценции диссоциированного NPC показано в (B), демонстрируя динамическое выражение Dll1. (D-F) Визуализация выражения репортера-промоутера Hes1 и белкового репортера Dll1 выражена в соседних клетках. (D) Структура Hes1 промоутер деятельности репортера (pHes1-Ub-luc) и Dll1 белка репортер (Dll1-Luc). (E и F) Положительная ячейка EGFP, несущая репортерhe Hes1 (Cell1) и положительная клетка mCherry, несущая репортера белка Dll1 (Cell2), были совместно культурными и измерялось люминесценция от обоих типов репортеров. Выражение репортера Hes1 в зеленой камере (cell1), казалось, началось примерно через 60 минут после того, как две клетки связались. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный фильм S1: Визуализация выражения Hes1 промоутер репортер и Dll1 белка репортер выразил в соседних клетках, связанных с рисунком 3D-3F. Пожалуйста, нажмите здесь, чтобы посмотреть это видео. (Право нажмите, чтобы скачать.)
Обсуждение
Компоненты Нотча сигнализации показывают колеблющиеся выражения синхронно во время сомитогенеза, но из синхронности во время нейрогенеза, что приводит к трудностям в захвате динамики выражения статический анализ в последнем случае. Таким образом, мониторинг в реальном времени необходим для выявления динамики выражения компонентов сигнализации Notch, таких как Hes1 и Dll1. Поскольку периоды колебаний Hes1 и Dll1 чрезвычайно коротки, для мониторинга динамики их выражения требуется быстрое реагирование и нестабильные репортеры. Для этого мы разработали биолюминесценцию репортера и системы визуализации. Биолюминесценция репортер luciferase показывает быстрое созревание кинетики и высокой чувствительности, чтобы проследить быстрый оборот таких циклических экспрессий генов. Быстрая текучесть репортеров приводит к очень слабым сигналам. Для обнаружения таких слабых сигналов, производимых журналистами биолюминесценции, мы используем оптимизированную систему визуализации биолюминесценции, включая высокочувствительную, водяную камеру CCD с сверхнизкой скоростью считывания (50 кГц), которая снижает уровень шума до минимума. Кроме того, объектив высокой численной диафрагмы (N.A.) позволяет нам собирать свет, высвобождаемый от дестабилизированного репортера люциферазы в полной мере. Для получения более высокой чувствительности мы обычно используем более высокую связующий (например, 2 х 2, 4 х 4, 8 х 8) и держать затвор, чтобы открыть в течение длительного времени (например, 5-20 мин). Поскольку сигнал от репортеров люциферазы очень слабый, вмешательство света из окружающей среды также представляет собой проблему в обнаружении слабого сигнала: таким образом, комната микроскопа должна быть полностью темной. Эта система позволяет нам измерять динамические выражения генов Hes1 и Dll1 в NPC как в транскрипционном, так и в уровне белка(рисунок 3). Кроме того, мы можем визуализировать белковую динамику внутриклеточной транслокации с помощью слитых белковых репортеров люциферазы. Кроме того, используя репортер амплуа быстрого реагирования, мы можем зафиксировать динамику передачи сигнализации Notch и измерить задержку времени для передачи сигнала между двумя живыми клетками(Рисунок 3D-F и Дополнительный фильм S1). Кроме того, сочетание промоутер репортер (Ub-luciferase репортер) и белка репортер (люцифераза слияния) одного гена позволяет нам измерить задержку времени между транскрипцией и переводом гена. Таким образом, несколько изображений различных видов люминесценции репортеров и флуоресценции репортер доступен для измерения задержки времени / скорость для биохимических реакций.
Мониторинг экспрессий генов в режиме реального времени при разрешении одной клетки показал, что существуют различия в динамике экспрессии одного и того же гена. Некоторые клетки выражают Dll1/Neurog2 колеблямским образом, но другие показывают устойчивые закономерности. Кроме того, различная динамика выражения (колеблющейся и устойчивой) вызывает различные выходы в состоянии клеток. Что, как представляется, ясно, что различные динамики выражения влияют на поведение клеток по-разному, предполагая, что динамика выражения кодирует больше информации21,22,26,27,28,29,30,31,32. Статический анализ не может захватить динамику экспрессии генов, и анализы в реальном времени необходимы для понимания биологических явлений, чтобы выявить динамику экспрессии в клеточных событиях. Подход, который мы внедряем здесь, может контролировать динамику ультрадиановатийских осцилляторов во время развития нервной системы при высоком височном разрешении. Используя этот метод, мы обнаружили, что гораздо больше генов динамически выражены, чем мы думали ранее, и мы можем проследить не только динамику экспрессии белка, но и динамику локализации белка в клетке при высоком височном разрешении. Такие модели динамического выражения могут иметь биологическое значение, которое еще предстоит выяснить.
Биолюминесценция репортеры имеют большое преимущество в височной резолюции и низкой токсичности для живых клеток по сравнению с флуоресценциирепортеров 33. Однако, в отличие от цветовых вариаций в флуоресцентных репортеров, Есть только несколько цветов в биолюминесценции репортеров, налагая ограничение на количество генов, которые могут контролироваться одновременно. Тем не менее, все большее число переменных люциферазы в настоящее время изолированы и клонированы от различных существ34,35, и с помощью такого разнообразия люциферасы, мы сможем одновременно проследить несколько динамики экспрессии генов в одной клетке при высоком временном разрешении. Молекулярный размер светлячка luciferase больше, чем флуоресценция репортеров, который представляет некоторые трудности в построении репортер слитых белков для мониторинга динамики белка, но в последнее время, новый, меньше и ярче luciferase был клонирован36, что позволит нам визуализировать динамику белка легче, чем когда-либо. Все большее число докладов в последнее время показали различные типы динамики экспрессии генов и транслокации белка в различных биологических событиях21,22,26,27,28,29,30,31,32. Анализ такой динамики в пространственно-временном регулировании с использованием системы мониторинга в реальном времени будет все более важным для фиксации фактических состояний клеток и выявления регуляции клеточных систем.
Раскрытие информации
У авторов нет противоречивых финансовых интересов.
Благодарности
Мы благодарим Yumiko Iwamoto за поддержку производства видео. Мы также благодарны Акихиро Исомуре за обсуждение и поддержку анализа изображений, Хитоси Мияти за техническую поддержку для генерации трансгенных животных, Yuji Shinjo (Olympus Medical Science), Масатоси Эгава (Olympus Medical Science), Такуя Исидзу ( Olympus Medical Science) и Уин Кунитаки (Андор Япония) для технической поддержки и обсуждения биолюминесценционной системы визуализации. Эта работа была поддержана Core Research for Evolutional Science and Technology (JPMJCR12W2) (R.K.), Grant-in-Aid for Scientific Research on Innovative Areas (MEXT 24116705 для H.S. и MEXT 16H06480 для R.K.), Grant-in-Aid for Scientific Research (C) (JSPS) (JSPS) 18K06254 ( H.S.), Фонд Такэда (R.K. и H.S.), а также Платформа для динамических подходов к живой системе от Министерства образования, культуры, спорта, науки и техники, Япония.
Материалы
| Name | Company | Catalog Number | Comments |
| Bioluminescence Imaging System | |||
| Chilled water circulator (chiller) | Julabo | Model: F12-ED | |
| Cooled CCD camera | Andor Technology | Model: iKon-M 934 | |
| Incubator system | TOKAI HIT | Model: INU-ONICS | |
| Inverted microscope | Olympus | Model: IX81 | |
| Inverted microscope | Olympus | Model: IX83 | |
| LED illumination device | CoolLED | Model: pE1 | |
| MetaMorph | MOLECULAR DEVICES | Model: 40000 | |
| Mix gas controller | Tokken | Model: TK-MIGM OLO2 | |
| Objective lens | Olympus | Model: UPLFLN 40X O | |
| Preparations for Dissection | |||
| Dissection microscope | Nikon | Model: SMZ-2B | |
| Fluorescence stereoscopic microscope | Leica | Model: MZ16FA | |
| Fine forceps | DUMONT | INOX No.5 | |
| Scissors, Micro scissors | |||
| Forceps | |||
| Ring-shaped forceps | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| PBS | Nacalai Tesque | 14249-24 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Reagents for NPC dissociation culture | |||
| B27 supplement | invitrogen | 12587-010 | |
| bFGF | invitrogen | 13256-029 | Stock solution: 1 μg/ml in 0.1% BSA/PBS |
| D-luciferin | Nacalai Tesque | 01493-85 | Stock solution: 100mM in 0.9% saline |
| DNase | Worthington Biochemical Corporation | LK003172 | Stock solution: 1000U/ml in EBSS |
| EBSS | Worthington Biochemical Corporation | LK003188 | |
| Glass bottom dish | IWAKI | 3910-035 | |
| N2 supplement (100x) | invitrogen | 17502-048 | |
| N-acetyl-cystein | Sigma | A-9165-25G | |
| Papain | Worthington Biochemical Corporation | LK003178 | Stock solution: 7U/ml in EBSS |
| Penicillin/Streptmycine | Nacalai Tesque | 09367-34 | |
| Poly-L-lysine | Sigma | P-6281 | 40 mg/ml in DW |
| Preparations for in utero electroporation | |||
| 50-ml syringe | TERUMO | 181228T | |
| Electrode | Neppagene | 7-mm | |
| Electroporator | Neppagene | CUY21 EDIT | |
| Forceps | |||
| Gauzes | Kawamoto co. | 7161 | |
| Micro capillary | Made in-house | ||
| PBS | Nacalai Tesque | 14249-24 | |
| Pentbarbital | Kyoritsuseiyaku | Somnopentyl | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Suture needle | Akiyama MEDICAL MFG. CO | F17-40B2 | |
| Xylazine | Bayer | Seractal | |
| Preparations for Slice culture | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| Culture insert | Millipore | PICM01250 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Fetal Bovine Serum | Sigma | 172012-500ML | |
| Fine forceps | DUMONT | INOX No.5 | |
| Forceps | |||
| Horse Serum | Gibco | 16050-122 | |
| Micro surgical knife | Alcon | 19 Gauge V-Lance | |
| Multi-gas incubator | Panasonic | MCO-5MUV-PJ | |
| N2/B27 media | Made in-house | ref. NPC dissociatioin culture | |
| PBS | Nacalai Tesque | 14249-24 | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Silicon rubber cutting board | Made in-house |
Ссылки
- Ross, S. E., Greenberg, M. E., Stiles, C. D. Basic helix-loop-helix factors in cortical development. Neuron. 39, 13-25 (2003).
- Pontious, A., Kowalczyk, T., Englund, C., Hevner, R. F. Role of intermediate progenitor cells in cerebral cortex development. Developmental Neuroscience. 30, 24-32 (2007).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Paridaen, J. T., Huttner, W. B. Neurogenesis during development of the vertebrate central nervous system. EMBO Reports. 15, 351-364 (2014).
- Taverna, E., Götz, M., Huttner, W. B. The cell biology of neurogenesis: toward an understanding of the development and evolution of the neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Louvi, A., Artavanis-Tsakonas, S. Notch signaling in vertebrate neural development. Nature Reviews Neuroscience. 7, 93-102 (2006).
- Pierfelice, T., Alberi, L., Gaiano, N. Notch in the Vertebrate Nervous System: An Old Dog with New Tricks. Neuron. 69, 840-855 (2011).
- Bray, S. Notch signalling: a simple pathway becomes complex. Nature Reviews Molecular Cell Biology. 7, 678-689 (2006).
- Bray, S. Notch signalling in context. Nature Reviews Molecular Cell Biology. 17, 722-735 (2016).
- Kopan, R., Ilagan, M. X. G. The Canonical Notch Signaling Pathway: Unfolding the Activation Mechanism. Cell. 137, 216-233 (2009).
- Ishibashi, M., et al. Persistent expression of helix-loop-helix factor HES-1 prevents mammalian neural differentiation in the central nervous system. The EMBO Journal. 13, 1799-1805 (1994).
- Ohtsuka, T., et al. Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation. The EMBO Journal. 18, 2196-2207 (1999).
- Ohtsuka, T., Sakamoto, M., Guillemot, F., Kageyama, R. Roles of the Basic Helix-Loop-Helix Genes Hes1 and Hes5 in Expansion of Neural Stem Cells of the Developing Brain. Journal of Biological Chemistry. 276, 30467-30474 (2001).
- Kageyama, R., Ohtsuka, T., Kobayashi, T. The Hes gene family: repressors and oscillators that orchestrate embryogenesis. Development. 134, 1243-1251 (2007).
- Shimojo, H., Ohtsuka, T., Kageyama, R. Oscillations in Notch Signaling Regulate Maintenance of Neural Progenitors. Neuron. 58, 52-64 (2008).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342, 1203-1208 (2013).
- Shimojo, H., et al. Oscillatory control of Delta-like1 in cell interactions regulates dynamic gene expression and tissue morphogenesis. Genes and Development. 30, 102-116 (2016).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Kageyama, R., Ohtsuka, T., Shimojo, H., Imayoshi, I. Dynamic Notch signaling in neural progenitor cells and a revised view of lateral inhibition. Nature Neuroscience. 11, 1247-1251 (2008).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 1313-1318 (2006).
- Levine, J. H., Lin, Y., Elowitz, M. B. Functional roles of pulsing in genetic circuits. Science. 342, 1193-1200 (2013).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152, 945-956 (2013).
- Luker, G. D., Pica, C. M., Song, J., Luker, K. E., Piwnica-Worms, D. Imaging 26S proteasome activity and inhibition in living mice. Nature Medicine. 9, 969-973 (2003).
- Yamaguchi, S., et al. Synchronization of Cellular Clocks in the Suprachiasmatic Nucleus. Science. 302, 1408-1412 (2003).
- Kiyohara, Y. B., et al. The BMAL1 C terminus regulates the circadian transcription feedback loop. Proceedings of the National Academy of Sciences of the United States of America. 103, 10074-10079 (2006).
- Behar, M., Hoffmann, A. Understanding the temporal codes of intra-cellular signals. Current Opinion in Genetics and Development. 20, 684-693 (2010).
- Elowitz, M. B., Levine, A. J., Siggia, E. D., Swain, P. S. Stochastic Gene Expression in a Single Cell. Science. 297, 1183-1186 (2002).
- Nelson, D. E., et al. Oscillations in NF-kappaB signaling control the dynamics of gene expression. Science. 306, 704-708 (2004).
- Purvis, J. E., et al. p53 dynamics control cell fate. Science. 336, 1440-1444 (2012).
- Hansen, A. S., O'Shea, E. K. Promoter decoding of transcription factor dynamics involves a trade-off between noise and control of gene expression. Molecular Systems Biology. 9, 704 (2014).
- Hansen, A. S., O'Shea, E. K. cis Determinants of Promoter Threshold and Activation Timescale. Cell Reports. 12, 1226-1233 (2015).
- Johnson, H. E., Toettcher, J. E. Signaling Dynamics Control Cell Fate in the Early Drosophila Embryo. Developmental Cell. 48, 361-370 (2019).
- Badr, C. E., Tannous, B. A. Bioluminescence imaging: Progress and applications. Trends in Biotechnology. 29, 624-633 (2011).
- Nakajima, Y., Ohmiya, Y. Bioluminescence assays: multicolor luciferase assay, secreted luciferase assay and imaging luciferase assay. Expert Opinion on Drug Discovery. 5, 835-849 (2010).
- Nakajima, Y., et al. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, (2010).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Molecular Imaging. 12, (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены