Method Article
뮤린 신경 발생 시 노치 신호 역학의 실시간 생물 발광 이미징
요약
신경 줄기/전구 세포는 세포 이벤트의 다른 결과로 이끌어 내는 노치 신호 분대의 각종 표현 역학을 전시합니다. 이러한 동적 발현은 유전자 발현의 급격한 변화를 시각화할 수 있는 매우 민감한 생물 발광 이미징 시스템을 사용하여 정적 분석이 아닌 실시간 모니터링을 통해 밝혀질 수 있습니다.
초록
노치 신호는 세포-세포 상호 작용에 의해 신경 줄기/전구 세포의 유지 를 조절합니다. 노치 시그널링의 구성 요소는 동적 표현을 나타낸다. 노치 시그널링 이펙터 Hes1 및 노치 리간드 델타 유사1(Dll1)은 신경 줄기/전구 세포에서 진동 방식으로 발현된다. 이들 유전자의 진동 발현 기간이 매우 짧기 때문에(2시간), 그들의 순환 발현을 모니터링하기가 어렵다. 유전자 발현 또는 단백질 역학의 이러한 급격한 변화를 검토하기 위해서는 빠른 반응 리포터가 필요합니다. 그것의 빠른 성숙 역학 및 높은 감도 때문에, 생물 발광 리포터 luciferase는 살아있는 세포에 있는 급속한 유전자 발현 변경을 감시하기 위하여 적당합니다. 우리는 단세포 분해능에서 단백질 역학의 시각화를 위해 프로모터 활성을 모니터링하기 위해 불안정한 루시퍼라제 리포터와 루시퍼라제 융합 리포터를 사용했습니다. 이러한 생물 발광 리포터는 빠른 회전율을 보여주고 매우 약한 신호를 생성합니다. 따라서, 우리는 그러한 희미한 신호를 검출하기 위해 매우 민감한 생물 발광 이미징 시스템을 개발했습니다. 이 방법을 사용하면 실제 세포 상태를 이해하는 데 도움이되는 중요한 정보인 살아있는 세포 및 조직에서 다양한 유전자 발현 역학을 모니터링 할 수 있습니다.
서문
포유류 뇌는 다양한 유형의 뉴런 및 신경교 세포로 구성되어 있습니다. 모든 세포는 신경 줄기 / 전구 세포 (NPC)에서 생성되며, 이는 먼저 그 수를 확장하기 위해 증식한 다음 뉴런으로 분화하기 시작하고 마지막으로 신경교세포1,2,3,4,5를발생시다. 일단 세포가 뉴런으로 분화되면, 그(것)들은 증식하거나 그들의 수를 증가할 수 없고, 그러므로, 나중 단계까지 NPC의 유지보수가 중요합니다. 세포-세포 상호 작용을 통한 노치 신호는 NPC6,7을유지하는 데 중요한 역할을 한다. 노치 리간드막 단백질, 노치, 이웃 세포의 표면에 상호 작용하고 노치 단백질을 활성화합니다. 활성화 후, 노치 단백질의 단백질 해가 발생하여 세포막에서 노치 (NICD)의 세포 내 도메인을 핵8,9,10으로방출합니다. 핵에서 NICD는 Hes1 및 Hes5 (Hes1/5)의프로모터 영역에 결합하고 이러한 유전자의 발현을 활성화합니다. Hes1/5 는 신경성 유전자 Ascl1 및 Neurogenin1/2 (Neurog1/2)11,12,13,14의발현을 억압한다. 신경성 유전자는 신경 분화를 유도하기 때문에 Hes1/5는 NPC 를 유지하는 데 필수적인 역할을 합니다. 더욱이, 신경성 유전자가 노치 리간드 델타유사1(Dll1)의 발현을 활성화시킬 수 있기 때문에, Hes1/5는 또한 Dll1의발현을 억압한다. 따라서, Dll1의 발현은 노치 시그널링을 통해 Dll1에 대해 음수인 인접 세포를 이끈다. 이와 같이, 세포는 인접한 세포가 동일한 운명을 따르는 것을 억제하며, 횡식 억제8로알려진 현상이다. 개발 뇌에서, 측면 억제 다양 한 다른 세포 종류를 생성하는 역할을 한다.
단일 셀 수준에서 실시간 이미징은 NPC15,16,17에서노치 시그널링 성분의 동적 발현을 보여줍니다. 노치 시그널링은 Hes1의발현을 활성화하지만 Hes1 단백질은 자체 프로모터에 결합하고 자체 발현을 억압합니다. 또한, Hes1은 매우 불안정한 단백질이며, 유비퀴틴-프로테아좀 통로에 의해 분해됩니다. 따라서, 자신의 프로모터의 억압은 단지 짧은 수명이고 그 다음에 전사가 다시 시작된다. 이와 같은 방식으로, Hes1의 발현은 2시간주기(18)에서전사 및 번역 수준 모두에서 진동한다. Hes1의 진동 발현은, 차례로, 주기적인 억압을 통해 Ascl1, Neurog2, 및 Dll1과 같은 하류 표적 유전자의 발진 발현을 유도한다15,16,17,19. 신경성 유전자는 신경 분화를 유도할 수 있지만, 그들의 진동 발현은 신경 분화를 위해 충분하지 않습니다; 오히려 그들의 지속적인 된 표현은 신경 분화에 필수적이다. 신경성 유전자의 진동 발현은 신경 분화 유도보다는 NPC 유지에 중요하다14,15,16. Dll1의 발현은 신경 발생 및 소미토발생과 같은 다양한 형태 발생 동안 전사 및 번역 수준 모두에서 진동한다. Dll1의 동적 발현은 정상적인 형태 형성및 Dll1의 꾸준한 발현에 중요하며 신경발생 및 소미토제네시스(17)의 결함을 유도한다. 이 사실 인정은 유전자 발현과 단백질 역학의 역학이 각종 발달 사건의 규칙에 있다는 중요한 기능을 보여줍니다 (즉, 다른 발현 역학은 세포 행동에서 다른 출력을 생성합니다).
노치 시그널링의 역학을 분석하기 위해 조직과 세포의 정적 분석은 끊임없이 변화하기 때문에 충분하지 않습니다. 단일 세포의 실시간 이미징은 유전자 발현의 역학을 밝히는 강력한 도구입니다. 노치 신호 분자의 동적 발현은 2-3 시간 의 기간에 급속한 순환 반응을 겪습니다. 이러한 빠른 주기적 발현은 실시간 모니터링을 위한 두 가지 어려운 문제를 제시한다: (1) 분자의 발현이 낮은 수준으로 억제되고, (2) 빠른 회전율은 빠른 응답 리포터가 필요하다. 이러한 문제점을 극복하기 위해, 우리는 이전에 생물 발광 실시간 이미징 방법20을개발하였다. 생물 발광 리포터는 형광 리포터보다 더 높은 감도와 짧은 성숙 시간을 가지고 있기 때문에,이 전략은 우리가 살아있는 세포의 급속한 역학을 모니터링 할 수 있습니다. 실시간 시각화를 사용하여, 우리는 더 많은 유전자가 우리가 이전에 생각했던 것보다 동적 발현을 나타낸다는 것을 것을을 발견했습니다. 또한, 살아있는 세포에서발현 및 단백질 역학을 나타내는 보고의 수와 다양한 생물학적 사건에서 이러한 역학의 중요성이 증가하고, 유전자 발현에서역학의 근본적인 역할을 시사하는21,22.
이 보고서에서는 해리된 배양물과 피질 슬라이스 배양물 모두에서 NPC에서 노치 리간드 Dll1의 표현을 시각화하는 방법을 설명합니다. 단일 세포 수준에서 Dll1 전사의 역학을 모니터링하기 위해, 우리는 pDll1-Ub-Fluc 리포터를 운반하는 형질전환 마우스의 배아 텔렌살론에서 유래한 NPC의 해리된 배양을 생성했습니다, Dll1 프로모터 구동 불안정성 luciferase 기자. 생체 내에서 Dll1 단백질 역학을 모니터링하기 위해 Dll1-Fluc 융합 리포터를 피질 내 NPC에 도입하고 피질 슬라이스 배양에서 NPC에서 리포터의 표정을 시각화했습니다. 실시간 화상 진찰은 높은 시간 해결책에 살아있는 세포에 있는 유전자 발현 그리고 단백질 역학의 각종 특징을 붙잡을 수 있었습니다.
프로토콜
동물 과목을 포함한 모든 절차는 교토 대학 프론티어 생명 의학 연구소의 기관 동물 관리 및 사용위원회의 승인을 받았습니다.
1. 생물 발광 기자
참고: 루시퍼라제 리포터는 분해 신호를 융합하여 프로모터 활성의 급속한 역학을 측정하는데 적합합니다. 더욱이, 루시퍼라제 융합 리포터는 단일 세포내의 단백질 역학을 모니터링할 수 있게 한다. 두 유형의 리포터는 단층 배양(해리 문화) 및 조직 배양(슬라이스 배양) 실험에 사용할 수 있다.
- Dll1 프로모터 활동 모니터링을 위한 리포터17
참고: 유전자 발현의 급격한 변화를 모니터링하려면 신속한 반응과 불안정한 리포터가 필수적입니다. 반딧불이 루시퍼라제(Fluc)는 플루오레세인 리포터에 비해 빠른 성숙을 나타낸다. 유비퀴틴 융합 루시퍼라제 리포터(Ub-Fluc)는 급격한 분해 및 빠른 회전율을 나타내기 때문에, 살아있는세포(20)에서동적 유전자 발현을 모니터링하는 것이 매우 유용하다.- Dll1 프로모터 구동 불안정루시퍼라제 리포터, 유비퀴틴화 루시퍼라제(pDll1-Ub-Fluc, 도 1A 상부 패널)를 사용하여, 전사 수준17에서 Dll1 발현의 급격한 변화를 모니터링한다.
- 이 리포터의 안정적인 발현을 위해 pDll1-Ub-Fluc을 운반하는 형질전환 마우스 라인을 생성한다.
- Dll1 단백질 역학 모니터링을 위한 리포터17.
- 노크인 마우스의 생성을 위해, Dll1-루시퍼라제 융합 단백질이 발현되도록 Dll1 코딩 영역의 3́ 테르미니에 루시퍼라아제 cDNA를 삽입한다(Dll1-Fluc 리포터, 도 1A,하부 패널)17.
- 루시퍼라아제 활성을 측정하여 단백질 수준에서 Dll1의 발현 역학을 모니터링합니다.
- 조직 수준에서 Dll1 단백질 역학을 모니터링하기 위해, 자궁 전기 천공에 의해 배아 텔렌세판에서 NPC에 Dll1-Fluc 리포터를 소개합니다.
2. 생물 발광 이미징 시스템
- 고감도 수냉 식 CCD 카메라로 설치된 반전 된 현미경을 사용하여 생물 발광 라이브 이미징 시스템을 구축하십시오. 노이즈를 줄이고 고감도를 얻으려면 -90 °C의 최적화된 온도에서 물 순환기가 제공하는 차가운 물로 카메라를 냉각하십시오.
- 살아있는 세포/조직 화상 진찰을 위해, 현미경 단계에 온도 및 혼합 가스를 통제하는 배양 시스템을 설치하십시오.
- 불안정한 루시퍼라제 리포터의 발현을 이미징하려면 높은 수치각(NA: 1.30) 40x 오일 침지 대물렌즈를 사용하십시오. 이 렌즈의 작동 거리는 0.2 mm이며, 모노 레이어 세포 배양뿐만 아니라 슬라이스 배양에도 사용할 수 있습니다.
- 루시퍼라아제 및 플루오레세인 리포터 발현을 이중으로 모니터링하려면 현미경의 광 경로에 LED 조명 장치를 설치하십시오.
- 현미경과 관련된 소프트웨어(예: MetaMorph 소프트웨어의 다차원 수집 프로그램)로 시간 경과 이미징을 제어합니다.
- 불안정한 루시퍼라제 리포터의 신호가 매우 희미하기 때문에 어두운 방에서 전체 시스템을 준비하고, 외부 빛을 피하기 위해 획득을 방지한다.
3. 신경 줄기 /선조 세포 (NPC) 해리 배양
- NPC 해리문화용 배양배지, 접시, 시약 준비
- DMEM/F12 매체에서 신경 줄기/선조 세포를 1x N2, 1x B27, 1 mM N-아세틸시스테인, 10 ng/mL bFGF 및 50 U/mL 페니실린/스트렙토마이신의 최종 농도로 배양하기 위한 N2/B27 용지를 준비합니다.
- EBSS 매체에 7 U/mL 파파인, 0.006% DNase 및 1 mMM N-아세틸시스테인을 함유하는 해리를 위한 파파인 용액을 준비한다.
- 발광 이미징을 위해 루시페린 나트륨 용액 100 mM을 준비하십시오. N2/B27 매질에서 100 mM 루시펠린 용액을 최종 농도 1 mM으로 희석합니다.
참고: 루시페린은 자동 플루오레세인 자체를 보여줍니다. 루시퍼라제-형광 이중 이미징의 경우, 특히 EGFP는 루시페린의 농도를 0.5 mM으로 낮추는 것이 좋습니다. - 실온에서 1시간 동안 40 μg/mL의 폴리-L-리신(PLL) 용액으로 35mm 유리 바닥 접시(유리 직경 27mm)를 코팅합니다. 배양 후, PBS로 플레이트를 3x 세척하고 건조시키십시오.
- 배아 의 해부 및 NPC의 해리
- 임신한 pDll1-Ub-luc 형질전환 마우스(배아일 12.5(E12.5))를CO2 질식 및 자궁 경부 탈구에 의해 안락사한 후, 복부를 잘라 내고 자궁을 꺼낸다.
참고: 연구원은 해당 기관의 동물 연구 위원회의 규정 및 지침을 따라야 합니다. 마취 또는 통증 완화 약물을 사용하는 경우 적절하게 사용하십시오. - 25 mL의 얼음 차가운 PBS를 포함하는 10cm 페트리 접시에 자궁을 옮김. 마이크로 가위와 미세 집게를 사용하여 얼음 차가운 PBS에서 자궁에서 배아를 꺼내십시오.
- 가위를 사용하여 각 배아의 머리를 잘라 얼음 차가운 DMEM / F12를 포함하는 10cm 페트리 접시로 옮김. 뇌를 둘러싼 표피와 연골을 제거하고 N2/B27 용지의 얼음 차가운 3 mL을 함유 한 35mm 페트리 접시로 뇌를 옮김.
- 디엔셀론에서 좌우 텔렌세프론을 잘라냅니다(그림1Ba-f, C,D). 미세 집게를 사용하여 텔렌세팔론의 표면을 덮는 수막을 제거합니다(그림 1Bi). 다시 미세 포셉을 사용하여, 텔렌세팔론에서 피질의 등측 부분을 꺼내(그림 1Bg, h, j-l E).
- P1000 파이펫을 사용하여 조직을 새로운 1.5 mL 튜브로 옮기고 P200 파이펫으로 여분의 매체를 제거하십시오. 뇌 조직 당 파파인 용액 0.1 mL을 추가하십시오 (피질 한 쌍). 24°C에서 15분간 배양한 후, P1000 파이펫으로 시료를 10회 부드럽게 파이펫처리합니다. 24°C에서 15분 동안 다시 샘플을 배양합니다.
- P1000 파이펫으로 샘플을 10회 부드럽게 파이펫합니다. 400 x g 및 실온 (RT)에서 3 분 동안 샘플을 원심 분리합니다. 상급제는 버리십시오.
- 펠릿에 DMEM/F12 용지 1mL를 추가합니다. P1000 파이펫으로 10회 부드럽게 파이펫을 만드십시오. 400 x g및 RT에서 3 분 동안 샘플을 원심 분리하고 상급을 폐기하십시오. 이 것을 적어도 2번 이상 반복하십시오.
- 펠릿에 1 mM 루시퍼린을 함유 한 N2 / B27 용지 0.5 mL를 넣고 잘 섞습니다. 세포(1 x 106 셀)를 PLL 코팅 유리 바닥 접시에 시드합니다. 1시간 동안CO2 인큐베이터에서 세포를 배양하였다. 세포가 접시에 부착되면, 1 mMM 루시퍼린을 함유 한 N2 / B27 매체 2 mL를 추가하십시오.
- 임신한 pDll1-Ub-luc 형질전환 마우스(배아일 12.5(E12.5))를CO2 질식 및 자궁 경부 탈구에 의해 안락사한 후, 복부를 잘라 내고 자궁을 꺼낸다.
- NPC 해리 문화에서 루시퍼라제 기자 표현의 시각화
- 해부를 수행하기 전에 발광 라이브 이미징 시스템을 시작합니다. NPC 배양의 경우, 스테이지 인큐베이터의 온도를 37°C로 설정하고 기체 혼합물의 설정을 20%O2,5%CO2로설정한다.
- 대물 렌즈에 침지 오일을 넣습니다. 샘플 접시를 현미경 단계에 놓습니다. 수동으로 필드를 보고 관심 있는 셀의 최적의 위치와 포커스를 선택합니다. 라이브를 클릭하여 테스트 이미지를 획득합니다.
- 다차원 수집 프로그램을 통해 24시간 동안 2차원(발광 및 밝은 필드) 획득에 의한 타임랩스 획득을 실행합니다. 다차원 수집 프로그램을 선택하고 수집 설정을 다음과 같이 설정합니다(3.3.6 단계).
- 발광 이미지 수집의 경우 낮은 전송 속도(50kHz), 2 x 2/4 x 4 비닝, 10분/5분 노출 시간 등 다음 카메라 설정을 사용합니다. 밝은 필드 이미지 수집의 경우 중간 전송 속도(1MHz), 1 x 1 비닝 및 100ms 노출 시간 등의 설정을 사용합니다.
4. 자궁 내 전기 포공
참고: 이것은 신경 전구 세포로 Dll1-Fluc 리포터의 소개를 위해 행해진 것입니다.
- 전기 개공을 위한 공구 및 시약의 준비
- 배아 텔렌세팔론의 심실로 DNA를 주입하기 위한 마이크로 모세혈관을 준비하십시오. 잔디 모세관을 열로 스트레칭하고 연마 기계로 잔디 끝을 자르고 연마하십시오.
- 염료와 DNA의 혼합물을 준비 (예를 들어, 트라이판 블루). 각 DNA의 농도는 PBS에서 1 μg/μL이고 염료를 최종 농도 10%에 첨가한다.
참고: Dll1 단백질 역학의 시각화를 위해 DNA의 혼합물을 사용한다: Dll1-Fluc (Dll1 단백질 리포터, 도 2E 상부)및 pEF-EGFP (EF 프로모터 구동 EGFP 발현 벡터, 도 2E 하부),형질감염된 세포의 위치 및 형태학적 모니터링. - 두 가지 유형의 마취제를 준비하십시오: 펜토바르비탈 3.88 mg/mL, 자일라진 0.12% 멸균 1x PBS.
- 수술 중에는 멸균 기구와 수술용 장갑을 사용하십시오.
- 자궁 전기 에서
- 500 μL의 3.88 mg/mL 펜토바르비탈과 0.12% 자일라진의 500 μL로 마취제를 침내 투여하여 임신 한 ICR 마우스 (E12.5)를 마취시.
참고: 연구원은 동물 실험의 규정을 따라야 합니다. 마취 또는 통증 완화 약물을 사용해야하는 경우 적절하게 사용하십시오. - 모발을 잘라내고 수술용 스크럽으로 피부를 소독합니다.
- 발가락 핀치 응답의 부족을 확인합니다. 페달 반사가 관찰되지 않으면 중간선을 따라 복부를 2-3cm 잘라냅니다. 해부 된 부분 주위에 거즈를 넣고 절개를 말리지 않도록 따뜻한 PBS로 거즈를 적십니다. 반지 모양의 집게로 오른쪽 자궁 경적을 부드럽게 꺼내 배아 수를 계산합니다.
- 혼합 된 DNA의 1-2 μL을 미세 모세관으로 부드럽게 배아의 말뇌골의 심실로 주입하십시오.
참고 : 주사가 성공하면 자궁 표면위에 염료의 파란색을 볼 수 있습니다. - 전압 펄스를 제공하기 전에 자궁과 전극을 적신 다음 배아의 머리를 부드럽게 잡습니다. DNA가 주입된 반구의 측면에 양전하 전극을 설정합니다. 전기 천공의 펄스의 조건이 50 ms에 대한 30-50 V인지, 펄스의 간격은 1 s (50 ms 충전 및 950 ms 비 충전)인지 확인하십시오. 한 배아에 5펄스를 제공하고 음전하 전극에서 기포가 생성되는지 확인합니다.
참고 : DNA가 양극 의 측면에있는 세포에 통합되어 있는지 확인하십시오. 이 과정에서 전극의 위치를 이동하지 마십시오. - 다른 배아의 경우 4.2.3-4.2.4 단계를 반복하고 자궁 경적을 복강으로 되감습니다. 왼쪽 자궁 경적의 배아에 동일한 절차를 수행하십시오.
- 왼쪽을 다시 넣은 후, 바늘(17 mm)으로 실크 봉합사(4-0)에 의한 절개를 봉합한다. 절개를 완전히 닫기 전에 따뜻한 PBS를 복강에 넣습니다.
참고 : 봉합사 사이의 간격은 약 2mm입니다. - 수술을 마친 후, 마취 후 회복을 위해 가열 패드에 마우스를 놓습니다. 마우스를 개별적으로 하우스합니다.
참고 : 연구원은 동물 실험의 로컬 선동 규정을 따라야합니다. 통증 완화 약물을 사용해야하는 경우 제대로 사용하십시오.
- 500 μL의 3.88 mg/mL 펜토바르비탈과 0.12% 자일라진의 500 μL로 마취제를 침내 투여하여 임신 한 ICR 마우스 (E12.5)를 마취시.
5. 피질 발달의 슬라이스 배양 준비 및 피질 슬라이스에서 luciferase 기자 표현의 시각화
- 피질의 슬라이스 배양에 대한 배양 배지 및 시약의 준비
- N2/B27 미디어에서 5% 태아 소 혈청과 5% 말 세럼을 함유한 피질 조각을 배양하기 위해 농축 된 미디어를 준비하십시오.
- DMEM/F12 용지를 통해 100% O2 가스를 버블링하고 피질 슬라이스를 만듭니다.
참고: 산소 가스를 안전하게 사용하려면O2 실린더를 실린더 캐비닛에 보관하고 산소 농도 계측기로 공기 중의 산소 농도를 모니터링하십시오. - 농축 된 매체에 100 mM 루시펠린 나트륨 용액을 1 mM의 최종 농도로 희석시켰다.
참고: 루시페린은 자동 플루오레세인 자체를 보여줍니다. 루시퍼라제-형광 이중 이미징의 경우, 특히 EGFP는 루시페린(0.5 mM)의 농도가 낮아진다. - 다중 가스 인큐베이터를 37°C에서 40%O2 및 5%CO2로설정합니다.
- 배아의 해부 및 형광 리포터의 발현검사
- 임산부 마우스를 안락사시킨 후 기자(E13.5)가 자궁 전기천공(단계 4.2)에 의해 도입되고, 복부를 잘라내고 자궁을 꺼낸다.
참고: 연구원은 동물 실험의 규정을 따라야 합니다. 마취 또는 통증 완화 약물을 사용하는 경우 적절하게 사용하십시오. - 자궁을 PBS가 들어있는 10cm 페트리 접시로 옮김. 마이크로 가위와 미세 집게를 사용하여 PBS에서 자궁에서 배아를 꺼내십시오. 각 배아의 머리를 잘라 100%O2 가스로 버블링된 DMEM/F12 매개체를 함유한 10 cm 페트리 접시로 옮김. DMEM/F12 미디어에서 뇌를 둘러싼 표피와 연골을 제거합니다.
- 고리 모양의 집게로 페트리 접시의 뚜껑에 뇌를 넣고 형광 입체 현미경 단계에 뚜껑을 설정합니다. 여기 빛 아래에서 형광 단백질을 발현하는 피질의 영역을 확인한다(그림2A,B).
- 100%O2 가스로 버블링된 30mL의 DMEM/F12 용지로 채워진 실리콘 고무 도마로 뇌를 옮김을 옮김. 미세 집게에 의해 텔렌세팔론의 표면을 덮는 수막을 제거합니다.
- 등지 말살 말루액의 내측과 측면 부분 사이의 경계를 잘라 마이크로 수술 칼이나 미세 집게를 사용하여 두 반구로 분리. 마이크로 수술 칼을 사용하여 줄무늬처럼 피질을 자르고 피질 조각을 만듭니다(그림 2C,D). 파이펫을 사용하여 중간 크기의 파이펫 슬라이스를 35mm 접시에 농축 된 매체로 옮김.
- 농축 된 매체와 유리 바닥 접시에 배양 삽입에 슬라이스를 넣어. 미세 한 집게를 사용 하 여 슬라이스의 방향을 수정 합니다. 배양 서팅의 표면에 슬라이스의 절단 표면을 설정합니다. 파이펫으로 여분의 용지를 제거합니다. 37°C에서 40%O2 및 5%CO2로 설정된 멀티 가스 인큐베이터에서 슬라이스를 30분 동안 배양한다.
- 유리 바닥 접시에 배양 삽입의 외부에 1 mMM luciferin을 포함하는 농축 된 매체의 300 μL을 추가합니다.
- 임산부 마우스를 안락사시킨 후 기자(E13.5)가 자궁 전기천공(단계 4.2)에 의해 도입되고, 복부를 잘라내고 자궁을 꺼낸다.
- 슬라이스 문화권에서 루시퍼라제 리포터 표현의 시각화
- 해부를 시작하기 전에 발광 라이브 이미징 시스템을 시작합니다. 피질 슬라이스 배양액의 다음 조건을 사용하십시오 : 40 % O2,5 % CO2 및 37 ° C.
- 40배 대물 렌즈에 침지 오일을 넣습니다. 샘플 접시를 현미경의 단계에 놓습니다. 형광의 테스트 이미지를 획득하고 여기 빛의 조명에서 관심 영역으로 위치 및 초점 평면을 설정합니다.
- 24시간 동안 3-디멘션(발광, 형광 및 밝은 필드) 획득에 의한 타임랩스 획득을실행합니다(그림 2F-H). 발광 이미지 수집의 경우 낮은 전송 속도(50kHz), 2x2/4x4 비닝, 10분/5분 노출 시간 등 다음 카메라 설정을 사용합니다. 형광 및 밝은 필드 이미지 수집의 경우 중간 전송 속도(1MHz), 1x1 버닝 및 100ms 노출 시간 등의 설정을 사용합니다.
6. 이미지 처리 및 분석
- 각 이미지를 연결하고 스택 이미지를 만듭니다. 파일 메뉴에서 이미지 시퀀스 가져오기를 클릭합니다(파일| 수입 | 이미지 시퀀스)를선택하고 획득 한 이미지가 저장되는 폴더를 선택합니다. 파일 이름에 포함된 일부 단어를 File이름의 열에포함합니다.
- 생물 발광 이미지에서 우주 광선의 노이즈를 제거하려면 ImageJ/Fiji의 SpikeNoise 필터 플러그인을 적용합니다. 스택 이미지를 열고 SpikeNoise 필터를클릭합니다.
- Savitzky 골레이 임시 필터 플러그인을 적용하여 리포터 표현의 명확한 역학을 얻습니다. 스택 이미지를 열고 Savitzky 골레이 시간 필터를클릭합니다.
- 리포터 식의 강도를 측정하려면 각 단일 셀에 Z 축 프로파일 플러스 플러그인을 적용합니다. 셀을 선택하고 관심 영역인 ROI를 설정하고 Z 축 프로필 플러스를 클릭합니다.
결과
Hes1/7 유전자의 발현은 다양한 세포주 및 소미토제네시스 동안2시간 진동 주기를 나타낸다. 게다가, 진동의 기간은 아주 짧고 그들의 mRNAs와 단백질 둘 다 약 20 분의 반감기와 극단적으로 불안정합니다. 느린 반응 리포터를 사용하는 경우, 우리는 이러한 급속한 역학을 추적 할 수 없으며, 안정적인 리포터를 사용하는 경우, 유전자 발현이 진동하는 동안 점차적으로 축적됩니다. 따라서, 리포터는 이러한 순환 발현 유전자의 급속한 회전율을 모니터링하기 위해 급속히 분해되어야 한다. 이러한 문제를 극복하기 위해 우리는 루시퍼라제 리포터를 사용하여 발진기의 동적 표현을 모니터링했습니다. 생물 발광 리포터는 짧은 성숙 시간과 높은 감도를 가지고 있기 때문에, 그것은 우리가 초경 발진기의 급속한 역학을 모니터링 할 수 있습니다. 형광 리포터와 마찬가지로, 루시퍼라제 리포터는 유전자 코딩 서열에 융합됨으로써 단백질의 발현 역학을 모니터링할 수있다(도 1A, 도 2E 및 도 3D). 루시퍼라제 융합 유전자 제품은 내인성 단백질과 마찬가지로 세포에서 동일한 발현, 회전율 및 전좌 역학을 나타낸다. 더욱이, 진동 유전자 Dll1의프로모터 활성을 모니터링하기 위해, 우리는 유비퀴틴화 된 루시퍼라아제, 불안정한 루시퍼라제 리포터(도1A 및 도 3A)23을사용했으며, 그의 반감기는 약 10 분20이다. 다양한 유형의 루시퍼라제 리포터를 사용하여, 우리는 신경 발생 시 NPC에서 리포터의 안정적인 발현을 얻기 위해 형질전환 마우스 또는 노크된 마우스를 생성하였다17. 조직 배양에서 단세포 수준에서 리포터 의 표정을 시각화하기 위해, 리포터의 산란 도입이 바람직하다. 따라서, 우리는 자궁 전기천공을 통해 NPC로 리포터 유전자의 일시적인형질변환을사용하였다(그림 2F-H). 루시퍼라제 리포터 시스템은 장시간(예를 들어, 1주) 동안 시계 유전자의 동적 발현을 모니터링하기 위해 일주기 리듬 분야에서 사용되어 왔으며, 반딧불이 루시페라아제 효소의 기질인 루시페린(D-luciferin)이 매우 안정적이며 살아있는 세포에 대한 독성이 없음을 시사하는24,25. 우리는 일반적으로 밤새 살아있는 세포 화상 진찰을 위해 충분한 매체에 있는 1 mM의 농도에서 luciferin를 이용합니다. 또한, 현미경 기반 이미징 시스템은 다차원 이미지, 밝은 필드 이미지, 형광 이미지 및 화학 발광 이미지를 획득 할 수 있습니다(그림 2F-H 및 도 3E).
이러한 조건을 사용하여 Hes1, Ascl1, Neurog2 및 Dll1(도 2 및 도 3)을포함한 다양한 울트라디안 클럭 유전자의 발현을 시각화하였다. 대표적인 결과는 그림 3에나와 있습니다. Dll1 프로모터 활동의 리포터는 Dll1-Ub-Fluc 리포터 마우스의 텔렌세팔론으로부터 유래된 NPC에서 진동 발현을 나타내었다. 불안정한 루시퍼라제리포터(그림 3A)는프로모터 활성의 발현에 대한 급격한 상하 조절을 나타냈다(그림3B,C). 이 경우, 단일 신경 전구 세포는 13h의 과정에 걸쳐 다양한 진폭을 가진 약 2.5 시간 진동 주기를 나타냈다(도 3C). 신속한 반응 루시퍼라제 리포터는 2개의 살아있는 세포 들 사이의 노치 신호의 전송 역학을 포착할 수 있게한다(그림 3D-F 및 보충 영화 S1). 우리는 DNA 혼합물의 2가지 유형을 제조하였다: (1) Hes1 프로모터 리포터(pHes1-Ub-luc) 및 EGFP 발현 벡터, 및 (2) Dll1 단백질 리포터(Dll1-Luc) 및 mCherry 발현 벡터를 별도로 NPC로 형질전환하였다. 이어서 우리는 살아있는 세포에서 기자의 발현을 측정하기 위해 두 가지 유형의 세포를 수집하고 공동 배양하였다. 대표적인 결과는 그림 3E,F에나와 있습니다. 인접한 EGFP 양성 세포는 Hes1 리포터 및 mCherry 양성 세포를 운반하여 Dll1 단백질 리포터를 발현하여 관찰하는 동안 서로 접촉하였다. Hes1 기자 는 녹색 세포에서 의 식은 두 세포접촉 후 약 60분 후에 시작되는 것으로보였다(그림 3E,F). 이는 인접한 세포 들 간의 노치 신호전달의 전송시간 지연이 약 1시간이었다는 것을 시사한다. 더욱이, 신호 투과 동안, Dll1 단백질 발현은 적혈구에서 동적 전좌를 나타내보였다(도3E).

그림 1: 배아 마우스 뇌의 해부. (A)루시퍼라제 기자, Dll1 프로모터 리포터 및 Dll1 단백질 리포터의 구조. (B)해부 절차. (a)마우스 배아의 측면 도면. (b)점선과 함께 머리를 잘라냅니다. (c)표피와 연골을 말란과 중뇌 사이의 틈새에서 제거합니다. (d)좌우 반구 사이의 중간선을 따라 주변 조직을 잘라냅니다. (e)중앙에서 양쪽으로 조직을 분리합니다. (f)주변 조직을 제거한 후 말뇌및 중뇌를 한다. (g)텔렌세팔론(tel), 중뇌(중간) 및 후각 전구(OB)를 분리한다. (h)텔렌세팔론의 단면, 점선으로 표시(g). (i)텔렌세팔론 의 표면을 둘러싼 수막을 제거합니다. ((j)텔렌팔론을 내측 부분과 측면 부분의 두 부분으로 분리합니다. (k)피질과 신경절 의 저명한 (GE)의 경계를 잘라. (l)피질의 도르소 측면 부분은 해리 문화에 사용된다. (C)배아의 날 14(E14)에서 뇌는, 좌측(a) 및오른쪽(b)말투암과중뇌(c)의반구로 구성된다. (D)중뇌에서 분리된 말뇌골 반구. (e)말뇌파의 하나의 해부 된 반구 : 신경절 전도를 포함하는 말뇌의 혈관 외 부분(d),해리 된 배양 및 슬라이스 배양에 사용되는 말뿔소의 등측 부분(e),뇌의 표면을 덮는 뇌의 내측 부분(f)및 뇌손상을 덮는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
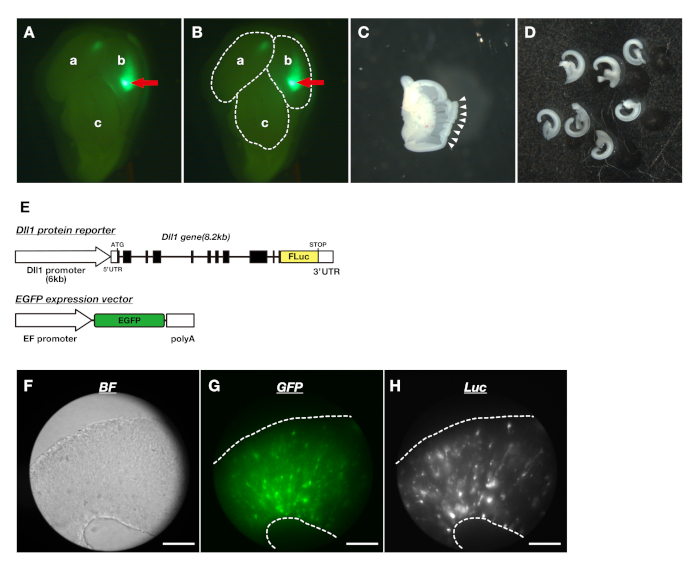
그림 2: 배아 텔렌스팔론의 피질 슬라이스를 만들고 피질 슬라이스 배양에서 Dll1 단백질 역학을 시각화합니다. (A)형광 입체 현미경을 사용하여 EGFP의 발현을 확인하였다. 빨간색 화살표는 EGFP를 발현하는 피질의 영역을 나타낸다. 왼쪽 반구(a),오른쪽 반구(b)및 중뇌(c). (B)점선은(A)에표시된 뇌 영역의 윤곽을 나타냅니다. (C)등측 말순의 해부 피질. 흰색 화살표촉은 절단 모서리를 나타냅니다. (D)도소 측성 말뇌골의 피질 슬라이스. (E)NPC에서 Dll1 단백질 역학을 시각화하기 위한 기자의 유전자 구조. Dll1 단백질 리포터, Dll1-Fluc (상부)는 피질 슬라이스에서 세포의 형태 및 이동을 모니터링하기 위해 EGFP 발현 벡터(lower)를 가진 NPC로 도입되었다. (F-H) 피질 슬라이스에서 밝은 필드(F),GFP 발현(G),및 생물 발광(H)의3 차원 이미지. 생물 발광 이미징 시스템은 루시퍼라아제 및 형광 리포터의 발현을 동시에 추적할 수 있었습니다. 배율 표시줄: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
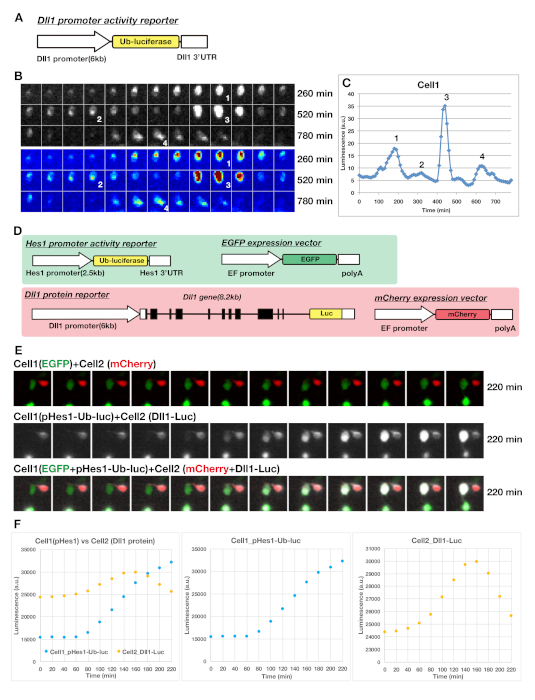
도 3: NPC 배양에서 Dll1 유전자의 동적 발현을 시각화및 분석하기 위한 대표적인 데이터. (A)리포터는 불안정한 루시퍼라아제 리포터(Ub-luciferase, 유비퀴타아제루시퍼라아제)를 사용하여 전사 수준에서 Dll1 발현을 가시화하기 위한 컨스트럭트. (B)생물 발광 리포터와 함께 단일 NPC에서 Dll1의 발현을 시각화하였다. 패널 내의 숫자는 패널C.(C)의숫자에 대응하는 Dll1의 진동 발현의 피크 포인트를 나타내며, (B)에 도시된 생물 발광NPC의 시간 코스 플롯은 Dll1의동적 발현을 나타낸다. (D-F) Hes1 프로모터 리포터 및 Dll1 단백질 리포터의 발현의 가시화는 인접한 세포에서 발현되었다. (D)Hes1 프로모터 활동 리포터(pHes1-Ub-luc)와 Dll1 단백질 리포터(Dll1-Luc)의 구조. (E와 F) EGFP 양성세포 운반 헤스1 리포터(Cell1)와 Dll1 단백질 리포터(Cell2)를 운반하는 mCherry 양성 세포를 두 종류의 리포터로부터 공동 배양하고 발광을 측정하였다. 녹색 세포 (cell1)에서 Hes1 리포터의 발현은 두 세포가 접촉 한 후 약 60 분 후에 시작되는 것처럼 보였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 동영상 S1: 도 3D-3F와 관련된 이웃 세포에서 발현된 Hes1 프로모터 리포터 및 Dll1 단백질 리포터의 발현의 가시화. (다운로드하려면 마우스 오른쪽 단추로 클릭합니다.)
토론
노치 시그널링의 구성 요소는 소미토 발생 시 동기화시 진동 발현을 나타내지만 신경 발생 시 동기화되지 않은 것으로 나타나며, 후자의 경우 정적 분석에 의한 발현 역학을 포착하는 데 어려움을 초래합니다. 따라서, 실시간 모니터링은 Hes1 및 Dll1과같은 노치 신호 구성 요소의 발현 역학을 밝히기 위해 요구된다. Hes1 및 Dll1 진동의 발현 기간이 매우 짧기 때문에 약 2-3시간 동안 신속한 응답과 불안정한 리포터가 표현 역학을 모니터링해야 합니다. 이를 위해 생물 발광 리포터 및 이미징 시스템을 개발했습니다. 생물 발광 리포터 루시퍼라제는 이러한 순환 유전자 발현의 빠른 회전율을 추적하기 위해 급속한 성숙 역학 및 고감도를 나타낸다. 기자의 급속한 회전율은 매우 희미한 신호생성으로 이어집니다. 생물 발광 리포터가 생성한 희미한 신호를 감지하기 위해, 우리는 고감도, 초저 판독 속도(50kHz)의 수냉식 CCD 카메라를 포함한 최적화된 생물 발광 이미징 시스템을 사용하여 노이즈를 최소한으로 줄입니다. 또한, 높은 수치 조리개 (N.A.) 대물 렌즈는 우리가 최대한 불안정 루시 퍼라제아제 기자에서 방출 된 빛을 수집 할 수 있습니다. 더 높은 감도를 얻으려면 일반적으로 더 높은 비닝(예: 2 x 2, 4 x 4, 8 x 8)을 사용하고 셔터를 장시간(예: 5-20분) 열어 두십시오. 루시퍼라제 리포터의 신호가 매우 희미하기 때문에 환경으로부터의 빛의 간섭은 희미한 신호를 감지하는 데 에도 문제가 있습니다: 따라서 현미경실은 완전히 어두워야 합니다. 이 시스템은 전사 및 단백질 수준 모두에서 NPC에서 Hes1 및 Dll1 유전자의 동적 발현을 측정할 수 있게합니다(그림 3). 또한, 우리는 luciferase 융합 단백질 기자를 가진 세포내 전좌의 단백질 역학을 구상할 수 있습니다. 더욱이, 신속한 반응 루시퍼라제 리포터를 이용하여, 노치 시그널링의 전송 역학을 포착하고 두 개의 살아있는 셀 사이의 신호 전송시간 지연을 측정할 수있다(도 3D-F 및 보조 무비 S1). 더욱이, 단일 유전자의 프로모터 리포터(Ub-luciferase reporter)와 단백질 리포터(luciferase fusion)의 조합은 유전자의 전사와 번역 사이의 시간 지연을 측정할 수 있게 한다. 이러한 방식으로 다양한 종류의 발광 리포터 및 형광 리포터의 다중 이미징을 통해 생화학 반응에 대한 시간 지연/속도를 측정할 수 있다.
단세포 해상도에서 유전자 발현을 실시간으로 모니터링한 결과 동일한 유전자의 발현 역학에 변화가 있음을 밝혀냈습니다. 일부 세포는 진동 방식으로 Dll1/Neurog2를 표현하지만, 다른 세포는 지속적인 패턴을 보여줍니다. 더욱이, 상이한 발현 역학(진동 대 안정)은 세포 상태에서 상이한 출력을 유도한다. 명확한 것으로 보이는 것은 다른 표현역학이 다른 방식으로 세포 행동에 영향을 미친다는 것입니다, 표현 역학이 더 많은 정보를 인코딩한다는 것을 시사21,22,26,27,28,29,30,31, 32. 정적 분석은 유전자 발현의 역학을 포착할 수 없으며, 세포 적 사건에서 발현 역학을 밝히기 위해 생물학적 현상을 이해하기 위해 실시간 분석이 필요합니다. 여기에서 소개하는 접근 방식은 높은 시간적 해상도로 신경 발달 중에 초다이아 발진기의 역학을 모니터링할 수 있습니다. 이 방법을 사용하여, 우리는 더 많은 유전자가 우리가 이전에 생각했던 것보다 동적으로 표현된다는 것을 것을을 발견하고, 우리는 단백질 발현의 역학 뿐 아니라 높은 시간적 해결책에 세포에 있는 단백질 현지화에 있는 역학을 추적할 수 있습니다. 이러한 동적 발현 패턴은 아직 해명되지 않은 생물학적 의미를 가질 수 있습니다.
생물발광 기자는형광기자(33)와비교하여 살아있는 세포에 대한 시간적 분해능 및 낮은 독성에 큰 이점을 갖는다. 그러나, 형광 리포터의 색상 변화와는 달리, 생물 발광 리포터에는 몇 가지 색상만 있어 동시에 모니터링할 수 있는 유전자의 수에 제한이 있습니다. 그럼에도 불구하고, 다양한 생물로부터 분리되고 복제되는 가변 루시퍼라아제의 수가 증가하고있으며,이러한다양한 루시퍼라제를 사용하여, 우리는 높은 시간적 해상도에서 단일 세포에서 다중 유전자 발현 역학을 동시에 추적할 수 있을 것이다. 반딧불이 루시퍼라아제의 분자 크기는 형광 리포터보다 크며, 이는 단백질 역학을 모니터링하기 위해 리포터 융합 단백질을 생성하는 데 어려움을 겪고 있지만,최근에는 새롭고 작고 밝은 루시퍼라이아제(36)가 복제되어 그 어느 때보다 쉽게 단백질 역학을 시각화할 수 있게 되었다. 최근 다양한 생물학적 사건에서 유전자 발현 및 단백질 전좌에서 역학의 상이한 유형을 보였다는 보고가21,22,26,27,28,29,30,31,32를나타냈다. 실시간 모니터링 시스템을 사용하여 시공간 적 조절에서 이러한 역학의 분석은 세포의 실제 상태를 캡처하고 셀룰러 시스템의 조절을 공개하는 것이 점점 더 중요 할 것이다.
공개
저자는 상충하는 재정적 이익이 없습니다.
감사의 말
이와모토 유미코에게 동영상 제작을 지원해 주신 것에 대해 감사드립니다. 또한 이미지 분석의 논의와 지원에 대한 이소무라 아키히로, 형질전환 동물 생성을 위한 기술 지원을 위한 미야치 히토시, 신조 유지(올림푸스 의학), 에가와 마사토시(올림푸스 의학), 이시즈 다쿠야() 올림푸스 의학)과 우인 쿠니타키(Andor Japan)는 생물 발광 이미징 시스템의 기술 지원 및 논의를 위해 이 작품은 진화 과학 기술에 대한 핵심 연구에 의해 지원되었다 (JPMJCR12W2) (R.K.), 혁신적인 영역에 대한 과학 연구를위한 보조금 에이드 (MEXT 24116705 H.S. 및 MEXT 16H06480 R.K.에 대한), 과학 연구를위한 보조금 지원 (C) (JPSPs) 18K06254) (H.S.), 다케다 재단 (R.K. 및 H.S.), 그리고 교육, 문화, 스포츠, 과학 기술, 일본에서 생활 시스템에 대한 동적 접근을위한 플랫폼.
자료
| Name | Company | Catalog Number | Comments |
| Bioluminescence Imaging System | |||
| Chilled water circulator (chiller) | Julabo | Model: F12-ED | |
| Cooled CCD camera | Andor Technology | Model: iKon-M 934 | |
| Incubator system | TOKAI HIT | Model: INU-ONICS | |
| Inverted microscope | Olympus | Model: IX81 | |
| Inverted microscope | Olympus | Model: IX83 | |
| LED illumination device | CoolLED | Model: pE1 | |
| MetaMorph | MOLECULAR DEVICES | Model: 40000 | |
| Mix gas controller | Tokken | Model: TK-MIGM OLO2 | |
| Objective lens | Olympus | Model: UPLFLN 40X O | |
| Preparations for Dissection | |||
| Dissection microscope | Nikon | Model: SMZ-2B | |
| Fluorescence stereoscopic microscope | Leica | Model: MZ16FA | |
| Fine forceps | DUMONT | INOX No.5 | |
| Scissors, Micro scissors | |||
| Forceps | |||
| Ring-shaped forceps | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| PBS | Nacalai Tesque | 14249-24 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Reagents for NPC dissociation culture | |||
| B27 supplement | invitrogen | 12587-010 | |
| bFGF | invitrogen | 13256-029 | Stock solution: 1 μg/ml in 0.1% BSA/PBS |
| D-luciferin | Nacalai Tesque | 01493-85 | Stock solution: 100mM in 0.9% saline |
| DNase | Worthington Biochemical Corporation | LK003172 | Stock solution: 1000U/ml in EBSS |
| EBSS | Worthington Biochemical Corporation | LK003188 | |
| Glass bottom dish | IWAKI | 3910-035 | |
| N2 supplement (100x) | invitrogen | 17502-048 | |
| N-acetyl-cystein | Sigma | A-9165-25G | |
| Papain | Worthington Biochemical Corporation | LK003178 | Stock solution: 7U/ml in EBSS |
| Penicillin/Streptmycine | Nacalai Tesque | 09367-34 | |
| Poly-L-lysine | Sigma | P-6281 | 40 mg/ml in DW |
| Preparations for in utero electroporation | |||
| 50-ml syringe | TERUMO | 181228T | |
| Electrode | Neppagene | 7-mm | |
| Electroporator | Neppagene | CUY21 EDIT | |
| Forceps | |||
| Gauzes | Kawamoto co. | 7161 | |
| Micro capillary | Made in-house | ||
| PBS | Nacalai Tesque | 14249-24 | |
| Pentbarbital | Kyoritsuseiyaku | Somnopentyl | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Suture needle | Akiyama MEDICAL MFG. CO | F17-40B2 | |
| Xylazine | Bayer | Seractal | |
| Preparations for Slice culture | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| Culture insert | Millipore | PICM01250 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Fetal Bovine Serum | Sigma | 172012-500ML | |
| Fine forceps | DUMONT | INOX No.5 | |
| Forceps | |||
| Horse Serum | Gibco | 16050-122 | |
| Micro surgical knife | Alcon | 19 Gauge V-Lance | |
| Multi-gas incubator | Panasonic | MCO-5MUV-PJ | |
| N2/B27 media | Made in-house | ref. NPC dissociatioin culture | |
| PBS | Nacalai Tesque | 14249-24 | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Silicon rubber cutting board | Made in-house |
참고문헌
- Ross, S. E., Greenberg, M. E., Stiles, C. D. Basic helix-loop-helix factors in cortical development. Neuron. 39, 13-25 (2003).
- Pontious, A., Kowalczyk, T., Englund, C., Hevner, R. F. Role of intermediate progenitor cells in cerebral cortex development. Developmental Neuroscience. 30, 24-32 (2007).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Paridaen, J. T., Huttner, W. B. Neurogenesis during development of the vertebrate central nervous system. EMBO Reports. 15, 351-364 (2014).
- Taverna, E., Götz, M., Huttner, W. B. The cell biology of neurogenesis: toward an understanding of the development and evolution of the neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Louvi, A., Artavanis-Tsakonas, S. Notch signaling in vertebrate neural development. Nature Reviews Neuroscience. 7, 93-102 (2006).
- Pierfelice, T., Alberi, L., Gaiano, N. Notch in the Vertebrate Nervous System: An Old Dog with New Tricks. Neuron. 69, 840-855 (2011).
- Bray, S. Notch signalling: a simple pathway becomes complex. Nature Reviews Molecular Cell Biology. 7, 678-689 (2006).
- Bray, S. Notch signalling in context. Nature Reviews Molecular Cell Biology. 17, 722-735 (2016).
- Kopan, R., Ilagan, M. X. G. The Canonical Notch Signaling Pathway: Unfolding the Activation Mechanism. Cell. 137, 216-233 (2009).
- Ishibashi, M., et al. Persistent expression of helix-loop-helix factor HES-1 prevents mammalian neural differentiation in the central nervous system. The EMBO Journal. 13, 1799-1805 (1994).
- Ohtsuka, T., et al. Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation. The EMBO Journal. 18, 2196-2207 (1999).
- Ohtsuka, T., Sakamoto, M., Guillemot, F., Kageyama, R. Roles of the Basic Helix-Loop-Helix Genes Hes1 and Hes5 in Expansion of Neural Stem Cells of the Developing Brain. Journal of Biological Chemistry. 276, 30467-30474 (2001).
- Kageyama, R., Ohtsuka, T., Kobayashi, T. The Hes gene family: repressors and oscillators that orchestrate embryogenesis. Development. 134, 1243-1251 (2007).
- Shimojo, H., Ohtsuka, T., Kageyama, R. Oscillations in Notch Signaling Regulate Maintenance of Neural Progenitors. Neuron. 58, 52-64 (2008).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342, 1203-1208 (2013).
- Shimojo, H., et al. Oscillatory control of Delta-like1 in cell interactions regulates dynamic gene expression and tissue morphogenesis. Genes and Development. 30, 102-116 (2016).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Kageyama, R., Ohtsuka, T., Shimojo, H., Imayoshi, I. Dynamic Notch signaling in neural progenitor cells and a revised view of lateral inhibition. Nature Neuroscience. 11, 1247-1251 (2008).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 1313-1318 (2006).
- Levine, J. H., Lin, Y., Elowitz, M. B. Functional roles of pulsing in genetic circuits. Science. 342, 1193-1200 (2013).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152, 945-956 (2013).
- Luker, G. D., Pica, C. M., Song, J., Luker, K. E., Piwnica-Worms, D. Imaging 26S proteasome activity and inhibition in living mice. Nature Medicine. 9, 969-973 (2003).
- Yamaguchi, S., et al. Synchronization of Cellular Clocks in the Suprachiasmatic Nucleus. Science. 302, 1408-1412 (2003).
- Kiyohara, Y. B., et al. The BMAL1 C terminus regulates the circadian transcription feedback loop. Proceedings of the National Academy of Sciences of the United States of America. 103, 10074-10079 (2006).
- Behar, M., Hoffmann, A. Understanding the temporal codes of intra-cellular signals. Current Opinion in Genetics and Development. 20, 684-693 (2010).
- Elowitz, M. B., Levine, A. J., Siggia, E. D., Swain, P. S. Stochastic Gene Expression in a Single Cell. Science. 297, 1183-1186 (2002).
- Nelson, D. E., et al. Oscillations in NF-kappaB signaling control the dynamics of gene expression. Science. 306, 704-708 (2004).
- Purvis, J. E., et al. p53 dynamics control cell fate. Science. 336, 1440-1444 (2012).
- Hansen, A. S., O'Shea, E. K. Promoter decoding of transcription factor dynamics involves a trade-off between noise and control of gene expression. Molecular Systems Biology. 9, 704 (2014).
- Hansen, A. S., O'Shea, E. K. cis Determinants of Promoter Threshold and Activation Timescale. Cell Reports. 12, 1226-1233 (2015).
- Johnson, H. E., Toettcher, J. E. Signaling Dynamics Control Cell Fate in the Early Drosophila Embryo. Developmental Cell. 48, 361-370 (2019).
- Badr, C. E., Tannous, B. A. Bioluminescence imaging: Progress and applications. Trends in Biotechnology. 29, 624-633 (2011).
- Nakajima, Y., Ohmiya, Y. Bioluminescence assays: multicolor luciferase assay, secreted luciferase assay and imaging luciferase assay. Expert Opinion on Drug Discovery. 5, 835-849 (2010).
- Nakajima, Y., et al. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, (2010).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Molecular Imaging. 12, (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유