Method Article
マウス神経新生時のノッチシグナル伝達ダイナミクスのリアルタイム生物発光イメージング
要約
神経幹/前駆細胞は、細胞イベントの異なる結果につながるノッチシグナル伝達成分の様々な発現ダイナミクスを示す。このような動的発現は、遺伝子発現の急速な変化の可視化を可能にする高感度生物発光イメージングシステムを用いて、静的解析ではなくリアルタイムモニタリングによって明らかにすることができる。
要約
ノッチシグナル伝達は、細胞間相互作用によって神経幹/前駆細胞の維持を調節する。ノッチシグナリングの成分は動的発現を示す。ノッチシグナル伝達エフェクターHes1およびノッチリガンドデルタ様1(Dll1)は、神経幹/前駆細胞において振動的に発現される。これらの遺伝子の振動発現の期間は非常に短い(2時間)ため、その周期発現を監視することは困難である。このような遺伝子発現またはタンパク質ダイナミクスの急速な変化を調べるには、迅速な応答レポーターが必要である。その速い成熟運動と高感度のために、生物発光レポータールシフェラーゼは、生きている細胞の急速な遺伝子発現変化を監視するのに適しています。プロモーター活性をモニタリングするために不安定化ルシフェラーゼレポーターと、単一細胞分解能でタンパク質ダイナミクスを可視化するためのルシフェラーゼ融合レポーターを使用しました。これらの生物発光レポーターは、急速な回転率を示し、非常に弱い信号を生成します。そこで、このようなかすかな信号を検出する高感度生物発光イメージングシステムを開発しました。これらの方法により、生きている細胞や組織における様々な遺伝子発現ダイナミクスをモニタリングすることが可能となり、実際の細胞状態を理解するのに役立つ重要な情報である。
概要
哺乳類の脳は、様々な種類のニューロンとグリア細胞で構成されています。すべての細胞は神経幹/前駆細胞(NPC)から生成され、最初に増殖してその数を拡大し、次にニューロンに分化し始め、最後にグリア細胞1、2、3、4、5を生み出します。細胞がニューロンに分化すると、細胞の増殖や数の増加はできないため、後の段階までNPCのメンテナンスが重要になります。細胞間相互作用を介したノッチシグナル伝達は、NPC6、7を維持する上で重要な役割を果たす。ノッチリガンドは、隣接する細胞の表面上の膜タンパク質、ノッチと相互作用し、ノッチタンパク質を活性化します。活性化後、ノッチタンパク質のタンパク質分解が起こり、それによってノッチ(NICD)の細胞内ドメインを細胞膜から核8、9、10に放出する。核では、NICDはHes1およびHes5(Hes1/5)のプロモーター領域に結合し、これらの遺伝子の発現を活性化する。 Hes1/5 は、プロニューラル遺伝子Ascl1およびニューロゲニン1/2 (Neurog1/2)11,12,13,14の発現を抑制します。プロニューラル遺伝子は神経分化を誘発するので、Hes1/5はNPCの維持に重要な役割を果たします。さらに、プロニューアル遺伝子はノッチリガンドデルタ様1(Dll1)の発現を活性化することができるので、Hes1/5もDll1の発現を抑制する。したがって、Dll1 の式は、ノッチシグナリングを介して Dll1 に対して隣接するセルが負の結果になります。このようにして、細胞は隣接する細胞が同じ運命をたどるのを阻害し、横方向阻害8と呼ばれる現象である。発達中の脳では、側面阻害は様々な異なる細胞型を生成する役割を果たす。
単一細胞レベルでのリアルタイムイメージングは、NPC15、16、17におけるノッチシグナリングの成分の動的表現を明らかにする。ノッチシグナル伝達はHes1の発現を活性化しますが、Hes1タンパク質は独自のプロモーターに結合し、独自の発現を抑制します。さらに、Hes1は非常に不安定なタンパク質であり、ユビキチン-プロテアソーム経路によって分解される。したがって、独自のプロモーターの抑圧は短命であり、その後、転写が再び開始されます。このようにして、Hes1の発現は、2時間サイクル18における転写レベルと翻訳レベルの両方で振動する。Hes1の振動発現は、順番に、Ascl1、Neurog2、およびDll1などの下流標的遺伝子の振動発現を、周期的な抑制15、16、17、19を介して誘導する。プロニューラル遺伝子は神経分化を誘発する可能性がありますが、その振動発現は神経分化には不十分です。むしろ彼らの持続的な発現は、神経の分化のために不可欠です。プロエン神経遺伝子の振動発現は、神経分化14、15、16を誘導するのではなく、NPCを維持するために重要である。Dll1の発現は、神経新生やソミトジェネシスなどの様々な形態形成の間の転写および翻訳レベルの両方で振動する。Dll1の動的発現は、正常な形態形成およびDll1の安定した発現が神経新生およびソミト形成17の欠陥を誘発する上で重要である。これらの知見は、遺伝子発現およびタンパク質動態のダイナミクスが様々な発達イベントの調節に及ぼす重要な機能を示している(すなわち、異なる発現ダイナミクスが細胞挙動において異なる出力を生み出す)。
ノッチシグナル伝達のダイナミクスを分析するために、組織や細胞の静的解析は絶えず変化しているため不十分です。単一細胞のリアルタイムイメージングは、遺伝子発現のダイナミクスを明らかにする強力なツールです。ノッチシグナル伝達分子の動的発現は、2〜3時間の間に急速な環状応答を受ける。この迅速な周期的発現は、リアルタイムモニタリングのための2つの困難な問題を提示する:(1)分子の発現が低レベルに抑制され、(2)急速な回転率は高速応答レポーターを必要とする。これらの問題を克服するために、我々は以前に生物発光リアルタイムイメージング法20を開発した。生物発光レポーターは蛍光レポーターよりも感度が高く成熟時間が短いため、生細胞の急激なダイナミクスをモニタリングすることができます。リアルタイムビジュアライゼーションを用いて、これまで考えられていたよりも多くの遺伝子が動的発現を示していることがわかりました。また、生細胞における発現およびタンパク質ダイナミクスを示す報告の数および様々な生物学的事象におけるこれらのダイナミクスの意義が増加しており、遺伝子発現21、22におけるダイナミクスの基本的な役割を示唆している。
本報告では、解別培養と皮質スライス培養の両方において、NPCにおけるノッチリガンドDll1の発現を可視化する方法について説明する。単一細胞レベルでのDll1転写のダイナミクスをモニタリングするために、pDll1-Ub-Flucレポーターを担うトランスジェニックマウスの胚性脳から由来するNPCの解離培養物を生成した。生体内のDll1タンパク質ダイナミクスをモニタリングするために、皮質のNPCにDll1-Fluc融合レポーターを導入し、皮質スライス培養におけるNPCにおけるレポーターの発現を可視化した。リアルタイムイメージングにより、生細胞における遺伝子発現やタンパク質ダイナミクスの様々な特徴を高い時間分解能で捉え得ることができます。
プロトコル
動物の被験者を含むすべての手続きは、京都大学フロンティア生命医科学研究所の制度的動物管理利用委員会によって承認されています。
1. 生物発光レポーター
注:ルシフェラーゼレポーターは、分解シグナルを融合してプロモーター活性の急速なダイナミクスを測定するのに適しています。さらに、ルシフェラーゼ融合レポーターは、単一細胞におけるタンパク質ダイナミクスのモニタリングを可能にします。両方のタイプのレポーターは、単層培養(解離培養)および組織培養(スライス培養)実験に利用できる。
- Dll1 プロモーターアクティビティを監視するためのレポーター17
注:遺伝子発現の急激な変化を監視するには、迅速な応答と不安定なレポーターが不可欠です。ホタルルシフェラーゼ(Fluc)は、フルオレセインレポーターと比較して急速な成熟を示す。ユビキチン融合ルシフェラーゼレポーター(Ub-Fluc)は急速な分解と急速なターンオーバーを示すので、生細胞20における動的遺伝子発現を監視することは非常に有用である。- Dll1プロモーター駆動不安定性ルシフェラーゼレポーター、ユビキチン化ルシフェラーゼ(pDll1-Ub-Fluc、図1A上部パネル)を使用して、転写レベル17でDll1発現の急激な変化を監視する。
- このレポーターの安定した発現のためのpDll1-Ub-Flucを運ぶトランスジェニックマウスラインを生成する。
- Dll1タンパク質ダイナミクスを監視するためのレポーター17.
- ノックインマウスの生成については、Dll1-ルシフェラーゼ融合タンパク質が発現するようにDll1コード領域の3'末端にルシフェラーゼcDNAを挿入する(Dll1-Flucレポーター、図1A、下部パネル)17。
- ルシフェラーゼ活性を測定することにより、タンパク質レベルでのDll1の発現ダイナミクスを監視する。
- 組織レベルでのDll1タンパク質ダイナミクスをモニタリングするために、子宮エレクトロポレーションによって胚性脳波のNPCにDll1-Flucレポーターを導入する。
2. 生物発光イメージングシステム
- 感度の高い水冷CCDカメラを搭載した反転顕微鏡を用いて、生物発光ライブイメージングシステムを構築する。騒音を低減し、高感度を得るためには、-90°Cの最適化された温度でサーキュレータが提供する冷水でカメラを冷却します。
- 生細胞/組織イメージングの場合は、インキュベーションシステムを設置し、温度と混合ガスを制御し、顕微鏡段階にします。
- 不安定化ルシフェラーゼレポーターの発現をイメージングするには、高い数値角(NA:1.30)40xオイル浸漬対物レンズを使用します。このレンズの作動距離は0.2mmであり、単層細胞培養のみならずスライス培養にも利用できる。
- ルシフェラーゼとフルオレセインレポーター発現の二重モニタリングのために、LED照明装置を顕微鏡の光経路に取り付けます。
- 顕微鏡に関連するソフトウェア(例えば、MetaMorphソフトウェアの多次元集録プログラム)を用いてタイムラプスイメージングを制御する。
- 不安定なルシフェラーゼレポーターの信号が非常にかすかであるため、システム全体を暗い部屋に準備し、余分な光を避けるために、取得を防ぎます。
3. 神経幹/前駆細胞(NPC)解離培養
- NPC解離培養のための培養媒体、食器、試薬の調製
- DMEM/F12メディアで、最終濃度1x N2、1x B27、1mM N-アセチルシステイン、10 ng/mL bFGFおよび50 U/mLペニシリン/ストレプトマイシンを用いて神経幹/前駆細胞を培養するためのN2/B27メディアを用意します。
- EBSSメディアで7 U/mLパパイン、0.006%DNaseおよび1 mM N-アセチルシステインを含む解離のためのパパイン溶液を調製します。
- 発光イメージング用ルシフェリンナトリウム溶液を100m調製します。N2/B27媒体中の希薄100mMルシフェリン溶液を1mMの最終濃度にする。
注:ルシフェリンは、オートフルオレセイン自体を示しています。ルシフェラーゼ蛍光デュアルイメージングの場合、特にEGFPは、ルシフェリンの濃度を0.5mMに低下させる方が良い。 - 35mmガラス底皿(ガラス径27mm)を、室温で1時間、ポリL-リジン(PLL)溶液の40μg/mLでコーティングします。インキュベーション後、プレート3xをPBSで洗い、乾燥させます。
- NPCの胚解離と解離
- CO2窒息と子宮頸部脱臼によって妊娠中のpDll1-Ub-lucトランスジェニックマウス(胚発生日12.5(E12.5)))を安楽死させた後、腹部を切り取り、子宮を取り出す。
注:研究者は、その機関の動物研究委員会の規則とガイドラインに従う必要があります。麻酔や痛みの軽減薬を使用する場合は、適切に使用してください。 - 25 mLの氷冷PBSを含む10cmペトリ皿で子宮を移します。マイクロはさみと細かい鉗子を使用して、氷冷PBSで子宮から胚を取り出します。
- はさみを使って各胚の頭部を切り取り、氷冷DMEM/F12を含む10cmペトリ皿に移します。脳を取り巻く表皮と軟骨を取り除き、N2/B27メディアの氷冷3mLを含む35mmペトリ皿に脳を移します。
- 死脳から左右の脳素を切り落とす (図 1Ba-f, C,D)。微細鉗子を使用して、脳素の表面を覆う髄膜を取り除きます(図1Bi)。再び微細鉗子を使用して、脳素から皮質のヤソ側部分を取り出す(図1Bg,h,j-l E)。
- P1000ピペットを使用して組織を新しい1.5 mLチューブに移し、P200ピペットで余分な媒体を取り外します。脳組織(皮質のペア)あたりパパイン溶液の0.1 mLを追加します。24°Cでインキュベーションを15分後、P1000ピペットでサンプルを10回軽くピペットします。24°Cで15分間、サンプルを再度インキュベートします。
- P1000ピペットでサンプルを10回軽くピペットします。400 x gと室温 (RT) で 3 分間サンプルを遠心分離します。上清を捨てる。
- DMEM/F12 メディアをペレットに 1 mL 追加します。P1000ピペットで10回軽くピペット。400 x gで3分間サンプルを遠心分離し、上清を廃棄します。これを少なくとも2回繰り返してください。
- ペレットに0.5 mLのN2/B27媒体を加え、ルシフェリン1mMを含み、よく混ぜます。細胞(1 x 106細胞)をPLLコーティングガラス底皿に播種します。CO2インキュベーター内の細胞を1時間培養する。細胞が皿に付着したら、1 mMルシフェリンを含むN2/B27媒体の2 mLを加える。
- CO2窒息と子宮頸部脱臼によって妊娠中のpDll1-Ub-lucトランスジェニックマウス(胚発生日12.5(E12.5)))を安楽死させた後、腹部を切り取り、子宮を取り出す。
- NPC解離培養におけるルシフェラーゼレポーター発現の可視化
- 解剖を実行する前に、発光ライブイメージングシステムを起動します。NPC培養の場合、ステージインキュベーターの温度を37°Cに設定し、ガス混合物の設定を20%O2、5%CO2に設定する。
- イマージョンオイルを対物レンズに入れます。サンプル皿を顕微鏡の段階に置きます。フィールドを手動で表示し、目的のセルの最適な位置とフォーカスを選択します。[ライブ] をクリックしてテスト イメージを取得します。
- 多次元集録プログラムで24時間分の2次元(発光・明視野)取得によるタイムラプス取得を実行します。多次元集録プログラムを選択し、取得設定を以下のように設定します(ステップ3.3.6)。
- 発光画像取得には、低転写速度(50kHz)、2 x 2/4 x 4ビニング、10分/5分露光時間のカメラ設定を使用します。明視野画像の取得には、中間転送速度(1 MHz)、1 x 1ビニング、100ミリ秒の露光時間の設定を使用します。
4. 子宮エレクトロポレーションで
注:これは、神経前駆細胞にDll1-Flucレポーターを導入するために行われます。
- エレクトロポレーション用工具・試薬の調製
- 胚性脳症の心室にDNAを注入するためのマイクロキャピラリーを準備する。熱で草の毛細血管を伸ばし、研磨機でその先端を磨きます。
- 色素(例えば、トリパンブルー)とDNAの混合物を調製する。各DNAの濃度はPBSで1μg/μLであり、最終濃度10%に染料を加える。
注:Dll1タンパク質ダイナミクスの可視化にはDNAの混合物を使用してください:Dll1-Fluc(Dll1タンパク質レポーター、図2E上部)およびpEF-EGFP(EFプロモーター駆動EGFP発現ベクター、図2E下部)は、トランスフェクトされた細胞の位置と形態を監視します。 - 2種類の麻酔薬を調製する:ペントバルビタールの3.88 mg/mLとキシラジンの0.12%、滅菌1x PBS。
- 操作中に無菌器具および外科手袋を使用してください。
- 子宮エレクトロポレーションで
- 3.88 mg/mL ペントバルビタールの 500 μL および 0.12% キシラジンの 500 μL を有する麻酔薬の腹腔内投与によって、時間妊娠 ICR マウス (E12.5) を麻酔する。
注:研究者は、動物実験の規制に従う必要があります。麻酔や痛みの軽減薬を使用する必要がある場合は、それらを適切に使用してください。 - 髪をクリップし、外科スクラブで皮膚を消毒します。
- つま先ピンチ応答の欠如を確認します。ペダル反射が見えなくなったら、2-3cmを腹部を中線に沿って切り取ります。解剖された部分の周りにガーゼを入れ、切開部を乾燥させないように暖かいPBSでガーゼを濡らします。リング状の鉗子で右の子宮の角を穏やかに取り出し、胚の数を数えます。
- 混合DNAの1~2μLを、マイクロキャピラリーで胚の脳波の心室にやさしく注入する。
注:注射が成功すると、子宮の表面上に色素の青色が見えます。 - 電圧パルスを供給する前に子宮と電極を濡らし、胚の頭部を穏やかに保持します。正に帯電した電極を半球の側面に設定し、DNAを注入した。エレクトロポレーションのパルスの状態が50ミリ秒で30~50Vであることを確認し、パルスの間隔は1秒(50ミリ秒、ノンチャージ950ms)です。1つの胚に5パルスを提供し、負の荷電電極から気泡が発生することを確認します。
注:電極の方向:DNAが正極の側面の細胞に組み込まれていることを確認してください。この手順の間、電極の位置を移動しないでください。 - 他の胚についても手順4.2.3~4.2.4を繰り返し、子宮角を腹腔に戻します。左子宮角の胚に同じ手順を実行します。
- 左側を戻した後、シルク縫合糸(4-0)で切開を針(17mm)で縫合します。切開を完全に閉じる前に、暖かいPBSを腹腔に入れる
注:縫合糸間の間隔は約2mmです。 - 手術を終えた後、麻酔後の回復のために加熱パッドの上にマウスを置きます。マウスを個別に収納します。
注:研究者は、動物実験の彼らの地元の扇動規則に従う必要があります。痛みの軽減薬を使用する必要がある場合は、適切に使用してください。
- 3.88 mg/mL ペントバルビタールの 500 μL および 0.12% キシラジンの 500 μL を有する麻酔薬の腹腔内投与によって、時間妊娠 ICR マウス (E12.5) を麻酔する。
5. 皮質スライスにおける発達皮質のスライス培養とルシフェラーゼレポーター発現の可視化
- 皮質のスライス培養のための培養媒体および試薬の調製
- N2/B27メディアで5%ウシ血清と5%馬血清を含む皮質スライスを培養するための濃縮媒体を準備します。
- 解剖し、皮質のスライスを作るためのDMEM /F12媒体を通して気泡100%O2ガス。
メモ:酸素ガスを安全に使用するには、O2シリンダーをシリンダーキャビネットに収納し、酸素濃度計で空気中の酸素濃度を監視してください。 - 濃縮媒体中の100mMルシフェリンナトリウム溶液を1mMの最終濃度に希釈する。
注:ルシフェリンは、オートフルオレセイン自体を示しています。ルシフェラーゼ蛍光デュアルイメージングの場合、特にEGFPは、ルシフェリン(0.5mM)の濃度が低い方が良い。 - マルチガスインキュベーターを37°Cに40%O2、5%CO2に設定します。
- 胚の解剖と蛍光レポーターの発現の検討
- レポーター(E13.5)が子宮エレクトロポレーション(ステップ4.2)で導入される妊娠中のマウスを安楽死させた後、腹部を切断し、子宮を取り出す。
注:研究者は、動物実験の規制に従う必要があります。麻酔や痛みの軽減薬を使用する場合は、適切に使用してください。 - PBSを含む10cmのペトリ皿に子宮を移します。マイクロはさみと細かい鉗子を使用して、PBSの子宮から胚を取り出します。各胚の頭部を切り取り、DMEM/F12媒体を含む10cmのペトリ皿に100%O2ガスで泡立たせて移します。DMEM/F12メディアで脳を取り巻く表皮と軟骨を取り除く。
- リング状の鉗子でペトリ皿のふたの上に脳を置き、蛍光立体顕微鏡の段階で蓋を置きます。励起光の下で蛍光タンパク質を発現する皮質の領域を確認する(図2A,B)。
- DMEM/F12メディアの30 mLを充填したシリコーンゴム製のまな板に脳を移し、100%O2ガスで泡立たせた。細かい鉗子によって脳素の表面を覆う髄膜を取り除く。
- 後側脳の内側と側面の間の境界を切断し、マイクロ手術ナイフまたは細かい鉗子を使用して2つの半球に分けます。マイクロ手術用ナイフを使用して、ストライプのような皮質をカットし、皮質のスライスを作ります(図2C,D)。ピペットを使用してミディアムでピペットスライスし、35ミリメートルの皿で濃縮されたメディアに転送します。
- 濃縮されたメディアとガラス底の皿に培養インサートにスライスを置きます。細かい鉗子を使用してスライスの方向を修正します。スライスの切断サーフェスをカルチャ挿入のサーフェスに設定します。ピペットで余分なメディアを取り外します。マルチガスインキュベーターでスライスを40%O2、5%CO2を37°Cで30分間インキュベートします。
- 1 mMルシフェリンを含む濃縮メディアをガラス底皿に培養インサートの外側に300μL加えます。
- レポーター(E13.5)が子宮エレクトロポレーション(ステップ4.2)で導入される妊娠中のマウスを安楽死させた後、腹部を切断し、子宮を取り出す。
- スライス培養におけるルシフェラーゼレポーター発現の可視化
- 解剖を開始する前に、発光ライブイメージングシステムを開始します。皮質スライス培養物の次の条件を使用してください: 40% O2, 5% CO2および 37 °C.
- 40倍の対物レンズに浸漬油を入れます。サンプル皿を顕微鏡の段階に置きます。蛍光の試験画像を取得し、励起光の照明下で目的の領域に位置とフォーカス平面を設定します。
- タイムラプス取得を24時間分の3-ジメンタル(発光、蛍光、明視野)による取得を実行する(図2F-H)。発光画像取得には、低転写速度(50kHz)、2x2/4x4ビニング、10分/5分露光時間のカメラ設定を使用します。蛍光および明視野画像取得には、中間転送速度(1 MHz)、1x1ビニング、100ミリ秒の露光時間の設定を使用します。
6. 画像処理と解析
- 各画像を接続し、スタックイメージを作成します。[ファイル] メニューの [イメージ シーケンスの読み込み] をクリックします (インポート |)をクリックし、取得した画像が保存されるフォルダを選択します。ファイル名に含まれる単語をFile 名の列に入れます。
- 生物発光画像の宇宙線のノイズを除去するには、ImageJ/Fijiのスパイクノイズフィルタープラグインを適用します。スタックイメージを開き、 (スパイクノイズフィルタ) をクリックします。
- Savitzky ゴレイテンポラル フィルタープラグインを適用して、レポーター式の明確なダイナミクスを取得します。スタック イメージを開き、[ Savitzky ゴレイテンポラル フィルター] をクリックします。
- レポーター式の強度を測定するには、Z軸プロファイル Plusプラグインを各セルに適用します。セルを選択し、ROI、対象地域を設定し、[Z 軸プロファイルプラス]をクリックします。
結果
遺伝子Hes1/7の表現は、様々な細胞株および通血中に2時間振動サイクルを示す。さらに、振動の期間は非常に短く、mRNAとタンパク質の両方が約20分の半減期で非常に不安定です。応答が遅いレポーターを使用すると、このような急速なダイナミクスを追跡することができず、安定したレポーターを使用すると、遺伝子発現が振動する間に徐々に蓄積します。したがって、レポーターは、このような周期的に発現される遺伝子の急速な回転を監視するために急速に分解されなければならない。これらの問題を克服するために、ルシフェラーゼレポーターを使用して発振器の動的発現を監視しました。生物発光レポーターは成熟時間が短く、感度が高いため、ウルトラジアン発振器の急速ダイナミクスを監視することができます。蛍光レポーターと同様に、ルシフェラーゼレポーターは、遺伝子コード配列に融合することによりタンパク質の発現ダイナミクスを監視することができます(図1A、図2Eおよび図3D)。ルシフェラーゼ融合遺伝子産物は、内因性タンパク質と同じ発現、ターンオーバーおよび転座動態を細胞内で示す。さらに、振動遺伝子Dll1のプロモーター活性をモニタリングするために、不安定化ルシフェラーゼレポーター(図1A及び図3A)23であるユビキチン化ルシフェラーゼを用いた。様々な種類のルシフェラーゼレポーターを用いて、トランスジェニックマウスまたはノックインマウスを生成し、神経新生17時にNPCにおけるレポーターの安定な発現を得た。組織培養における単一細胞レベルでレポーター発現を可視化するためには、レポーターの散在導入が好ましい。そこで、子宮エレクトロポレーションを介してレポーター遺伝子をNPCに一過性トランスフェクションを用いた(図2F-H)。ルシフェラーゼレポーターシステムは、長期間(例えば、1週間)時計遺伝子の動的表現を監視するために概日リズムの分野で使用されており、ホタルルシフェラーゼ酵素の基質であるルシフェリン(D-ルシフェリン)が非常に安定であり、生細胞24、25に対する毒性を有さないことを示唆している。通常、我々は、一晩の生細胞イメージングのために十分であるメディア中の1 mMの濃度でルシフェリンを使用します。さらに、顕微鏡ベースのイメージングシステムにより、多次元画像、明視野画像、蛍光画像、化学発光画像を取得することができます(図2F-Hおよび図3E)。
これらの条件を用いて、Hes1、Ascl1、Neurog2、Dll1(図2および図3)を含む様々な超音波時計遺伝子の表現を可視化しました。 代表的な結果を図 3に示します。Dll1プロモーター活性のレポーターは、Dll1-Ub-Flucレポーターマウスのテレンセファロン由来のNPCにおいて振動発現を示した。不安定化ルシフェラーゼレポーター(図3A)は、プロモーター活性の発現の急激な上下調節を示した(図3B,C)。この場合、単一の神経前駆細胞は、13時間の間に様々な振幅を有する約2.5時間の発振サイクルを示した(図3C)。迅速応答ルシフェラーゼレポーターを使用すると、2つの生細胞間のノッチシグナリングの伝送ダイナミクスを捉えすることができます(図3D-Fおよび補足ムービーS1)。(1)Hes1プロモーターレポーター(pHes1-Ub-luc)とEGFP発現ベクター、(2)Dll1プロテインレポーター(Dll1-Luc)とmCherry発現ベクターの2種類のDNA混合物を調製し、別々にNPCにトランスフェクトしました。その後、2種類の細胞を採取し、生細胞におけるレポーターの発現を測定するために共培養した。代表的な結果を図3E,Fに示します。Hes1レポーターおよびmCherry陽性細胞を発現する隣接するEGFP陽性細胞は、観察中に互いに接触したDll1タンパク質レポーターを発現する。緑色のセルでのHes1レポーター発現は、2つの細胞が接触した後、約60分で始まるように見えた(図3E,F)。これは、隣接する細胞間のノッチシグナリングの伝送に対する遅延が約1時間であることを示唆した。さらに、シグナル伝達中、Dll1タンパク質発現は赤細胞における動的転座を示した(図3E)。

図1:胚性マウス脳の解剖。(A) ルシフェラーゼレポーター、Dll1プロモーターレポーター、Dll1タンパク質レポーターの構造(B) 解剖の手続き。(a) マウス胚の横図。(b) 点線と一緒に頭を切り落とします。(c) 脳症と中脳の間の隙間から表皮と軟骨を取り除く。(d) 右半球と左半球の中間線に沿って周囲の組織を切断します。(e) 組織を中央の破断から両側に取り出します。(f) 周囲の組織を除去した後のテレンセファロンと中脳。(g) テレンセファロン(tel)、中脳(中)、嗅球(OB)を分離します。(h) テレンセファロンの断面を、(g)で点線で示す。(i) 脳波の表面を取り囲む髄膜を取り除きます。(j) テレンセファロンを内側と側面の2つの部分に分ける。(k) 皮質と神経節のエミネンス(GE)の境界を切断します。(l)皮質のドーソ側部分は解離培養に用いられる。(C) 胚発生日14(E14)の脳は、脳素症と中脳の左(a)と右(b)半球からなる(c)。(D) 中脳から分離した脳波半球。(E) テレンセファロンの1つの解剖半球:神経節エミネンスを含む脳素(d)のベントロラテラル部分(d)、解離培養およびスライス培養に使用される脳素の横側部分(e)、脳頭症の中間部(f)および脳表面を覆う髄膜この図の大きなバージョンを表示するには、ここをクリックしてください。
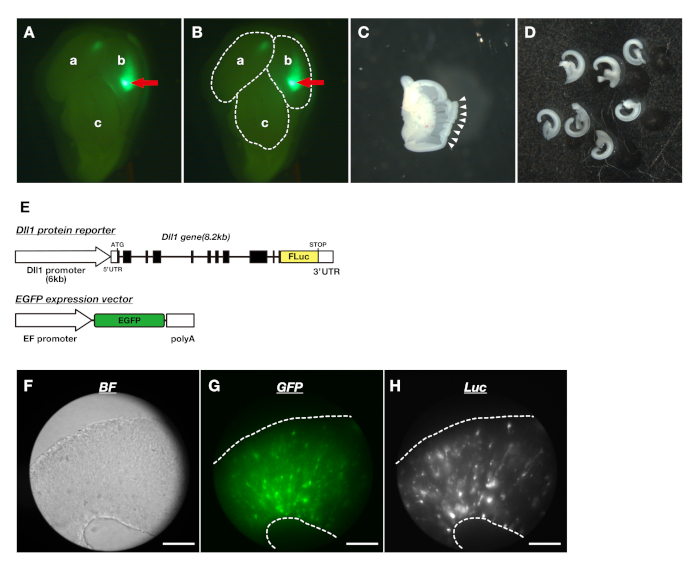
図2:胚性脳の皮質スライスを作り、皮質スライス培養におけるDll1タンパク質ダイナミクスを可視化する。(A)蛍光立体顕微鏡を用いてEGFPの発現を確認する。赤色の矢印は、EGFPを発現する皮質の領域を示す。左半球 (a) 、右半球 (b) と中脳 (c)(B) 点線は(A) に示す脳領域の輪郭を示す。(C)後方脳性脳の皮質を解剖した。白い矢印はカットエッジを示します。(D)ドソ-側面脳の皮質スライス。(E) NPCにおけるDll1タンパク質ダイナミクスを可視化するためのレポーターの遺伝子構造Dll1タンパク質レポーターであるDll1-Fluc(上)をEGFP発現ベクター(下)でNPCに導入し、皮質スライス内の細胞の形態と移動をモニタリングした。(F-H)皮質スライスにおける明視野(F)、GFP発現(G)、生物発光(H)の3次元画像。生物発光イメージングシステムは、ルシフェラーゼと蛍光レポーターの表現を同時にトレースすることを可能にした。スケールバー: 200 μm.ここをクリックすると、この図の大きなバージョンが表示されます。
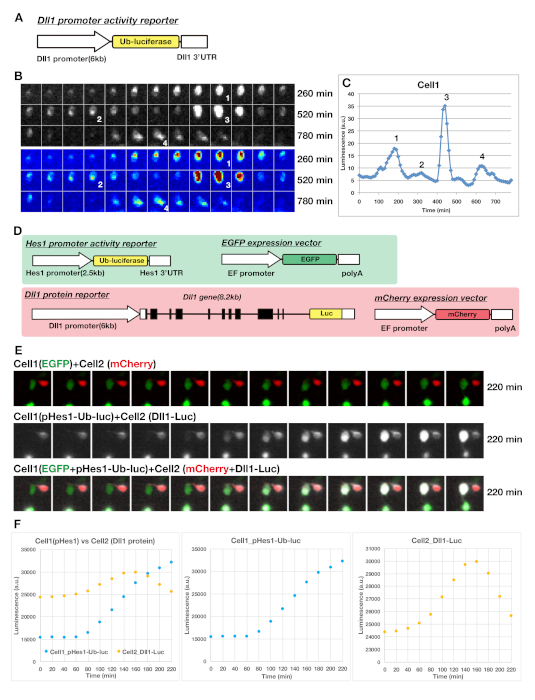
図3:NPC培養におけるDll1遺伝子の動的発現の可視化および解析のための代表的なデータ。(A)不安定化ルシフェラーゼレポーター(Ub-ルシフェラーゼ、ユビキチン化ルシフェラーゼ)を用いて、転写レベルでDll1発現を可視化するためのレポーターコンストラクト。(B) 生物発光レポーターを用いた単一のNPCにおけるDll1の発現の可視化パネル内の数字は、パネルC(C)に示す解解剖NPCの生物発光の経時図プロット(B)における、パネルC(C)の数字に対応するDll1の振動発現のピーク点を示し、Dll1の動的発現を示す。(D-F)隣接細胞で発現したHes1プロモーターレポーターおよびDll1タンパク質レポーターの発現の可視化(D) Hes1プロモーター活性レポーター(pHes1-Ub-luc)およびDll1タンパク質レポーター(Dll1-Luc)の構造。(E および F)Hes1レポーター(Cell1)を担持するEGFP陽性細胞とDll1タンパク質レポーター(Cell2)を担持するmCherry陽性細胞を共培養し、両タイプのレポーターからの発光を測定した。緑色の細胞(cell1)におけるHes1レポーターの発現は、2つの細胞が接触してから約60分後に始まるように見えた。この図の大きなバージョンを表示するには、ここをクリックしてください。
補足ムービーS1:図3D-3Fに関連して、隣接する細胞で発現されるHes1プロモーターレポーターとDll1タンパク質レポーターの発現の可視化。このビデオを見るにはここをクリックしてください。(右クリックしてダウンロードします。
ディスカッション
ノッチシグナル伝達の成分は、ソミト形成時に同期して振動発現を示すが、神経新生時には同期がとれないので、後者の場合には静的解析によって発現ダイナミクスを捕捉するのが困難になる。したがって、Hes1やDll1などのノッチ シグナリング コンポーネントの表現ダイナミクスを明らかにするには、リアルタイム監視が必要です。Hes1およびDll1振動の式の期間は非常に短いため、約 2 ~ 3 時間、表現のダイナミクスを監視するには迅速な応答と不安定なレポーターが必要です。そのために、生物発光レポーターとイメージングシステムを開発しました。生物発光レポータールシフェラーゼは、このような環状遺伝子発現の急速なターンオーバーを追跡するために、急速な成熟運動および高感度を示す。記者の急速な回転率は、非常にかすかな信号が生成につながります。生物発光レポーターが生成するこのようなかすかな信号を検出するために、超低読み出し速度(50kHz)の高感度の水冷CCDカメラを含む最適化された生物発光イメージングシステムを使用し、ノイズを最小限に抑えます。さらに、高い開口(N.A.)対物レンズにより、不安定化したルシフェラーゼレポーターから放出される光を最大限に集めます。より高い感度を得るためには、通常、より高いビニング(例えば、2 x 2、4 x 4、8 x 8)を使用し、シャッターを長時間開いたままにしておきます(例えば、5-20分)。ルシフェラーゼレポーターからの信号は非常にかすかであるため、環境からの光の干渉は、かすかな信号を検出する際にも問題を提示します:したがって、顕微鏡室は完全に暗くなければなりません。このシステムにより、転写レベルとタンパク質レベルの両方でNPCのHes1遺伝子およびDll1遺伝子の動的表現を測定することができます(図3)。また、ルシフェラーゼ融合タンパク質レポーターを用いて細胞内転位のタンパク質ダイナミクスを可視化することができます。さらに、迅速応答ルシフェラーゼレポーターを用いて、ノッチシグナリングの伝送ダイナミクスを捕捉し、2つの生きている細胞間の信号伝送の時間遅延を測定することができる(図3D-Fおよび補足ムービーS1)。また、単一遺伝子のプロモーターレポーター(Ub-ルシフェラーゼレポーター)とタンパク質レポーター(ルシフェラーゼ融合)の組み合わせにより、遺伝子の転写と翻訳の間の時間遅延を測定することができます。このようにして、様々な種類の発光レポーターと蛍光レポーターの多重イメージングを利用して、生化学反応の時間遅延/速度を測定することができます。
単一細胞分解能における遺伝子発現のリアルタイムモニタリングは、同じ遺伝子の発現ダイナミクスにばらつきがあることを明らかにした。振動的にDll1/Neurog2を発現する細胞もあれば、持続的なパターンを示す細胞もある。さらに、異なる発現ダイナミクス(振動対安定)は、細胞の状態で異なる出力を誘導する。明確に見えるのは、異なる式ダイナミクスが異なる方法でセルの動作に影響を与えることであり、式ダイナミクスは、より多くの情報をエンコードすることを示唆しています21,22,26,27,28,29,30,31,32.静的解析では遺伝子発現のダイナミクスを捉えることができず、生物学的現象を理解して細胞イベントの発現ダイナミクスを明らかにするためにはリアルタイム解析が必要です。ここで紹介するアプローチは、高時間分解能で神経発達中のウルトラディアン発振器のダイナミクスを監視することができます。この方法を用いて、これまで考えられていたよりも多くの遺伝子が動的に発現していることがわかり、タンパク質発現のダイナミクスだけでなく、細胞内のタンパク質局在化のダイナミクスを高時間分解能で追跡できることがわかりました。このような動的発現パターンは、まだ解明されていない生物学的意義を有する可能性がある。
生物発光レポーターは、蛍光レポーター33と比較して、時間分解能と生細胞に対する低毒性において大きな利点を有する。しかし、蛍光レポーターの色の変化とは対照的に、生物発光レポーターには少数の色しかなく、同時に監視できる遺伝子の数に制限を課しています。それにもかかわらず、可変ルシフェラーゼの数が増加し、様々な生き物34、35から分離およびクローン化され、このような様々なルシフェラーゼを使用して、同時に高い時間分解能で単一の細胞内の複数の遺伝子発現ダイナミクスをトレースすることが可能になります。ホタルルシフェラーゼの分子サイズは蛍光レポーターよりも大きく、タンパク質ダイナミクスを監視するためにレポーター融合タンパク質を構築する際にいくつかの困難を示していますが、最近では、新しい、より小さく、より明るいルシフェラーゼが36のクローン化され、タンパク質のダイナミクスをこれまで以上に容易に可視化することができます。最近、様々な生物学的事象において遺伝子発現およびタンパク質転座における異なる種類のダイナミクスを示す報告が増えており、21、22、26、27、28、29、30、31、32である。リアルタイム監視システムを用いた時空間調節におけるこのようなダイナミクスの解析は、細胞の実際の状態を捉え、細胞システムの調節を明らかにするためにますます重要になるだろう。
開示事項
著者は相反する金銭的利害関係を持っていない。
謝辞
映像制作を応援してくださった岩本由美子さんに感謝します。また、磯村明宏の議論や画像解析のサポートにも感謝しており、トランスジェニック動物の生成に対する技術支援のための宮地仁、新庄裕司(オリンパス医学)、江川正敏(オリンパス医科)、石津拓也()オリンパス医科学)とオイン・クニタキ(アンドール・ジャパン)は、生物発光イメージングシステムの技術サポートと議論を行っています。この研究は、進化科学技術のコア研究(JPMJCR12W2)(R.K.)、革新的領域に関する科学研究のための助成(H.S.のためのMEXT 24116705およびR.K.のためのMEXT 16H06480)、科学研究のための補助金援助(C)(JSPS)によって支えられた18K06254)(H.S.)、武田財団(R.K.およびH.S.)、および文部科学省の生活システムへの動的アプローチのためのプラットフォーム。
資料
| Name | Company | Catalog Number | Comments |
| Bioluminescence Imaging System | |||
| Chilled water circulator (chiller) | Julabo | Model: F12-ED | |
| Cooled CCD camera | Andor Technology | Model: iKon-M 934 | |
| Incubator system | TOKAI HIT | Model: INU-ONICS | |
| Inverted microscope | Olympus | Model: IX81 | |
| Inverted microscope | Olympus | Model: IX83 | |
| LED illumination device | CoolLED | Model: pE1 | |
| MetaMorph | MOLECULAR DEVICES | Model: 40000 | |
| Mix gas controller | Tokken | Model: TK-MIGM OLO2 | |
| Objective lens | Olympus | Model: UPLFLN 40X O | |
| Preparations for Dissection | |||
| Dissection microscope | Nikon | Model: SMZ-2B | |
| Fluorescence stereoscopic microscope | Leica | Model: MZ16FA | |
| Fine forceps | DUMONT | INOX No.5 | |
| Scissors, Micro scissors | |||
| Forceps | |||
| Ring-shaped forceps | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| PBS | Nacalai Tesque | 14249-24 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Reagents for NPC dissociation culture | |||
| B27 supplement | invitrogen | 12587-010 | |
| bFGF | invitrogen | 13256-029 | Stock solution: 1 μg/ml in 0.1% BSA/PBS |
| D-luciferin | Nacalai Tesque | 01493-85 | Stock solution: 100mM in 0.9% saline |
| DNase | Worthington Biochemical Corporation | LK003172 | Stock solution: 1000U/ml in EBSS |
| EBSS | Worthington Biochemical Corporation | LK003188 | |
| Glass bottom dish | IWAKI | 3910-035 | |
| N2 supplement (100x) | invitrogen | 17502-048 | |
| N-acetyl-cystein | Sigma | A-9165-25G | |
| Papain | Worthington Biochemical Corporation | LK003178 | Stock solution: 7U/ml in EBSS |
| Penicillin/Streptmycine | Nacalai Tesque | 09367-34 | |
| Poly-L-lysine | Sigma | P-6281 | 40 mg/ml in DW |
| Preparations for in utero electroporation | |||
| 50-ml syringe | TERUMO | 181228T | |
| Electrode | Neppagene | 7-mm | |
| Electroporator | Neppagene | CUY21 EDIT | |
| Forceps | |||
| Gauzes | Kawamoto co. | 7161 | |
| Micro capillary | Made in-house | ||
| PBS | Nacalai Tesque | 14249-24 | |
| Pentbarbital | Kyoritsuseiyaku | Somnopentyl | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Suture needle | Akiyama MEDICAL MFG. CO | F17-40B2 | |
| Xylazine | Bayer | Seractal | |
| Preparations for Slice culture | |||
| 10-cm plastic petri dish | greiner | 664160-013 | |
| 35-mm plastic petri dish | greiner | 627160 | |
| Culture insert | Millipore | PICM01250 | |
| DMEM/F12 | invitrogen | 11039-021 | |
| Fetal Bovine Serum | Sigma | 172012-500ML | |
| Fine forceps | DUMONT | INOX No.5 | |
| Forceps | |||
| Horse Serum | Gibco | 16050-122 | |
| Micro surgical knife | Alcon | 19 Gauge V-Lance | |
| Multi-gas incubator | Panasonic | MCO-5MUV-PJ | |
| N2/B27 media | Made in-house | ref. NPC dissociatioin culture | |
| PBS | Nacalai Tesque | 14249-24 | |
| Ring-shaped forceps | |||
| Scissors, Micro scissors | |||
| Silicon rubber cutting board | Made in-house |
参考文献
- Ross, S. E., Greenberg, M. E., Stiles, C. D. Basic helix-loop-helix factors in cortical development. Neuron. 39, 13-25 (2003).
- Pontious, A., Kowalczyk, T., Englund, C., Hevner, R. F. Role of intermediate progenitor cells in cerebral cortex development. Developmental Neuroscience. 30, 24-32 (2007).
- Kriegstein, A., Alvarez-Buylla, A. The glial nature of embryonic and adult neural stem cells. Annual Review of Neuroscience. 32, 149-184 (2009).
- Paridaen, J. T., Huttner, W. B. Neurogenesis during development of the vertebrate central nervous system. EMBO Reports. 15, 351-364 (2014).
- Taverna, E., Götz, M., Huttner, W. B. The cell biology of neurogenesis: toward an understanding of the development and evolution of the neocortex. Annual Review of Cell and Developmental Biology. 30, 465-502 (2014).
- Louvi, A., Artavanis-Tsakonas, S. Notch signaling in vertebrate neural development. Nature Reviews Neuroscience. 7, 93-102 (2006).
- Pierfelice, T., Alberi, L., Gaiano, N. Notch in the Vertebrate Nervous System: An Old Dog with New Tricks. Neuron. 69, 840-855 (2011).
- Bray, S. Notch signalling: a simple pathway becomes complex. Nature Reviews Molecular Cell Biology. 7, 678-689 (2006).
- Bray, S. Notch signalling in context. Nature Reviews Molecular Cell Biology. 17, 722-735 (2016).
- Kopan, R., Ilagan, M. X. G. The Canonical Notch Signaling Pathway: Unfolding the Activation Mechanism. Cell. 137, 216-233 (2009).
- Ishibashi, M., et al. Persistent expression of helix-loop-helix factor HES-1 prevents mammalian neural differentiation in the central nervous system. The EMBO Journal. 13, 1799-1805 (1994).
- Ohtsuka, T., et al. Hes1 and Hes5 as notch effectors in mammalian neuronal differentiation. The EMBO Journal. 18, 2196-2207 (1999).
- Ohtsuka, T., Sakamoto, M., Guillemot, F., Kageyama, R. Roles of the Basic Helix-Loop-Helix Genes Hes1 and Hes5 in Expansion of Neural Stem Cells of the Developing Brain. Journal of Biological Chemistry. 276, 30467-30474 (2001).
- Kageyama, R., Ohtsuka, T., Kobayashi, T. The Hes gene family: repressors and oscillators that orchestrate embryogenesis. Development. 134, 1243-1251 (2007).
- Shimojo, H., Ohtsuka, T., Kageyama, R. Oscillations in Notch Signaling Regulate Maintenance of Neural Progenitors. Neuron. 58, 52-64 (2008).
- Imayoshi, I., et al. Oscillatory control of factors determining multipotency and fate in mouse neural progenitors. Science. 342, 1203-1208 (2013).
- Shimojo, H., et al. Oscillatory control of Delta-like1 in cell interactions regulates dynamic gene expression and tissue morphogenesis. Genes and Development. 30, 102-116 (2016).
- Hirata, H., et al. Oscillatory expression of the bHLH factor Hes1 regulated by a negative feedback loop. Science. 298, 840-843 (2002).
- Kageyama, R., Ohtsuka, T., Shimojo, H., Imayoshi, I. Dynamic Notch signaling in neural progenitor cells and a revised view of lateral inhibition. Nature Neuroscience. 11, 1247-1251 (2008).
- Masamizu, Y., et al. Real-time imaging of the somite segmentation clock: revelation of unstable oscillators in the individual presomitic mesoderm cells. Proceedings of the National Academy of Sciences of the United States of America. 103, 1313-1318 (2006).
- Levine, J. H., Lin, Y., Elowitz, M. B. Functional roles of pulsing in genetic circuits. Science. 342, 1193-1200 (2013).
- Purvis, J. E., Lahav, G. Encoding and decoding cellular information through signaling dynamics. Cell. 152, 945-956 (2013).
- Luker, G. D., Pica, C. M., Song, J., Luker, K. E., Piwnica-Worms, D. Imaging 26S proteasome activity and inhibition in living mice. Nature Medicine. 9, 969-973 (2003).
- Yamaguchi, S., et al. Synchronization of Cellular Clocks in the Suprachiasmatic Nucleus. Science. 302, 1408-1412 (2003).
- Kiyohara, Y. B., et al. The BMAL1 C terminus regulates the circadian transcription feedback loop. Proceedings of the National Academy of Sciences of the United States of America. 103, 10074-10079 (2006).
- Behar, M., Hoffmann, A. Understanding the temporal codes of intra-cellular signals. Current Opinion in Genetics and Development. 20, 684-693 (2010).
- Elowitz, M. B., Levine, A. J., Siggia, E. D., Swain, P. S. Stochastic Gene Expression in a Single Cell. Science. 297, 1183-1186 (2002).
- Nelson, D. E., et al. Oscillations in NF-kappaB signaling control the dynamics of gene expression. Science. 306, 704-708 (2004).
- Purvis, J. E., et al. p53 dynamics control cell fate. Science. 336, 1440-1444 (2012).
- Hansen, A. S., O'Shea, E. K. Promoter decoding of transcription factor dynamics involves a trade-off between noise and control of gene expression. Molecular Systems Biology. 9, 704 (2014).
- Hansen, A. S., O'Shea, E. K. cis Determinants of Promoter Threshold and Activation Timescale. Cell Reports. 12, 1226-1233 (2015).
- Johnson, H. E., Toettcher, J. E. Signaling Dynamics Control Cell Fate in the Early Drosophila Embryo. Developmental Cell. 48, 361-370 (2019).
- Badr, C. E., Tannous, B. A. Bioluminescence imaging: Progress and applications. Trends in Biotechnology. 29, 624-633 (2011).
- Nakajima, Y., Ohmiya, Y. Bioluminescence assays: multicolor luciferase assay, secreted luciferase assay and imaging luciferase assay. Expert Opinion on Drug Discovery. 5, 835-849 (2010).
- Nakajima, Y., et al. Enhanced beetle luciferase for high-resolution bioluminescence imaging. PLoS One. 5, (2010).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Molecular Imaging. 12, (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved