Method Article
Изоляция и расширение цитотоксических цитотинов индуцированных Killer T-клеток для лечения рака
В этой статье
Резюме
Здесь мы представляем протокол для выполнения изоляции и расширения периферической крови моноядерных клеток, полученных цитокиновых CD3cd56- клетки-убийцы и иллюстрируем их цитотоксический эффект против гематологических и твердых раковых клеток с помощью системы цитометрии в пробирке диагностики.
Аннотация
Приемная клеточная иммунотерапия фокусируется на восстановлении распознавания рака через иммунную систему и улучшает эффективное убийство опухолевых клеток. Цитокин индуцированных убийца (CIK) Т-клеточная терапия, как сообщается, оказывают значительное цитотоксиче эффекты против раковых клеток и уменьшить неблагоприятные последствия хирургии, радиации и химиотерапии в лечении рака. CIK может быть получен из периферических моноядерных клеток крови (ПБМК), костного мозга и пуповинной крови. Клетки CIK представляют собой разнородную субпопуляцию Т-клеток с CD3иCD56 и природными фенотипическими характеристиками убийцы (NK), которые включают в себя основные комплексы гистосовместимости (MHC)-неограниченной противоопухолевой активности. Это исследование описывает квалифицированный, клинически применимый, поток цитометрии на основе метода для количественной цитолической способности ПБМК полученных клеток CIK против гематологических и твердых раковых клеток. В цитолическом анализе, клетки CIK совместно инкубируются в различных соотношениях с заранее целевыми опухолевыми клетками. После инкубационного периода, количество клеток-мишеней определяется нуклеиновой кислотой-связывающей пятно для обнаружения мертвых клеток. Этот метод применим как к исследованиям, так и к диагностическим приложениям. Клетки CIK обладают мощной цитотоксичностью, которая может быть изучена в качестве альтернативной стратегии для лечения рака после его доклинической оценки с помощью установки цитометра и отслеживания (CS и T) на основе цитометрии потока системы.
Введение
Цитотоксические Т-лимфоциты являются специфической популяцией клеток иммунного эффектора, которая опосредует иммунные реакции против рака. Несколько популяций эпреторных клеток, включая лимфокин-активированный убийца (LAK) клетки, опухолевые лимфоциты (TILs), естественные клетки убийцы (НК), Т-клетки, и цитокин-индуцированных убийца (CIK) клетки были разработаны для приемной Т-клеточной терапии (ACT) целей1. Существует растущий интерес к клеткам CIK, потому что они представляют собой смесь цитокинов индуцированных цитотоксических клеток населения расширена от аутологичных периферических клеток крови (PMBCs)2.
Неконтролируемый рост клеток-прародителей лимфоидов, миелобластов и лимфобластов приводит к трем основным видам рака крови (например, лейкемии, лимфомы и миеломы), твердых опухолей, включая рак , рак легких, рак желудка, рак шейки матки) и саркомы, среди других видов рака3. Клетки CIK представляют собой смесь клеточных популяций, которые демонстрируют широкий спектр основных комплекс гистосовместимости (MHC)-неограниченной противоопухолевой активности и, таким образом, держать обещание для лечения гематологических и передовых опухолей4,5,6,7. Клетки CIK состоят из комбинации ячеек, в том числе Т-клеток (CD3иCD56),НК-Т-клеток (CD3иCD56)и НК-клеток (CD3-CD56). Оптимизация протокола индукции CIK с использованием фиксированного графика для добавления IFN-З, анти-CD3 антител и IL-2, приводит к расширению ciK-клеток8. Цитотоксические возможности клеток CIK против раковых клеток в основном зависит от участия НК группы 2 член D (член C-типа лектин-подобных рецепторов семьи) NKG2D лиганды на опухолевые клетки, и на перфорин-опосредованных путей9. Результаты доклинического исследования показали, что IL-15-стимулировали клетки CIK индуцированной мощной цитотоксичности против первичной и острой миелоидной лейкемии клеточных линий в пробирке и выставлены более низкую алореактивность против нормальных ПБМК и фибробластов9. В последнее время, результат ы одноразовый здоровый донора полученных CIK (1 х 108/ кг CD3- клетки) инфузии, как консолидация после немиелоаблятивной аллогенной трансплантации для лечения миелоидных неоплазм в фазе II клинического исследования было опубликовано10.
В настоящем исследовании мы разработали оптимизированную формулу культуры клеток, состоящую из IFN-Я, IL-1, антител анти-CD3 и IL-2, добавленных в гематопоиетическую среду для увеличения производства CIK, и исследовали цитотоксический эффект клеток CIK против хронических человеческих миелоидный лейкоз (K562) клетки рака яичников (OC-3) клеток.
протокол
Клинический протокол был выполнен и утвержден в соответствии с руководящими принципами Институционального наблюдательного совета Китайского медицинского университета и Комитета по этике исследований больниц. Образцы периферийной крови были собраны у здоровых добровольцев с их информированного согласия.
1. Подготовка материалов
- Храните реагенты, антитела и химические вещества, как показано на листе данных о материальной безопасности (MSDS). Растворите препараты или цитокины в растворителях в качестве стоковых растворов, а затем аликвот для хранения при -20 градусах или -80 градусов по Цельсию.
ПРИМЕЧАНИЕ: Подробная информация для подготовкиматериала отмечена в таблице материалов .
2. Изоляция PBMC
- Разогрейте градиентный раствор плотности(Таблица материалов) до 18-20 градусов по Цельсию перед использованием. Несколько раз переворачивайте бутылку раствора, чтобы обеспечить тщательное смешивание.
- Соберите 3'5 мл образца венозной крови человека в гепаринилном флаконе и хорошо перемешайте, несколько раз аккуратно инвертируя трубку.
- Приготовьте 4 мл градиентного раствора плотности в стерильной трубке 15 мл.
- Тщательно прокладывайте 1 мл образца крови на градиентный раствор плотности.
- Центрифуга при 400 х г в течение 30 мин при 18–20 градусах по Цельсию (выключите перерыв).
- Тщательно и сразу же аспирировать буйный слой пальто моноядерных клеток (около 1 мл) сразу, чтобы избежать нарушения слоев стерильной трубки 15 мл с помощью 1 мл стерильной пипетки.
- Добавьте не менее 3 томов (3 мл) фосфатно-буферного сосудистого раствора (PBS) в буйный слой в центрифуге трубки. Приостановить клетки, аккуратно pipetting их вверх и вниз, по крайней мере 3x со стерильной пипеткой.
- Центрифуга при 400 х г в течение 10 мин при 18-20 градусах По Цельсию. Аспирируй супернатанта.
- Приостановить клетку гранулы с 5 мл базальной среды (Таблица материалов) и передать в колбу. Культура клеток в инкубаторе клеточной культуры при 37 градусах По цельсии и 5% CO2.
3. Индукция и расширение CIK
- На день 0, культура PBMCs (1 х 106) в свежей базальной среде, содержащей 1000 МЕ /мл IFN-я для 24 ч в увлажненных инкубатор культуры клеток на 37 C и 5% CO2.
- На 1-й день освежите среду со свежей базальной средой, содержащей 50 нг/мл анти-CD3 антител, 1 нг/мл rh IL-1 и 1000 U/mL rh IL-2. Освежать среду каждые 3 дня.
- На 7-й день освежите среду со свежей базальной средой, содержащей 1000 U/mL rh IL-2. Освежать среду каждые 3 дня до конца расширения клеток (День 14).
4. Иммунофенотипирование для оценки клеток CIK
- Вымойте клетки CIK с 10 мл стерильных PBS. Центрифуга в течение 10 мин при 300 х г и 18-20 градусов по Цельсию, аспирируй супернатант и resuspend клетки с 10 мл PBS. Подсчитайте номер ячейки и жизнеспособность ячейки теста, используя анализ исключения trypan blue.
- Aliquot клетки CIK в шесть стерильных труб 1,5 мл при плотности 5-10 х 105 клеток / мл PBS. Этикетка и лечить следующим образом: Труба 1, Пустой (без антитела); Трубка 2, добавьте 20 зл изотипа IgG1-FITC; Трубка 3, добавить 20 зл изотипов IgG1-APC mAbs; Трубка 4, добавить 20 зл CD3-FITC; Трубка 5, добавить 20 зл и d56-APC mAbs; и трубка 6, добавить 20 зл CD3-FITC и 20 Зл CD56-APC mAbs.
- Аккуратно перемешайте клетки CIK с антителами, аккуратно пайпетируя их вверх и вниз, по крайней мере 3x с 1 мл стерильной пипетки, а затем инкубировать в течение 30 минут при комнатной температуре в темноте.
- Центрифуга трубки в течение 10 мин при 300 х г и 18-20 градусов по Цельсию. Аспирируйте супернатант и приостанавливаете клетку гранулы один раз с 1 мл PBS. Аккуратно пайпет их вверх и вниз, по крайней мере 3x с 1 мл стерильной пипетки.
- Повторите шаг 4.4.
- Оставьте трубки в темноте перед циклометрическим анализом потока.
5. Распознавание маркеров CD
- Перенесите суспензию клетки в стерильную 5 мл полистирола круглой нижней трубки с крышкой ситечко (100 мкм сетки) путем мягкого трубачерез через крышку. Поставьте трубки на карусель в порядок.
- Откройте программное обеспечение для анализа цитометрии потока и создайте экспериментальную папку. Нажмите кнопку New Specimen, чтобы добавить образец и трубку к эксперименту и назвать трубы следующим образом: Tube 1, Blank; Трубка 2, Изотип IgG1-CD3; Трубка 3, Изотип IgG1-CD56; Трубка 4, CD3; Трубка 5, CD56; Трубка 6, CD3CD56.
- Создайте систему рассеяния gating для популяций клеток CIK(Рисунок 2A).
- Выберите трубку 1 (Blank) и нажмите на кнопку Dot Plot, чтобы создать участок FSC-A/SSC-A. Нарисуйте прямоугольник ворота над всей популяции клеток с FSC-A порога йgt;5 х 104, чтобы исключить мусор ауда.
- Выберите параметр SSC-A/SSC-H для нового точечного участка и нарисуйте многоугольные ворота вокруг всех одиночных ячеек. Выберите параметр Count/FITC (CD3) и Count/APC (CD56) для нового сюжета гистограммы соответственно. Выберите параметр FITC (CD3)/APC (CD56) для нового точечного участка и нарисуйте четыре квадранта для определения четырех субпопуляций.
- Запишите данные из 20 000 одиночных ячеек в каждом образце. Нажмите кнопку Load Sample, чтобы сначала проанализировать образец элемента управления Blank. Определите всю популяцию клеток CIK с помощью параметров канала CD56 и CD3.
- Повторите шаг 5.3 для исследования всех образцов.
- Откройте файлы, содержащие статистические значения отдельного образца, для анализа популяций клеток CIK и перепечатки их в файлы анализа.
6. Культирование и окрашивание хронических миелоидных клеток K562 и клеток рака яичников OC-3
- Клетки K562
- Культура K562 клеток в полных носителях (RPMI базальной среде, содержащей 10% плода крупного рогатого скота сыворотки (FBS) и 50 U/mL антибиотики и настроить глюкозу до 4,5 г/л) при плотности 0,5 х 1 х 106 клеток / мл в колбу клеточной культуры и инкубировать в увлажненный инкубатор при 37 "C и 5% CO2.
- Перенесите культурные носители, содержащие клетки K562, в стерильные трубки 50 мл и гранулируйте клетки при 300 х г в течение 10 минут при 18–20 градусах По Цельсию в день эксперимента.
- Аспирируйте супернатант, resuspend клетки в 5 мл стерильных PBS, и хорошо перемешать осторожно.
- Пеллет клетки на 300 х г в течение 10 мин. Аспирировать супернатант, resuspend клетки в PBS, и настроить K562 клеток до концентрации 0,5-1 х 106 клеток / мл.
- Добавьте 0,5 л красителя CFSE к 1 мл суспензии клеток K562 в стерильной трубке 15 мл при конечной концентрации 5 мкм. Аккуратно перемешать подвеску, пипетка вверх и вниз, по крайней мере 3x.
- Оставьте трубку в инкубаторе клеточной культуры при 37 градусах Цельсия и 5% CO2 в течение 10-15 мин.
- Добавьте 9 мл PBS в трубку и гранулы клетки на 300 х г в течение 10 мин. Декант супернатант, а затем приостановить клеточной гранулы в 10 мл полных носителей. Перенесите суспензию клетки в колбу клеточной культуры и поместите в инкубатор.
- Oc-3 клетки
- Культура OC-3 клеток в полных носителях (DMEM/ F12 среды, содержащей 10% FBS и 50 U/mL антибиотики) при плотности 0,5-1 х 106 клеток в колбе клеточной культуры на 37 C и 5% CO2.
- Аспирируйте культурные носители и мойте клетки PBS за 1 день до начала эксперимента.
- Отсоедините клетки, добавив 1 мл клеточного ферментного раствора(Таблица материалов)и инкубировать в течение 5 мин при 37 градусах Цельсия.
- Приостановить клетки, добавив 5 мл PBS и хорошо перемешать осторожно. Пелле клетки на 300 х г в течение 10 минут и аспирации супернатант. Приостановите работу клеток в PBS и настроить клетки до концентрации 0,5-1 х 106 клеток / мл.
- Добавьте 0,5 л красителя CFSE к 1 мл клеточной подвески OC-3 в стерильной трубке 15 мл при конечной концентрации 5 мкм. Аккуратно перемешать подвеску, пипетка вверх и вниз, по крайней мере 3x.
- Оставьте трубку в инкубаторе клеточной культуры при 37 градусах Цельсия и 5% CO2 в течение 10-15 мин.
- Добавьте 9 мл PBS в трубку и гранулы клетки на 300 х г в течение 10 мин. Декант супернатант, а затем приостановить клеточной гранулы с полным испытуемым. Семена 5 х 105 клеток / хорошо в 6 хорошо пластины и инкубировать в увлажненный инкубатор при 37 градусов по Цельсию и 5% CO2 ночь.
7. Цитотоксический ассссе
- Кокультура клеток CIK и K562 (CIK-K562)
- Подсчитайте клетки K562 со ступени 6.1.7 и проверьте жизнеспособность клетки, происните синий анализ исключения. Добавьте 1 мл клеток K562 к каждой скважине в6 скважине при плотности 5 х 10 5/мл.
- Добавить 1 мл базальной среды с или без клеток CIK от шага 3,4 до 6 хорошо пластины от шага 7.1.1 следующим образом: Ну 1 - Пустой, K562 клетки в одиночку (5 х 105); Ну 2 - CFSE окрашенных K562 клетки в одиночку (5 х 105); Ну 3 - клетки CIK (E (эффектор), 25 x 105) - окрашенные CFSE клетки K562 (T «цель», 5 x 105); Ну 4 - клетки CIK (E, 50 x 105)
- Смешайте клеточные суспензии, аккуратно пайпетируя их вверх и вниз, по крайней мере 3x. Поместите тарелку в инкубатор на 24 ч.
- Кокультура клеток CIK и OC-3 (CIK-OC-3)
- Добавить 1 мл базальной среды с или без клеток CIK от шага 3,4 до 6 хорошо пластины от шага 6.2.7 следующим образом: Ну 1 - Пустой, OC-3 клетки в одиночку (5 х 105); Ну 2 - CFSE окрашенных OC-3 клетки в одиночку (5 х 105); Ну 3 - клетки CIK (E, 25 x 105)- CFSE-окрашенные OC-3 клетки (T, 5 x 105); Ну 4 - клетки CIK (E, 50 x 105)- CFSE-окрашенные OC-3 клетки (T, 5 x 105).
- Смешайте клеточные суспензии, аккуратно пайпетируя их вверх и вниз, по крайней мере 3x. Положите тарелку в инкубатор на 24 ч.
- 7-Аминоактиномицин D (7-AAD) окрашивание красителя
- Урожай CIK-K562 подвески ячейки от шага 7.1.3 непосредственно в 15 мл стерильной трубки.
- Урожай как подвески и адептов клетки из группы CIK-OC-3 от шага 7.2.2.
- Перенесите суспензию клетки в стерильную трубку 15 мл. Вымойте колодец с 1 мл стерильных PBS, собирать PBS, и добавить в трубку. Добавьте 0,5 мл раствора фермента диссоциации клеток и инкубируют в течение 5 мин при 37 градусах Цельсия.
- Добавьте 1 мл раствора из той же трубки в соответствующую скважину и аккуратно перемешайте клетки, пополнив их вверх и вниз по крайней мере 3x с 1 мл стерильной пипетки. Соберите все клетки в одной трубке.
- Центрифуга при 300 х г в течение 10 мин, аспирируй супернатант и resuspend клетки в 1 мл стерильных PBS. Пеллет клетки на 300 х г в течение 10 минут, аспирации супернатант, и resuspend клеток в 100 л стерильных PBS.
- Добавьте в клеточный суспензию 5 кЛ 7-AAD красителя (50 нг/Л. Аккуратно перемешать клетки, пипетка их вверх и вниз, по крайней мере 3x с 1 мл стерильной пипетки. Инкубировать в течение 10 минут и оставить в темноте перед анализом.
- Цитолитический ассикул
- Смешайте суспензию ячейки со ступени 7.3.4 и повторите шаги 5.1 и 5.2 один раз.
- Нажмите кнопку New Specimen, чтобы добавить образец и трубку к эксперименту и назвать трубки следующим образом: Трубка 1, K562 (или OC-3) клетки только; Трубка 2, CFSE окрашенных K562 (или OC-3) клетки только; Трубка 3, E:T - 5:1; Трубка 4, E:T и 10:1.
- Создайте систему рассеяния Gating для цитолитического асссе(Рисунок 3A).
- Выберите трубку 1 и нажмите на кнопку Dot Plot, чтобы создать участок FSC-A/SSC-A. Нарисуйте прямоугольник ворота над всеми событиями с FSC-A порога йgt;5 х 104, чтобы исключить мусор аулаизм клетки.
- Выберите параметр SSC-A/CFSE для нового точечного участка. Выберите параметр 7-AAD/CFSE для нового точечного участка и нарисуйте ворота из четырех квадрантов, чтобы определить четыре субпопуляции.
- Нажмите кнопку Load Sample, чтобы сначала проанализировать пустой образец управления.
- Отрегулируйте напряжение SSC-A и FSC-A. Определите популяцию мертвых клеток с помощью параметров канала CFSE и 7AD. Запись данных изклеток CFSE в каждом образце.
- Повторите раздел 7.4.6 для исследования всех образцов.
- Откройте файлы, содержащие статистические значения каждого отдельного образца, для анализа нежизнеспособных популяций ячеек и экспорта данных в файлы анализа.
Результаты
Цель юристого протокола состоит в том, чтобы изолировать и расширить цитокин-индуцированных киллеров (CIK) Т-клеток из периферических моноцитов крови и оценить цитотоксический эффект CIK против гематологической злокачественности и твердых раковых клеток, соответственно. Индукция CIK была определена признанием CD3/CD56. На рисунке 1А показан протокол индукции и расширения CIK. Репрезентативные результаты стратегии gating для анализа субпопуляции CD3иCD56и Т-клеток от здоровых доноров иллюстрируются на рисунке 1B. На рисунке 1C показан статистический анализ доли CIK от трех особей.
Рисунок 2А показывает, что доляклеток CD3иCD56 (0,65% для оригинального PBMC, левой нижней панели и 27,4% для клеток CIK, собранных в день14-й,правая нижняя панель) значительно увеличилась после 14 дней расширения. В нашей культурной системе, клетки CIK дали около половины сторазных изменений по сравнению с первоначальным числом PBMCs(Рисунок 2B).
На рисунке 3 показано цитотоксическое действие CIK против клеток хронического миелоидного лейкоза человека K562 и клеток рака яичников человека OC-3. Клетки K562 или OC-3 (цель, T) были окрашены нелюфлуоресцентным красителем (CFSE), который был расщеплён внутриклеточными эстеразами в жизнеспособных клетках, а затем стал высокофлуоресцентным красителем. В цитотоксическом исследовании кокультуры, CFSE окрашенных K562 или OC-3 клетки были cotreated с клетками CIK в течение 24 ч. В конце инкубации, общая клетка были собраны и окрашены 7-AAD краситель, который является нуклеиновой кислоты связывающей краситель, который используется в качестве зонда жизнеспособности для исключения мертвых клеток. Размер и детализацияклеток CIK и CFSE иллюстрируются на рисунке 3A. Окрашенные CFSE клетки K562 (целевые клетки, T) были совместно обработаны клетками CIK (эффекторные клетки, E) в соотношении E/T 0:1, 5:1 и 10:1, соответственно. Были оценены 7-AAD- клетки CFSEи K562. Статистические результаты были получены в результате трех независимых экспериментов. Базальная лиза означает процент клеточной смерти при отсутствии ээффекторных клеток (E:T и 0:1). На рисунке 3B показана очевидная цитотоксичность CIK против клеток OC-3 (E:T и 10:1) после 24 ч инкубации.
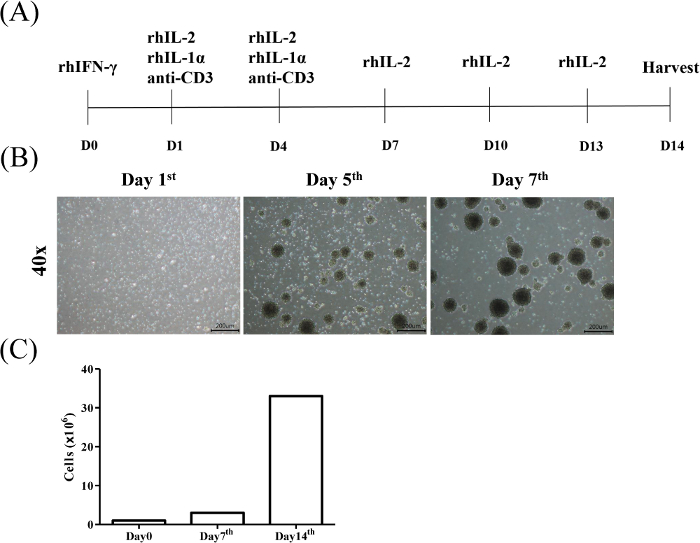
Рисунок 1: Диаграмма потока цитокинов индукции клеток-убийц и расширения. (A) PBMCs от согласия здоровых доноров были первоначально подвержены rhIFN-я (День 0), а затем rhIL-2, rhIL-1 ", и анти-CD3 mAb (День 1) каждые 3 дня (День 4). Впоследствии, среда была обновлена с rhIL-2-содержащих среды каждые 3 дня, и клетки были собраны на день 14. (B) Морфология клеток CIK в течение 7 дней индукции. Активация и расширение клеток CIK были проведены, как описано в протоколе. Клетки наблюдались под световым микроскопом в дни 1, 5 и 7, соответственно (увеличение 40x, шкала бар 200 мкм). (C)Количество клеток выполнялось еженедельно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
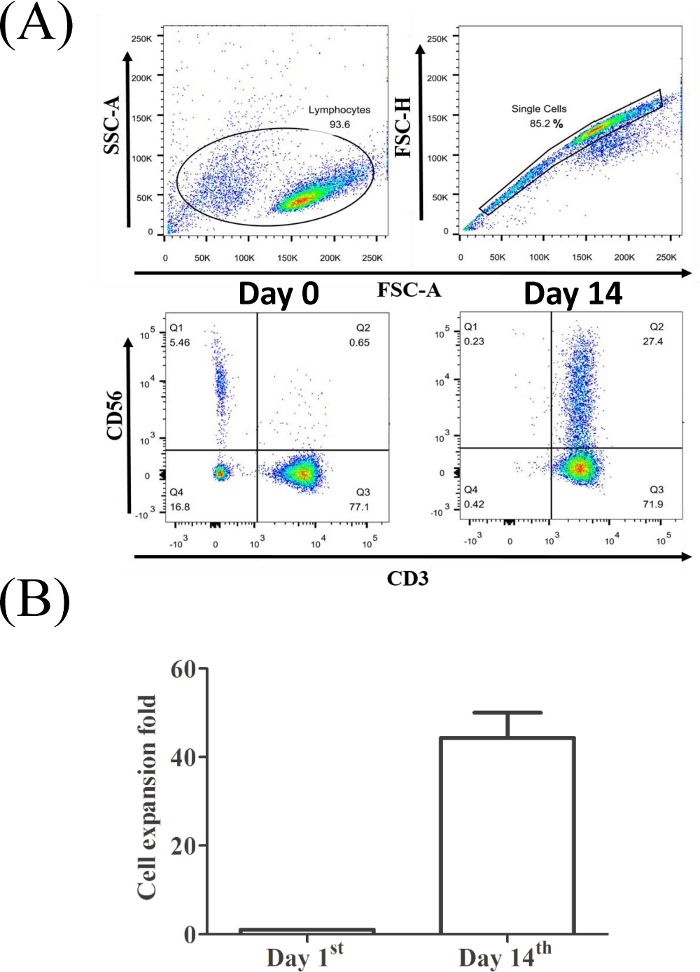
Рисунок 2: Доля CD3иCD56и Т-клеток из репрезентативной выборки PBMC. (A) Лимфоциты были признаны по определенному размеру и детализации. Выбранная популяция одной ячейки для анализа цитометрией потока. (B) Статистический анализ эффективности расширения CIK от трех здоровых доноров был проведен с использованием t-теста (яп. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Цитотоксические эффекты клеток CIK против хронического миелоидного лейкоза человека K562 и рака яичников человека OC-3 клеток. (A) После coculture с клетками CIK для 24 h, клетки цели K562 были узнаны и закрыты на основе окрашивания красителя CFSE. Квадрант иллюстрация общей популяции клеток под выбранным параметром 7-AAD/CFSE и кумулятивной цитотоксичности клеток CIK в указанном соотношении E:T. (B) Цитотоксический эффект клеток CIK против клеток OC-3 в соотношении E:T и 10:1. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Описанный метод представляет собой быстрый, удобный и надежный протокол для изоляции и расширения цитотоксических цитокинов- индуцированных киллером (CIK) Т-клеток из цельных образцов крови здоровых доноров. Он также показывает цитотоксический эффект CIK против лейкемии (K562) и раковых клеток яичников (OC-3) с помощью системы цитометрии потока и отслеживания (CS и T) системы. Клетки CIK могут быть индуцированы и расширены в хороших мануфактурных практиках (GMP) условиях с помощью Цитокинов класса GMP и среды без сыворотки для дальнейшего клинического вливания11. Тем не менее, эффективность ИНДукции и расширения CIK демонстрирует индивидуальные различия12,13,14. Кроме того, безопасность является преимуществом вливания пациентов полученных клеток CIK для терапии раковых клеток. Было сообщено, что клетки CIK оказывают цитолитическое воздействие на эпителиальные твердые раковые клетки в основном в NKG2D-зависимым образом. В гематологических раковых клетках блокирование NKG2D с помощью специфического антитела значительно подавляет цитотоксичность, вызванную CIK, против клеток NKG2D-low K562; однако, это лечение не имеет никакого влияния на клетки HL-60, не имеющие NKG2D15. Кроме того, клетки CIK проявляют меньшую активность в отношении клеток K562 по сравнению с клетками CD8и CIK16. В этом исследовании, мы обнаружили, что CIK выставлены больший цитотоксический потенциал против рака яичников OC-3 клеток по сравнению с лейкемией K562 клеток. Эти данные свидетельствуют о том, что точные молекулярные механизмы, с помощью которых эффекторы CIK убивают опухолевые клетки, пока не ясны.
Отслеживание жизнеспособности целевых клеток и оценка цитотоксического потенциала клеток-эффектора с использованием цитометрии потока стала стандартным и обычным методом для клинического обследования17. Было высказано предположение, что негативное влияние наблюдается на жизнеспособность клеток и выражение маркеров активации, таких как CD3и населения в CFSE окрашенных лимфоцитов с потоком цитометрии18,19. Таким образом, окрашивание целевых раковых клеток является более эффективной стратегией для оценки цитотоксического воздействия первичных клеток CIK. ИФН-З, ОКТ3 и Ил-2 являются основными цитокинов или стимуляторами для дифференциации и пролиферации CIK. Кроме того, другие факторы, такие как тимоголобулин, ИЛ-1, Ил-10, Ил-15, также являются стимуляторами. В настоящее время сыворотка человека, богатая тромбоцитами плазма и даже сыворотка крупного рогатого скота плода используются в качестве средних добавок, которые могут повысить пролиферацию клеток CIK. Хотя сыворотка или плазма обогащены питательными веществами и факторами роста, добавление аллогенных продуктов животного происхождения представляет источник, партии и много вариаций, которые приводят к экспериментальной изменчивости, и неизбежно смятение исследований с терапевтическими исходами для культивированных клеток. В этом исследовании мы использовали коммерчески доступные без сыворотки, без альбумина, и ксено-бесплатные GMP-класса средств массовой информации дополняется клинического класса цитокинов для успешной культуры клеток CIK. Недостатком использования ксено-свободных или аллогено-свободных добавок является то, что они снижают эффективность пролиферации клеток.
Двухцветные методы отслеживания клеток, предусмотренные в протоколах, независимо вычисляют жизнеспособные или мертвые клетки-цели-эффектора в прямом анализе цитотоксичности. В наших стратегиях gating, клетки cfSEи целевые можно очевидно различить от клеток эффектора CIK(рисунок 3). Самое главное, процесс индукции и расширения CIK должен быть квалифицированным и показать высокую жизнеспособность. Для дальнейших вливания нескольких доз, состояние криоконсервации, и жизнеспособность и цитотоксичность после оттаивания, являются другими критическими проблемами. Фактическое соотношение конкретного лисиса равняется пропорции 100 x (%Образец лиза - %Базальный лиза)/(100 - % базальный лиза). В отличие от других исследований18,20, рекомендуется, чтобы все целевые клетки быть исследованы, чтобы выявить точную и фактическую цитотоксичность клеток CIK.
В заключение, протокол, описанный в этом исследовании, предназначен для увеличения числа пБМК полученных клеток CIK от здоровых доноров и для оценки их цитотоксических функций против раковых клеток с двухцветными фотоактивируемыми зондами для селективного отслеживания клетки-мишени с помощью цитометрии потока с системой диагностики in vitro (IVD).
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих конфликтов финансовых интересов.
Благодарности
Это исследование было поддержано больницей Китайского медицинского университета (DMR-Cell-1809).
Материалы
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
Ссылки
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены