Method Article
癌治療のための細胞傷害性サイトカイン誘発キラーT細胞の分離と拡張
要約
ここでは、末梢血単核細胞由来のサイトカイン誘導CD3+CD56+キラー細胞の単離・増殖を行うプロトコルを提示し、インビトロ診断フローサイトメトリーシステムを用いて血液学的および固形癌細胞に対する細胞毒性効果を示す。
要約
養子細胞免疫療法は、免疫系を介して癌の認識を回復することに焦点を当て、効果的な腫瘍細胞死滅を改善する。サイトカイン誘発キラー(CIK)T細胞療法は、癌細胞に対して顕著な細胞毒性作用を及ぼし、癌治療における手術、放射線および化学療法の悪影響を軽減することが報告されている。CIKは末梢血単核細胞(PBMC)、骨髄、臍帯血から誘導することができる。CIK細胞は、CD3+ CD56+および自然殺し (NK) 主要な組織適合性複合体 (MHC) 制限のない抗腫瘍活性を含む発現特性を有するT細胞の不均質な亜集団である。本研究は、PBMC由来CIK細胞の細胞分解能力を血球学的および固形癌細胞に対する定量化のための修飾された、臨床的に適用可能なフローサイトメトリーベースの方法について説明する。細胞分解アッセイでは、CIK細胞は、前染色された標的腫瘍細胞との異なる比率で共培養される。インキュベーション期間後、標的細胞数は、死細胞を検出する核酸結合染色によって決定される。この方法は、研究アプリケーションと診断アプリケーションの両方に適用できます。CIK細胞は、細胞計のセットアップとトラッキング(CS&T)ベースのフローサイトメトリーシステムによる前臨床評価で、がん治療の代替戦略として探求できる強力な細胞毒性を有しています。
概要
細胞傷害性Tリンパ球は、癌に対する免疫応答を媒介する特異的な免疫エフェクター細胞集団である。いくつかのエフェクター細胞群は、リンパ球活性化キラー(LAK)細胞、腫瘍浸潤リンパ球(TILs)、ナチュラルキラー(NK)細胞、γδT細胞、およびサイトカイン誘発キラー(CIK)細胞を含む、養子T細胞療法(ACT)の目的のために開発された。CIK細胞に対する関心が高まっているのは、サイトカイン誘発細胞傷害性細胞集団の混合物を表すため、自己性末梢血単核細胞(PMBC)2から拡大される。
リンパ系前駆細胞、骨髄芽細胞、リンパ芽細胞の制御不能な増殖は、3種類の血液癌(白血病、リンパ腫、骨髄腫)、癌腫を含む固形腫瘍(例えば、肺癌、胃癌、子宮頸癌)、および肉腫の3つの主要なタイプにつながる。CIK細胞は、広範囲の主要組織適合性複合体(MHC)-無制限の抗腫瘍活性を示す細胞集団の混合物であり、したがって、造馬学および進行性腫瘍4、5、6、7の治療のための約束を保持する。CIK細胞は、T細胞(CD3+CD56-)、NK-T細胞(CD3+CD56+)、およびNK細胞(CD3–CD56+)を含む細胞の組み合わせを含む。IFN-γ、抗CD3抗体、およびIL-2の添加のための固定スケジュールを用いてCIK誘導プロトコルの最適化は、CIK細胞8の拡張をもたらす。癌細胞に対するCIK細胞の細胞傷害性は、主にNK群2のメンバーD(C型レクチン様受容体ファミリーのメンバー)の腫瘍細胞上のNKG2Dリガンドの関与に依存し、そしてパーフォリン媒介経路9に依存する。前臨床試験の結果、IL-15刺激CIK細胞がインビトロで一次および急性骨髄性白血病細胞株に対して強力な細胞毒性を誘導し、正常PBMCおよび線維芽細胞9に対して低い刺激性を示したことが明らかになった。最近、第II相臨床試験における骨髄性新生物治療のための非骨髄異系移植に続く統合として、1回限りの健康ドナー由来CIK(1x 108/kgCD3+細胞)の注入の結果が発表された。
本研究では、CIK産生を増加させる造血細胞培地にIFN-γ、IL-1α、抗CD3抗体、IL-2を添加した最適化細胞培養式を開発し、ヒト慢性に対するCIK細胞の細胞傷害作用を調べた。骨髄性白血病(K562)細胞および卵巣癌(OC-3)細胞。
プロトコル
臨床プロトコルは、中国医科大学および病院研究倫理委員会の機関審査委員会のガイドラインに従って実施され、承認されました。末梢血標本は、彼らのインフォームド・コンセントを持って健康なボランティアから採取された。
1. 材料の調製
- 物質安全データシート(MSDS)に示すように、試薬、抗体、および化学物質を保存する。ストック溶液として薬剤またはサイトカインを溶媒に溶解し、-20°Cまたは-80°Cで保存するためにアリコートを使用します。
注: 材料準備の詳細については、資料表に記載されています。
2. PBMCの分離
- 使用前に密度勾配溶液(材料表)を18~20°Cに温めます。溶液ボトルを数回反転させ、完全な混合を確実にします。
- ヘパリンバイアルで3-5 mLのヒト静脈血球試料を集め、チューブを数回穏やかに反転させることでよく混ぜます。
- 15 mLの滅菌チューブに4mLの密度勾配溶液を調製します。
- 血液サンプルの1mLを密度勾配溶液に慎重に重層する。
- 18-20 °Cで30分間400 x gで遠心分離します(休憩をオフにします)。
- 1mLの無菌ピペットを用いて、単核細胞(約1mL)のバフィーコート層を注意深く、すぐに吸引し、1mLの無菌ピペットを用いて無菌15mLチューブに層を乱さないようにする。
- 遠心管のバフィーコートに少なくとも3巻のリン酸緩衝生理食塩水(PBS)を加える。滅菌ピペットで少なくとも3倍上下に穏やかにピペットを入れて細胞を吊り下げます。
- 18-20 °Cで10分間400 x gで遠心分離。上清を吸引する。
- 5 mLの基底培地(材料表)で細胞ペレットを懸濁し、フラスコに移します。細胞を培養した細胞培養インキュベーターで37°Cおよび5%CO2で培養する。
3. CIKの誘導と拡張
- 日目に、PBMC(1 x106)を、37°Cおよび5%CO2で加湿した細胞培養インキュベーターで24時間IFN-γの1,000 IU/mLを含む新鮮な基礎培地で培養する。
- 1日目に、抗CD3抗体50ng/mL、rh IL-1αの1ng/mL、およびrh IL-2の1,000 U/mLを含む新鮮な基底培地で培地をリフレッシュします。3 日ごとにメディアを更新します。
- 7日目に、rh IL-2の1,000 U/mLを含む新鮮な基底媒体で培地をリフレッシュします。セルの拡張が終了するまで、3 日ごとにメディアを更新します (14 日目)。
4. CIK細胞の評価のための免疫フェノタイピング
- 10 mLの無菌PBSでCIK細胞を洗浄します。300×gおよび18-20°Cで10分間遠心分離し、上清を吸引し、10 mLのPBSで細胞を再懸濁した。トリパンブルー除外アッセイを用いて、細胞番号と試験細胞の生存率をカウントします。
- CIK細胞を6つの無菌1.5 mLチューブに~5~10~10 x 105セル/mL PBSの密度でアリコートします。ラベルと治療は次のとおりです: チューブ1、ブランク(抗体なし);チューブ 2、アイソタイプ IgG1-FITC の 20 μL を追加します。チューブ 3、アイソタイプ IgG1-APC mAbs の 20 μL を追加します。チューブ 4、CD3-FITC の 20 μL を追加します。チューブ 5、CD56-APC mAbs の 20 μL を追加します。チューブ6、CD3-FITCの20 μLとCD56-APC mAbsの20 μLを追加します。
- CIK細胞と抗体を軽く混合し、少なくとも3倍の上と下に1mLの滅菌ピペットを軽くピペットで入れ、暗闇の中で室温で30分間インキュベートします。
- 300 x gおよび 18-20 °C で 10 分間チューブを遠心分離します。上清を吸引し、1 mLのPBSで細胞ペレットを1回懸濁させる。1 mL滅菌ピペットで少なくとも3倍上下に軽くピップします。
- 手順 4.4 を繰り返します。
- フローサイトメトリの解析前に、暗い部分にチューブを残します。
5. CDマーカー認識
- セル懸濁液を、キャップを通して穏やかにピペットでセルストレーナーキャップ(100 μmメッシュ)で滅菌5 mLポリスチレン丸底管に移します。カルーセルにチューブを順番に置きます。
- フローサイトメトリー解析ソフトウェアを開き、実験用フォルダを作成します。[新しい標本]ボタンをクリックして、試験体とチューブを実験に追加し、チューブに「チューブ 1、ブランク」と名前を付けます。チューブ 2、 アイソタイプ IgG1-CD3;チューブ 3、 アイソタイプ IgG1-CD56;チューブ4、CD3;チューブ5、CD56;チューブ6、CD3CD56。
- CIK 細胞集団の散布体系を作成します (図 2A)。
- チューブ 1 (空白) を選択し、[ドット プロット] ボタンをクリックして FSC-A/SSC-A プロットを作成します。FSC-A しきい値が > 5 x 104のセル全体に長方形ゲートを描画して、セルの破片を除外します。
- 新しいドット プロットのSSC-A/SSC-Hパラメータを選択し、すべての単一セルの周囲にポリゴン ゲートを描画します。新しいヒストグラム プロットのカウント/FITC (CD3)およびカウント/APC (CD56)パラメータをそれぞれ選択します。新しいドット プロットのFITC (CD3)/APC (CD56)パラメータを選択し、4 つの象限ゲートを描画して 4 つのサブ母集団を定義します。
- 各標本の20,000個の単一細胞からのデータを記録します。[サンプルの読み込み] ボタンをクリックして、最初に [空のコントロール] サンプルを分析します。CD56 および CD3 チャネル パラメータを使用して、CIK セル全体を識別します。
- すべての検体の調査のためにステップ5.3を繰り返します。
- 個々の標本の統計値を含むファイルを開いて、CIK細胞集団を分析し、それらを分析ファイルに再印刷します。
6. ヒト慢性骨髄性白血病K562細胞および卵巣癌OC-3細胞の培養および染色
- K562細胞
- 完全培地中のK562細胞(10%胎児ウシ血清[FBS]と50 U/mL抗生物質を含むRPMI基底培地および50U/mL抗生物質を含み、グルコースを4.5g/Lに調整する)を細胞培養フラスコで0.5〜1 x 106細胞/mLの密度で培養し、37°Cおよび5%の加湿インキュベーターでインキュベートする。
- K562細胞を含む培養培地を50 mL滅菌チューブに移し、実験当日18-20°Cで10分間300xgで細胞をペレットします。
- 上清を吸引し、5 mLの無菌PBSに細胞を再懸濁し、優しく混ぜ合わせます。
- 細胞を300xgで10分間ペレットにし、上清を吸引し、PBSで細胞を再懸濁し、K562細胞を濃度0.5-1 x 106細胞/mLに調整した。
- CfSE色素の0.5 μLを、最終濃度5μMの15mLの滅菌管にK562細胞懸濁液1mLを加えます。少なくとも3倍上下にピペットでサスペンションを軽く混ぜます。
- チューブを細胞培養インキュベーターの37°Cと5%のCO2(10~15分)に放置します。
- チューブに9 mLのPBSを加え、細胞を300 x gで10分間ペレットにし、上清をデカントし、10 mLの完全な培地で細胞ペレットを懸濁させます。細胞懸濁液を細胞培養フラスコに移し、インキュベーター内に置く。
- OC-3細胞
- 完全培地(10%FBSおよび50 U/mL抗生物質を含むDMEM/F12培地)でOC-3細胞を培養し、37°Cおよび5%CO2の細胞培養フラスコ内の0.5〜1 x 106細胞の密度で。
- 培養培地を吸引し、実験の1日前にPBSで細胞を洗浄した。
- 細胞解離酵素溶液(材料表)を1mL添加して細胞を切り離し、37°Cで5分間インキュベートする。
- 5 mLのPBSを加えて細胞を懸濁させ、優しく混ぜ合わせます。細胞を300 x gで10分間ペレットし、上清を吸引する。PBSで細胞を再懸濁し、細胞を0.5~1 x 106細胞/mLの濃度に調整します。
- CFSE色素0.5μLを、最終濃度5μMの15mLの滅菌管にOC-3細胞懸濁液の1mLに添加します。少なくとも3倍上下にピペットでサスペンションを軽く混ぜます。
- チューブを細胞培養インキュベーターの37°Cと5%のCO2(10~15分)に放置します。
- チューブに9 mLのPBSを加え、細胞を300 x gで10分間ペレットにし、上清をデカントし、完全な培地で細胞ペレットを懸濁させます。種5 x 105細胞/ウェルを6ウェルプレートに入れ、37°Cおよび5%CO2で一晩加湿インキュベーターでインキュベートした。
7. 細胞傷害性アッセイ
- CIK細胞とK562細胞のコカルチャー(CIK-K562)
- ステップ6.1.7からK562細胞を数え、トリパンブルー排除アッセイによって細胞の生存率を試験する。5 x 105/mLの密度で6ウェルプレートに各ウェルにK562細胞の1 mLを加えます。
- ステップ3.4から6ウェルプレートまでのCIK細胞の有無に関わらず1mLをステップ7.1.1から次のように加える:ウェル1=ブランク、K562細胞単独(5 x105);ウェル 2 = CFSE 染色 K562 細胞単独 (5 x 105);ウェル 3 = CIK 細胞 (E [エフェクター], 25 x 105)+ CFSE 染色 K562 セル (T [ターゲット], 5 x 105);ウェル 4 = CIK 細胞 (E, 50 x 105)+ CFSE 染色 K562 セル (T, 5 x 105)。
- 細胞懸濁液を少なくとも3倍上下に軽くピペットで混ぜます。プレートをインキュベーターに24時間入れる。
- CIK細胞とOC-3細胞のコカルチャー(CIK-OC-3)
- ステップ3.4から6ウェルプレートまでのCIK細胞の有無に関わらず1mLを加えるステップ6.2.7から:ウェル1=ブランク、OC-3細胞単独(5 x105);ウェル 2 = CFSE 染色 OC-3 細胞単独 (5 x 105);ウェル 3 = CIK 細胞 (E, 25 x 105)+ CFSE 染色 OC-3 細胞 (T, 5 x 105);ウェル 4 = CIK 細胞 (E, 50 x 105)+ CFSE 染色 OC-3 細胞 (T, 5 x 105)。
- 細胞懸濁液を少なくとも3倍上下に軽くピペットで混ぜます。プレートをインキュベーターに24時間入れます。
- 7-アミノアクチノマイシンD(7-AAD)染色
- ステップ 7.1.3 から CIK-K562 セル懸濁液を 15 mL の滅菌チューブに直接収穫します。
- ステップ 7.2.2 から CIK-OC-3 グループから懸濁液と接着細胞の両方を収穫します。
- 細胞懸濁液を15mLの無菌チューブに移します。1 mLの無菌PBSでウェルを洗浄し、PBSを回収し、チューブに加えます。0.5 mLの細胞解離酵素溶液を加え、37°Cで5分間インキュベートします。
- 同じチューブから1 mLの溶液を対応するウェルに加え、少なくとも3倍の上と下に1mLの滅菌ピペットでピペットを入れて細胞を穏やかに混ぜます。同じチューブ内のすべての細胞を収集します。
- 300xgで10分間遠心分離し、上清を吸引し、無菌PBSの1 mLで細胞を再懸濁する。300 x gで細胞を10分間ペレットし、上清を吸引し、100 μLの無菌PBSで細胞を再懸濁した。
- 細胞懸濁液に7-AAD色素(50ng/μLストック)を5μL添加します。少なくとも3倍の上と下に1mLの滅菌ピペットを入れて細胞をそっと混ぜます。10分間インキュベートし、分析前に暗闇の中に残します。
- 細胞分解能アッセイ
- ステップ7.3.4から細胞懸濁液を混合し、ステップ5.1と5.2を1回繰り返します。
- [新しい標本]ボタンをクリックして試験体とチューブを実験に追加し、チューブにチューブ1、K562(またはOC-3)セルのみという名前を付けます。チューブ2、CFSE染色K562(またはOC-3)細胞のみ;チューブ 3、E:T = 5:1;チューブ 4、E:T = 10:1。
- 細胞分解アッセイ用の散乱合合法システムを作成します (図3A)。
- チューブ 1 を選択し、[ドット プロット]ボタンをクリックして FSC-A/SSC-A プロットを作成します。FSC-A しきい値が >5 x 104のイベントに長方形ゲートを描画して、セルの破片を除外します。
- 新しいドットプロットのSSC-A/CFSEパラメータを選択します。新しいドット プロットの7-AAD/CFSEパラメータを選択し、4 つの象限ゲートを描画して 4 つのサブ Population を定義します。
- [サンプルの読み込み] ボタンをクリックして、最初に空のコントロール サンプルを分析します。
- SSC-AおよびFSC-Aの電圧を調整します。CFSE および 7-AAD チャネル パラメーターを使用して、デッド セルの作成を識別します。各標本の>20,000 CFSE+細胞からのデータを記録します。
- すべての標本の調査のためにセクション7.4.6を繰り返します。
- 個々の標本の統計値を含むファイルを開き、生存不可能な細胞集団を分析し、データを分析ファイルにエクスポートします。
結果
本プロトコルの目的は、サイトカイン誘導キラー(CIK)T細胞を末梢血単球から分離・拡張し、血液学的悪性度および固形癌細胞に対するCIKの細胞毒性効果を評価することにある。CIKの誘導は、CD3/CD56認識によって同定された。図 1A は、CIK の誘導と拡張のプロトコルを示しています。健常ドナー由来のCD3+CD56+T細胞の亜集団を分析するためのガッティング戦略の代表的な結果を図1Bに例示する。図1Cは、3個体からのCIK比率の統計分析を示す。
図2Aは、CD3+CD56+細胞比率(14日目に収穫されたCIK細胞の左下パネルと27.4%の元PBMCの場合は0.65%、右下パネルのCIK細胞の場合は27.4%)が14日後に有意に増加したことを示す。当社の培養システムでは、CIK細胞は、元のPBMCの数と比較して約500倍の変化をもたらしました(図2B)。
図3は、ヒト慢性骨髄性白血病K562細胞及びヒト卵巣癌OC-3細胞に対するCIKの細胞傷害作用を示す。K562またはOC-3細胞(標的、T)を非蛍光色素(CFSE)で染色し、生存細胞内の細胞内エステラーゼによって切断し、次いで高蛍光色素となった。細胞傷害性コカルチャー研究では、CFSE染色されたK562またはOC-3細胞をCIK細胞と24時間共処理した。インキュベーションの終わりに、全細胞を回収し、死細胞排除のための生存率プローブとして使用される核酸結合色素である7-AAD色素で染色した。CIK および CFSE+セルのサイズと粒度を図 3Aに示します。CFSE染色されたK562細胞(標的細胞、T)を、それぞれE/T=0:1、5:1、および10:1の比率でCIK細胞(エフェクター細胞、E)と共処理した。CFSE+K562細胞の7-AAD+細胞を全て評価した。 統計的結果は3回の独立した実験から行われた。基底のリシスは、エフェクター細胞がない場合の細胞死の割合を意味します(E:T = 0:1)。図3Bは、24時間のインキュベーションに続くOC-3細胞に対するCIKの明らかな細胞毒性(E:T = 10:1)を示す。
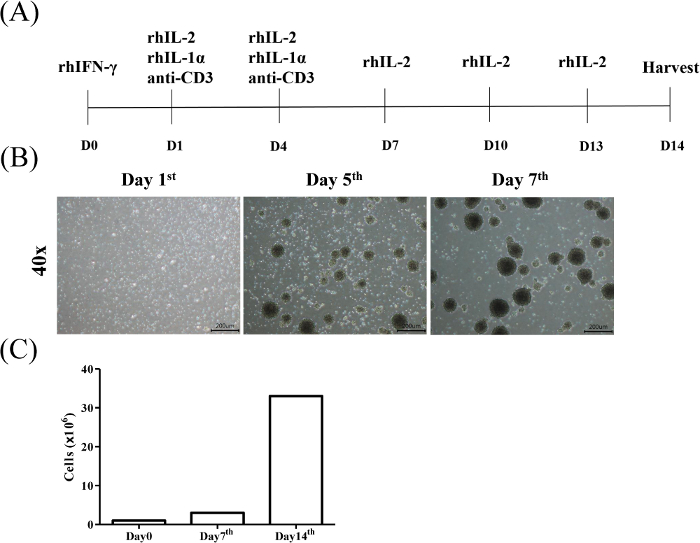
図1:サイトカイン誘発キラー細胞の誘導および拡張のフローチャート。(A)同意した健康ドナーからのPBMCは、最初はrhIFN-γ(0日目)に曝露され、次いでrhIL-2、rhIL-1α、および抗CD3 mAb(1日目)が3日ごとに(4日目)に曝露された。続いて、3日毎にrhIL-2含有培地で培地をリフレッシュし、14日目に細胞を採取した。(B) 誘導7日間におけるCIK細胞の形態学。CIK細胞の活性化と拡張は、プロトコルに記載されているように行った。細胞を、それぞれ1日目、5日目、7日目に光顕微鏡で観察した(倍率=40倍、スケールバー=200μm)。(C) セルカウントは毎週実行されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
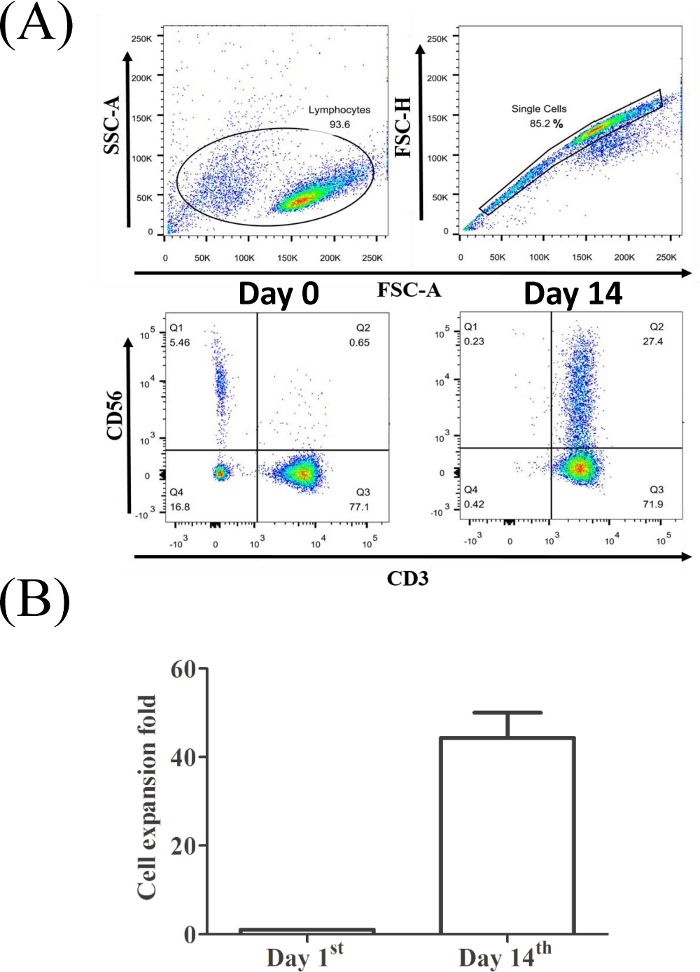
図2:代表的なPBMCサンプルからのCD3+CD56+T細胞の割合。(A) リンパ球は、特定の大きさと粒度によって認識された。フローサイトメトリーによる分析のために選択された単一細胞集団。(B) 3人の健康なドナーからのCIK拡張有効性の統計分析は、t検定(*, p < 0.01)を用いて行った。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:ヒト慢性骨髄性白血病K562およびヒト卵巣癌OC-3細胞に対するCIK細胞の細胞傷害作用(A)CIK細胞を24時間用に共培養した後、CFSE色素の染色に基づいてK562標的細胞を認識し、ゲート化した。選択した7-AAD/CFSEパラメータの下の全細胞集団と、示されたE:T比におけるCIK細胞の累積細胞毒性の象限図。(B) Oc-3細胞に対するCIK細胞の細胞傷害作用をE:T=10:1比で表した。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
記載された方法は、健康なドナーの全血サンプルからの細胞傷害性サイトカイン誘発キラー(CIK)T細胞の分離および拡張のための迅速で便利で信頼性の高いプロトコルである。また、フローサイトメトリーのセットアップおよびトラッキング(CS&T)システムを用いた白血病(K562)および卵巣癌細胞(OC-3)に対するCIKの細胞傷害作用も示す。CIK細胞は、GMPグレードのサイトカインおよび無血清培地をさらに臨床注入用11に使用することにより、良好なマニュファクトリープラクティス(GMP)条件で誘導および拡大することができる。しかし、CIK誘導および拡張の有効性は、個人差12、13、14を示す。また、安全性は、がん細胞治療のための患者由来CIK細胞の注入の利点である。CIK細胞は、主にNKG2D依存的に上皮性癌細胞に細胞分解作用を及ぼすことが報告されている。造馬癌細胞では、特異的抗体を用いてNKG2Dを遮断すると、NKG2D-低K562細胞に対するCIK誘導細胞毒性が有意に阻害される。しかし、この治療は、NKG2D15を欠いているHL-60細胞に影響を及ぼさない。さらに、CIK細胞は、CD8+CIK細胞16と比較してK562細胞に対してより少ない細胞殺死活性を示す。本研究では、CIKが白血病K562細胞と比較して卵巣癌OC-3細胞に対してより大きな細胞毒性ポテンシャルを示すことを発見した。これらのデータは、CIKエフェクターが腫瘍細胞を殺す正確な分子機構がまだ明らかではないことを示唆している。
標的細胞の生存率を追跡し、フローサイトメトリーを用いてエフェクター細胞の細胞毒性ポテンシャルを評価することは、臨床検査17の標準および従来の方法となっている。細胞生存率や活性化マーカーの発現に悪影響が認められることが示唆されているが、例えば、CFSE染色されたリンパ球におけるCD3+細胞群の細胞増殖率18,19。したがって、標的癌細胞を染色することは、一次CIK細胞の細胞傷害作用を評価するためのより効果的な戦略である。IFN-γ、OKT3、およびIL-2はCIKの分化および増殖のための主要なサイトカインまたは刺激物である。さらに、チモグロブリン、IL-1α、IL-10、IL-15などの他の因子も刺激因子である。現在、ヒト血清、ヒト血小板が豊富な血漿、さらにはウシ胎児血清が、CIK細胞の増殖を増強できる培地サプリメントとして使用されている。血清または血漿は栄養因子および成長因子で富化されるが、同種動物製品の添加は、実験変動をもたらすソース、バッチ、およびロット変動を提示し、培養細胞の治療結果を伴う必然的に不愉快な研究を行う。本研究では、市販の無血清、アルブミンフリー、ゼノフリーGMPグレードの培地を臨床グレードのサイトカインで補い、CIK細胞の培養に成功しました。ゼノフリーまたは同種異種フリーのサプリメントを使用することの欠点は、細胞増殖の有効性を低下させることです.
プロトコルで提供される2色細胞追跡方法は、直接細胞傷害アッセイにおいて生存または死んだエフェクター標的細胞を独自に計算した。この Gating の戦略では、CFSE+標的細胞は CIK エフェクター細胞とは明らかに区別できます (図 3)。最も重要なことは、CIKの誘導および拡張のプロセスは、資格を有し、高い生存率を示さなければならない。さらなる多剤注入のために、凍結保存の状態、および解凍後の生存率および細胞毒性は、他の重要な課題である。特定のリシスの実際の比率は、100 x (%サンプル・リシス - %基礎のリシス)/(100 - %基礎のリシス)の比率に等しい。他の研究18、20とは対照的に、CIK細胞の正確かつ実際の細胞毒性を明らかにするために、すべての標的細胞を調査することをお勧めします。
結論として、この研究で説明されているプロトコルは、健康なドナーからのPBMC由来CIK細胞の数を増やし、選択的追跡のための2色の光活性化可能なプローブを用いて癌細胞に対する細胞傷害性機能を評価するように設計されている。インビトロ診断(IVD)システムを用いたフローサイトメトリーによる標的細胞。
開示事項
著者らは、競合する金銭的利益の対立を宣言していない。
謝辞
この研究は、中国医科大学病院(DMR-Cell-1809)によって支持された。
資料
| Name | Company | Catalog Number | Comments |
| 7-Amino Actinomycin D | BD | 559925 | |
| APC Mouse Anti-Human CD56 antibody | BD | 555518 | B159 |
| APC Mouse IgG1, κ Isotype Control | BD | 555751 | MOPC-21 |
| BD FACSCanto II Flow Cytometer | BD | 338962 | |
| Carboxyfluorescein diacetate succinimidyl ester (CFSE) | BD | 565082 | |
| D-(+)-Glucose solution | SIGMA | G8644 | |
| Dulbecco's Modified Eagle Medium/F12 | HyClone | SH30023.02 | |
| Fetal bovine serum | HyClone | SH30084.03 | |
| Ficoll-Paque Plus | GE Healthcare Life Sciences | 71101700-EK | |
| FITC Mouse Anti-Human CD3 antibody | BD | 555332 | UCHT1 |
| FITC Mouse IgG1, κ Isotype Control | BD | 555748 | MOPC-21 |
| Human anti-CD3 mAb | TaKaRa | T210 | OKT3 |
| Penicillin-Streptomycin | Gibco | 15140122 | |
| Proleukin | NOVARTIS | ||
| Recombinant Human Interferon-gamma | CellGenix | 1425-050 | |
| Recombinant Human Interleukin-1 alpha | PEPROTECH | 200-01A | |
| RPMI1640 medium | Gibco | 11875-085 | |
| Sigma 3-18K Centrifuge | Sigma | 10295 | |
| TrypLE Express Enzyme | Gibco | 12605028 | |
| X-VIVO 15 medium | Lonza | 04-418Q |
参考文献
- Cappuzzello, E., et al. Cytokines for the induction of antitumor effectors: The paradigm of Cytokine-Induced Killer (CIK) cells. Cytokine & Growth Factor Reviews. 36, 99-105 (2017).
- Schmidt-Wolf, R. S., et al. Propagation of large numbers of T cells with natural killer cell markers. British Journal of Haematology. 87 (3), 453-458 (1994).
- Grainger, S., et al. Wnt Signaling in Hematological Malignancies. Progress in Molecular Biology and Translational Science. 153, 321-341 (2018).
- Dai, C., et al. Implication of combined PD-L1/PD-1 blockade with cytokine-induced killer cells as a synergistic immunotherapy for gastrointestinal cancer. Oncotarget. 7 (9), 10332-10344 (2016).
- Schmidt-Wolf, I. G., et al. Use of a SCID mouse/human lymphoma model to evaluate cytokine-induced killer cells with potent antitumor cell activity. TheJournal of Experimental Medicine. 174 (1), 139-149 (1991).
- Introna, M., et al. Rapid and massive expansion of cord blood-derived cytokine-induced killer cells: an innovative proposal for the treatment of leukemia relapse after cord blood transplantation. Bone Marrow Transplantation. 38 (9), 621-627 (2006).
- Schmeel, L. C., et al. Cytokine-induced killer (CIK) cells in cancer immunotherapy: report of the international registry on CIK cells (IRCC). Journal of Cancer Research and Clinical Oncology. 141 (5), 839-849 (2015).
- Rutella, S., et al. Adoptive immunotherapy with cytokine-induced killer cells generated with a new good manufacturing practice-grade protocol. Cytotherapy. 14 (7), 841-850 (2012).
- Nausch, N., et al. NKG2D ligands in tumor immunity. Oncogene. 27 (45), 5944-5958 (2008).
- Gammaitoni, L., et al. Effective activity of cytokine-induced killer cells against autologous metastatic melanoma including cells with stemness features. Clinical Cancer Research. 19 (16), 4347-4358 (2013).
- Rettinger, E., et al. The cytotoxic potential of interleukin-15-stimulated cytokine-induced killer cells against leukemia cells. Cytotherapy. 14 (1), 91-103 (2012).
- Narayan, R., et al. Donor-derived cytokine-induced killer cell infusion as consolidation after nonmyeloablative allogeneic transplantation for myeloid neoplasms. Biology of Blood and Marrow Transplantation. 19, 1083 (2019).
- Castiglia, S., et al. Cytokines induced killer cells produced in good manufacturing practices conditions: identification of the most advantageous and safest expansion method in terms of viability, cellular growth and identity. Journal of Translational Medicine. 16 (1), 237 (2018).
- Bonanno, G., et al. Thymoglobulin, interferon-γ and interleukin-2 efficiently expand cytokine-induced killer (CIK) cells in clinical-grade cultures. Journal of Translational Medicine. 8, 129 (2010).
- Iudicone, P., et al. Interleukin-15 enhances cytokine induced killer (CIK) cytotoxic potential against epithelial cancer cell lines via an innate pathway. Human Immunology. 77 (12), 1239-1247 (2016).
- Liu, J., et al. Phenotypic characterization and anticancer capacity of CD8+ cytokine-induced killer cells after antigen-induced expansion. PLoS One. 12 (4), 0175704 (2017).
- Chen, D., et al. Cytokine-induced killer cells as a feasible adoptive immunotherapy for the treatment of lung cancer. Cell Death & Disease. 9 (3), 366 (2018).
- Tario, J. D. Monitoring cell proliferation by dye dilution: considerations for probe selection. Methods in Molecular Biology. 1678, 249-299 (2018).
- Last'ovicka, J., et al. Assessment of lymphocyte proliferation: CFSE kills dividing cells and modulates expression of activation markers. Cellular Immunology. 256 (1-2), 79-85 (2009).
- Yoshida, T., et al. Characterization of natural killer cells in tamarins: a technical basis for studies of innate immunity. Frontiers in Microbiology. 1, 1-9 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved